第章芳香亲电和亲核取代反应
芳环的取代反应
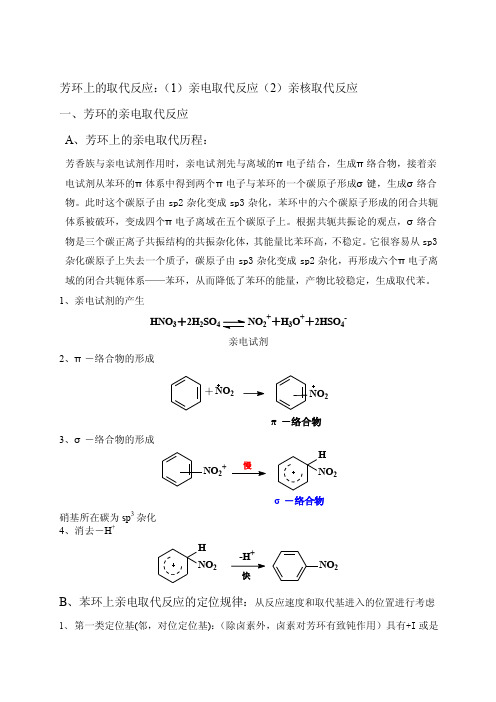
芳环上的取代反应:(1)亲电取代反应(2)亲核取代反应 一、芳环的亲电取代反应 A 、芳环上的亲电取代历程:芳香族与亲电试剂作用时,亲电试剂先与离域的π电子结合,生成π络合物,接着亲电试剂从苯环的π体系中得到两个π电子与苯环的一个碳原子形成σ键,生成σ络合物。
此时这个碳原子由sp2杂化变成sp3杂化,苯环中的六个碳原子形成的闭合共轭体系被破环,变成四个π电子离域在五个碳原子上。
根据共轭共振论的观点,σ络合物是三个碳正离子共振结构的共振杂化体,其能量比苯环高,不稳定。
它很容易从sp3杂化碳原子上失去一个质子,碳原子由sp3杂化变成sp2杂化,再形成六个π电子离域的闭合共轭体系——苯环,从而降低了苯环的能量,产物比较稳定,生成取代苯。
1、亲电试剂的产生HNO 3+2H 2SO4NO 2++H 3O ++2HSO 4-亲电试剂2、π-络合物的形成+NO 2π-络合物23、σ-络合物的形成NO 2+HNO2σ-络合物硝基所在碳为sp 3杂化 4、消去-H ++NO 2H NO 2快B 、苯环上亲电取代反应的定位规律:从反应速度和取代基进入的位置进行考虑1、 第一类定位基(邻,对位定位基):(除卤素外,卤素对芳环有致钝作用)具有+I 或是+C 效应,其作用是增大芳环的电子云密度。
致活基NH 2NHR2OHORNHCROPhR致钝基F Cl BrI2、 第二类定位基(间位定位基):具有-I 或-C 效应,使芳环上的电子云密度降低,均为致钝基NO 2NR 3COOHCOORSO 3HCNCHOCROCCl 3C 、影响亲电取代的因素:(1)芳环上取代基对于E +进入芳环位置的影响第一类定位基-邻对位定位基第二类定位基-间位定位基共振式越多, 正电荷分散程度越大,芳正离子越稳定。
(2) 动力学控制与热力学控制: α位取代-动力学控制产物; β位取代-热力学控制产物。
(3) 邻位和对位定向比:a 亲电试剂的活性越高,选择性越低。
有机化学中的芳香亲核取代与芳香亲电取代

有机化学中的芳香亲核取代与芳香亲电取代芳香亲核取代和芳香亲电取代是有机化学中的两个重要反应类型。
这两种反应是有机芳香化合物中的氢原子被置换为另一种原子或基团的过程。
本文将详细介绍芳香亲核取代和芳香亲电取代的原理、机理和应用。
一、芳香亲核取代芳香亲核取代反应是指芳香化合物中的氢原子被一个亲核试剂取代的过程。
亲核试剂可能是氢氧根离子、卤素离子、芳基负离子等。
这种反应一般需要在碱性条件下进行。
芳香亲核取代反应的机理是由共轭碳氢键的特殊性质决定的。
芳香环中的π电子可以共享给亲核试剂,而由于环上的π电子非常稳定,取代反应的活性较低,因此需要在碱性条件下进行。
常见的芳香亲核取代反应有苯酚的溴化反应、苯的硝化反应等。
苯酚的溴化反应以环境中的溴离子为亲核试剂,生成溴苯和溴化氢。
苯的硝化反应以硝酸为亲核试剂,生成硝基苯和水。
这些反应在有机合成中具有重要意义,可以用于合成药物、香料等化合物。
二、芳香亲电取代芳香亲电取代反应是指芳香化合物中的氢原子被一个亲电试剂取代的过程。
亲电试剂可能是正离子、电子不足的分子等。
这种反应一般需要在酸性条件下进行。
芳香亲电取代反应的原理是由共轭芳香体系的特殊稳定性决定的。
共轭芳香体系能够吸引亲电试剂的正电荷,使其参与反应。
芳香环上的π电子提供了稳定性和活性中心,使得亲电试剂能够与芳香化合物反应。
常见的芳香亲电取代反应有苯的硝化反应、苯的磺化反应等。
苯的硝化反应以浓硝酸为亲电试剂,在酸性条件下发生取代反应,生成硝基苯和水。
苯的磺化反应以浓硫酸为亲电试剂,生成苯磺酸和水。
这些反应在有机合成中也具有重要意义,可以用于合成各种化合物。
三、芳香亲核取代与芳香亲电取代的比较芳香亲核取代和芳香亲电取代在机理和反应条件上有明显的区别。
芳香亲核取代需要在碱性条件下进行,而芳香亲电取代需要在酸性条件下进行。
此外,芳香亲核取代的亲核试剂通常是负离子,而芳香亲电取代的亲电试剂通常是正离子或电子不足的分子。
两种反应类型在有机合成中有着不同的应用。
第六章芳香环上的取代反应

第六章芳香环上的取代反应芳香环上的取代反应与饱和碳原子上的取代反应相似,有亲电取代、亲核取代和自由基取代反应。
在亲电反应中进攻试剂是正离子或偶极分子中正的一端,离去基团在离去时必须失去它的电子对,它们是弱的Liews酸,最常见的离去基团是氢(以H+形式离去)。
在亲核反应中进攻试剂是负离子或具有未共用电子对的原子或基团。
离去基团在离去时以最大的可能携带其键合电子。
离去后以负离O等即为弱的碱、自由基取代反应是另子或分子的形式存在,如Br-、-OTS和H2一种情况将在以后讨论。
6-1 亲电取代反应最简单的芳环是苯环,从苯的结构可知,苯的离域π轨道使苯环六个碳原子组成的平面上下集中着带负电的电子云,对苯环碳原子起着屏蔽作用,从而不利于亲核试剂的进攻,相反却有利于亲电试剂的进攻,发生亲电取代反应。
6-1-1 反应历程1.π和σ-络合物在亲电取代反应中,无论是正离子还是极性试剂中正电荷的部分进攻芳环,首先遇到的是芳环上的π电子云,因此反应的第一步可能是进攻的亲电试剂与芳环上离域的π电子相互作用。
例如硝酰正离子进攻苯环,可能是其中氮原子的空轨道与苯环的π轨道交盖,通过π电子的离域发生微弱的结合生成π-络合物。
由于是通过电荷转移形成的,也称电荷转移络合物。
在π-络合物的形成中,芳烃作为电子的给予体,试剂作为电子的接受体,它们通过电荷转移而结合,是非常松弛的,这意味着给予体和接受体两者的分轨道都未发生明显的变化,在多数情况下,它们之间的结合是很弱的(4-20KT/mol),以至络合物的组分能够迅速地发生逆反应而复原。
例如:+II2甲苯与氯化氢生成的π络合物,即使在-78℃的低温情况下两组分之间也能很快建立平衡。
CH3+Cl H CH 3ClH若作同位素试验,用氯化氘(DCl )代替氯化氢(HCl )在很长的时间内也未发现D 与H 的交换。
说明亲电试剂并没有与环上任何一个碳原子发生键合作用而生成离子。
即没有C-D 键生成,故可证明没有发生D 与H 的交换。
芳香族化合物的取代反应

(D)H (D)H NO2 H(D) HNO3/H2SO4 H(D) H(D) kH/kD = 1.05 (D)H (D)H NO2 H(D) NO2 H(D)
容易观察到较小的同位素效应 (kH/kD = 1-3,而非正常的6-7): 第一步具有可逆性及由此引起 的分配效应所产生的。
:
:
:
:OMe
+
H
E
H
E :
H
E : :OMe H E
H
E
:OMe
+
:
:OMe
+
H E
H E
+
化学
-I > +C ,钝化苯环:X
Cl
Cl E H H E
B间位定位基 的定位能力次序大致为(从强到弱) 2.
-NR3, -NO2, -CF3, -CCl3, -CN, -SO3H, -CHO, -COR,-COOH, -CONH2。
反 应 进 程
化学
2. 同位素效应 当一个反应进行时,在决定反应速率的步骤中发生 了反应物分子的同位素键的断裂,将显示初级动力 学同位素效应。最常见的是,反应物分子中的氢被 氘取代后,反应时有速率上的不同,这种变化称为 氘同位素效应,用kH/kD表示。 例如下列反应有 动力学同位素效 应,说明质子是 在决速步的失去 的:
CH2CH3 H
CH3CH2 + [AlCl3Br]
CH2CH3
H+
+
HBr AlCl3
化学
特点: 1°常用的催化剂是无水AlCl3,此外 FeCl3、BF3、 无水HF、SnCl4、ZnCl2、H3PO4、H2SO4等都有催 化作用。
芳环的亲电取代、亲核取代反应及芳环取代基的反应

两个钝化基存在时,则弱钝化基决定定位) —— 活性作用大小接近时,获得混合物 —— 空阻大的位置难进入
多取代苯的定位效应:
多取代苯的定位效应:
位阻较大
多取代苯的定位效应:
二、取代基对芳环亲电取代反应的影响
总反应机理如下:
E
+E
H
Step 1: 亲电试剂进攻苯环的
键,形成碳正离子
Nu
E 取代产物具有芳香性
E
Nu
加成产物失去芳香性
Nu
Step 2: 脱去一个质子, 回复芳香稳定结构
一、芳环的亲电取代反应及机制
2. Reaction coordinate diagrams:
一、芳环的亲电取代反应及机制
HCl
Cu HBr
N2+ Cl - 1) Cu, Na2SO3 2) H+
Cu
Cl Br
SO3H
四、芳环取代基的反应
5、 芳香重氮盐的偶联反应(与胺或酚反应)
——芳香重氮盐作为亲电试剂与非常活泼的芳香化合酚类或胺 类发生反应,生成偶氮化合物。
HO HO
+
CH3 +
N2+ Cl-
Br N2+ Cl-
particu larly s ta bl e
CH3
pa ra -
EH
m e ta-
CH3
E H
particu larly s ta bl e CH3
EH CH3 E H
CH3
EH CH3 E H
OH, OR;NH2, NHR, NR2:强致活基,邻对位定位基。
理论有机第九章-芳环上的亲电和亲核取代反应

L Nu-
L Nu Nu
快
F 》Cl,Br, I
OCH3
H3CO OC2H5
OC2H5
O2N
NO2 KOC2H5 O2N
NO2 OCH3 O2N
NO2
NO2
NO2
NO2
L δ+
L Nu
Nu
+ Nu-
L-
δ+
慢
快
NO2
NO2
NO2
CH3O OCH3
又称为SNAr2历程
K+ NO2
NO2 Meisenheimer络合物已被分离出
Zn-Hg HCl
CH3CH2CH2CH2
O
R C Cl + AlCl3
O R C Cl AlCl3
O R C Cl AlCl3
RCO
R C O + AlCl4
R
+C
O
H CR
O + AlCl4
H CR O
CR
O + HCl + AlCl3
O
+
H2C
C O
AlCl3
H2C C
CH2 CH2
Cl C O
-H+
NH2
N2+Cl-
I
NaNO2
KI
HCl
NN
+ CuCN
Zn +HCl
N2Cl
CN NH2 + NH3
NaNO2/HCl ArNH2 ArNH2 NaNO2/HCl
ArN2Cl HBF4 CuX
ArN2Cl
ArF ArX (X=Cl,Br)
合成???
有机化学基础知识点整理亲电芳香取代和亲核芳香取代反应

有机化学基础知识点整理亲电芳香取代和亲核芳香取代反应有机化学基础知识点整理:亲电芳香取代和亲核芳香取代反应亲电芳香取代和亲核芳香取代反应是有机化学中常见的反应类型,它们都与芳香族化合物的反应有关。
本文将对亲电芳香取代和亲核芳香取代的基本概念、反应条件、机理和应用进行整理和探讨。
1. 亲电芳香取代亲电芳香取代反应是指在芳香环上引入一个新的官能团(通常是通过一个亲电试剂)的反应过程。
该反应发生的条件包括有合适的亲电试剂、溶剂和温度,以及适当的反应过程。
亲电试剂可以是卤素化合物、羰基化合物、硝酸酯等。
反应机理通常包括电子亲和性试剂的亲电攻击、芳香环上电子密度的变化和氢的碱性。
2. 亲电芳香取代的应用2.1 酰基化反应酰基化反应是一种常见的亲电芳香取代反应,常用的试剂为酰氯。
该反应在有机合成中广泛应用,用于引入酰基团。
2.2 硝化反应硝化反应是指芳香烃在硝化混酸的条件下引入硝基基团。
硝基芳香化合物广泛应用于药物合成、爆炸物制备和染料合成等领域。
3. 亲核芳香取代亲核芳香取代反应是指在芳香环上引入一个新的官能团(通常是通过一个亲核试剂)的反应过程。
与亲电芳香取代不同,亲核芳香取代的反应机理涉及到亲核试剂的亲核攻击和芳香环上电子密度的变化。
常见的亲核试剂有醇、氨基化合物等。
4. 亲核芳香取代的应用4.1 氢化反应氢化反应是指通过亲核试剂在芳香环上引入氢原子,形成饱和环的反应。
该反应广泛应用于工业催化反应和药物合成等领域。
4.2 氨基化反应氨基化反应是指在芳香环上引入氨基基团的反应。
该反应在药物合成和聚合物合成等领域具有重要应用。
综上所述,亲电芳香取代和亲核芳香取代是有机化学中重要的反应类型。
它们的应用广泛,对于有机合成和药物合成等领域具有重要意义。
深入理解亲电芳香取代和亲核芳香取代的基本概念、反应条件和机理,对于提高有机化学研究的水平和进一步拓宽应用领域具有重要作用。
(本文仅为示例,实际内容请根据具体要求和知识点进行撰写)。
第七章 芳环上亲电和亲核取代反应反应

磺化反应及苯磺酸衍生物的重要性
亲油端
NaOH C12H25 SO3H C12H25 SO3Na
• 合成苯磺酸衍生物
C12H25 H2SO4 (浓)
亲水端
合成洗涤剂
H3C H2SO4 (浓) H3C SO3H
(有机强酸,固体)
TsOH,对甲基苯磺酸
• 由磺酸转化为其它衍生物
Ar SO3H POCl3 Ar SO2Cl
芳环上的卤代在合成上的重要性
• 是芳环引入卤素(Cl、Br)的主要方法之一(Ar-X是合成
其它类型的化合物的重要中间体,
芳环的氟代和碘代方法
I2 +
HNO3 H Cl I -H+ I
I
(I2 + Cl2) HF / CCl4 + XeF2 (自由基型反应) F
3. 苯环上的硝化反应
取代甲氧基
NaOCH3
取代硝基
NH3 100 C
o
其它底物的类似取代反应
X + Nu Nu + X
W
W
W: 吸电子基
各类吸电子基对反应速率的促进作用比较:
W: N2
>
O CR
Nபைடு நூலகம்3
>
CN
NO
>
NO2 >
CF3
>
>
>
COOH
例:
N H NC Cl NaOR Cl Cl Cl Cl Cl F DMSO, Cl OR + NaCl NC N H F
p键
(sp2-sp2) 未参与环的共振
苯炔的性质:
活泼、易反应(不能分离、可捕获)
第8章-芳香亲电和亲核取代反应

第8章 芳香亲电和亲核取代反应
第8章 芳香亲电和亲核取代反应
8.1 亲电取代反应 8.2 结构与反应活性 8.3 同位素效应 8.4 离去基团效应 8.5 芳香亲核取代反应
8.1 芳香亲电取代反应
一.亲电取代反应类型 1.卤代反应 2.硝化反应 3.磺化反应 4.付-克烷基化反应及其相关的反应 5.付-克酰基化及其相关的反应 6.与重氮化合物的偶联反应
8.5 芳环上的亲核取代反应
一.SNAr2历程 • 亲核试剂首先与芳环加成,生成一种叫迈森海默
(Meisen heimer)络合物的活性中间体,
• 然后从中间体中消去一个取代基而完成反应。 • 反应是一个双分子反应,通常第一步是定速步骤。
L + Nu- 慢
LL Nu
快
Nu + L-
• L可为卤素或烷氧基等,L的邻位或对位必须有强 吸电子基,如-NO2、-CN、-COR、-CF3等,使中 间体的稳定性增加,有助于反应的进行。
反应速度与重氮盐的浓度成正比,而与亲核试剂 的浓度无关,
苯环间位上有供电子基时,如-OH、-OCH3、 -CH3等可使反应速度加快;
有吸电子时,如-COOH、-SO3H、-CI、-NO2等 使反应速度减慢。
8.5 芳环上的亲核取代反应
三.苯炔机理
Cl NH2-
NH2-
NH2 +
NH3
NH2
• 芳环上的亲核取代反应在理论上和实际合成中也是 很重要的。
• 芳环上的亲核取代反应很少是一步反应,而大多数 涉及不同的活性中间体。从合成的观点,芳香重氮 化合物,其中氮作为离去基团的反应最重要。
8.5 芳环上的亲核取代反应
一.通过SNAr2历程(加成-消除历程)的取代反应 二.通过SNAr1历程(重氮离子)的亲核取代反应 三.通过苯炔机理(消除-加成)的取代反应
高等有机 第八章 芳香亲电荷亲核取代反应

以甲苯为例:
H H
sp3 sp2
sp2
H H
sp3
δ δ δ
C H
CH
C H2
C H
从共振论的观点看:
C H3 进攻邻位: + E
+ +
C H3 H E
+
C H3 H E
+
C H3 H E
C H3 进攻对位:
C H3 进攻间位: + E+
C H3 + E+
+
+
C H3
C H3
+
H
E C H3
+
C H3 Br +
C H3 +
C H3
Br 32.9 % Br 65.8% 1.3%
8
2. 硝化:
浓 H2S O4 50~60 。 C
+ 例: NO2 +
浓 HNO3
NO2
NO2 浓 HNO3 浓 H2S O4 100~110。 C 6% NO2 +
NO2 +
NO2 NO2
NO2 1%
93%
9
3. 磺化:
+
OH
+
H 进攻间位:
E OH
+
H
E OH
H
E OH
H
E
H E
+
H E
+
H E
每个原子都有完整 的外电子层结构。
29
B.+C <–I 的基团:
X
Cl
+
I > +C
Cl H E
亲电取代和亲核取代反应

亲电取代和亲核取代反应亲电取代和亲核取代反应是有机化学中常见的两种重要反应类型。
它们在合成有机化合物和药物中起着重要作用。
本文将分别介绍亲电取代和亲核取代反应的基本概念、机理和应用。
一、亲电取代反应1. 概念:亲电取代反应是指通过亲电试剂攻击有机化合物的反应。
亲电试剂通常是电子亏损的离子或分子,例如卤素、卤代烷、强酸等。
亲电取代反应的特点是反应物中的亲电子基团被亲电试剂取代。
2. 机理:亲电取代反应的机理通常分为两步:亲电试剂与反应物形成中间体,然后中间体发生重排或消除反应,最终生成产物。
其中中间体的形成是通过亲电试剂攻击反应物中较活泼的亲电子基团实现的。
3. 应用:亲电取代反应广泛应用于有机合成中,例如合成醇、醚、酮、酯等有机化合物。
常见的亲电取代反应有卤代烷与亲核试剂的取代反应、酮与亲电试剂的取代反应等。
二、亲核取代反应1. 概念:亲核取代反应是指通过亲核试剂攻击有机化合物的反应。
亲核试剂通常是富电子的离子或分子,例如氢离子、氢氧根离子、氨基离子等。
亲核取代反应的特点是反应物中的亲核子基团被亲核试剂取代。
2. 机理:亲核取代反应的机理通常分为两步:亲核试剂与反应物形成中间体,然后中间体发生重排或消除反应,最终生成产物。
其中中间体的形成是通过亲核试剂攻击反应物中较活泼的亲电子基团实现的。
3. 应用:亲核取代反应广泛应用于有机合成中,例如合成醇、醚、酮、酯等有机化合物。
常见的亲核取代反应有醇与酸的酯化反应、酮与亲核试剂的取代反应等。
总结:亲电取代和亲核取代反应是有机化学中重要的反应类型。
亲电取代反应是通过亲电试剂攻击有机化合物,取代亲电子基团的反应;亲核取代反应是通过亲核试剂攻击有机化合物,取代亲核子基团的反应。
这两种反应在有机合成中具有广泛的应用价值,能够合成多样化的有机化合物和药物。
因此,对于有机化学的学习和研究来说,了解亲电取代和亲核取代反应的机理和应用是非常重要的。
11-第八章 芳香亲电亲核取代反应

1
第八章 芳香族化合物的取代反应
2
8.1 芳环上亲电取代反应历程 8.2 亲电试剂生成方式及亲电能力 8.3 取代基的定位效应和反应活性 8.4 典型的亲电取代反应 8.5 芳香族亲核取代反应
3
芳香族化合物取代反应的种类
• 亲电取代:这类反应多,重点研究。 • 亲核取代:这类反应少。 • 自由基取代:本章不讨论。 易发生亲电取代的原因?
Cl2 - MXn
RSO2+ ................
RSO2Cl + AlCl3 ................ MXn = AlCl3, BF3, ZnCl2 等
RSO2+ + AlCl4-
杂原子亲 电试剂
以上亲电试剂是强亲电体,既可与含致活定位基的 芳环反应也可以与含致钝定位基的芳环反应。
碳原子亲电试剂 11
亲电试剂
生成方式
HC≡N+H
HC≡N + HX
+NO
HNO2 + H+
ArN≡N+
ArNH2 + HNO2 + H+
以上试剂活性低,只能取代含高活性基团的芳环
氮原子亲电试剂,且氮上只联有一个电负 较大的原子
高活性芳环:PhNHR, PhNR1R2, PhOR
12
8.3 取代基的定位效应和反应活性
28
RCl + AlCl3 R—Cl…AlCl3 R+ + AlCl4-
R—OH + H+
RO+H2 R+ + H2O
生成的碳正离子可以重排成更稳定的碳正离子。如:
第五章:芳香性和芳香化合物的取代反应

Fe
从表面看杯烯的偶极矩应为µ=0,而实际测得 杯烯的µ=5.6 D,为什么?
Ph Ph Ph Ph Ph Ph
Ph Ph Ph Ph
富烯
Ph
Ph
6.3 D
有偶极矩,有芳香性的 非芳香化合物
R
R‘
R
R‘
2、 中环芳香结构
(1) 七元环π 体系
上述4个化合物,哪个具有芳香性?为什么?
Br H Br2 -HBr Br H H H H H H Br Br
(B)
(C)
A是全顺式,B是反,顺,顺,顺,顺式,C是反,顺, 反,顺,顺式,都没有芳香性。在C中由于环内两 个氢的排斥力影响分子的稳定性,使之不具芳 香性;[10]-环共轭的不稳定性可归于容易热环 化为双环体系。
原因:
在[10]-轮烯中,若用一个桥键代替两个轮内氢 原子得1,6-桥-[10]-环共轭多烯,则有芳香性:
5.1 芳香性
芳香性定义
早期的定义是考虑动力学及热力学的稳定性: 芳香 性——易取代难加成,环的热稳定性,即化学标准; 后来的定义是以共轭能的大小来量度,具有较大的共 轭能的化合物具有芳香性; 另一种物理标准:是整个芳香体系具有相同键长和共 平面的特性。 最近的定义提倡用光谱及磁学的标准,看考察的化合 物是否存在反磁环流。既可用质子磁共振光谱中位移 到较低的场来鉴定或借反磁性的灵敏度上升的测定。
三、定位效应和反应活性
1、邻对位定位基和间位定位基 致活效应:取代基的影响使芳环的反应活性提高; 致钝效应:取代基的影响使芳环的反应活性降低。
第一类定位基: (1).指示新进入的取代基进入它的邻、对位 。
Y
N(CH3)2, NH2, OH, OCH3, NHCOCH3, OCOCH3, Cl, Br, I, CH3, CH2COOCH3
第七章 芳环上的亲电和亲核取代反应

付氏酰基化反应的特点: 不发生重排反应 不生成多元取代产物(酰基钝化苯环) 催化剂需要量增多
O CH3C OH + SOCl2
80°C
O CH3C Cl + SO2 + HCl
付氏反应的禁忌:
钝化基团(硝基、酰基等)连在芳环上时, 不能进行付氏反应
不能用三氯化铝催化苯胺(苯酚)进行付氏 反应。因三氯化铝与其生成络合物,Lewis酸失 去活(Cl3Al:NH2-) 。解决方法?
②重氮盐与活性芳烃(芳胺或酚类化合物) 在适当酸、碱条件下反应,生成有色的偶氮 化合物的反应 —— 偶联反应
+ N2Cl + H NaOH/ H2O OH 0°C CH3CO2Na /H2O N(CH3)2 0°C N N OH
对羟基偶氮苯(橘红色) + N2Cl H + N N
N(CH3)2
对二甲氨基偶氮苯
例:C6H5X的硝化
X 产物 (%) oF 12 O N 硝化 NO2 NO2 + NO2 -C 10.0% 1.5% 88.5% NO2 + NO2
NO2
例:
CH3 硝化 CH3 NO2 + NO2 +I 56.3% 41.1% 2.6% CH3 + NO2 CH3
三、芳基重氮离子的单分子亲核取代反应 芳基正离子历程: SNAr1 第一步,重氮盐首先分解产生芳基正离子, 其正电荷处在sp2轨道,不能与苯环π轨道共 轭,很不稳定,反应速度慢,是速控步骤。 反应为什么能发生?
第二步,非常活泼的芳正离子很快与亲核试 剂反应生成产物。
特点: 1、重氮盐之所以能分解生成很不稳定的芳 基正离子,是由于-N2+是一个很好的离去基 团,且离去后生成稳定的氮气分子。 2、芳环上的供电基使反应加速(稳定芳基 正离子)
兰州大学化学化工学院有机化学课件 第10章 芳烃 芳环的亲电取代和亲核取代反应

Cl + 1.75D
Cl + 1.75D
0.37+1.75=2.12D 实测值2.21D
+ 0.37D
H3C + 0.37D
35
Cl
NO2 + 4.28D
+ 1.75D
Cl + 1.75D +
NO2
4.28-1.75=2.53D 实测值2.81D
4.28D
36
Cl
Cl
Cl Cl Cl
Cl
偶极矩
熔 点 oC
8
苯在常温下为无色液体,有特殊的气味,易挥 发,易燃,难溶于水,易溶于醇、醚、丙酮、 冰醋酸等溶剂。相对密度0.879,熔点5.5℃, 沸 点80.1℃。蒸气与空气形成爆炸性混合物,爆 炸极限1.5~8.0%(体积)。
9
苯对人的神经和心血管系统有明显的毒性,对 造血机能有抑制作用,如使白血球减少、造成 贫血等。苯的急性中毒主要发生于清洗贮苯设 备或大量使用苯时防护不周所致。急性中毒可 产生麻醉作用,轻者类似酒醉、嗜睡、头昏等; 中度中毒出现噁心、呕吐、昏迷;剧烈的急性 中毒可很快失去知觉,处于昏迷状态,甚至停 止呼吸而死亡。长期接触液态苯,可对皮肤产 生刺激作用,轻者干燥、发红,重者可出现湿 疹样皮疹或脱脂性皮炎。因此使用苯时必须注 意安全,做好防护措施。
NO2
3-硝基-5-羟基 苯甲酸
2-甲氧基-6氯苯胺
33
10.2.2.2 物理性质
芳香烃不溶于水,但溶于有机溶剂。一 般芳香烃均比水轻。沸点随相对分子质量 升高而升高,以及随极性增大而升高。熔 点除与相对分子质量有关外,还与结构的 对称性有关,通常对位异构体由于分子对 称,熔点较高。
大学有机化学反应方程式总结芳香化合物的亲电取代与亲核取代反应

大学有机化学反应方程式总结芳香化合物的亲电取代与亲核取代反应在有机化学中,芳香化合物是一类具有特殊环状结构的化合物,具有特殊的性质和反应。
本文将对芳香化合物的亲电取代和亲核取代反应进行总结。
一、芳香化合物的亲电取代反应亲电取代反应是指通过一个亲电试剂的攻击,将其中一个芳香环上的氢原子进行取代的反应。
常见的亲电试剂包括卤素、酸、酰卤、氰基离子等。
1. 卤代反应卤代反应是指将一个或多个卤素原子取代芳香环上的氢原子,常用的亲电试剂包括卤素和卤代烷。
其反应机理为:Ar-H + X2(或ROH)→ Ar-X + HX(或ROH2+)其中,X代表卤素原子(Cl、Br、I),Ar代表芳香环,ROH代表醇基团。
2. 羟基化反应羟基化反应是指将一个或多个羟基取代芳香环上的氢原子,常用的亲电试剂包括酸和酰氯。
其反应机理为:Ar-H + HX(或酰氯)→ Ar-OH(或酰基)其中,HX代表酸(如HCl、H2SO4),Ar代表芳香环。
3. 羰基化反应羰基化反应是指将一个或多个羰基(C=O)取代芳香环上的氢原子,常见的亲电试剂包括酰氯、酸酐等。
其反应机理为:Ar-H + R-COCl → Ar-COR + HCl其中,R代表脂肪基团。
二、芳香化合物的亲核取代反应亲核取代反应是指通过一个亲核试剂的攻击,将芳香环上的一个或多个取代基进行取代的反应。
常用的亲核试剂包括碱、有机锂试剂等。
1. 碱的取代反应碱的取代反应是指碱攻击芳香环上的氢原子,并将其取代为碱的共轭酸,常见的亲核试剂包括氨水、氢氧化钠等。
其反应机理为:Ar-H + Nuc- → Ar-Nuc + H-其中,Nuc-代表亲核试剂。
2. 有机锂试剂的取代反应有机锂试剂的取代反应是指有机锂试剂攻击芳香环上的氢原子并将其取代为有机锂试剂上的烃基,常见的有机锂试剂包括丁基锂、叔丁基锂等。
其反应机理为:Ar-H + RLi → Ar-R + LiH其中,R代表烃基。
综上所述,芳香化合物的反应通常可以分为亲电取代和亲核取代两类。
第3章芳香性和亲电取代

蓝烃: 一个天蓝稳定的化合物,偶极矩约为1.0
环辛四烯二负离子:
轮烯:
Ⅰ [18]轮烯 有芳香性; Ⅱ [10]轮烯 因环内两个氢原子的相互排斥使整个分子 不共平面,因而无芳香性; Ⅲ 1,6桥代 [10]轮烯 亚甲基取代了Ⅱ 中两个氢原子, 消除了斥力,有芳香性; Ⅳ [12]轮烯双负离子 有芳香性。
邻位和对位定向比: 1)亲电试剂的活性越高,选择性越低:
CH3
相对速率o% m%p%
N HO N2O +B 3F H 42-/SC O H 43CN
17
2.3
60 69
3 2
37 29
2) 空间效应越大,对位产物越多:
C(CH3)3 H2SO4
C(CH3)3
100%
SO3H
极化效应:
X
X o% p% m% F 12 88 0
CH
CH2
CH CH2 H
邻对位
E
CH CH2 H
CH CH2 H
E
E
CH CH2 H E
+E
间位 CH CH2 CH CH2
共振式越多,
H
H
正电荷分散
E
E
程度越大,芳正离子越稳定。
CH CH2
H E
动力学控制与热力学控制
+ H2SO4
H
80℃
H
165℃
SO3H
165℃
SO3H
α位取代-动力学控制产物; β位取代-热力学控制产物。
值的差异。
O
Ph
Ph
K平衡
Ph Ph
6.2
O
31.2
Ph O
芳香亲电与亲核取代反应

σ-络合物
• 形成 HCl(气)+AlCl3(固)
R
H-Cl·AlCl3(溶液)
(溶液) +H-Cl·AlCl3(溶液)
[
. . . . +. .
H H
R
] AlCl -(溶液) 4
σ-络合物
• 结构的证明 实验1:固体AlCl3在甲苯中-78.5℃不溶解; 通入HCl转变成绿色透明溶液; 溶液吸收光谱发生变化,电子跃迁 实验2:生成和分解速度比π-络合物慢得多 实验3:溶液导电 实验4:DCl中的D与苯环上的H发生交换
取代基效应
诱导效应(I):由电负性大小决定。 -I:吸电子 +I:供电子 共轭效应(T):包括π-π共轭和p-π共轭。 -I:吸电子 +I:供电子
• 有+I,无T: 如-C2H5 (1)使σ-配合物稳定,活化苯环;
(2)使邻、对位取代产物更稳定;
(3)为邻、对位定位基。
• 有-I,无T: 如-N+(CH3)3,-CF3,-CCl3等
上述亲电试剂进攻,系发生在芳环上已有取代基的位置上, 这种亲电进攻称为ipso进攻。
亲电体E+在不同的反应中可以进攻X的邻位、对位、间位 和X所在之位。反应既可在分子间发生也可在分子内发生。
不同的芳香亲电取代反应区别在于亲电体的不同及进攻芳环位 置的不同; 不同的亲电体是由不同的试剂和催化剂产生的。 进攻芳环的位置不同是由芳环上已有取代基团的定位效应引起 的。
• 特点
(1)生成了新的σ键;
(2)芳烃的π电子体系被破坏,形成了不稳
定的非芳香性化合物。
也可以通过中间的分离和捕获等方法,证明芳香 亲电取代反应中络合物的存在。
例如:在低温下用硝酰氟和氟化硼硝化三氟甲苯的反应, 其中间体络合物已被分离出来,结构也为核磁共振所证实。
8 芳香亲电和亲核取代

ArF + N2 + BF3
ArN2 BF4
(Schiemann反应,是目前引入F到芳环的最重要方法)
(三) Aryne(芳炔)机理
机理:
14
Cl NH2
14
NH2 +
14
NH2
Cl + NH2 H H + NH3 NH2 + H NH2 + NH3 + Cl
OEt O 2N NO2 O 2N E tO OMe NO2 e tc .
+
NO2
M eO
N O O
1) 在决速步骤中,C-X没有断裂,所以对 于卤素反应速度没有太大的影响,如:
X NO2 H N
+
NO2
O2N
N NO2
+X
当X=Cl, Br, I, SOPh, 时, O
2N
O
速度相差在5倍以内,也不可能期望所有的反 应速度都一样,因为它们对YΘ 进攻芳环有不 同的影响。
H +Y Y + Y Y
-H
+
(二) 定位效应
反应中间体(单取代苯)
Z
+
Z H Y
+
Z H Y
+
Z+ H Y H Y
ortho
Z
Z
+ +
Z H Y
Z
+
meta
+
H Y
Z
H Y
Z
Z+
para
+ +
H
Y
H
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
8.5 芳环上的亲核取代反应
二.SNAr1历程
芳
C uC l
香
重
C uB r
氮
盐
N 2+C l-
KI
的
亲 核
H 2O
取
代
H 3P O 2
反
应
C uC N
Cl
Br 桑德迈尔反应
I OH
CN H2O H+
COOH
8.5 芳环上的亲核取代反应
二.SNAr1历程 例如:重氮盐水解生成酚的反应
N N - N 2
OH
Br CHO
NR3
I COCH3
OR
COON
COOCH3
CONH2
电子 +I 效应 +C
+C>-I
+C< -C
+I -I
-I
-I
+I:供电诱导;-I:吸电诱导; +C:供电共轭;-C:吸电共轭
8.3 同位素效应
反应物分子中的氢被重氢置换后引起反应速率发
生变化,称为重氢同位素效应。
当C-H、O-H、N-H键的断裂发生在决定速率步 骤时,就会出现同位素效应,kH/kD >1 一般C-H:C-D快7倍 C-H:C-T快20倍
• 芳环上的亲核取代反应在理论上和实际合成中也是 很重要的。
• 芳环上的亲核取代反应很少是一步反应,而大多数 涉及不同的活性中间体。从合成的观点,芳香重氮 化合物,其中氮作为离去基团的反应最重要。
8.5 芳环上的亲核取代反应
一.通过SNAr2历程(加成-消除历程)的取代反应 二.通过SNAr1历程(重氮离子)的亲核取代反应 三.通过苯炔机理(消除-加成)的取代反应
SO3H +H2O
苯磺酸
8.1 芳香亲电取代反应
烷基化 酰基化
+R-XAlX3
R+HX
烷基苯
= =
O +R-C-X(1)(A2l )CHl23 O
O -C-R+HX
芳香酮
8.1 芳香亲电取代反应
苯环亲电取代反应历程小结
+ E+
亲电试剂
X+ NO2+ SO3 R+ R-C+=O
H E+慢 + E 快
高等有机化学
第8章 芳香亲电和亲核取代反应
第8章 芳香亲电和亲核取代反应
8.1 亲电取代反应 8.2 结构与反应活性 8.3 同位素效应 8.4 离去基团效应 8.5 芳香亲核取代反应
8.1 芳香亲电取代反应
一.亲电取代反应类型 1.卤代反应 2.硝化反应 3.磺化反应 4.付-克烷基化反应及其相关的反应 5.付-克酰基化及其相关的反应 6.与重氮化合物的偶联反应
NH2-
N H 2 +NH3Fra bibliotekN H 2
CH3 NH2-
8.4 离去基团效应
•(1) 无需协助即离去(即对于离去基团是SN1反应) 的基团:
•(2)需要从外界亲核试剂剂来的帮助才离去(SN2机理) 的基团:
这种顺序可以帮助人们估计形成什么样的芳烃正离 子,从而得到可能发生哪一个亲电取代的概念。
8.5 芳环上的亲核取代反应
• 芳环上电子云密度大,富电子的亲核试剂不易接近, 芳基正离子(如C6H5+)不稳定、不易生成。因此, 芳环上的亲核取代反应对反应物、试剂及反应条件 等都有一定限制,大多数的芳香族化合物在芳环上 不起亲核取代反应。
NO2
NO2
C l O 2N N O 2+N aH C O 3 35℃
NO2 O H
O 2N N O 2
N O 2
N O 2
8.5 芳环上的亲核取代反应
二.SNAr1历程
• 芳香族重氮盐是合成芳香族化合物的一个重要中 间体,重氮基(N2+)可被其他原子或原子团取代并 放出氮气。重氮基(N2+)离去倾向特别强,故取代 反应较易进行。
8.5 芳环上的亲核取代反应
一.SNAr2历程 • 亲核试剂首先与芳环加成,生成一种叫迈森海默
(Meisen heimer)络合物的活性中间体,
• 然后从中间体中消去一个取代基而完成反应。 • 反应是一个双分子反应,通常第一步是定速步骤。
L+Nu- 慢
L L N N u u
快
Nu+L-
• L可为卤素或烷氧基等,L的邻位或对位必须有强 吸电子基,如-NO2、-CN、-COR、-CF3等,使中 间体的稳定性增加,有助于反应的进行。
+ E + k 1 k -1
H
+
k 2 E
E + H +
k2 > k1, k-1时,无同位素效应
k2 < k1, k-1时,有同位素效应 芳环上多数亲电取代反应观察不到同位素效应, 但在有些反应中也观察到了同位素效应的存在。
8.4 离去基团效应
•在大量的芳香族亲电取代反应中,离去基团是质子, 质子确是最好的离去基团之一。其他离去基团的离去 能力次序如下:
应
反 致活效应:活化基团使芳环的反应活性提高; 应 活 致钝效应:钝化基团使芳环的反应活性降低。 性
常见取代基定位效应
类别 邻 对 位 取 代 基
间位取代基
性质 致 活
致钝 致 钝
取 最强 强 中 弱 弱
强
最强
代
NR2
O NHC R
CH3
F
NO2 CN
NHR
O CR3 C l S O 3H
基 O N H 2 OCR
二.亲电取代反应历程 三.亲电取代反应活性和定位效应
8.1 芳香亲电取代反应
卤代
+X2或 FeF Xe 3
X+ HX
卤苯
硝化 磺化
反应活性 CI2>Br2>I2
+HNO3浓 50 H ~6 2S 0 O 。 4 C NO2+H2O
硝基苯
+HO-SO3H或 发 烟 70 H- 28 S0 O。 4C25。 C
+ H 2 O O H + H +
反应速度与重氮盐的浓度成正比,而与亲核试剂 的浓度无关,
苯环间位上有供电子基时,如-OH、-OCH3、 -CH3等可使反应速度加快;
有吸电子时,如-COOH、-SO3H、-CI、-NO2等 使反应速度减慢。
8.5 芳环上的亲核取代反应
三.苯炔机理
C l N H 2 -
σ-配合物 卤素正离子 硝酰正离子 三氧化硫 烷基正离子 酰基正离子
E+ H+
8.1 芳香亲电取代反应
π络合物
络合物
一般来说, π络合物的形成是可逆的; 络合物的形成基本上是不可逆的, 且通常是速度的控制步骤。
8.2 结构与反应活性
定 第一类定位基-邻对位定位基
位 效
第二类定位基-间位定位基
• Nu:RO-、CN-、RS-、-NH2等
8.5 芳环上的亲核取代反应
一.SNAr2历程
例:
Cl
Cl Nu
Nu
Nu-
-Cl-
NO2
NO2
NO2
Cl
+NaOH
360℃ 高压
OH
C l
O H
N O 2+N aH C O 3 130℃
N O 2
8.5 芳环上的亲核取代反应
一.SNAr2历程
Cl
OH
NO2+NaHCO3 100℃
