λ噬菌体生长途径的控制和选择
λ噬菌体载体名词解释

λ噬菌体载体是一种广泛应用于分子生物学和基因工程领域的载体,用于将外源DNA序列引入细菌细胞中。
噬菌体是一种寄生性病毒,可以感染细菌并在其内部复制。
而λ噬菌体是其中最为常见和常用的一种。
λ噬菌体载体通常由数万个碱基对的环状DNA组成,其中包含了多个重要的功能区域。
其中,最重要的功能区域是Origins of Replication(ORI),即复制起始点,负责引导DNA的复制。
此外,载体还包含了选择性标记基因,如抗生素抗性基因,以便在细菌培养基中筛选带有该载体的细菌。
λ噬菌体载体还含有多个限制内切酶切位点,这些切位点可以用于将外源DNA序列插入到载体的特定位置上。
通过将外源DNA与载体进行限制性内切酶切割,然后使用DNA连接酶进行连接,可以将外源DNA序列插入到载体的DNA链上。
这一过程称为重组。
一旦重组完成,λ噬菌体载体可以通过转化的方式引入到宿主细菌中。
转化是指将外源DNA 导入到细菌细胞中的过程。
一旦载体进入到细菌细胞中,它会在细菌细胞内部复制,并产生大量的噬菌体颗粒。
这些噬菌体颗粒可以感染其他细菌细胞,并将携带的外源DNA序列传递给它们。
λ噬菌体载体在分子生物学和基因工程研究中具有广泛的应用。
它可以用于构建基因文库,即将外源DNA序列插入到载体上,并通过转化的方式导入到细菌细胞中。
这样,研究人员就可以通过筛选和分析细菌细胞中的载体来获得感兴趣的外源DNA序列。
此外,λ噬菌体载体还可以用于基因表达,即将外源DNA序列插入到载体的表达位点上,以便在细菌细胞中大量产生特定的蛋白质。
总之,λ噬菌体载体是一种在分子生物学和基因工程领域中被广泛使用的载体。
它具有多个重要的功能区域,可以用于将外源DNA序列引入到细菌细胞中,并在其中进行复制和表达。
通过利用λ噬菌体载体,研究人员可以进行基因库构建、基因表达和其他相关研究,为生物技术的发展提供了重要的工具和平台。
噬菌体调控
N: 编码一种反终止子蛋白,通过对寄主细胞RNA聚合 酶的修饰,使RNA聚合酶通过早早期基因的终止子, 继续转录迟早期基因 Q: 是与N基因相似的反终止子,使使RNA聚合酶通过迟 早期基因的终止子,继续转录晚期基因 qut 位点: Q蛋白结合位点
早早期基因(immediate early genes ):启动子和宿主基因启 动子类似 Cro 负调控因子 N 抗终止子 迟早期基因(delayed early genes ): C II 和C III 7个重组基因 2个复制基因 Q 抗终止子 晚期基因(Late genes ): 10个头部基因 11个尾部基因 2个裂解基因
2. 进入细菌
①DNA上没有调节蛋白,RNA
聚合酶结合于 PL和PR
②转录并产生抗终止蛋白N和
调节蛋白Cro
③N蛋白的抗终止作用使 RNA
聚合酶通过终止子并转录出CII、 CIII等蛋白
④ CII、CIII共同作用,促进CI转录 a. cro和cII基因之间存在一个PRE启动子,它只有在 cII蛋白存在时才能被RNA聚合酶识别 b. cII蛋白在体内极不稳定,容易被寄主的Hf1A蛋白 酶降解 c. cIII的作用是保护cII蛋白,避免被降解
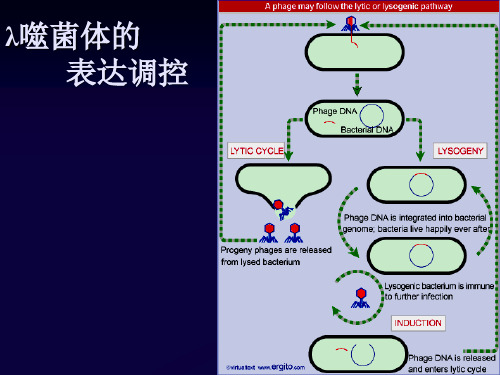
λ噬菌体的 表达调控
1. λ噬菌体基因组
PL: λ基因左侧区域转录启动子 PR: λ基因右侧区域转录启动子 OL: 非编码区(约50bp),位于CI和N基因之间 OR: 非编码区(约50bp),位于CI和Cro之间
CI: 以自身的启动子PRM转录,编码一种236个氨基酸的 阻遏蛋白,与OR 结合将阻遏cro基因的转录,但仍 允许CI转录;与OL结合后将阻碍N基因及其左侧基 因的转录 CII和CIII: 编码激活蛋白,具有增强CI基因转录的作用 Cro: 阻止CI蛋白的合成(裂解周期的必需步骤) 关闭早早期基因的表达(裂解周期后期不需要早 期基因的表达)
噬菌体表达-实验室手册

噬菌体表达-实验室手册噬菌体是一种特殊的病毒,能够感染并繁殖在细菌中。
由于噬菌体具有高度的寄生性和选择性,因此它被广泛应用于分子生物学实验室中,特别是在基因工程和蛋白质表达方面。
噬菌体表达系统已成为分子生物学研究和生物制药行业的重要工具之一。
本文将介绍噬菌体表达的基本原理、操作步骤和一些常见问题及解决方法。
一、噬菌体表达的基本原理噬菌体表达的基本原理是将待表达的外源基因插入噬菌体质粒中,将其转化到感受态宿主细菌中,并利用噬菌体的寄生性使目标基因在宿主细菌中大量复制和表达。
噬菌体表达系统一般采用两种类型的噬菌体:λ噬菌体和M13噬菌体。
其中,λ噬菌体常用于表达大片段的DNA,如整个蛋白基因;而M13噬菌体常用于表达中小片段的DNA,如DNA片段、多肽等。
二、噬菌体表达的操作步骤1.购买噬菌体表达系统所需的噬菌体质粒、宿主细菌菌株等试剂。
噬菌体质粒一般包含启动子、转录终止子和选择标记基因等功能元件,以及适当的限制性内切酶切位点,便于插入目标基因。
2.将目标基因插入噬菌体质粒中。
首先,将噬菌体质粒线性化;然后,将目标基因与线性化的质粒进行连接;最后,利用内切酶诱导的粘性末端效应,将连接好的质粒和目标基因转化到宿主细菌中。
3.筛选转化成功的宿主细菌。
将转化好的宿主细菌接种到含有适当抗生素的琼脂平板上进行筛选。
只有带有目标基因的细菌能够生长并形成菌落。
4.批量培养转化成功的宿主细菌。
将筛选得到的菌落转移到液体培养基中,并进行大规模培养。
在培养过程中,宿主细菌会大量复制和表达目标基因。
5.提取目标蛋白。
通过裂解宿主细菌,使目标蛋白释放到细胞外,然后利用适当的分离技术(如层析法、电泳法等)将目标蛋白从其他细胞成分中纯化出来。
6.鉴定目标蛋白。
通过质谱分析、Western blotting等技术对纯化的目标蛋白进行鉴定,并验证其功能和活性。
三、噬菌体表达的常见问题及解决方法1.转化率低:可能是由于转化条件不当,如转化时间过长、转化温度不合适等。
λ噬菌体的裂解性和溶原性的基因调控机制

λ噬菌体的裂解性和溶原性的基因调控机制摘要:λ噬菌体(phage)有两种生存策略,一种通过感染宿主细胞,产生大量的子代噬菌体,同时宿主细胞裂解死亡,这种方式称为裂解性感染。
另一种是噬菌体的基因组以一种原噬菌体的方式潜伏于细菌中,这种增值方式称为溶原态(lysogeny)。
λ噬菌体的裂解发育、溶原发育和溶原发育到裂解发育的诱导是研究生物分子调节优异的模型。
经过四十多年的研究,在这个模型中已经发现了众多的正调节因子和负调节因子在转录水平或转录后调节基因的表达。
关键词:λ噬菌体、裂解性、溶原性1951年J. Lederberg的妻子Esther Lederberg证明了J. Lederberg和Tatum用来杂交的K12中有原噬菌体,并命名为λ,经10年的研究搞清了溶原化的实质。
λ噬菌体的基因组长达50 Kb,共61个基因,其中38个较为重要。
其生活史如图8-15所示,可分为裂解周期和溶原周期。
细菌处于溶原化状态时,细胞质中有一些λ CⅠ基因的产物CⅠ蛋白,这是一种阻遏蛋白,可以阻止λ左、右两个早期起动子的转录,使之不能产生一些复制及细胞裂解的蛋白。
λ的DNA随着宿主的染色体复制而复制。
但在UV诱导下Rec蛋白可降解CⅠ蛋白(见第17章),诱导90%的细胞裂解。
有时λ也可自发地(10-5)从宿主的染色体上游离出来,进行复制,最终导致宿主细胞的裂解,此称为治愈(curing)。
游离在细胞质中的λ可以进行滚环复制,产生多个拷贝,并合成头部和尾部蛋白,包装成完整的λ噬菌体,使细胞裂解,释放出λ噬菌体再感染新的细胞。
(图8-19)。
因为λ噬菌体的DNA也有整合在染色体上和游离于细胞质中两种状态,所以也称做附加体。
但和F因子不同,λ噬菌体有细胞外形式,而F因子无细胞外形式。
在E.coli K12中是有原噬菌体的存在。
Jacob和Wollman(1956年)发现了合子诱导(zygotic induction)现象,并利用合子诱导确定了几个E.coli染色体上原噬菌体的整合位点。
λ噬菌体的裂解性和溶原性

生命科学学院λ噬菌体的裂解性和溶原性的基因调控机制姓名:学号:班级:专业:摘要λ噬菌体(phage)有两种生存策略,一种通过感染宿主细胞,产生大量的子代噬菌体,同时宿主细胞裂解死亡,这种方式称为裂解性感染。
另一种是噬菌体的基因组以一种原噬菌体的方式潜伏于细菌中,这种增值方式称为溶原态(lysogeny)。
λ噬菌体的裂解发育、溶原发育和溶原发育到裂解发育的诱导是研究生物分子调节优异的模型。
经过四十多年的研究,在这个模型中已经发现了众多的正调节因子和负调节因子在转录水平或转录后调节基因的表达。
关键词:λ噬菌体、裂解性、溶原性目录1.摘要22.λ噬菌体的结构组成 32.1壳体结构 32.2λ噬菌体的核心33.λ噬菌体的生活周期 63.1 λ噬菌体DNA复制 63.2λ噬菌体的转录调控73.3λ噬菌体的溶原性感染93.3.1λ噬菌体溶原化状态的建立93.3.2λ噬菌体基因组的整合113.3.3原噬菌体的割离123.3.4裂解性-溶原性选择决定154.参考文献161951年 Esther Lederberg 发现E.coli K12菌株经UV诱发或偶尔自发放出噬菌体。
E.coli K12中有潜伏的、无感染能力状态的噬菌体,称原噬菌体。
将这种噬菌体命名为λ。
λ侵染 E.coli后可进入裂解周期(lytic cycle)或溶原周期(lysogeny)。
2.λ噬菌体的结构组成2.1壳体结构λ噬菌体是有尾噬菌体,壳体由头部和尾部组成,头部和尾部通过颈部相连。
头部通常呈二十面体对称,直径为60nm左右;尾部呈螺旋对称,无收缩性。
λ噬菌体头部蛋白主要有gpE(38kD)和gpD(12kD),他们以非二硫键进行共价连接。
2.2λ噬菌体的核心λ噬菌体核心包含线状dsDNA,分子量为30.8MD,含有48502bp,其双链DNA的两5′端叫做m端, 末端碱基为G,为左向或反时针方向转录的链。
R链或右链5′端称为m′端,末端碱基为A。
λ噬菌体的培养、纯化和DNA提取

λ噬菌体的培养、纯化和DNA提取(一)铺平板细菌的制备1) 取一消毒的250ml烧瓶,加入50ml灭菌的含0.2%麦芽糖的加富培养液(如NZCYM或LB),接种一个单菌落,于37℃适度振摇(摇床250转/分)培养过夜。
加麦芽糖后细菌更容易吸附λ噬菌体,因为λ噬菌体受体编码基因(lamB)位于麦芽糖操纵子内,而麦芽糖可诱导麦芽糖操纵子。
2) 于室温以4000g离心10分钟。
3) 倾出上清液,加入约20ml灭菌的0.01mol/L MgSO4溶液,振荡悬起细菌沉淀。
如果将细菌悬液稀释到适当的密度(通常OD600=2时,细菌密度约为1.6×109细胞/ml),则实验结果的一致性更好。
4) 可做可不做:也可将该细菌悬液倒入一个100ml灭菌烧瓶,于37℃适度振摇(250转/分的摇床)培养1小时。
5) 将细菌悬液贮存于4℃,可用3个星期。
但新鲜制备的细菌悬液转化效率最高。
(二)λ噬菌体的铺平板培养单个病毒颗粒感染一个细菌后就可形成一个噬菌斑。
它的子代病毒颗粒感染邻近细菌,后者可再释放下一代子代病毒颗粒。
如果细菌在半固体培养基(如含琼脂糖或琼脂)上生长,病毒颗粒的扩散就受到限制。
在这种情况下,噬菌体的连续感染就形成了一个不断扩大的溶菌圈,最终在浑浊的细菌生长背景上肉眼可见一个清亮区。
由于每个噬斑含大哥噬菌体的子代颗粒,因而就可以获得遗传学本质毫无二致的大量噬菌体颗粒。
1) 用SM将噬菌体原种连续10倍稀释。
2) 取每个稀释度的噬菌体悬液0.1ml加入一灭菌试管(13×100mm)中。
3) 各加入0.1ml铺平板细菌,轻摇或振荡混匀。
于37℃温育20分钟,使噬菌体颗粒吸附于细菌。
4) 取3ml融化(47℃)的0.7%琼脂糖或琼脂加入第一支试管内,轻轻振荡后,立即将管内容物倒入一含30-35ml凝固的底层琼脂培养基(NZCYM或LB)的平板内,注意勿产生气泡。
轻轻晃动平板,以使细菌和顶层琼脂或顶层琼脂糖分布均匀。
大肠杆菌的λ-噬菌体

•功能区:裂解相关S和R,复制相关O和P
3、感染周期(溶菌循环)
•λDNA复制早期:一个ori ,双向复制 •晚期:滚环复制--多个λDNA分子形成线状多联体
尾巴上的微丝可以把噬菌 体的DNA注入细菌内。
噬菌体或病毒的DNA能被开发
成为基因工程的有用载体,因为:
1.高效率的感染性能使外源基
因高效导入受体细胞;
2.自主复制繁殖性能使外源基
因在受体细胞中高效扩增。
大肠杆菌的λ-噬菌体
(一) λ-噬菌体的生物学特性 1、由外壳包装蛋白和λ-DNA组成 2、 λ-DNA的物理图谱
必须携带标记基因
经改造后只具有一个可供外源DNA插入的克隆位点,长度 为37kb,为包装的下限,它本身也能被包装,允许插入 片段最大为14kb.
取代型载体(substitution vector)
具有成对的克隆位点,空载的载体DNA只26kb,不能被包 装,无法进入受体细胞中去,不需要标记基因.
应用:
(1)功能相近的基因在基因组中聚集在一起 目前已经被确定的基因至少61种,一半为必需 基因
(2)线状双链DNA,两端各有一个12bp的互补单链 (粘性末端,cohesive-end site),称λcos site ,粘性末端粘连接变成环状DNA。
λco基因大致分为3个区:
cI基因:编码阻遏蛋白,是感染了λ噬菌体的寄主细胞进 入溶源化的必要条件。cI基因失活或缺失的λ噬菌体无法 使寄主细胞发生溶源化效应。
DNA重组技术一般需要噬菌体处于溶源状态。
λ噬菌体DNA的整合与删除:
λ噬菌体的基因调控
λ噬菌体的基因调控姓名学号:班级:目录λ噬菌体的发现λ噬菌体的结构组成1.基本结构2.λ噬菌体的核心λ噬菌体的生活周期I.两种发育途径简介II.调控发育途径的分子基础1.两种途径共同的早期基因表达途径2.溶源发育中基因的相互作用3.裂解途径的建立4.溶源和裂解的平衡5.溶源发育向裂解发育的转变λ噬菌体的侵染过程1.吸附2.穿入3.生物合成4.成熟与释放λ噬菌体的应用1.细菌的鉴定与分型2.耐药细菌感染的治疗3.分子生物学研究的重要工具4.遗传工程5.其他参考文献λ噬菌体的发现:1951年J. Lederberg的妻子Esther Lederberg证明了J. Lederberg和Tatum用来杂交的K12中有原噬菌体,并命名为λ,经10年的研究搞清了溶原化的实质。
在E.coli K12中是有原噬菌体的存在。
Jacob和Wollman(1956年)发现了合子诱导(zygotic induction)现象,并利用合子诱导确定了几个E.coli染色体上原噬菌体的整合位点。
他们发现Hfr(λ)×F-所得到的重组子频率要比Hfr×F-(λ)或Hfr(λ)×F-(λ)要低得多。
这是由于在Hfr(λ)×F-的杂交中,原噬菌体进入无阻遏物的受体细胞质中,进行大量复制使受体细胞裂解(图8-20b),因此不易得到重组子,此现象就称为合子诱导。
现在我们再回过头来查阅一下传递等级作图,中断杂交实验以及重组作图都是采用Hfr×F-(λ)就是不致产生合子诱导的缘故。
λ噬菌体的结构组成:1.基本结构λ噬菌体是一种温和的诱导性噬菌体,其基因组除在5'端有12个可互补的碱基外均为线性双链DNA,感染时DNA形成环状。
λ噬菌体的基因组长达50 Kb,共61个基因,其中38个较为重要。
λ-DNA的基因顺序组织如图所示,按基因组功能共分六大区域:头部编码区、尾部编码区、重组区、控制区、复制区和裂解区.它们分属四个操纵子结构:阻遏蛋白操纵子、早期左向操纵子、早期右向操纵子以及晚期右向操纵子。
λ噬菌体溶源途径和裂解途径的基因调控

λ噬菌体溶源途径和裂解途径的基因调控摘要λ噬菌体侵染细胞后,大多数情况下进入裂解循环,λDNA复制,产生较多的噬菌体粒子。
而在以对数期以后的细菌和培养在缺乏碳源物质的培养基中的细菌作为寄主时进入溶源化途径,只有与溶源化有关的少数基因如cI才被表达。
另外溶源性细菌受到UV照射等因子诱导时,原噬菌体可以脱离细菌染色体而进行自我复制,最终导致细菌裂解,游离出大量噬菌体。
噬菌体是进入裂解循环还是整合到寄主染色体上形成溶源态,这主要取决于CI蛋白和Cro蛋白的合成及它们的调控作用。
关键词λ噬菌体,溶源化,裂解,基因调控,CⅠ蛋白,Cro蛋白一.λ噬菌体基因组和调控区λDNA分子总长度为48.5kb,编码66个基因(如下图所示),可分为三个区域:1.左臂区,自基因A到基因J,包括参与噬菌体头部蛋白质和尾部蛋白质合成所必需的全部基因。
2.中间区,介于基因J和基因N之间,这个区又称为非必需区,包含了与重组有关的基因(如基因gam)以及使噬菌体整合到大肠杆菌染色体中去的int基因和把原噬菌体从寄主染色体上切除下来的xis基因。
3.右臂区,位于N基因的右侧,包括全部主要的调控基因(cⅠ,c Ⅱ和cro),噬菌体的复制基因(O和P)以及溶菌基因(S和R)。
λ噬菌体主要的调节元件及调节基因产物的功能调节元件或调节基因产物及功能P L,O L, P R,O R左右向转录的启动子和操纵子t R(1,2,3,4,5)右向转录的终止子t L(1,2)左向转录的终止子P RE CⅠ蛋白建立启动子,受CⅡ蛋白调控P I int基因启动子,受CⅡ蛋白调控P aQ Q蛋白反义RNA启动子,受CⅡ蛋白调控P RM CⅠ蛋白基因维持启动子,受CⅠ浓度调控P R′晚期转录的启动子nut L, nut R N蛋白左右两个反终止结合位点qut Q蛋白反终止结合位点cro P L和P R的阻遏蛋白,并可阻遏P E,抑制 CI 表达c I P L和P R的主要的阻遏物,并可自主调控P RMcⅡ可以启动P RE、P I和P AQ,使λ进入溶原化途径cⅢ和CⅡ组成复合物,启动P E产生cⅠ及cro的反义RNA N t R1, t R2及t L1的反终止蛋白Q t R4的反终止蛋白.二.λ噬菌体转录调控λ噬菌体的调控有多种形式,有正调节、负调节、自主性的反馈调节、抗终止调节、反义调节及反向调节等。
植物基因工程中的λ噬菌体载体
中段:从J到N长约 20kb,是λDNA整合 和切出,溶原生长所 需的序列 ,但非溶菌 生长所必需
右臂:长约10kb,控 制溶菌和溶原生长最重 要的调控基因和序列、 以及λDNA复制起始均 在这区域内。
➢ 基因组长约50kb ,至少包括61个基因,除少数例外,大多数编码基因均是按功噬菌体结构蛋白合成、组装成熟噬菌体、溶菌生 长所需全部序列;对溶菌生长来说,中段是非必需的。
(4)重组噬菌体的体外包装,形成有感染力 的噬菌体颗粒
• 利用特殊材料,制备噬菌体包装蛋白
• 连接产物与包装蛋白混合时,就可完成包 装反应,形成有感染力的噬菌体颗粒
• 包装蛋白对所包装的DNA大小有高度选择 性, 范围:λDNA分子的75%-105%
λ噬菌体的改造
• 设计去除λDNA上的多余序列和一些限制性酶切点:因为 λDNA较大,序列中的限制性酶切点过多,妨碍其应用。
•
相信相信得力量。20.12.272020年12月 27日星 期日4时26分33秒20.12.27
谢谢大家!
•
生活中的辛苦阻挠不了我对生活的热 爱。20.12.2720.12.27Sunday, December 27, 2020
•
人生得意须尽欢,莫使金樽空对月。04:26:3304:26:3304:2612/27/2020 4:26:33 AM
植物基因工程中的 λ噬菌体载体
2013年6月29日
载体(vector)是把一个有用的目的DNA片段通过重 组DNA技术,送进受体细胞中去进行繁殖和表达的工 具。 植物基因工程技术中尤为重要的是载体,不同目的 基因需要采用不同的载体。 组成植物基因工程载体系统常见的几种载体有:
质粒 λ噬菌体 柯斯质粒(cosmid) m13单链噬菌体。
λ噬菌体的裂解性和溶原性

生命科学学院λ噬菌体的裂解性和溶原性的基因调控机制姓名:学号:班级:专业:摘要λ噬菌体(phage)有两种生存策略,一种通过感染宿主细胞,产生大量的子代噬菌体,同时宿主细胞裂解死亡,这种方式称为裂解性感染。
另一种是噬菌体的基因组以一种原噬菌体的方式潜伏于细菌中,这种增值方式称为溶原态(lysogeny)。
λ噬菌体的裂解发育、溶原发育和溶原发育到裂解发育的诱导是研究生物分子调节优异的模型。
经过四十多年的研究,在这个模型中已经发现了众多的正调节因子和负调节因子在转录水平或转录后调节基因的表达。
关键词:λ噬菌体、裂解性、溶原性目录1.摘要 (2)2.λ噬菌体的结构组成 (3)2.1壳体结构 (3)2.2λ噬菌体的核心 (3)3.λ噬菌体的生活周期 (6)3.1 λ噬菌体DNA复制 (6)3.2λ噬菌体的转录调控 (7)3.3λ噬菌体的溶原性感染 (9)3.3.1λ噬菌体溶原化状态的建立 (9)3.3.2λ噬菌体基因组的整合 (11)3.3.3原噬菌体的割离 (12)3.3.4裂解性-溶原性选择决定 (15)4.参考文献 (16)1951年 Esther Lederberg 发现E.coli K12菌株经UV诱发或偶尔自发放出噬菌体。
E.coli K12中有潜伏的、无感染能力状态的噬菌体,称原噬菌体。
将这种噬菌体命名为λ。
λ侵染E.coli后可进入裂解周期(lytic cycle)或溶原周期(lysogeny)。
2.λ噬菌体的结构组成2.1壳体结构λ噬菌体是有尾噬菌体,壳体由头部和尾部组成,头部和尾部通过颈部相连。
头部通常呈二十面体对称,直径为60nm左右;尾部呈螺旋对称,无收缩性。
λ噬菌体头部蛋白主要有gpE(38kD)和gpD(12kD),他们以非二硫键进行共价连接。
2.2λ噬菌体的核心λ噬菌体核心包含线状dsDNA,分子量为30.8MD,含有48502bp,其双链DNA的两5′端叫做m端, 末端碱基为G,为左向或反时针方向转录的链。
λ噬菌体的裂解性和溶原性

生命科学学院λ噬菌体的裂解性和溶原性的基因调控机制姓名:学号:班级:专业:摘要λ噬菌体(phage)有两种生存策略,一种通过感染宿主细胞,产生大量的子代噬菌体,同时宿主细胞裂解死亡,这种方式称为裂解性感染。
另一种是噬菌体的基因组以一种原噬菌体的方式潜伏于细菌中,这种增值方式称为溶原态(lysogeny)。
λ噬菌体的裂解发育、溶原发育和溶原发育到裂解发育的诱导是研究生物分子调节优异的模型。
经过四十多年的研究,在这个模型中已经发现了众多的正调节因子和负调节因子在转录水平或转录后调节基因的表达。
关键词:λ噬菌体、裂解性、溶原性目录1.摘要 (2)2.λ噬菌体的结构组成 (3)2.1壳体结构 (3)2.2λ噬菌体的核心 (3)3.λ噬菌体的生活周期 (6)3.1 λ噬菌体DNA复制 (6)3.2λ噬菌体的转录调控 (7)3.3λ噬菌体的溶原性感染 (9)3.3.1λ噬菌体溶原化状态的建立 (9)3.3.2λ噬菌体基因组的整合 (11)3.3.3原噬菌体的割离 (12)3.3.4裂解性-溶原性选择决定 (15)4.参考文献 (16)1951年Esther Lederberg 发现E.coli K12菌株经UV诱发或偶尔自发放出噬菌体。
E.coli K12中有潜伏的、无感染能力状态的噬菌体,称原噬菌体。
将这种噬菌体命名为λ。
λ侵染E.coli后可进入裂解周期(lytic cycle)或溶原周期(lysogeny)。
2.λ噬菌体的结构组成2.1壳体结构λ噬菌体是有尾噬菌体,壳体由头部和尾部组成,头部和尾部通过颈部相连。
头部通常呈二十面体对称,直径为60nm左右;尾部呈螺旋对称,无收缩性。
λ噬菌体头部蛋白主要有gpE(38kD)和gpD(12kD),他们以非二硫键进行共价连接。
2.2λ噬菌体的核心λ噬菌体核心包含线状dsDNA,分子量为30.8MD,含有48502bp,其双链DNA的两5′端叫做m端, 末端碱基为G,为左向或反时针方向转录的链。
λ噬菌体的综述

生命科学学院病毒生物学λ噬菌体综述摘要:噬菌体是一类温和噬菌体,它们感染大肠杆菌后能进行溶菌性生长(Lytic growth)和溶源性生长(Lysogenic growth)。
其溶源特性对基因重组与遗传工程研究有很大帮助。
本文就λ噬菌体的基因组结构、溶关键词:λ噬菌体溶原性溶菌性基因克隆引言:大肠杆菌噬菌体λ为长尾噬菌体科,是一类中等大小的大肠杆菌病毒,其基因组为双链线状DNA,由48502对碱基组成,分子量3.2×107 ,约50个基因,特点是相关基因成簇排列,形成若干个操纵子。
基因组两端为粘性末端,中间有相当长的DNA片段是裂解生长非必需的,这就为其作为外源基因的克隆载体提供了方便。
λ噬菌体由头和尾构成,其基因组组装在头部蛋白质外壳内部,其序列已被全部测出。
感染时吸附位点为细胞壁。
属温和性感染;感染的DNA环化并整合于宿主基因组中。
以θ环双向复制,然后通过滚环机制单向复制。
用于感染大肠杆菌的λ噬菌体改造成的载体应用最为广泛。
1、The discovery of bacteriophage lambda1951年J. Lederberg的妻子Esther Lederberg第一个证明了 J. Lederberg和Tatum用来杂交的K-12中有原噬菌体,并命名为λ,经10年的研究搞清了溶原化的实质。
从此之后,λ噬菌体被广泛用于模式物种;1962年Esther Lederberg的同事并且还是她最好的朋友Allan Campbell首次发现了λDNA整合到细菌DN A的机制;之后由λ噬菌体改造后的载体广泛的用于基因工程。
2、The characteristics of bacteriophage lambda2.1、结构特点:λ为大肠杆菌温和性噬菌体,属长尾噬菌体科,头壳为直径约50nm的二十面体,其内包裹一长线状双链DNA分子(46500bp),因分子两端各有一含12个核苷酸的黏性末端,故又可黏合成环状分子。
λ噬菌体的基因调控策略

λ噬菌体的基因调控策略λ噬菌体侵染细菌后,由于PL /OL和PR/OR上没有阻抑物cI的结合,所以细菌RNA聚合酶自PL 和PR处开始转录并形成N蛋白和cro蛋白,转录终止于左右两侧的第一个启动子tL1和tR1;N蛋白发挥抗终止作用,使得转录越过左右两个终止子而转录cII和cIII;cII对于cI的产生是必需的,cII导致细菌的RNA聚合酶识别PRE启动子而向左转录,从而表达cI;“无中生有”的cI之后启动正调节回路,从PRM 开始转录产生更多的cI,cI也结合到OL和OR,阻止N蛋白和cro的表达,使λ噬菌体维持溶源发育。
如果早早期基因表达翻译出的Cro蛋白与OR3结合,就能够停止从PRM 处开始的阻抑物合成;Cro蛋白同时跟OR1或OR2,以及OL1或OL2结合,以下调基因表达。
通过停止合成cII和cIII蛋白,导致从PRE停止合成阻抑物cI;当不稳定的cII蛋白和cIII蛋白降解时,阻抑物回路就被关闭。
-------------------------------------------------------------------------λ噬菌体是一种感染大肠杆菌的温和噬菌体,侵染E.coli后既能进行复制和造成细菌裂解死亡,又能整合进入E. coli基因组并随着宿主基因组进行复制,进行溶源态生存。
溶源发育尽管十分稳定,但是仍然可以通过一些损害宿主细胞的诱导剂使之诱导进入裂解感染。
λ噬菌体的裂解发育、溶源发育和溶源发育到裂解发育的诱导是研究生物分子调节优异的模型。
经过四十多年的研究,在这个模型中已经发现了众多的正调节因子和负调节因子在转录水平或转录后调节基因的表达【Donald L. C. et. al., 2007】。
I.两种发育途径简介λ噬菌体在裂解发育中的繁殖过程为吸附宿主、向宿主注射核酸物质、基因的复制和蛋白质的表达、宿主细胞的裂解和子代噬菌体的释放(如图1)。
裂解发育通过使噬菌体的基因按照一定的顺序表达而完成,这样就保证了每种成分在生命周期适宜的时间表达。
e42-2λ噬菌体基因表达的时序性调控
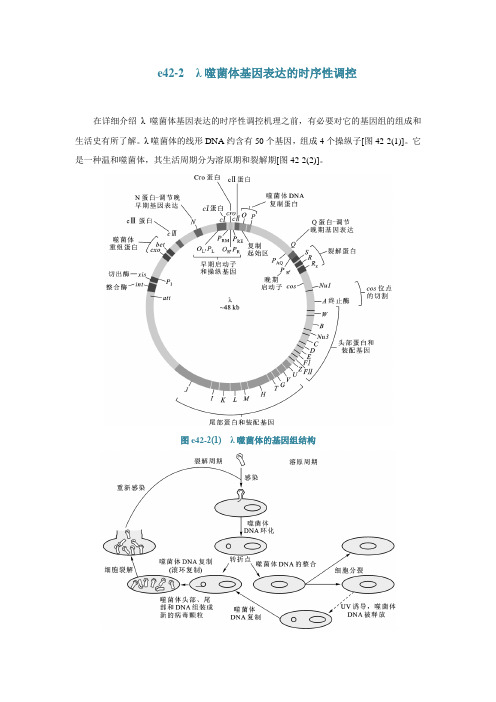
e42-2 λ噬菌体基因表达的时序性调控在详细介绍λ噬菌体基因表达的时序性调控机理之前,有必要对它的基因组的组成和生活史有所了解。
λ噬菌体的线形DNA约含有50个基因,组成4个操纵子[图42-2(1)]。
它是一种温和噬菌体,其生活周期分为溶原期和裂解期[图42-2(2)]。
图e42-2(1) λ噬菌体的基因组结构图e42-2(2) λ噬菌体的生活周期在不同的时期,λ噬菌体基因组表达的基因差别很大[图42-2(3)]。
如果进入溶原期,噬菌体DNA首先环化,前早期基因表达Cro蛋白和N蛋白。
晚早期基因表达整合酶和CI阻遏蛋白,其中CI阻止晚期基因表达,整合酶催化λ-DNA通过位点特异性重组整合到宿主DNA上(参看第三十五章DNA重组),以原噬菌体的形式存在,并随着宿主DNA的复制而复制,但不会对宿主细胞造成什么严重的损害。
在这期间,只有CI蛋白表达。
需要强调的是,整合并非是进入溶原状态必需的条件,因为某些λ噬菌体的变体虽然不能进行整合,但也能以原噬菌体的形式存在,这种情况下的λ-DNA仿佛质粒DNA一样,游离在宿主染色体DNA之外。
如果在溶原期,宿主细胞出现饥饿、中毒(如抗生素)或DNA损伤等生存压力,原噬菌体就会被激活,从溶原期转变成裂解期。
在裂解期,也是噬菌体DNA首先环化,前早期基因表达,然后是晚早期基因表达。
这时DNA发生双向θ复制。
最后是晚期基因表达,DNA通过滚环复制大量扩增,新的病毒颗粒装配,宿主细胞裂解。
图e42-2(3) λ噬菌体生活周期不同阶段的基因表达(一)前早期的基因表达在噬菌体感染宿主细胞以后,转录从左右两个主要的启动子(P L和P R)向两个方向展开。
这两个启动子可以被大肠杆菌的RNA聚合酶有效地识别,并分别终止于左右两个终止子(t L1和t R1)。
转录的终止依赖于ρ因子,转录的产物经翻译分别产生Cro蛋白和N蛋白。
Cro也是一种阻遏蛋白,它能与cI蛋白之间竞争结合操纵基因。
植物基因工程中的λ噬菌体载体

•右臂:长约10kb,控 制溶菌和溶原生长最重 要的调控基因和序列、 以及λDNA复制起始均 在这区域内。
➢ 基因组长约50kb ,至少包括61个基因,除少数例外,大多数编码基因均是按功能的相似 性成簇排列。左右臂包含λDNA复制、噬菌体结构蛋白合成、组装成熟噬菌体、溶菌生 长所需全部序列;对溶菌生长来说,中段是非必需的。 植物基因工程中的λ噬菌体载体
植物基因工程中的λ噬菌体载体
λ早使用的载体 系统,其主要优点是插入片段的装载容量大,适合于 全长的eDNA克隆,不仅质量高、代表性好,而且重组 噬菌体颗粒的感染活性在替换或插入某些标志基因,如上述的可 供蓝白筛选lacZ’序列和多克隆位点等。
• 建立重组λDNA分子的体外包装系统。
• 与一般的质粒载体不同, 噬菌体转染前需要利用噬菌体外 壳蛋白和噬菌体DNA加工酶组成的混合物(包装抽提物
• )在体外将连接好的DNA线性分子包装成噬菌体颗粒
植物基因工程中的λ噬菌体载体
植物基因工程中的λ噬菌 体载体
2020/11/20
植物基因工程中的λ噬菌体载体
载体(vector)是把一个有用的目的DNA片段通过重 组DNA技术,送进受体细胞中去进行繁殖和表达的工 具。 植物基因工程技术中尤为重要的是载体,不同目的 基因需要采用不同的载体。 组成植物基因工程载体系统常见的几种载体有:
右臂,填充片断的存在会影响连接效率, 必须纯化左臂和右臂。
植物基因工程中的λ噬菌体载体
(3)外源片断与载体的连接 • 通过载体的粘性末端,将载体连接成多联
体,以利于将两个cos位点之间的片断装入 噬菌体颗粒
植物基因工程中的λ噬菌体载体
(4)重组噬菌体的体外包装,形成有感染力 的噬菌体颗粒
分子生物学课件λ噬菌体基因表达的调控

OR3
CI
O R2
PR
CRO
O R1
P RM
G/C as axis IR seq of 17 bp
OL3
O L2
O L1
CI
OR1, OR2, OR3 序列的差异, 决定了CI-p, CRO-p 与其的结合力
For CI-p (repressor) For CRO-p (repressor)
OR1 > OR2 = OR3 OR1 = OR2 < OR3
P RE
Cis- factor
Trans-factor
F的基因组成
C gene (与溶原直接相关)
λ ? host ? lysogenic ? tuibid colony C gene mut. ? lytic ? Clear plaque
P RE
Early
N-P Anti-termination
Delayed early stage
Anti-termination in Rho-dependent terminator
TR1; Rho-dependent terminator 8s Cro RNA
Np
NuTR
Cro
CII
16s RNA
Immediate early stage; N & Cro genes transcription from P L & P R
Delayed early stage; N-p required for anti-termination at T L & T R
Late stage; Q-p required
λ噬菌体基因表达的调控
2006
烈性噬菌体( lytic phages ) 温和噬菌体( temperate phages )
λ噬菌体生长途径的控制和选择

噬菌体重组蛋白基因
切除酶基因 xis PL 整合酶基因 int att
cI crocII 噬菌体DNA复制蛋白基因
N
PL PRM PRE PR
PR , PL:强 PRM , PRE:弱
50 Kb 61个基因
PAQ
P
R
Q
裂解蛋白基因
cห้องสมุดไป่ตู้s
λ噬菌体环形图
头部基因
尾部基因
裂解生长和溶原生长中 λ 控制区的转录
PRE和PRM : 弱启动子( CⅠ)
正常情况下,CⅡ不稳定 CⅡ稳定性受大肠杆菌生长条件的调控
生命过程与生命个体是非常精巧的!!!
从大肠杆菌的角度, 如何理解λ噬菌体两种生长途径的选择???
下次课见!
OR3 PRM
OR2
OR1 PR
裂解生长
cⅠ
RNA polymerase
cro
TTTTGTGCTCATACGTTAAATCTATCACCGCAAGGGATAAATATCTAACACCGTGCGTGTTGACTATTTTACCTCTGGCGGTGATAATGGTTGCATGTACTAA AAAACACGAGTATGCAATTTAGATAGTGGCGTTCCCTATTTATAGATTGTGGCACGCACAACTGATAAAATGGAGACCGCCACTATTACCAACGTACATGATT
CⅠ 和 Cro 以不同方式结合 操作子来稳定 λ 噬菌体的生长途径
CⅠ: 正自我调控
溶原生长
cⅠ
RNA polymerase
cro
TTTTGTGCTCATACGTTAAATCTATCACCGCAAGGGATAAATATCTAACACCGTGCGTGTTGACTATTTTACCTCTGGCGGTGATAATGGTTGCATGTACTAA AAAACACGAGTATGCAATTTAGATAGTGGCGTTCCCTATTTATAGATTGTGGCACGCACAACTGATAAAATGGAGACCGCCACTATTACCAACGTACATGATT
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
噬菌体重组蛋白基因
切除酶基因 xis PL 整合酶基因 int att
cI crocII 噬菌体DNA复制蛋白基因
N
PL PRM PRE PR
PR , PL:强 PRM , PRE:弱
50 Kb 61个基因
PAQ
P
R
Q
裂解蛋白基因
cos
λ噬菌体环形图
头部基因
尾部基因
裂解生长和溶原生长中 λ 控制区的转录
OR3 PRM
OR2
OR1 PR
裂解生长
cⅠ
RNA polymerase
cro
TTTTGTGCTCATACGTTAAATCTATCACCGCAAGGGATAAATATCTAACACCGTGCGTGTTGACTATTTTACCTCTGGCGGTGATAATGGTTGCATGTACTAA AAAACACGAGTATGCAATTTAGATAGTGGCGTTCCCTATTTATAGATTGTGGCACGCACAACTGATAAAATGGAGACCGCCACTATTACCAACGTACATGATT
如何选择?
E. coli宿主细胞的生长条件控制 CⅡ稳定性从而控制 l噬菌体的生长途径
CⅡ在E. coli中不稳定,被蛋白酶FtsH降解 CⅡ指导cI转录的效率由它被FtsH降解速度决定
FtsH活性由E. coli细胞的生长条件控制
E. coli生长条件良好 FtsH活性高
CⅡ CⅡ被FtsH降解
λ噬菌体生长途径的控制和选择
—— 体现生命过程与生命个体精巧的一个实例
λ噬菌体感染E. coli有两种生长途径
λ噬菌体:感染大肠杆菌的病毒
λ噬菌体感染E. coli的两种生长途径
溶原生长
λ噬菌体
E.coli
裂解生长
E.coli基因组 λ噬菌体基因组
λ抑制物
溶原诱导 (今天不讲)
基因的选择表达模式 控制λ噬菌体裂解生长和溶原生长
OR3 PRM
OR2
OR1 PR
感染发生时,λ CⅡ蛋白 控制λ噬菌体生长途径的建立
cⅢ
cⅠ
cro c Ⅱ
PL
PRM PR
OR
PRE c Ⅱ
结合位点
cⅢ
cⅠ
cro c Ⅱ
PL
PRM PR
PRE c Ⅱ
OR
结合位点
Repressor Maintance
Repressor Establishment
cⅢ
cⅠ
cro c Ⅱ
PL
PRM PR
OR2 & OR1
PRE c Ⅱ
结合位点
CⅡ指导cI转录的效率 对决定l噬菌体生长途径起关键作用
cⅢ
cⅠ
cro
PL
PRM PR
cⅡ PRE
建立溶原生长, CⅡ 必须在Cro抑制PRM前激活之
在特定感染中, 哪些因素决定CⅡ的工作效率, 从而决定l噬菌体的生长途径呢?
PRE和PRM : 弱启动子( CⅠ)
正常情况下,CⅡ不稳定 CⅡ稳定性受大肠杆菌生长条件的调控
生命过程与生命个体是非常精巧的!!!
从大肠杆菌的角度, 如何理解λ噬菌体两种生长途径的选择???
下次课见!
CⅠ 和 Cro 以不同方式结合 操作子来稳定 λ 噬菌体的生长途径
CⅠ: 正自我调控
溶原生长
cⅠ
RNA polymerase
cro
TTTTGTGCTCATACGTTAAATCTATCACCGCAAGGGATAAATATCTAACACCGTGCGTGTTGACTATTTTACCTCTGGCGGTGATAATGGTTGCATGTACTAA AAAACACGAGTATGCAATTTAGATAGTGGCGTTCCCTATTTATAGATTGTGGCACGCACAACTGATAAAATGGAGACCGCCACTATTACCAACGTACATGATT
裂解生长
cⅠ
cro
PL
PRM
PR
溶原生长
cⅠ
cro
PL
P CⅠ
调控蛋白: Cro 和 CⅠ
Cro: Control of Repressor and Other things 抑制物和其他基因的控制 抑制基因表达
CⅠ: λ阻遏物、 λ抑制物(repressor) 抑制基因表达 激活基因表达
裂解生长
FtsH活性弱
E. coli生长条件恶劣
CⅡ
CⅡ积累
溶原生长
?
以生存需要为目的进行选择!!!
总结和思考
cⅢ
cⅠ
cro
cⅡ
PL
PRM PR
PRE
PR 和PL : 强启动子( Cro , CⅡ / CⅢ )
Cro:裂解生长
CⅡ :溶原生长
CⅢ : 稳定CⅡ(可能作为FtsH替代性底物)- 溶原生长
