医用耗材使用安全情况记录表格模板
各科室医疗器械使用安全情况考核评估表.docx

WORD格式
各科室医疗器械使用安全情况考核评估表
监督检查人:检查时间:年月日
使用记录销毁记录是否完整设备有无外修情况有无不科室备注是否完整(一次性医用耗材)(是否修好)良事件
急诊科
康复科
内一科
骨伤科
普外科
综合病区
内二科
妇产科
各科室医疗器械使用安全情况考核评估表
监督检查人:检查时间:年月日
使用记录销毁记录是否完整设备有无外修情况有无不科室备注是否完整(一次性医用耗材)(是否修好)良事件
急诊科
康复科
内一科
骨伤科
普外科
综合病区
内二科
妇产科
专业资料整理。
医疗器械使用安全情况记录表
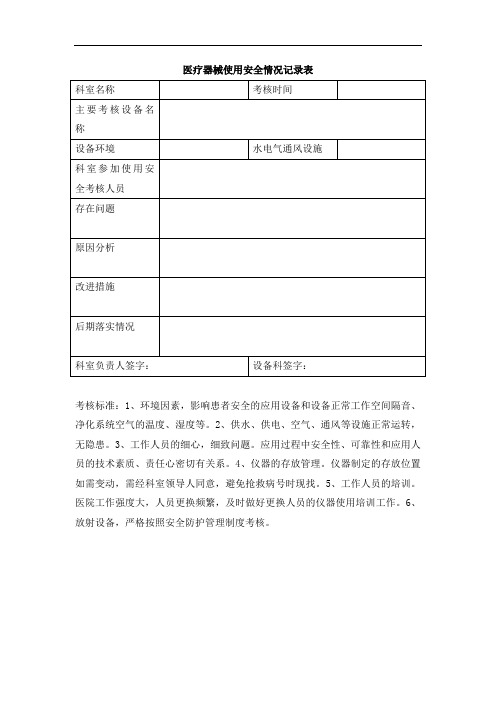
医疗器械使用安全情况记录表
考核标准:1、环境因素,影响患者安全的应用设备和设备正常工作空间隔音、净化系统空气的温度、湿度等。
2、供水、供电、空气、通风等设施正常运转,无隐患。
3、工作人员的细心,细致问题。
应用过程中安全性、可靠性和应用人员的技术素质、责任心密切有关系。
4、仪器的存放管理。
仪器制定的存放位置如需变动,需经科室领导人同意,避免抢救病号时现找。
5、工作人员的培训。
医院工作强度大,人员更换频繁,及时做好更换人员的仪器使用培训工作。
6、放射设备,严格按照安全防护管理制度考核。
医疗器械操作安全检查表

医疗器械操作安全检查表一、检查患者信息
- 患者姓名:
- 患者性别:
- 患者年龄:
- 患者病历号:
二、检查操作人员信息
- 操作人员姓名:
- 操作人员职务:
三、检查操作器械信息
- 器械名称:
- 器械型号:
- 器械数量:
四、操作环境检查
- 操作室是否整洁有序:
- 是否存在任何不相关的物品:
- 是否有必要的安全警示标识:
- 是否有紧急事故处理设备:
五、操作步骤检查
- 检查器械是否完整无损:
- 是否按照操作手册进行操作:
- 是否使用正确的消毒方式:
- 操作人员是否佩戴好个人保护装备:六、操作后处理
- 是否对器械进行清洗消毒:
- 是否妥善存放器械,避免损坏:
- 是否将操作室恢复整洁有序:
- 是否记录操作过程中的任何异常情况:
七、其他注意事项
- 是否定期检查器械的有效性和完好度:
- 是否按照操作规程进行培训和考核操作人员:
- 是否及时修理和更换损坏的器械:
- 是否定期审查和更新操作手册:
以上是医疗器械操作安全检查表,通过认真填写和检查,可以确保医疗器械操作过程的安全性和可靠性。
保障患者的健康和医疗质量。
医疗器械使用记录表(标准版)

标题:医疗器械使用记录表(标准版)一、概述医疗器械使用记录表(标准版)是为了规范医疗器械使用过程中的记录和管理,确保医疗器械的安全、有效使用,提高医疗质量,保障患者权益。
本记录表适用于各级医疗机构、医疗器械生产经营企业及相关管理部门。
在使用医疗器械过程中,应严格按照本记录表的要求进行记录,并妥善保存,以备查验。
二、记录内容1. 医疗器械基本信息(1)名称:记录医疗器械的通用名称或品牌名称。
(2)型号:记录医疗器械的型号规格。
(3)注册证号:记录医疗器械的注册批准文号。
(4)生产厂家:记录医疗器械的生产厂家名称。
(5)生产日期:记录医疗器械的生产日期。
(6)有效期:记录医疗器械的有效期限。
2. 使用人员信息(1)姓名:记录使用医疗器械的医护人员姓名。
(2)工号:记录使用医疗器械的医护人员的工号。
(3)职称:记录使用医疗器械的医护人员的职称。
3. 使用信息(1)使用日期:记录医疗器械的使用日期。
(2)使用时间:记录医疗器械的使用时间。
(3)使用地点:记录医疗器械的使用地点。
(4)患者信息:记录使用医疗器械的患者的姓名、性别、年龄、病历号等基本信息。
(5)使用目的:记录使用医疗器械的目的和原因。
(6)操作步骤:记录医疗器械的操作步骤和注意事项。
(7)使用结果:记录医疗器械使用后的效果和患者反应。
(8)维护保养:记录医疗器械的维护保养情况。
4. 监督检查(1)检查人员:记录对医疗器械使用情况进行检查的人员姓名。
(2)检查日期:记录对医疗器械使用情况进行检查的日期。
(3)检查结果:记录对医疗器械使用情况检查的结果,包括是否符合规定、存在问题等。
三、记录要求1. 记录应及时、准确、完整,字迹清晰,不得随意涂改。
2. 记录应使用蓝黑墨水或碳素墨水填写,不得使用圆珠笔、铅笔等易褪色、易涂改的书写工具。
3. 记录应妥善保存,防止遗失、损坏,确保可追溯性。
4. 记录应定期进行整理、归档,保存期限应符合相关法律法规要求。
一次性医疗用品使用销毁记录表

一次性医疗用品使用销毁记录表一次性医疗用品使用销毁记录表1·概述本记录表用于记录一次性医疗用品的使用情况及销毁情况,用于保障医疗安全和质量控制。
以下是详细的记录内容。
2·医疗用品信息2·1 用品名称:填写一次性医疗用品的具体名称。
2·2 生产厂商:填写该用品的生产厂商信息。
2·3 批号:填写该用品的批次号码,用于追溯和区分不同批次的用品。
2·4 规格:填写该用品的规格,例如尺寸、容量等。
3·使用情况记录3·1 使用日期:填写该次使用的日期。
3·2 使用科室:填写该次使用的科室,例如手术室、护理部等。
3·3 使用数量:填写使用的该次使用用品的数量。
3·4 使用人员:填写参与使用该次用品的人员姓名。
4·销毁情况记录4·1 销毁日期:填写该次销毁的日期。
4·2 销毁方式:注明该次销毁采用的方式,例如焚烧、化学处理等。
4·3 销毁人员:填写参与销毁该次用品的人员姓名。
5·监测与问题处理记录5·1 监测项目:填写对一次性医疗用品进行的监测项目,例如检查外包装完整性、材料质量等。
5·2 监测结果:填写监测项目的结果,例如合格、不合格等。
5·3 处理措施:如果监测结果不合格,填写对该批次用品的处理措施,例如停用、报废等。
6·附件本文档涉及的附件包括:●一次性医疗用品供应商的合作协议书●一次性医疗用品的产品质量合格证明复印件●相关监测报告的复印件7·法律名词及注释7·1 一次性医疗用品:指在医疗过程中只能使用一次、不能再次使用的医疗设备、物品等。
7·2 生产厂商:指生产一次性医疗用品的厂家、企业等。
7·3 批号:指生产批次的号码,用于追溯和区分不同批次的一次性医疗用品。
7·4 规格:指一次性医疗用品的具体尺寸、容量等特征。
医用耗材使用情况调查表
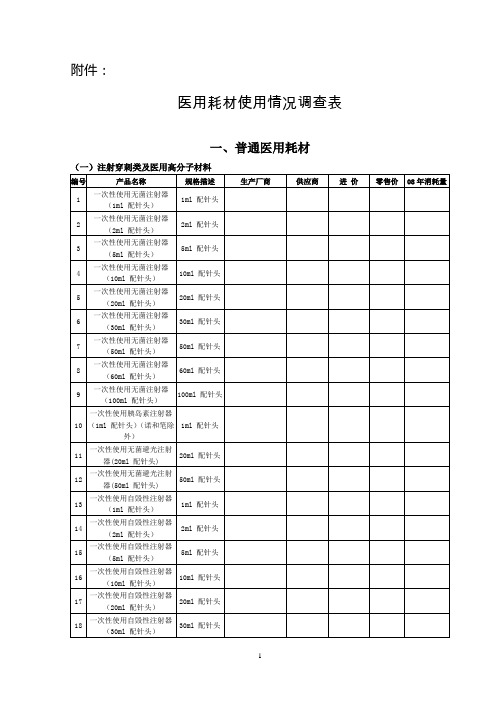
68
吸痰管
成人
69
一次性(神经阻滞)麻醉包
70
一次性(腰椎穿刺)麻醉包
71
一次性(硬膜外)麻醉包
72
一次性(联合)麻醉包
73
一次性使用无菌导尿包
74
一次性产包(通用型)
(二)医用卫生材料及敷料
编号
产品名称
规格描述
生产厂商
供应商
进价
零售价
08年消耗量
75
纱布绷带
76
医用弹性绷带
77
医用石膏绷带
78
225
普通透析器(铜仿膜透析器膜面积小于等于1.2)
226
普通透析器(铜仿膜透析器膜面积1.3-1.5)
227
普通透析器(铜仿膜透析器膜面积≥1.6)
228
普通透析器(血仿膜透析器膜面积小于等于1.2)
229
普通透析器(血仿膜透析器膜面积1.3-1.5)
230
普通透析器(血仿膜透析器膜面积≥1.6)
231
普通透析器(双醋酸膜透析器膜面积小于等于1.2)
232
普通透析器(双醋酸膜透析器膜面积1.3-1.5)
233
普通透析器(双醋酸膜透析器膜面积≥1.6)
234
普通透析器(三醋酸膜透析器膜面积小于等于1.2)
235
普通透析器(三醋酸膜透析器膜面积1.3-1.5)
236
普通透析器(三醋酸膜透析器膜面积≥1.6)
含各种口径
47
一次性单腔导尿管(成人用)
含各种口径
48
一次性双腔气囊导尿管(儿童用)
含各种口径
49
一次性双腔气囊导尿管(成人用)
含各种口径
一次性医疗用品使用销毁记录表

一次性医疗用品使用销毁记录表一次性医疗用品使用销毁记录表⒈概述本文档旨在记录医疗机构使用一次性医疗用品的情况以及销毁过程的记录,以确保医疗用品的安全使用和环境保护。
⒉使用记录⑴医疗用品信息表格记录每批一次性医疗用品的相关信息,包括但不限于:产品名称、生产厂商、批号、规格、数量等。
⑵使用情况记录每批一次性医疗用品的使用情况,包括但不限于:使用部门、使用日期、使用数量等。
⒊销毁记录⑴销毁计划记录一次性医疗用品的销毁计划,包括但不限于:销毁时间、销毁方式、销毁单位等。
⑵销毁过程记录实际销毁过程的情况,包括但不限于:销毁日期、销毁人员、销毁数量等。
⒋异常情况处理记录一次性医疗用品销毁过程中的异常情况以及相应的处理措施。
⒌监督检查记录监督检查人员对一次性医疗用品使用和销毁情况的监督检查结果,包括但不限于:检查日期、检查人员、检查意见等。
⒍上报通知记录因一次性医疗用品使用和销毁相关问题而进行的上报通知,包括但不限于:上报日期、上报单位、上报内容等。
⒎附件本文档涉及的附件包括但不限于:一次性医疗用品使用记录表、销毁计划表、监督检查记录、异常情况处理记录、上报通知记录等。
⒏法律名词及注释⑴一次性医疗用品:指在医疗过程中只能使用一次,不能重复使用的医疗器械或材料,如一次性注射器、一次性手套等。
⑵销毁:指对一次性医疗用品进行安全处理的过程,包括物理销毁、化学销毁等。
⑶监督检查:指对一次性医疗用品使用和销毁情况进行监督和检查,以确保符合相关法律法规和规定。
⑷异常情况处理:指对一次性医疗用品使用和销毁过程中出现的异常情况进行及时处理和记录。
医疗器械(骨科)使用情况登记表
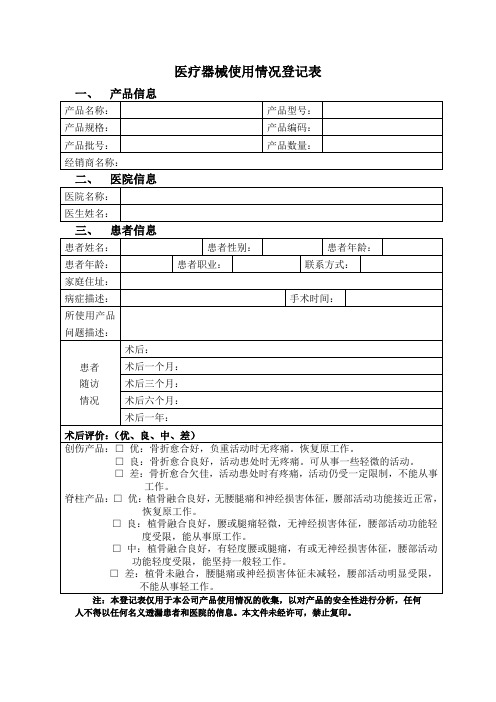
医疗器械使用情况登记表
一、产品信息
产品名称:产品型号:
产品规格:产品编码:
产品批号:产品数量:
经销商名称:
二、医院信息
医院名称:
医生姓名:
三、患者信息
患者姓名:患者性别:患者年龄:患者年龄:患者职业:联系方式:
家庭住址:
病症描述:手术时间:
所使用产品
问题描述:
患者随访情况术后:
术后一个月:术后三个月:术后六个月:术后一年:
术后评价:(优、良、中、差)
创伤产品:□优:骨折愈合好,负重活动时无疼痛。
恢复原工作。
□良:骨折愈合良好,活动患处时无疼痛。
可从事一些轻微的活动。
□差:骨折愈合欠佳,活动患处时有疼痛,活动仍受一定限制,不能从事工作。
脊柱产品:□优:植骨融合良好,无腰腿痛和神经损害体征,腰部活动功能接近正常,恢复原工作。
□良:植骨融合良好,腰或腿痛轻微,无神经损害体征,腰部活动功能轻度受限,能从事原工作。
□中:植骨融合良好,有轻度腰或腿痛,有或无神经损害体征,腰部活动功能轻度受限,能坚持一般轻工作。
□差:植骨未融合,腰腿痛或神经损害体征未减轻,腰部活动明显受限,不能从事轻工作。
注:本登记表仅用于本公司产品使用情况的收集,以对产品的安全性进行分析,任何人不得以任何名义透漏患者和医院的信息。
本文件未经许可,禁止复印。
医疗器械安全事件报表

备注:1、当事人身份类别:本院正式职工、本院退休返聘职工、本院见习期职工、进修生(执业许可)、研究生(执业许可)、访问学者、聘用外院人员、不明、其他。
2、职别:科主任、副主任、护士长、副护士长、执业医师、助理医师、见习期医师、进修医师、在读研究
生、住院总医师、非执业医师、注册护士、非注册护士、护理员/工/陪护、理疗、检验、医学影像、超声、核医学、药剂、康复训练、口腔技工、行政、营养、病案/信息、不明、其他。
3、本表根据卫生部医政司及中国医师协会“医疗安全(不良)事件报告网络系统”设计制作。
4、根据卫生部《三级综合医院评审标准实施细则》,医院至少每年每100张床报告10-20件。
