高二化学化学平衡图像历年高考试题汇总
高考化学速率平衡图像专题练习题

化学反应速率、化学平衡图像一、ν-t图像或c-t图像1、对于反应2SO 2(g)+O2(g) 2SO3(g) △H<0,填写改变的条件及平衡移动的方向。
t 1时,,平衡向移动。
t2时,,平衡向移动。
t3时,,平衡向移动。
t4时,,平衡向移动。
改变条件,图像一点保持连续;改变,两点突变,__________使正逆反应速率同等程度的增大而平衡不移动。
2、对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化如右图所示,则图像中关于X、Y、Z、W四种物质的聚集状态为( )A.Z、W均为气体,X、Y中有一种是气体B.Z、W中有一种是气体,X、Y皆非气体C.X、Y、Z、W皆非气体D.X、Y均为气体,Z、W中有一种为气体3、在密闭容器,一定条件下进行反应,mA(g)+nB(g) pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )A.正反应是吸热反应B.逆反应是吸热反应C.m+n>p+q D.m+n<p+q4、N2(g)+3H2(g) 2NH3(g) △H<0 在某一时间段中反应速率与反应过程的曲线关系如图,则图中氨的百分含量最低的时间段是( ) ,氨的百分含量最高的时间段是( )A.t0-t1B.t2-t3C.t3-t4D. t5-t65、今有X(g)+Y(g) 2Z(g) △H<0。
从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的原因是( )A.增大X或Y的浓度B.增大压强C.增大Z的浓度D.升高温度6、右图表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间。
试回答:(1)该反应的反应物是______;(2)反应物的转化率是______;(3)该反应的化学方程式为___________________________。
高二化学(必修一)化学平衡图象练习题

高二化学(必修一)化学平衡图象练习题(含答案解析)学校:___________姓名:___________班级:___________一、单选题1.在2A(g)+B(g)=3C(g)+5D(g)反应中,表示该反应速率最快的是()A.v(A)=2mol·L-1·min-1B.v(B)=0.3mol·L-1·s-1C.v(C)=0.8mol·L-1·s-1D.v(D)=1mol·L-1·s-12.a A(g)+b B(g)⇌c C(g)+d D(g)Δ H=Q,同时符合两图中各曲线规律的是()A.a+b>c+d T1>T2 Q>0B.a+b>c+d T1>T2 Q<0C.a+b>c+d T1<T2 Q<0D.a+b<c+d T1<T2 Q<03.CuCl2溶液中存在平衡:[Cu(H2O)4]2+(蓝色)+4Cl-⇌[CuCl4]2-(黄色)+4H2O,下列说法中错误的是()A.[CuCl4]2-中铜的化合价是+2价B.1mol[Cu(H2O)4]2+中σ键的物质的量为12molC.向溶液中加入AgNO3可使黄绿色的CuCl2溶液变成蓝色D.若升高CuCl2溶液温度,溶液pH不变4.在某恒容密闭容器中充入一定量的O2(g)和O3(g),发生反应2O3(g)3O2(g) △H<0,下列说法正确的是()A.若混合气体的密度不再随时间而改变,则该反应达到平衡B.加入合适的催化剂,反应达到平衡后,O2的体积分数增大C.该反应的生成物的总能量大于反应物的总能量D.若起始时充入少量的稀有气体,则该反应的反应速率保持不变5.中国科学技术大学设计出一种“松果结构”的铂金属催化剂,在催化电解水制氢效果不变的情况下,铂金属的用量降低到传统商业催化剂的175,下列说法不正确的是()A.催化剂的结构会影响催化效果B.使用“松果结构”的铂金属催化剂能够极大提高水的转化率C.使用铂金属催化剂能够降低电解水的活化能D.氢能是一种高能、洁净的可再生能源6.以Cu/Zn O/Al2O3为催化剂,乙醇直接合成乙酸乙酯过程中发生的可逆反应如下:C2H5OH(g)=CH3CHO(g)+H2(g);Δ H=59kJ·mol-12CH3CHO(g)+H2O(g)=C2H5OH(g)+CH3COOH(g);Δ H=-86kJ·mol-1CH3COOH(g)+C2H5OH(g)=CH3COOC2H5(g)+H2O(g);Δ H=-25kJ·mol-12C2H5OH(g)=C2H5OC2H5(g)+H2O(g);Δ H=-44kJ·mol-1其他条件相同,将无水乙醇经预热气化后以一定流速通过装有催化剂的反应管,将出口处收集到的乙酸乙酯、乙醛、乙醚、乙酸、乙醇冷凝,测得部分有机物占全部有机物的质量分数与反应温度的关系如图所示。
高二化学平衡移动图像问题专项训练题(附答案)

高二化学平衡移动图像问题专项训练题一、单选题1.在不同条件下进行化学反应2A(g) B(g) + D(g), B、 D起始浓度均为0,反应物A的浓度-1序号0 20 40 50①800 1.0 0.67 0.50 0.50②800 x 0.50 0.50 0.50③800 y 0.75 0.60 0.60④820 1.0 0.25 0.20 0.20下列说法不正确的是( )A.①中B在0~20min平均反应速率为8.25x10-3mo1·L-1min-1B.②中K=0.25,可能使用了催化剂C.③中Y=1.4mo1·L-1D.比较①、④可知,该反应为吸热反应2.烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g)C2H5OH(g)。
乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1L)。
下列分析不正确的是( )A.乙烯气相直接水合反应的ΔH<0B.图中压强的大小关系为:p1>p2>p3C.图中a点对应的平衡常数K=5/16D.达到平衡状态a、b所需要的时间:a>b3.升高温度,下列各项的值可能减小的是( )A.化学反应速率vB.NaCl的溶解度SC.化学平衡常数KD.弱酸的电离平衡常数K a4.在恒容密闭容器中进行反应:2CO2(g)+6H2(g)C2H5OH(g)+3H2O(g) ΔΗ在某压强下起始时按不同氢碳比[n(H2)/n(CO2)]投料(见图中曲线①②③ ),测得CO2的平衡转化率与温度的关系如图所示,下列有关说法正确的是( )A.该反应的ΔΗ>0B.氢碳比:① <② <③C.其他条件不变的情况下,增大容器的体积可提高CO 2的转化率D.若起始时CO 2浓度为2mol·L -1,H 2浓度为4mol·L -1,在图中曲线③ 氢碳比条件下进行反应,则400K 时该反应的平衡常数数值约为1.75.在某容积一定的密闭容器中,有下列可逆反应:()()()A g +B g xC g H 僔未知,有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T 表示温度,P 表示压强,C%表示C 的体积分数( )A. 34P >P ,y 轴表示C 的转化率B. 34P <P ,y 轴表示B 的体积分数C. 34P <P ,y 轴表示混合气体的密度D. 34P >P ,y 轴表示混合气体的平均摩尔质量6.在一恒温、恒容密闭容器中发生反应:()()()()50~804180~200Ni s +4CO g Ni CO g ,H<0垐垐垎V 噲垐垐℃℃利用该反应可以将粗镍转化为纯度达99.9%的高纯镍.对该反应的说法正确的是( ) A. 增加Ni 的量可提高CO 的转化率,Ni 的转化率降低℃ B. 缩小容器容积,平衡右移,H V 减小C. 反应达到平衡后,充入CO 再次达到平衡时,CO 的体积分数降低D. 当()()44v Ni CO =v CO ⎡⎤⎣⎦正正时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态7.以下自发反应可以用熵判据来解释的是( ) A. ()()()222N g +2O g ==2NO g H=+67.7kJ/mol VB. ()()()23CaO s +CO g ==CaCO s H=-175.5kJ/mol VC. ()()()()434332NH CO s ==NH HCO s +NH g H=+74.9kJ/mol VD. ()()()2222H g +O g ==2H O l H=-285.8kJ/mol V 8.工业上以CH 4为原料制备H 2的原理为CH 4(g)+H 2O(g)4CO(g)+3H 2(g) ΔΗ>0。
化学平衡图像题总汇
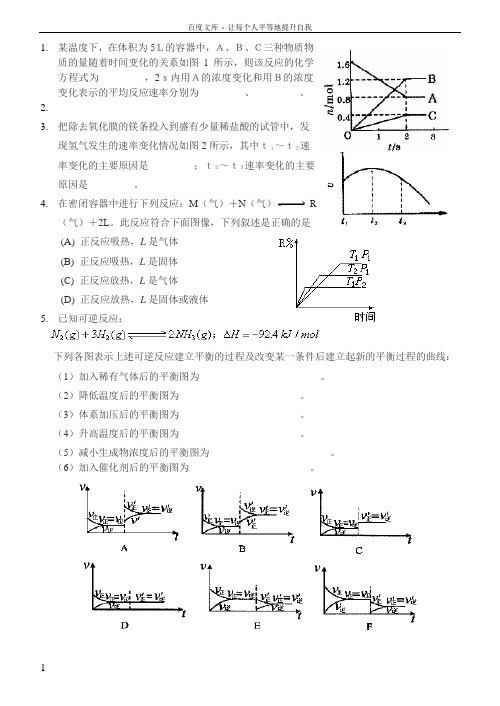
1.某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图1所示,则该反应的化学方程式为_________,2s内用A的浓度变化和用B的浓度变化表示的平均反应速率分别为_________、_________。
2.3.把除去氧化膜的镁条投入到盛有少量稀盐酸的试管中,发现氢气发生的速率变化情况如图2所示,其中t1~t2速率变化的主要原因是_________;t2~t3速率变化的主要原因是_________。
4.在密闭容器中进行下列反应:M(气)+N(气)R(气)+2L。
此反应符合下面图像,下列叙述是正确的是(A) 正反应吸热,L是气体(B) 正反应吸热,L是固体(C) 正反应放热,L是气体(D) 正反应放热,L是固体或液体5.已知可逆反应:下列各图表示上述可逆反应建立平衡的过程及改变某一条件后建立起新的平衡过程的曲线:(1)加入稀有气体后的平衡图为________________________。
(2)降低温度后的平衡图为________________________。
(3)体系加压后的平衡图为________________________。
(4)升高温度后的平衡图为________________________。
(5)减小生成物浓度后的平衡图为________________________。
(6)加入催化剂后的平衡图为________________________。
6. 对于可逆反应:A 2(g )+3B 2(g )2AB 3(g )△H =-Q (Q >0)下列图象中正确的是 [ ].7. 有可逆反应)()(g dD g cC △H=Q ,试根据下图回答:(1) 压强比_____________填(大、小) (2) 体积_____________(填大、小)(3) 温度T 1℃比T 2℃____________(填高、低)(4) Q 值是_____________(填正、负)【达标练习】1.在容积固定的4L 密闭容器中,进行可逆反应:X(气)+2Y(气)2Z(气)并达到平衡,在此过程中,以Y 的浓度改变表示的反应速率v(正)、v(逆)与时间t 的关系如右图,则图中阴影部分面积表示( )A. Y 的浓度的减少B. Y 的物质的量的减少C. Z 的浓度的增加D. X 的物质的量的减少2.可逆反应aA (气)+bB (气) cC (气)+dD (气)△H 图所示,下列叙述正确的是( )(A )p 1<p 2,a +b <c+d ,T 1<T 2,△H <0(B )p 1>p 2,a +b >c+d ,T 1>T 2,△H <0(C)p1<p2,a+b>c+d,T1>T2,△H>0(D)以上答案均不对3、对于mA(固)+nB(气)pC(气)△H 可逆反应,在一定温度下平衡时B的百分含量与压强的关系如图所示,则下列判断正确的是(A)m+n<p (B)n>p(C)x点的状态是v正>v逆(D)x点比y点的反应速度慢4.在密闭的容器中进行如下的反应:H 2(G+I2(g)2HI(g),在温度T1和T2时,产物的量彧时间的关系如下图所示,符合图象的正确的判断是( )A.T1>T2,△H>0B.T1>T2,△H<0C.T1<T2,△H>0D.T1<T2,△H<05.一密封体系中发生下列反应:N2 +3H22NH3 ΔH<0,下图是某一时间段中反应速率与反应进程的曲线关系图:回答下列问题:(1)处于平衡状态的时间段是______.(2)t1、t3、t4时刻体系中分别是什么条件发生了变化?、、(3)下列各时间段时,氨的百分含量最高的是______.A.t0~t1B.t2~t3C.t3~t4D.t5~t6。
高二化学选择性必修一 化学平衡图像专项练习题

化学平衡图像选择题(每小题有一个或两个选项符合题意)1.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是()A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)B.反应开始时10s,X的物质的量浓度减少了0.79mol/LC.反应开始时10s,Y的转化率为79.0%D.反应的化学方程式为:X(g)+Y(g)Z(g)2.T℃时,A气体与B气体反应生成C气体。
反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是()A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动B.在(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动C.T℃时,在相同容器中,若由0.3mol·L—1A0.1mol·L—1B和0.4mol·L—1C反应,达到平衡后,C的浓度仍为0.4mol·L—1D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大3.已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是()A.该反应在T1、T3温度时达到过化学平衡B.该反应在T2温度时达到过化学平衡C.该反应的逆反应是放热反应D.升高温度,平衡会向正反应方向移动4.右图表示反应N2(g)+3H2(g)2NH3(g);ΔH=-92.2kJ/mol。
在某段时间t~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是()A.t~t1B.t2~t3C.t3~t4D.t5~t65.反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是()A.10~15min可能是加入了正催化剂B.10~15min可能是降低了温度C.20min时可能是缩小了容器体积D.20min时可能是增加了B的量6.今有反应X(g)+Y(g)2Z(g)(正反应放热),右图表示该反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。
高二化学下学期化学平衡图像题

Байду номын сангаас
下列哪项不是理想的桥基牙应具备的条件A.牙冠、牙根均应长而粗大,形态结构正常B.牙周组织正常C.失活的死髓牙D.咬合关系正常E.牙位置正常 薄层固定床反应器主要用于。A、快速反应B、强放热反应C、可逆平衡反应D、可逆放热反应 用于在网络应用层和传输层之间提供加密方案的协议是A.PGPB.SSLC.IPSecDES 细胞因子测定的首选方法是A.放射性核素掺入法B.NBT法C.ELISAD.MTT比色法E.RIA 下列哪项没有参与促进乳腺发育及泌乳功能A.皮质醇B.雌激素C.甲状旁腺素D.胎盘生乳素E.胰岛素 注册会计师了解被审计单位控制活动,特别是了解与信息处理有关的与用于生成、记录、处理、报告交易或其他财务数据的程序相关信息技术应用控制,其内容包括。A.综合分析财务数据与经营数据的内在关系B.接触或访问权限控制C.修改及维护控制D.对例外报告进行人工干预 当管理层的作用为积极主动,而变革的性质为渐变性变革,该种变革为。A.协调变革B.计划变革C.接受变革D.迫使变革 如何看待中国传统社会“精耕细作”的农业生产方式? 对中度以上营养不良患者每日应保证供应蛋白质的量为。A.1.5g/kgB.2.5g/kgC.3.5g/kgD.4.5g/kgE.5g/kg 博学公司项目经理向客户推荐了四种供应商选择方案。每个方案损益值已标在图18-16的决策树上。根据预期收益值,应选择设备供应商A.1B.2C.3D.4 何谓沟通?沟通的作用有哪些? 下列哪项是诊断钩端螺旋体病的血清学检查方法A.肥达试验B.外斐反应C.补体结合试验D.显微镜凝集溶解试验E.红细胞溶解试验 癫痫持续状态临床表现之一是指一次癫痫发作持续超过A.50minB.40minC.30minD.20minE.10min 下列对于同程式空调水系统评述错误的是。ABCD 预防早产的重要措施中不正确的是A.加强对高危妊娠病人的管理B.定期产前检查C.积极治疗妊娠并发症D.常规抗生素预防感染E.子宫颈内口松弛者应于妊娠中期行宫颈内口环扎术 患者,男性,20岁,左眼视力渐进性下降。查远视力:右眼为0.8,左眼为0.2。检查无斜视,裂隙灯、眼底镜检查未见有明显器质性病变。对于该患者,最有可能的诊断是()A.弱视B.圆锥角膜C.球后视神经炎D.逆规性散光E.青光眼 小孔扩散律 编制洪水水文要素摘录表时,摘录点应尽量摘录的值,所摘数值应为定时观测值,不得用日平均值代替。A、每日0时B、每日8时C、每日12时D、每日24时 甲企业2014年6月以融资租赁的方式租入一处房产,原值1000万元,租赁期5年,租入当月投入使用,每月支付租赁费10万元(注:当地计算房产余值的扣除比例为20%)。2014年甲企业融资租赁的房产应缴纳房产税万元。A.4.8B.5.6C.7.2D.8.4 下列关于输尿管损伤的说法,不正确的是A.输尿管损伤多为医源性损伤B.交通事故导致输尿管损伤常伴有其他脏器的损伤C.逆行肾盂造影可用于输尿管损伤的检查D.术中发现输尿管损伤,可视情况立即进行修复E.输尿管损伤后血尿轻重与损伤程度一致 利用永久建筑物和设备是矿井建设的一项重要经验,在建井初期,一般可利用的久建筑物或设施有。A.永久井架B.办公楼C.职工食堂D.机修厂E.井下炸药库 正常的肺间质主要包括的成分有A.血管B.细胞外基质C.肺泡结构D.支气管E.细胞 1984年11月,在东京公开发行200亿日元债券,标志着中国正式进入国际债券市场。A.中国银行B.中国农业银行C.中国工商银行D.中国建设银行 通常利用搜索引擎查找信息的方法有:按关键字查找和___。A.按图片查找B.按内容分类逐级查找C.按名字查找D.按文件大小查找 若外界的温度在-18℃—35℃之间,ECB将APU速度设置到A、98%B、99%C、100% 下列哪种是正确的消毒法。A.2%中性戊二醛水溶液,浸泡时间30min消毒,灭菌为5hB.5%中性戊二醛水溶液,浸泡时间30min消毒,灭菌为10hC.2%中性戊二醛水溶液,浸泡时间30min消毒,灭菌为10hD.2%中性戊二醛水溶液,浸泡时间45min消毒,灭菌为10hE.2%中性戊二醛水溶液,浸泡时间 毒,灭菌为5h 姜片虫重要保虫宿主是A.猫B.犬C.猪D.羊E.牛 下列哪一种胆汁酸是初级胆汁酸A.甘氨石胆酸B.甘氨胆酸C.牛磺石胆酸D.牛磺脱氧胆酸E.甘氨脱氧胆酸 病案质量管理的特点叙述不正确的是。A.多学科融合的专业特点B.专业的独立性C.协调作用D.服务对象的多元性E.病案管理人员的专业性 不属于风水泛滥型水肿的症状是A.浮肿起于眼睑,继则四肢及全身皆肿B.下肢浮肿按之凹陷不起C.来势迅速D.兼有咽喉红肿疼痛E.小便短少 演示戴无菌手套的方法。 需要进行电除颤的心电图类型有。A.心室停搏B.心室颤动C.无脉性室性心动过速D.电-机械分离E.心房颤动 中国农业银行于1955年3月再次恢复成立,成为在农村金融体系中占主导地位的国家专业银行。A.正确B.错误 何谓催化剂寿命?催化剂的寿命如何计算? 企业意识到顾客满意是实现企业利润的唯一手段,因而成为经营管理的核心要素。A.物流B.顾客服务C.生产D.销售额
高二化学下学期化学平衡图像题

[单选]温标有华氏温标、摄氏温标以及()。A、基本温标B、通用温标C、标准温标D、开氏温标 [单选]关于可兴奋细胞动作电位的描述,正确的是A.动作电位是细胞受刺激时出现的快速而不可逆的电位变化B.在动作电位的去极相,膜电位由内正外负变为内负外正C.动作电位的大小不随刺激强度和传导距离而改变D.动作电位的大小随刺激强度和传导距离而改变E.不同的细胞,动作电位 [单选]液体的饱和蒸汽压与()有关。A、质量B、体积C、温度D、面积 [问答题,简答题]进化的主要研究内容是什么? [单选,A1型题]认知疗法的治疗目标是()A.改变患者的不良行为B.帮助患者建立理性的认知模式C.消除不良嗜好D.帮助患者自我实现E.挖掘患者的最大潜力 [单选,A1型题]产褥期是指胎盘娩出至产后()A.2周B.4周C.6周D.8周E.12周 [填空题]所有电气设备的()均应有良好的接地装置。使用中不准将接地装置()或对其进行()。 [单选]Inmarsat-C船站在进行卫星洋区登记时,()是正确的.A.只能进行报文的接收B.可以接收EGC报文C.只能接收来自地面站的遇险报警信息D.不能进行报文的发射 [多选]矿业工程项目的成本由建筑安装工程费,设备及工器具购置费及()构成。A.工程建设其他费B.建设期贷款利息C.企业管理费D.措施费E.预备费 [判断题]防火门、防火窗应划分为甲、乙、丙三级,其耐火极限:甲级应为1.50h,乙级应为1.00h,丙级应为0.50h。()A.正确B.错误 [单选,A1型题]小儿化脓性脑炎的脑脊液变化为()A.细胞数增高,蛋白正常,糖降低B.细胞数增高,蛋白增高,糖降低C.细胞数正常,蛋白正常,糖降低D.细胞数增高,蛋白升高,糖升高E.细胞数升高,蛋白正常,糖正常 [单选]混凝土,轻骨料混凝土,砖及石材的强度等级代号分别是()A.C,MU,MU,CLB.C,CL,MU,M
高中化学 高考总复习 化学平衡图像 习题解析

高考总复习化学平衡图像一、选择题:(每题有1-2个选项符合题意)1.在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)2SO3(g)ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响。
下列分析正确的是()。
A.图Ⅰ研究的是t0时刻增大O2的物质的量浓度对反应速率的影响B.图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高2.右图为可逆反应A (g)+2B (g)nC (g);ΔH<0,生成物C的浓度随压强变化并建立平衡的关系图,则n值与压强p1、p2的关系正确的是()A.p2>p1,n<3 B.p2>p1,n>3C.p1>p2,n<3 D.p1>p2,n>33.如图所示,a曲线表示一定条件可逆反应X(g)+Y(g) 2Z(g)+W(s)(正反应为放热反应)的反应过程。
若使a曲线变为b曲线,可采取的措施是()A、加入催化剂B、增大Y的浓度C、降低温度D、增大体系压强4.一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是()。
A.CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g)ΔH<0B.CO2(g)+H2(g) CO(g)+H2O(g)ΔH>0C.CH3CH2OH(g) CH2===CH2(g)+H2O(g)ΔH>0D.2C6H5CH2CH3(g)+O2(g) 2C6H5CH===CH2(g)+2H2O(g)ΔH<05.已知:2NO(g) +O2(g)2NO2(g),其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如右图),下列说法不正确...的是A. p1<p2B.该反应的△H<0C.A、B两点的平衡常数:K(A)<K(B)D.A、B两点的化学反应速率:v(A)<v(B)6.已知:4NH3(g)+5O2(g)=4NO(g)+6H2(g). △H= -1025kJ/mol该反应是一个可逆反应。
完整化学平衡移动图像专题

0
A
B
C
E
D
T
NO转化率
3 、图表示反应N2(g)+3H2(g) 2NH3(g);ΔH=-92.2kJ/mol。在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是 ( ) A t0~t1 B t2~t3 C t3~t4 D t5~t6
AB
练习:
D
下列图象中,不能表示反应A2(g)+3B2(g) 2AB3(g)(△H<0)平衡体系的是…( )
练习:
2、下图是在其它条件一定时,反应2NO+O2 2NO2+ Q(Q>0)中NO 的最大转化率与温度的关系曲线。图中坐标有A、B、C、D、E 5点,其中表示未达平衡状态且V正>V逆的点是 。
•对于反应mA(g)+nB(g) pC(g)+qD(g)有如下图所示的变化,请分析t1时的改变因素可能是什么?并说明理由。
二、速度-时间图:
v逆
t1
t
v
v正
由于v正、v逆相同程 度的增大,t1时的改变因素可能是 a.加入(正)催化剂 b.当m+n=p+q时增大压强。平衡没有移动。
t
v
v正
增大
逆
<
•若对以上反应已知m+n>p+q,平衡后降低压强时,画出相关的 v – t 图。
t1 t2
t
v
v逆
v正
二、速度-时间图:
v逆
t1 t2
t
v
v正
•对于反应A(g)+3B(g) 2C(g)+D(g)(正反应放热)有如下图所示的变化,请分析引起平衡移动的因素可能是什么?并说明理由。
高二化学下学期化学平衡图像题

化学平衡中的图像题
解化学平衡图像题的技巧
1、弄清横坐标和纵坐标的意义。 2、弄清图像上点的意义,特别是一些特殊点 (如与坐标轴的交点、转折点、几条曲线的交叉 点)的意义。 3、弄清图像所示的增、减性。 4、弄清图像斜率的大小。
1、时间对反应物或生成物的某个量(如转化 率、体积分数)的曲线
我们以反应2S02(g)+O2(g)=2S03(g)+Q为例去说 明,我们用横坐标代表时间,纵坐标代表SO2的转化 率,反应刚开始的一瞬间SO2还没有被消耗,S02的转 化率为0,随着时间的推移,S02被消耗,其转化率升 高,最后达平衡,转化率不变。图2-25代表了在温度
如可逆反应aA(g)+ bB(g)=dD(g)+eE(g)+Q 在一定条件下达平衡状态时,A的转化率与温度、 压强的关系如图2-29所示。则在下列空格处填 写“大于”、“小于”或“等于”。
(1)a+b_____c+d; (2)Q___0。
看任一根曲线,可知温度升高, A的转化率变大,送说明升温使 平衡正移,故正反应为吸热反应, 即Q<0 再垂直于横坐标画一直线,可知: 温度相同时,压强越大,A的转 化率越小。这说明增大压强使平 衡逆移,即(a+b)<(c+d)
化学平衡图像高考真题

化学平衡图像高考真题化学平衡作为高考化学中的一个重要内容,一直是考试中的难点之一。
其中,常常会涉及到化学平衡的图像表达。
通过图像,我们可以更直观地理解化学反应中各种物质的含量变化,从而更好地解决相关问题。
下面就以高考真题为例,来分析化学平衡图像的相关知识。
在一道高考真题中,题目描述了如下化学反应:\[2A + B \rightleftharpoons 3C + D\]并要求根据该反应写出平衡常数表达式,并利用图像表示该反应的化学平衡。
首先,我们知道平衡常数(Kc)的表达式为:\[Kc = \frac{{[C]^3 [D]}}{{[A]^2 [B]}}\]根据上述反应式,我们可以得知,在达到化学平衡时,反应物A和B与生成物C和D的摩尔比为2:1:3:1。
因此,在图像中我们可以通过不同长度的线段,分别表示反应物A和B的浓度,以及生成物C和D 的浓度。
接着,我们可以将该反应表示成图像形式。
在横轴上,我们表示出反应物A和B的初始浓度以及生成物C和D的初始浓度。
在纵轴上,表示各物质的浓度变化。
通过画出不同颜色的线段,分别代表不同物质的浓度变化,并在适当的位置标出各种物质的浓度比例。
通过这样的图像表达,我们可以清晰地看到在达到化学平衡时,反应物和生成物的浓度变化情况,以及它们之间的比例关系。
这样不仅有助于我们更直观地理解化学平衡的概念,也能帮助我们更好地解答相关问题。
综上所述,化学平衡的图像表达在高考化学中起着重要作用。
通过图像,我们可以更直观地理解化学反应中各物质的浓度变化,从而更好地掌握相关知识,并更好地应对考试中的问题。
希望同学们在备战高考时能够充分利用图像表达,提升化学学科的学习效果。
高中化学平衡图像练习题

高中化学平衡图像练习题一、化学平衡常数与图像1. 已知反应:N2(g) + 3H2(g) ⇌ 2NH3(g),在某温度下,平衡常数K为50。
若反应物和物的初始浓度分别为0.1 mol/L和0.2 mol/L,请画出反应物和物的浓度随时间变化的图像。
2. 对于反应:2SO2(g) + O2(g) ⇌ 2SO3(g),在不同温度下,平衡常数K分别为200和400。
请分别画出两个温度下,SO2和SO3的浓度随时间变化的图像。
二、勒夏特列原理与图像1. 对于反应:H2(g) + I2(g) ⇌ 2HI(g),在体积固定的条件下,向体系中加入一定量的H2。
请画出反应物和物的浓度随时间变化的图像。
2. 对于反应:N2O4(g) ⇌ 2NO2(g),在温度固定的条件下,增大体系的压强。
请画出反应物和物的浓度随时间变化的图像。
三、化学平衡移动与图像1. 对于反应:CaCO3(s) ⇌ CaO(s) + CO2(g),在温度固定的条件下,向体系中通入一定量的CO2。
请画出反应物和物的浓度随时间变化的图像。
2. 对于反应:Fe3O4(s) + 4H2(g) ⇌ 3Fe(s) + 4H2O(g),在温度和压强固定的条件下,移除部分Fe。
请画出反应物和物的浓度随时间变化的图像。
四、化学平衡与反应速率1. 对于反应:2NO(g) + O2(g) ⇌ 2NO2(g),在温度固定的条件下,改变反应物的初始浓度。
请画出反应物和物的浓度随时间变化的图像。
2. 对于反应:A(g) + 2B(g) ⇌ 3C(g),在温度和压强固定的条件下,加入催化剂。
请画出反应物和物的浓度随时间变化的图像。
五、化学平衡计算与图像1. 对于反应:2FeCl3(aq) + H2S(g) ⇌ 2FeCl2(aq) + 2HCl(aq)+ S(s),平衡常数K为100。
已知初始浓度为FeCl3 0.1 mol/L,H2S 0.2 mol/L,请画出反应物和物的浓度随时间变化的图像。
2024年高考化学一轮复习一遍过专题27化学平衡图像专练含解析

专题27 化学平衡图像专练1.已知反应:CH2=CHCH3(g)+Cl2(g)CH2=CHCH2Cl(g)+HCl(g)。
在肯定压强下,按向密闭容器中充入氯气与丙烯。
图甲表示平衡时,丙烯的体积分数(ϕ)与温度(T)、ω的关系,图乙表示反应的平衡常数K与温度T的关系。
则下列说法正确的是A.图甲中11ω>B.若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强将不变C.温度T1、2ω=, Cl2的转化率约为33.3%D.图乙中,线A表示正反应的平衡常数【答案】C【解析】A.ω增大,CH2=CHCH3的转化率增大,则φ减小,由上述分析可知:ω2>ω1,则ω1<1,故A错误;B.该反应在反应前后气体分子数不变,依据图甲上升温度丙烯的体积分数增大,即上升温度平衡逆向移动,正反应放热,在恒容绝热装置中进行题述反应,体系内温度上升,依据PV=nRT,达到平衡时,装置内的气体压强将增大,故B错误;C.由图乙可知,T1时平衡常数为1,设起始时CH2=CHCH3和Cl2的物质的量分别为amol和2amol,达到平衡时转化的Cl2的物质的量为xmol,依据三段式进行计算:CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g)起始(mol) a 2a 0 0转化(mol) x x x x平衡(mol) a-x 2a-x x x则(xV)2÷(a xV-×2a xV-)=1,解得x=2/3a,则Cl2的转化率2/3a÷2a×100%=33.3%,故C正确;D.由图甲可知,ω肯定时,温度上升,φ增大,说明正反应是放热反应,故温度上升,正反应平衡常数减小,故图乙中,线A表示逆反应的平衡常数,故D错误。
2.如图所示的各图中,表示2A(g)+B(g)⇌2C(g)(△H<0)这个可逆反应的正确图象为(注:Φ(C)表示C的质量分数,P表示气体压强,C表示浓度)()A.B.C.D.【答案】A【解析】A.该反应为放热反应,温度上升平衡向逆反应方向移动,C的质量分数减小,故A正确;B.依据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,正逆反应速率都增大,且V正>V逆,故B错误;C.催化剂同等程度地变更正逆反应速率,平衡不发生移动,故C错误;D.该反应为放热反应,温度上升平衡向逆反应方向移动,A的转化率降低,依据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,A的转化率增大,本题温度的曲线不正确,故D错误。
2023-2024学年高二化学2019选择性必修1试题2.3.2化学平衡的移动(化学平衡图像)-

基础知识清单化学平衡的移动(化学平衡图像)一、化学平衡图像1.反应速率图像(vt图)(1)“渐变”类vt图——浓度对化学反应速率的影响图像Ⅰ中,v′(正)突变,而v′(逆)渐变,t1时刻图像中有一条线是连续的,且v′(正)>v′(逆),说明t1时刻改变的条件是增大了反应物的浓度,使v′(正)突变,平衡正向移动。
图像Ⅰ中,v′(正)渐变,v′(逆)突变,t1时刻图像中有一条线是连续的,且v′(正)>v′(逆),说明t1时刻改变的条件是减小了生成物的浓度,使v′(逆)突变,平衡正向移动。
(2)“断点”类vt图——温度(或压强)对化学反应速率的影响图像Ⅰ中,v′(正)、v′(逆)都是突然增大的,t1时刻,图像中出现了“断点”,且v′(正)>v′(逆),平衡正向移动,说明该反应的正反应是吸热反应(或气体分子数减小的反应),改变的外界条件是升高温度(或增大压强)。
图像Ⅰ中,v′(正)、v′(逆)都是突然变小的,t1时刻,图像中出现了“断点”,且v′(正)>v′(逆),平衡正向移动,说明该反应的正反应是放热反应(或气体分子数增大的反应),改变的条件是降低温度(或减小压强)。
(3)“平台”类vt图——催化剂(或压强)对化学反应速率的影响图像中v′(正)、v′(逆)都是突然增大,且增大的程度相同,t1时刻,图像中出现了“平台”,化学平衡不发生移动,改变的条件是使用了催化剂或反应前后气体分子数目不发生变化的反应增大了压强。
(4)速率-温度(压强)图这类图有两种情况:一是不隐含时间因素的速率-时间图,二是隐含时间变化的速率-时间图。
以2SO2(g)+O2(g)2SO3(g)ΔH<0为例,vT(p)图如图:2.物质的量(或浓度)—时间图像[n(或c)t图像]此类图像说明各平衡体系组分(或某一组分)在反应过程中的变化情况。
解题原则:注意各物质曲线的折点(到达平衡的时刻),各物质浓度变化的比例符合化学方程式中的化学计量数关系等情况可以求得某段时间内的平均反应速率。
高中化学高考总复习---化学平衡图像知识讲解及巩固练习题(含答案解析)

高中化学高考总复习---化学平衡图像知识讲解及巩固练习题(含答案解析)【高考展望】图像题是化学反应速率和化学平衡部分的重要题型。
这类题可以全面考查各种条件对化学反应速率和化学平衡的影响,具有很强的灵活性和综合性。
该类题型的特点是:图像是题目的主要组成部分,把所要考查的知识寓于坐标曲线上,简明、直观、形象,易于考查学生的观察能力、类比能力和推理能力。
当某些外界条件改变时,化学反应速率或有关物质的浓度(或物质的量、百分含量、转化率等)就可能发生变化,反映在图像上,相关的曲线就可能出现渐变(曲线是连续的)或突变(出现"断点")。
解答化学平衡图像题必须抓住化学程式及图像的特点。
析图的关键在于对“数”、“形”、“义”、“性”的综合思考,其重点是弄清“四点”(起点、交点、转折点、终点)及各条线段的化学含义,分析曲线的走向,发现图像隐含的条件,找出解题的突破口。
【方法点拨】一、解答化学平衡图像题的一般方法:【高清课堂:ID:363520解答化学平衡图像题的一般方法】化学平衡图像题,一是以时间为自变量的图像;二是以压强或温度为自变量的图像。
从知识载体角度看,其一判断化学平衡特征;其二应用勒夏特列原理分析平衡移动过程;其三逆向思维根据图像判断可逆反应的有关特征;其四综合运用速率与平衡知识进行有关计算。
①确定横、纵坐标的含义。
②分析反应的特征:正反应方向是吸热还是放热、气体体积是增大还是减小或不变、有无固体或纯液体物质参与反应等。
③分清因果,确定始态和终态;必要时可建立中间态以便联系始、终态(等效模型)。
④关注起点、拐点和终点,分清平台和极值点,比较曲线的斜率,把握曲线的变化趋势,抓住“先拐先平数值大”。
⑤控制变量:当图像中有三个变量时,先确定一个量不变,再讨论另外两个量之间的关系。
⑥最后检验结论是否正确。
二、常见化学平衡图像归纳:例:对于反应mA(g)+nB(g)pC(g)+qD(g),若m+n>p+q且ΔH>0。
化学平衡图像 典型例题及答案

化学平衡图像综合题图像是一种有效的表示物理量之间关系的有效手段。
在遇到图像时,一般需要关注以下几点: ①认清横、纵坐标各自表示的物理量; ②看清起点及变化趋势; ③关注“平”、“陡”情况; ④理解原点、拐点、极值点的意义。
一、速率——时间图像对于图像而言,最常见的就是v -t 图像,它可以很直观地体现反应的快慢,请补全下面的v -t 图像。
除此之外,还有许多其他更复杂的v -t 图像:例题1下图是可逆反应A 2B 2C 3D ++的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )A .正反应是吸热反应B .若A 、B 是气体,则D 是液体或固体C .逆反应是放热反应D .A 、B 、C 、D 均为气体 答案:B增加反应物浓度 升高温度增大压强加入催化剂减少反应物浓度 降低温度减小压强练1反应A(g)B(g)C(g) 0H <+∆已达平衡,升高温度,平衡移动,当反应一段时间后反应又达平衡,则v -t 的曲线为( )答案:C 练2(1) 确定t 1、t 2、t 3时刻的操作:A .降低浓度;B .降温;C .加压 t 1__________________;t 2__________________;t 3__________________。
(2) 该反应正方向是__________热反应,气体物质的量_____________的反应。
答案:(1) B ;C ;A (2) 放;增大 练3在某一恒温体积可变的密闭容器中发生如下反应:A(g)B(g)2C(g) 0H <+∆,t 1时刻达到平衡后,在t 2时刻改变某一条件,其反应过程(I 、Ⅱ)如图所示。
下列说法中,一定不正确的是( )A .0~t 1时,v 正>v 逆B .I 、Ⅱ两过程分别达到平衡时,A 的体积分数Ⅱ>ⅡC .t 2时刻改变的条件可能是向密闭容器中加C 物质D .Ⅱ、Ⅱ两过程达到平衡时,平衡常数K Ⅱ=K Ⅱ 答案:B二、物质的量/浓度/转化率/百分含量-时间图像除了v -t 图像之外,c -t 图像也是很常见的一类,它能直接表现出反应体系中的浓度大小。
精选高考化学平衡图像专题

精选高考化学平衡图像专题1.对于反应A(气)+2B(气) 2C(气) △H<0,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是()A B C D2、反应2X(气)+Y(气)2Z(气) △H< 0,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(n Z)与反应时间(t)的关系如图所示。
下列判断正确的是()A、T1<T2P1<P2B、T1<T2P1>P2C、T1>T2P1>P2D、T1>T2P1<P23.图中C%表示某反应物在体系中的百分含量,v表示反应速度,P表示压强,t表示反应时间。
图(A)为温度一定时压强与反应速度的关系曲线;图(B)为压强一定时,在不同时间C%与温度的关系曲线。
同时符合以下两个图像的反应是()A.4NH3(g)+5O2(g)4NO(g)+6H2O(g)(正反应为放热反应)B.N2O3(g)NO2(g)+NO(g)(正反应为吸热反应)C.3NO2(g)+H2O(l)2HNO3(l)+NO(g)(正反应为放热反应)D.CO2(g)+C(s)2CO(g)(正反应为吸热反应)4.下图表示反应A(气)+B(气)nC(气)(正反应放热)在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。
下列有关叙述正确的是()A.若其它条件相同,a比b的温度高B.a表示有催化剂,b表示无催化剂C.若n=2,其它条件相同,a比b的压强大D.反应由逆反应开始5.在A(g)+B(g)=C(g)+D(g)的反应体系中,C的百分含量和时间的关系如图所示,若反应分别在400℃和100℃下进行,所得曲线分别为Q与P,则正反应是放热反应的图为()A B C D6.在一定条件下,固定容积的密闭容器中反应:C%t t t500 C200 C500 C o200 C oC%oC%o200 C o500 C o C%t200 C o500 C oT2 P1n zT2 P2T1 P2t2NO 2(g)2NO(g)+O2(g);△H>0,达到平衡。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高二化学化学平衡图像历年高考试题汇总
1、在密闭的容器中进行如下的反应:H 2(G+I2(g)2HI(g),
在温度T1和T2时,产物的量彧时间的关系如下图所示,符合
图象的正确的判断是( )
A.T1>T2,△H>0 B.T1>T2,△H<0
C.T1<T2,△H>0 D.T1<T2,△H<0
2、已知:4NH3(g)+5O2(g)=4NO(g)+6H2(g). △H=-1025kJ/mol
该反应是一个可逆反应。
若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
3、各可逆反应达平衡后,改变反应条件,其变化趋势正确的是
4、I 2在KI溶液中存在下列平衡:I2(aq)+I-(aq)I3-(aq)某I2、、
KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所
示(曲线上任何一点都表示平衡状态)。
下列说法正确的是()
A.反应I 2(aq)+I-(aq)I3-(aq)的△H>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2则K1>K2
C.若反应进行到状态D时,一定有v正>v逆
D.状态A与状态B相比,状态A的c(I2)大
5、反应aM(g)+bN(g) cP(g)+dQ(g)达到平衡时。
M的体积分数y(M)与反应条件的关系如图所示。
其中:Z表示反应开始时N的物质的量与M的物质的量之比。
下列说法正确的是A.同温同压Z时,加入催化剂,平衡时Q的
体积分数增加
B.同压同Z时,升高温度,平衡时Q的体积
分数增加
C.同温同Z时,增加压强,平衡时Q的体积
分数增加
D.同温同压时,增加Z,平衡时Q的体积分
数增加
6、下图表示反应X(g)4Y(g)+Z(g),△H<0,在某温度时X的浓度随时间变化曲线:下列有关该反应的描述正确的是
A.第6min后,反应就终止了
B.X的平均转化率为85%
C.若升高温度,X的平均转化率将大于85%
D.若降低温度,v正和v逆将以同样倍数减小
7、某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据下表中数据,在由图中画出X、Y、Z物质的量(n)随时间(t)变化的曲线:
(2)体系中发生反应的化学方程式
是。
(3)列式计算该反应在0~3min时间内产物Z的平
均反应速率:。
(4)该反应达到平衡时反应物X的转化率α等
于。
(5)如果该反应是放热反应。
改变实验条件(温度、
压强、催化剂)得到Z随时间变化的曲线①、②、
③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:① ② ③ 。
8、一定条件下,在体积为3 L 的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu 2O/ZnO):CO(g)+2H 2(g)CH 3OH(g)
0t /min n (甲醇)/mol
n (B)
n (A)
t (B)t (A)曲线A 300 ℃曲线B 500 ℃E C D
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K = ,升高温度,K 值 (填“增大”、“减小”或“不变”)。
(2)在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H2)= 。
(3)在其他条件不变的情况下,对处于E 点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a .氢气的浓度减少
b .正反应速率加快,逆反应速率也加快
c .甲醇的物质的量增加
d .重新平衡时n(H 2)/n(CH 3OH)增大
(4)据研究,反应过程中起催化作用的为Cu 2O ,反应体系中含少量CO 2有利于维持催化剂Cu 2O 的量不变,原因是:________________________________(用化学方程式表示)。
9、2SO 2(g)+O 2(g) 2SO 3(g)反应过程的能量变化如图所示。
已知1mol SO 2(g)氧化为1mol SO 3的ΔH =—99kJ·mol —1.请回答下列问题:
(1)图中A 、C 分别表示 、 ,E 的大小对该反应的
反应热有无影响? 。
该反应通常用V 2O 5作催化剂,加V 2O 5
会使图中B 点升高还是降低? ,理由是 ;
(2)图中△H = KJ·mol —1;
(3)V 2O 5的催化循环机理可能为:V 2O 5氧化SO 2时,自身被
还原为四价钒化合物;四价钒化合物再被氧气氧化。
写出该催
化循环机理的化学方程式 ;
(4)如果反应速率v (SO 2)为0.05 mol·L —1·min —1,则v (O 2)= 、v (SO 3)=
(5)已知单质硫的燃烧热为296 KJ·mol —1,计算由S(s)生成3 molSO 3(g)的△H
10、二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。
综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO 2催化氧化生成SO 3: 2SO 2(g)+O 2(g)
△催化剂2SO 3(g)。
某温度下,SO 2的平衡转化率(α)与体系总压强(p )的关系如图所示。
根据图示回答下列问题:
p /MPa
0.100.500.800.85
A B
①将2.0 mol SO 2和1.0 mol O 2置于10 L 密闭容器中,反应达平衡后,体系总压强为0.10 MPa 。
该反应的平衡常数等于____________。
②平衡状态由A 变到B 时,平衡常数K (A)_______K (B)(填“>”、“<”或“=”)。
(2)用CH 4催化还原NO x 可以消除氮氧化物的污染。
例如:
CH 4(g)+4NO 2(g) = 4NO(g)+CO 2(g)+2H 2O(g);∆H =-574 kJ/mol
CH 4(g)+4NO(g) = 2N 2(g)+CO 2(g)+2H 2O(g);∆H =-1160 kJ/mol
若用标准状况下4.48 L CH 4还原NO 2至N 2,整个过程中转移的电子总数为_____________(阿伏加德罗常数的值用N A 表示),放出的热量为_________kJ 。
11、在溶液中,反应A+2B C 分别在三种不同实验条件下进行,它们的起始浓度均为()0.100/c A mol L =、()0.200/c B mol L =及()0/c C mol L =。
反应物A 的浓度随时间的变化如下图所示。
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。
所改变的条件和判断的理由是: ②_____________ __;③_________ ______;
(2)实验②平衡时B 的转化率为_________;实验③平衡时C 的浓度为____________;
(3)该反应的H ∆_________0,判断其理由是__________________________________;
(4)该反应进行到4.0min 时的平均反应速度率:
实验②:
B v =_____________________________实验③:
C v =______________________________ 12、在2L 密闭容器中,800℃时反应2NO(g)+O 2(g)
2NO 2(g)体系中,n(NO)随时间的变
化如表:
(1)写出该反应的平衡常数表达式:K =___________________。
已知:K(300℃)>K(350℃),该反应是________热反应。
(2)右图中表示NO 2的变化的曲线是____用O 2表示从0~2s 内该反应的平均速率v =___
(3)能说明该反应已经达到平衡状态的是___________。
a 、v(NO 2)=2v(O 2)
b 、容器内压强保持不变
c 、v 逆(NO)=2v 正(O 2)
d 、容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a 、及时分离出NO 2气体
b 、适当升高温度
c 、增大O 2的浓度
d 、选择高效的催化剂。
