第四章 酶汇总
第四章 酶1

• 酶活力的测定(实际就是酶的定量测定):测定酶促反应 的速度 • 酶反应速度:单位时间内、单位体积中底物的减少量或产 物的增加量来表示,单位:浓度/反应时间 •一般测定产物的增加为好why? •酶反应速度往往随时间延长而变化? →常以酶促反应的初速度表示? 据产物物理化学性质选择适当测定方法(以判断产物增加量) UV-Vis、荧光、同位素测定、电化学方法
2)转移酶Transferase
• 转移酶催化基团转移反应,即:将一个底物分子的基团 转移到另一个底物的分子上 • 例如:谷丙转氨酶催化的氨基转移反应
CH3CHCOOH HOOCCH2CH2CCOOH NH2 CH3CCOOH O O HOOCCH2CH2CHCOOH NH2
• 还有转移碳基、醛或酮基、酰基、糖苷基、磷酸基和含 硫基的酶
• 生物体内辅因子种类有限,而酶的种类繁多 • 每一种需要辅因子的脱辅酶往往只能与特定的辅因子结合, 即:脱辅酶对辅因子的要求有一定选择性 • 同一种辅因子往往可以与多种不同的脱辅酶结合而表现出 多种不同的催化作用 • 如:3-磷酸甘油醛脱氢酶、乳酸脱氢酶中,均需辅酶I • 催化不同的底物脱氢
3、单体酶、寡聚酶、多酶复合体
生
物
化
学
第四章 酶
酶——生物催化剂
• 每一种生物过程所必须,生命现象是催化剂催化的多步反应
• 营养素分子的分解、从小分子前体合成生物大分子 • 化学能的贮存和转换
• 细胞为什麽需要酶
• 在生理条件下无催化剂许多反应进行的太慢
• 在细胞环境中没有催化剂时许多生化反应不能进行
• 为什麽要研究酶?
• 酶研究是理解缺陷=遗传紊乱的基础(酶活性为什麽丧失?) • 是理解和治疗一些癌症的基础(为什麽生长控制中酶活性永远 处于“开”状态?) • 可以指示药物的作用靶点(病原体酶进行选择性抑制) • 应用于生物产业(复杂的合成与转化)
生物化学 第四章 酶

生物化学 第四章 酶1、什么是酶?(酶的定义是什么)?酶的化学本质是什么?(1)酶是由活细胞产生的对特异底物具有高效催化作用的蛋白质和核酸(2) 化学本质:蛋白质2、什么是单体酶?寡聚酶?多酶复合体?多功能酶?单体酶:由一条多肽链构成的酶,溶菌酶;寡聚酶:由多个相同或不同亚基以非共价键连接的酶,磷酸化酶a ;多聚复合体:由几种酶靠非共价键彼此嵌合而成。
可一次催化连锁反应的复合体,丙酮酸脱氢酶系;多功能酶:一条多肽链上同时具有多种不同催化活性的酶,生物进化中基因融合的产物,DNA 聚合酶3、简述酶的分类?单纯酶、结合酶的定义是什么?酶蛋白、辅助因子的作用? 酶的分类:单体酶、寡聚酶、多酶复合体及多功能酶单纯酶:仅由多肽链组成,如淀粉、脲酶、核糖核酸酶等结合酶:由蛋白质部分和非蛋白质部分组成,其催化作用依赖于两部分的共同参与,如氨基转移酶、碳酸酐酶、乳酸脱氢酶等。
酶蛋白的作用:决定反应专一性辅助因子的作用:决定反应的种类与性质4、辅助因子的分类及分类依据是什么?各自(辅酶、辅基)的作用分别由哪些? 辅助因子的分类:辅酶和辅基。
分类依据:按照其与酶蛋白结合的紧密程度及作用特点不同辅酶的作用:与酶蛋白共价键结合紧密,不可用透析、超滤方法除去 辅基的作用:与酶蛋白非共价键结合不牢固,可用透析、超滤方法除去5、什么是酶的活性中心?酶的活性中心包括哪些基团?这些基团的功能是什么? 酶的活性中心:酶分子中必需基团相对集中,形成一个与底物特异性结合并催化其反应生成产物的具有特定三维结构的区域。
活性中心的基团 (1)结合基团:可与底物结合(2)催化基团:催化底物发生化学反应6、什么是酶原?什么是酶原激活?酶原激活的机制是什么?简述酶原激活的生理意义?酶原:是细胞内合成或初分泌时处于无活性状态的酶的前体 酶原激活:在一定条件下,酶原向有活性酶转化的过程。
酶原激活的生理意义:(1)酶原是酶的安全转运形式,避免细胞产生的酶对细胞进行自身消化,并使酶在特定的部位和环境中发挥作用,保证体内代谢正常进行。
高级生化题库——第四章酶

⾼级⽣化题库——第四章酶第四章酶⼀、名词解释1、固定化酶⼆、是⾮题1、酶的最适pH与酶的等电点是两个不同的概念,但两者之间有相关性,两个数值通常⽐较接近或相同。
(-)2、对于⼀个酶⽽⾔,其过渡态的底物类似物与底物的物相⽐较,是更有效的竞争性抑制剂。
(+)3、在结构上与底物⽆关的各种代谢物有可能改变酶的Km值o4、如果加⼊⾜够的底物,即使存在⾮竞争性抑制剂,酶催化反应也能达到正常的Vmax。
5.、酶反应最适pH不仅取决于酶分⼦的解离情况,同时也取决于底物分⼦的解离情况( )6、反竞争性抑制剂(I)⾸先与酶结合形成EI,EI再与底物(S)结合形成EIS,EIS不能分解成产物,I因此⽽起抑制作⽤。
7、Km的物理意义是指当酶反应速率达到最⼤反应速率⼀半时的底物浓度。
为使某⼀反应的反应速度从10%Vmax提⾼到90%Vmax,其底物浓度应提⾼9倍。
8、推导Michaelis-Menten⽅程时,假设之⼀是随底物转变为产物,酶-底物复合物的浓度不断下降。
9、⼀种酶有⼏种底物时,就有⼏种Km值。
10、别构酶对温度的反应很特殊,有的在0℃时不稳定,在室温时反⽽稳定。
三、填空题1、酶容易失活,如何保存酶制品是⼀个很重要的问题。
通常酶制品的保存⽅法有___和___等。
2、有⼀类不可逆抑制剂具有被酶激活的性质,被称为_________型不可逆抑制剂,⼜可被称作酶的_____________3、抗体酶既具有专⼀结合抗原的性质,⼜具有酶的催化功能。
4、胰蛋⽩酶原__________端切去6肽后变成有活性的胰蛋⽩酶。
5、于1953年⾸先完成了胰岛素的全部化学结构的测定⼯作。
⽽⽜胰核糖核酸酶是测出⼀级结构的第⼀个酶分⼦,由⼀条含124个残基的多肽链组成,分⼦内含有__________个⼆硫键。
6、胰凝乳蛋⽩酶原受到胰蛋⽩酶作⽤后,在______________与_______________之间的肽键断开,成为有活性的π-胰凝乳蛋⽩酶,再失去两个⼆肽_________________和________________⽽形成酶的稳定形式α-胰凝乳蛋⽩酶。
酶学第四章酶的结构和功能

第四章酶的结构和功能4.1 酶的活性中心4.1.1 酶的活性中心和必需基团的概念在酶蛋白中,只有少数特异的氨基酸残基与催化活性直接相关。
这些特异的氨基酸残基可以在肽链的一级结构上相距较远,但通过肽链的折叠、盘旋,使它们在空间上接近,形成活性中心(或称活性部位)。
组成活性中心的氨基酸残基有些执行结合底物的任务,有些执行催化反应的任务。
我们把组成活性中心的氨基酸残基的侧链基团及一些维持整个酶分子构象所必需的侧链基团称为必需基团。
1960年,Koshland将酶分子中的氨基酸残基或其侧链基团分成4类:接触残基(直接与底物接触,参与结合或催化的残基;右图中的R1、R2、R6、R8、R9、R163、R164、R165),辅助残基(对接触残基的功能起辅助作用的残基,也位于活性中心;右图中的R4),结构残基(维持构象的残基,此为活性中心以外的必需基团;右图中的R10、R162、R169),非贡献残基(或称非必需残基,非必需只是对酶发挥活性而言,它们可能有其他作用,如识别自身物质、运输、防止降解等;右图中的R3、R5、R7)。
4.1.2 酶活性中心的拓扑学酶的活性中心可以设想为一个口袋或是一条沟槽,形状与底物相近。
不同的酶的口袋适合不同的底物。
口袋中有相应的结合残基与底物上的某些基团结合,发生反应的底物上的键与催化基团靠近。
亲水基团与亲水残基亲合,疏水基团与疏水残基亲合,带电荷的基团与带相反电荷的残基亲合。
例如羧肽酶A催化多肽链上羧基端氨基酸的水解。
当末端氨基酸是含有较大疏水基团的氨基酸时(苯丙氨酸、缬氨酸、亮氨酸、异亮氨酸),反应速度很快。
但是当有这些较大疏水基团的氨基酸残基进入亚位点3~6时,就会减低酶对这些底物的亲和力。
说明羧肽酶A对底物的识别和结合有多个位点。
同时,苯丙氨酸是羧肽酶A的竞争性抑制剂。
4.2 酶活性中心化学基团的鉴定常用的方法有化学修饰法、反应动力学法和x-光晶体衍射法。
4.2.1化学修饰法酶分子中有许多氨基酸残基的侧链基团可以被化学修饰,如羟基、巯基、咪唑基、氨基、羧基等。
分子生物学第四章--基因工程常用工具酶

同裂酶:识别位点相同,酶的来源不同。
同尾酶:识别位点不同,切出片段有相同末端序列。
B.以切出片段末端性质不同可分,粘性末端和平末端。
粘性末端:(Cohesive Ends)两个突出末端可退火互补— — DNA是分子重组的基础
15
同裂酶
又称异源同工酶。指来源不同,但具有相同的识别 序列。 在切割DNA时,其切割点可以是相同的,产生平 头末端,称为同识同切; 切割点也可以是不同的,产生3ˊ或5ˊ粘性末端, 称为同识异切。
第四章 基因工程常用工具酶
1
Manipulating Genes
- Transferring Genes
Restriction Ligation Extract DNA
Transformation
Selection
Culturing
2
重组DNA实验中常见的主要工具酶
3
我们的基本目的是:把外源基因与载体 连接在一起形成重组DNA分子,最少需要以 下两类工具酶:
23
如果用一种限制酶,切割两种不同的DNA时,
产生相同的末端,混合后“退火”,这两种不同的
DNA分子彼此可以连接,形成重组DNA分子。
24
限制性内切酶的剪切方式
25
Yu Zheng, et al. Using shotgun sequence data to find active restriction enzyme genes. Nucleic Acids Res., 2009, 37: e1. Whole genome shotgun sequence analysis has become the standard method for beginning to determine a genome sequence. The preparation of the shotgun sequence clones is, in fact, a biological experiment. It determines which segments of the genome can be cloned into Escherichia coli and which cannot. By analyzing the complete set of sequences from such an experiment, it is possible to identify genes lethal to E. coli.
第四章 酶法分析

优点:
不需要特殊复杂的设备和仪器 灵敏度高 重复性好 对健康无害
应用前景
食品卫生 环境污染生化 指标 临床医学
“瘦肉精”快速检测新技术 ——竞争酶标免疫法
“瘦肉精”(学名盐酸克伦特罗)为一种人工合成的 作用于β —肾上腺受体的兴奋剂,常用来防治哮喘、肺气 肿等肺部疾病,当其应用剂量达到治疗量的5—10倍时, 可使肌肉合成增加,脂肪沉积减少,因此将其俗称为“瘦 肉精”。
应用时应考虑两个问题,即工具酶的用 量与反应的平衡点。
终点法要操作中应注意:
(1)被测的底物浓度必须十分小,并控制反 应于1级反应水平。因为这样可以使反应迅速 达到平衡点防止过多的产物生成,避免逆反 应;减少工具酶的用员。 (2)其它因素应尽量处于最适水平,双底物 反应的另一底物应具有足够高的浓度。 (3)酶的用量要高,以保证反应较快地达到 终点。
底物? pH? 温度? 样品?
二、测定中应注意的问题 1.初速度
底物浓度对酶速的影响
浓度选择: a) [s]>=100Km; b) 有时不宜采用高底物浓度(有 毒性、价高、溶解度小、抑制 酶反应等)则根据具体条件,通 过实验选一适当浓度。
作用于待测酶产物的其它酶;
(如腈水合酶与酰胺酶) 其它因素。
三、酶标免疫分析法
Enzyme Immunoassay (EIA)
在70年代初,从放射免疫分析发展起 来的一种称为“酶标免疫”的分析方法, 它是将免疫学的专一性和酶的高效催化能 力有机地结合在一起,建立的一种高度特 异、灵敏的分析方法。
放射免疫分析(Radioimmunoassay,RIA)是用放射 性同位素标记抗原Ag*,该抗原与未标记抗原Ag竞 争结合抗体(Ab)结合位点时的能力相同,所以反应 生成的Ag*-Ab复合物与Ag的量呈负相关。Ag*-Ab的 生成量可通过测定其放射活性得到,然后根据已知 浓度抗原的标准曲线就可以计算出样品中抗原浓度, 这种分析方法称为放射免疫分析。
第四章 酶

第四章酶0007104010102 01 10 70 30 01 01 01辅酶与辅基的主要区别在于A.分子大小不同B.理化性质不同C.化学本质不同D.分子结构不同E.与酶蛋白结合紧密程度不同00071E0007204030300 01 10 60 35 01 01 03心肌梗死时,乳酸脱氢酶的同工酶谱中增加最显著的A.LDH lB.LDH2C.LDH3D.LDH4E.LDH500072A0007304040300 01 10 80 10 01 01 03保存酶制品最适宜的温度是A.4℃B.25℃C.37℃D.60℃E.80℃00073A0007404030100 01 10 40 50 01 01 01有关酶活性中心的论述正确的是A.酶的活性中心由非必需基团组成B.酶的活性中心不是底物结合的部位C.催化相同反应的酶具活性中心不同D.酶的活性中心有结合基团和催化基团E.酶的活性中心是由一级结构相互邻近的基团组成00074D0007504030200 01 10 70 30 01 01 01酶原的激活是由于A.激活剂能促使抑制物从酶原分子上除去B.激活剂能促使酶原分子上的催化基因活化C.激活剂能促使酶原分子的空间构象发生变化D.激活剂能促使酶原分子上的结合基团与底物结合E.激活剂能促使酶原分子上的活性中心暴露或形成00075E00007604040200 01 10 70 30 01 01 01酶促反应速度与酶浓度成正比时的条件是A.正常体温B.碱性条件C.酸性条件D.酶浓度足够大时E.底物浓度足够大时00076E0007704010102 01 10 70 30 01 01 01结合酶的酶蛋白的作用是A.选择催化的底物B.提高反应的活化能C.决定催化反应的类型D.使反应的平衡常数增加E.使反应的平衡常数减少00077A0007804010102 01 10 70 30 01 01 01全酶是指A.酶的无活性前体B.酶蛋白与底物复合物C.酶蛋白与抑制剂复合物D.酶蛋白与辅助因子复合物E.酶蛋白与变构剂的复合物00078D0007904010000 01 10 70 30 01 01 01关于酶的叙述哪项是正确的A.只能在体内起催化作用B.所有的酶都含有辅基或辅酶C.大多数酶的化学本质是蛋白质D.都具有立体异构专一性(特异性)E.能改变化学反应的平衡点加速反应的进行00079C0008004030200 01 10 68 32 01 01 01酶原所以没有活性是因为A.缺乏辅酶或辅基B.是已经变性的蛋白质C.酶原是普通的蛋白质D.酶蛋白肽链合成不完全E.活性中心未形成或未暴露00080E0008104040602 01 10 60 40 01 01 03磺胺类药物的类似物是A.叶酸B.嘧啶C.二氢叶酸D.四氢叶酸E.对氨基苯甲酸00081E0008204010102 01 10 65 35 01 02 01辅酶NADP+分子中含有哪种B族维生素A.叶酸B.核黄素C.硫胺素D.尼克酰胺E.磷酸吡哆醛00082D0008304010102 01 10 50 50 01 01 01下列关于酶蛋白和辅助因子的叙述,哪一点是正确的A.酶蛋白决定反应类型B.辅助因子不直接参加反应C.酶蛋白或辅助因子单独存在时均有催化作用D.一种酶蛋白只与一种辅助因子结合成一种全酶E.一种辅助因子只能与一种酶蛋白结合成一种全酶00083D0008404040101 01 10 30 80 01 01 01如果有一酶促反应其〔S〕=1/2Km,则v值应等于多少VmaxA.0.25B.0.33C.0.50D.0.67E.0.7500084B0008504040601 01 10 60 40 01 01 03有机磷杀虫剂对胆碱酯酶的抑制作用属于A.可逆性抑制作用B.竞争性抑制作用C.非竞争性抑制作用D.反竞争性抑制作用E.不可逆性抑制作用00085E0008604040602 01 10 75 25 01 01 03丙二酸对于琥珀酸脱氢酶的影响属于A.反馈抑制B.底物抑制C.变构调节D.竞争性抑制E.非竞争性抑制00086D0008704030501 01 10 70 30 01 03 01酶高度的催化效率是因为它能A.升高反应温度B.增加反应的活化能C.降低反应的活化能D.改变化学反应的平衡点E.催化热力学上允许催化的反应00087C0008804010102 01 10 60 40 01 01 01决定酶特异性的是A.辅酶B.辅基C.酶蛋白D.金属离子E.辅助因子00088C0008904010102 01 10 70 30 01 01 01全酶是指A.结构完整的酶B.酶与激动剂的复合物C.酶与抑制剂的复合物D.酶与变构剂的复合物E.酶蛋白与辅助因子的结合物00089E0009004030100 01 10 30 70 01 01 01有关酶活性中心的叙述正确的是A.酶都有活性中心B.位于酶分子核心C.酶活性中心都含辅基或辅酶D.抑制剂都作用于酶活性中心E.酶活性中心都有调节部位和催化部位00090A0009104030200 01 10 70 30 01 01 01以酶原形式分泌的酶是A.脂肪酶B.淀粉酶C.转氨酶D.消化管内的蛋白酶E.组织细胞内的脱氢酶00091D0009204030200 01 10 67 33 01 01 01 酶原没有催化活性是因为A.辅助因子的脱落B.由于周围有抑制剂C.作用的温度不合适D.活性中心没有形成或暴露E.反应环境的酸碱度不合适00092D0009304030300 01 10 90 10 01 01 01 同工酶具有下列何种性质A.催化功能相同B.理化性质相同C.免疫学性质相同D.酶蛋白分子量相同E.酶蛋白分子结构相同00093A0009404030200 01 10 60 35 01 01 01 激活胰蛋白酶原的物质是A.胃酸B.胆汁酸C.肠激酶D.端粒酶E.胃蛋白酶00094C0009504030200 01 10 70 30 01 01 02胰液中的蛋白水解酶最初以酶原形式存在的意义是A.保持其稳定性B.保护自身组织C.促进蛋白的分泌D.抑制蛋白酶的分泌E.保证蛋白质在一定时间内发挥消化作用00095B0009604040602 01 10 70 30 01 01 01下列关于竞争性抑制剂的论述哪项是正确的A.抑制剂与酶活性中心结合B.抑制剂与酶以共价键结合C.抑制剂结构与底物不相似D.抑制剂与酶的结合是不可逆的E.抑制程度只与抑制剂浓度有关00096A0009704040602 01 10 60 40 01 01 03磺胺类药物是下列哪个酶的抑制剂A.二氢叶酸合成酶B.二氢叶酸还原酶C.四氢叶酸合成酶D.四氢叶酸还原酶E.一碳单位转移酶00097A0009804040101 01 10 60 40 01 01 01反应速度为最大反应速度的80%时,Km值等于A.1/2[s]B.1/4[s]C.1/5[s]D.1/6[s]E.1/8[s]00098B0009904040300 01 10 65 35 01 01 03乳酸脱氢酶加热后活性大大降低的原因是A.亚基解聚B.酶蛋白变性C.酶活性受抑制D.辅酶失去活性E.酶蛋白与辅酶分离00099B0010004040601 01 10 60 40 01 01 02重金属盐对巯基酶的抑制作用是A.可逆性抑制B.竞争性抑制C.非竞争性抑制D.不可逆抑制E.竞争性抑制00100D0010104040601 01 10 65 35 01 01 02化学毒气路易士气中毒时,下列哪种酶受抑制A.碳酸苷酶B.胆碱脂酶C.含巯基酶D.丙酮酸脱氢酶E.琥珀酸脱氢酶00101C0010204020200 01 10 90 10 01 01 03唾液淀粉酶对淀粉起催化作用,对蔗糖不起作用这一现象说明了酶有A.不稳定性B.可调节性C.高度的特异性D.高度的敏感性E.高度的催化效率00102C0010304010000 01 10 70 30 01 01 01关于酶概念的叙述下列哪项是正确的A.其底物都是有机化合物B.所有蛋白质都有酶的活性C.其催化活性都需特异的辅助因子D.体内所有具有催化活性的物质都是酶E.酶是由活细胞合成的具有催化作用的生物大分子00103E0010404020000 01 10 60 40 01 02 01关于酶性质的叙述下列哪项是正确的A.酶能改变反应的平衡点B.酶能提高反应所需的活化能C.酶加快化学反应达到平衡的速度D.酶的催化效率高是因为分子中含有辅酶或辅基E.酶使化学反应的平衡常数向加速反应的方向进行00104C0010504030100 01 10 60 40 01 01 01关于酶活性中心的叙述下列哪项是正确的A.所有的酶都有活性中心B.所有酶的活性中心都含有辅酶C.所有酶的活性中心都有金属离子D.所有的必需基团都位于酶的活性中心E.所有的抑制剂都作用于酶的活性中心00105A0010604020000 01 10 60 40 01 02 01酶加速化学反应的根本原因是A.升高反应温度B.增加底物浓度C.降低产物的自由能D.增加反应物碰撞频率E.降低催化反应的活化能00106E0010704010102 01 10 60 40 01 01 01关于辅酶的叙述正确的是A.与酶蛋白紧密结合B.金属离子是体内最重要的辅酶C.在催化反应中不与酶活性中心结合D.体内辅酶种类很多,其数量与酶相当E.在催化反应中传递电子、原子或化学基团00107E0010804010102 01 10 80 20 01 01 01单纯酶是指A.结构简单的酶B.酶的无活性前体C.酶与抑制剂复合物D.酶与辅助因子复合物E.仅由氨基酸残基构成的单纯蛋白质00108E0010904010102 01 10 70 30 01 01 01关于结合酶的论述正确的是A.酶蛋白具有催化活性B.酶蛋白与辅酶共价结合C.酶蛋白决定酶的专一性D.辅酶与酶蛋白结合紧密E.辅酶不能稳定酶分子构象00109C0011004040102 01 10 80 20 01 01 01Km值是指A.反应速度等于最大速度时的温度B.反应速度等于最大速度时酶的浓度C.反应速度等于最大速度时的底物浓度D.反应速度等于最大速度50%的底物浓度E.反应速度等于最大速度50%的酶的浓度00110D0011104040102 01 10 70 30 01 01 01关于Km的意义正确的是A.Km为酶的比活性B.Km值与酶的浓度有关C.Km的单位是mmol/minD.Km值是酶的特征性常数之一E.Km越大,酶与底物亲和力越大00111D0011204040102 01 10 60 40 01 01 03关于Km的叙述,下列哪项是正确的A.与环境的pH无关B.是酶和底物的反应平衡常数C.是反映酶催化能力的一个指标D.是引起最大反应速度的底物浓度E.通过Km的测定可鉴定酶的最适底物00112E0011304040100 01 10 70 30 01 01 01当[E]不变,[S]很低时,酶促反应速度与[S]A.无关B.成正比C.成反比D.成反应E.不成正比00113B0011404040101 01 10 60 40 01 01 01当酶促反应速度等于Vmax的80%时,Km与[S]关系是A.Km=0.1[S]B.Km=0.22[S]C.Km=0.25[S]D.Km=0.40[S]E.Km=0.50[S]00114C0011504040300 01 10 90 10 01 01 01关于酶的最适温度下列哪项是正确的A.与反应时间无关B.是酶的特征性常数C.是酶促反应速度最快时的温度D.是一个固定值与其它因素无关E.是指反应速度等于50%Vmax时的温度00115C0011604040100 01 10 70 30 01 01 01当底物浓度达到饱和后,如再增加底物浓度A.形成酶一底物复合物增多B.反应速度随底物的增加而加快C.增加抑制剂反应速度反而加快D.随着底物浓度的增加酶失去活性E.酶的活性中心全部被占据,反应速度不再增加00116E0011704030300 01 10 60 40 01 01 01关于乳酸脱氢酶同工酶的叙述正确的是A.5种同工酶的理化性质相同B.5种同工酶的电泳迁移率相同C.由H亚基和M亚基以不同比例组成D.H亚基和M亚基单独存在时均有活性E.H亚基和M亚基的一级结构相同,但空间结构不同00117C0011804040602 01 10 50 50 01 01 02关于非竞争性抑制的叙述,正确的是A.不影响VmaxB.抑制剂与酶的活性中心结合C.抑制剂与酶结合后不能与底物结合D.抑制剂与酶结合后不影响与底物结合E.抑制作用可通过增加底物浓度减弱或消除00118D0011904030300 01 10 90 10 01 01 01同工酶是指A.催化的化学反应相同B.酶的结构相同而存在部位不同C.催化不同的反应而理化性质相同D.催化相同的化学反应理化性质也相同E.由同一基因编码翻译后的加工修饰不同00119A0012004030300 01 10 90 10 01 01 01含LDH1丰富的组织是A.心肌B.骨骼肌C.脑组织D.肾组织E.肝组织00120A0012104010000 08 30 90 10 01 01 02酶00121酶是由活细胞合成的;对特异的底物起高效催化作用的;生物大分子;0012204030100 08 30 50 50 01 01 02酶的活性中心00122能与底物特异结合并将底物转化为产物的这一区域称为酶的活性中心;0012304030200 08 30 70 30 01 01 02酶原00123这种无活性的酶的前体称酶原;0012404030300 08 30 70 30 01 01 01同工酶00124同工酶是指催化相同的化学反应;但酶蛋白的分子结构、理化性质乃至免疫学特性不同的一组酶;0012504020200 08 30 70 30 01 01 01酶的特异性00125酶对其催化的底物有严格的选择性;0012604030300 09 80 50 50 01 01 01什么是同工酶?其检测有何临床意义?00126(1)同工酶是指催化相同的化学反应,但酶蛋白的分子结构、理化性质及免疫学性质不同的组酶;(2)当某一特定器官发生病变时,其细胞内的酶释放人血,测定血中其同工酶谱及活性增多的情况,可反映组织器官病变的严重程度。
第四章 酶法分析.

第二节 酶法分析
在进行酶法分析时,先要根据分析 对象选择适它的“工具酶”,然后再通 过酶反应的测定,并借助相应的校正曲 线来检知它们的浓度或含量。在上述几 种检测对象中,除了底物可以采用总变 量分析法(终点法)外,其它都只能用 动力学分析法。
Hale Waihona Puke 件:和酶活力测定的基本相同,但其所用 的酶量必须一定,除了相应的被测因素 的浓度应控制在限速水平以外,其它反 应成份均须保证处于恒定和最适。
底物? pH? 温度? 样品?
二、测定中应注意的问题 1.初速度
底物浓度对酶速的影响
浓度选择: a) [s]>=100Km; b) 有时不宜采用高底物浓度(有 毒性、价高、溶解度小、抑制 酶反应等)则根据具体条件,通 过实验选一适当浓度。
作用于待测酶产物的其它酶;
(如腈水合酶与酰胺酶) 其它因素。
A
E1
B
E2
C
被测反应的产物是某脱氢酶的底物,即B 是脱氢酶E2的底物,测定系统中加入足量的 脱氢酶E2和NADH,使反应进行到C,然后通过 NADH的特征变化而测知。
HK 被测反应:
G + ATP
G6PDH
G-6-P + ADP NADPH + 6-PGCOOH
偶联指示反 应: G-6-P
+ NADP
酶分析法:
酶活力测定(酶研究的一部分) 酶法分析(酶作为分析的工具)
前者的目的在于检知样品中某种酶的 含量或活性,后者则主要用于测定与生 物学有关的样品中酶以外其它物质的含 量。两者检测对象不同,但原理基本一 致:酶的专一性、高效性,通过酶反应 速度测定物质的变化进行定量分析。
酶分析
(Enzyme Assay)
生物化学第四章酶

生物化学
授课教师:叶素梅 副教授
第四章 酶
问题1:
你每天吃的东西在体内是怎么消化的?
酶类药物
酶的发现
第一节 酶的概念及作用特点
一、酶(E)及相关概念 • 定义:由活体细胞分泌的, 在体内外具有催化功能的蛋白质 • 酶促反应:酶所催化的化学反应
• 底物:酶所催化的物质
S
• 产物:酶促反应的生成物
心肌炎:LDH1 ↑ 肺梗塞:LDH3 ↑ 肝炎:LDH5 ↑
生理及临床意义
在代谢调节上起着重要的作用; 用于解释发育过程中各阶段特有的代谢特征; 同工酶谱的改变有助于对疾病的诊断; 同工酶可以作为遗传标志,用于遗传分析研究。
第四节 酶促反应动力学
➢ 概念
研究各种因素对酶促反应速度的影响,并加以定量 的阐述。
磷酸基的受体)
第三节 酶的结构与催化活性 一、酶的分子组成
1.单纯酶
仅由氨基酸构成
2.结合酶
还含有非蛋白质部分
酶蛋白 + 辅助因子
(无催化活性) (无催化活性)
全酶
(有催化活性)
各部分在催化反应中的作用
酶蛋白决定反应的特异性
辅助因子决定反应的种类与性质
组成
无机金属离子
常见: K+、Na+、Mg2+、
相对专一性
作用于一类化合物或一种化学键
脂肪酶 催化脂肪水解 酯类水解
立体异构专一性
一种酶仅作用于立体异构体中的一种
L-乳酸
D-乳酸
乳酸脱氢酶(LDH)
(3)高度不稳定性 • 易受变性因素影响而失活
(4)酶活性的可调性 • 自身不断进行新陈代谢,通过改变酶合成和降解的速度调
第四章 酶工程

化学酶工程
也称初级酶工程,指自然酶、化学修饰酶、固定 化酶以及人工合成酶的研究和应用。 (1)自然酶:由生物材料中分离出来的酶制成的 酶制剂。价格低,生产方式简单;应用方便,不需辅 因子参加;产品种类少,应用范围窄。 (2)化学修饰酶:通过酶分子的化学修饰达到改 性变构的目的。主要用于酶学研究和疾病治疗。
化学结合法
(1)共价结合法:将载体有关基团活化、与酶分 子上的功能团发生化学反应形成共价键的一种固定化 方法;与载体结合的酶功能团有α或ε-NH2,α、β 或γ-羧基,巯基,咪唑基,酚基等,但参与共价结 合的氨基酸残基应当是酶催化活性的非必需基团,否 则可能会导致固定后酶活力完全丧失;
( 2 )共价交联法 :通过双功能或多功能试剂 (交联剂),在酶分子之间或酶分子与微生物细胞 之间形成共价键的连接方法; 常用的交联剂有戊二 醛、异氰酸酯、顺丁烯二酸酐和乙烯共聚物等;
等电点沉淀法
利用蛋白质在等电点时溶解度最低,以及不同 的蛋白质具有不同的等电点这一特性,对酶进行分 离纯化的方法。经常与盐析沉淀、有机溶剂沉淀等 方法一起使用,使其沉淀完全。
有机溶剂沉淀法
利用酶在有机溶剂中溶解度不同而使其分离。 常用有机溶剂:乙醇、丙酮、异丙酮等。
(二)根据酶分子大小和形状不同的方法
酶反应器是完成酶促反应的装臵,研究内容包括 酶反应器的类型、特性;酶反应器的设计、制造及选 择等。
二、酶的生产与分离纯化技术
生化第4章_酶

体内的物质代谢。
维生素分为脂溶性和水溶性两大类。脂溶性维生素在体内 可直接参与代谢的调节作用,而水溶性维生素是通过转变 成辅基对代谢起调节作用。
大多数辅酶的前体是水溶性 B 族维生素。辅酶I、辅酶II
9
3. 酶结构与功能特点
蛋白质的结构特点: 一级、二级、三级、四级结构
根据结构不同酶可分为:
37
3.酶与底物结合形成中间络合物的方式(理论)
(1) 锁钥假说 (lock and key hypothesis):
•
认为整个酶分子的天然构象具
有刚性结构,酶表面具有特定 的形状。酶与底物的结合如同
一把钥匙对一把锁一样。
(2) 诱导契合假说(induced–fit hypothesis):
•
认为酶表面并没有一种与底物
H2N C OH
CH2 NH2 OH
亲核性基团
酸碱性基团
16
酶催化反应举例
溶菌酶(lysozyme)降解细菌细胞壁多糖
溶菌酶是一种葡萄糖苷酶,水解NAG形成的β(1, 4)糖苷键
溶菌酶内部几乎都是非极性的,在分子表面有一较深的裂缝
其大小恰好容纳底物的 6 个单糖,是酶的活性部位.
酶的水解作用
31
(7) 核酸酶(催化核酸) (Ribozymes)
核酸酶是唯一的非蛋白酶, 是一类特殊 RNA,能催化 RNA 分子中的磷酸酯键的水解及其逆反应。
B
3'
B
3'
B
3'
B
3'
B
3'
P
5'
P
5'
P
生物化学:第四章 酶(6周1-2节)
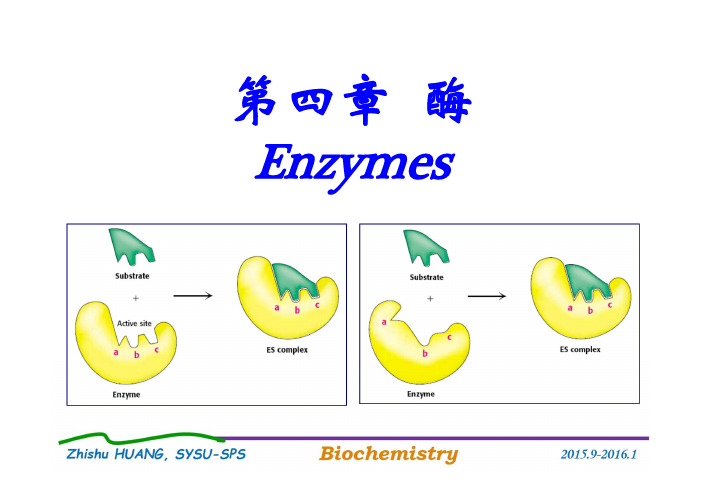
第四章酶Enzymes本章主要内容(9学时)一.酶的概念(重点)二.维生素与辅酶(重点)三.酶促反应动力学(重点)四.酶的结构和催化作用机制(重点)五.酶的调控(重点)六.人工酶与酶工程(自学为主)一、酶的概念⏹生物机体的一切生理活动,都是由无数复杂的化学变化(反应)来实现的。
⏹生物体内进行的所有这些化学变化都在酶的催化下进行的。
⏹Much of the history of biochemistry is the history of enzyme research.一、酶的概念⏹In the late 1700s, biological catalysis was first recognized.⏹1897年,E. Büchner,首次从酵母细胞中提取出酶,实现无细胞生醇发酵。
一、酶的概念⏹1926年,James Sumner,结晶出第一个蛋白酶---脲酶。
⏹pepsin, trypsin, andother digestive enzymesAll enzymes are proteins.一、酶的概念⏹J. B. S. Haldane⏹A paper entitled “Enzymes”.weak bonding interactions between an enzyme and its substrate might be used to catalyze a reaction.一、酶的概念⏹1989年,推翻“酶都是蛋白质”这一传统概念。
⏹In 1982,Thomas Cech,RNA spliced itselfaccurately without anyprotein enzymes fromTetrahymena(四膜虫).Most Enzymes Are Proteins.一、酶的概念酶是生物催化剂⏹生物催化剂(Biocatalysts):活细胞产生的一类具有催化功能的生物分子。
生物化学第四章酶

⽣物化学第四章酶第四章酶酶是⼀类具有⾼效率、⾼度专⼀性、活性可调节的⾼分⼦⽣物催化剂。
1957巴斯德提出酒精发酵是酵母细胞活动的结果。
1 分⼦Glc→2分⼦⼄醇+2分⼦CO2 从Glc开始,经过12种酶催化,12步反应,⽣成⼄醇。
1897 Buchner兄弟证明发酵与细胞的活动⽆关,不含细胞的酵母汁也能进⾏⼄醇发酵。
1913 Michaelis和Menten提出⽶⽒学说—酶促动⼒学原理。
1926 Sumner⾸次从⼑⾖中提出脲酶结晶,并证明具有蛋⽩质性质。
1969 化学合成核糖核酸酶。
1967-1970 从E.coli中发现第I、第II类限制性核酸内切酶。
1986 Cech发现四膜⾍细胞⼤核期间26S rRNA前体具有⾃我剪接功能。
ribozyme ,deoxyribozymeE.coRI5’——GAA TTC——3’3’——CTTAAG——5’限制作⽤修饰作⽤5’——GAATTC——3’5’——GAATTC——3’3’——CTTAAG——5’ 3’——CTTAAG——5’第⼀节酶学概论⼀、酶的⽣物学意义⼤肠杆菌⽣命周期20分钟,⽣物体内化学反应变得容易和迅速进⾏的根本原因是体内普通存在⽣物催化剂—酶。
没有酶,⽣长、发育、运动等等⽣命活动就⽆法继续。
限制性核酸内切酶(限制-修饰)⼆、酶的概念及其作⽤特点1、酶是⼀种⽣物催化剂酶是⼀类具有⾼效率、⾼度专⼀性、活性可调节的⾼分⼦⽣物催化剂。
⽣物催化剂:酶(enzyme),核(糖)酶(ribozyme),脱氧核(糖)酶(deoxyribozyme)2、酶催化反应的特点(1)、催化效率⾼酶催化反应速度是相应的⽆催化反应的108-1020倍,并且⾄少⾼出⾮酶催化反应速度⼏个数量级。
(2)、专⼀性⾼酶对反应的底物和产物都有极⾼的专⼀性,⼏乎没有副反应发⽣。
(3)、反应条件温和(4)、活性可调节根据据⽣物体的需要,许多酶的活性可受多种调节机制的灵活调节,包括:别构调节、酶的共价修饰、酶的合成、活化与降解等。
第四章酶的归纳总结

“第四章酶”归纳总结第一节酶的分子结构和催化功能酶是一类由活细胞产生的,对其特异底物(反应物)具有高效催化作用的蛋白质,是生物催化剂中的一种类型。
生物催化剂酶\核酶:具有催化作用的核糖核酸,主要以核酸为底物。
根据酶的组成特点辅酶、辅基——B族维生素的活性形式二、酶的活性中心必需基团:酶分子中氨基酸残基侧链具有不同的化学基团,其中一些与酶活性密切相关的化学基团。
酶的活性中心:一些必需基团在酶蛋白的一级结构上可能相距很远,但在空间结构上彼此靠近,组成具有特定空间结构的区域,能与底物特异的结合并将底物转为产物。
必需基团活性中心外的必需基团活性中心内的必需基团 结合基团:能与底物或辅酶结合形成酶复合物催化基因:参与催化化学反应完成的化学基因三、酶催化作用机制酶促反应的机制酶促反应的化学机制第二节 酶促反应的特性诱导契合学说:酶与底物相互接近时,其结构相互诱导、相互变形和相互适应, 进而相互结合而有利于反应的进行。
中间复合物学说:目前一般认为,酶催化某一反应时,首先在酶的活性中心 与底物结合生成酶-底物复合物,此复合物再进行分解而释放出酶,同时生成一种或数种产物。
邻近\定向效应 多元催化 表面效应:酶促反应在酶的疏水活性中心进行,防止水化膜的形成酶促反应的特性1、具有化学催化剂的特点4、特异性5、调节性2、酶促反应的条件温和:一般最佳反应条件;常温、37°C、pH近中性3、高效性——显著降低活化能C、对于可逆反应,只加快进程而不改变化学平衡常数B、只催化热力学允许的化学反应A、参与反应而无质量变化a、绝对特异性:酶只能作用于特定结构的底物分子,进行一种专一的反应,生成一种特定结构的产物c、立体异构特异性:当底物具有立体异构体时,仅用于底物的一种立体异构体b、相对特异性:酶作用于一类化合物或一种化学键d、酶含量的调节e、同工酶:c、共价修饰调节b、酶的别构调节:对酶催化活性a、酶原与酶原激活:生理意义机体的自我保护酶原被视为酶的贮存方式一种调节方式,即当一种同工酶受抑制或破坏时,其他同工酶仍起作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
◆例如:麦芽糖酶只作用于麦芽糖,脲酶只催化尿 素水解。
NH 2 CO
H2O
脲酶
NH 2
CO2 + 2NH3
NH 2 CO
H2O
X
脲酶
NHCH 3
相对专一性 有的酶对底物的化学结构要求比上述绝 对专一性略低一些,它们能作用于一类化合物或一种 化学键。
1)键专一性 有的酶只作用于一定的键,而对 键 两端的基团并无严格要求。
A —B
O
酯酶
R1C
+ H2O
OR 2
R1COOH + R2OH
2)基团专一性 另一些酶,除要求作用于一定的键 以外,对键两端的基团还有一定要求,往往是对其中 一个基团要求严格,对另一个基团则要求不严格。
A—B 或 A— B
如α-D-葡萄糖苷酶
CH2OH O
OH OH
OH
OR
立体异构专一性
1)旋光异构专一性 底物具有旋光异构体(D型、L型)时,酶只能作用 于其中的一种
◆全酶需要辅因子参与才能发挥活性。
四、酶的组成
据酶分子 组成分类
单纯蛋白质酶类:组成上仅有氨基酸作为构成成分
酶蛋白
结合蛋白质酶类 (全酶)
辅助因子
金属离子 小分子有机物
全酶 = 酶蛋白+辅助因子
酶的辅因子
◆ 辅因子按与酶蛋白结合的牢固程度分两种 辅酶:结合疏松,用透析等方法易除去 辅基:结合紧密,不易除去
酶的化学本质是蛋白质
5.80年代初发现了具有催化功能的RNA——核酶(ribozyme)
1983年美国S.Altman等研究RNaseP(由20%蛋白质和80%的 RNA组成),发现RNaseP中的RNA可催化E. coli tRNA前体加工。 同时,切克(Thomas Cech)等人也发现四膜虫(Tetrahynena) 细胞的26 S rRNA前体具有自我剪接功能,并命名这一类酶为 ribozyme(核酶)。2人共同获1989年诺贝尔化学奖。
第四章 酶化学
enzyme
第一节 的比较 酶的组成 酶的命名与分类
一、酶的研究历史和概念
※人们对酶的认识起源于生产与生活实践。 ※夏禹时代,人们掌握了酿酒技术。 ※春秋战国时期已知用麴(曲)治疗消化不良的疾病。 ※酶者,酒母也
1. 不自觉的应用:酿酒、造酱、制饴、治病 2. 对酶的初步认识: 消化与发酵现象
诱导契合学说
3. 酶易失活,要求温和条件
◆ 酶是蛋白质,凡能一起蛋白质变性的因素均能引 起酶的失活 ◆通常是常温、常压和中性pH。
4. 酶的活性可受到调节、控制;
◆酶促反应受多种因素的调控,以适应机体对不断 变化的内外环境和生命活动的需要。
环境调节,酶结构、浓度、激素调节、反馈调节等。
5. 酶催化常需辅助因子。
1. 催化效率极高
以摩尔为单位进行比较,酶的催化效率比化学 催化剂高107~1013倍,比非催化反应高108~1020倍。
例 2H2O2→2H2O+O2
反应 非催化反应 钯催化反应 H2O2酶催化
活化能 75.24kJ/mol 48.9kJ/mol 8.36kJ/mol
2. 酶具有高度专一性
绝对专一性 有的酶对底物的化学结构要求非常严格, 只作用于一种底物,不作用于其它任何物质。
※ 19世纪30年代,德国科学家施旺获得胃蛋白酶。 ※ 1833年,法国化学家Payen和Person用酒精处理麦 芽抽提液,得到淀粉酶(diastase)。 ※ 1878年,德国科学家Kűhne提出enzyme—从活生物 体中分离得到的酶,意思是“在酵母中”(希腊文)。
3. 19世纪,对于发酵过程的本质开展了长期的学术争论, 并导致了随后一系列对于酶的分离及化学本质的研究
4. 酶是活细胞产生的,能在细胞内外起催化作用的生理活 性物质。那么酶的化学本质究竟是什么?
※ 1926年,美国康乃尔大学的Sumner博士从刀豆中提取出 脲酶结晶,并证明具有蛋白质的性质。 ※ 1930年,美国的生物化学家Northrop分离得到了胃蛋白 酶(pepsin)、胰蛋白酶(trypsin)、胰凝乳蛋白酶 (chymotrypsin)结晶,确立了酶的化学本质。 ※ 随着X光晶体衍射,多维核磁共振(NMR )技术的发展, 很多酶的空间结构被揭示。
这一发现打破了生物催化剂是蛋白质的传统观念,拓宽了 人们的思路。
酶是生物催化剂,但并不是 所有的生物催化剂都是酶
二、酶的定义
酶是由活细胞产生的,在细胞内、外均有催 化作用的特殊蛋白质或其他物质。
酶参与的反应称为酶促反应,被其作用发生 化学变化的物质称为底物。
化学本质:蛋白质
酶是蛋白质的证据:
1 酶的化学组成,含氮16%。 2 在水溶液中发生两性解离,有等电点。 3 水解产物为氨基酸。 4 凡使蛋白质变性的因素作用于酶也使之变性。
2)顺反异构专一性(几何异构专一性)
酶作用专一性机理
1.1894年 Fischer 提出锁钥学说( Lock and key theory ):将酶的活性中心比喻作锁孔,底物分子象 钥匙,底物能专一性地插入到酶的活性中心。
刚性学说
2.诱导契合学说 (Induced-fit theory)
酶的活性中心在结构上具柔性,底物接近活 性中心时,可诱导酶蛋白构象发生变化,这样就 使使酶活性中心有关基团正确排列和定向,使之 与底物成互补形状有机的结合而催化反应进行。 1959年由Koshland提出。
三、酶与一般催化剂的比较
(一)酶与一般催化剂的共性
(1)用量少而催化效率高 (2)能加快化学反应的速度,但不改变平衡点。 (3)反应前后本身不发生变化 (4)降低反应所需的活化能
(二)酶作为生物催化剂的特性
※ 催化效率极高 ※ 高度专一 ※ 酶易失活,要求温和条件; ※ 酶的活性可受到调节、控制; ※ 酶催化常需辅助因子。
※当时法国化学家和微生物学家Pasteur认为没有生物则没 有发酵。 ※ 德国化学家Liebig认为发酵是由化学物质引起的。 ※ 此争议由德国学者Buchner兄弟于1896年解决。 ※ Buchner兄弟的试验:用细砂研磨酵母细胞,压取汁液, 汁液不含活细胞,但仍能使糖发酵生成酒精和二氧化碳。 证明:发酵与细胞的活动无关。
