湘教版九年级化学下册《酸性溶液和碱性溶液》PPT课件(3篇)
【湘教版】九年级化学下册(全书)教学课件汇总(297张)

化 氮肥
学 磷肥
肥
钾肥 复合肥料
料 微量元素肥料
未施肥时
施肥后
氮元素可使植物细胞加 速分裂和生长,促使植物枝叶 茂盛。
磷元素使植物提早开花结 果,增强抵抗力。
钾元素有利光和作用,促 进作物生长健壮。这三种元素 都是植物生长不可缺少的成分。
一、氮肥 思考:什么是氮肥?
常见氮肥 的俗称及氮元素的质量分数
现象:红色逐 渐褪去
滴有酚酞试液的NaOH溶液
结论:酸可与碱反 应生成盐和水
化学方程式:
HCl+NaOH=NaCl+H2O
往稀硫酸溶液中滴入氯化钡溶液
现象: 有白色 沉淀 生成
BaCl2溶液
稀硫酸
结论:酸可与盐发生复分 解反应, 生成盐和水。 反应方程式:
H2SO4+BaCl2=BaSO4↓+H2O
1、月季花适宜在酸性土壤中生长。某同
学给月季花施肥前,对下列氮肥溶液 的PH值进行了测定,结果如下表:
化肥名称 尿素 碳酸氢 硫酸 氨
铵
铵水
溶液的PH 7
8
8 11
该同学最好选用(
)
A、尿素
B、碳酸氢铵
C、硫酸铵 D、氨水
2、下表为家庭中一些常见物质的PH值
物 食 牙 食盐 肥皂 火碱液 质醋膏水 水
完成课本P7上 的实践应用
酸性质的实验 探究
向稀盐酸中滴入1—2滴紫色石蕊 试液
石蕊
现象:紫色石蕊 试液变红
结论:酸能使紫色 稀盐酸 石蕊试液变 红
向锌粒中逐滴加稀硫酸
稀硫酸
现象:锌 粒逐渐减 少,并产 生大量气 泡.
结论:酸能与活泼金属 反应生成盐和氢气
《溶液的酸碱性》PPT教学课件

治理措施:投入适量酸进行中和(合理即可)。
4.某学校化学课外活动小组的同学开展了下列实验活 动:取刚降到地面的雨水水样, 用pH计(测pH的仪 器)每隔几分钟测一次pH,其数据如下表所示:
测定时刻 5 : 5 : 5 : 5 : 5 : 5 : 5 : 05 10 15 20 25 30 35
硫酸厂产生的SO2和煤燃烧产生的SO2排放到 空中,溶于水降落到地面形成酸雨;利用水能、 核能和太阳能等清洁能源(或将工厂产生的废气 处理达标后排放)。
碱性,向肥皂水中滴加酚酞,溶液呈红色,C 正确;
厕所清洁剂pH 小于7,呈酸性,炉具清洁剂pH 大
于7,呈碱性,将厕所清洁剂与炉具清洁剂混合使
用,会发生反应,洗涤效果降低,D 错误。
感悟新知
1.【中考•宜昌】用pH计测得一些物质的pH如下: 知3-练
物质 苹果汁 西瓜汁 牛奶 鸡蛋清 炉具清洁剂
pH 2.9
感悟新知
知2-练
1.【中考•北京】一些物质的pH范围如下,其中呈
碱性的是( A )
A.油污净(12~13)
B.西瓜汁(5~6)
C.洁厕灵(1~2)
D.橘子汁(3~4)
感悟新知
知2-练
2.【中考•雅安】人体内的一些液体正常pH范围如
下,其中呈酸性的是( C )
A. 血浆7.35~7.45
B. 胆汁7.1~7.3
下列物质中可用于改良土壤结构,降低水稻 对镉吸收率的是( C ) A.氯化钾 B.烧碱 C.熟石灰 D.硫酸亚铁(水溶液显酸性)
知3-练
课堂小结
指示剂
紫色石蕊试液:遇酸变红,遇碱变蓝 无色酚酞试液:遇酸不变色,遇碱变红
湘教版化学九年《酸性溶液和碱性溶液》PPT共22页

61、奢侈是舒适的,否则就不是奢侈 。——CocoCha nel 62、少而好学,如日出之阳;壮而好学 ,如日 中之光 ;志而 好学, 如炳烛 之光。 ——刘 向 63、三军可夺帅也,匹夫不可夺志也。 ——孔 丘 64ቤተ መጻሕፍቲ ባይዱ人生就是学校。在那里,与其说好 的教师 是幸福 ,不如 说好的 教师是 不幸。 ——海 贝尔 65、接受挑战,就可以享受胜利的喜悦 。——杰纳勒 尔·乔治·S·巴顿
谢谢!
湘教版化学九年《酸性溶液和碱性溶 液》
16、人民应该为法律而战斗,就像为 了城墙 而战斗 一样。 ——赫 拉克利 特 17、人类对于不公正的行为加以指责 ,并非 因为他 们愿意 做出这 种行为 ,而是 惟恐自 己会成 为这种 行为的 牺牲者 。—— 柏拉图 18、制定法律法令,就是为了不让强 者做什 么事都 横行霸 道。— —奥维 德 19、法律是社会的习惯和思想的结晶 。—— 托·伍·威尔逊 20、人们嘴上挂着的法律,其真实含 义是财 富。— —爱献 生
初中化学九年级下册精品教学课件 第10单元酸和碱 课题2 第2课时 溶液酸碱度的表示方法——pH

B × 二氧化碳气体本身不具有酸性,不能使 pH 试纸变色
C × 浓硫酸具有脱水性,会使 pH 试纸因脱水而变黑
D
√
将氢氧化钠溶液滴到干燥的 pH 试纸上,与标准比色卡对照即 可测定其 pH
答案:D
一二
二、中和反应中溶液pH的变化及溶质判断(以氢氧化钠溶液与 盐酸反应为例)
图1 1.用酸滴碱的pH变化(如图1所示)。 从曲线图中可获得如下信息: (1)在加入盐酸前,溶液的pH>7,随着盐酸的滴入,溶液的pH逐渐减 小,在C点之前溶液的溶质为NaOH、NaCl; (2)C点处恰好完全中和,溶液的pH=7,此时溶液的溶质为NaCl; (3)继续滴加盐酸至过量,溶液的pH<7,此时溶液的溶质为HCl、 NaCl。
(填
“酸”“碱”或“中”)性,pH (填“>”“<”或“=”)7。
(3)粗略测定雨水的酸碱度可使用
。
(1)能 (2)碱 > (3)pH试纸
关闭
答案
一二
【例题2】某校化学兴趣小组利用数字化传感器探究稀盐酸与 氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积 变化的曲线如图所示,下列说法正确的是( )
A.图中A点所示溶液中,含有的溶质是NaCl和NaOH B.由A点到B点的pH变化过程证明酸与碱发生了中和反应 C.向图中C点所示溶液中滴加无色酚酞溶液,溶液不变色 D.该实验是将盐酸逐滴滴入盛有氢氧化钠溶液的烧杯中
答案:B
1234
1.人体内一些液体的正常pH范围如下,其中呈酸性的是( )
A.血浆7.35~7.45 B.胃液0.9~1.5
C.胆汁7.1~7.3
D.胰液7.5~8.0
关闭
B
答案
九年级化学下册专题七初识酸碱和盐单元1酸性溶液和碱性溶液课件2新版湘教版ppt版本

新知学习 课堂小结 知能知训能练训练
上一页 下一页
Thyoaunk
End
结束
再见
2019/11/10
2.碱性物质能使它变色吗?
新知新学知习学习 课堂小结
知能训练
上一页 下一页
实验活动:检验溶液酸碱性 内容: 在两个白色点滴板的空穴里 分别滴入几滴白醋、酸果汁、 稀盐酸、纯碱溶液、肥皂水、石灰水、氨水、 食盐水、蔗糖水,一个点滴板里各滴加1~2滴 紫色石蕊试液,另一个点滴板里各滴加1~2滴 酚酞试液,观察颜色的变化。
柠
苹
檬
果
酸
酸
碳
乳
醋
酸
酸
酸
新知新学知习学习 课堂小结 知能训练
上一页 下一页
想一想生活中你接触到的碱性物质有哪些?
苏打水
碱性电池
洗涤剂
肥皂水
新知新学知习学习 课堂小结 知能训练
上一页 下一页
英国科学家波义耳偶然发现盐酸能使紫罗兰花由紫变红。
由此,他提出这样的问题:
1.其它酸性物质也能使紫罗兰花变红吗?
新知新学知习学习 课堂小结
知能训练
上一页 下一页
通过上述实验得出如下结论: 酸性溶液可以使石蕊试液变红,不能使酚酞溶液变色; 碱性溶液可以使石蕊试液变蓝,使酚酞溶液变红。
石蕊 试液
遇酸溶液变红 遇碱溶液变蓝
酚酞 遇酸溶液不变色 试液 遇碱溶液变红色
新知新学知习学习 课堂小结 知能训练
上一页 下一页
下图是几种生活中常见的物质,试着说一说它们的酸 碱性。
新知新学知习学习 课堂小结 知能训练
பைடு நூலகம்
上一页 下一页
健康人的体液pH必须维持在一定范围内,如果超越 正常范围,会导致生理功能失调或发生疾病,甚至出
《溶液的酸碱性》常见的酸和碱PPT教学课件

白醋 柠檬汁 石灰水 肥皂水 食盐水 蔗糖水
红红
蓝
蓝
紫
紫
加入石蕊试
液的颜色 无 无
红
红
无
无
加入酚酞试 思液考的:颜色 酸性溶液
碱性溶液
根据实验结果,上述溶液可以分为几种类型?
中性溶液
广泛pH试纸和标准比色卡
【思考】 如何用pH试纸测定溶液的pH
在点滴板或玻璃片上放一小片试纸,用玻璃棒 将被测液滴到试纸上,把试纸显示的颜色与标 准比色卡比较,即可得出被测液的pH。
讨论:1.测定溶液pH时如果试纸用水湿润,pH会
如何变化?
如果溶液是酸性的,用水润湿pH试纸,测得 的pH会变大;
蒸馏水湿润,再把白醋滴到试纸上,则测得的结果
与白醋实际的pH比较( B )
A.偏低
B.偏高
C.相等
D.无法比较
7.将一定溶质质量分数的稀硫酸中加水稀释,下图中能 正确表示pH变化的是( C ) (横坐标表示加水的量,纵坐标表示pH)
7 A
7
7
B
C
7 D
8.下列说法正确的是( A ) A. pH越小,溶液的酸性越强 B. pH小于7的雨水是酸雨 C. 胃酸过多的病人在空腹时最好多喝一些柠檬汁 D. 用广泛pH试纸测得某地雨水的pH为5.2
拓展:石蕊试纸
1.取红色石蕊试纸滴加氢氧化钠溶液,观察并记录实验现象。 2.取蓝色石蕊试纸滴加稀盐酸,观察并记录实验现象。
红色的石蕊试纸
稀盐酸 不变色
变红色
氢氧化钠溶液 蓝色
不变色
湘教版九年级化学下学期酸性溶液和碱性溶液

九年级化学下学期酸性溶液和碱性溶液一、学习目标1.会用酸碱指示剂和pH试纸检验溶液的酸碱性。
2.知道溶液酸碱性的强弱程度与pH的关系。
3.知道酸碱性对生命活动和农作物生长的影响。
4.能设计和完成确定溶液酸碱性的简单化学实验。
5.进一步认识化学与人类生活以及工农业生产的关系。
二、重点:用酸碱指示剂和pH试纸检验溶液的酸碱性,难点:是溶液酸碱性的强弱程度与pH的关系。
二、课时1课时。
教学设计[提问]:试管中的紫色石蕊试液,在不借助任何化学药品的情况下,能否使之变成红色学生演示:向试管中吹气。
紫色石蕊试液变成红色。
[追问]:为什么会变色?学生回答:二氧化碳与水反应生成碳酸。
[提问]:除了碳酸,还有其他物质能使紫色石蕊试液变色吗?探究实验:分别在下表溶液中滴加紫色石蕊试液或酚酞。
石蕊和酚酞溶液叫酸碱指示剂,它们能跟酸或碱反应而显示不同颜色,pH是溶液酸碱性强弱的简单表示方法。
我们都知道,用石蕊、酚酞试液可以检验出溶液的酸碱性。
例如,要知道某溶液是酸性溶液还是碱性溶液,可用一支试管取少量待测液,滴入2滴~3滴紫色石蕊试液,若变红,为酸性溶液;变蓝,为碱性溶液;若仍然保持紫色则为中性溶液。
这种检验溶液酸碱性的方法,简便易行,现象明显,结果可靠,是实验室里常用的方法。
但是,石蕊、酚酞只能帮助我们了解溶液的酸碱性,却不能知道溶液酸碱性强弱的程度,要进一步知道溶液酸碱性强弱的程度,必须测定溶液的pH。
用pH试纸测定溶液的pH,方法是很简便的,但要注意操作正确:取一支洁净的玻璃棒蘸取少量待测液,滴在pH试纸上,在半分钟的时间内,将pH试纸变化的颜色与标准比色卡比较,便可知道溶液的pH。
为什么要强调“半分钟”这样短的时间?因为时间长了,pH试纸可能会与待测液发生其他化学反应,颜色就不真实了,测定的pH也就不准确了。
有的同学为了省事,不用玻璃棒蘸取待测液,而是把pH试纸直接浸入到待测液中,这种操作是错误的,会把待测液污染。
(新)湘教版化学九下《酸性溶液和碱性溶液》公开课(教案)word版 (4)
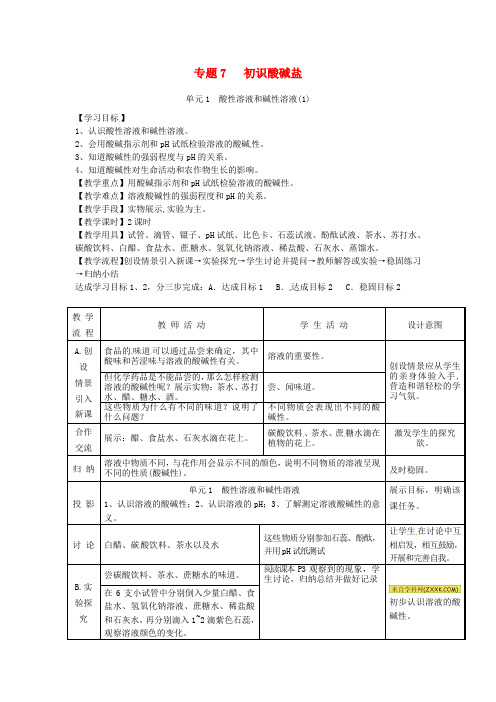
专题7 初识酸碱盐单元1 酸性溶液和碱性溶液(1)【学习目标】1、认识酸性溶液和碱性溶液。
2、会用酸碱指示剂和pH 试纸检验溶液的酸碱性。
3、知道酸碱性的强弱程度与pH的关系。
4、知道酸碱性对生命活动和农作物生长的影响。
【教学重点】用酸碱指示剂和pH试纸检验溶液的酸碱性。
【教学难点】溶液酸碱性的强弱程度和pH的关系。
【教学手段】实物展示,实验为主。
【教学课时】2课时【教学用具】试管、滴管、镊子、pH试纸、比色卡、石蕊试液、酚酞试液、茶水、苏打水、碳酸饮料、白醋、食盐水、蔗糖水、氢氧化钠溶液、稀盐酸、石灰水、蒸馏水。
【教学流程】创设情景引入新课→实验探究→学生讨论并提问→教师解答或实验→稳固练习→归纳小结达成学习目标1、2,分三步完成:A.达成目标1 B .达成目标2 C.稳固目标2教学流程教师活动学生活动设计意图A.创设情景引入新课食品的味道可以通过品尝来确定,其中酸味和苦涩味与溶液的酸碱性有关。
溶液的重要性。
创设情景应从学生的亲身体验入手,营造和谐轻松的学习气氛。
但化学药品是不能品尝的,那么怎样检测溶液的酸碱性呢?展示实物:茶水、苏打水、醋、糖水、酒。
尝、闻味道。
这些物质为什么有不同的味道?说明了什么问题?不同物质会表现出不同的酸碱性。
合作交流展示:醋、食盐水、石灰水滴在花上。
碳酸饮料、茶水、蔗糖水滴在植物的花上。
激发学生的探究欲。
归纳溶液中物质不同,与花作用会显示不同的颜色,说明不同物质的溶液呈现不同的性质(酸碱性)。
及时稳固。
投影单元1 酸性溶液和碱性溶液1、认识溶液的酸碱性;2、认识溶液的pH;3、了解测定溶液酸碱性的意义。
展示目标,明确该课任务。
讨论白醋、碳酸饮料、茶水以及水这些物质分别参加石蕊、酚酞,并用pH试纸测试让学生在讨论中互相启发,相互鼓励,开展和完善自我。
B.实验探究尝碳酸饮料、茶水、蔗糖水的味道。
阅读课本P3 观察到的现象,学生讨论,归纳总结并做好记录初步认识溶液的酸碱性。
最新湘教版九年级化学下册7单元1酸性溶液和碱性溶液优质教案(3)

专题7 初识酸碱盐单元1 酸性溶液和碱性溶液(2)【学习目标】1、认识酸性溶液和碱性溶液。
2、会用酸碱指示剂和pH试纸检验溶液地酸碱性。
3、知道酸碱性地强弱程度与pH地关系。
4、知道酸碱性对生命活动和农作物生长地影响。
【教学重点】用酸碱指示剂和pH试纸检验溶液地酸碱性。
【教学难点】溶液酸碱性地强弱程度和pH地关系。
【教学手段】实物展示,实验为主。
【教学课时】2课时【教学用具】试管、滴管、镊子、pH试纸、比色卡、石蕊试液、酚酞试液、茶水、苏打水、碳酸饮料、白醋、食盐水、蔗糖水、氢氧化钠溶液、稀盐酸、石灰水、蒸馏水。
【教学流程】实验探究→学生讨论并提问→教师解答或实验→巩固练习→归纳小结达成学习目标2~4,分三步完成:A.达成目标2、3 B.达成目标4 C.巩固目标3、4教学流程教师活动学生活动设计意图A.指导做实验并记录,完成表设置对比实实验探究实验:P2“请你尝试”格内容试管溶液pHA 白醋B 蒸馏水C 石灰水验,让学生在自主体验中经过细致地观察而充分体验探究过程:猜想与假设→设计实验→观察现象→得出结论归纳石蕊:遇酸性溶液变红,遇碱性溶液变蓝酚酞:遇酸性溶液不变,遇碱性溶液变红培养规范表达和分析问题地能力,树立实事求是,严谨中性溶液:pH=7,例:蒸馏水、食盐水等酸性溶液:pH<7,pH越小,酸性越强碱性溶液:pH>7,pH越大,碱性越强务实地科学态度B.教师引导测定雨水、土壤、人地体液地pH测定雨水地pH,可以分析空气地质量;测定土壤地pH,可以改良土壤;测定人地体液pH,可以分析健康状况通过归纳,自主学习,及时对知识点巩固而形成记忆C.学以致用1、pH=7,溶液呈性;pH<7,溶液呈性;pH>7,溶液呈性。
2、一些食物地近似pH为:食醋3.2~3.6,葡萄3.5~4.5,牛奶6.3~6.8,鸡蛋清7.6~8.0。
其中显碱性地是()A. 食醋B. 葡萄C.牛奶 D. 鸡蛋清3、向某溶液中滴入无色酚酞后颜色不变,向该溶液中滴入紫色石蕊试液,则()通过课堂练习反馈,让学生享受成功地喜悦,培养学生分析问题地能力;及时检查,便于纠正学生在练习中出现地问题A. 一定显红色B. 可能显红色,也可能仍为紫色C. 可能显蓝色D.一定显无色4、在测定某溶液地pH时,先用水把pH试纸润湿后,再滴该溶液测pH,则实际值与测定值比较()A. 变大B. 变小C. 不变D. 可能变大、变小或不变【板书设计】单元1 酸性溶液和碱性溶液一、溶液地酸碱度—pH溶液地酸碱度:表示溶液酸碱性地强弱程度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、溶液酸碱性的 强弱程度
用石蕊或酚酞试液可以检验出某溶液的酸碱性,但能否 比较两种溶液酸碱性的强弱呢?例如:食醋和稀盐酸都是 酸性的,谁的酸性比较强呢?
二、溶液酸碱性的强弱程度
----------------酸碱度
酸果汁、白醋、稀盐酸的酸性强弱不同,石灰水、
氨水和肥皂水的碱性强弱也不同。因此,人们 用酸碱度来表示溶液酸碱性强弱的 程度。
紫色 石蕊
红色 紫色
紫色 色 无色 红色 无色 红色
1、 能跟酸或碱的溶液起作用而显
示不同颜色的物质叫做酸碱指示剂
遇酸变红 紫色石蕊溶液 遇中性还是紫色
遇碱变蓝
遇酸不变色 无色酚酞溶液 遇中性的不变色
遇碱变红
(1)酸性溶液:
2、
溶
液
的
(2)中性溶液:
酸
碱
性
(3)碱性溶液:
通常情况下是不允许品尝化学试剂的味道的, 那我们怎么确定物质的酸性或碱性呢?
回忆:将二氧化碳通入紫色石蕊试液看到什么 现象?
CO2+H2O==H2CO3
能使紫色石蕊试液变红
食醋、酸果汁等有酸味的物质的溶液是否能 使紫色石蕊试液变红?
实验:
白醋 食盐 蔗糖 NaOH 稀盐 石灰 水 水 溶液 酸 水
专题七 初识酸、碱和盐
酸性溶液和碱性溶液
根据物 质的组 成是否 单一
物质的简单分类:
混合物 由两种或多种物质混合而成的物质
(如:空气、溶液等)
物 质
根据元 素的组 成是否
单一
金属单质 (如铁、镁等) 单质
非金属单质(如碳、氧气等)
纯净物
同种元素组成的纯净物
由一种物质 组成的物质。 (例如氧气、 二氧化碳、 高锰酸钾等)
PPT素材:/sucai/ PPT图表:/tubiao/ PPT教程: /powerpoint/ 范文下载:/fanwen/ 教案下载:/jiaoan/
PPT课件:/kejian/ 数学课件:/kejian/shuxue/ 美术课件:/kejian/meishu/
科学课件:/kejian/kexue/ 物理课件:/kejian/wuli/
二、溶液酸碱性的强弱程度
----------------酸碱度
2、测定酸碱度方法:pH试纸法、 酸度计法等。
酸碱指示剂可以粗略区分溶液的酸碱性
PH试纸可以粗略地测定溶液的酸碱度(整数)
酸度计可以比较精确地测定溶液的PH。
活动与探究:
3、用pH试纸测定溶液的酸碱度
方法:用洗净的玻璃棒醮取少量待测溶液,涂在 PH试纸上,观察试纸的颜色,并将其与标准比色 卡对照,读出其PH值。
表7-1 人体中几种重要体液的正常pH范围
体液 血液 唾液
pH 7.35-7.45
6.6-7.1
体液 胃液 胆汁
pH 0.8-1.5 6.8-7.4
体液 乳汁
尿
pH 6.4-6.7 5.0-7.0
三、溶液的酸碱性与生命活动的关系
阅读资料:
大多数农作物适宜在接近中性(pH在6.5—7.5之间)的 土壤中生长,酸性太强(pH小于4)或碱性太强(pH大于8) 的土壤都不适宜作物的生长。
单元1 课堂目标
1、怎样判断溶液的酸碱性?
单元1 课堂目标
1、怎样判断溶液的酸碱性?
利用酸碱指示剂
2、怎样判断溶液的酸碱度?
PH试纸可以粗略地测定溶液的酸碱度(整数)
测定生活中常见物质的pH值:
将可食用与非食用物质的pH值比较,有 何结论?
三、溶液的酸碱性与生命 活动的关系
阅读资料:
健康人的体液pH必须维持在一定的范围内。如果体 液pH超越正常范围 ,就会导致生理功能失调或发生疾病, 甚至出现“酸中毒”。如果胃酸分泌过多,使胃液pH降 到正常水平以下,容易出现胃痛等症状。
化学课件:/kejian/huaxue/ 生物课件:/kejian/shengwu/
地理课件:/kejian/dili/
历史课件:/kejian/lishi/
2、怎样判断溶液的酸碱度?
一、酸性溶液和碱性溶液
日常生活中,有哪些物质 曾给你留下过“酸的印 象”?
生活启示
酒有辣味—酒中有乙醇 糖水有甜味—糖水中有蔗糖 食盐水有咸味—食盐水有氯化钠 苏打水有苦涩味—其中有碱性物质 醋、酸奶中有酸味—其中有酸性物质
将一定质量分数的酸性或碱性溶液加水稀释,则溶液的PH 随所加水的体积(V)变化关系是
PH
A
对于碱性溶液来说,加水后,溶液碱 性减弱,PH减小,逐渐接近于7,但
总不会等于7。
7
B
0
对于酸性溶液来说,加水后,溶液酸 性减弱,PH增大,逐渐接近于7,但 总不会等于7。
化合物
不同种元素组成 的纯净物
氧化物
由两种元素
组成,其中
其它化合物 一种是氧元
(酸碱盐等) 素的化合物
单元1 课堂目标
1、怎样判断溶液的酸碱性? PPT模板:/moban/ PPT背景:/beijing/ PPT下载:/xiazai/ 资料下载:/ziliao/ 试卷下载:/shiti/ PPT论坛: 语文课件:/kejian/yuwen/ 英语课件:/kejian/yingyu/
注 意
酸性溶液的pH值越小酸性越强,反 之PH值越大酸性越弱(反比)。
碱性溶液的pH值越大碱性越强,反之 PH值越小碱性越弱(正比)。
二、溶液酸碱性的强弱程度
----------------酸碱度
观察下图,并完成下列填空: 1、溶液的酸碱性:pH=7,溶液呈 中 性; pH<7,溶液 呈 酸 性; pH>7,溶液呈 碱 性。 2、溶液的pH与酸碱性强弱的关系: pH 越大,碱性越强; pH越小, 酸性越强 。
单元1 课堂目标
1、怎样判断溶液的酸碱性?
利用酸碱指示剂
思考
现有两瓶失去标签的无色溶 液,一瓶是稀盐酸,一瓶是氢氧 化钠溶液,请你通过鉴别,贴上 标签。
检验酸碱溶液的操作步骤:
1. 取样 2. 滴加指示剂 3. 观察现象
4. 得出结论
笔纸答案:
取样于试管中,分别滴加紫色 石蕊溶液,观察现象,如果紫色 石蕊变红,则原溶液是盐酸;如 果紫色石蕊变蓝,则原溶液是氢 氧化钠溶液。
表7-2 几种作物生长最适宜的pH范围
作物
pH
作物
pH
水稻、小麦、玉米 6.0-7.0 甘蔗、桑树、苹果树 6.0-8.0
番茄、西瓜
6.0-7.0
松树、烟草
5.0-6.0
棉花
6.0-6.8
柑橘树
5.0-7.0
大豆
6.5-7.5
茶树
5.0-5.5
你能得出答案吗?
1、将一定质量分数的KOH溶液加水稀释,则溶液的PH与 所加水的体积(V)关系正确的是( D )
