高中化学物质与氧气的反应常见方程式
氧化反应方程式

氧化反应方程式
氧化反应方程式是描述物质在与氧气反应时发生氧化的化学方程式。
具体的反应方程式取决于反应物的种类和反应条件。
以下是一些常见物质的氧化反应方程式的示例:
1.金属的氧化反应方程式(生成金属氧化物):铁+ 氧气->
二氧化铁 4Fe + 3O2 -> 2Fe2O3
2.非金属物质的氧化反应方程式:硫 + 氧气 -> 二氧化硫 S +
O2 -> SO2
3.碳氢化合物的氧化反应方程式:甲烷 + 氧气 -> 二氧化碳 +
水 CH4 + 2O2 -> CO2 + 2H2O
4.无机化合物的氧化反应方程式:二氧化硫+ 氧气-> 三氧
化硫 SO2 + O2 -> SO3
请注意,这些方程式是示例。
氧化反应的方程式会根据具体的反应物和反应条件而有所不同。
此外,方程式中的系数应根据生成物的摩尔比例进行平衡,以确保质量守恒和电荷守恒。
初中高中化学方程式大全

一、 氧气的性质:
(1)单质与氧气的反应:(化合反应)
1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO
2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
3. 铜在空气中受热:2Cu + O2 加热 2CuO
4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3
63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O
(4)酸 + 盐 -------- 另一种酸 + 另一种盐
64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
(3)盐 + 碱 -------- 另一种碱 + 另一种盐
76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH
(4)盐 + 盐 ----- 两种新盐
77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓ + NaNO3
78.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl
54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg
(3)金属铁的治炼原理:
55.3CO+ 2Fe2O3 高温 4Fe + 3CO2↑
中考化学必背化学方程式

中考化学必背化学方程式中考有时候我觉得比高中的学业还要繁重,因为在这个阶段要学九门课程。
有同学需要化学必背的方程式,为了回应同学们的需要。
下面是由小编为大家整理的“中考化学必背化学方程式”,仅供参考,欢迎大家阅读。
中考化学必背化学方程式一、物质与氧气的反应(一)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热:2Cu + O2 加热 2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O6. 红磷在空气中燃烧:4P + 5O2 点燃 2P2O57. 硫粉在空气中燃烧:S + O2 点燃 SO28. 碳在氧气中充分燃烧:C + O2 点燃 CO29. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO(二)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO211. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O二、几个分解反应13. 水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑14. 加热碱式碳酸铜:Cu2(OH)2CO3 加热2CuO + H2O + CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 == 2KCl + 3O2 ↑16. 加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑17. 碳酸不稳定而分解:H2CO3 == H2O + CO2↑18. 高温煅烧石灰石:CaCO3 高温CaO + CO2↑三、几个氧化还原反应19. 氢气还原氧化铜:H2 + CuO 加热 Cu + H2O20. 木炭还原氧化铜:C + 2CuO 高温2Cu + CO2↑21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑22. 焦炭还原四氧化三铁:2C+ Fe3O4 高温3Fe + 2CO2↑23. 一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO225. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2四、单质、氧化物、酸、碱、盐的相互关系(一)金属单质 + 酸 --- 盐 + 氢气 (置换反应)26. 锌和稀硫酸:Zn + H2SO4 == ZnSO4 + H2↑27. 铁和稀硫酸:Fe + H2SO4 == FeSO4 + H2↑28. 镁和稀硫酸:Mg + H2S O4 == MgSO4 + H2↑29. 铝和稀硫酸:2Al +3H2SO4 == Al2(SO4)3+3H2↑30. 锌和稀盐酸:Zn + 2HCl == ZnCl2 + H2↑31. 铁和稀盐酸:Fe + 2HCl == FeCl2 + H2↑32. 镁和稀盐酸:Mg+ 2HCl == MgCl2 + H2↑33. 铝和稀盐酸:2Al + 6HCl == 2AlCl3+ 3H2↑(二)金属单质 + 盐(溶液) --- 另一种金属 + 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu35. 锌和硫酸铜溶液反应:Zn + CuSO4 == ZnSO4 + Cu36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 +Hg(三)碱性氧化物 +酸 --- 盐 + 水37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl == 2FeCl3 + 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3+ 3H2O39. 氧化铜和稀盐酸反应:CuO + 2HCl == CuCl2 + H2O40. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O41. 氧化镁和稀硫酸反应:MgO + H2SO4 == MgSO4 + H2O42. 氧化钙和稀盐酸反应:CaO + 2HCl == CaCl2 + H2O(四)酸性氧化物 +碱 --- 盐 + 水43.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O 46.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2+ SO2 == CaSO3 ↓+H2O(五)酸 + 碱 ---盐 + 水48. 盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH == KCl +H2O50. 盐酸和氢氧化铜反应:2HCl + Cu(OH)2 == CuCl2 + 2H2O 51. 盐酸和氢氧化钙反应:2HCl +Ca(OH)2 == CaCl2 + 2H2O 52. 盐酸和氢氧化铁反应:3HCl +Fe(OH)3 == FeCl3 + 3H2O 53. 氢氧化铝药物治疗胃酸过多:3HCl+ Al(OH)3 == AlCl3 + 3H2O 54. 硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4 + 2H2O 55. 硫酸和氢氧化钾反应:H2SO4+ 2KOH == K2SO4 + 2H2O 56. 硫酸和氢氧化铜反应:H2SO4+ Cu(OH)2 == CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4+ 2Fe(OH)3 == Fe2(SO4)3 + 6H2O 58. 硝酸和烧碱反应:HNO3+NaOH == NaNO3 +H2O(六)酸 + 盐--- 另一种酸 + 另一种盐59. 大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑60. 碳酸钠与稀盐酸反应:Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑61. 碳酸镁与稀盐酸反应:MgCO3 + 2HCl == MgCl2 + H2O + CO2↑62. 盐酸和硝酸银溶液反应:HCl + AgNO3 == AgCl↓ + HNO363. 硫酸和碳酸钠反应:Na2CO3 + H2SO4 == Na2SO4+ H2O + CO2↑64. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4↓+2HCl(七)碱 + 盐 --- 另一种碱 + 另一种盐65. 氢氧化钠与硫酸铜:2NaOH + CuSO4 == Cu(OH)2↓ +Na2SO4 66. 氢氧化钠与氯化铁:3NaOH + FeCl3 == Fe(OH)3↓ +3NaCl67. 氢氧化钠与氯化镁:2NaOH + MgCl2 == Mg(OH)2↓ +2NaCl 68. 氢氧化钠与氯化铜:2NaOH + CuCl2 == Cu(OH)2↓ +2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+2NaOH (八)盐 + 盐 --- 两种新盐70. 氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓ + NaNO371. 硫酸钠和氯化钡:Na2SO4 + B aCl2 == BaSO4↓ +2NaCl五、其它反应72. 二氧化碳溶解于水:CO2 + H2O == H2CO373. 生石灰溶于水:CaO + H2O == Ca(OH)274. 氧化钠溶于水:Na2O + H2O == 2NaOH75. 三氧化硫溶于水:SO3 + H2O == H2SO476. 硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 + 5H2O77. 无水硫酸铜作干燥剂:CuSO4 + 5H2O == CuSO4·5H2O拓展阅读:怎么快速提高初三化学成绩?要好好研究课本和做题。
高中化学方程式总结(全)

高中化学方程式总结物质与氧气的反应:1)单质与氧气的反应:2Mg + O2 点燃 2MgO 3Fe + 2O2 点燃 Fe3O4 2Cu+ O2 加热 2CuO 4Al + 3O2 点燃 2Al2O35. 氢气中空气中燃烧: 2H2 + O2 点燃 2H2O6. 红磷在空气中燃烧: 4P + 5O2 点燃 2P2O57. 硫粉在空气中燃烧: S + O2 点燃 SO28. 碳在氧气中充分燃烧: C + O2 点燃 CO29. 碳在氧气中不充分燃烧: 2C + O2 点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧: 2CO + O2 点燃 2CO211. 甲烷在空气中燃烧: CH4 + 2O2 点燃 CO2 + 2H2O12. 酒精在空气中燃烧: C2H5OH + 3O2点 燃 2CO2 + 3H2O 二.几个分解反应:13. 水在直流电的作用下分解: 2H2O 通电 2H2↑+ O2 ↑14. 加热碱式碳酸铜: Cu2(OH )2CO3加 热 2CuO + H2O + CO2↑15. 加热氯酸钾(有少量的二氧化锰): 2KClO3 ==== 2KCl + 3O2 ↑16. 加热高锰酸钾: 2KMnO4加 热 K2MnO4 + MnO2 + O ↑217. 碳酸不稳定而分解: H2CO3 === H2O + CO ↑218. 高温煅烧石灰石: CaCO3高 温 CaO + CO2↑ 三.几个氧化还原反应:19. 氢气还原氧化铜: H2 + CuO 加热 Cu + H2O20. 木炭还原氧化铜: C+ 2CuO 高温 2Cu + CO2↑21. 焦炭还原氧化铁: 3C+ 2Fe2O3 高温 4Fe + 3CO2↑22. 焦炭还原四氧化三铁: 2C+ Fe3O4 高温 3Fe + 2CO2↑23. 一氧化碳还原氧化铜: CO+ CuO 加 热 Cu + CO224. 一氧化碳还原氧化铁: 3CO+ Fe2O3高 温 2Fe + 3CO225. 一氧化碳还原四氧化三铁: 4CO+ Fe3O4高 温 3Fe + 4CO2 四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质 + 酸 ---- 盐 + 氢气(置换反应)26. 锌和稀硫酸 Zn + H2SO4 = ZnSO4 + H2↑27. 铁和稀硫酸 Fe + H2SO4 = FeSO4 + H2↑28. 镁和稀硫酸 Mg + H2SO4 = MgSO4 + H2↑29. 铝和稀硫酸 2Al +3H2SO4 = Al2(SO4)3 +3H2 ↑30. 锌和稀盐酸 Zn + 2HCl === ZnCl2 + H2 ↑31. 铁和稀盐酸 Fe + 2HCl === FeCl2 + H2 ↑32. 镁和稀盐酸 Mg+ 2HCl === MgCl2 + H2↑33. 铝和稀盐酸 2Al + 6HCl == 2AlCl3 + 3H2 ↑(2)金属单质 + 盐(溶液) --- 另一种金属 + 另一种盐 1. 镁在空气中燃烧 2. 铁在氧气中燃烧 3. 铜在空气中受热 4. 铝在空气中燃烧34. 铁和硫酸铜溶液反应: Fe + CuSO4 === FeSO4 + Cu35. 锌和硫酸铜溶液反应: Zn + CuSO4 === ZnSO4 + Cu36. 铜和硝酸汞溶液反应: Cu + Hg(NO3)2 === Cu(NO3)2 + Hg(3) -------------------------------- 碱性氧化物 +酸 盐 + 水Fe2O3 + 6HCl === 2FeCl3 + 3H2OFe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2OCuO + 2HCl ==== CuCl2 + H2O CuO + H2SO4 ==== CuSO4 + H2O MgO + H2SO4 ==== MgSO4 + H2O CaO + 2HCl ==== CaCl2 + H2O(4) 酸性氧化物 +碱 盐 + 水43.苛性钠暴露在空气中变质: 2NaOH + CO2==== Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体: 2NaOH + SO2==== Na2SO3 + H2O 45.苛性钠吸收三氧化硫气体: 2NaOH + SO3==== Na2SO4 + H2O 46.消石灰放在空气中变质: Ca(OH)2 + CO2==== CaCO3↓ + H2O 47. 消石灰吸收二氧化硫: Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O(5) --------------------- 酸 + 碱 盐 + 水48.盐酸和烧碱起反应: HCl + NaOH ==== NaCl +H2O 49. 盐酸和氢氧化钾反应: HCl + KOH ==== KCl +H2O 50.盐酸和氢氧化铜反应: 2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应: 2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应: 3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53. 氢氧化铝药物治疗胃酸过多: 3HCl + Al(OH)3 ==== AlCl3 + 3H2O54. 硫酸和烧碱反应: H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55. 硫酸和氢氧化钾反应: H2SO4 + 2KOH ==== K2SO4 + 2H2O56. 硫酸和氢氧化铜反应: H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57. 硫酸和氢氧化铁反应: 3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应: HNO3+ NaOH ==== NaNO3 +H2O(6) --------------------- 酸 + 盐 另一种酸 + 另一种盐59.大理石与稀盐酸反应: CaCO3 + 2HCl === CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应 : Na2CO3 + 2HCl === 2NaCl + H2O + CO2 ↑ 61.碳酸镁与稀盐酸反应 : MgCO3 + 2HCl === MgCl2 + H2O + CO2 ↑62.盐酸和硝酸银溶液反应: HCl + AgNO3 === AgCl ↓ + HNO3 63.硫酸和碳酸钠反应: Na2CO3 + H2SO4 === Na2SO4 + H2O + CO ↑2 64.硫酸和氯化钡溶液反应: H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl2NaOH + CuSO4 ==== Cu(OH)↓2 + Na2SO43NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl Ca(OH)2 + Na2CO3 === CaCO ↓3 + 2NaOH8)盐 + 盐 两种新盐70.氯化钠溶液和硝酸银溶液: NaCl + AgNO3 ==== AgCl ↓ + NaNO371.硫酸钠和氯化钡: Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl37. 氧化铁和稀盐酸反应 38. 氧化铁和稀硫酸反应 39. 氧化铜和稀盐酸反应 40. 氧化铜和稀硫酸反应 41. 氧化镁和稀硫酸反应 42. 氧化钙和稀盐酸反应 7)碱 + 盐 ----- 另一种碱 + 另一种盐 65.氢氧化钠与硫酸铜 66.氢氧化钠与氯化铁 67.氢氧化钠与氯化镁五.其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO3 73.生石灰溶于水:CaO +H2O === Ca(OH)2 74.氧化钠溶于水:Na2O + H2O ==== 2NaOH 75.三氧化硫溶于水:SO3 + H2O ==== H2SO4 76.硫酸铜晶体受热分解:CuSO·4 5H2O 加热CuSO4 + 5H2O 77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO·45H2O化学方程式反应现象应用2Mg+O2点燃或Δ2MgO剧烈燃烧.耀眼白光.生成白色固体. 放热. 产生大量白烟白色信号弹2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+O2点燃或Δ2CuO 红色金属变为黑色固体4Al+3O2点燃或Δ2Al2O3 银白金属变为白色固体3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热4Fe + 3O2 高温2Fe2O3C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰. 氧气中蓝紫色火焰2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水) 高能燃料4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水) 甲烷和天然气的燃烧2C2H2+5O2点燃2H2O+4CO2蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水) 氧炔焰、焊接切割金属2KClO3MnO2Δ 2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4+MnO2+↑O2 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgOΔ2Hg+O↑2 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2COΔ3 2CuO+H2O+C↑O2 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCOΔ3NH3↑+ H2O +CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+H2SO4=ZnSO42+↑H 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4=FeSO4+↑H2 有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4 =MgSO4+↑H 2有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4=Al2(SO4)3+3H↑2 有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2Δ 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H2Δ 3Fe+4H2O黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+H32Δ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3+3H2Δ Mo +3H2O冶炼金属钼、利用氢气的还原性2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2 点燃或光照2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH↓)2+Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2C O+O2点燃2CO2 蓝色火焰煤气燃烧C + CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C高温4Fe+ 3CO2↑ 冶炼金属Fe3O4+2C高温3Fe + 2CO2↑ 冶炼金属C + CO2 高温2COCO2 + H2O = H2CO3碳酸使石蕊变红证明碳酸的酸性H2CO3Δ CO2↑+ H2O 石蕊红色褪去Ca(OH)2+CO2= CaCO↓3+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2 = Ca(HCO3白)2色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+H2O+CO↑2 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成. 钟乳石的形成2NaHCOΔ3 Na2CO3+H2O+C↑O 2产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3高温CaO+ CO↑2 工业制备二氧化碳和生石灰CaCO3+2HCl=CaCl2+ H2O+C↑O 2固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢Na2CO3+H2SO4=Na2SO4O++HC2O↑2 固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理Na2CO3+2HCl=2NaCl+ H2O+C↑O 2固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理MgCO3+2HCl=MgCl2+H2O+↑CO 固2 体逐渐溶解、有使澄清石灰水变浑浊的气体CuO +COΔ Cu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属Fe2O3+3CO高温2Fe+3CO2 冶炼金属原理Fe3O4+4CO高温3Fe+4CO2 冶炼金属原理WO3+3C高O温W+3CO2冶炼金属原理CH3COOH+NaOH=CH3COONa+H2O2CH3OH+3O点2 燃2CO2+4H2OC2H5OH+3O点2燃2CO2+3H2O蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧Fe+CuSO4=Cu+FeSO银4 白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4= Fe+ MgSO溶4 液由浅绿色变为无色Cu+Hg(NO3)2=Hg+ Cu (NO3)2 Cu+2AgNO3=2Ag+ Cu(NO3)红2 色金属表面覆盖一层银白色物质镀银Zn+CuSO4= Cu+ZnSO青4 白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl=2FeCl3+3H2O铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解Na2O+2HCl=2NaCl+H2O白色固体溶解CuO+2HCl=CuCl2+H2O黑色固体溶解、溶液呈蓝色ZnO+2HCl=ZnCl2+ H2O白色固体溶解MgO+2HCl=MgCl2+ H2O白色固体溶解CaO+2HCl=CaCl2+ H2O白色固体溶解NaOH+HCl=NaCl+ H2O白色固体溶解Cu(OH)2+2HCl=CuCl2+2H2O蓝色固体溶解Mg(OH)2+2HCl=MgCl2+2H2O白色固体溶解Al(OH)3+3HCl=AlCl3+3H2O 白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl=FeCl3+3H2O红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl=CaCl2+2H2OHCl+AgNO3= AgC↓l +HNO3生成白色沉淀、不溶解于稀硝酸检验Cl —的原理Fe2O3+3H2SO4= Fe2(SO4)3+3H2铁O 锈溶解、溶液呈黄色铁器除锈Al2O3+3H2SO4= Al2(SO4)3+3H2O白色固体溶解CuO+H2SO4=CuSO4+H黑2O色固体溶解、溶液呈蓝色ZnO+H2SO4=ZnSO4+H白2O色固体溶解MgO+H2SO4=MgSO4+H白2色O 固体溶解2NaOH+H2SO4=Na2SO4+2H2OCu(OH)2+H2SO4=CuSO4+2H蓝2O色固体溶解Ca(OH)2+H2SO4=CaSO4+2H2OMg(OH)2+H2SO4=MgSO4+2H白2O色固体溶解2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O白色固体溶解2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2红O 褐色沉淀溶解、溶液呈黄色Ba(OH)2+ H2SO4=BaSO↓4+2H2O生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+ H2SO4=BaSO↓4+2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4=BaS↓O4+2HNO3生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Na2O+2HNO3=2NaNO3+H白2色O 固体溶解CuO+2HNO3=Cu(NO3)2+H黑2O色固体溶解、溶液呈蓝色ZnO+2HNO3=Zn(NO3)2+ H2白O 色固体溶解MgO+2HNO3=Mg(NO3)2+ H白2O色固体溶解CaO+2HNO3=Ca(NO3)2+ H2白O色固体溶解NaOH+HNO3=NaNO3+ H2OCu(OH)2+2HNO3=Cu(NO3)2+2H2蓝O色固体溶解Mg(OH)2+2HNO3=Mg(NO3)2+2H白2O色固体溶解Al(OH)3+3HNO3=Al(NO3)3+3H2O白色固体溶解Ca(OH)2+2HNO3=Ca(NO3)2+2H2OFe(OH)3+3HNO3=Fe(NO3)3+3H2红O 褐色沉淀溶解、溶液呈黄色3NaOH + H3PO4=3H2O + Na3PO43NH3+H3PO4=(NH4)3PO42NaOH+CO2=Na2CO3+ H吸2O收CO、O2、H2 中的CO2、2NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4处+ 理H2硫O酸工厂的尾气( SO2) FeCl3+3NaOH=Fe(OH)↓3 +3NaCl 溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成MgCl2+2NaOH = Mg(OH)↓2 +2NaClCuCl2+2NaOH = Cu(OH)↓2 +2NaCl 溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O = Ca(OH)2 白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2=CaS↓O3+ H2O 有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3=CaC↓O+32NaOH有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3=BaC↓O3+2NaOH有白色沉淀生成Ca(OH)2+K2CO3=CaC↓O 3+2KOH 有白色沉淀生成CuSO4+5H2O= CuS·O4H2O 蓝色晶体变为白色粉末CuSO·4 H2OΔ CuSO4+5H2O白色粉末变为蓝色检验物质中是否含有水AgNO3+NaCl = AgC↓l +Na NO3 白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子BaCl2 + Na2SO4 = BaSO4↓+2NaCl 白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子CaCl2+Na2CO3= CaCO↓3+2NaCl 有白色沉淀生成MgCl2+Ba(OH)2=BaCl2+Mg(OH↓)2 有白色沉淀生成CaCO3+2HCl=CaCl2+H2O+C↑O2MgCO3+2HCl= MgCl2+H2O+ CO↑2NH4NO3+NaOH=NaNO3↑+N+H32O 生成使湿润石蕊试纸变蓝色的气体,应用于检验溶液中的铵根离子NH4Cl+ KOH= KCl+NH↑3 +H2O 生成使湿润石蕊试纸变蓝色的气体氨:NH3 胺:氨分子中的氢被烃基取代而生成的化合物。
初高中化学方程式大全

初高中化学方程式大全初中化学方程式总结化合反应1、镁在空气中燃烧:2Mg+O22MgO2、铁在氧气中燃烧:3Fe+2O2 Fe3O43、铝在空气中燃烧:4Al+3O2 2Al2O34、氢气在空气中燃烧:2H2+O2 2H2O5、红磷在空气中燃烧:4P+5O2 2P2O56、硫粉在空气中燃烧:S+O2 SO27、碳在氧气中充分燃烧:C+O2 CO28、碳在氧气中不充分燃烧:2C+O2 2CO9、二氧化碳通过灼热碳层:C+CO2 2CO10、一氧化碳在氧气中燃烧:2CO+O2 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O==H2CO312、生石灰溶于水:CaO+H2O==Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O==CuSO4·5H2O14、钠在氯气中燃烧:2Na+Cl2 2NaCl分解反应15、实验室用双氧水制氧气:2H2O2 2H2O+O2↑16、加热高锰酸钾:2KMnO4 K2MnO4+MnO2+O2↑17、水在直流电的作用下分解:2H2O 2H2↑+O2↑18、碳酸不稳定而分解:H2CO3==H2O+CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 CaO+CO2↑置换反应20、铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu21、锌和稀硫酸反应(实验室制氢气):Zn+H2SO4==ZnSO4+H2↑22、镁和稀盐酸反应:Mg+2HCl==MgCl2+H2↑23、氢气还原氧化铜:H2+CuO Cu+H2O24、木炭还原氧化铜:C+2CuO2Cu+CO2↑25、水蒸气通过灼热碳层:H2O+C H2+CO26、焦炭还原氧化铁:3C+2Fe2O34Fe+3CO2↑其他27.氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO4==Cu(OH)2↓+Na2SO428、甲烷在空气中燃烧:CH4+2O2 CO2+2H2O29、酒精在空气中燃烧:C2H5OH+3O2 2CO2+3H2O30、一氧化碳还原氧化铜:CO+CuO Cu+CO231、一氧化碳还原氧化铁:3CO+Fe2O32Fe+3CO232、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+CO2==CaCO3↓+H2O33、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+CO2==Na2CO3+H2O34、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3+2HCl==CaCl2+H2O+CO2↑35、碳酸钠与浓盐酸反应(泡沫灭火器的原理):Na2CO3+2HCl==2NaCl+H2O+CO2↑一.物质与氧气的反应:⑴单质与氧气的反应:1. 镁在空气中燃烧:2Mg+O2 2MgO2. 铁在氧气中燃烧:3Fe+2O2 Fe3O43. 铜在空气中受热:2Cu+O2 2CuO4. 铝在空气中燃烧:4Al+3O22Al2O35. 氢气中空气中燃烧:2H2+O2 2H2O6. 红磷在空气中燃烧:4P+5O2 2P2O57. 硫粉在空气中燃烧:S+O2 SO28. 碳在氧气中充分燃烧:C+O2 CO29. 碳在氧气中不充分燃烧:2C+O2 2CO⑴化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O2 2CO211. 甲烷在空气中燃烧:CH4+2O2 CO2+2H2O12. 酒精在空气中燃烧:C2H5OH+3O2 2CO2+3H2O二.几个分解反应:13. 水在直流电的作用下分解:2H2O 2H2↑+O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO32CuO+H2O+CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 2KCl+3O2↑16. 加热高锰酸钾:2KMnO4 K2MnO4+MnO2+O2↑17. 碳酸不稳定而分解:H2CO3==H2O+CO2↑18. 高温煅烧石灰石:CaCO3 CaO+CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2+CuO Cu+H2O20. 木炭还原氧化铜:C+2CuO 2Cu+CO2↑21. 焦炭还原氧化铁:3C+2Fe2O3 4Fe+3CO2↑22. 焦炭还原四氧化三铁:2C+Fe3O4 3Fe+2CO2↑23. 一氧化碳还原氧化铜:CO+CuOCu+CO224. 一氧化碳还原氧化铁:3CO+Fe2O3 2Fe+3CO225. 一氧化碳还原四氧化三铁:4CO+Fe3O4 3Fe+4CO2四.单质、氧化物、酸、碱、盐的相互关系⑴金属单质+ 酸--------盐+ 氢气(置换反应)26. 锌和稀硫酸Zn+H2SO4==ZnSO4+H2↑27. 铁和稀硫酸Fe+H2SO4==FeSO4+H2↑28. 镁和稀硫酸Mg+H2SO4==MgSO4+H2↑29. 铝和稀硫酸2Al+3H2SO4==Al2(SO4)3+3H2↑30. 锌和稀盐酸Zn+2HCl==ZnCl2+H2↑31. 铁和稀盐酸Fe+2HCl==FeCl2+H2↑32. 镁和稀盐酸Mg+2HCl==MgCl2+H2↑33. 铝和稀盐酸2Al+6HCl==2AlCl3+3H2↑⑴金属单质+ 盐(溶液)-------另一种金属+ 另一种盐34. 铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu35. 锌和硫酸铜溶液反应:Zn+CuSO4==ZnSO4+Cu36. 铜和硝酸汞溶液反应:Cu+Hg(NO3)2==Cu(NO3)2+Hg⑴碱性氧化物+酸--------盐+ 水37. 氧化铁和稀盐酸反应:Fe2O3+6HCl==2FeCl3+3H2O38. 氧化铁和稀硫酸反应:Fe2O3+3H2SO4==Fe2(SO4)3+3H2O39. 氧化铜和稀盐酸反应:CuO+2HCl==CuCl2+H2O40. 氧化铜和稀硫酸反应:CuO+H2SO4==CuSO4+H2O41. 氧化镁和稀硫酸反应:MgO+H2SO4==MgSO4+H2O42. 氧化钙和稀盐酸反应:CaO+2HCl==CaCl2+H2O⑴酸性氧化物+碱--------盐+ 水43.苛性钠暴露在空气中变质:2NaOH+CO2==Na2CO3+H2O 44.苛性钠吸收二氧化硫气体:2NaOH+SO2==Na2SO3+H2O 45.苛性钠吸收三氧化硫气体:2NaOH+SO3==Na2SO4+H2O 46.消石灰放在空气中变质:Ca(OH)2+CO2==CaCO3↓+H2O47. 消石灰吸收二氧化硫:Ca(OH)2+SO2==CaSO3↓+H2O⑴酸+ 碱--------盐+ 水48.盐酸和烧碱起反应:HCl+NaOH==NaCl+H2O49. 盐酸和氢氧化钾反应:HCl+KOH==KCl+H2O50.盐酸和氢氧化铜反应:2HCl+Cu(OH)2==CuCl2+2H2O51. 盐酸和氢氧化钙反应:2HCl+Ca(OH)2==CaCl2+2H2O52. 盐酸和氢氧化铁反应:3HCl+Fe(OH)3==FeCl3+3H2O53.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3==AlCl3+3H2O54.硫酸和烧碱反应:H2SO4+2NaOH==Na2SO4+2H2O55.硫酸和氢氧化钾反应:H2SO4+2KOH==K2SO4+2H2O56.硫酸和氢氧化铜反应:H2SO4+Cu(OH)2==CuSO4+2H2O57.硫酸和氢氧化铁反应:3H2SO4+2Fe(OH)3==Fe2(SO4)3+ 6H2O58.硝酸和烧碱反应:HNO3+NaOH==NaNO3+H2O⑴酸+ 盐--------另一种酸+ 另一种盐59.大理石与稀盐酸反应:CaCO3+2HCl==CaCl2+H2O+CO2↑60.碳酸钠与稀盐酸反应: Na2CO3+2HCl==2NaCl+H2O+CO2↑61.碳酸镁与稀盐酸反应: MgCO3+2HCl==MgCl2+H2O+CO2↑62.盐酸和硝酸银溶液反应:HCl+AgNO3==AgCl↓+HNO363.硫酸和碳酸钠反应:Na2CO3+H2SO4==Na2SO4+H2O+CO2↑64.硫酸和氯化钡溶液反应:H2SO4+BaCl2==BaSO4↓+2HCl⑴碱+ 盐--------另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:2NaOH+CuSO4==Cu(OH)2↓+Na2SO4 66.氢氧化钠与氯化铁:3NaOH+FeCl3==Fe(OH)3↓+3NaCl 67.氢氧化钠与氯化镁:2NaOH+MgCl2==Mg(OH)2↓+2NaCl68. 氢氧化钠与氯化铜:2NaOH+CuCl2==Cu(OH)2↓+2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH⑴盐+ 盐-----两种新盐70.氯化钠溶液和硝酸银溶液:NaCl+AgNO3==AgCl↓+NaNO3 71.硫酸钠和氯化钡:Na2SO4+BaCl2==BaSO4↓+2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+H2O==H2CO373.生石灰溶于水:CaO+H2O==Ca(OH)274.氧化钠溶于水:Na2O+H2O==2NaOH75.三氧化硫溶于水:SO3+H2O==H2SO476.硫酸铜晶体受热分解:CuSO4·5H2OCuSO4+5H2O77.无水硫酸铜作干燥剂:CuSO4+5H2O==CuSO4·5H2O化学方程式反应现象应用2Mg+O22MgO剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O2 2HgO银白液体、生成红色固体拉瓦锡实验2Cu+O2 2CuO红色金属变为黑色固体4Al+3O2 2Al2O3银白金属变为白色固体3Fe+2O2 Fe3O4剧烈燃烧、火星四射、生成黑色固体、放热C+O2 CO2剧烈燃烧、白光、放热、使石灰水变浑浊S+O2 SO2剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O2 2H2O淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O2 2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2 2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O2 2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO32KCl+3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4 K2MnO4+MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgO 2Hg+O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O 2H2↑+O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2CO3 2CuO+H2O+CO2↑绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3NH3↑+H2O+CO2↑白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+H2SO4==ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4==FeSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4==MgSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4==Al2(SO4)3+3H2↑有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H2 3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2 W+3H2O 冶炼金属钨、利用氢气的还原性MoO3+3H2 Mo+3H2O 冶炼金属钼、利用氢气的还原性2Na+Cl22NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2 2HCl 苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C+O2 2CO煤炉中常见反应、空气污染物之一、煤气中毒原因2CO+O2 2CO2蓝色火焰煤气燃烧C+CuO2Cu+CO2↑黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C 4Fe+3CO2↑冶炼金属Fe3O4+2C3Fe+2CO2↑冶炼金属C+CO2 2COCO2+H2O==H2CO3碳酸使石蕊变红证明碳酸的酸性H2CO3CO2↑+H2O石蕊红色褪去Ca(OH)2+CO2==CaCO3↓+H2O澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2==Ca(HCO3)2白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2 CaCO3↓+H2O+CO2↑白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3 Na2CO3+H2O+CO2↑产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3CaO+CO2↑工业制备二氧化碳和生石灰CaCO3+2HCl==CaCl2+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢Na2CO3+H2SO4==Na2SO4+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理Na2CO3+2HCl==2NaCl+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理MgCO3+2HCl==MgCl2+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体CuO+CO Cu+CO2黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属Fe2O3+3CO 2Fe+3CO2冶炼金属原理Fe3O4+4CO 3Fe+4CO2冶炼金属原理WO3+3CO W+3CO2冶炼金属原理CH3COOH+NaOH=CH3COONa+H2O2CH3OH+3O2 2CO2+4H2OC2H5OH+3O2 2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧Fe+CuSO4==Cu+FeSO4银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4==Fe+MgSO4溶液由浅绿色变为无色Cu+Hg(NO3)2==Hg+Cu(NO3)2Cu+2AgNO3==2Ag+Cu(NO3)2红色金属表面覆盖一层银白色物质镀银Zn+CuSO4==Cu+ZnSO4青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl==2FeCl3+3H2O铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl==2AlCl3+3H2O白色固体溶解Na2O+2HCl==2NaCl+H2O白色固体溶解CuO+2HCl==CuCl2+H2O黑色固体溶解、溶液呈蓝色ZnO+2HCl==ZnCl2+H2O白色固体溶解MgO+2HCl==MgCl2+H2O白色固体溶解CaO+2HCl==CaCl2+H2O白色固体溶解NaOH+HCl==NaCl+H2O白色固体溶解Cu(OH)2+2HCl==CuCl2+2H2O蓝色固体溶解Mg(OH)2+2HCl==MgCl2+2H2O白色固体溶解Al(OH)3+3HCl==AlCl3+3H2O白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl==FeCl3+3H2O红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl==CaCl2+2H2OHCl+AgNO3==AgCl↓+HNO3生成白色沉淀、不溶解于稀硝酸检验Cl— 的原理Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+3H2SO4==Al2(SO4)3+3H2O白色固体溶解CuO+H2SO4==CuSO4+H2O黑色固体溶解、溶液呈蓝色ZnO+H2SO4==ZnSO4+H2O白色固体溶解MgO+H2SO4==MgSO4+H2O白色固体溶解2NaOH+H2SO4==Na2SO4+2H2OCu(OH)2+H2SO4==CuSO4+2H2O蓝色固体溶解Ca(OH)2+H2SO4==CaSO4+2H2OMg(OH)2+H2SO4==MgSO4+2H2O白色固体溶解2Al(OH)3+3H2SO4==Al2(SO4)3+3H2O白色固体溶解2Fe(OH)3+3H2SO4==Fe2(SO4)3+3H2O红褐色沉淀溶解、溶液呈黄色Ba(OH)2+H2SO4==BaSO4↓+2H2O生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+H2SO4==BaSO4↓+2HCl生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4==BaSO4↓+2HNO3生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Na2O+2HNO3==2NaNO3+H2O白色固体溶解CuO+2HNO3==Cu(NO3)2+H2O黑色固体溶解、溶液呈蓝色ZnO+2HNO3==Zn(NO3)2+H2O白色固体溶解MgO+2HNO3==Mg(NO3)2+H2O白色固体溶解CaO+2HNO3==Ca(NO3)2+H2O白色固体溶解NaOH+HNO3==NaNO3+H2OCu(OH)2+2HNO3==Cu(NO3)2+2H2O蓝色固体溶解Mg(OH)2+2HNO3==Mg(NO3)2+2H2O白色固体溶解Al(OH)3+3HNO3==Al(NO3)3+3H2O白色固体溶解Ca(OH)2+2HNO3==Ca(NO3)2+2H2OFe(OH)3+3HNO3==Fe(NO3)3+3H2O红褐色沉淀溶解、溶液呈黄色3NaOH+H3PO4==3H2O+Na3PO43NH3+H3PO4==(NH4)3PO42NaOH+CO2==Na2CO3+H2O吸收CO、O2、H2中的CO22NaOH+SO2==Na2SO3+H2O 2NaOH+SO3==Na2SO4+H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH==Fe(OH)3↓+3NaCl溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH==Al(OH)3↓+3NaCl有白色沉淀生成MgCl2+2NaOH==Mg(OH)2↓+2NaClCuCl2+2NaOH==Cu(OH)2↓+2NaCl溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O==Ca(OH)2白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2==CaSO3↓+H2O有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3==CaCO3↓+2NaOH有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3==BaCO3↓+2NaOH有白色沉淀生成Ca(OH)2+K2CO3==CaCO3↓+2KOH有白色沉淀生成CuSO4+5H2O==CuSO4·H2O蓝色晶体变为白色粉末CuSO4+H2O CuSO4+5H2O白色粉末变为蓝色检验物质中是否含有水AgNO3+NaCl==AgCl↓+NaNO3白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子BaCl2+Na2SO4==BaSO4↓+2NaCl白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子CaCl2+Na2CO3==CaCO3↓+2NaCl有白色沉淀生成MgCl2+Ba(OH)2==BaCl2+Mg(OH)2↓有白色沉淀生成CaCO3+2HCl==CaCl2+H2O+CO2↑MgCO3+2HCl==MgCl2+H2O+ CO2↑NH4NO3+NaOH==NaNO3+NH3↑+H2O生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子NH4Cl+KOH==KCl+NH3↑+H2O生成使湿润石蕊试纸变蓝色的气体高中化学方程式总结1.碳与氧气(不足)的反应2C+O2==== 2CO碳与氧气(充足)的反应C+O2==== CO22.一氧化碳与氧气的反应2CO+O2==== 2CO23.二氧化碳与碳的反应CO2+C==== 2CO4.碳酸氢钠与盐酸的反应NaHCO3+HCl==== NaCl+H2O+CO2↑5.碳酸钠与盐酸的反应Na2CO3+ 2HCl==== 2NaCl+ H2O+ CO2↑6.碳酸钙与盐酸的反应CaCO3+2HCl==== CaCl2+ H2O+ CO2↑7.碳酸氢钠与氢氧化钠的反应NaHCO3+NaOH==== Na2CO3 +H2O8.碳酸钠与氢氧化钙的反应Na2CO3+Ca(OH)2==== CaCO3↓+ 2NaOH9.碳酸氢钠(少量)与氢氧化钙的反应NaHCO3+ Ca(OH)2==== CaCO3↓+NaOH+ H2O 碳酸氢钠(过量)与氢氧化钙的反应2NaHCO3+ Ca(OH)2==== CaCO3↓+Na2CO3+2H2O10.碳酸氢钠加热的反应2NaHCO3==== Na2CO3+ H2O+CO2↑11.碳酸氢钙加热的反应Ca(HCO3)2==== CaCO3↓+H2O+CO2↑12.碳酸钙加热的反应CaCO3==== CaO+CO2↑13.二氧化碳(过量)通入氢氧化钙溶液中的反应Ca(OH)2+2CO2==== Ca(HCO3)2二氧化碳(少量)通入氢氧化钙溶液中的反应Ca(OH)2+CO2==== CaCO3↓+H2O14.氮气与氧气的反应N2+O2==== 2NO15.一氧化氮与氧气的反应2NO+O2==== 2NO216.二氧化氮与水的反应3NO2+ H2O==== 2HNO3+ NO17.氮气与氢气的反应N2+3H2========= 2NH318.氨气与水的反应NH3+H2O==== NH3?H2O19.氨气与盐酸的反应NH3+HCl==== NH4Cl20.氨气与硫酸的反应2NH3+H2SO4==== (NH4)2SO421.氨气与强酸的离子的反应NH3+H+==== NH4+22.氨的催化氧化的反应4NH3+5O2====== 4NO+6H2O23.碳酸氢铵加热的反应NH4HCO3==== NH3↑+CO2↑+H2O24.氯化铵加热的反应NH4Cl==== NH3↑+HCl↑25.碳酸铵加热的反应(NH4)2CO3==== 2NH3↑+CO2↑+H2O26.氯化铵与氢氧化钙的反应2NH4Cl+ Ca(OH)2==== CaCl2+2NH3↑+2H2O27.氯化铵与氢氧化钠的反应NH4Cl+ NaOH==== NaCl+NH3↑+H2O28.碳酸氢铵与氢氧化钠的反应NH4HCO3+2NaOH==== Na2CO3+NH3↑+2H2O29.碳酸氢铵与氢氧化钙的反应NH4HCO3+Ca(OH)2==== CaCO3↓+NH3↑+2H2O30.硝酸的分解的反应4HNO3========= 4NO2↑+O2↑+2H2O31.铜与浓硝酸的反应Cu+4HNO3(浓)==== Cu(NO3)2+2NO2↑+2H2O32.铜与稀硝酸的反应3Cu+8HNO3(稀)==== 3Cu(NO3)2+2NO↑+4H2O33.铁与浓硝酸的反应Fe+6HNO3(浓)==== Fe(NO3)3+3NO2↑+3H2O34.铁与稀硝酸的反应Fe+4HNO3(稀)==== Fe(NO3)3+NO↑+2H2O35.碳与浓硝酸的反应C+4HNO3(浓)==== CO2↑+4NO2↑+2H2O36.一氧化氮与一氧化碳的反应2NO+2CO====== N2+2CO237.一氧化氮与氧气和水的反应4NO+3O2+2H2O==== 4HNO338.二氧化氮与氧气和水的反应4NO2+O2+2H2O==== 4HNO339.氢氧化钠吸收二氧化氮和一氧化氮的反应2NaOH+NO2+NO==== 2NaNO2+ H2O40.氨气(过量)与氯气的反应8NH3+3Cl2==== 6NH4Cl+N2氨气(少量)与氯气的反应2NH3+3Cl2==== 6HCl+N241.二氧化氮生成四氧化二氮的反应2NO2==== N2O442.硫与铜的反应S+2Cu==== Cu2S43.硫与铁的反应S+Fe==== FeS44.硫与钠的反应S+2Na==== Na2S45.硫与铝的反应3S+2Al==== Al2S346.硫与汞的反应S+Hg==== HgS47.硫与氧气的反应S+O2==== SO248.硫与氢气的反应S+H2==== H2S49.硫与氢氧化钠的反应3S+6NaOH==== 2Na2S+Na2SO3+3H2O50.硫与浓硫酸的反应S+2H2SO4(浓)==== 3SO2+2H2O51.黑火药点燃S+2KNO3+3C==== K2S+3CO2↑+N2↑52.二氧化硫(少量)与氢氧化钠的反应SO2+2NaOH==== Na2SO3+H2O二氧化硫(过量)与氢氧化钠的反应SO2+NaOH==== NaHSO353.二氧化硫与氢氧化钙的反应SO2+Ca(OH)2==== CaSO3↓+H2O54.二氧化硫与亚硫酸钙溶液的反应SO2+CaSO3+H2O ==== Ca(HSO3)255.二氧化硫与水的反应SO2+H2O==== H2SO356.二氧化硫与硫化氢的反应SO2+2H2S==== 3S↓+2H2O57.二氧化硫与氧气的反应2SO2+O2====== 2SO358.二氧化硫与过氧化钠的反应SO2+Na2O2==== Na2SO459.二氧化硫与氯水的反应SO2+ Cl2+2H2O==== H2SO4+2HCl60.三氧化硫与水的反应SO3+H2O==== H2SO461.亚硫酸与氧气的反应2H2SO3+O2==== 2H2SO462.亚硫酸钠与氧气的反应2Na2SO3+O2==== 2Na2SO463.浓硫酸与铜的反应2H2SO4(浓)+Cu==== CuSO4+SO2↑+2H2O64.浓硫酸与碳的反应2H2SO4(浓)+C==== CO2↑+2SO2↑+2H2O寿65.工业制备硫酸(初步) 4FeS2+11O2==== 8SO2+2Fe2O366.实验室制备硫酸(初步) Na2SO3+H2SO4(浓)==== Na2SO4+SO2↑+H2O67.硫化氢(少量)与氢氧化钠的反应H2S+2NaOH==== Na2S+2H2O硫化氢(过量)与氢氧化钠的反应H2S+NaOH==== NaHS+H2O68.硫化氢(少量)与氨气的反应H2S+2NH3==== (NH4)2S硫化氢(过量)与氨气的反应H2S+NH3==== NH4HS69.硫化氢与氧气(不足)的反应2H2S+O2==== 2S↓+2H2O 2H2S+O2==== 2S+2H2O 硫化氢与氧气(充足)的反应2H2S+3O2==== 2SO2+2H2O70.硫化氢与氯气的反应H2S+Cl2==== 2HCl+S↓71.硫化氢与浓硫酸的反应H2S+H2SO4(浓)==== S↓+SO2↑+2H2O72.硫化氢的制备FeS+H2SO4==== FeSO4+H2S↑73.电解饱和食盐水(氯碱工业) 2NaCl+2H2O==== 2NaOH+H2↑+Cl2↑74.电解熔融状态氯化钠(制单质钠) 2NaCl==== 2Na+Cl2↑75.海水制镁(1) CaCO3==== CaO+CO2(2) CaO+H2O==== Ca(OH)2(3) Mg2++2OH2-==== Mg(OH)2↓(4) Mg(OH)2+2HCl==== MgCl2+2H2O(5) MgCl2==== Mg+Cl2↑76.镁在空气中燃烧(与氧气的反应) 2Mg+O2==== 2MgO(与氮气的反应) 3Mg+N2==== Mg3N2(与二氧化碳的反应) 2Mg+CO2==== 2MgO+C77.镁与氯气的反应Mg+Cl2==== MgCl278.镁与水的反应Mg+2H2O==== Mg(OH)2+H2↑79.镁与盐酸的反应Mg+2HCl==== MgCl2+H2↑80.镁与氢离子的反应Mg+2H+==== Mg2++H2↑81.二氮化三镁与水的反应Mg3N2+6H2O==== 3Mg(OH)2↓+2NH3↑82.镁与溴水的反应(颜色退去) Mg+Br2==== MgBr2(产生气泡) Mg+2HBr==== MgBr2+H2↑83.溴与水的反应Br2+H2O==== HBr+HBrO84.溴与氢氧化钠的反应Br2+2NaOH==== NaBr+NaBrO+H2O85.溴与氢气的反应Br2+H2==== 2HBr86.溴与铁的反应3Br2+2Fe==== 2FeBr387.碘与铁的反应I2+Fe==== FeI288.溴与碘化钾的反应Br2+2KI==== 2KBr+I289.氯气与溴化钾的反应2KBr+Cl2==== 2KCl+Br2第四章90.硅与氧气的反应Si+O2==== SiO291.硅与氯气的反应Si+2Cl2==== SiCl492.硅与氢气的反应Si+2H2===== SiH493.二氧化硅与氟的反应Si+2F2==== SiF494.硅与碳的反应Si+C==== SiC95.硅与氢氧化钠溶液的反应Si+2NaOH+H2O==== Na2SiO3+2H2↑96.硅与氢氟酸的反应Si+4HF==== SiF4+2H2↑97.单质硅的制备(1.制备)SiO2+2C==== Si+2CO(2.提纯)Si+2Cl2==== SiCl4(3.提纯)SiCl4+2H2==== Si+4HCl98.二氧化硅与氢氧化钠的反应SiO2+2NaOH==== Na2SiO3+H2O99.二氧化硅与氧化钠的反应SiO2+Na2O==== Na2SiO3100.二氧化硅与碳酸钠的反应SiO2+Na2CO3==== Na2SiO3+ CO2↑101.二氧化硅与氧化钙的反应SiO2+CaO==== CaSiO3102.二氧化硅与碳酸钙的反应SiO2+CaCO3==== CaSiO3+CO2↑103.二氧化硅与氢氟酸的反应SiO2+4HF==== SiF4+2H2O104.硅酸的制备Na2SiO3+ CO2+H2O==== H2SiO3↓+ Na2CO3105.硅酸加热分解H2SiO3==== SiO2+H2O106.铝与氧气的反应4Al+3O2==== 2Al2O3107.铝与氯气的反应2Al+3Cl2==== 2AlCl3108.铝与盐酸的反应2Al+6HCl==== 2AlCl3+3H2↑109.铝与氢氧化钠的反应2Al+2NaOH+6H2O==== 2Na[Al(OH)4]+3H2↑110.铝与水的反应2Al+6H2O==== 2Al(OH)3+3H2↑111.铝与三氧化二铁的反应(铝热反应)2Al+Fe2O3==== 2Fe+Al2O3 112.铝与二氧化锰的反应(铝热反应)4Al+3MnO2==== 3Mn+2AlO3113.氧化铝与盐酸的反应Al2O3+6HCl==== 2AlCl3+3H2O114.氧化铝与氢氧化钠的反应Al2O3+2NaOH+3H2O==== 2Na[Al(OH)4]115.电解氧化铝2Al2O3==== 4Al+3O2↑116.硫酸与与一水合氨的反应Al2(SO4)3+6NH3?H2O==== 2Al(OH)3↓+3(NH4)2SO4 117.氯化铝与一水合氨的反应AlCl3+3NH3?H2O==== Al(OH)3↓+3NH4Cl118.氯化铝与氢氧化钠(少量)的反应AlCl3+3NaOH==== Al(OH)3↓+3NaCl119.氢氧化铝与氢氧化钠的反应Al(OH)3+NaOH==== Na[Al(OH)4]120.氯化铝与氢氧化钠(过量)的反应AlCl3+4NaOH==== Na[Al(OH)4]+3NaCl121.四羟基合氯酸钠与盐酸(少量)的反应Na[Al(OH)4]+HCl==== Al(OH)3↓+NaCl+H2O 122.氢氧化铝与盐酸的反应Al(OH)3+3HCl==== AlCl3+3H2O123.四羟基合氯酸钠与盐酸(过量)的反应Na[Al(OH)4]+4HCl==== AlCl3+NaCl+4H2O 124.四羟基合氯酸钠与氯化铝的反应3Na[Al(OH)4]+AlCl3==== 4Al(OH)3↓+3NaCl 125.向四羟基合氯酸钠中通入过量二氧化碳Na[Al(OH)4]+CO2==== Al(OH)3↓+NaHCO3 126.铜在潮湿空气中被腐蚀2Cu+O2+H2O+CO2==== Cu2(OH)2CO3127.铜与氧气的反应2Cu+O2==== 2CuO128.铜与氯气的反应Cu+Cl2==== CuCl2129.铜氧化在高温下转化4CuO==== 2Cu2O+O2↑130.硫酸铜与水的反应CuSO4+5H2O==== CuSO4?5H2O附件列表:。
在氧气中燃烧的化学方程式

在氧气中燃烧的化学方程式
燃烧是人们日常生活中的一项重要活动,常见的燃烧物包括燃料、木材等,这
些物质在进行燃烧时会吸收大量的氧气。
其中,在氧气中燃烧的化学方程式为:碳(C)+氧(O2)=二氧化碳(CO2),而水(H2O)=氧气(O2)+氢气(H2)。
燃烧是物质形态发生变换过程,物质形态发生变换这一过程,是一种热化学反应,即物质中能量急剧升高,燃烧反应式中最后产生的排出物,一般是CO2和H2O。
据不同的燃料形状,其化学反应的幅度也不尽相同。
燃烧反应也是定义能源的核心,即物质经由燃烧而有效地释放出能量,其中
CO2和H2O分别是燃烧过程中的产物物质。
燃烧的实践活动不仅是单纯的能量和物质的转化过程,同时展示了大自然的奇妙,表现了人类对一切事物的探索和控制。
燃烧过程并非每一个人都参与,但它仍然成为日常生活中必不可少的一环,如烹饪、焙烧、蒸汽发动机等,都是燃烧反应的产物。
在氧气中燃烧的化学方程式中,碳含有丰富的能量,它一经燃烧就会瞬间释放
出它蕴藏的能量,引发巨大的热量作用,而最后产生的CO2就会进入大气,回归自然之中。
总之,燃烧反应是一种十分重要的物理化学反应方式,它不仅改变了物质的形态,同时也释放出丰厚的能量。
而在氧气中燃烧的产物学方程式是反应中最重要的组成部分,是控制及调节燃烧过程的根本手段。
常见的化学反应方程式

常见的化学反应方程式(1)单质与氧气的反应(化合反应):镁在空气中燃烧:铁在氧气中燃烧:铜在空气中加热:铝在空气中燃烧:氢气在空气中燃烧:红磷在空气中燃烧:硫粉在空气中燃烧:碳在空气中燃烧:碳在空气中不充分燃烧:(2)化合物与氧气的反应:一氧化碳在氧气中燃烧:甲烷在空气中燃烧:酒精在空气中燃烧:水在直流电的作用下分解:加热高锰酸钾:碳酸不稳定分解:加热氧化汞:分解过氧化氢制取氧气:高温煅烧石灰石:氢气还原氧化铜:木炭还原氧化铜:焦炭还原氧化铁:一氧化碳还原氧化铜:一氧化碳还原氧化铁:(1)金属单质+酸==盐+氢气(置换反应)锌和稀硫酸反应:铁和稀硫酸反应:镁和稀硫酸反应:铝和稀硫酸反应:锌和稀盐酸反应:铁和稀盐酸反应:镁和稀盐酸反应:铝和稀盐酸反应:(2)金属单质+盐(溶液)==另一种金属+另一种盐铁和硫酸铜溶液反应:锌和硫酸铜溶液反应:铜和硝酸汞溶液反应:(3)碱性氧化物+酸==盐+水氧化铁和稀盐酸反应:氧化铁和稀硫酸反应:氧化铜和稀盐酸反应:氧化镁和稀硫酸反应:氧化钙和稀盐酸反应:(4)酸性氧化物+碱==盐+水苛性钠暴露在空气中变质:苛性钠吸收二氧化硫气体:苛性钠吸收三氧化硫气体:消石灰放在空气中变质:消石灰吸收二氧化硫:(5)酸+碱==盐+水盐酸和烧碱起反应:盐酸和氢氧化钾反应:盐酸和氢氧化铜反应:盐酸和氢氧化钙反应:盐酸和氢氧化铁反应:氢氧化铝药物治疗胃酸过多:硫酸和烧碱反应:硫酸和氢氧化钾反应:硫酸和氢氧化铜反应:硫酸和氢氧化铁反应:硝酸和烧碱反应:(6)酸+盐==另一种酸+另一种盐大理石与稀盐酸反应:碳酸镁与稀盐酸反应:盐酸和硝酸银溶液反应:硫酸和碳酸钠反应:硫酸和氯化钡溶液反应:(7)碱+盐==另一种碱+另一种盐氢氧化钠与硫酸铜:氢氧化钠与氯化铁:氢氧化钠与氯化镁:氢氧化钠与氯化铜:氢氧化钙与碳酸钠:(8)盐+盐==两种新盐氯化纳溶液和硝酸银溶液:硫酸钠和氯化钡:二氧化碳溶解于水:生石灰溶于水:氧化钠溶于水:三氧化硫溶于水:硫酸铜晶体受热分解:无水硫酸铜作于干燥剂:。
初高中化学方程式总结

一、初中化学方程式总结二、高中化学方程式总结一.钠Na4Na+O2=2Na2O 2Na+O2点燃Na2O2Cl2+2Na点燃2NaCl 2Na+S=Na2S(爆炸)2Na+2H2O=2NaOH+H2↑Na2O+H2O=2NaOH2Na2O+O2△2Na2O2 Na2O+CO2=Na2CO3 Na2O+2HCl=2NaCl+H2O2Na2O2+2H2O=4NaOH+O2↑2Na2O2+2CO2=2Na2CO3+O2 NaHCO3+HCl=NaCl+H2O+CO2↑Na2CO3+2HCl=2NaCl+CO2↑+H2O2NaHCO3△2CO3+CO2↑+H2O(固体)NaHCO3 +NaOH=Na2CO3+H2O(溶液)Na2CO3++CO2+H2O=2NaHCO3二、镁Mg2Mg+O2点燃2MgO Mg+Cl2点燃MgCl22Mg+CO2点燃2MgO+C3Mg+N2=Mg3N2Mg+2HCl=MgCl2+H2↑Mg+H2SO4=MgSO4+H2↑MgO+2HCl=MgCl2+H2O Mg(OH)2+2HCl=MgCl2+2H2OMg3N2+8H2O=3Mg(OH)2↓+2NH3·H2O三、铝AlAl+3O2点燃2Al2O32Al+Fe2O3高温Al2O3+2Fe(铝热反应)2Al+6HCl=2AlCl3+3H2↑2Al+3H2SO4=Al2(SO4)3+3H2↑2Al+2NaOH+2H2O=2NaAlO2+3H2↑Al2O3+3H2SO4=Al2(SO4)3+3H2OAl2O3+2NaOH=2NaAlO2+H2O Al(OH)3+3HCl=AlCl3+3H2O 2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O Al(OH)3+NaOH=NaAlO2+2H2O AlCl3+3NaOH=Al(OH)3↓+3NaClAlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl(实验室制Al(OH)3)2Al(OH)3△Al2O3+3H2O四、铁Fe2Fe+3Cl2点燃2FeCl33Fe+2O2点燃Fe3O4Fe+S△3Fe+4H2O(g)高温Fe3O4+4H2Fe+2HCl=FeCl2+H2↑Fe3O4+8HCl(浓)△2+2FeCl3+4H2O 4Fe(OH)2+O2+2H2O=4Fe(OH)32Fe(OH)3△Fe2O3+3H2O 2FeCl2+Cl2=2FeCl32FeCl3+Fe=3FeCl22FeCl3+Cu=2FeCl2+CuCl2(用于雕刻印刷电路板)2FeCl3+2KI=2FeCl2+2KCl+I2 FeCl3+3NH3·H2O=Fe(OH)3↓+3NH4Cl五、其它金属2KMnO4△2MnO4+MnO2+O2↑2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2OMnO2+4HCl(浓)△2+Cl2↑+2H2O2Cu+O2△2CuO2Cu+S△Cu2SCu+Cl2CuCl2 Cu(OH)2△CuO+H2O CuCl2+2NaOH=Cu(OH)2↓+2NaClCuSO4+2NaOH=Cu(OH)2↓+Na2SO4CuSO4+Ba(OH)2=Cu(OH)2↓+BaSO4↓六、氯气Cl 2 Cl 2+2Na2NaCl 3Cl 2+2Fe2FeCl 3 Cl 2+CuCuCl 2Cl 2+2FeCl 2=2FeCl 3 2Cl 2+2NaBr =2NaCl+Br 2 Cl 2+2NaOH =NaCl+NaClO+H 2O2Cl 2+2Ca(OH)2=CaCl 2+Ca(ClO)2+2H 2O (漂白粉的制取) 3Cl 2+6KOH(热、浓)=5KCl+KClO 3+3H 2OCa(ClO)2+CO 2+H 2O =2HClO +Ca 2CO 3↓(漂白粉漂白原理) 4HCl(浓)+MnO 2 △2+Cl 2↑+2H 2O (实验室制Cl 2) 16HCl+2KMnO 4=2KCl+2MnCl 2+5Cl 2↑+8H 2O 14HCl+K 2Cr 2O 7=2KCl+2CrCl 3+3Cl 2+7H 2OHCl+NH 3=NH 4Cl (白烟) HClO=HCl+O 2↑ F 2+H 2=2HF Cl 2+H 2=2HCl (光照或点燃) Br 2+H 2△2HBr I 2+H 22HI2F 2+2H 2O =4HF+O 2 Cl 2+H 2O =HCl+H Cl O Br 2+H 2O =HBr+HBrO 4HF+SiO 2=SiF 4↑+2H 2O Cl 2+2KI =2KCl+I 2 Br 2+NaI =NaBr+I 2 Br 2+HI =HBr+I 2 Br 2+NaOH =NaBr+NaBrO+H 2O 2HI+Cl 2=2HCl+I 2 七、氮N 2+3H 2 2NH 3 N 2+3Mg 点燃Mg 3N 2 N 2+O 22NO2NO+O 2=2NO 2 3NO 2+H 2O =2HNO 3+NO 4NH 3+5O 2 催化剂△ 4NO+6H 2O4NH 3+6NO 催化剂△ 5N 2+6HO (用氨清除NO ) NH 3+HCl =NH 4Cl (白烟)NH 3+HNO 3=NH 4NO 3(白烟) 2NH 3+H 2SO 4=(NH 4)2SO 4 2NH 3+SO 2+H 2O =(NH 4)2SO 3 NH 3·H 2O△NH 3↑+H 2ONH 3+H 2O NH 3·H 2O NH 4++OH -NH 4HCO 3=NH 3+H 2O+CO 2 (NH 4)2CO 3=2NH 3↑+H 2O+CO 2↑ NH 4Cl =NH 3+HCl 2NH 4Cl+Ca(OH)2 △CaCl 2+NH 3↑+H 2O (铵盐与碱固体实验室制NH 3)NH 4Cl+NaOH△3↑+H 2ONH 3+NaCl+H 2O+CO 2=NaHCO 3↓+NH 4Cl (侯氏制碱法) 4HNO 3(浓)+C △2↑+4NO 2↑+2H 2O 4HNO 3(稀)+Cu===Cu(NO 3)2+2NO ↑+2H 2O8HNO 3(稀)+3 Cu (过量)===3 Cu (NO 3)2+2NO ↑+4H 2O 4HNO 3=4NO 2+O 2+2H 2O (见光或受热分解) 八 碳 2C+O 2(少量)点燃2CO C+O 2(足量)点燃CO 2 2CO+O 2点燃2CO 2C+CO 2△2CO C+H 2O高温CO+H 2(生成水煤气) C+Si△SiC (金刚砂)2C+SiO 2△Si+2CO (制得粗硅) CO+CuO △Cu+CO 2 3CO+Fe 2O 3 △2Fe+3CO 2催化剂 高温、高压CO+H 2O 催化剂 △CO 2+H 2 CO 2+2Mg点燃2MgO+CCO 2+2NaOH(过量)=Na 2CO 3+H 2O CO 2(过量)+NaOH =NaHCO 3CO 2+Ca(OH)2(过量)=CaCO 3↓+H 2O 2CO 2(过量)+Ca(OH)2=Ca(HCO 3)2CO 2+2NaAlO 2+3H 2O =2Al(OH)3↓+Na 2CO 3 SiO 2+CaO 高温CaSiO 3 SiO 2+2NaOH =Na 2SiO 3+H 2O (常温下强碱缓慢腐蚀玻璃) 4HF+SiO 2=SiF 4↑+2H 2OSiO 2+Na 2CO 3 高温 Na 2SiO 3+CO 2 SiO 2+CaCO 3高温CaSiO 3+ CO 2 九、氧 O 2+2H 2点燃2H 2O O 2+KKO 2 2O 2+3Fe 点燃 Fe 3O 4 O 2+S 点燃SO 2O 2+N 22NO 4P+5O 2 点燃 2P 2O 5 2C+O 2(少量) 点燃2CO C+O 2(足量)点燃CO 2 4Na+O 2=2Na 2O 2Na 2O+O 2 △2Na 2O 2 2Na+O 2 △ 2O 2 2Mg+O 2 点燃 2MgO 4Al+3O 2点燃2Al 2O 3 4NH 3+5O 2 催化剂△ 4NO+6H 2O 2SO 2+O 22SO 3 2CO+O 2点燃2CO 26FeO+O 2 △2Fe 3O 4 2H 2SO 3+O 2=2H 2SO 4 4Fe(OH)2+O 2+2H 2O =4Fe(OH)33O 22O 3 2H 2O 电解 2H 2↑+O 2 3Fe+4H 2O(g) 高温Fe 3O 4+4H 2 2H 2O 2=2H 2O+O 2↑ S+H 2 △2S 2S+C △CS 2 S+Fe △FeS S+2Cu △ 2S 3S+2Al △ Al 2S 3 S+Zn △ ZnS SO 2+2H 2S =3S+2H 2O 2H 2SO 3+O 2=2H 2SO 4 H 2SO 3+H 2O 2=H 2SO 4+H 2O H 2SO 3=H 2O+SO 2↑ Zn+H 2SO 4=ZnSO 4+H 2↑ Fe+H 2SO 4=FeSO 4+H 2↑ 2H 2SO 4(浓)+C△CO 2↑+2SO 2↑+2H 2O 2H 2SO 4(浓)+S =3SO 2↑+2H 2O6H 2SO 4(浓)+2Fe =Fe 2(SO 4)3+3SO 2↑+6H 2O 2H 2SO 4(浓)+Cu △4+SO 2↑+2H 2O。
高中化学五大反应方程式整理

高中化学五大反应方程式整理 经过初中的学习,学生对化学这一学科有了基础的了解。
但针对高中化学学习,大部分学生还茫然无措。
下面是小编整理的高中化学五大反应方程式整理,希望对大家有所帮助。
高中化学五大反应方程式整——物质与氧气的反应: 1. 镁在空气中燃烧:2Mg + O2 点燃2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43. 铜在空气中受热:2Cu + O2 加热2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃2H2O6. 红磷在空气中燃烧:4P + 5O2 点燃2P2O57. 硫粉在空气中燃烧:S + O2 点燃SO28. 碳在氧气中充分燃烧:C + O2 点燃CO29. 碳在氧气中不充分燃烧:2C + O2 点燃2CO 高中化学五大反应方程式整理——几个分解反应: 1. 水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑2.加热碱式碳酸铜:Cu2(OH)2CO3 加热2CuO + H2O + CO2↑3.加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑4.加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑5.碳酸不稳定而分解:H2CO3 === H2O + CO2↑6.高温煅烧石灰石:CaCO3 高温CaO + CO2↑ 高中化学五大反应方程式整理——几个氧化还原反应: 1. 氢气还原氧化铜:H2 + CuO 加热Cu + H2O2. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑3.焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑4.焦炭还原四氧化三铁:2C+ Fe3O4 高温3Fe + 2CO2↑5.一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO26. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温2Fe + 3CO27. 一氧。
高中化学方程式大全 高考化学必背重点公式

高中化学方程式大全高考化学必背重点公式高中化学必背公式总结1.碳与氧气(不足)的反应2C+O2==== 2CO碳与氧气(充足)的反应C+O2==== CO22.一氧化碳与氧气的反应2CO+O2==== 2CO23.二氧化碳与碳的反应CO2+C==== 2CO4.碳酸氢钠与盐酸的反应NaHCO3+HCl==== NaCl+H2O+CO2↑5.碳酸钠与盐酸的反应Na2CO3+ 2HCl==== 2NaCl+ H2O+CO2↑6.碳酸钙与盐酸的反应CaCO3+2HCl==== CaCl2+ H2O+ CO2↑7.碳酸氢钠与氢氧化钠的反应NaHCO3+NaOH==== Na2CO3 +H2O8.碳酸钠与氢氧化钙的反应Na2CO3+Ca(OH)2==== CaCO3↓+ 2NaOH9.碳酸氢钠(少量)与氢氧化钙的反应NaHCO3+ Ca(OH)2==== CaCO3↓+NaOH+ H2O碳酸氢钠(过量)与氢氧化钙的反应2NaHCO3+ Ca(OH)2==== CaCO3+Na2CO3+2H2O10.碳酸氢钠加热的反应2NaHCO3==== Na2CO3+ H2O+CO2↑11.碳酸氢钙加热的反应Ca(HCO3)2==== CaCO3↓+H2O+CO2↑12.碳酸钙加热的反应CaCO3==== CaO+CO2↑13.二氧化碳(过量)通入氢氧化钙溶液中的反应Ca(OH)2+2CO2==== Ca(HCO3)2二氧化碳(少量)通入氢氧化钙溶液中的反应Ca(OH)2+CO2==== CaCO3↓+H2O14.氮气与氧气的反应N2+O2==== 2NO15.一氧化氮与氧气的反应2NO+O2==== 2NO216.二氧化氮与水的反应3NO2+ H2O==== 2HNO3+ NO17.氮气与氢气的反应N2+3H2========= 2NH318.氨气与水的反应NH3+H2O==== NH3?H2O19.氨气与盐酸的反应NH3+HCl==== NH4Cl20.氨气与硫酸的反应2NH3+H2SO4==== (NH4)2SO421.氨气与强酸的离子的反应NH3+H+==== NH4+22.氨的催化氧化的反应4NH3+5O2====== 4NO+6H2O23.碳酸氢铵加热的反应NH4HCO3==== NH3↑+CO2↑+H2O24.氯化铵加热的反应NH4Cl==== NH3↑+HCl↑25.碳酸铵加热的反应(NH4)2CO3==== 2NH3↑+CO2↑+H2O26.氯化铵与氢氧化钙的反应2NH4Cl+ Ca(OH)2====CaCl2+2NH3↑+2H2O27.氯化铵与氢氧化钠的反应NH4Cl+ NaOH====NaCl+NH3↑+H2O28.碳酸氢铵与氢氧化钠的反应NH4HCO3+2NaOH====Na2CO3+NH3↑+2H2O29.碳酸氢铵与氢氧化钙的反应NH4HCO3+Ca(OH)2==== CaCO3↓+NH3↑+2H2O30.硝酸的分解的反应4HNO3========= 4NO2↑+O2↑+2H2O31.铜与浓硝酸的反应Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O32.铜与稀硝酸的反应3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O33.铁与浓硝酸的反应Fe+6HNO3(浓)====Fe(NO3)3+3NO2↑+3H2O34.铁与稀硝酸的反应Fe+4HNO3(稀)====Fe(NO3)3+NO↑+2H2O35.碳与浓硝酸的反应C+4HNO3(浓)==== CO2↑+4NO2↑+2H2O36.一氧化氮与一氧化碳的反应2NO+2CO====== N2+2CO237.一氧化氮与氧气和水的反应4NO+3O2+2H2O==== 4HNO338.二氧化氮与氧气和水的反应4NO2+O2+2H2O==== 4HNO339.氢氧化钠吸收二氧化氮和一氧化氮的反应2NaOH+NO2+NO==== 2NaNO2+ H2O40.氨气(过量)与氯气的反应8NH3+3Cl2==== 6NH4Cl+N2氨气(少量)与氯气的反应2NH3+3Cl2==== 6HCl+N241.二氧化氮生成四氧化二氮的反应2NO2==== N2O442.硫与铜的反应S+2Cu==== Cu2S43.硫与铁的反应S+Fe==== FeS44.硫与钠的反应S+2Na==== Na2S45.硫与铝的反应3S+2Al==== Al2S346.硫与汞的反应S+Hg==== HgS47.硫与氧气的反应S+O2==== SO248.硫与氢气的反应S+H2==== H2S49.硫与氢氧化钠的反应3S+6NaOH==== 2Na2S+Na2SO3+3H2O50.硫与浓硫酸的反应 S+2H2SO4(浓)==== 3SO2+2H2O高中化学怎么学1、准确记忆基本的概念、理论和规律教材中所有重要的概念和定义,不仅要完整准确地记住,而且要以其内涵和外延来深刻理解和把握,不能根据自己的兴趣随意更改。
化学方程式及现象汇总

化学方程式及现象
一、物质与氧气的反应:
1、单质与氧气的反应:
①镁在空气中燃烧:
现象:
②铁在氧气中燃烧:
现象:
③铜在空气中受热:
现象:
④铝在氧气中燃烧:
现象:
⑤氢气在空气中燃烧:
现象:
⑥红磷在空气中燃烧:
现象:
⑦硫粉在空气中燃烧:
现象:
⑧碳在氧气中充分燃烧:
现象:
⑨碳在氧气中不充分燃烧:
现象:
2、化合物与氧气的反应:
①一氧化碳在氧气中燃烧:
现象:
②甲烷在空气中燃烧:
现象:
③乙炔燃烧:
④酒精在空气中燃烧:
小结:碳氢化合物燃烧一般生成CO2和H2O
二、生成氧气的几个分解反应:
①过氧化氢分解制取氧气(MnO2作催化剂):
②加热氯酸钾(MnO2作催化剂)制取氧气:
③加热高锰酸钾制取氧气:
④水在直流电的作用下分解:
三、与二氧化碳有关的几个反应:
①二氧化碳与水反应:
②碳酸不稳定而分解:
③二氧化碳与澄清石灰水反应:
④二氧化碳与氢氧化钠反应:
⑤石灰石与稀盐酸反应:
⑥饱和碳酸钠溶液与浓盐酸反应:
⑦饱和碳酸钠溶液与硫酸反应:
⑧碳酸氢钠溶液与硫酸反应:
⑨碳酸氢钠溶液与盐酸反应:
⑩镁在二氧化碳中燃烧:
四、几个作业中出现过的常见反应:
①无水硫酸铜与水反应:
②硫酸铜晶体受热分解:
③氢氧化钠与硫酸铜反应:
④钠在氯气中燃烧:
⑤氢气还原氧化铜:
⑥一氧化碳还原氧化铁:
⑦呼吸作用的表达式:
⑧光合作用的表达式:。
高中化学各反应公式

高中化学各反应公式1.氧化还原反应:氧化还原反应是指物质中的电子转移过程。
反应中氧化剂得到电子,另一物质则失去电子,称为还原剂。
常见的氧化还原反应包括:-燃烧反应:燃料与氧气反应生成二氧化碳和水。
例如:C3H8+5O2→3CO2+4H2O-金属与非金属氧化物反应:金属与非金属氧化物反应生成金属氧化物。
例如:2Mg+O2→2MgO-金属与酸反应:金属与酸反应生成盐和氢气。
例如:Zn+2HCl→ZnCl2+H22.酸碱反应:酸碱反应是指酸与碱反应生成盐和水的化学反应。
常见的酸碱反应包括:-酸与碱反应:酸和碱的中和反应。
例如:HCl+NaOH→NaCl+H2O-酸与金属碱反应:酸与金属碱反应生成盐和水。
例如:2HCl+Mg(OH)2→MgCl2+2H2O-酸与碳酸盐反应:酸与碳酸盐反应生成盐、水和二氧化碳。
例如:H2SO4+CaCO3→CaSO4+H2O+CO23.氧化反应:氧化反应是指物质中的氧原子数增加的反应。
常见的氧化反应包括:-金属与氧气反应:金属与氧气反应生成金属氧化物。
例如:2Mg+O2→2MgO-非金属与氧气反应:非金属与氧气反应生成氧化物。
例如:C+O2→CO2-有机物的燃烧反应:有机物与氧气反应生成二氧化碳和水。
例如:C3H8+5O2→3CO2+4H2O4.还原反应:还原反应是指物质中的氧原子数减少的反应。
常见的还原反应包括:-金属与非金属氧化物反应:金属与非金属氧化物反应生成金属。
例如:2Fe2O3+3C→4Fe+3CO2-金属与酸反应:金属与酸反应生成氢气。
例如:Zn+2HCl→ZnCl2+H2-还原剂还原反应:还原剂失去电子,被氧化剂得到电子。
例如:2Na+Cl2→2NaCl5.沉淀反应:沉淀反应是指反应物中溶解度较低的产物在溶液中析出而生成的反应。
常见的沉淀反应包括:-阴离子交换反应:两种溶液中有交换离子的反应。
例如:AgNO3+NaCl→AgCl↓+NaNO3-阳离子交换反应:两种溶液中有交换离子的反应。
氧气与常见物质发生的反应
镁
镁在空气中燃烧,发出耀眼的白光、放热、生成白色固体物质
2Mg+O2 2MgO
铜
红色的固体逐渐变成黑色固体(用来除O2)
2Cu+O2 2CuO
汞
银白色液体逐渐变成红色பைடு நூலகம்质
2Hg+O2 2HgO
一氧化碳
纯净CO的产生蓝色火焰,放热,生成能使澄清石灰水变浑浊的气体
2CO+O2 2CO2
S+ O2 SO2
氢气
①纯净的氢气在空气中燃烧,产生淡蓝色火焰,
放热、生成能使白色无水硫酸铜变蓝的液体
2H2+O2 2H2O
铁
铁在氧气中剧烈燃烧,火星四射,放热,生成黑色固体物质
3Fe+2O2 Fe3O4
铝
铝在氧气中燃烧,发出耀眼的白光,放热,生成白色固体物质
4Al+3O2 2Al2O3
铝在空气中与氧气反应,表面形成致密的氧化膜
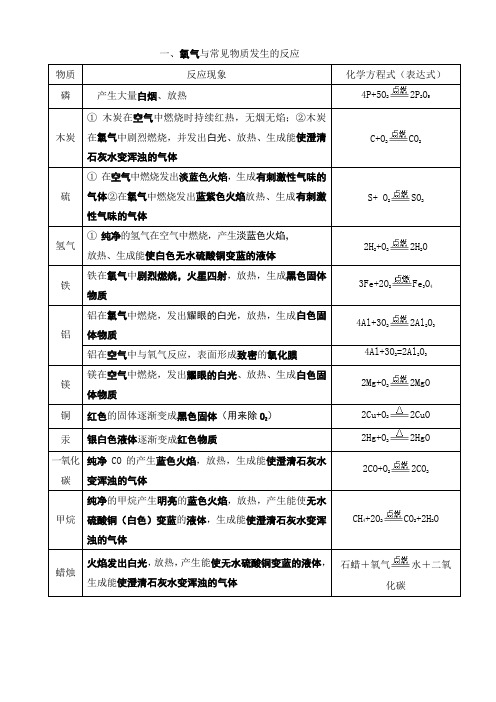
一、氧气与常见物质发生的反应
物质
反应现象
化学方程式(表达式)
磷
产生大量白烟、放热
4P+5O2 2P2O5
木炭
①木炭在空气中燃烧时持续红热,无烟无焰;②木炭在氧气中剧烈燃烧,并发出白光、放热、生成能使澄清石灰水变浑浊的气体
C+O2 CO2
硫
①在空气中燃烧发出淡蓝色火焰,生成有刺激性气味的气体②在氧气中燃烧发出蓝紫色火焰放热、生成有刺激性气味的气体
甲烷
纯净的甲烷产生明亮的蓝色火焰,放热,产生能使无水硫酸铜(白色)变蓝的液体,生成能使澄清石灰水变浑浊的气体
CH4+2O2 CO2+2H2O
化学方程式汇总+文字表达式

化学方程式汇总一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2点燃 2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹照明弹镁+氧气→氧化镁2. 铁在氧气中燃烧:3Fe + 2O2点燃 Fe3O4剧烈燃烧、火星四射、生成黑色固体、放热(4Fe + 3O2△2Fe2O3) 铁+氧气→四氧化三铁3. 铜在空气中受热:2Cu + O2加热 2CuO 红色金属变为黑色固体铜+氧气→氧化铜4. 铝在空气中燃烧:4Al + 3O2 2Al2O3银白金属变为白色固体铝+氧气→氧化铝5. 氢气中空气中燃烧:2H2+ O2点燃 2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料、最理想的燃料(资源丰富,热值高,无污染).6. 红磷在空气中燃烧:4P + 5O2点燃 2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量烟幕弹发令枪子弹磷—+氧气→五氧化二磷7. 硫粉在空气中燃烧: S + O2点燃 SO2剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰,.氧气中蓝紫色火焰硫+氧气→二氧化硫8. 碳在氧气充分时燃烧:C + O2点燃 CO2剧烈燃烧、白光、放热、使石灰水变浑浊碳+氧气→二氧化碳9. 碳在氧气不充分时燃烧:2C + O2点燃2CO 产生能量少,污染大;煤炉中常见反应、生成物是空气污染物之一、煤气中毒原因碳+氧气→一氧化碳(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2点燃 2CO2CO还原金属氧化物实验中,尾气处理的反应一氧化碳+氧气→二氧化碳11. 甲烷在空气中燃烧:CH4 + 2O2点燃 CO2+ 2H2O 明亮的蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧甲烷+氧气→二氧化碳+水12. 酒精在空气中燃烧:C2H5OH + 3O2点燃 2CO2+ 3H2O 清洁能源、绿色能源酒精+氧气→二氧化碳+水13.光合作用:6H2O +6 CO2光照C6H12O6+O2↑二氧化碳+水→葡萄糖+氧气14.呼吸作用:C6H12O6+O2呼吸6H2O +6 CO2↑葡萄糖+氧气→二氧化碳+水二.几个分解反应:15. 水在直流电的作用下分解:2H2O 通电 2H2↑+ O2↑初中唯一的一个条件为“通电”的反应。
【高中化学】化学物质反应现象的化学方程式

【高中化学】化学物质反应现象的化学方程式2mg+o22mgo剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O 22hgo银白色液体形成红色固体拉瓦丁的实验2cu+o22cuo红色金属变为黑色固体4Al+3o22al 2O 3银白色金属变成白色固体3fe+2o2fe3o4剧烈燃烧、火星四射、生成黑色固体、放热C+O2剧烈燃烧,发出白光,释放热量,使石灰水浑浊s+o2so2剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2h2+o22h2o浅蓝色火焰放热,产生液体(水)高能燃料,使无水CuSO4变为蓝色4p+5o22p2o5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2o22h2o+CO2蓝色火焰,热量释放,产生使石灰水浑浊的气体,以及使无水硫酸铜呈蓝色的液态(水)甲烷和天然气2c2h2+5o22h2o+4co2蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水cuso4变蓝的液体(水)氧炔焰、焊接切割金属2kclo32kcl+3O2↑ 产生气体,用火星重新点燃木条,并在实验室制备氧气2kmno4k2mno4+mno2+o2↑紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2hgo2hg+O2↑ 红色变成银白色,并产生一种气体,用火星重建木条。
拉瓦丁实验2h2o2h2↑+o2↑水通电分解为氢气和氧气电解水Cu2(OH)2co32cuo+H2O+CO2↑ 绿色变黑,试管壁上有液体,石灰水变浑浊,气体用铜绿色加热nh4h co3nh3↑+h2o+co2↑白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+H2SO4==ZnSO4+H2↑ 产生大量气泡,锌颗粒逐渐溶解。
氢是在实验室制备的fe+h2so4==feso4+h2↑有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4==MgSO4+H2↑ 产生大量气泡,金属颗粒逐渐溶解2al+3h2so4==al2(so4)3+3h2↑有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3h22fe+3H2O红色逐渐变成银白色,试管壁具有液态熔炼金属和氢气的还原性fe3o4+4h23fe+4h2o黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性wo3+3h2w+3h2o的还原性&钨冶炼与氢利用moo3+3h2mo+3h2o冶炼金属钼、利用氢气的还原性2Na+cl22nacl强烈燃烧,形成黄焰离子化合物h2+cl22hcl苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2naoh=Cu(OH)2↓ + Na2SO4蓝沉淀,上半部分为澄清溶液质量守恒定律实验 2c+o22co煤炉中常见反应、空气污染物之一、煤气中毒原因2CO+o22co2蓝色火焰气体燃烧c+cuo2cu+co2↑黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2fe2o3+3c4fe+3co2↑ 冶炼金属fe3o4+2c3fe+2co2↑冶炼金属c+co22coco2+h2o==h2co3碳酸使石蕊变红证明碳酸的酸性H2co3co2↑ + H2O石蕊红褪色ca(oh)2+co2==caco3↓+h2o澄清石灰水变浑浊应用co2检验和石灰浆粉刷墙壁CaCO 3+H 2O+CO 2==Ca(HCO 3)2白色沉淀物逐渐溶解,形成溶洞,岩石风化ca(hco3)2caco3↓+h2o+co2↑白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2nahco3na2co3+H2O+CO2↑ 产生一种气体,使澄清的石灰水浑浊。
单质与氧气的反应的化学方程式

(1)金属与氧气反应:镁在空气中燃烧:2Mg + O2 点燃 2MgO铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4铜在空气中受热:2Cu + O2 加热 2CuO铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质 + 酸 -------- 盐 + 氢气(置换反应)锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质 + 盐(溶液) ------- 新金属 + 新盐铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg (3)金属铁的治炼原理:3CO+ 2Fe2O3 高温4Fe + 3CO2↑四、分解反应:1、水在直流电的作用下分解:2H2O2H2↑+ O2 ↑现象:(1)电极上有气泡产生。
H2:O2=2:1正极产生的气体能使带火星的木条复燃。
负极产生的气体能在空气中燃烧,产生淡蓝色火焰2、加热碱式碳酸铜:Cu2(OH)2CO32CuO + H2O + CO2↑现象:绿色粉末变成黑色,试管内壁有水珠生成,澄清石灰水变浑浊。
3、加热氯酸钾和二氧化锰制氧气:2KClO32KCl + 3O2 ↑4、加热高锰酸钾制氧气:2KMnO4K2MnO4 + MnO2 + O2↑5、实验室用双氧水制氧气: 2H2O22H2O + O2↑现象:有气泡产生,带火星的木条复燃。
高中常用氧化还原反应方程式

高中常用氧化还原反应方程式
在学习高中化学过程中,会接触到很多化学方程式,氧化还原反应也是高中重点考察的知识点。
下面小编整理了高中常用的氧化还原反应方程式,供大家参考!
1氧化还原反应方程式一.物质与氧气的反应:
(一)单质与氧气的反应:
1.镁在空气中燃烧:2Mg+O2点燃2MgO
2.铁在氧气中燃烧:3Fe+2O2点燃Fe3O4
3.铜在空气中受热:2Cu+O2加热2CuO
4.铝在空气中燃烧:4Al+3O2点燃2Al2O3
5.氢气中空气中燃烧:2H2+O2点燃2H2O
6.红磷在空气中燃烧:4P+5O2点燃2P2O5
7.硫粉在空气中燃烧:S+O2点燃SO2
8.碳在氧气中充分燃烧:C+O2点燃CO2
9.碳在氧气中不充分燃烧:2C+O2点燃2CO
(二)化合物与氧气的反应:
10.一氧化碳在氧气中燃烧:2CO+O2点燃2CO2
11.甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O
12.酒精在空气中燃烧:C2H5OH+3O2点燃2CO2+3H2O
二.几个分解反应:
13.水在直流电的作用下分2H2O通电2H2↑+O2↑
14.加热碱式碳酸铜:Cu2(OH)2CO3加热2CuO+H2O+CO2↑。
高中化学方程式大全 高考化学必背重点公式

高中化学方程式大全高考化学必背重点公式
很多人想知道高中化学有哪些重点公式,高考化学中常用的公式有哪些呢?下面小编为大家总结了一下,供参考了!
高中化学必背公式总结1.碳与氧气(不足)的反应2C+O2==== 2CO碳与氧气(充足)的反应C+O2==== CO2
2.一氧化碳与氧气的反应2CO+O2==== 2CO2
3.二氧化碳与碳的反应CO2+C==== 2CO
4.碳酸氢钠与盐酸的反应NaHCO3+HCl==== NaCl+H2O+CO2↑
5.碳酸钠与盐酸的反应Na2CO3+ 2HCl==== 2NaCl+ H2O+ CO2↑
6.碳酸钙与盐酸的反应CaCO3+2HCl==== CaCl2+ H2O+ CO2↑
7.碳酸氢钠与氢氧化钠的反应NaHCO3+NaOH==== Na2CO3 +H2O
8.碳酸钠与氢氧化钙的反应Na2CO3+Ca(OH)2==== CaCO3↓+ 2NaOH
9.碳酸氢钠(少量)与氢氧化钙的反应NaHCO3+ Ca(OH)2==== CaCO3↓+NaOH+
H2O碳酸氢钠(过量)与氢氧化钙的反应2NaHCO3+ Ca(OH)2==== CaCO3+Na2CO3+2H2O
10.碳酸氢钠加热的反应2NaHCO3==== Na2CO3+ H2O+CO2↑
11.碳酸氢钙加热的反应Ca(HCO3)2==== CaCO3↓+H2O+CO2↑
12.碳酸钙加热的反应CaCO3==== CaO+CO2↑
13.二氧化碳(过量)通入氢氧化钙溶液中的反应Ca(OH)2+2CO2====
Ca(HCO3)2二氧化碳(少量)通入氢氧化钙溶液中的反应Ca(OH)2+CO2==== CaCO3↓+H2O。
消耗氧气的化学反应方程式

消耗氧气的化学反应方程式
1. 燃烧反应
燃烧是一种常见的消耗氧气的化学反应。
在燃烧过程中,可燃物质(如木材、煤、天然气等)与氧气发生反应,释放出热量和产生新的物质。
例如:
C(固体) + O2(气体) → CO2(气体)
(碳 + 氧气→ 二氧化碳)
2. 呼吸作用
呼吸作用是生物体内的一种代谢过程,需要消耗氧气。
在这个过程中,葡萄糖与氧气发生反应,产生二氧化碳、水和能量。
C6H12O6(固体) + 6O2(气体) → 6CO2(气体) + 6H2O(液体) + 能量 (葡萄糖 + 氧气→ 二氧化碳 + 水 + 能量)
3. 金属氧化反应
许多金属在与氧气接触时会发生氧化反应,形成氧化物。
这种反应也消耗了氧气。
4Fe(固体) + 3O2(气体) → 2Fe2O3(固体)
(铁 + 氧气→ 铁氧化物)
4. 电池反应
一些电池的工作原理就是基于消耗氧气的化学反应。
例如,锌-空气
电池中的阴极反应:
2Zn(固体) + O2(气体) → 2ZnO(固体)
(锌 + 氧气→ 氧化锌)
以上是一些常见的消耗氧气的化学反应方程式,它们广泛存在于我们的日常生活中。
通过这些反应,氧气被消耗并产生新的物质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学物质与氧气的反应常见方程式
物质与氧气的反应是化学反应中最常见的,物质与
氧气的反应常见方程式新鲜出炉,请大家认真学习牢记。
(1)单质与氧气的反应:
1.镁在空气中燃烧:2Mg+O2点燃2MgO
2.铁在氧气中燃烧:3Fe+2O2点燃Fe3O4
3.铜在空气中受热:2Cu+O2加热2CuO
4.铝在空气中燃烧:4Al+3O2点燃2Al2O3
5.氢气中空气中燃烧:2H2+O2点燃2H2O
6.红磷在空气中燃烧:4P+5O2点燃2P2O5
7.硫粉在空气中燃烧:S+O2点燃SO2
8.碳在氧气中充分燃烧:C+O2点燃CO2
9.碳在氧气中不充分燃烧:2C+O2点燃2CO
(2)化合物与氧气的反应:
10.一氧化碳在氧气中燃烧:2CO+O2点燃2CO2
11.甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O
12.酒精在空气中燃烧:C2H5OH+3O2点燃2CO2+3H2O
相信大家已经掌握了高中化学物质与氧气的反应常见
方程式,在书写时一定要注意反应的条件不要忘记。
第 1 页。
