高一化学元素周期表3
高一化学《元素周期表》
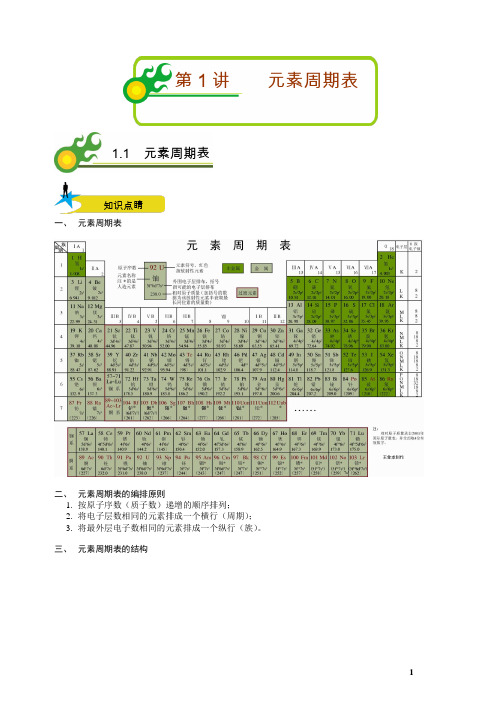
第1讲元素周期表1.1 元素周期表知识点睛一、元素周期表二、元素周期表的编排原则1.按原子序数(质子数)递增的顺序排列;2.将电子层数相同的元素排成一个横行(周期);3.将最外层电子数相同的元素排成一个纵行(族)。
三、元素周期表的结构⎧⎧⎧⎪⎪⎪⎨⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎨⎧⎪⎪⎪⎪⎪⎪⎪⎨⎪⎨⎪⎪⎪⎪⎪⎩⎩⎧⎪⎪⎨⎪⎪⎩⎩:2:8:8:18:18:32::IA ~VIIA 7:IIIB ~VIIB IB ~IIB 7VIII VIIB IB 第一周期种元素短周期第二周期种元素第三周期种元素周期第四周期种元素第五周期种元素长周期第六周期种元素第七周期未填满(又称不完全周期)主族共个主族副族、共个副族族第族:三个纵行,位于第族和第族之间零族:稀有气体⎪⎪⎪⎪⎪⎪⎪ 【总结】1.周期表中的相等关系 周期序数=电子层数主族族序数=最外层电子数=价电子数=最高正价数元素的原子序数=核电荷数=质子数=原子的核外电子数 2.元素周期表(记忆口诀):3.周期和族的表示方法(1)周期用大写数字直接表示即可,如:第四周期。
(2)主族:用罗马数字加A 表示,如:第IIA 族; 副族:用罗马数字加B 表示,如:第IVB 族。
4.由原子序数确定元素位置的规律记住每周期的元素的种数(2、8、8、18、18、32)以及稀有气体元素的原子序数(He 2、Ne 10、Ar 18、Kr 36、Xe 54、Rn 86),便于确定元素在元素周期表中的位置。
具体如下:①若比相应的稀有气体元素的原子序数多1或2,则应处在下周期的第IA 族或第IIA 族,如88号元素88862-=,则应在第七周期第IIA 族。
②若比相应的稀有气体元素少1~5时,则应处在同周期的第VIIA ~IIIA 族,如:84号元素84862-=-,则应在第六周期第VIA 族。
③若预测新元素,可与未发现的第七周期的稀有气体元素(118号元素)相比较,去推知它的位置; 如:114号元素1141184-=-,应在第七周期第IV A 族。
高中化学常见基本元素周期表

高中化学常见基本元素周期表第一周期1. 氢(H)- 原子序数:1,原子量:1.008,气态元素,常用于制造氢气。
2. 氦(He)- 原子序数:2,原子量:4.002,气态元素,广泛应用于气球和激光技术。
第二周期3. 锂(Li)- 原子序数:3,原子量:6.941,金属元素,用于制造锂电池和合金。
4. 铍(Be)- 原子序数:4,原子量:9.012,金属元素,用于制造合金和核反应堆。
5. 硼(B)- 原子序数:5,原子量:10.81,非金属元素,广泛应用于玻璃制造和化学反应。
6. 碳(C)- 原子序数:6,原子量:12.01,非金属元素,构成有机化合物的基础。
7. 氮(N)- 原子序数:7,原子量:14.01,非金属元素,构成大气中最主要的成分之一。
8. 氧(O)- 原子序数:8,原子量:16.00,非金属元素,氧气是生物呼吸的重要组成部分。
9. 氟(F)- 原子序数:9,原子量:19.00,非金属元素,广泛应用于制备氟化物和合成有机化合物。
第三周期10. 钠(Na)- 原子序数:11,原子量:22.99,金属元素,广泛应用于制备碱金属化合物。
11. 镁(Mg)- 原子序数:12,原子量:24.31,金属元素,用于制造合金和轻质材料。
12. 铝(Al)- 原子序数:13,原子量:26.98,金属元素,广泛应用于制造铝制品和建筑材料。
13. 硅(Si)- 原子序数:14,原子量:28.09,非金属元素,广泛应用于制造玻璃和半导体。
14. 磷(P)- 原子序数:15,原子量:30.97,非金属元素,广泛应用于农业肥料和化学反应。
15. 硫(S)- 原子序数:16,原子量:32.07,非金属元素,广泛应用于制备硫酸和制药工业。
16. 氯(Cl)- 原子序数:17,原子量:35.45,非金属元素,广泛应用于消毒和制备氯化物。
第四周期17. 钾(K)- 原子序数:19,原子量:39.10,金属元素,广泛应用于制备碱金属化合物。
化学元素周期表

第一周期元素:1 氢(qīng) 2 氦(hài) 第二周期元素:3 锂(lǐ) 4 铍(pí) 5 硼(pãng) 6 碳(tàn) 7 氮(dàn) 8 氧(yǎng) 9 氟(fú) 10 氖(nǎi)第三周期元素:11 钠(nà) 12 镁(měi) 13 铝(lǚ) 14 硅(guī) 15 磷(lín) 16 硫(liú) 17 氯(lǜ) 18 氩(yà)第四周期元素:19 钾(jiǎ) 20 钙(gài) 21 钪(kàng) 22 钛(tài) 23 钒(fán) 24 铬(gâ) 25 锰(měng) 26 铁(tiě) 27 钴(gǔ) 28 镍(niâ) 29 铜(tïng) 30 锌(xīn) 31 镓(jiā) 32 锗(zhě) 33 砷(shēn) 34 硒(xī) 35 溴(xiù) 36 氪(kâ)第五周期元素:37 铷(rú) 38 锶(sī) 39 钇(yǐ) 40 锆(gào) 41 铌(ní) 42 钼(mù) 43 锝(dã) 44 钌(liǎo) 45 铑(lǎo) 46 钯(bǎ) 47 银(yín) 48 镉(gã) 49 铟(yīn) 50 锡(xī) 51 锑(tī) 52 碲(dì) 53 碘(diǎn) 54 氙(xiān)第六周期元素:55 铯(sâ) 56 钡(bâi) 57 镧(lán) 58 铈(shì) 59 镨(pǔ) 60 钕(nǚ) 61 钷(pǒ) 62 钐(shān) 63 铕(yǒu) 64 钆(gá) 65 铽(tâ) 66 镝(dī) 67 钬(huǒ) 68 铒(ěr) 69 铥(diū) 70 镱(yì) 71 镥(lǔ) 72 铪(hā) 73 钽(tǎn) 74 钨(wū) 75 铼(lái) 76 锇(ã) 77 铱(yī) 78 铂(bï) 79 金(jīn) 80 汞(gǒng) 81 铊(tā) 82 铅(qiān) 83 铋(bì) 84 钋(pō) 85 砹(ài) 86 氡(dōng)第七周期元素:87 钫(fāng) 88 镭(lãi) 89 锕(ā) 90 钍(tǔ) 91 镤(pú) 92 铀(yïu) 93 镎(ná) 94 钚(bù) 95 镅(mãi) 96 锔(jú) 97 锫(pãi) 98 锎(kāi) 99 锿(āi) 100 镄(fâi) 101 钔(mãn) 102 锘(nuî) 103 铹(láo) 104 鑪(lú) 105 (dù) 106 (xǐ)107(bō) 108 (hēi) 109 䥑(mài) 110 鐽(dá) 111 錀(lún) 112 鎶(gē)[暂定] 注:新元素汉字请使用Win7系统浏览,XP系统下无法显示。
化学元素周期表(自创文字)最终版

9 2
[281]
yǒu
[280]
gá
(6d 7s )
10
2
[285]
tè
(7s 7p )
2
1
[284]
dī
(7s 7p )
2
2
[289]
huǒ
(7s 7p )
2
3
[288]
ěr
P O 32 32 32 N 18 18 18 M 2 4 2 5 2 6 6s 6p 6s 6p 6s 6p 8 8 8 L [209] 2 [210] 2 [222] 2 K 6 7 8 Q lì tián ào 18 P 18 18 116 32 O 32 117 32 118 32 N 32 32 Og 18 M 18 18 2 4 2 5 2 6 (7s 7p ) 8 (7s 7p ) 8 (7s 7p ) 8 L [293] 2 [294] 2 [294] 2 K
2
204.38
nǐ
6s 6p
2
1
207.2
fū
6s 6p
2
2
208.980
mò
6s 6p
2
3
87 88 钫 Fr Ra 镭
[223]
7s
1
8 2
[226]
7s
2
锕系
Ac~Lr
104
Rf
(6d 7s )
2 2
* 105
Db
(6d 7s )
3 2
* 106
Sg
(6d 7s )
4 2
* 107
2
8 2 2 9
150.36
bù
4f 6s
高一化学必修一第四章思维导图物质结构 元素周期表

高一化学必修一第四章思维导图物质结构元素周期表
1. 元素周期表的历史和基本组成
2. 元素周期表中元素的排列原则:原子序数、电子结构和化学性质
3. 元素周期表的周期性规律:周期性表格、周期性趋势和周期性特征
4. 元素周期表中的主族元素和过渡元素:特征、性质和应用
5. 元素周期表和能带理论的关系:元素的导电性和化学键的性质
6. 元素周期表中的稀有气体元素:物理性质、化学反应和应用
7. 元素周期表中的金属元素:物理性质、化学性质和应用
8. 元素周期表中的非金属元素:物理性质、化学性质和应用
9. 元素周期表中的同位素:发现、特征和应用
10. 元素周期表中的放射性元素:自然衰变、人工放射性和应用。
高中化学元素周期表背诵口诀

高中化学元素周期表背诵口诀元素周期表是高中学习化学的基础,每个化学老师在高中的时候都会要求学生背诵元素周期表。
那么,化学元素周期表有哪些背诵口诀呢?下面一起来看看吧!元素周期表口诀1化学元素周期表背诵口诀按周期背诵:第一周期:氢氦----侵害第二周期:锂铍硼碳氮氧氟氖----鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩----那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰----嫁改康太反革命铁钴镍铜锌镓锗----铁姑捏痛新嫁者砷硒溴氪----生气休克第五周期:铷锶钇锆铌----如此一告你钼锝钌----不得了铑钯银镉铟锡锑----老把银哥印西堤碲碘氙----地点仙第六周期:铯钡镧铪----(彩)色贝(壳)蓝(色)河钽钨铼锇----但(见)乌(鸦)(引)来鹅铱铂金汞砣铅----一白巾供它牵铋钋砹氡----必不爱冬(天)第七周期:钫镭锕----很简单了~就是----防雷啊!按族分:氢锂钠钾铷铯钫——请李娜加入私访铍镁钙锶钡镭——媲美盖茨被雷硼铝镓铟铊——碰女嫁音他碳硅锗锡铅——探归者西迁氮磷砷锑铋——蛋临身体闭氧硫硒碲钋——养牛西蹄扑氟氯溴碘砹——父女绣点爱氦氖氩氪氙氡——害耐亚克先动元素周期表口诀2化学元素周期表有什么作用元素周期表是元素周期律用表格表达的具体形式,它反映元素原子的内部结构和它们之间相互联系的规律。
元素周期表简称周期表。
元素周期表有很多种表达形式,目前最常用的是维尔纳长式周期表。
元素周期表有7个周期,有16个族和4个区。
元素在周期表中的位置能反映该元素的原子结构。
周期表中同一横列元素构成一个周期。
同周期元素原子的电子层数等于该周期的序数。
同一纵行(第Ⅷ族包括3个纵行)的元素称“族”。
族是原子内部外电子层构型的反映。
例如外电子构型,IA族是ns1,IIIA族是ns2 np1,O族是ns2 np4,IIIB族是(n-1)d1·ns2等。
元素周期表能形象地体现元素周期律。
元素周期表_课件PPT

人类在长期的生产活动和科学实践中,逐步认识了元 素间的内在联系和元素性质变化的规律性。那么同族元素 间有哪些规律存在呢?让我们一起走进丰富多彩的物质世 界,共同探讨元素的性质与原子结构的关系。
●梳理导引 1.碱金属元素原子的最外层都有______________个 电子,都是活泼的金属;且随核电荷数增加,电子层数逐 渐______________,原子半径逐渐______________,金属 性逐渐____________。 2.碱金属单质的物理性质:都有______________的 金属光泽,质______________,密度______________,熔 点____________,导电性和导热性都____________;随着 核电荷数增加,碱金属单质的熔、沸点逐渐____________, 密度逐渐____________[特殊的ρ(K)<ρ(Na)]。
4.比较元素金属性强弱的方法 (1)根据金属活动性顺序表判断。自左至右金属性减弱, 即失电子能力减弱,如:Zn>Cu。 (2)根据元素周期表判断。同周期,从左至右金属性减 弱 。 同 主 族 , 自 上 而 下 金 属 性 增 强 。 如 : Na>Mg>Al , Na<K。 (3)根据元素的单质与水(或酸)反应置换出氢的难易程 度判断。置换反应越易发生的元素金属性越强。如钾与水 比钠与水反应剧烈,则K>Na(金属性)。
溶液分上 下两层,下层呈 红棕色
Cl2+ 2NaBr===2NaCl+Br2
b.将少量新制的饱 和氯水加入盛有KI溶液 的试管,振荡后加CCl4, 振荡,静置
溶液分上 下两层,下层呈 紫红色
+I2
Cl2+2KI===2KCl
实验
c.将少量溴水加 入盛有KI溶液的试管, 振荡后加CCl4,振荡,
高一化学 23元素周期表

③最外层电子数是次外层电子数的 3倍的元素: O ④电子层数与最外层电子数相等的 元素:H、Be、Al
⑤次外层电子数是最外层电子数 2倍的元素: Li、Si ⑥原子核内无中子的原子: H ⑦最外层电子数是1的原子: Li Na H ⑧最外层电子数是2的原子: He Be Mg
元素金属性强弱判断的依据 元素金属性是指元素的原子失去电子的 能力. 判断元素金属性强弱, 从参加反应的元素 的原子失电子的难易程度加以分析判断: 1、利用原子结构和元素在周期表中的 位置判断: 在周期表中,同一周期里从左到右, 元素的金属性逐渐减弱,同一主族里 从上到下,元素的金属性逐渐增强。
2、 从元素单质与水或酸反应置换出氢 的难易判断: 与水反应越易、越剧烈的金属单质,其 原子越易失电子,该金属活泼性越强。
钠与水在常温下剧烈反应,置换出水中的氢
镁与冷水反应很微弱,镁与沸水迅 铝与热水不反应 地反应并产生气泡, 金属性由强到弱:Na>Mg>Al Na、Fe、Cu分别加入盐酸中,钠反 应剧烈, Fe反应迅速,Cu不反应。 金属性由强到弱:Na>Fe> Cu
1
2
3
4
5
6
7
8
1
2
3
4
5
6
7
8
原子半径的周期性变化
原子半径由大变小
主要化合价的周期性变化 IA IIA IIIA VIA VA VIA VIIA 0
最高正价从+1递增到+7, 负价从-4递增到-1
+1 +2 +3 +4 +5 --- ----4 -3 -2 -1 +1 +2 +3 +4 +5 +6 +7 -4 -3 -2 -1
原子结构与元素周期表(三) 教学设计-2020年秋高中化学人教版(2019)必修一

P1:同学们,大家好!今天很高兴和同学们一起完成人教版高中化学必修第一册第四章第一节原子结构与元素周期表第三课时的学习。
P2:P3:考古的一个重大难题就是如何对考古发现作出尽可能准确的时间范围判断。
近几十年来形成并逐步完善的同位素断代法,在考古断代中正在发挥着决定性的作用。
图片展示的是146C衰变测定装置的局部图,考古工作者就是利用这种粒子对文物进行年代测定和研究。
那么同位素断代法中提到的同位素是什么呢?通过本节课的学习,大家将会得到答案。
学习新课前,我们先来复习回顾一下所学知识。
P4:原子由原子核和核外电子构成;而原子核又由质子和中子构成。
原子的质量主要集中在原子核上。
忽略电子的质量,将核内所有质子和中子的相对质量取近似的整数值相加,所得到的数值称为质量数。
质量数等于质子数加中子数。
P5:质量数写在元素符号的左上角,质子数写在元素符号的左下角。
所以14C表示的是质子数是6,质量数是14的一种碳原子。
P6:通过元素周期表的学习,同学们已经知道,元素周期表中的每个方格,都包含该元素的一些基本信息,如原子序数、元素符号、元素名称和相对原子质量等。
P7:但有特别需要的,周期表方格中还会标有质量数。
比如氢元素有三种质量数,分别是1、2、3。
即氢1、氢2、氢3. 那这三种粒子是同一种原子吗?是否为同一种元素呢?为了回答这一问题。
我们需要先明确元素与核素的概念。
P8:元素就是质子数即核电荷数相同的一类原子的总称。
即同种元素的核内质子数是相同的。
P9:例如:1H、2H、3H的质子数相同,都是1,所以它们是同一种元素,均属于氢元素。
那同种元素原子的中子数是否也相同呢?P10:1H、2H、3H的中子数分别为0、1、2,中子数并不相同,所以同种元素原子的中子数不一定相同。
P11:我们把具有一定数目质子和一定数目中子的一类原子称为核素。
P12:因此,1H、2H、3H是氢元素的三种不同的核素,也可以说是氢元素的三种氢原子。
高中化学第2节 原子结构与元素周期表 选修三

课题:第2节原子结构与元素周期表课本:物质结构与性质 (选修) 山东科学技术出版社知识与技能:1.理解能量最低原则、泡利不相容原理、洪特规则,能用以上规则解释1~36号元素基态原子的核外电子排布;2.能根据基态原子的核外电子排布规则和基态原子的核外电子排布顺序图完成1~36号元素基态原子的核外电子排布和价电子排布;3.知道元素周期表中元素按周期划分的原因,族的划分与原子中价电子数目和价电子排布的密切关系。
4.了解原子半径的周期性变化,能用原子结构的知识解释主族元素原子半径周期性变化的原因;5.明确原子结构的量子力学模型的建立使元素周期表的建立有了理论依据。
过程与方法:通过书写1~18号元素的原子结构示意图进行联想质疑,从而尝试总结排布原则,理解能量最低原则、泡利不相容原理、洪特规则,在活动探究中学会1~36号原子的核外电子排布式书写。
第2、3课时也通过联想质疑、交流研讨、观察思考等栏目理清核外电子排布与元素周期表,与原子半径等的关系。
情感、态度与价值观:树立发展的认识观,积极参与活动探究培养个人处理事情的能力。
教学重难点:认识能量最低原则、泡利不相容原理、洪特规则,了解核外电子排布与元素周期表的周期、族划分的关系。
课型:新课课时安排:3课时(第一课时)教学过程:[基础梳理]1 我们以前知道的原子核外电子的排布规律内容有:(1)原子核外电子总是尽先排布在能量最低的电子层理,然后由里向外逐步排布在能量逐渐升高的电子层里,即先排满K层再排L层,排满L层再排M层┅┅┅(2)每一层上最多容纳的电子数为个;(3)最外层电子数不超过个(K层为最外层不超过个);(4)次外层电子数不超过个,倒数第三层电子数不超过个。
2 请画出 1 ~ 20号元素的原子结构示意图。
[联想质疑]为什么第一层最多只能容纳两个电子,第二层最多只能容纳八个电子而不能容纳更多的电子呢?第三、四、五层及其他电子层最多可以容纳多少个电子?原子核外电子的排布与原子轨道有什么关系?[引入新课] 通过上一节的学习,我们知道:电子在原子核外是按能量高低分层排布的,同一个能层的电子,能量也可能不同,还可以把它们分成能级(S、P、d、f),就好比能层是楼层,能级是楼梯的阶级。
人教版高一化学必修一第一章第一节元素周期表 课件(共20张ppt)

3.现行元素周期表中已经列出了112种元素,其中元素种类最多的周
期是?
C
A.第4周期
B.第5周期
C.第6周期
D.第7周期
2024/1/20
16
判断下列说法是否正确
1、短周期元素全是主族元素 错,还有0族元素
2、短周期元素共有20种元素 错,短周期包括1、2、3周期,共18种元素
——32 种
主族 共 7 个主族,包括短周期和长周期元素
副族 共 7 个副族,只包括在长周期中
族
(16个) 第VIII族 包括第8、9、10 纵行
0族
稀有气体元素
2024/1/20
18
练习
推算原子序数为6,13,34,53,88,82的元素在周期表中的位置。
第6号元素: 6-2=4
第二周期第ⅣA 族。
2023最新整理收集 do something
第一节 元素周期表
化学 必修2
第一课时
元素周期表
2
1
2019年被联合国批准为“国际化学元素周 期表年”。2019年是国际纯粹与应用化学联合 会IUPAC成立100周年,同时也是化学元素周期 表发明150周年。
俄国科学家门捷列夫
2024/1/20
2
一、元素周期表的发展史
3、过渡元素全是长周期元素 正确,过渡元素还全是金属元素
4、过渡元素全是副族元素
错,还有第VIII族元素
2024/1/20
17
课堂小结:
短周期
周期
(7个) 长周期
第 1周期 第 2周期
第 3周期 第 4周期
第 5周期 第 6周期 第 7周期
化学元素周期表(学生版)

化学元素周期表和周期律一.完成下列元素周期表1.并标明元素性质变化趋势、非金属性最强和金属性最强元素。
12.、完成氢化物周期表并标明氢化物稳定性趋势、氢化物最稳定的物质23.、完成最高价氧化物对于水化物周期表并标明最高价氧化物对于水化物性质变化趋势、最强酸和最强碱3第一周期:氢氦---- 侵害第二周期:锂铍硼碳氮氧氟氖---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩---- 那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰---- 嫁改康太反革命铁钴镍铜锌镓锗---- 铁姑捏痛新嫁者砷硒溴氪---- 生气休克二.熟悉元素周期表的结构,熟记前36号元素及主族和零族元素的名称及符号。
1.记住7个横行,即个周期(短、长)。
2.记住18个纵行,包括个主族(ⅠA~ⅦA)、个副族(ⅠB~ⅦB)、1个第族(第8、9、10纵行)和1个族(即稀有气体元素)。
3.记住金属与非金属元素的分界线(氢、硼、硅、砷、碲、砹与锂、铝、锗、锑、钋之间)。
三、特殊元素集锦1、最活泼的金属元素、最高价氧化物对应的水化物碱性最强的元素、阳离子氧化性最弱的元素是铯()。
2、最活泼的非金属元素、无正价的非金属元素、无含氧酸的非金属元素、无氧酸(或氢化物)可腐蚀玻璃的元素、气态氢化物最稳定的元素、阴离子的还原性最弱的元素是氟()。
3、最强的碱是()最强的含氧酸是()最高价氧化物的水化物能与其气态氢化物发生化合反应的短周期元素是()最高价氧化物的水化物能与其气态氢化物发生氧化还原反应的短周期元素是(())气态氢化物和它的氧化物在常温下生成该元素的单质的元素是()3、最稳定的气态氢化物是()气态氢化物中含氢质量分数最大的是()最小的是()4、形成化合物种类最多的元素是()、单质是自然界中硬度最大的物质的元素、气态氢化物中氢的质量分数最大的元素是碳()。
空气中含量最多的元素是()或气态氢化物的水溶液呈碱性的元素是氮()。
地壳中含量最多的元素是()地壳中含量最多的金属元素是()5、焰色反应呈黄色的元素是()透过蓝色钴玻璃观察焰色反应呈紫色的元素是()46、常温下单质呈液态的元素是()常温下单质呈液态的非金属元素是()7、无氧酸能腐蚀玻璃的元素是()最易着火的非金属单质的元素是()8、既能与酸反应又能与碱溶液反应可产生H2的金属元素为铝(),与碱溶液反应可产生H2的非金属元素为(),Al2O3和Al(OH)3都有两性。
高一化学元素周期表

2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O Al(OH)3+3H+=Al3++3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
Al(OH)3+OH-=AlO2-+2H2O(难点)
元素周期表
你能否: 将前18号元素编一个周期表?
原则:
1. 能体现原子序数递增; 2. 相同电子层数的原子在表中能进行归类; 3. 原子最外层电子数相同的元素能进行归类。
性质
元素位、构、性三者关系(举例)
周期表中位置 a.某元素处于第四周期,第VI主族 b .某元素处于第六周期,第I主族
c .某元素处于第三周期,0族 d .某元素处于第二周期,第IIIA族
元素
Se Cs Ar B
元素位、构、性三者关系(举例)
1. 金属性最强的元素(不包括放射性元素)
是
;Cs
2. 最活泼的非金属元素是 F ;
元 (横向)
第 4 周期:18 种元素
素 周 期
长周期 第 5 周期:18 种元素
第 6 周期:32 种元素 不完全周期: 第 7 周期( 28 种元素)
表 族 主族: ⅠA ~ ⅦA族(第1~2、13~17纵行)
(纵向)副族:ⅢB 族~Ⅶ B族、ⅠB族~ⅡB族(第3~7、11~12纵行
第 Ⅷ 族:第8、9、10 三个纵行,位于 Ⅶ B ~ ⅠB 之间 零族: 稀有气体元素(第 18 纵行)
元素周期表的结构(周期)
1. 周期(横行)
具有相同的电子层数而又按原子序数递
增的顺序排列的一系列元素,称为一个周
期。周期数为其电子层数。
化学周期表

化学周期表化学元素周期表元素周期表中的元素(每周期开头设为空4个字节)1H氢 1.00792He氦 4.00263Li 锂 6.9414Be铍9.01225B硼10.8116C碳12.0117N 氮14.0078O氧15.9999F氟18.99810Ne氖20.1711 Na钠22.989812Mg镁24.30513Al铝26.98214Si硅28.08515P磷30.97416S硫32.0617Cl氯35.45318Ar 氩39.9419K钾39.09820Ca钙40.0821Sc钪44.95622 Ti钛47.923V钒50.9424Cr铬51.99625Mn锰54.938 26Fe铁55.8427Co钴58.933228Ni镍58.6929Cu铜63.5430Zn锌65.3831Ga镓69.7232Ge锗72.533As 砷74.92234Se硒78.935Br溴79.90436Kr氪83.837 Rb铷85.46738Sr锶87.6239Y钇88.90640Zr锆91.2241Nb铌92.906442Mo钼95.9443Tc锝(99)44Ru 钌161.045Rh铑102.90646Pd钯106.4247Ag银107.86848Cd镉112.4149In铟114.8250Sn锡118.6 51Sb锑121.752Te碲127.653I碘126.90554Xe氙131.355Cs铯132.90556Ba钡137.3357-71La-Lu镧系57La镧138.958Ce铈140.159Pr镨140.960Nd钕144.261Pm钷(147)62Sm钐150.363Eu铕151.9664 Gd钆157.2565Tb铽158.966Dy镝162.567Ho钬164.968Er铒167.269Tm铥168.970Yb镱173.0471 Lu镥174.96772Hf铪178.473Ta钽180.94774W钨183.875Re铼186.20776Os锇190.277Ir铱192.278 Pt铂195.0879Au金196.96780Hg汞200.581Tl铊204.382Pb铅207.283Bi铋208.9884Po钋(209)85At 砹(201)86Rn氡(222)87Fr钫(223)88Ra镭226.03 89-103Ac-Lr锕系89Ac锕(227)90Th钍232.091Pa镤231.092U铀238.093Np镎(237)94Pu钚(239,244)95 Am镅(243)96Cm锔(247)97Bk锫(247)98Cf锎(251)99 Es锿(252)100Fm镄(257)101Md钔(258)102No锘(259) 103Lr铹(260)104Rf钅卢(257)105Db钅杜(261)106Sg钅喜(262)107Bh钅波(263)108Hs钅黑(262)109Mt钅麦(265) 110Ds钅达(266)111Rg钅仑(272)112Uub(285)113 Uut(284)114Uuq(289)115Uup(289)116Uuh(292)117 Uus(*)/*尚未被发现*/118Uuo(293)?6?7?6?7各个元素的读音氢(qīng)氦(hài)锂(lǐ)铍(pí)硼(p?0?0ng)碳(tàn)氮(dàn)氧(yǎng)氟(fú)氖(nǎi)钠(nà)镁(měi)铝(lǚ)硅(guī)磷(lín)硫(liú)氯(lǜ)氩(yà)钾(jiǎ)钙(gài)钪(kàng)钛(tài)钒(fán)铬(g?0?9)锰(měng)铁(tiě)钴(gǔ)镍(ni?0?9)铜(t?0?7ng)锌(xīn)镓(jiā)锗(zhě)砷(shēn)硒(xī)溴(xiù)氪(k?0?9)铷(rú)锶(sī)钇(yǐ)锆(gào)铌(ní)钼(mù)锝(d?0?0)钌(liǎo)铑(lǎo)钯(pá)银(yín)镉(g?0?0)铟(yīn)锡(xī)锑(tī)碲(dì)碘(diǎn)氙(xiān)铯(s?0?9)钡(b?0?9i)镧(lán)铪(hā)钽(tǎn)钨(wū)铼(lái)锇(?0?0)铱(yī)铂(b?0?7)金(jīn)汞(gǒng)铊(tā)铅(qiān)铋(bì)钋(pō)砹(ài)氡(dōng)钫(fāng)镭(l?0?0i)锕(ā)钅卢(lú)钅杜(dù)钅喜(xǐ)钅波(bō)钅黑(hēi)钅麦(mài)钅达(dá)钅仑(lún)镧(lán)铈(shì)镨(pǔ)钕(nǚ)钷(pǒ)钐(shān)铕(yǒu)钆(gá)铽(t?0?9)镝(dí)钬(huǒ)铒(ěr)铥(diū)镱(yì)镥(lǔ)锕(ā)钍(tǔ)镤(pú)铀(y?0?7u)镎(ná)钚(bù)镅(m?0?0i)锔(jū)锫(p?0?0i)锎(kāi)锿(āi)镄(f?0?9i)钔(m?0?0n)锘(nu?0?6)铹(láo)小结:其实大多数元素的读音比较好读,只要读半边就可以了。
高一化学必修一第一章第一节元素周期表

同种元素原子的原子核中质子数是相同的。 那么,中子数是否一定相同呢?
1 H 1 2 1
H
3 1H
氕 H 氢
氘 D 重氢
氚 T 超重氢
核素:具有一定数目的质子和一定数目的中子 的一种原子。 即一种原子就是一种核素。
1 H 1 2
1
H
3 H 各为一种核素 1
同位素:质子数相同而中子数不同的同一元素 的不同原子互称为同位素。 同一种元素的不同核素互称为同位素。
一、元素周期表
1. 编排原则: (1)按原子序数递增的顺序从左到右排成横行
(2)按电子层数递增的顺序从上而下排成纵行
一、元素周期表
2.元素周期表的结构:
第一周期:2 种元素 第二周期:8 种元素 第三周期:8 种元素 第四周期:18 种元素 第五周期:18 种元素 第六周期:32 种元素(含 镧系15种) 第七周期(不完全周期):26 种元素 (含 锕系15种)
★主族序数=最外层电子数
习题:
序号位置:
例1:试推测出第32号元素在周期表中的 位置。 分析:0族定位法。即根据与该元素原子 序数最接近的0族元素的位置来确定。
答案:第四周期 第ⅣA族。
原子结构示意图位置:
例2:写出下列元素在周期表的位置:
第 三 周期 第 ⅣA 族
第 二 周期 第 ⅥA 族
13 6 C-NMR(核磁共振)可以用于含碳化
元素相对原子质量的计算:
按各种同位素所占的一定百分 比算出的平均值
A=A1×a1%+A2×a2%+…
A1、A2: 同位素的相对原子质量 a1%、a2%: 同位素原子的个数分数 如
35Cl
——75% , 37Cl——25% 35×0.75+37×0.25=35.5 即:氯的原子量为35.5。(近似值)
高一化学元素周期表知识点归纳

高一化学元素周期表知识点归纳高一元素周期表知识点总结1单质及简单离子的氧化性与还原性同一周期中,从左到右,随着原子序数的递增,单质的氧化性增强,还原性减弱;所对应的简单阴离子的还原性减弱,简单阳离子的氧化性增强。
同一族中,从上到下,随着原子序数的递增,单质的氧化性减弱,还原性增强;所对应的简单阴离子的还原性增强,简单阳离子的氧化性减弱。
元素单质的还原性越强,金属性就越强;单质氧化性越强,非金属性就越强。
最高价氧化物所对应的水化物的酸碱性同一周期中,元素最高价氧化物所对应的水化物的酸性增强(碱性减弱);同一族中,元素最高价氧化物所对应的水化物的碱性增强(酸性减弱)。
单质与氢气化合的难易程度同一周期中,从左到右,随着原子序数的递增,单质与氢气化合越容易;同一族中,从上到下,随着原子序数的递增,单质与氢气化合越难。
高一元素周期表知识点总结2编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同的各元素从左到右排成一横行。
(周期序数=原子的电子层数)........③把最外层电子数相同的元素按电子层数递增的顺序从上到下排成一纵行。
..........主族序数=原子最外层电子数2.结构特点:核外电子层数元素种类第一周期12种元素短周期第二周期28种元素周期第三周期38种元素元7第四周期418种元素素7第五周期518种元素周长周期第六周期632种元素期第七周期7未填满(已有26种元素)表主族:ⅠA~ⅦA共7个主族族副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵行)第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间(16个族)零族:稀有气体高一元素周期表知识点总结3原子核外电子排布规律1.在含有多个电子的原子里,电子依能量的不同是分层排布的,其主要规律是:核外电子总是尽先排布在能量较低的电子层,然后由里向外,依次排布在能量逐步升高的电子层。
2.原子核外各电子层最多容纳2n2个电子。
3.原子最外层电子数目不超过8个(K层为最外层时不能超过2个电子)。
高一化学知识点-元素周期表

高一化学知识点:元素周期表高一化学知识点:元素周期表一、元素周期表原子序数=核电荷数=质子数=核外电子数1、元素周期表的编排原则:①按照原子序数递增的顺序从左到右排列;②将电子层数相同的元素排成一个横行——周期;③把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行——族2、周期序数=电子层数;主族序数=最外层电子数3、元素金属性和非金属性判断依据:①元素金属性强弱的判断依据:单质跟水或酸起反应置换出氢的难易;元素最高价氧化物的水化物——氢氧化物的碱性强弱;置换反应。
②元素非金属性强弱的判断依据:单质与氢气生成气态氢化物的难易及气态氢化物的稳定性;最高价氧化物对应的水化物的酸性强弱;置换反应。
4、核素:具有一定数目的质子和一定数目的中子的一种原子。
①质量数二二质子数+中子数:A==Z+N②同位素:质子数相同而中子数不同的同一元素的不同原子,互称同位素。
(同一元素的各种同位素物理性质不同,化学性质相同)二、元素周期律1、影响原子半径大小的因素:①电子层数:电子层数越多,原子半径越大(最主要因素)②核电荷数:核电荷数增多,吸引力增大,使原子半径有减小的趋向(次要因素)③核外电子数:电子数增多,增加了相互排斥,使原子半径有增大的倾向2、元素的化合价与最外层电子数的关系:最高正价等于最外层电子数(氟氧元素无正价)负化合价数=8—最外层电子数(金属元素无负化合价)3、同主族、同周期元素的结构、性质递变规律:同主族:从上到下,随电子层数的递增,原子半径增大,核对外层电子吸引能力减弱,失电子能力增强,还原性(金属性)逐渐增强,其离子的氧化性减弱。
七大方法助你告别化学“差生”一.尽快去找化学老师,让他告诉你以前学过的关键知识点,在短期内掌握,目的是能够大致跟上现在的教学进度,以听懂老师讲授的新知识。
要想进步,必须弄清楚导致化学成绩差的根本原因是什么?是常用的几个公式、概念没记住,还是很重要的几个基本解题方法不能熟练应用,或者是以前的一些重点知识没有理解透彻等等。
高一化学 元素周期表 新课标 人教版
门捷列夫
1868年,门捷列夫 发表了第一张元素 周期表,完整系统 地提出化学元素周 期表。
元素周期表的编排原则:
1、把电子层数相同的各种元素,按原子序 数递增的顺序从左到右排成横行。
2、把不同横行中最外层电子数相同的元素, 按电子层数递增的顺序由上而下排成纵行。
思考: 1.每个周期所容纳的元素种类是多少? 2.1、2、3周期序数和前18号元素的核 外电子排布有何联系?
5、X、Y、Z是周期表中相邻的三种短周期元素, 4X和Y同周期,Y和Z同主族,三种元素原子的 最外层电子数之和为17,核内质子数之和为31, 则X、Y、Z是
A、Mg、Al、Si B、Li、Be、Mg
C、N、O、S
D、P 、S、O
2、指出原子序数为16的元素的名称、符号及 在周期表中的位置。
3、氟位于周期表的第二周期,第ⅫA族,画出 其原子结构简图。
4、X和Y属于短周期元素,X原子的最外层电 子数是次外层电子数的一半,Y位于X的前一周 期,且最外层只有一个电子,则X和Y形成的化 合物的化学式可表示为
A、XY
B、XY2 C、XY3 D、X2Y3
NO. NO. NO. NO. NO. NO. H 1 Al 11 Fe 21 Sr 31 Sb 41 O Li 2 Si 12 Co&Ni22 Zr 32 Te 42 Hg G 3 P 13 Cu 23 Ce&La 33 I 43 Tl Bo 4 S 14 Zn 24 Di&Mo 34 Cs 44 Pb C 5 Cl 15 Y 25 Ro&Ru 35 Pa&V 45 Bi N 6 K 16 In 26 Pd 36 Ta 46 Th O 7 Ca 17 As 27 Ag 37 W 47 F 8 Ti 18 Se 28 Cd 38 Nb 48 Na 9 Cr 19 Br 29 Sn 39 Au 49 Mg 10 Mn20 Rb 30 U 40 Pt&Ir 50
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[单选]患儿,出生3周,喂奶后立即或不久即吐,呈喷射状,吐物为奶及奶块。根据超声中腹部检查如图,最可能的诊断为()A.先天性肥厚型幽门狭窄B.先天性胆管狭窄C.胃溃疡D.肠套叠E.正常声像图 [多选]按照《建设工程质量管理条例》,工程竣工验收应当具备的条件有()。A.有完整的技术档案和施工管理资料B.部分工程的质量必须优良C.有施工单位签署的工程保修书D.有勘察、设计、监理单位共同签署的质量合格文件E.已经办理竣工结算 [单选]危机干预需要评估的下列哪项是错误的()A.现场干预B.认知状态C.情绪状态D.意志行为E.应对方法资源 [单选]校验供电系统保护装置灵敏度时,应使用()运行方式下的短路电流数据。A.最小B.最大C.正常D.满载 [单选]类风湿关节炎滑膜的病理特征是()。A.血管翳形成B.滑膜水肿C.淋巴细胞浸润D.滑膜增厚E.滑膜消失或变薄 [单选]屈曲型肱骨髁上骨折断端最常见的移位方向是()A.近折端向后下移位,远折端向前移位B.近折端向后上移位,远折端向前下移位C.近折端向前下移位,远折端向后上移位D.近折端向前下移位,远折端向桡侧移位E.近折端向后下移位,远折端向尺侧移位 [单选,A2型题,A1/A2型题]早期结核性脑膜炎的主要临床表现特点是().A.性情改变B.头痛、呕吐C.结核中毒症状D.嗜睡、双眼凝视E.感觉过敏 [问答题,案例分析题]B企业拟在A市郊区原A市卷烟厂厂址处(现该厂已经关闭)新建屠宰量为120万头猪/年的项目(仅屠宰,无肉类加工),该厂址紧临长江干流,A市现有正在营运的日处理规模为3万t的城市污水处理厂,距离B企业1.5km。污水处理厂尾水最终排入长江干流(长江干流在A市段 [名词解释]十波罗夷 [单选,案例分析题]贝加尔湖湖面每年1—5月封冻,冰厚可达90厘米。图5为贝加尔湖地区等高线图。贝加尔湖()A.结冰主要原因是海拔高B.湖面中心结冰早于边缘C.位于山谷导致冰层较厚D.北部的封冻期长于南部 [单选]关系数据库设计理论主要包括3个方面的内容,其中起核心作用的是()A.范式B.关键码C.数据依赖D.数据完整性约束 [单选,B1型题]聚合性痤疮()。A.表现为严重结节、囊肿、窦道及瘢痕,好发于男性青年B.少数患者病情突然加重,并出现发热、关节痛、贫血等全身症状C.雄激素、糖皮质激素、卤素等所致的痤疮样损害D.婴儿期由于母体雄激素在胎儿阶段进入体内E.与月经周期密切相关 [单选,A2型题,A1/A2型题]FAB分型中,AML-M1骨髓中原始细胞应占非红系细胞的().A.≥30%B.≥40%C.≥50%D.≥70%E.≥90% [单选]在信托业务中,为了一定目的将其财产以信托的方式委托给受托人经营的人指的是()。A.委托人B.受托人C.第三方D.受益人 [单选,A1型题]中毒的主要机理有()A.局部刺激、腐蚀作用B.缺氧C.麻醉作用D.抑制酶的活力E.以上都是 [名词解释]半卫 [单选]关于考试焦虑症的处理,以下哪种说法是不正确的?()A.考试焦虑症必要时可以心理治疗配合抗焦虑的药物来处理B.学业压力和考试焦虑会形成恶性循环,令考试焦虑症越来越严重C.考试焦虑症的形成原因主要是学生内部的压力,所以只要处理好学生的心态和观念就可以了D.系统脱 [单选]如果将物体放在互相垂直的投影面之间,用三组分别()的平行投射线进行投影,就得到物体三个方向的正投影图,也即形成了三面投影图。A.倾斜B.直射C.折射D.垂直 [单选]给肌松药后骨骼肌的松弛有一定规律,下列哪项描述正确()A.眼轮匝肌肉-膈肌-肋间肌-四肢肌肉B.眼轮匝肌肉-四肢肌肉-膈肌-肋间肌C.眼轮匝肌肉-肋间肌-四肢肌肉-膈肌D.眼轮匝肌肉-上肢肌肉-肋间肌-膈肌E.眼轮匝肌肉-肋间肌-膈肌-四肢肌肉 [单选]公路管理机构扣留车辆、工具的,应当当场出具凭证,并告知当事人在规定期限内到公路管理机构接受处理。逾期不接受处理,并且经公告()仍不来接受处理的,对扣留的车辆、工具,由公路管理机构依法处理。A、1个月B、3个月C、6个月 [单选]妊娠晚期每周体重增加不应超过().A.0.2kgB.0.5kgC.0.8kgD.1kgE.2.0kg [单选]药物分析课程的内容主要是以()A.六类典型药物为例进行分析B.八类典型药物为例进行分析C.九类典型药物为例进行分析D.七类典型药物为例进行分析E.十类典型药物为例进行分析 [单选,A1型题]球部尿道损伤7天后出现严重尿外渗,局部处理方法应是()A.局部穿刺抽吸外渗的尿和血液B.局部热敷促进尿外渗吸收C.延长留置导尿时间,防止尿外渗感染在局部形成瘢痕导致尿道狭窄D.尿外渗部位多处切开引流,并行耻骨上膀胱造瘘术E.广谱抗生素预防感染即可 [单选]1926年美国波士顿的内科医生首次应用放射性氡研究人体动、静脉血管床之间的循环时间,被誉为“临床核医学之父”。该内科医生是()A.卢姆加特B.亚历山大?丹拉斯C.卡森D.特克尔E.cassen [单选]在工业管道施工中,需对273X7的碳钢无缝管的5个焊口进行X光射线探伤,胶片长度为300mm,其X光射线探伤工程量为()A.20张B.18张C.15张D.14张 [单选]乳房部疾病症见经前胀痛者为()A.内吹乳痈B.乳疬C.乳腺增生病D.乳岩E.乳痨 [多选]对事物的知觉是()A.受人以往知识经验影响的B.感觉的相加C.不同的人不同的D.人脑对直接作用感官的事物的整体的反映 [单选]关于病原携带者的论述,正确的是()A.所有的传染病均有病原携带者B.病原携带者不是重要的传染源C.发生于临床症状出现之前者称为健康携带者D.病原携带者不显出临床症状而能排出病原体E.处于潜伏性感染状态者就是病原携带者 [单选,A2型题,A1/A2型题]患者右侧肢体无力一年余,查体右上肢下运动神经元瘫,肌力4级,右下肢上运动神经元瘫,肌力3级,其病变部位为()。A.左上胸髓部B.右上胸髓部C.双侧颈膨大部D.左侧颈膨大部E.右侧颈膨大部 [单选]公安机关消防机构在消防监督检查中发现建筑消防设施不符合消防安全要求,存在影响公共安全的重大火灾隐患的,应当。()A、口头报告本级人民政府B、书面报告本级人民政府C、书面报告本级公安机关D、书面报告上级公安机关消防机构 [判断题]浮选精矿灰分高时,应减少捕收剂用量;尾矿灰分高时,想提高尾煤泥发热量,应减少捕收剂用量。A.正确B.错误 [单选]证据审查内容包括()两个方面。A.括程序性审查和实体性审查B.主观性审查和客观性审查C.询问审查和现场审查D.全面审查和单一审查 [单选,A1型题]患者,男,65岁,有高血压、糖尿病多年。一天前发现左侧上、下肢活动受限,吐字不清,神志清楚。无明显头痛、呕吐,检查发现左侧上、下肢肌力3级,左半身痛觉减退,头颅CT未见异常,临床上考虑可能性最大的疾病是()。A.脑出血B.脑栓塞C.短暂性脑缺血发作D.蛛网膜下 [单选,A2型题]不同文化之间的相互影响性,指的是文化的()A.历史性B.现实性C.渗透性D.继承性E.社会性 [单选]由于电子商务的推行,企业的经营活动打破了时间和空间的限制,将会出现一种完全新型的企业组织形式()A.并行企业B.刚性企业C.虚拟企业D.柔性企业 [单选,A2型题,A1/A2型题]目前我国最常用的智力量表是()A.斯坦福-比纳智力量表B.洛奇-桑代克智力量表C.韦克斯勒智力量表D.瑟斯顿智力量表E.勒特国际操作量表 [单选]碳的元素符号为C,如有8个中子、6个质子的原子核,可表示为()A.['D.CE.C [问答题,简答题]简述抓斗的抓取过程及两瓣抓斗与四瓣抓斗的使用特点。 [多选]控制网优化设计的三个主要质量控制标准是()A.精度B.可靠性C.费用D.时间 [填空题]各类油泵吊至检修平台过程中应注意油泵内的()。不得在运输途中发生漏油。如在途中有漏油,应及时做好(),防止人员()。
