物理化学第五章电化学知识点汇总ppt课件
物理化学电化学知识点总结

物理化学电化学知识点总结一、原电池的原理1.构成原电池的四个条件(以铜锌原电池为例)①活拨性不同的两个电极②电解质溶液③自发的氧化还原反应④形成闭合回路2.原电池正负极的确定①活拨性较强的金属作负极,活拨性弱的金属或非金属作正极。
②负极发生失电子的氧化反应,正极发生得电子的还原反应③外电路由金属等导电。
在外电路中电子由负极流入正极④内电路由电解液导电。
在内电路中阳离子移向正极,阴离子会移向负极区。
Cu-Zn原电池:负极: Zn-2e=Zn2+ 正极:2H+ +2e=H2↑总反应:Zn +2H+=Zn2+ +H2↑氢氧燃料电池,分别以OH和H2SO4作电解质的电极反应如下:碱作电解质:负极:H2—2e-+2OH-=2 H2O 正极:O2+4e-+2 H2O=4OH-酸作电解质:负极:H2—2e-=2H+ 正极:O2+4e-+4H+=2 H2O总反应都是:2H2+ O2=2 H2O二、电解池的原理1.构成电解池的四个条件(以NaCl的电解为例)①构成闭合回路②电解质溶液③两个电极④直流电源2.电解池阴阳极的确定①与电源负极相连的一极为阴极,与电源正极相连的一极为阳极②电子由电源负极→导线→电解池的阴极→电解液中的(被还原),电解池中阴离子(被氧化)→电解池的阳极→导线→电源正极③阳离子向负极移动;阴离子向阳极移动④阴极上发生阳离子得电子的还原反应,阳极上发生阴离子失电子的氧化反应。
注意:在惰性电极上,各种离子的放电顺序三.原电池与电解池的比较原电池电解池(1)定义化学能转变成电能的装置电能转变成化学能的装置(2)形成条件合适的电极、合适的电解质溶液、形成回路电极、电解质溶液(或熔融的电解质)、外接电源、形成回路(3)电极名称负极正极阳极阴极(4)反应类型氧化还原氧化还原(5)外电路电子流向负极流出、正极流入阳极流出、阴极流入四、在惰性电极上,各种离子的放电顺序:1、放电顺序:如果阳极是惰性电极(Pt、Au、石墨),则应是电解质溶液中的离子放电,应根据离子的放电顺序进行书写书写电极反应式。
第五章 多相平衡PhaseEquilibrium 物理化学课件

(2) 相律的推导
现设该独立变量为温度,则根据纯液态锌的克拉佩 龙-克劳休斯方程,p(Zn)=f (T), 在一定温度下有确 定的p(Zn),上面第一个方程表示如下的平衡
ZnO(s) + C(s) = Zn(g) +CO(g) 因其平衡常数在定温下为定值,有K1=p(Zn)·p(CO) 于是p(CO)有定值。再根据第二个化学平衡,其平衡 常数在定温下为另一定值K2=p(CO2)/p2(CO),因此 p(CO2)也有定值。故一个强度变量的值可确定其它四 个强度变量的值,F=1,同样若先确定另一强度变量 的值,例如p(CO)为某值,同样可推论出其它强度变 量的值。
(2) 相律的推导
设有 S 种物质在 P 个相中, 描述一个相的状态要 T,p,(x1, x2, …xs)
(S–1)种独立变量 所以总变量数= P(S –1) + 2
(2) 相律的推导
在一个封闭的多相系统中,相与相之间可以有热的 交换、功的传递和物质的交流。对具有P个相系统的 热力学平衡,实际上包含了如下四个平衡条件: (1)热平衡条件:设系统有、Ⅱ······P 个相,达到平 衡时,各相具有相同温度
2c(NH3) = c(H2S) 但如果分解产物在不同相则不然,如反应:
CaCO3(s) = CO2(g) + CaO(s) c(CO2, g)和c(CaO, s)无关,则无浓度限制条件。 设浓度限制条件的数目为R′,则又有R′个关于浓度的 方程式。
(2) 相律的推导
电化学基本概念ppt课件
i i
两相间建立平衡电势
电极(Electrode)
电极材料/电解质
Zn|Zn2+, SO42Pt|H2,H+ Fe|Fe3O4|Fe2O3|水溶液
电极(Electrode)
电极材料/电解质 •传递电荷
Zn|Zn2+,SO42-,
•氧化或还原反应
Pt|H2,H+
的地点
•“半电池”
Fe|Fe3O4|Fe2O3|水溶液
法拉弟定律的几个要点
1. 电和化学反应相互作用的定量关系 2. 不受电极、外界条件的影响 3. 适用于多个电化学装置的多个反应(串联)
e-
i
H2
Cl2
Na+
Cl-
Ag
Ag+
ei
Ag+
Ag+
H+
OH-
阴极
阳极
H+
NO3-
银阴极 银阳极
法拉弟定律的几个要点
1. 电和化学反应相互作用的定量关系 2. 不受电极、外界条件的影响 3. 适用于多个电化学装置的多个反应(串联) 4. 适用于单个电化学装置的多个反应(并联)
I
负极 e
e 正极
-2e Pb
Pb2+ PbSO4
H2O H+
SO4= SO4= H+
硫酸
+2e PbO2
Pb2+ PbSO4
铅酸蓄电池 (1860年--)
充电
(吸收电能)
负极 e
e 正极
Pb2+ PbSO4
+2e
Pb
Pb2+
H2O
PbSO4
物理化学课件:电化学

03
电化学保护
利用原电池原理或外加电流方法对金属进行保护,以延长其使用寿命。
电极过程动力学基础
01
极化现象
由于电极表面上的电流密度不同,导致电极电位发生偏离,称为极化现象。
02
腐蚀与防护
金属在某些环境中发生腐蚀,通过电化学方法可以减缓或防止金属腐蚀。
02
电池及电极过程
电池的组成
电池通常由正极、负极、电解质、隔膜和外壳等组成。
能源生产
利用电解和电合成技术处理废水、废气等污染物,实现环保和资源化利用。
环境保护
通过电解和电合成方法制备新型材料,如电池电极材料、光电器件等。
材料制备
电解和电合成应用
04
电化学分析方法
电极过程
电极过程是指发生在电极与电解质界面上的电荷转移过程,包括吸附、反应、双电层充电等。
电化学分析基本原理
电动势与电极电势
目前,燃料电池的研究集中在提高电池的效率和稳定性,以及降低成本等方面。
太阳能电池研究
03
目前,金属电沉积的研究主要集中在提高沉积质量和降低成本等方面。
金属电沉积研究
01
金属电沉积是指利用电化学方法在电极上沉积金属或合金的过程。
02
金属电沉积在工业上广泛应用于金属表面处理和材料制备等方面。
06
电化学应用领域
脉冲伏安法优缺点
03
脉冲伏安法具有高灵敏度、高分辨率等优点,但也存在一些缺点,如仪器复杂、对实验条件要求较高、数据处理繁琐等。
循环伏安法原理
循环伏安法是一种常用的电化学分析方法,通过在一定时间间隔内反复扫描电压,并测量电流响应的方法,可以获得电流随电压变化的关系曲线。
循环伏安法
天津大学物理化学第五章ppt

而第二项为:RT
νBln
B
pB p
RT ln
B
pB p
νB
RT
ln
B
pB p
νB
其中的
B
pB p
νB
是反应物及产物的
pB p
νB
的连乘积。
因为反应物计量系数 vB 为负,产物计量系数vB 为正,所以它
的形式是
p产 物 /p p反 应 物/p
ν产 物 ν反 应 物
有气相和凝聚相(液相、固体)共同参与的反应称为复 相化学反应。只考虑凝聚相是纯态的情况,纯态的化学势就 是它的标准态化学势,所以复相反应的热力学平衡常数只与 气态物质的压力有关。
例如,有下述反应,并设气体为理想气体:
CaCO3(s) ƒ CaO(s) CO2(g)
K$ peq (CO2 ,g) / p$
p(CO 2, g) 称为CaCO 3 (s) 的解离压力。
4. 有凝聚态物质参加的理想气体化学反应
如果产生的气体不止一种,则所有气体压力的总和称为 解离压。
例如: NH 4HS(s) NH3 (g) H2S(g)
解离压力 p p(NH3 ) p(H2S)
则热力学平衡常数:
Kө$
peq
(NH3 p$
(1) N2(g) 3H2(g) 2NH3(g)
1
3
(2) 2 N2(g) 2 H2(g) NH 3(g)
Δr Gm,1 RT lnK1 Δr Gm,2 RT lnK2
ΔrGm,1 2ΔrGm,2 K1 K2 2
所以,在给出化学反应标准平衡常数时,必须指明它所对应 的化学计量式。
4. 有凝聚态物质参加的理想气体化学反应
物理化学PPT电化学(新)

⒉电池 汽车、宇宙飞船、照明、通讯、 生化和医学等方面都要用不同类 型的化学电源。 ⒊电分析 ⒋生物电化学
本章学习基本要求
1 熟悉摩尔电导、迁移数、离子强度、平均活度、平均
活度因子、分解电压、极化等基本概念;
2 掌握能斯特方程的应用;能熟练地进行电极电势、电 动势以及电池反应的摩尔吉布斯函数、摩尔熵变、 摩尔反应焓等的计算; 3 能区分电极的类型,熟练地写出原电池的图解式,能 根据氧化还原反应进行原电池的设计。
电池中进行的任何反应与过程均为 可逆的电池才能被称为可逆电池。
组成可逆电池的必要条件
原电池
电解池
化学反应可逆
能量变化可逆
思考题
铅蓄电池可以设计成可逆电池吗?
铅蓄电池PbO2作正极,海绵状Pb作负 极,H2SO4作电解液。
放电 2H2SO4 充电
PbO2 + Pb +
2PbSO4 + 2H2O
(2)电池的书写 • 左边为负极,右边为正极,从左到右物质等 依实际顺序排列。 • 遇相界面用“|”表示,“||”表示盐桥,“┆” 表示半透膜、多孔塞等。 • 要注明物态,气体要注明压力;溶液要注明 浓度,常温常压和物质的状态十分明确的可以不注 明。 • 气体电极和氧化还原电极要写出导电的惰性 电极。 • 金属的接触电势一般不标出。
Qr,m T Δr Sm
§7.7 电极电势和液体接界电势
1. 电极电势
选氢电极作为参考标准,定义其在标准态
下的电极电势为0,以此电极为负极与欲测电
极组成电池,测得此电池的电动势即为欲测电
极的电极电势,也称为还原电极电势。
注:还原电极电势的高低,反映了该电极氧化 态物质获得电子的能力,电极电势越高,其夺 得电子的能力越强,反之亦然。
物理化学电化学课件

重金属离子去除。
物理化学电化学的发展历程
早期发展
物理化学电化学的早期发展可以追溯到18世纪,当时科学家开始研究电解现象和电池的 原理。
现代发展
20世纪以来,随着电子学和材料科学的快速发展,物理化学电化学在能源转换和储存、 工业应用以及环境监测与治理等领域取得了重要突破。
未来展望
随着可再生能源和环保意识的不断提高,物理化学电化学在未来将发挥更加重要的作用。 未来研究方向包括新型电池和燃料电池技术的开发、高效能量转换与储存材料的探索以及 环境友好型电化学过程的开发等。
恒温水浴
用于控制实验温度,保证实验 结果的准确性和可靠性。
电化学实验操作与安全
实验前应仔细阅读相关 操作规程和注意事项, 确保实验安全。
在实验过程中,应佩戴 防护眼镜、实验服和化 学防护手套等个人防护 用品。
避免使用易燃、易爆、 有毒或有腐蚀性的试剂 ,并确保实验室有良好 的通风 系统。
在实验结束后,应按照 实验室规定正确处理废 弃物,并确保实验室安 全卫生。
要点二
详细描述
物理化学电化学在生物医学领域的应用广泛,如生物传感 器、药物输送等。生物传感器可用于检测生物体内的物质 浓度,为疾病的诊断和治疗提供依据。药物输送方面,利 用物理化学电化学方法可将药物精准地输送到病变部位, 提高药物的疗效并降低副作用。此外,物理化学电化学还 可用于基因治疗、组织工程等领域的研究和应用。
电感的感抗
电感是衡量线圈产生自感电动 势能力的物理量,定义为线圈 的自感电动势与通过线圈的电 流的比值。
电容与电感的应用
电容和电感在电子电路中有着 广泛的应用,如滤波器、振荡 器、变压器等。
电解与电镀
电解的概念
电解是将电能转化为化学能的化 学反应过程,通过电解可实现金 属的提取和精炼、电解反应的合
优选物理化学_电化学总结PPT演示ppt

课件
第一页,共4页。
电池:电化能学能化学 电能 能: :电 原解 电池 池,构成
( 1)电解质溶液 ( 2)电极
内容:(1)电解质理论;(2)电极理论;(3)电池理论
基导本(i电定)机电律理解( (质mm 12) )溶v离 离(m液1子 子m,理的 在论电 电v-c迁 极)m移 上,::放K离o电h子lra独us立ch的导运公量电动式度能定力律( ( ( 312)) )摩电 电尔导 导电: 率导G:率:R1 G(Sm)Al (S+cv•(mS••1m)-v2
• mol1
1 v
)
电解质:Mv Av vM+ vA
+
+
•
b ,
bӨ
-
-
• b bӨ
v +
•
v -
•
b bӨ
1
b
bv +
•
bv -
v
1
• v
v
+
-
v
第二页,共4页。
课程总结
(ii)电极
氧化态 ne 还原态
构成( ( 12) )电 传解 到质 电溶 子液 的材料电极反应
能斯特方程:E
vB B
( 1)通过电池的电流趋于零时电池两极的电势差 电池电动势:E:( 2)E E阴极 E阳极
第三页,共4页。
课程总结
(iii)电极电势及电池电动势的应用
(1)计算电化学反应的热力学函数变
rGm
T ,P
W' max
nFE
rUm Q W nFE nFT
r Sm
nF
E T
P
大学课程《物理化学》各章节知识点汇总

第一定律的数学表达式
U Q W
对微小变化: dU Q W
等容热效应
dU Q W W pdV 0
dU QV
CV
QV
dT
U T
V
U QV ,
U nB
S ,V ,n j B
H nB
S, p,nj B
F nB
T ,V ,n j B
B
G nB
T , p,n j B
n B
S ,V ,n j B
F f (T ,V , n1, n2 )
H f (S, p, n1, n2 )
组成可变系统的热力学基本关系式:
dU TdS pdV BdnB
Q和W都不是状态函数,其数值与变化途径有关。
§1-4 可逆过程和体积功
一、体积功
因系统的体积变化而引起的系统与环境之间交换的功称
为体积功。 pe
W Fedl ( pe A)dl
ped ( Al) pedV
A
dl
pi
二、功与过程
功不是状态函数,其数值与过程有关。系统由同一始态 经不同的过程变化到同一终态,则体统对环境或环境对 体系所作的功不同。
p2 dp
压缩
p1
p1
p2 , V2
p1, V1
p2
V1
V2
W
V1 V2
pedV
( p V1
V2
i
dp)dV
V1 V2
pi dV
三、可逆过程
某系统经一系列的过程后,如果系统回到初始状态叫做 系统的复原;环境在经历一些的变化后,如果既没有功 的得失也没有热的得失就叫做环境的复原。
第五章电化学

电解池
电极①: 与外电源负极相接,是负极。 发生还原反应,是阴极。 Cu2++2e-→Cu(S)
①
②
电极②: 与外电源正极相接,是正极。 发生氧化反应,是阳极。 Cu(S)→ Cu2++2e-
物 理 化 学 简 明 教 程
(3). 几组基本概念 正极: 电势高的极称为正极,电流从正极流向 负极。在原电池中正极是阴极;在电解 池中正极是阳极。 负极: 电势低的极称为负极,电子从负极流向 正极。在原电池中负极是阳极;在电解 池中负极是阴极。
3.电解后含某离子的物质的量n(终了)。
4.写出电极上发生的反应,判断某离子浓度是增加了、减少了 还是没有发生变化。 5.判断离子迁移的方向。
物 理 化 学 简 明 教 程
【5-1】在Hittorf 迁移管中,用Ag电极电解AgNO3水溶液,电解前,溶 液中每 1kg 水中含 43.50 mmol AgNO3。实验后,串联在电路中的银库 仑计上有0.723mmol Ag析出。据分析知,通电后阳极区含 23.14g 水和 1.390 mmol AgNO3。试求Ag+和NO3-的离子迁移数。
上有4 mol 阴离子氧化,阴极上有4 mol阳离子还原。
两电极间正、负离子要共同承担4 mol电子电量的运输
任务。
现在离子都是一价的,则离子运输电荷的数量只取决于 离子迁移的速度。
物 理 化 学 简 明 教 程
设正、负离子迁移的速率相等, u+ = u- ,则导电任务各分 担2mol,在假想的AA、BB平面上各有2mol正、负离子逆向通 过。
物 理 化 学 简 明 教 程
Hittorf 法中必须采集的数据:
1. 通入的电量,由库仑计中称重阴极质量的增加而得,例如, 银库仑计中阴极上有0.0405 g Ag析出,
电化学 物理化学知识

3、 n n n 通入电量的电子摩尔数
离子迁移数——某离子i 运载的电量与通入溶液的
总电量之比。
Qi Qi ti Q Qi
ti 1
如果溶液中只有一种电解质,则:
Q Q t Q Q Q
Q Q t Q Q Q
t t 1
通电前后阳极区、阴极区的 浓度变化→Δn+和Δn电量计→ Q→Δn(Farady Law)
串联的电量计用于测定电 极反应的物质的量。
ห้องสมุดไป่ตู้
通过测定通电前后阳极区或 阴极区溶液中电解质浓度的变化, 可计算出对应区域中电解质的物 质的量的变化。
希托夫法测定离子迁移数的装置
若两电极均为惰性,则两电 极区的电解质溶液浓度均有所下 降。否则要进行物料衡算。
离子的电迁移率(离子淌度) 离子在指定溶液中电场强度E =1V · -1时的运动速度 m
Define:
vB vB uB E dU dl
cB→0, uB∞为极大值,称为离子的极限电迁移 率或无限稀释电迁移率
ti与电迁移率u的关系 v u u t v u u u
v u u t v u u u
例 题二
在25℃时,已知Ba(OH)2, BaCl2, NH4Cl溶液
无限稀释摩尔电导率分别为 512.88×104Sm2 mol1,277.99×104S m2 mol1,149.75×104 S m2 mol1,试计算25℃时NH3· 2O溶液的无限稀释 H 摩尔电导率Λ 解:
阳极 原电池 电解池 + 阴极 + -
在电解池中正极为 阳极,负极为阴极; 在原电池中则相反
原电池和电解池的比较
第五章 物理化学 电解质溶液

所有强电解质的Λm − c都近似成直线关系。 化学家Kohlrausch在实验基础上提出经验公式:
Λm
=
Λ
∞ m
(1
−
β
c)
该经验式只适用于强电解质的稀薄溶液。
其中,β 在一定温度下对于指定的电解质是一个常数。
Λ∞m是直线的截距,代表当c → 0时溶液的摩尔电导率,称为极限摩尔电导率。
2.
对于弱电解质,Λ
Λm
=
k c
c : mol ⋅ m-3
单位: Λm: S⋅ m2 ⋅ mol-1
注:任何电解质的
Λ
均是对1mol电解质而言。
m
例如:
1 1molNaCl, 1mol 2 H2SO4, 1molHAc
摩尔电导率的优点:
当这些电解质完全电离后所产生的正、负电荷均为1mol,这就为比较 不同电解质的导电能力提供了共同的基础。
2返回
离子的迁移数
在电解质溶液导电时,溶液所导的总电量是由溶液中的所有离子共同分担的, 其中某种离子所导的电量与总电量之比叫做该离子的迁移数,用符号t表示。
t+
=
Q+ Q
;
t-
=
;
由于 Q=Q+ +Q-
所以 t+ +t- =1
e上一内容 f下一内容 回主目录
2返回
在同一电解质溶液中,不同离子的迁移数代表它们对溶液导电所做 贡献的相对大小,由于两种离子的电迁移率不同,所以整个导电任 务并不是由它们平均分担的,它们的数值取决于离子电迁移率的 相对大小,即
3. Λm= κ 1÷c1=1.64×10-2÷(0.01×103)
=1.64×10-3( S·m2·mol-1 )
《物理化学》(电化学)知识点汇总

可逆电池热力学
一、电池反应的能斯特方程
aA dD gG hH
rGm
rGm
RT
ln
aGg aHh aAa aDd
(rGm )T ,P zEF
rGm zE F
EE
RT zF
ln
aGg aHh aAa aDd
能斯特方程
三、电极反应的能斯特方程
§5.5 原电池
等温、等压封闭体系: GT , p W '
可逆电化学反应:
rGT , p zEF
电池的书写方式
1. 发生氧化反应的负极写在左边,发生还原反应的正极写在右边。
2. 用单垂线“│”表示不同物相的界面,表明有接界电势的存在。 这种界面包括电极与溶液的界面,惰性电极与依附其上的气体或 液体之间的界面;用双垂线“ || ”代表盐桥,用以消除两种液体 的接界电势;用“,”代表混合溶液中的不同组分。
H / H2
H / H2
RT F
1 ln
aH
H2 Pt
0 8.314 298 ln1107 0.29 0.704V 96500
Fe2 / Fe H / H2 Zn2 / Zn, Fe最先析出
H / H2
H / H2
RT F
ln 1 aH
H2 Fe
0 8.314 298 ln1107 0.4 0.814V
m 则可以通过电解质的质量摩尔浓度计算得到。
1
m 对于质量摩尔浓度为
m
的电解质溶液有:
m m m m
1
m
(m
m
)
1
m
m
二、离子强度
《物理化学》第五章(电化学)知识点汇总

弱电解质: 电导率随浓度的变化不显著。
c/mol· dm-3
2. 摩尔电导率与浓度的关系 强电解质: 遵从科尔劳许经验关系:
m m (1 c )
m2· mol-1 Λ m/S·
HCl
NaOH AgNO3
Λ m -为极限摩尔电导率 弱电解质:
HAc
c /( mol dm )
3
$ RT aH 2 H / H ln 2 2 2 F aH
Cu
H
2
/ Cu
$ Cu 2 / Cu
aCu RT ln 2F aCu2
/ H2
$ H / H2
RT aH 2 ln 2 2 F aH
氧化态 ze 还原态
m Vm
m
1 Vm c
1mol 电解质
c
电导率
三、电导率、摩尔电导率与浓度的关系
1. 电导率与浓度的关系 强电解质: 浓度增加,电导率增加; 浓度增加到一定值后,低。 m-1 κ/S·
H2SO4
KOH NaOH NaCl HAc
2. 离子迁移数
定义:当电流通过电解质溶液时,某种离子迁移 的电量与通过溶液的总电量的比称为该离子的迁 移数。
Q r Q t = Q r r- Q Q-
Q t Q
Q- Q Q- -
r r r-
2. 摩尔电导率
是把含有1mol电解质的溶液置于相距1m的两个平行 电极之间,溶液所具有的电导。
( HCl ) ( NaAc ) m m m ( NaCl )
§5.4 溶液中电解质的活度和活度系数
大学课程《物理化学》各章节知识点汇总

1. 自由膨胀过程(即外压等于零):
W pedV
W
V2 V1
pedV
0
5
2. 恒定外பைடு நூலகம்膨胀(压缩)过程
a. 一次膨胀过程
p2
p2
膨胀
p1, V1
p2 , V2
p1
W
V2 V1
pedV
p2
p2 (V2 V1)
V1
V2
a ' .一次压缩过程
p1 p1
p2 , V2
压缩
p1, V1 p1
W
A (p1V1)
p
D
A S1(等 温)C S2 (等容) B
S
S1
S2
nR ln
p1
T
T
T
V1
p2
可逆相变过程的熵变
S Qr Qp H TT T
20
变温过程中熵变的计算
Q CdT
dS Q C dT
T
T
等容过程:
dT dS CV T
或
S
C T2
T1 V
dT T
等压过程:
dS
Cp
dT T
或
S
C T2
T1 p
dT T
压力、体积、温度都发生 变化的过程
U QV
T2 T1
CV
dT
等压热效应(p1 p2 pe ) U Q W
U U2 U1 Qp pe (V2 V1)
(U2 p2V2 ) (U1 p2V2 ) Qp
H2 H1 H Qp
dH Qp
Cp
Qp
dT
H T
p
pH Qp
T2 T1
C
《物理化学》第五章-电化学 ppt课件

0.05
0.830 0.823 0.815 0.823 0.818 0.574 0.529 0.340 0.304 0.556 0.230 0.202
第五章 电化学
(Charper 5 Electrochemistry)
电化学:研究电子导体/离子导体(电解质溶液)和离子 导体/离子导体的界面结构、界面现象及其变化过程与 机理的科学。
应用:1、生命现象最基本的过程是电荷运动。生 物电的起因可归结为细胞膜内外两侧的电势差。
a: 细胞的代谢作用可以借用电化学中的燃料电池的 氧化和还原过程来模拟;
根据离子的无限稀释摩尔电导率 m.、m.,可以计
算弱电解质的
m
,也可以用强电解质的
m
计算弱
电解质的
m
。
m (HA )C m (H ) m (A)c m (H ) m (A)c m (C)l m (C)l m (N)a m (N)a
m (H)C lm (Na) A m (cNa ) Cl
(1)在电极上发生化学反应的物质的量与通入 的电量成正比;
(2)通入相同的电量时,在各个电极上发生反 应的物质的量相同。
n = Q/zF 或 Q = nzF
Q = nzF
Q — 通入的电量 n — 参加反应的物质的量 z — 电极反应式中的电子计量系数 F — 法拉第常数(1 mol元电荷所具有的电量) F = e×L = 1.6022×10-19 C ×6.0221×1023 mol-1
课堂练习
1、在一定温度和较小的浓度情况下,增大强电解质溶液的浓
度,则溶液的电导率κ与摩尔电导率 m的变化为( B)
A、κ增大,
增大
m
B、κ增大, 减m 少
物理化学电化学基础

电导率与浓度的关系
•
摩尔电导率与浓度的关系
• 由于溶液中导电物质的量已给定,都为1mol,所 以,当浓度降低时,粒子之间相互作用减弱,正、 负离子迁移速率加快,溶液的摩尔电导率必定升 高。但不同的电解质,摩尔电导率随浓度降低而 升高的程度也大不相同。
电解质的Λm与c的关系
•
电解质的Λm 与c的关系
电解
电能
电池
化学能
• e
外电源
阴极 阳极 负极 正极
H
H2
Cl2
Cl
HCl溶液
(a)电解池
H2
e Cl2
阳极 阴极 e
负极 正极
e H
Pt
Cl Pt
HCl溶液
(b) 原电池
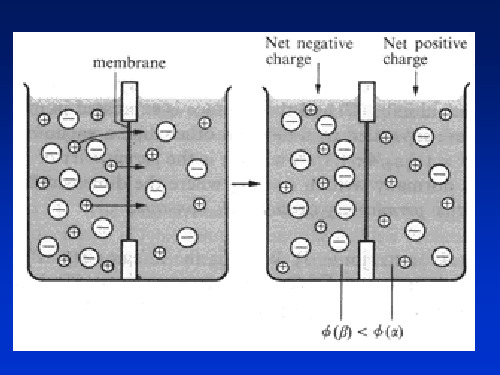
• 如上图所示:是一电解池,系由与外电源相连接的两个铂 电极插入HCl水溶液而构成。在溶液中,由于电场力的作 用,H+向着与外电源负极相连的、电势较低的Pt电极—— 负极迁移,而Cl-向着与外电源正极相连的、电势较高的 Pt电极——正极迁移。这些带电离子的定向迁移,形成了 电流在溶液中通过。
A
m
c
二、电解质溶液电导的测定
•
三、电导率、摩尔电导率与浓度的关系
• 强电解质溶液的电导率随着浓度的增加而升高。 当浓度增加到一定程度后,解离度下降,离子运 动速率降低,电导率也降低,如H2SO4和KOH溶液。
• 中性盐由于受饱和溶解度的限制,浓度不能太高, 如KCl。
• 弱电解质溶液电导率随浓度变化不显著,因浓度 增加使其电离度下降,粒子数目变化不大,如醋 酸。
• 由于不同离子的价数不同,发生1mol物质的电极反应所需 的电子数会不同,通过电极的电量自然也不同。例如, 1mol Cu2+在电极上还原为Cu需要2 mol电子,而1 molAg+ 在电极上还原为Ag 仅需要1 mol电子,所以通过电极的电 量:Q = nzF
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
m
m,
m,
弱电解质的极限摩尔电导率的计算:
m
(HAc)
m,
(H
)
m,
(
Ac
)
[m,
(H
)
m,
(Cl
)]
[m,
(
Na
)
m,
(
Ac
)]
[m,
(
Na
)
m,
(Cl
)]
m
(HCl)
物理化学第五章电化学知识点汇总
第五章 电化学
二、法拉第电解定律
法拉第电解定律:电解时,在任一电极上发生化 学反应的物质的量与通入的电量成正比;在几个 串联的电解池中通入一定的电量后,各个电极上 发生化学反应的物质的量相同。
n Q zF
Q nzF Z -电极反应中的
电子计量系数 F-法拉第常数
2. 离子迁移数
2. 摩尔电导率与浓度的关系 强电解质: 遵从科尔劳许经验关系:
m m(1 c) Λm -为极限摩尔电导率 弱电解质:
溶液稀释时,电解质电离度 迅速增大,离子数目急剧增 加,摩尔电导率迅速上升。
Λm/S·m2·mol-1
HCl
NaOH
HAc AgNO3
c
/(mol
dm3
)
1 2
四、离子独立运动规律
例2 在298K和标准压力下,用Pt作电极,以一定的电流密度 点解含有浓度均为1.00mol∙kg-1的Zn2+和Fe2+的中性溶液, 若Zn在Pt、Zn、Fe上的超电势分别为0.29V、0.4V、和0.7V。 试确定H+、Zn2+、Fe2+三种离子的析出顺序。设离子的活度 系数均等于1。
解:
H
e
H / H2
$ H / H2
RT F
1 ln
aH
H2 Pt
0 8.314 298 ln1107 0.29 0.704V 96500
Q Fe2 / Fe H / H2 Zn2 / Zn, Fe最先析出
m
( NaAc)
m
(
NaCl
)
§5.4 溶液中电解质的活度和活度系数
一、平均活度和平均活度系数
理想混合溶液:
B
$ B
(T )
RT
ln
mB m$
各种形态物质: B B$ (T ) RT ln B
电解质溶液:
B,m
B,m
mB m$
m m$
m m$
$ (T ) RT ln $ (T ) RT ln
2F a a H2 Cu2
$
Cu2 / Cu
RT 2F
ln
aCu aCu2
$ H
/
H
2
RT 2F
ln
aH2 a2
H
Cu2 / Cu
$ Cu2 / Cu
RT 2F
ln
aCu aCu2
H / H2
$ H / H2
RT 2F
ln
aH2 a2
H
氧化态 ze 还原态
=$ RT ln a还原态
m 则可以通过电解质的质量摩尔浓度计算得到。
1
m 对于质量摩尔浓度为
m
的电解质溶液有:
m m m m
1
m
(m
m
)
1
m
m
二、离子强度
I 1
2
B
mB zB2
三、德拜-休克尔极限定律
ln B AzB2 I
A=1.172mol-1/2∙kg1/2
ln Az z I
B
离子平均活度:
(
1
)
离子平均活度系数:
(
)
1
离子平均质量摩尔浓度活度:
m
(m
m
)
1
m m$
m m$
1
(
m m$
)
(
m m$
)
1
(
)
1
(m
m
)
1
1 m$
m m$
B
( m m$ )
可以通过依数性、电池电动势和溶解度等方法测定,
zF a氧化态
了解电极的分类及浓差电池
电极的极化与超电势 E可逆 可逆,阳 可逆,阴
阴 可逆,阴 不可逆,阴 阳 不可逆,阳 可逆,阳
阴极曲线
阳极曲线
E可逆
阳
阴
E不可逆
j/A∙m-2 j/A∙m-2
阴
阳
E可逆
阴 阳
/V
电解池中电极的极化曲线
E可逆
负
正
极 曲
阳 线
极
曲 线
阴
/V
原电池中电极的极化曲线
3. 注明物质的相态、压力(逸度)或浓度(活度)。
可逆电池热力学
一、电池反应的能斯特方程
aA dD gG hH
rGm
rGm$
RT
ln
aGg aHh aAa aDd
(rGm )T ,P zEF
rGm$ zE$ F
E
E$
RT zF
ln
aGg aHh aAa aDd
能斯特方程
三、电极反应的能斯特方程
1 2
H2
电极反应:
Fe2 2e Fe
Zn2 2e Biblioteka ZnZn2 / Zn$ Zn2 / Zn
RT 2F
ln
1 aZn2
0.763 8.314 298 ln1 0.763V 2 96500
Fe2 / Fe
$ Fe2 / Fe
RT 2F
ln
1 aFe2
0.440 8.314 298 ln1 0.440V 2 96500
§5.5 原电池
等温、等压封闭体系: GT , p W '
可逆电化学反应:
rGT , p zEF
电池的书写方式
1. 发生氧化反应的负极写在左边,发生还原反应的正极写在右边。
2. 用单垂线“│”表示不同物相的界面,表明有接界电势的存在。 这种界面包括电极与溶液的界面,惰性电极与依附其上的气体或 液体之间的界面;用双垂线“ || ”代表盐桥,用以消除两种液体 的接界电势;用“,”代表混合溶液中的不同组分。
Pt
|
H2
(
p)
|
H
(a H
)
||
Cu
2
(aCu2
)
|
Cu(s)
负极(氧化作用):
H2
(
p)
2H
(a H
)
2e
正极(还原作用): Cu2 /Cu
H / H2
Cu2 (aCu2 ) 2e Cu(s)
电池反应:
H2
(
p)
Cu
2
(aCu2
)
2H
(a H
)
Cu(s)
E E$
RT
ln
a2 H
aCu
定义:当电流通过电解质溶液时,某种离子迁移 的电量与通过溶液的总电量的比称为该离子的迁 移数。
t
Q Q
Q Q Q-
= r r r-
Q- Q- Q Q-
t Q
r r r-
2. 摩尔电导率
是把含有1mol电解质的溶液置于相距1m的两个平行 电极之间,溶液所具有的电导。
m Vm
m
1mol 电解质
Vm
1 c
c
电导率
三、电导率、摩尔电导率与浓度的关系
1. 电导率与浓度的关系
强电解质:
浓度增加,电导率增加; 浓度增加到一定值后,正 负离子间的作用力增大, 离子运动速率降低,导致 电导率降低。
κ/S·m-1
H2SO4
KOH NaOH NaCl
弱电解质: 电导率随浓度的变化不显著。
HAc
c/mol·dm-3
