《电化学基础》PPT课件
合集下载
《电化学基础》课件

电化学反应速率
总结词
电化学反应速率描述了电化学反应的快 慢程度,是衡量反应速度的重要参数。
VS
详细描述
电化学反应速率与参与反应的物质的浓度 、温度、催化剂等条件有关。在一定条件 下,反应速率可由实验测定,对于一些特 定的电化学反应,也可以通过理论计算来 预测其反应速率。
反应速率常数
总结词
反应速率常数是描述电化学反应速率的重要参数,它反映了电化学反应的内在性质。
详细描述
反应速率常数与参与反应的物质的性质、温度等条件有关。在一定条件下,反应速率常数可以通过实验测定,也 可以通过理论计算得到。反应速率常数越大,表示该反应的速率越快。
反应机理
总结词
电化学反应机理是描述电化学反应过程中各步骤的详细过程和相互关系的模型。
详细描述
电化学反应机理可以帮助人们深入理解电化学反应的本质和过程,从而更好地控制和优化电化学反应 。不同的电化学反应可能有不同的反应机理,同一电化学反应也可能存在多种可能的反应机理。 Nhomakorabea05
电化学研究方法
实验研究方法
01
重要手段
02
实验研究是电化学研究的重要手段,通过实验可以观察和测量电化学 反应的过程和现象,探究反应机理和反应动力学。
03
实验研究方法包括控制电流、电位、电场等电学参数,以及观察和测 量电流、电位、电导等电化学参数。
04
实验研究需要精密的实验设备和仪器,以及严格的操作规范和实验条 件控制。
01
02
03
电池种类
介绍不同类型电池的制造 过程,如锂离子电池、铅 酸电池、镍镉电池等。
电池材料
阐述电池制造过程中涉及 的主要材料,如正负极材 料、电解液、隔膜等。
大学无机化学-第七章-氧化还原反应-电化学基础-课件

② 分别写出氧化剂被还原和还原剂被氧化的半反应 ③ 分别配平两个半反应方程式,等号两边的各
种元素的原子总数各自相等且电荷数相等 ④ 确定两半反应方程式得、失电子数目的最小公倍
数。将两个半反应方程式中各项分别乘以相应的 系数,使得、失电子数目相同。然后,将两者合 并,就得到了配平的氧化还原反应的离子方程式。 有时根据需要可将其改为分子方程式。
3Cl2 (g) + 6OH- = 5Cl- + ClO3- + 3H2O 3Cl2 (g) + 6NaOH = 5NaCl + NaClO3 + 3H2O
无机化学
§7.1 氧化还原反应的基本概念
例 4 配平方程式
Cr(OH)3 (s) + Br2 (l) + KOH
K2CrO4 + KBr
Cr(OH)3 (s) + Br2 (l)
电极组成:Pt , Cl2(p) | Cl- (a)
电极反应: Cl2 + 2e
2Cl-
无机化学
§7.2 电化学电池
3. 金属-金属难溶盐-阴离子电极
将金属表面涂有其金属难溶盐的固体,然后浸 入与该盐具有相同阴离子的溶液中构成的电极
电极组成:Ag ,AgCl(s)| Cl- (a) 电极反应:AgCl + e Ag + Cl电极组成:Hg ,Hg2Cl2(s)| Cl- (a) 电极反应:Hg2Cl2+2e 2Hg +2Cl-
无机化学
§7.1 氧化还原反应的基本概念
2-2 半反应法(离子—电子法) 配平原则 (1)反应过程中氧化剂得到的电子数等于还
原剂失去的电子数 (2)反应前后各元素的原子总数相等
种元素的原子总数各自相等且电荷数相等 ④ 确定两半反应方程式得、失电子数目的最小公倍
数。将两个半反应方程式中各项分别乘以相应的 系数,使得、失电子数目相同。然后,将两者合 并,就得到了配平的氧化还原反应的离子方程式。 有时根据需要可将其改为分子方程式。
3Cl2 (g) + 6OH- = 5Cl- + ClO3- + 3H2O 3Cl2 (g) + 6NaOH = 5NaCl + NaClO3 + 3H2O
无机化学
§7.1 氧化还原反应的基本概念
例 4 配平方程式
Cr(OH)3 (s) + Br2 (l) + KOH
K2CrO4 + KBr
Cr(OH)3 (s) + Br2 (l)
电极组成:Pt , Cl2(p) | Cl- (a)
电极反应: Cl2 + 2e
2Cl-
无机化学
§7.2 电化学电池
3. 金属-金属难溶盐-阴离子电极
将金属表面涂有其金属难溶盐的固体,然后浸 入与该盐具有相同阴离子的溶液中构成的电极
电极组成:Ag ,AgCl(s)| Cl- (a) 电极反应:AgCl + e Ag + Cl电极组成:Hg ,Hg2Cl2(s)| Cl- (a) 电极反应:Hg2Cl2+2e 2Hg +2Cl-
无机化学
§7.1 氧化还原反应的基本概念
2-2 半反应法(离子—电子法) 配平原则 (1)反应过程中氧化剂得到的电子数等于还
原剂失去的电子数 (2)反应前后各元素的原子总数相等
电化学基础PPT教学课件

[解析] 化学反应符合设计要求.该氧化还原反应可拆 分为如下两个半反应: 氧化反应(负极反应):Cu-2e-===Cu2+, 还原反应(正极反应):2Fe3++2e-===2Fe2+.
结合原电池构成的条件可确定:负极材料为铜,正极材 料可用石墨,电解质溶液为FeCl3溶液.如果设计不带 盐桥装置的则用一烧杯,如果设计带盐桥装置的要考虑 两个烧杯中反应的特点,设计烧杯中的溶液,负极Cu 应放在CuCl2溶液中,正极碳棒应置于盛放FeCl3溶液的 烧杯中.
◇检查预习◇
2.“记”,古代散文的一种,主要是记载事物, 并通过记事、记物或写景、记人来抒发作者 的感情或见解,即景抒情,托物言志。
• 3.写病梅,疗梅。表达了作者疗梅的愿望和 决心。(表)
• 摧残人才,拯救人才。揭露和抨击了清朝封 建统治阶级,表达渴望人才、追求个性解放 的强烈愿望。(里)
1. 理解文中重要文言实词、虚词的
言志—— 揭露社会黑暗,人
才被埋没、扭曲;要求 政治改革,追求个性解 放。
问题三:概括本文的主题。
• 本文通过谴责人们对梅花的摧残, 形象地揭露和抨击了清朝封建统治阶 级束缚人民思想,压制摧残人才的罪 行,表达了要求改革政治、渴望人才、 追求个性解放的强烈愿望。
总结
谢谢大家 再见!
是与电源正极相连的活性阳极,若电极质量增加, 则该电极一定是与电源负极相连的阴极,此时溶液 中一定存在氧化性强于H+的金属离子.
3.在电解过程中,若阳极质量不变,则阳极一定是惰 性电极.若阴极质量不变,则此电极上一定有气体 产生,该气体一定是H2.
4.溶液中若阳离子的放电能力强于H+,而阴离子的放 电能力强于OH-时,电解的实质一定是电解电解质 本身,如CuCl2.
电化学基础-PPT课件

35
3. 氢镍电池是近年开发出来的可充电电池,
它可以取代会产生镉污染的镉镍电池。氢镍
电池的总反应式是:
1/2H2+NiO(OH)
Ni(OH)2
CD
据此反应判断,下列叙述中正确的是( )
A. 电池放电时,负极周围溶液的pH不
断增大
B. 电池放电时,镍元素被氧化
C. 电池充电时,氢元素被还原
D. 电池放电时,H2是负极
Ag
电解质溶液Y是__A_g_N__O_3_溶__液_;
(2)银电极为电池的___正_____极,CuSO4溶液 Y
发生的电极反应为__A_g_+__+__e_-__=_A__g___
X电极上发生的电极反应为
__C_u___-2__e_-___=__C__u_2_+__________;
(3)外电路中的电子是从__负__(_C_u_电) 极流向
14
6. 双液原电池的工作原理(有关概念)
(1)盐桥中装有饱和的KCl溶液和琼脂制成的 胶冻,胶冻的作用是防止管中溶液流出
(2)盐桥的作用是什么?
可提供定向移动的阴阳离子,
使由它连接的两溶液保持电
中性,盐桥保障了电子通过
外电路从锌到铜的不断转移
,使锌的溶解和铜的析出过 程得以继续进行。
盐桥的作用: (1)形成闭合回路。
?思考
1、银器皿日久表面逐渐变黑色,这是由于生成硫
化银,有人设计用原电池原理加以除去,其处理方 法为:将一定浓度的食盐溶液放入一铝制容器中, 再将变黑的银器浸入溶液中,放置一段时间后,黑 色会褪去而银不会损失。 试回答:在此原电池反应中,负极发生的反应
为 Al -3e- = Al3+ ; 正极发生的反应为 Ag2S+2e- = 2Ag;+S2-
3. 氢镍电池是近年开发出来的可充电电池,
它可以取代会产生镉污染的镉镍电池。氢镍
电池的总反应式是:
1/2H2+NiO(OH)
Ni(OH)2
CD
据此反应判断,下列叙述中正确的是( )
A. 电池放电时,负极周围溶液的pH不
断增大
B. 电池放电时,镍元素被氧化
C. 电池充电时,氢元素被还原
D. 电池放电时,H2是负极
Ag
电解质溶液Y是__A_g_N__O_3_溶__液_;
(2)银电极为电池的___正_____极,CuSO4溶液 Y
发生的电极反应为__A_g_+__+__e_-__=_A__g___
X电极上发生的电极反应为
__C_u___-2__e_-___=__C__u_2_+__________;
(3)外电路中的电子是从__负__(_C_u_电) 极流向
14
6. 双液原电池的工作原理(有关概念)
(1)盐桥中装有饱和的KCl溶液和琼脂制成的 胶冻,胶冻的作用是防止管中溶液流出
(2)盐桥的作用是什么?
可提供定向移动的阴阳离子,
使由它连接的两溶液保持电
中性,盐桥保障了电子通过
外电路从锌到铜的不断转移
,使锌的溶解和铜的析出过 程得以继续进行。
盐桥的作用: (1)形成闭合回路。
?思考
1、银器皿日久表面逐渐变黑色,这是由于生成硫
化银,有人设计用原电池原理加以除去,其处理方 法为:将一定浓度的食盐溶液放入一铝制容器中, 再将变黑的银器浸入溶液中,放置一段时间后,黑 色会褪去而银不会损失。 试回答:在此原电池反应中,负极发生的反应
为 Al -3e- = Al3+ ; 正极发生的反应为 Ag2S+2e- = 2Ag;+S2-
《电化学基础 》课件

电化学基础
电化学基础是研究电化学原理与应用的基础知识。电化学研究从化学反应中 产生电压、电流和电功率之间的相互作用,为科学和工业界提供了广泛的应 用。
定义
1 电化学
电化学是研究电流、电 势和电解过程中化学反 应的分支领域。
2 电感耦合
一个电子器件、传感器 或转换器用磁性耦合原 理将信号从一个电路传 送到另一个电路。
应用案例
1
节能灯
电化学领域的典型应用之一,催化层的材料选择是节能灯的成本决定因素。
2
肝素
肝素制备的中间体是一种糖,用电化学方法可以制备这种糖。
3
锂离子电池
锂离子电池正极材料由氧化物和其他元素经过多次烧结制备而成。
学习方法
1 精读重点内容
化学和物理的基础课程 是学习电化学重要的基 础。
2 参加相关学术会议
电化学池
可控制体系内离子的浓度,以适用于电化学 研究。
扫描电子显微镜
可通过成像和分析的手段观察样品形态、尺 寸、形貌等信息。
反应动力学
反应速率
电极反应性能
电化学反应速率可能受到温度、 电流密度、电极表面等因素的 影响。
电极表面材料和形貌会影响反 应动力学。
动力学基础
对电分析反应进行研究,可为 其他电化学研究领域提供理论 基础。
3 电池
一种能将化学能转化为 电能的设备。
重要性
能源
电化学研究为制造更高效、更 环保的能源提供了理论基础。
医学
电化学技术在医学领域中有潜 在的广阔应用领域。
电子产品
电化学原理及材料,如半导体、 电容器等,应用广泛于电子产 品中。
交通运输
电化学技术正在推动电动汽车 和混合动力汽车的发展。
电化学基础是研究电化学原理与应用的基础知识。电化学研究从化学反应中 产生电压、电流和电功率之间的相互作用,为科学和工业界提供了广泛的应 用。
定义
1 电化学
电化学是研究电流、电 势和电解过程中化学反 应的分支领域。
2 电感耦合
一个电子器件、传感器 或转换器用磁性耦合原 理将信号从一个电路传 送到另一个电路。
应用案例
1
节能灯
电化学领域的典型应用之一,催化层的材料选择是节能灯的成本决定因素。
2
肝素
肝素制备的中间体是一种糖,用电化学方法可以制备这种糖。
3
锂离子电池
锂离子电池正极材料由氧化物和其他元素经过多次烧结制备而成。
学习方法
1 精读重点内容
化学和物理的基础课程 是学习电化学重要的基 础。
2 参加相关学术会议
电化学池
可控制体系内离子的浓度,以适用于电化学 研究。
扫描电子显微镜
可通过成像和分析的手段观察样品形态、尺 寸、形貌等信息。
反应动力学
反应速率
电极反应性能
电化学反应速率可能受到温度、 电流密度、电极表面等因素的 影响。
电极表面材料和形貌会影响反 应动力学。
动力学基础
对电分析反应进行研究,可为 其他电化学研究领域提供理论 基础。
3 电池
一种能将化学能转化为 电能的设备。
重要性
能源
电化学研究为制造更高效、更 环保的能源提供了理论基础。
医学
电化学技术在医学领域中有潜 在的广阔应用领域。
电子产品
电化学原理及材料,如半导体、 电容器等,应用广泛于电子产 品中。
交通运输
电化学技术正在推动电动汽车 和混合动力汽车的发展。
电化学基本概念ppt课件
i i
两相间建立平衡电势
电极(Electrode)
电极材料/电解质
Zn|Zn2+, SO42Pt|H2,H+ Fe|Fe3O4|Fe2O3|水溶液
电极(Electrode)
电极材料/电解质 •传递电荷
Zn|Zn2+,SO42-,
•氧化或还原反应
Pt|H2,H+
的地点
•“半电池”
Fe|Fe3O4|Fe2O3|水溶液
法拉弟定律的几个要点
1. 电和化学反应相互作用的定量关系 2. 不受电极、外界条件的影响 3. 适用于多个电化学装置的多个反应(串联)
e-
i
H2
Cl2
Na+
Cl-
Ag
Ag+
ei
Ag+
Ag+
H+
OH-
阴极
阳极
H+
NO3-
银阴极 银阳极
法拉弟定律的几个要点
1. 电和化学反应相互作用的定量关系 2. 不受电极、外界条件的影响 3. 适用于多个电化学装置的多个反应(串联) 4. 适用于单个电化学装置的多个反应(并联)
I
负极 e
e 正极
-2e Pb
Pb2+ PbSO4
H2O H+
SO4= SO4= H+
硫酸
+2e PbO2
Pb2+ PbSO4
铅酸蓄电池 (1860年--)
充电
(吸收电能)
负极 e
e 正极
Pb2+ PbSO4
+2e
Pb
Pb2+
H2O
PbSO4
电化学基础说课课件ppt

说课标
新课标:“改变课程实施过于强调接受 学习、死记硬背、机械训练的状态,倡导 学生主动学习、乐于探究、勤于动手,培 养学生搜集和处理信息的能力,获取新知 识的能力,分析问题和解决问题的能力以 及交流与合作的能力。”
从使用情况来看,闭胸式的使用比较 广泛。 敞开式 盾构之 中有挤 压式盾 构、全 部敞开 式盾构 ,但在 近些年 的城市 地下工 程施工 中已很 少使用 ,在此 不再说 明。
【自我测试】
下列装置属于原电池的是( )
从使用情况来看,闭胸式的使用比较 广泛。 敞开式 盾构之 中有挤 压式盾 构、全 部敞开 式盾构 ,但在 近些年 的城市 地下工 程施工 中已很 少使用 ,在此 不再说 明。
璇怒截巫
机激断山
散狂江神三 落涛流女峡 海撞意弄颂 西斗不阴
明碎平晴
。,,,
从使用情况来看,闭胸式的使用比较 广泛。 敞开式 盾构之 中有挤 压式盾 构、全 部敞开 式盾构 ,但在 近些年 的城市 地下工 程施工 中已很 少使用 ,在此 不再说 明。
从使用情况来看,闭胸式的使用比较 广泛。 敞开式 盾构之 中有挤 压式盾 构、全 部敞开 式盾构 ,但在 近些年 的城市 地下工 程施工 中已很 少使用 ,在此 不再说 明。
【动画模拟】
Zn -
负 极
A
电流计
Zn→Zn2+
Zn2+
H+ H+
Zn-2e-=Zn2+
(氧化反应)
稀硫酸
正极
Cu
原 电
池
工 H+→H2↑
从使用情况来看,闭胸式的使用比较 广泛。 敞开式 盾构之 中有挤 压式盾 构、全 部敞开 式盾构 ,但在 近些年 的城市 地下工 程施工 中已很 少使用 ,在此 不再说 明。
新课标:“改变课程实施过于强调接受 学习、死记硬背、机械训练的状态,倡导 学生主动学习、乐于探究、勤于动手,培 养学生搜集和处理信息的能力,获取新知 识的能力,分析问题和解决问题的能力以 及交流与合作的能力。”
从使用情况来看,闭胸式的使用比较 广泛。 敞开式 盾构之 中有挤 压式盾 构、全 部敞开 式盾构 ,但在 近些年 的城市 地下工 程施工 中已很 少使用 ,在此 不再说 明。
【自我测试】
下列装置属于原电池的是( )
从使用情况来看,闭胸式的使用比较 广泛。 敞开式 盾构之 中有挤 压式盾 构、全 部敞开 式盾构 ,但在 近些年 的城市 地下工 程施工 中已很 少使用 ,在此 不再说 明。
璇怒截巫
机激断山
散狂江神三 落涛流女峡 海撞意弄颂 西斗不阴
明碎平晴
。,,,
从使用情况来看,闭胸式的使用比较 广泛。 敞开式 盾构之 中有挤 压式盾 构、全 部敞开 式盾构 ,但在 近些年 的城市 地下工 程施工 中已很 少使用 ,在此 不再说 明。
从使用情况来看,闭胸式的使用比较 广泛。 敞开式 盾构之 中有挤 压式盾 构、全 部敞开 式盾构 ,但在 近些年 的城市 地下工 程施工 中已很 少使用 ,在此 不再说 明。
【动画模拟】
Zn -
负 极
A
电流计
Zn→Zn2+
Zn2+
H+ H+
Zn-2e-=Zn2+
(氧化反应)
稀硫酸
正极
Cu
原 电
池
工 H+→H2↑
从使用情况来看,闭胸式的使用比较 广泛。 敞开式 盾构之 中有挤 压式盾 构、全 部敞开 式盾构 ,但在 近些年 的城市 地下工 程施工 中已很 少使用 ,在此 不再说 明。
化学课件《电化学基础》优秀ppt8(10份打包) 人教课标版4

(2)原电池电极反应式的书写: ①一般电极反应式的书写:
②复杂电极反应式的书写
复杂电
较简单一极的
极反应式 = 总反应式 - 电极反应式
如:CH4 酸性燃料电池中: 总反应式:CH4+2O2===CO2+2H2O, 正极反应式:2O2+8H++8e-===4H2O, 则:负极反应式=总反应式-正极反应式,
阳极:阳极材料是活泼电极时阳极材料放电,否则是溶液中阴离 子放电,放电顺序是:活泼金属>S2->I->Br->Cl->OH->SO24->F-。
阴极:一般是溶液中的阳离子放电,金属活动性顺序的逆顺序。 阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Fe2+>Zn2+>H+ (水)>活泼金属阳离子。
【答案】 D 【点拨】 近年来高考中对化学电源的考查趋向于以新型电池为 素材,这类试题具有取材新颖、信息陌生、情景综合等特点,侧重于 考查运用所学知识解决实际问题的能力。这类题起点很高,但落点还 是在基础知识和基本规律上,且设错通常较为明显。因此,面对新颖
的化学电源,不要因其电极材料和电极反应、电池反应陌生而感到无 所适从,依据放电、充电的基本知识和规律审题,即可化生为熟、化 难为易。
[例 4] 以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意 图如下:
下列说法不正确的是( )
A.在阴极室,发生的电极反应为:2H2O+2e-===2OH-+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区 H
+浓度增大,使平衡 2CrO24-+2H+
Cr2O27-+H2O 向右移动
【答案】 D 【点拨】 首先根据外接电源的正负极判断电解池的电极,其次
《电化学基础》课件

学习储能装置和电池技术的原 理,如锂离子电池和太阳能电 池。
燃料电池和电化学传感器
燃料电池
探索燃料电池的原理与应用,如氢燃料电池和燃料电池汽车。
电化学传感器
了解电化学传感器的工作原理,以及其在环境监测和医学诊断中的应用。
《电化学基础》PPT课件
本PPT课件将介绍电化学的基础理论、动力学、电池与电解池、电化学表征技 术以及电化学的应用领域,带你深入了解这个令人着迷的领域。
电化学基础理论
1 电化学基础概念
2 电化学反应的基本
学习电化学的基础概念,
特征和实验表征方 法
包括电解质、离子和电
探索电化学反应的特征
子传输。
以及实验方法,包括溶
了解反应速率和速率常数的 定义及其在动力学研究中的 重要性。
电池和电解池
1
电池和电解池的基本概念
探索电池与电解池的原理和应用,包
奥姆定律和纳尔斯特方程
2
括电子转移和离子传输过程。
学习奥姆定律和纳尔斯特方程,揭示
电池和电解池中电流与电势之间的关
系。
3
活性质量、化学放电和电化学 效率
和计时电流法
深入了解线性扫描伏安法和循环伏安法的 原理和应用。
探索电位阶跃法和计时电流法在电化学研 究中的重要性。
电化学应用
电催化和电极催化反应
电化学合成和电化学分析 储能装置和电池技术
了解电催化和电极催化反应的 应用,如催化转化和废水处理。
探索电化学合成和电化学分析 在化学工业和实验室中的应用。
电解和电沉积过程
4
响,以及化学放电和电化学效率的计
算。
了解电解和电沉积在电化学中的应用
以及相关实验和工业过程。
第十一章电化学基础.ppt

④确定两半反应方程式得、失电子数目的最小公倍数。 将两个半反应方程式中各项分别乘以相应的系数,使得、 失电子数目相同。然后,将两者合并,就得到了配平的氧 化还原反应的离子方程式。有时根据需要可将其改为分e2(SO4)3 + K2SO4+ H2O
(3)若出现分数,可调整为最小正整数:
2 KMnO4 +10 FeSO4 + H2SO4 = 2 MnSO4 + 5 Fe2(SO4)3 + K2SO4 + H2O
(4) 配平各元素原子数(观察法)
先配平非H、O原子,后配平H、O原子。 1)配平K+、SO42-数目 SO42-:左11,应+7;右18
配平原则: ① 电荷守恒:氧化剂得电子数等于还原剂失电子数。
② 质量守恒:反应前后各元素原子总数相等。
配平步骤:
①用离子式写出主要反应物和产物(气体、纯液体、固 体和弱电解质则写分子式)。
②分别写出氧化剂被还原和还原剂被氧化的半反应。
③分别配平两个半反应方程式,等号两边的各种元素 的原子总数各自相等且电荷数相等。
3)配平(或核对)O的原子数目:已平衡。
对于电解质在溶液中的反应,也可通过“离子方程 式”表示(更简洁),配平步骤类似: MnO4- + Fe2+ + H+ Mn2+ + Fe3+ + H2O
MnO4- + 5 Fe2+ + H+ Mn2+ + 5 Fe3+ + H2O
MnO4- + 5 Fe2+ + 8 H+ Mn2+ + 5 Fe3+ + H2O
(3)若出现分数,可调整为最小正整数:
2 KMnO4 +10 FeSO4 + H2SO4 = 2 MnSO4 + 5 Fe2(SO4)3 + K2SO4 + H2O
(4) 配平各元素原子数(观察法)
先配平非H、O原子,后配平H、O原子。 1)配平K+、SO42-数目 SO42-:左11,应+7;右18
配平原则: ① 电荷守恒:氧化剂得电子数等于还原剂失电子数。
② 质量守恒:反应前后各元素原子总数相等。
配平步骤:
①用离子式写出主要反应物和产物(气体、纯液体、固 体和弱电解质则写分子式)。
②分别写出氧化剂被还原和还原剂被氧化的半反应。
③分别配平两个半反应方程式,等号两边的各种元素 的原子总数各自相等且电荷数相等。
3)配平(或核对)O的原子数目:已平衡。
对于电解质在溶液中的反应,也可通过“离子方程 式”表示(更简洁),配平步骤类似: MnO4- + Fe2+ + H+ Mn2+ + Fe3+ + H2O
MnO4- + 5 Fe2+ + H+ Mn2+ + 5 Fe3+ + H2O
MnO4- + 5 Fe2+ + 8 H+ Mn2+ + 5 Fe3+ + H2O
电化学基本知识ppt课件

电池过程
阴极
阳极
ZnSO4
CuSO4
Zn
Cu
盐桥
1.1 V
典型电化学过程
e
电化学过程的特点
Zn(s) + CuSO4(aq) ZnSO4(aq) + Cu(s) 半反应: Zn(s) Zn2+ + 2e- 阳极反应 Cu2+ + 2e- Cu(s) 阴极反应 电子不能在离子导体中运动 离子不能在电子导体中运动 即:电子与离子间必定在界面处发生了转化,这个转化就发生在离子导体和电子导体的界面处。
高频区为电极反应动力学(电荷传递过程)控制,低频区由电极反应的反应物或产物的扩散控制。
从图可得体系R、Rct、Cd以及参数,与扩散系数有关,利用它可以估算扩散系数D。由Rct可计算i0和k0。
扩散阻抗的直线可能偏离45,原因:
电极表面很粗糙,以致扩散过程部分相当于球面扩散; 除了电极电势外,还有另外一个状态变量,这个变量在测量的过程中引起感抗。
盐桥
1. 可以同时测量极化电流和极化电位; 2. 三电极两回路具有足够的测量精度。
三电极的优点
1.2.5.1 辅助电极的作用 实现WE导电并使WE电力线分布均匀。 1.2.5.2 辅助电极的要求 ①辅助电极面积大; 为使参比电极等势面,应使辅助电极面积增大,以保证满足研究电极表面电位分布均匀,如是平板电极: ; ②辅助电极形状应与研究电极相同,以实现均匀电场作用。
参比电极
常见的参比电极 ①甘汞电极; Hg|Hg2Cl2|Cl- 由于Hg+→Hg2+ (亚汞不稳定,高温时易变成Hg2+,受温度影响大。<70℃,另外,[Cl-]要饱和,防止 发生变化)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
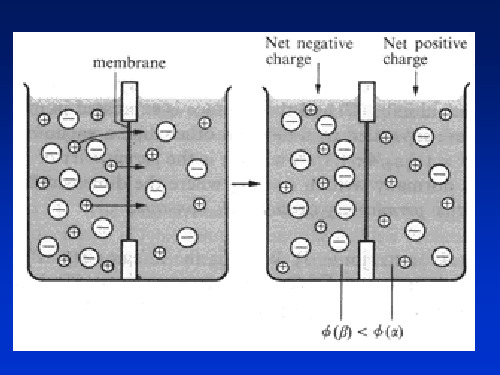
一、电极电势的产生 原电池可产生电流,说明两电极间形成了电势
差。当电池内部无电流通过或通过的电流极小而接 近于零时,所测得的电势差就等于原电池的电动势E, 它代表了正负电极之间的电势差,即:
E= E + - E -
问题:单个电极的电势是怎样产生的? 为什么不同电极具有不同的电势?
+++++ +++++
氧化值:把反映电子偏移情况的“形式电荷”数称为 “氧化值”。
(1)在单质中元素的氧化值等于零,因为原子间成键 电子并不偏离一个原子而靠近另一个原子。
(2)在二元离子化合物中,各元素的氧化值和离子的 电荷数相一致。
(3)在共价化合物中,成键电子对总是向电负性大的 元素靠近,所以电负性最大的F元素氧化值总是-1, 电负性次大的O元素一般为-2(在过氧化物中为-l, 在氟化物OF2、O2F2中分别为十2和十1 ),最常见 的H元素一般为+1(在盐型氢化物中为-1)。然后 按照化合物中各元素氧化值的代数和等于零(即整个 分子必定电中性)的原则来确定其他元素的氧化值。
金属-金属难 溶盐电极
Hg2Cl2 / Hg
Hg | Hg2Cl2 (s) | Cl-(c) Hg2Cl2+2e- =2Hg + 2Cl-
氢气电极
甘汞电极
例:将下列反应组装成原电池
2Al + 3NiCl2
2AlCl3 + 3Ni
解 负极:Al(s) →Al3+ + 3e正极:Ni2+ + 2e- → Ni(s)
负极反应: Zn(s) 还原态
Zn2+(aq) + 2e氧化态
正极反应: Cu2+ (aq) + 2e氧化态
Cu (s) 还原态
(3) 氧化还原电对
氧化反应: 还原态 - ne 还原反应: 氧化态+ ne
氧化态 还原态
这种同一元素的氧化态与还原态彼此依靠,相互转
化的关系,是一个共轭关系。这种关系称为氧化还 原电对,简称电对。
在负极上发生Zn的氧化反应: Zn(s)=Zn2+(aq)+2e- 即阳极
在正极上发生Cu2+的还原反应:Cu2+(aq)+2e-=Cu(s) 即阴极
(2)从铜锌原电池的电极反应看,每一电极上参加 反应的物质和生成的物质,都是由同一元素不同 价态的物质组成,通常把其中低价态物质叫还原 态物质(可作还原剂),高价态物质叫氧化态物 质(可作氧化剂)。
2、按实际顺序用化学式从左到右依次排列出各电池 物质,气体要标明压力,溶液要标明浓度。
3、用“|”表示相与相之间的界面,用逗号表示可混溶 的液相之间的接界,用“||”表示盐桥。
4、气体电极和氧化还原电极要写出导电的惰性电极, 通常是铂电极。
例如:Cu-Zn原电池可表示为
(-) Zn(s)|ZnSO4(c1) || CuSO4(c2)|Cu(s) (+)
Zn(s)|ZnSO4||H2SO4|H2(p),Pt
电池的书写 AgCl(s)→Ag++Cl解: (-) Ag(s) →Ag++e(+) AgCl(s)+e-→Ag(s)+Cl-
电池反应:AgCl(s)→Ag++Cl-
Ag(s)|Ag+(aq)||HCl(aq)|AgCl(s)|Ag(s)
第3节 原电池电动势和电极电势
利用氧化还原反应产生电流的装置,即使化学能 转变为电能的装置叫做原电池。
如:Zn(s) + Cu2+(aq) = Zn2+(aq) + Cu(s)
氧化半反应: Zn - 2e- = Zn 2+ 还原剂
还原半反应: Cu 2+ + 2e- = Cu 氧化剂
Cu-Zn电池
若干概念
(1) 正、负极,阴、阳极。 如:电池反应 Zn(s) + Cu2+(aq) = Zn2+(aq) + Cu(s)
一般表达式: 氧化态+ne
还原态
习惯将电对表达为: 氧化态/还原态 或 Ox / Red 比如:Fe3+/Fe2+, O2/OH-, Hg2Cl2/Hg, MnO4-/Mn2+ 等。 (4)任一自发的氧化还原反应都可以组成一个原电池。
二、原电池的表示方法
1、左边为负极,起氧化作用; 右边为正极,起还原作用。
电池反应: 2Al(s) + 3Ni2+ → 2 Al3+ +3Ni(s)
(-)Al(s)|Al3+(c1)‖Ni2+(c2)|Ni(s)(+)
电池的书写 Zn(s)+H2SO4(aq)→H2(p)+ZnSO4(aq) 解: (-) Zn(s) →Zn2++2e(+) 2H++2e-→H2(p) 电池反应:Zn(s)+2H+→Zn2++H2(p)
注:氧化值不一定为整数,如Na2S4O6中S的氧化值 是2.5。
2. 氧化还原反应 定义:元素的氧化值发生了变化的化学反应。
Cu(s) +1/2O2(g) →CuO(s) CuO(s) + H2(g) → Cu(s) + H2O(l) Sn2++Fe3+ → Sn4+ + Fe2+
存在着两个半反应: 氧化值升高的反应 ——氧化反应 氧化值降低的反应—— 还原反应
+++++ ++++
+
----- -----
-----
相应的 氧化值升高的物种 (元素)—— 还原剂 氧化值降低的物种 (元素)—— 氧化剂
如:反应 Cu(s) + 2Ag+(aq) = Cu2+(aq) + 2Ag(s)
氧化半反应: 还原半反应:
Cu(s)=Cu2+(aq)+2e-
还原剂
2Ag+(aq)+2e-=2Ag(s)
氧化剂
第2节 原电池 一、原电池
三、电极的种类
电极类型
金属-金属离 子电极
电对示例
Zn2+/ Zn
电极符号
Zn | Zn2+(c)
气体电极
Cl2 / Cl-
Pt, Cl2(p) | C; 2e- = Zn
Cl2 + 2e- = 2Cl-
离子型 电极
Fe3 + / Fe2+ Pt | Fe2+(c1), Fe3+(c2) Fe3+ + e- = Fe2+
第5章 电化学基础
电解
电能
电池
化学能
2019/5/8
第1节 氧化还原反应
一、氧化值(或氧化数)
Fe + Cu2+
Fe2+ + Cu
1 H2 2 O2
H2O
O HH
每个O-H键含有一对成键电子,由 于氧的电负性大,可看作H原子失 去1个电子,其“形式电荷”为+1; 而氧原子由于得到2个电子, “形 式电荷”为-2。
差。当电池内部无电流通过或通过的电流极小而接 近于零时,所测得的电势差就等于原电池的电动势E, 它代表了正负电极之间的电势差,即:
E= E + - E -
问题:单个电极的电势是怎样产生的? 为什么不同电极具有不同的电势?
+++++ +++++
氧化值:把反映电子偏移情况的“形式电荷”数称为 “氧化值”。
(1)在单质中元素的氧化值等于零,因为原子间成键 电子并不偏离一个原子而靠近另一个原子。
(2)在二元离子化合物中,各元素的氧化值和离子的 电荷数相一致。
(3)在共价化合物中,成键电子对总是向电负性大的 元素靠近,所以电负性最大的F元素氧化值总是-1, 电负性次大的O元素一般为-2(在过氧化物中为-l, 在氟化物OF2、O2F2中分别为十2和十1 ),最常见 的H元素一般为+1(在盐型氢化物中为-1)。然后 按照化合物中各元素氧化值的代数和等于零(即整个 分子必定电中性)的原则来确定其他元素的氧化值。
金属-金属难 溶盐电极
Hg2Cl2 / Hg
Hg | Hg2Cl2 (s) | Cl-(c) Hg2Cl2+2e- =2Hg + 2Cl-
氢气电极
甘汞电极
例:将下列反应组装成原电池
2Al + 3NiCl2
2AlCl3 + 3Ni
解 负极:Al(s) →Al3+ + 3e正极:Ni2+ + 2e- → Ni(s)
负极反应: Zn(s) 还原态
Zn2+(aq) + 2e氧化态
正极反应: Cu2+ (aq) + 2e氧化态
Cu (s) 还原态
(3) 氧化还原电对
氧化反应: 还原态 - ne 还原反应: 氧化态+ ne
氧化态 还原态
这种同一元素的氧化态与还原态彼此依靠,相互转
化的关系,是一个共轭关系。这种关系称为氧化还 原电对,简称电对。
在负极上发生Zn的氧化反应: Zn(s)=Zn2+(aq)+2e- 即阳极
在正极上发生Cu2+的还原反应:Cu2+(aq)+2e-=Cu(s) 即阴极
(2)从铜锌原电池的电极反应看,每一电极上参加 反应的物质和生成的物质,都是由同一元素不同 价态的物质组成,通常把其中低价态物质叫还原 态物质(可作还原剂),高价态物质叫氧化态物 质(可作氧化剂)。
2、按实际顺序用化学式从左到右依次排列出各电池 物质,气体要标明压力,溶液要标明浓度。
3、用“|”表示相与相之间的界面,用逗号表示可混溶 的液相之间的接界,用“||”表示盐桥。
4、气体电极和氧化还原电极要写出导电的惰性电极, 通常是铂电极。
例如:Cu-Zn原电池可表示为
(-) Zn(s)|ZnSO4(c1) || CuSO4(c2)|Cu(s) (+)
Zn(s)|ZnSO4||H2SO4|H2(p),Pt
电池的书写 AgCl(s)→Ag++Cl解: (-) Ag(s) →Ag++e(+) AgCl(s)+e-→Ag(s)+Cl-
电池反应:AgCl(s)→Ag++Cl-
Ag(s)|Ag+(aq)||HCl(aq)|AgCl(s)|Ag(s)
第3节 原电池电动势和电极电势
利用氧化还原反应产生电流的装置,即使化学能 转变为电能的装置叫做原电池。
如:Zn(s) + Cu2+(aq) = Zn2+(aq) + Cu(s)
氧化半反应: Zn - 2e- = Zn 2+ 还原剂
还原半反应: Cu 2+ + 2e- = Cu 氧化剂
Cu-Zn电池
若干概念
(1) 正、负极,阴、阳极。 如:电池反应 Zn(s) + Cu2+(aq) = Zn2+(aq) + Cu(s)
一般表达式: 氧化态+ne
还原态
习惯将电对表达为: 氧化态/还原态 或 Ox / Red 比如:Fe3+/Fe2+, O2/OH-, Hg2Cl2/Hg, MnO4-/Mn2+ 等。 (4)任一自发的氧化还原反应都可以组成一个原电池。
二、原电池的表示方法
1、左边为负极,起氧化作用; 右边为正极,起还原作用。
电池反应: 2Al(s) + 3Ni2+ → 2 Al3+ +3Ni(s)
(-)Al(s)|Al3+(c1)‖Ni2+(c2)|Ni(s)(+)
电池的书写 Zn(s)+H2SO4(aq)→H2(p)+ZnSO4(aq) 解: (-) Zn(s) →Zn2++2e(+) 2H++2e-→H2(p) 电池反应:Zn(s)+2H+→Zn2++H2(p)
注:氧化值不一定为整数,如Na2S4O6中S的氧化值 是2.5。
2. 氧化还原反应 定义:元素的氧化值发生了变化的化学反应。
Cu(s) +1/2O2(g) →CuO(s) CuO(s) + H2(g) → Cu(s) + H2O(l) Sn2++Fe3+ → Sn4+ + Fe2+
存在着两个半反应: 氧化值升高的反应 ——氧化反应 氧化值降低的反应—— 还原反应
+++++ ++++
+
----- -----
-----
相应的 氧化值升高的物种 (元素)—— 还原剂 氧化值降低的物种 (元素)—— 氧化剂
如:反应 Cu(s) + 2Ag+(aq) = Cu2+(aq) + 2Ag(s)
氧化半反应: 还原半反应:
Cu(s)=Cu2+(aq)+2e-
还原剂
2Ag+(aq)+2e-=2Ag(s)
氧化剂
第2节 原电池 一、原电池
三、电极的种类
电极类型
金属-金属离 子电极
电对示例
Zn2+/ Zn
电极符号
Zn | Zn2+(c)
气体电极
Cl2 / Cl-
Pt, Cl2(p) | C; 2e- = Zn
Cl2 + 2e- = 2Cl-
离子型 电极
Fe3 + / Fe2+ Pt | Fe2+(c1), Fe3+(c2) Fe3+ + e- = Fe2+
第5章 电化学基础
电解
电能
电池
化学能
2019/5/8
第1节 氧化还原反应
一、氧化值(或氧化数)
Fe + Cu2+
Fe2+ + Cu
1 H2 2 O2
H2O
O HH
每个O-H键含有一对成键电子,由 于氧的电负性大,可看作H原子失 去1个电子,其“形式电荷”为+1; 而氧原子由于得到2个电子, “形 式电荷”为-2。
