高中化学方程式总结(超全)
高中化学方程式归纳总结大全

高中化学方程式归纳总结大全
一、酸-碱反应:
1、金属与碱反应:金属与强碱反应,产生金属离子和氢气,其反应方
程式为:M+2OH--->M(OH)2+H2↑
2、无机酸与碱反应:无机酸与碱反应,发生交换反应,产生对应的
盐和水,其反应方程式为:HX+M(OH)Y--->M(X)Y+H2O
3、盐酸反应:盐酸与碱反应,会发生水解反应,产生碱性盐和氢气,其反应方程式为:HCl+M(OH)2--->MCl+H2O+H2↑
4、有机酸与碱反应:有机酸与碱反应会发生碱溶解反应,产生对应
的盐和水,其反应方程式为:R-COOH+M(OH)Y--->RCOO-M+H2O
二、碱与金属盐反应:
1、金属碱与氧化物反应:金属碱与氧化物反应,产生金属盐和水,
其反应方程式为:M(OH)2+MO--->M2O+H2O
2、金属碱与酸反应:金属碱与酸反应,产生金属盐和水,其反应方
程式为:M(OH)2+HX--->MX+H2O
3、金属碱与溶液反应:金属碱与溶液反应,产生金属盐和水,其反
应方程式为:M(OH)2+MX--->M2X+H2O
三、水的溶解反应:
1、非金属氧化物溶解:非金属氧化物溶解于水,可以产生质子和氧
离子,其反应方程式为:MO+H2O--->H3O++M
2、金属氧化物溶解:金属氧化物溶解于水,会产生金属离子和氢氧离子,其反应方程式为:M2O+2H2O--->2H3O++2M。
高中化学公式大全 (完整版)

二. 金属单质(Na,Mg,Al,Fe,Cu) 的还原
性
2Na+H2==2NaH==4Na+O2==2Na2O==2Na2O
+O2==2Na2O2
2Na+O2==Na2O2==2Na+S==Na2S(爆炸)
2Na+2H2O==2NaOH+H2
↑
==2Na+2H2O=2Na++2OH―+H2↑
2Na+2NH3==2NaNH2+H2
样中 SiO2 的含量,玻璃雕刻)
4HF+Si==SiF4+2H2↑
2HF+CaCl2==CaF2+2HCl==H2S+Fe==FeS
↓+H2↑
H2S+CuCl2==CuS↓+2HCl==(弱酸制强酸
的典型反应)
H2S+Cu2+=CuS↓+2H+
H2S+2AgNO3==Ag2S↓+2HNO3
H2S+2Ag+=Ag2S↓+2H+
↑
==2Al+6H+=2Al3++3H2↑
2Al+6H2SO4( 浓 )==Al2(SO4)3+3SO2+6H2
O==(Al,Fe 在冷,浓的 H2SO4,HNO3 中钝
化)
Al+4HNO3( 稀 )==Al(NO3)3+NO ↑
+2H2O==Al+4H++NO3–=Al3++NO↑+2H2O
2Al+2NaOH+2H2O==2NaAlO2+3H2
高中化学方程式大全(超全)

高中化学方程式汇编温州市第十五中学高三化学备课组Petros Xn.无机化学部分非金属单质(F 2 ,Cl 2 , O 2 , S, N 2 , P , C , Si ) 1. 氧化性:F 2 + H 2 === 2HF2F 2 +2H 2O===4HF+O 2Cl 2 +2FeCl 2 ===2FeCl 3 2Cl2+2NaBr===2NaCl+Br2 Cl2 +2NaI ===2NaCl+I2Cl2+SO2 +2H2O===H2SO4 +2HCl (2004北京高考)2. 还原性S+6HNO 3(浓)===H 2SO 4+6NO 2↑+2H 2O 3S+4 HNO 3(稀)===3SO 2+4NO ↑+2H 2OPX 3+X 2===PX 5C+CO 2===2CO(生成水煤气)(制得粗硅)Si+2NaOH+H 2O===Na 2SiO 3+2H 2↑ 3.(碱中)歧化Cl 2+H 2O===HCl+HClO (加酸抑制歧化,加碱或光照促进歧化) Cl 2+2NaOH===NaCl+NaClO+H 2O 2Cl 2+2Ca(OH)2===CaCl 2+Ca(ClO)2+2H 2O 金属单质(Na ,Mg ,Al ,Fe )的还原性 4Na+O 2===2Na 2O 2Na+S===Na 2S (爆炸) 2Na+2H 2O===2NaOH+H 2↑ Mg+H 2SO 4===MgSO 4+H 2↑ 2Al+6HCl===2AlCl 3+3H 2↑ 2Al+3H 2SO 4===Al 2(SO 4)3+3H 2↑2Al+6H 2SO 4(浓、热)===Al 2(SO 4)3+3SO 2↑+6H 2O (Al,Fe 在冷,浓的H 2SO 4,HNO 3中钝化) Al+4HNO 3(稀)===Al(NO 3)3+NO ↑+2H 2O 2Al+2NaOH+2H 2O===2NaAlO 2+3H 2↑ Fe+2HCl===FeCl 2+H 2↑ Fe+CuCl 2===FeCl 2+Cu 非金属氢化物(HF,HCl,H2O,H2S,NH3)1.还原性: 16HCl+2KMnO 4==2KCl+2MnCl 2+5Cl 2↑+8H 2O (实验室常用) 2H 2S+SO 2===3S ↓+2H 2O 2NH 3+3Cl 2===N 2+6HCl 8NH 3+3Cl 2===N 2+6NH 4Cl 4NH 3+3O 2(纯氧)===2N 2+6H 2O 4NH 3+6NO===5N 2+6H 2O(用氨清除NO) 2.酸性: 4HF+SiO 2===SiF 4+2H 2O (HF 保存在塑料瓶的原因,此反应广泛应用于测定矿样或钢样中SiO 2的含量) H 2S+CuCl 2===CuS ↓+2HCl H 2S+FeCl 2===(不反应)3.碱性: NH 3+HCl===NH 4Cl NH 3+HNO 3===NH 4NO 3 2NH 3+H 2SO 4===(NH 4)2SO 4 NH 3+NaCl+H 2O+CO 2===NaHCO 3+NH 4Cl (此反应用于工业制备小苏打,苏打) 4.不稳定性: 2H 2O 2===2H 2O+O 2↑ 非金属氧化物 1.低价态的还原性:2SO 2+O 2+2H 2O===2H 2SO 4 (这是SO 2在大气中缓慢发生的环境化学反应) SO 2+Cl 2+2H 2O===H 2SO 4+2HCl 2NO+O 2===2NO 2 2CO+O 2===2CO 22.氧化性: NO 2+2KI+H 2O===NO+I 2↓+2KOH(不能用淀粉KI 溶液鉴别溴蒸气和NO 2)(CO 2不能用于扑灭由Mg,Ca,Ba,Na,K 等燃烧的火灾) 3.与水的作用: SO 2+H 2O===H 2SO 3 SO 3+H 2O===H 2SO 4 3NO 2+H 2O===2HNO 3+NO N 2O 5+H 2O===2HNO 3 P 2O 5+H 2O (冷)===2HPO 3 P 2O 5+3H 2O (热)===2H 3PO 4 (P 2O 5极易吸水,可作气体干燥剂) 4.与碱性物质的作用: SO 2+(NH 4)2SO 3+H 2O===2NH 4HSO 3 (这是硫酸厂回收SO 2的反应.先用氨水吸收SO 2,再用H 2SO 4处理: 2NH 4HSO 3+H 2SO 4=== (NH 4)2SO 4 + 2H 2O+ 2SO 2 生成的硫酸铵作化肥,SO 2循环作原料气) SO 2+Ca(OH)2===CaSO 3+H 2O(不能用澄清石灰水鉴别SO 2和CO 2.可用品红鉴别) SO 3+Ca(OH)2===CaSO 4+H 2OCO 2+2NaOH(过量)===Na 2CO 3+H 2O CO 2(过量)+NaOH===NaHCO 3CO 2+Ca(OH)2(过量)===CaCO 3↓+H 2O 2CO 2(过量)+Ca(OH)2===Ca(HCO 3)2CO 2+2NaAlO 2+3H 2O===2Al(OH)3↓+Na 2CO 3 CO 2+C 6H 5ONa+H 2O===C 6H 5OH ↓+NaHCO 3SiO 2+2NaOH===Na 2SiO 3+H 2O (强碱缓慢腐蚀玻璃)金属氧化物1.低价态的还原性:FeO+4HNO 3===Fe(NO 3)3+NO 2↑+2H 2O 2。
(完整版)高中有机化学方程式总结
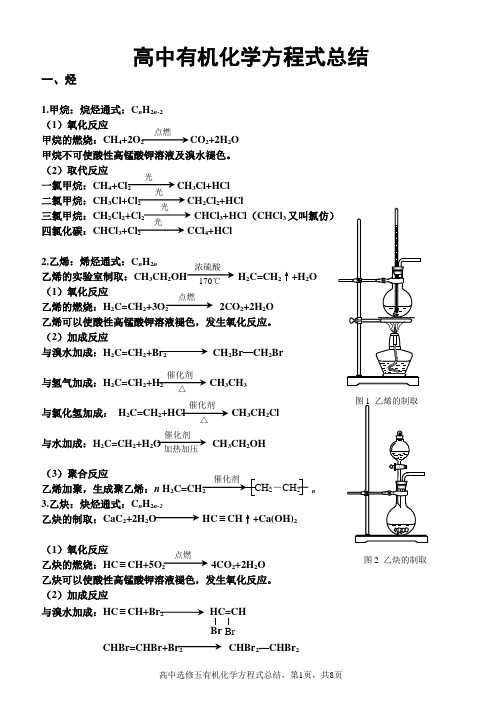
高中有机化学方程式总结一、烃1.甲烷:烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯:烯烃通式:C n H 2n乙烯的实验室制取:CH 3CH 2OH H 2C=CH 2↑+H 2O (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2 n3.乙炔:炔烃通式:C n H 2n-2乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br 2 HC=CHBr点燃光光光光浓硫酸170℃ 点燃催化剂△催化剂加热加压 2-CH 2点燃图2 乙炔的制取Br 催化剂△与氢气加成:HC ≡CH+H 2 H 2C=CH2与氯化氢加成:HC ≡CH+HCl CH2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯:苯的同系物通式:C n H 2n-6(1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
高中新课标化学方程式全总结(全)

无机部分1、钠钠与氧气反应:4Na + O2 = 2Na2O钠在空气中燃烧:2Na + O2Na2O2钠与水反应:2Na + 2H2O = 2NaOH + H2↑过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O2碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑碳酸氢钠与盐酸反应: NaHCO3 + HCl = NaCl + H2O + CO2↑2、铝铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2O氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2O实验室制氢氧化铝:Al2(SO4)3 + 6NH3·H2O = 2Al(OH)3↓+ 3(NH4)2SO4氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2O氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO2 + 2H2O氢氧化铝加热分解:2Al(OH)3Al2O3 + 3H2O3、铁氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH=Fe(OH)2↓+ Na2SO4 氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3氢氧化铁加热分解:2Fe(OH)3Fe2O3 + 3H2O↑三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl2氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl34、氮氮气与氧气在放电下反应:N2 + O22NO一氧化氮与氧气反应:2NO + O2 = 2NO2二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NO浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑稀硝酸与铜反应:3Cu + 8HNO3(稀) 3Cu(NO3)2 + 4H2O + 2NO↑氨气与氯化氢反应:NH3 + HCl = NH4Cl氯化铵受热分解:NH4Cl NH3↑ + HCl↑碳酸氢氨受热分解:NH4HCO3NH3↑ + H2O↑ + CO2↑氨气的实验室制取:2NH4Cl + Ca(OH)2CaCl2 + 2H2O + 2NH3↑5、硅硅单质与氧气反应:Si + 2O2SiO2二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 ↑+ 2H2O二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2O硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓往硅酸钠溶液中通二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓硅单质的实验室制法:粗硅的制取:SiO2 + 2C Si + 2CO(石英沙)(焦炭)(粗硅)6、硫二氧化硫与氧气在催化剂的作用下反应:2SO2 + O22SO3二氧化硫与水反应:SO+ H2O H2SO3三氧化硫与水反应:SO3 + H2O = H2SO4二氧化硫与氢氧化钠反应:SO2 + 2NaOH = Na2SO3 + H2O二氧化硫与氢氧化钙反应:SO2 + Ca(OH)2 = CaSO3↓ + H2O二氧化硫与氧化钙反应:SO2 + CaO = CaSO3二氧化硫与硫化氢反应:SO2 + 2H2S = 3S + 2H2O二氧化硫与氯水反应:SO2 + Cl2 + 2H2O = 2HCl + H2SO4浓硫酸与木炭反应:C + 2H2SO4(浓) CO2↑+ 2SO2↑ + 2H2O浓硫酸与铜反应:Cu + 2H2SO4(浓) CuSO4 + 2H2O + SO2↑7、氯氯气与金属钠反应:2Na + Cl2 2NaCl氯气与金属铁反应:2Fe + 3Cl22FeCl3氯气与金属铜反应:Cu + Cl2CuCl2氯气与氢气反应:Cl 2 + H 2 2HCl氯气与水反应:Cl 2 + H 2O = HCl + HclO次氯酸光照分解:2HClO2HCl + O2↑氯气与氢氧化钠溶液反应:Cl 2 + 2NaOH = NaCl + NaClO + H 2O 氯气与消石灰反应:2Cl 2 + 2Ca(OH)2 = CaCl 2 + Ca(ClO)2 + 2H 2O 漂白粉长期置露在空气中:Ca(ClO)2 + H 2O + CO 2 = CaCO 3↓ + 2HClO 盐酸与硝酸银溶液反应:HCl + AgNO 3 = AgCl↓ + HNO 3 8、其他Cl 2从溴化物(或碘化物)中置换出Br 2(或I 2):Cl 2+2NaBr=Br 2+2NaCl ; Cl 2+2KI=I 2+2KCl Br 2可以从碘化物中置换出I 2: Br 2+2KI=I 2+2KBr 双氧水的分解:2H 2O 2催化剂 △2H 2O+O 2↑氧化钙与水反应:CaO + H 2O = Ca(OH)2氯化钙与碳酸钠溶液反应:Na 2CO 3 + CaCl 2 = CaCO 3↓+ 2NaCl 碳酸根离子的检验: Na 2CO 3+ CaCl 2 = CaCO 3↓ + 2NaCl 硫酸根离子的检验: Na 2SO 4+ BaCl 2= BaSO 4↓+ 2NaCl 铁片与硫酸铜溶液反应: Fe + CuSO 4 = FeSO 4 + Cu一氧化碳还原氧化铁:Fe 2O 3 + 3CO 2Fe + 3CO 2有机部分1、甲烷的主要化学性质(1)氧化反应 CH 4+2O 2−−→−点燃 CO 2+2H 2O(2)取代反应2、乙烯的主要化学性质(1)氧化反应: C 2H 4+3O 2 −−→−点燃 2CO 2+2H 2O (2)加成反应乙烯还可以和氢气、氯化氢、水等发生加成反应。
高中化学方程式大全(完整版)

高中化学方程式总结第一章 卤素第一节 氯气1、NaCl 2Cl Na 22−−→−+点燃2、22CuCl Cl Cu −−→−+点燃3、32FeCl 2Cl 3Fe 2−−→−+点燃4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃6、523PCl Cl PCl →+7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()( 9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)(10、O H NaCl NaClO Cl NaOH 222++→+11、↑++−→−+∆2222Cl O H 2MnCl MnO HCl 412、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓) 13、2O HCl 2HClO 2+−−→−见光第二节 氯化氢14、↑+→+HCl NaHS O S O H NaCl 442(浓) 15、↑+−→−+∆HCl S O Na NaCl NaHS O 42416、↑+−→−+∆HCl 2S O Na S O H NaCl 24242(浓)(14、15结合) 17、33HNO AgCl AgNO HCl +↓→+18、33NaNO AgCl AgNO NaCl +↓→+19、33KNO AgCl AgNO KCl +↓→+20、↑++→+2223CO O H CaCl CaCO HCl 2第三节 氧化还原反应21、O H Cu H CuO 22+−→−+∆22、O H 2NO 4CO HNO 4C 2223+↑+↑→+23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++−→−+∆)((极稀) 24、4243324S O H 15PO H 6P Cu 5O H 24CuS O 15P 11++→++ 25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓)26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++−→−+∆)((极稀)27、O H 31S O K S O Fe 9S O Cr S O H 31O Fe 6O Cr K 2423423424243722+++→++)()( 28、↑+↑+→++2223CO 3N S K S C 3KNO 2第四节 卤族元素29、HF 2F H 22→+30、HBr 2Br H 22→+31、HI 2I H 22→+32、22Br NaCl 2Cl NaBr 2+→+33、22I KCl 2Cl KI 2+→+34、22I KBr 2Br KI 2+→+35、33NaNO AgBr AgNO NaBr +↓→+36、33KNO AgI AgNO KI +↓→+37、2Br Ag 2AgBr 2+−−→−光照第二章 摩尔 反应热第一节 摩尔38、22CO O C →+39、↑+→+22H MgCl HCl 2Mg第二节 气体摩尔体积40、22H ZnCl HCl 2Zn +→+第三节 物质的量浓度41、O H 2SO Na SO H NaOH 224242+→+第四节 反应热42、kJ 5.393CO O C 22+−−→−+(气)(气)(固)点燃 43、kJ 6.483O H 2O H 2222+→+(气)(气)(气) 44、kJ 6.571O H 2O H 2222+→+(液)(气)(气) 45、kJ 3.131H CO O H C 22-+−→−+∆(气)(气)(气)(固) 第三章 硫 硫酸第一节 硫46、S Cu S Cu 22−→−+∆47、FeS S Fe −→−+∆48、S H H S 22−→−+∆49、2CS C S −−→−+高温50、22S O O S −−→−+点燃51、O H 3S O K S K 2KOH 6S 32422++−→−+∆第二节 硫的氢化物和氧化物52、↓+−→−∆S H S H 2253、2222S O 2O H 2(O 3S H 2+−−→−+点燃足)54、↓+−−→−+S 2O H 2(O S H 2222点燃不足)55、↓+−−→−+S 3O H 2S O S H 2222点燃56、HBr 2S Br S H 22+↓→+57、↑+→+S H FeCl HCl 2FeS 2258、4224S O H CuS S H CuS O +↓→+59、HAc 2PbS S H PbAc 22+↓→+60、O H NaHS NaOH S H 22+→+61、O H S Na NaOH NaHS 22+→+62、O H 2S Na NaOH 2S H 222+→+(60、61结合) 63、HCl 2FeCl 2S FeCl 2S H 232++↓→+64、↑+→+S H FeS O FeS S O H 2442(稀) 65、3222S O H O H S O ⇔+66、3OV 22SO 2O SO 252∆−−→←+ 67、4223S O H O H S O →+68、↑++→+22424232S O O H S O Na S O H S O Na 69、O H S O Na NaOH 2S O 2322+→+70、32CaSO CaO SO →+71、O H CaSO OH Ca 2S O 2322+↓→+)( 72、23232HS O Ca O H CaS O S O )(→++73、O H 2S 3S H 2S O 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++75、42222SO H HBr 2O H 2Br SO +→++76、42424422SO H 2SO K MnSO KMnO 2O H 2SO 5++→++第三节 硫酸的工业制法77、↑+−−→−+23222S O 8O Fe 2O 11FeS 4高温78、3OV 22SO 2O SO 252∆−−→←+ 79、4232S O H S O O H →+第四节 硫酸 硫酸盐80、O H 2S O 2CO S O H 2C 22242+↑+↑−→−+∆(浓) 81、O H 2S O 3S O H 2S 2242+↑−→−+∆(浓)82、O H 2S O PO H S O H P 224342+↑+−→−+∆(浓) 83、O H 2S O S S O H S H 22422++−→−+∆(浓) 84、O H 2S O CuS O S O H 2Cu 22442+↑+−→−+∆(浓) 85、HCl 2BaS O S O H BaCl 4422+↓→+86、NaCl 2BaS O S O Na BaCl 4422+↓→+87、NaCl 2BaCO CO Na BaCl 3322+↓→+88、↑++→+2223CO O H BaCl HCl 2BaCO89、↑++→+222333CO O H NO Ba HNO 2BaCO )( 90、↑++→+2223232CO O H S Na S O H CO Na91、42232S O H 2O S O H 2→+92、42232S O Na 2O S O Na 2→+93、423CaS O 2O CaS O 2→+94、O H 6SO 3S O Fe S O H 6Fe 22234242+↑+−→−+∆)((浓) 95、O H S O Na S O Br S O H 2NaBr 22422242++↑+−→−+∆(浓) 96、↑+−→−+∆HCl 2S O Na S O H NaCl 24242(浓) 97、O H 11C 12O H C 2SOH 11221142+−−−→−浓 第四章 碱金属第一节 钠98、O Na 2O Na 422→+99、222O Na O Na 2→+100、NaCl 2Cl Na 22−−→−+点燃101、S Na S Na 22−−→−+研磨102、↑+→+22H NaOH 2O H 2Na 2103、↑++→++242242H SO Na OH Cu CuS O O H 2Na 2)( 第二节 钠的氧化物104、NaOH 2O H O Na 22→+105、↑+→+2222O NaOH 4O H 2O Na 2106、3222CO Na CO O Na →+107、232222O CO Na 2CO 2O Na 2+→+108、O H NaCl 2HCl 2O Na 22+→+109、↑++→+2222O O H 2NaCl 4HCl 4O Na110、O H CO NaCl 2HCl 2CO Na 2232+↑+→+111、O H CO NaCl HCl NaHCO 223+↑+→+112、O H CO CO Na NaHCO 222323+↑+−→−∆113、O H CO Na NaOH NaHCO 2323+−→−+∆114、O H 2CO Na CaCO OH Ca NaHCO 2232323++↓→+(少量))( 115、O H NaOH CaCO OH Ca NaHCO 2323++↓→+(足量))( 116、NaCl 2BaCO BaCl CO Na 3232+↓→+117、NaCl 2CaCO CaCl CO Na 3232+↓→+118、O H 2CO 2CaCl HCl 2HCO Ca 22223+↑+→+)( 119、O H 2CO Na CaCO NaOH 2HCO Ca 232323++↓→+)( 120、O H S O NaCl HCl NaHS O 223+↑+→+第三节 碱金属元素121、O Li 2O Li 422−−→−+点燃122、22KO O K −−→−+点燃123、MX 2X M 22→+(M 表示氧族元素,X 代表卤族元素)124、MH 2H M 22→+125、↑+→+22H MOH 2O H 2M 2第五章 物质结构 元素周期律本章内容、性质特殊,所有化学反应方程式均融在其他章节中。
高中化学方程式大全(完整版)

第一章卤素第一节氯气占燃1、2Na Cl 2> 2NaCI占燃2、Cu Cl2> CuCI 23、2Fe 3CI2 点燃、2FeCb4、H2 Cl2点燃(光照)> 2HCI5、2P 3CI2点燃、2PCI36、PCI 3 ■ CI 2 J PCI 57、CI2 H2O > HCI HCIO8、2Ca (OH )+2CI2 t Ca (CIO ) 2 +CaCI 2 + 2H 2O9、Ca (CIO)2 CO2 H2O > CaCO3":;2HCIO12NaOH CI2 > NaCIO NaCI H2O0、14HCI MnO2—MnCI 2 2H2O CI21、12KMnO 4 16HCI (浓)> 2MnCI 2 2KCI 5CI28H2O2、13、2HCIO 见光> 2HCI O2第二节氯化氢1NaCI H2SO4(浓)> NaHSO4 HCI4、1NaHSO4 NaCI—Na2SO4 HCI5、12NaCI H2SO(浓)一- Na2SO4 2HCI (14、15 结合)6、1HCI AgNO 3 > AgCI S'HNO 37、1NaCI AgNO 3 > AgCI S'NaNO381KCI AgNO 3 > AgCI X KNO 39、20、2HCI CaCO3 > CaCI2 H2O CO2第三节氧化还原反应21、CuO 亠H 2——-Cu 亠H2O22、C 4HNO3「CO2 4NO 22H 2O23、4Zn 10HNO 3(极稀)一:-'4Zn (NO/2 NH4NO3 3H2O24、11P 15CuSO424H2O > 5Cu3P 6H3PO4 15H2SO425、KClO 3 6HCl (浓)> 3Cl2 KCl 3H2O26、4Mg 1OHNO3(极稀)一-4Mg ( NO3) 2 NH 4NO3 3H 2O27、K2CQO7 + 6Fe3。
高中化学方程式大全(完整版)

高中化学方程式大全(完整版) Chapter 1: Halogensn 1: Chlorine Gas1.2NaCl → 2Na + Cl2 (n)2.Cu + Cl2 → CuCl2 (n)3.2Fe + 3Cl2 → 2FeCl3 (n)4.H2 + Cl2 → 2HCl (n under light)5.2P + 3Cl2 → 2PCl3 (n)6.PCl3 + Cl2 → PCl57.Cl2 + H2O → HCl + HClO8.2Ca(OH)2 + 2Cl2 → Ca(ClO)2 + CaCl2 + 2H2O9.Ca(ClO)2 + CO2 + H2O → CaCO3 ↓ + 2HClO10.2NaOH + Cl2 → NaClO + NaCl + H2O11.MnCl2 + 2H2O + Cl2 → Δ MnO2 + 2HClO12.2KMnO4 + 16HCl (concentrated) → 2MnCl2 + 2KCl + 5Cl2 ↑ + 8H2O13.2HClO → (light)n 2: Hydrogen Chloride14.NaCl + H2SO4 (concentrated) → NaHSO4 + HCl ↑15.NaHSO4 + NaCl → Na2SO4 + HCl ↑ (combined with 14)16.2NaCl + H2SO4 (concentrated)17.HCl + AgNO3 → AgCl ↓ + HNO318.NaCl + AgNO3 → AgCl ↓ + NaNO319.KCl + AgNO3 → AgCl ↓ + KNO320.2HCl + CaCO3 → CaCl2 + H2O + CO2↑n 3: Redox ns21.CuO + H2 → Cu + H2O22.C + 4HNO3 → CO2 ↑ + 4NO2 ↑ + 2H2O23.4Zn + 10HNO3 (very dilute) → 4Zn(NO3)2 + NH4NO3 + 3H2O24.11P + 15CuSO4 + 24H2O → 5Cu3P + 6H3PO4 +15H2SO425.KClO3 + 6HCl (concentrated) → 3Cl2 ↑ + KCl + 3H2O26.4Mg + 10HNO3 (very dilute) → 4Mg(NO3)2 + NH4NO3 + 3H2O27.K2Cr2O7 + 6Fe3O4 + 31H2SO4 → Cr2(SO4)3 +9Fe2(SO4)3 + K2SO4第四节卤族元素卤族元素是指周期表中第17族元素,包括氟、氯、溴、碘和石蕊。
高中所有化学方程式总结(全)

高中所有化学方程式总结(全)第一部分金属一、碱金属1.钠Na4Na+O2=2Na2O 2Na+S =Na2S(爆炸) 2Na+2H2O=2NaOH+H2↑ 2Na+2NH3=2NaNH2+H2 4Na+TiCl4(熔融)=4NaCl+TiNa2ONa2O+H2O=2NaOH Na2O+SO3=Na2SO4 Na2O+CO2=Na2CO3 Na2O+2HCl=2NaCl+H2ONa2O2+2Na=2Na2O(此反应用于制备Na2O) 2Na2O2+2CO2=2Na2CO3+O2 Na2O2+H2SO4(冷、稀)=Na2SO4+H2O22Na2O2+2H2O=4NaOH+O2↑(此反应分两步Na2O2+2H2O=2NaOH+H2O2;2H2O2=2H2O+O2↑。
H2O2的制备可利用类似的反应)NaHNaH+H2O=NaOH+H2↑NaOH2NaOH+Si+H2O=Na2SiO3+2H2↑2NaOH+2Al+2H2O=2NaAlO2+3H2↑2NaOH(过量)+CO2=Na2CO3+H2O NaOH+CO2(过量)=NaHCO32NaOH+SiO2=Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)2NaOH+Al2O3=2NaAlO2+H2O 2NaOH+Cl2=NaCl+NaClO+H2ONaOH+HCl=NaCl+H2O NaOH+H2S(足量)=NaHS+H2O2NaOH+H2S(少量)=Na2S+2H2O3NaOH+AlCl3=Al(OH)3↓+3NaCl NaOH+Al(OH)3=NaAlO2+2H2O2NaOH+P2O5=2NaPO3+H2O 6NaOH+P2O5=2Na3PO3+3H2ONaAlO22NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3 3NaAlO2+AlCl3+6H2O=4Al(OH)3↓NaCl、NaClO、NaBr、NaINaI+Cl2=2NaCl+I2NaBr+H3PO4(浓)=NaH2PO4+HBr NaI+H3PO4(浓)=NaH2PO4+HINa2CO3、NaHCO3Na2CO3 +HCl=NaHCO3+NaClNaHCO3+HCl=NaCl+H2O+CO23Na2CO3+2AlCl3+3H2O=2Al(OH)3↓+3CO2↑+6NaCl3Na2CO3+2FeCl3+3H2O=2Fe(OH)3↓+3CO2↑+6NaCl3NaHCO3+AlCl3=Al(OH)3↓+3CO2↑3NaHCO3+FeCl3=Fe(OH)3↓+3CO2↑NaHCO3+HCl=NaCl+CO2↑+H2O3Na2CO3+2Br2+H2O=2NaHCO3+2NaBrO+2NaBr+CO2↑NaHCO3+Br2=NaBr+HBrO+CO2↑NaNO3、NaNO2KClO3+6HCl =KCl+3Cl2↑+3H2ONaNO2+NH4Cl=NaCl+N2↑+2H2O Na3PO4、NaH2PO4、Na2HPO4Na3PO4+HCl=Na2HPO4+NaCl Na2HPO4+HCl=NaH2PO4+NaClNaH2PO4+HCl=H3PO4+NaClNa2S、NaHSNa2S+Cl2=2NaCl+S↓3Na2S+8HNO3(稀)=6NaNO3+2NO+3S↓+4H2O3Na2S+Al2(SO4)3+6H2O=2Al(OH)3↓+3H2S↑Na2SO4、Na2SO3、Na2S2O33Na2SO3+2HNO3(稀)=3Na2SO4+2NO↑+H2O2Na2SO3+O2=2Na2SO4 Na2S2O3+H2SO4=Na2SO4+S+SO2+H2ONa2SO3+SO2+H2O=2NaHSO3Na2SiO3Na2SiO3+2HCl=H2SiO3↓+2NaClC6H5ONaC6H5ONa+CO2+H2O=C6H5OH+NaHCO32.钾K 2K+2H2O=2KOH+H2↑K2O、K2O2K2O+H2O=2KOH K2O+CO2=K2CO3 2K2O2+2CO2=K2CO3+O2 2K2O2+2H2O=4KOH+O2 KOH2KOH+CO2=K2CO3+H2O KOH+CO2=KHCO3K2CO3K2CO3+2HCl=2KCl+CO2↑+H2O K2CO3+CaCl2=CaCO3↓+2KCK2CO3+2AgNO3=Ag2CO3↓+2KNO3KHCO3 KHCO3+HCl=KCl+CO2↑+H2OKClO3 KClO3+6HCl=KCl+3Cl2↑+3H2OKI 2KI+Cl2=2KCl+I2 KI+AgNO3=AgI↓+KNO3KAl(SO4)22KAl(SO4)2+6NaOH=K2SO4+3Na2SO4+2Al(OH)3↓2KAl(SO4)2+3Ba(OH)2=K2SO4+3BaSO4↓+2Al(OH)3↓KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓KSCN 3KSCN+FeCl3=Fe(SCN)3+3KClKH KH+H2O=KOH+H2↑3.锂Li 2Li+2H2O=2LiOH+H2↑Li2O Li2O+CO2=Li2CO3 Li2O+H2O=2LiOHLiOH 2LiOH+CO2=Li2CO3↓+H2O LiOH+CO2=LiHCO3Li2CO3 Li2CO3+2HCl=2LiCl+CO2↑+H2OLiHCO3 LiHCO3+HCl=LiCl+CO2↑+H2O二、常见金属1.镁MgMg+2H2O=2Mg(OH)2↓+H2↑ Mg+S=MgS Mg+Br2=MgBr2Mg+2HCl=MgCl2+H2↑ Mg+H2SO4=MgSO4+H2↑2Mg+TiCl4(熔融)=Ti+2MgCl2 Mg+2RbCl(熔融)=MgCl2+2RbMgOMgO+2HCl=MgCl2+H2O MgO+H2O=Mg(OH)2↓Mg(OH)2 Mg(OH)2+2HCl=MgCl2+2H2OMgCO3 MgCO3+2HCl=2MgCl2+CO2↑+H2OMg(HCO3)2 Mg(HCO3)2+2HCl=MgCl2+2CO2↑+2H2OMgSO4MgSO4+Ba(OH)2=Mg(OH)2↓+BaSO4↓ MgSO4+2NaOH=Mg(OH)2↓+Na2SO4↓2.铝Al2Al+6HCl=2AlCl3+3H2↑2Al+3H2SO4=Al2(SO4)3+3H2↑2Al+2NaOH+2H2O=2NaAlO2+3H2↑Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O(Al、Fe在冷、浓的H2SO4、HNO3中钝化)Al2O3、Al(OH)3Al2O3+3H2SO4=Al2(SO4)3+3H2O(Al2O3是两性氧化物)Al2O3+2NaOH=2NaAlO2+H2OAl(OH)3+3HCl=AlCl3+3H2O 2Al(OH)3+3H2SO4=Al2(SO4)3+6H2OAl(OH)3+NaOH=NaAlO2+2H2O铝盐AlCl3+3NaOH=Al(OH)3↓+3NaClAlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl2AlCl3+3Na2CO3+3H2O=2Al(OH)3↓+3CO2↑+6NaClAlCl3+3NaHCO3=Al(OH)3↓+3CO2↑AlCl3+3NaAlO2+6H2O=4Al(OH)3↓ Al2(SO4)3+3Na2S+6H2O=2Al(OH)3↓+3H2S↑Al4C3+12H2O=4Al(OH)3↓+3CH4↑3.铁Fe2Fe+3Br2=2FeBr3Fe+2HCl=FeCl2+H2↑Fe+CuCl2=FeCl2+Cu Fe+SnCl4=FeCl2+SnCl2 Fe+H2S=FeS+H2↑2Fe+6H2SO4(浓)=Fe2(SO4)3+3SO2↑+6H2O Fe+H2SO4(稀)=FeSO4+H2↑Fe+6HNO3=Fe(NO3)3+3NO2↑+3H2OFe+4HNO3=Fe(NO3)3+NO↑+2H2O8Fe+30HNO3=8Fe(NO3)3+3N2O↑+15H2O 10Fe+36HNO3=10Fe(NO3)3+3N2↑+18H2O8Fe+30HNO3=8Fe(NO3)3+3NH4NO3+9H2O Fe+(CH3COO)2Cu=Cu+(CH3COO)2FeFeOFeO+4HNO3=Fe(NO3)3+NO2↑+2H2OFe2O3Fe2O3+3H2=2Fe+3H2O(制还原铁粉) Fe2O3+6HCl=2FeCl3+3H2OFe3O4Fe(OH)2、Fe(OH)34Fe(OH)2+O2+2H2O==4Fe(OH)3FeCl22FeCl2+Cl2=2FeCl3 FeCl2+Mg=Fe+MgCl2FeCl32FeCl3+Fe=3FeCl2 2FeCl3+Cu=2FeCl2+CuCl2(用于雕刻铜线路版) 2FeCl3+H2SO3+H2O=H2SO4+2FeCl2+2HCl2FeCl3+Zn=2FeCl2+ZnCl2 2FeCl3+H2S=2FeCl2+2HCl+S↓2FeCl3+2KI=2FeCl2+2KCl+I2 FeCl3+3NH3·H2O=Fe(OH)3↓+3NH4Cl2FeCl3+3Na2CO3+3H2O=2Fe(OH)3↓+3CO2↑+6NaClFeCl3+3NaHCO3=Fe(OH)3↓+3CO2↑ 2FeCl3+SO2+2H2O=2FeCl2+H2SO4+2HCl BaCl2+H2SO4=BaSO4↓+2HCl FeCl3+3KSCN=Fe(SCN)3+3KClFeSFeS+2HCl=FeCl2+H2S↑ FeS+H2SO4=FeSO4+H2S↑4FeS2+11O2=2Fe2O2+8SO2H2FeO4 4H2FeO4+2H2O=4Fe(OH)3+3O2↑4Na2FeO4+10H2O=4Fe(OH)3+3O2↑+8NaOH2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2OFe2O3+3Na2O2=2Na2FeO4+Na2O其它Fe化合物Fe2(SO4)3+2Ag=FeSO4+Ag2SO4(较难反应)三、其他金属1.锰KMnO42. 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O3. 2KMnO4+5H2O2+6HCl=2KCl+2MnCl2+5O2↑+8H2OMnO22.铜CuCuO+2HCl=CuCl2+H2OCuO+H2SO4=CuSO4+H2O Cu(OH)2+2HCl=CuCl2+2H2OCu(OH)2+H2SO4=CuSO4+2H2OCuCl2+H2S=CuS↓+2HCl CuCl2+2NaOH=Cu(OH)2↓+2NaClCuSO4+H2S=CuS↓+H2SO4 CuSO4+2NaOH=Cu(OH)2↓+Na2SO4CuSO4+Ba(OH)2=Cu(OH)2↓+BaSO4↓3.钙CaCaO+H2O=Ca(OH)22Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O Ca(OH)2+SO3=CaSO4+H2OCaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑(用HNO3和浓H2SO4不能制备H2S、HI、HBr、SO2等还原性气体)CaF2+H2SO4(浓)=CaSO4+2HF↑Ca3(PO4)2+3H2SO4(浓)=3CaSO4+2H3PO4Ca3(PO4)2+2H2SO4(浓)=2CaSO4+Ca(H2PO4)2Ca3(PO4)2+4H3PO4=3Ca(H2PO4)2(重钙) CaH2+2H2O=Ca(OH)2+2H2↑4.钡BaBa(OH)2+CO2=BaCO3↓+H2O Ba(OH)2+2CO2(过量)=Ba(HCO3)25. Ba(OH)2+H2SO4=BaSO4↓+2H2O3Ba(OH)2+2H3PO3=Ba3(PO4)2↓+6H2OBaCl2+H2SO4=BaSO4↓+2HCl BaCl2+Na2SO4=BaSO4↓+2NaClBaCO3+2HCl=BaCl2+CO2↑+H2OBaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O BaO2+H2SO4(稀)=BaSO4↓+H2O2)5.铅Pb、PbO2Pb+2HCl=PbCl2+H2↑铅盐Pb(NO3)2+H2S=PbS↓+2HNO3(CH3COO)2Pb+H2S=PbS↓+CH3COOH6.锌ZnZn+2HCl=ZnCl2+H2↑ Zn+H2SO4=ZnSO4+H2↑Zn+2NaOH=Na2ZnO2+H2↑ Zn+2FeCl3=2FeCl2+ZnCl2ZnOZnO+2HCl=ZnCl2+H2O ZnO+2NaOH=Na2ZnO2+H2OZn(OH)2 Zn(OH)2+2HCl=ZnCl2+2H2O Zn(OH)2+2NaOH=Na2ZnO2+2H2OZn(OH)2+4NH3·H2O=Zn(NH3)4(OH)2+4H2O7.铍BeBe+2HCl=BaCl2+H2↑ Be+2NaOH=Na2BO2+H2↑8. BeCl2+2NaOH=Be(OH)2↓+2H2O Be(OH)2+2HCl=BeCl2+2H2OBe(OH)2+2NaOH=Na2BO2+2H2O8.汞Hg3Hg+8HNO3(稀)=3Hg(NO3)2+2NO2↑+4H2O Hg+4HNO3(浓)=Hg(NO3)2+2NO2↑+2H2O第二部分卤族元素、氮族元素一、卤族元素1.氟F2F2+H2=2HF 2F2+2H2O=4HF+O2HF 4HF+SiO2=SiF4+2H2O2.氯Cl2Cl2+H2=2HCl(光照或点燃)Cl2+2FeCl2=2FeCl3 2Cl2+2NaBr=2NaCl+Br2Cl2+2KI=2KCl+I2 5Cl2+I2+6H2O=2HIO3+10HClCl2+Na2S=2NaCl+S↓ Cl2+H2S=2HCl+S↓Cl2+SO2+2H2O=H2SO4+2HCl Cl2+H2SO3+H2O=H2SO4+2HClCl2+H2O=HCl+HClO Cl2+H2O2=2HCl+O2Cl2+2NaOH=NaCl+NaClO+H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O3Cl2+6KOH(热、浓)=5KCl+KClO3+3H2OHCl6HCl+2Al=2AlCl3+3H2↑ 2HCl+Fe=FeCl2+H2↑16HCl+2KMnO4=2KCl+2MnCl2+5Cl2+8H2O 14HCl+K2Cr2O7=2KCl+2CrCl3+3Cl2+7H2O HCl+NH3=NH4Cl(白烟)2HCl+FeO=FeCl2+3H2O6HCl+Fe2O3=2FeCl3+3H2OHCl+Na3PO4=Na2HPO4+NaClHCl+Na2HPO4=NaH2PO4+NaCl HCl+NaH2PO4=H3PO4+NaCl HCl+Na2CO3=NaHCO3+NaCl HCl+NaHCO3=NaCl+H2O+CO2HClO HClO=HCl+O2↑3.溴Br2 Br2+Fe=FeBr3 Br2+2FeBr2=2FeBr34.Br2+NaI=NaBr+I2 Br2+HI=HBr+I2 Br2+H2O=HBr+HBrOBr2+NaOH=NaBr+NaBrO+H2O Br2+SO2+2H2O=H2SO4+2HBr5. Br2+H2S=S↓+2HBr2Br2+3Na2CO3+H2O=2NaHCO3+2NaBrO+2NaBr+CO2↑HBrHBr+NaOH=NaBr+H2O2HBr+Cl2=2HCl+Br24.碘I2 I2+2NaOH=NaI+NaIO+H2OHI 2HI+Cl2=2HCl+I2 HI+NaOH=NaI+H2O二、氮族元素1.氮N2N2+6Na=2Na3NNO、NO2、N2O52NO+O2=2NO2 NO+NO2+2NaOH=2NaNO2(用于制硝酸工业中吸收尾气中的NO和NO2)NO2+2KI+H2O=NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)4NO2+H2S=4NO+SO3+H2ONO2+SO2=SO3+NO 3NO2+H2O=2HNO3+NO N2O5+H2O=2HNO3HNO33HNO3+Ag3PO4=H3PO4+3AgNO3Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O3As2S3+28HNO3+4H2O=6H3AsO4+9H2SO4+28NO↑2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑ 6HNO3+Fe=Fe(NO3)3+3NO2↑+3H2O4HNO3+Fe=Fe(NO3)3+NO↑+2H2O30HNO3+8Fe=8Fe(NO3)3+3N2O↑+15H2O36HNO3+10Fe=10Fe(NO3)3+3N2↑+18H2O30HNO3+8Fe=8Fe(NO3)3+3NH4NO3+9H2OFeO+4HNO3=Fe(NO3)3+NO2↑+2H2O 3H2S+2HNO3(稀)=3S↓+2NO+4H2O4HNO3=4NO2+O2+2H2O(见光或受热分解)NH3+HNO3=NH4NO3(白烟)(用HNO3和浓H2SO4不能制备H2S、HI、HBr、(SO2)3Na2S+8HNO3(稀)=6NaNO3+2NO+3S↓+4H2O3Na2SO3+2HNO3(稀)=3Na2SO4+2NO↑+H2O 5HNO3(浓)+P=H3PO4+5NO2↑+H2OP4+20HNO3(浓)=4H3PO4+20NO2+4H2OS+6HNO3(浓)=H2SO4+6NO2↑+2H2O 3S+4HNO3(稀)=3SO2↑+4NO↑+2H2OS+6HNO3(浓)=H2SO4+6NO2↑+2H2ONH32NH3+3Cl2=N2+6HCl 8NH3+3Cl2=N2+6NH4ClNH3+H Cl=NH4Cl(白烟) NH3+HNO3=NH4NO3(白烟)2NH3+H2SO4=(NH4)2SO4 NH3+NaCl+H2O+CO2=NaHCO3↓+NH4Cl(侯氏制碱法) 2NH3+SO2+H2O=(NH4)2SO3NH4HCO3、(NH4)2CO3NH4HCO3=NH3+H2O+CO2 (NH4)2CO3=2NH3↑+H2O+CO2↑NH4Cl NH4Cl=NH3+HClNH4Cl+NaOH==NaCl+NH3·H2ONH4NO3NH4NO3+NaOH==NaNO3+NH3·H2O(NH4)2SO3、(NH4)2SO4(NH4)2SO3+SO2+H2O=2NH4HSO3 (NH4)2SO4+2NaOH==Na2SO4+2NH3·H2O2.磷PPH3+2O2=H3PO4P4+20HNO3(浓)=4H3PO4+20NO2+4H2O 11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4 P2O3、P2O5P2O5+H2O(冷)=2HPO3 P2O5+3H2O(热)=2H3PO4(P2O5极易吸水、可作气体干燥剂) P2O5+3H2SO4(浓)=2H3PO4+3SO3P2O5+2NaOH=2NaPO3+H2O P2O5+6NaOH=2Na3PO3+3H2OH3PO44H3PO4+Ca3(PO4)2=3Ca(H2PO4)2(重钙)H3PO4(浓)+NaBr=NaH2PO4+HBr H3PO4(浓)+NaI=NaH2PO4+HI3.砷AsAs2O3+6Zn+12HCl=2AsH3↑+6ZnCl2+3H2O4. 3As2S3+28HNO3(稀)+4H2O=6H3AsO4+9H2SO4+28NO↑As2S3+28HNO3(浓)=2H3AsO4+3H2SO4+28NO2↑+8H2O第三部分碳族元素、氧族元素一、碳族元素1.碳CC+2F2=CF4 C+2Cl2=CCl4COCO2CO2+H2O=H2CO32.CO2+2NaOH(过量)=Na2CO3+H2O CO2(过量)+NaOH=NaHCO3CO2+Ca(OH)2(过量)=CaCO3↓+H2O3.2CO2(过量)+Ca(OH)2=Ca(HCO3)2 CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3 CO2+C6H5ONa+H2O=C6H5OH+NaHCO3 CO2+Na2O=Na2CO34. 2CO2+2Na2O2=2Na2CO3+O2CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl(侯氏制碱法)5.H2CO3H2CO3=CO2↑+H2O2.硅SiSi+2NaOH+H2O=Na2SiO3+2H2SiO24HF+SiO2=SiF4+2H2OSiO2+2NaOH=Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃) 2NaOH+SiO2=Na2SiO3+H2O二、氧族元素1.氧O24Na+O2=2Na2O 2Na+O2=Na2O22H2SO3+O2=2H2SO4 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Na2SO3+O2=2Na2SO4 O32O3=3O2 O3+2HI==I2+O2+H2OH2O 2F2+2H2O=4HF+O2 Cl2+H2O=HCl+HClO2Na+2H2O=2NaOH+H2↑ Mg+2H2O=Mg(OH)2+H2↑SO2+H2O=H2SO3 SO3+H2O=H2SO43NO2+H2O=2HNO3+NO N2O5+H2O=2HNO3P2O5+H2O(冷)=2HPO3 P2O5+3H2O(热)=2H3PO4 CO2+H2O=H2CO3H2O22H2O2=2H2O+O2↑ H2O2+Cl2=2HCl+O25H2O2+2KMnO4+6HCl=2MnCl2+2KCl+5O2↑+8H2O2.硫SS+6HNO3(浓)=H2SO4+6NO2↑+2H2O3. 3S+4HNO3(稀)=3SO2↑+4NO↑+2H2OS+2Na=Na2S(爆炸) S+Mg=MgS S+2H2SO4(浓)=3SO2↑+2H2OSO2SO2+2H2S=3S+2H2O 2SO2+O2+2H2O=2H2SO4 SO2+Cl2+2H2O=H2SO4+2HCl SO2+Br2+2H2O=H2SO4+2HBrSO2+I2+2H2O=H2SO4+2HI SO2+NO2=SO3+NO SO2+2H2S=3S+2H2O SO2+H2O=H2SO3 SO2+2NH3+H2O=(NH4)2SO3SO2+(NH4)2SO3+H2O=2NH4HSO3 SO2+Ca(OH)2=CaSO3↓+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)4.2NaOH+SO2(少量)=Na2SO3+H2O NaOH+SO2(足量)=NaHSO35. Cl2+SO2+2H2O=H2SO4+2HClSO3SO3+H2O=H2SO4 SO3+MgO=MgSO4 SO3+Ca(OH)2=CaSO4+H2O6. SO3+Na2O=Na2SO4 SO3+2KI=K2SO3+I2H2SH2S+Cl2=2HCl+S↓ H2S+Mg=MgS+H22H2S+3O2(足量)=2SO2+2H2O 2H2S+O2(少量)=2S+2H2O2H2S+SO2=3S+2H2O H2S+H2SO4(浓)=S↓+SO2+2H2O3H2S+2HNO3(稀)=3S↓+2NO+4H2O5H2S+2KMnO4+3H2SO4=2MnSO4+K2SO4+5S+8H2O3H2S+K2Cr2O7+4H2SO4=Cr2(SO4)3+K2SO4+3S+7H2OH2S+4Na2O2+2H2O=Na2SO4+6NaOH H2S+Fe=FeS+H2↑H2S+CuCl2=CuS↓+2HCl H2S+2AgNO3=Ag2S↓+2HNO3H2S+HgCl2=HgS↓+2HCl H2S+Pb(NO3)2=PbS↓+2HNO3H2S+4NO2=4NO+SO3+H2OH2SO3H2SO3+X2+H2O=H2SO4+2HX(X表示Cl2、Br2、I2) 2H2SO3+O2=2H2SO4 H2SO3+H2O2=H2SO4+H2O5H2SO3+2KMnO4=2MnSO4+K2SO4+2H2SO4+3H2OH2SO3+2FeCl3+H2O=H2SO4+2FeCl2+2HClH2SO3=H2O+SO2↑ 2H2SO3+2H2S=3S↓+2H2OH2SO4Zn+H2SO4=ZnSO4+H2↑ Fe+H2SO4=FeSO4+H2↑Mg+H2SO4=MgSO4+H2↑ 2Al+3H2SO4=Al2(SO4)3+3H2↑2NH3+H2SO4=(NH4)2SO4 H2S+H2SO4(浓)=S↓+SO2+2H2OP2O5+3H2SO4(浓)=2H3PO4+3SO3 BaO2+H2SO4(稀)=BaSO4+H2O2)Na2O2+H2SO4(冷、稀)=Na2SO4+H2O2MgO+H2SO4=MgSO4+H2O Al2O3+3H2SO4=Al2(SO4)3+3H2O2H2SO4(浓)+S=3SO2↑+2H2O6H2SO4(浓)+2Fe=Fe2(SO4)3+3SO2↑+6H2OH2SO4(浓)+CaF2=CaSO4+2HF↑3H2SO4(浓)+Ca3(PO4)2=3CaSO4+2H3PO42H2SO4(浓)+Ca3(PO4)2=2CaSO4+Ca(H2PO4)2第四部分有机反应一、烃1.甲烷甲烷的制取:烷烃通式:CnH2n-2(1)氧化反应甲烷的燃烧:甲烷不可使酸性高锰酸钾溶液及溴水褪色。
高中化学方程式总结高中化学方程式总结版(精选8篇)

高中化学方程式总结高中化学方程式总结版(精选8篇)高考过程须做到小心翼翼,涂卡规范,写清姓名、考号、座号等,保证不涂错号。
选择题答案选出后,要及时将答案填涂到答题卡上,定不能在收卷时匆忙涂卡。
本文是细致的小编给大家收集整理的8篇高中化学方程式总结的相关范文,希望能够帮助到大家。
高中化学方程式总结版篇一(1)镁在空气中燃烧2Mg+O22MgO2Al2O3铝在空气中燃烧4Al+3O2铁在氧气中燃烧3Fe+2O2Fe3O4铜在空气中受热2Cu+O22CuO(2)氢气在氧气中燃烧2H2+O22H2O2P2O5红磷在空气中燃烧4P+5O2SO2硫粉在空气中燃烧S+O2碳在氧气中充分燃烧C+O2(充足)CO2碳在氧气中不充分燃烧2C+O2(不充足)2CO(3)一氧化碳在氧气中燃烧2CO+O22CO2电解水2H2O2H2↑+O2↑(4)甲烷在空气中燃烧CH4+2O2CO2+2H2O酒精在空气中燃烧C2H5OH+3O22CO2+3H2O(5)加热高锰酸钾制氧气2KMnO4K2MnO4+MnO2+O2↑加热氯酸钾制氧气(二氧化锰做催化剂)2KClO32KCl+3O2↑过氧化氢溶液制氧气(二氧化锰做催化剂)2H2O22H2O+O2↑高考化学考前冲刺技巧篇二一、重视基础回归——元素化合物知识的复习元素化合物知识是学习化学的基础,在以能力和素养立意为价值取向的高考命题中,元素化合物知识成为考查化学概念与理论、反应原理、化学实验和化学计算的载体,分值占试卷的60%左右。
自己回归教材,形成知识网络,基础知识点掌握牢固了,再做题就得心应手了。
二、重视知识体系的构建和解题方法指导——有机化学复习有机化学作为整个化学学科中重要的内容,是一个独立于其他知识体系的模块,分值占试卷的18%左右。
复习当中,我们应当着重加强对有机化合物的组成与结构,各类化合物的反应原理和反应条件以及反应后产生的有机物做出充分的了解。
加强对信息的反应机理的挖掘和分析,并能应用到有机合成路线设计之中。
高中化学方程式大全(最全)

高中化学方程式总结汇总一.物质与氧气的反应(1)单质与氧气的反应1.镁在空气中燃烧:2Mg+O2点燃2MgO2.铁在氧气中燃烧:3Fe+2O2点燃Fe3O43.铜在空气中受热:2Cu+O2加热2CuO4.铝在空气中燃烧:4Al+3O2点燃2Al2O35.氢气中空气中燃烧:2H2+O2点燃2H2O6.红磷在空气中燃烧:4P+5O2点燃2P2O57.硫粉在空气中燃烧:S+O2点燃SO28.碳在氧气中充分燃烧:C+O2点燃CO29.碳在氧气中不充分燃烧:2C+O2点燃2CO(2)化合物与氧气的反应10.一氧化碳在氧气中燃烧:2CO+O2点燃2CO211.甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O12.酒精在空气中燃烧:C2H5OH+3O2点燃2CO2+3H2O二.几个分解反应13.水在直流电的作用下分解:2H2O通电2H2↑+O2↑14.加热碱式碳酸铜:Cu2(OH)2CO3加热2CuO+H2O+CO2↑15.加热氯酸钾(有少量的二氧化锰):2KClO3====2KCl+3O2↑16.加热高锰酸钾:2KMnO4加热K2MnO4+MnO2+O2↑17.碳酸不稳定而分解:H2CO3===H2O+CO2↑18.高温煅烧石灰石:CaCO3高温CaO+CO2↑三.几个氧化还原反应19.氢气还原氧化铜:H2+CuO加热Cu+H2O20.木炭还原氧化铜:C+2CuO高温2Cu+CO2↑21.焦炭还原氧化铁:3C+2Fe2O3高温4Fe+3CO2↑22.焦炭还原四氧化三铁:2C+Fe3O4高温3Fe+2CO2↑23.一氧化碳还原氧化铜:CO+CuO加热Cu+CO224.一氧化碳还原氧化铁:3CO+Fe2O3高温2Fe+3CO225.一氧化碳还原四氧化三铁:4CO+Fe3O4高温3Fe+4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸--------盐+氢气(置换反应)26.锌和稀硫酸Zn+H2SO4=ZnSO4+H2↑27.铁和稀硫酸Fe+H2SO4=FeSO4+H2↑28.镁和稀硫酸Mg+H2SO4=MgSO4+H2↑29.铝和稀硫酸2Al+3H2SO4=Al2(SO4)3+3H2↑30.锌和稀盐酸Zn+2HCl===ZnCl2+H2↑31.铁和稀盐酸Fe+2HCl===FeCl2+H2↑32.镁和稀盐酸Mg+2HCl===MgCl2+H2↑33.铝和稀盐酸2Al+6HCl==2AlCl3+3H2↑。
高中阶段所有的化学方程式大汇总

高中阶段所有的化学方程式大汇总一、氧化反应1、氢氧化钠反应:2Na+2H2O→2NaOH+H22、铝酸钠反应:2Al+3Na2O2→2Na3AlO3+3O23、铬酸钠反应:2Na+Cr2O3→2Na2CrO44、硫酸钠反应:Na2S2O3+2HCl→2NaCl+H2SO35、氧气的氧化反应:4Fe+3O2→2Fe2O36、硝酸的氧化反应:2HNO3+2NaOH→Na2NO3+2H2O7、苯胺的氧化反应:C6H5NH2+NaOH+O2→C6H5NO2+H2O8、碳酸钠的氧化反应:2Na+CO2→Na2CO39、钾碳酸反应:2K+CO2→K2CO310、亚硝酸钠反应:NaNO2+HCl→NaCl+HNO2二、还原反应1、硫化氢的还原反应:2H2S+SO2→3S+2H2O2、氯化铵的还原反应:2NH4Cl+2Na→2NaCl+N2+2H23、硫酸钴的还原反应:2KMnO4+3H2SO4+3CuSO4→MnSO4+K2SO4+3Cu+4H2O4、硝酸铁的还原反应:Fe(NO3)3+3NaOH→Fe(OH)3+3NaNO35、硫酸汞的还原反应:Hg2(SO4)2+2Na2CO3→Hg+2Na2SO4+2CO26、铁酸的还原反应:Fe(OH)3+3H2SO4→3FeSO4+3H2O7、氧气的还原反应:MnO2+4HCl+2H2O→MnCl2+4H2O+O28、硫酸铝的还原反应:2Al2(SO4)3+3NaOH+6H2O→2Al(OH)3+3Na2SO4+3H29、氧化铜的还原反应:Cu2O+H2→2Cu+H2O10、过氧化氢的还原反应:2H2O2+2NaOH→2H2O+O2+2Na三、酸碱反应1、硝酸与氢氧化钠的反应:HNO3+NaOH→Na NO3+H2O2、盐酸与氢氧化钠的反应:HCl+NaOH→NaCl+H2O3、硫酸与氢氧化钠的反应:H2SO4+2NaOH→Na2SO4+2H2O。
高中化学方程式大全(最最完整版)

优质解答1、硝酸银与盐酸及可溶性盐酸盐溶液:Ag++Cl-=AgCl↓2、钠与水反应:2Na+2H2O=2Na++2OH–+H2↑3、钠与硫酸铜溶液:2Na+2H2O+Cu2+=2Na++Cu(OH)2↓+H2↑4、过氧化钠与水反应:2Na2O+2H2O=4Na++4OH–+O2↑5、碳酸氢盐溶液与强酸溶液混合:HCO3-+H+=CO2↑+H2O6、碳酸氢盐溶液与醋酸溶液混合:HCO3-+CH3COOH=CO2↑+H2O+CH3COO-7、氢氧化钙溶液与碳酸氢镁反应:Ca2++2OH-+2HCO3-+Mg2+=Mg(OH)2↓+CaCO3↓8、向碳酸氢钙溶液中加入过量的氢氧化钠:2HCO3-+Ca2++2OH–=CaCO3↓+2H2O+CO32–9、向碳酸氢钙溶液中加入少量的氢氧化钠:Ca2++HCO3-+OH–=CaCO3↓+H2O10、澄清石灰水与少量小苏打溶液混合:Ca2++OH–+HCO3-=CaCO3↓+H2O11、澄清石灰水通入少量CO2:Ca2++2OH–+CO3=CaCO3↓+H2O12、澄清石灰水通入过量CO2:OH–+CO2=HCO3-13、碳酸氢钠溶液与少量石灰水反应:Ca2++2OH–+2HCO3-=CaCO3↓+CO32–+2H2O14、碳酸氢钠溶液与过量石灰水反应:HCO3-+OH–+Ca2+=CaCO3↓+H2O15、等物质的量氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH–+NH4++HCO3-=BaCO3↓+H2O+NH3•H2O16、碳酸钠溶液与盐酸反应:CO32–+H+=HCO3- 或CO32–+2H+=CO2↑+H2O17、向氢氧化钠溶液中通入少量的CO2¬:CO2+2OH–=CO32–+H2O18、过量的CO2通入氢氧化钠溶液中:CO2+OH–=HCO3-19、碳酸氢铵溶液中加入过量氢氧化钠溶液:NH4++HCO3-+2OH–=NH3↑+CO32–+2H2O20、碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O21、碳酸钙与醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O22、澄清石灰水与稀盐酸反应:H++OH–=H2O23、磷酸溶液与少量澄清石灰水:H3PO4+OH–=H2O+H2PO4–24、磷酸溶液与过量澄清石灰水:2H3PO4+3Ca2++6OH–=Ca3(PO4)2↓+6H2O25、碳酸镁溶于强酸:MgCO3+2H+=Mg2++CO2↑+H2O26、硫酸镁溶液跟氢氧化钡溶液反应:Ba2++2OH–+Mg2++SO42–=BaSO4↓+Mg(OH)2↓27、硫酸溶液跟氢氧化钡溶液反应:Ba2++2OH–+2H++SO42–=BaSO4↓+2H2O28、硫酸氢钠溶液与氢氧化钡反应至中性:2H++SO42–+2OH–+Ba2+=2H2O+BaSO4↓29、硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀:H++SO42–+OH–+Ba2+=BaSO4↓+H2O30、硫酸铝溶液中加入过量氢氧化钡溶液:2Al3++3SO42–+8OH–+3Ba2+=3BaSO4↓+2AlO2–+4H2O31、氢氧化镁与稀硫酸反应:Mg(OH)2+2H+=Mg2++2H2O32、铝跟氢氧化钠溶液反应:2Al+2OH–+2H2O=2AlO2–+3H2↑33、物质的量之比为1:1NaAl合金置于水中:Na+Al+2H2O=Na++AlO2–+2H2↑34、氧化铝溶于强碱溶液:Al2O3+2OH–=2AlO2–+H2O35、氧化铝溶于强酸溶液:Al2O3+6H+=2Al3++3H2O36、氢氧化铝与氢氧化钠溶液:Al(OH)3+OH–=AlO2–+2H2O37、氢氧化铝与盐酸溶液反应:Al(OH)3+3H+=Al3++3H2O38、硫酸铝溶液与碳酸氢钠溶液:Al3++3HCO3-=Al(OH)3↓+CO2↑39、硫酸铝溶液与碳酸钠溶液:2Al3++3CO32–+3H2O=2Al(OH)3↓+3CO2↑40、氯化铝溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+41、明矾溶液加热水解生成沉淀:Al3++3H2O=Al(OH)3↓+3H+42、氯化铝溶液与偏铝酸钠溶液:Al3++3AlO2–+6H2O=4Al(OH)3↓43、偏铝酸钠溶液中加入氯化铁溶液:Fe3++3AlO2–+6H2O=Fe(OH)3↓+3Al(OH)3↓44、偏铝酸钠溶液中加入少量盐酸:AlO2–+H++H2O=Al(OH)3↓45、偏铝酸钠溶液中加入过量盐酸:AlO2–+4H+=Al3++2H2O46、偏铝酸钠溶液中加入氯化铵溶液:AlO2–+NH4++H2O=Al(OH)3↓+NH3↑47、金属铁溶于盐酸中:Fe+2H+=Fe2++H2↑48、铁粉与氯化铁溶液反应:Fe+2Fe3+=3Fe2+49、铜与氯化铁溶液反应:Cu+2Fe3+=Cu2++3Fe2+50、硫化亚铁与盐酸反应:FeS+H+=Fe2++H2S↑51、硫化钠与盐酸反应:S2–+2H+=H2S↑52、硫化钠溶液中加入溴水:S2–+Br2=S↓+2Br–53、氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl–54、向硫酸铁的酸性溶液中通入足量的H2S:2Fe3++H2S=2Fe2++S↓+2H+55、氯化铁溶液中滴加少量硫化钠溶液:2Fe3++S2–=S↓+2F e2+56、硫化钠溶液中滴加少量氯化铁溶液:2Fe3++3S2–=S↓+2FeS↓57、氯化铁溶液中滴加少量碘化钾溶液:2Fe3++2I–=2Fe2++I258、氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH–=Fe(OH)3↓59、氯化铁溶液跟过量氨水反应:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+60、氯化铁溶液与硫氰化钾溶液: Fe3++3SCN–=Fe(SCN)361、氯化铁溶液跟过量锌粉反应: 2Fe3++3Zn=2Fe+3Zn2+62、锌与稀硫酸: Zn+2H+=Z n2++H2↑63、锌与醋酸: Zn+2CH3COOH=CH3COO–+Zn2++H2↑64、锌与氯化铵溶液:Zn+2NH4+=Zn2++NH3↑+H2↑65、氯化铁溶液加入碘化钾溶液: 2Fe3++2I-=2Fe2++I266、硫酸亚铁溶液中加用硫酸酸化的过氧化氢溶液:2Fe2++H2O2+2H+=2Fe3++2H2O67、硫酸亚铁溶液中加用硫酸酸化的高锰酸钾溶液:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O68、四氧化三铁溶于浓盐酸: Fe3O4+8H+=2Fe3++Fe2++4H2O69、氧化铁溶于盐酸: Fe2O3+6H+=2Fe3++3H2O70、氧化铁溶于氢碘酸溶液: Fe2O3+2I-+6H+=2Fe2++I2+3H2O71、用氯化铁与沸水反应制氢氧化铁胶体:Fe3++3H2O Fe(OH)3+3H+72、向溴化亚铁溶液通入足量的氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-73、向溴化亚铁溶液通入少量氯气: 2Fe2++Cl2=2Fe3++2Cl-74、向碘化亚铁溶液通入足量氯气: 2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-75、向碘化亚铁溶液通入少量氯气: 2I-+Cl2=I2+2Cl-76、碘化钾溶液中加入氯水: 2I-+Cl2=I2+2Cl-77、碘化钾溶液中加入过量氯水: I-+3Cl2+3H2O=6H++IO3-+6Cl-78、溴化钠溶液中加入氯水: 2Br-+Cl2=Br2+2Cl-79、亚硫酸溶液中加入氯水: H2SO3+Cl2+H2O=4H++2Cl-+SO42-80、亚硫酸溶液中加入氯化铁: H2SO3+2Fe2++H2O=4H++2Fe2++SO42-81、亚硫酸溶液中加入双氧水: H2SO3++H2O2=2H++H2O+SO42-82、氯气通入水中: Cl2+H2O=H++Cl-+HClO83、氯气通入碳酸氢钠溶液中: Cl2+HCO3=Cl-+CO2+HClO84、亚硫酸钠溶液中加入溴水: SO32-+H2O+Br2=SO42-+Br-+2H+85、亚硫酸钠溶液中加入双氧水: SO32-+H2O2=SO42-+2H2O86、二氧化硫通入溴水中: SO2+Br2+2H2O=4H++2Br-+SO42-87、单质铁溶于过量稀硝酸中(NO):Fe+NO3-+4H+=Fe3++NO↑+2H2O88、过量单质铁溶于稀硝酸中(NO):3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O89、单质铜与稀硝酸反应: 3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O90、单质铜与浓硝酸反应: Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O91、铜片插入硝酸银溶液: 2Ag++Cu=2Ag+Cu2+92、用氨水吸收少量SO2: SO2+2NH3+H2O=2NH4++SO32-93、用氨水吸收过量的SO¬2 : SO2+NH3+H2O=NH4++HSO3-94、稀硝酸中通入SO2: 3SO2+2NO3-+2H2O=3SO42-+2NO↑+4H+95、浓硝酸中通入SO2: SO2+2NO3-=SO42-+2NO2↑96、氯化铵与氢氧化钠两种浓溶液混合加热:NH4++OH- NH3↑+H2O97、向次氯酸钙溶液中通入SO2: Ca2++SO2+ClO-+H2O=CaSO4↓+Cl-+2H+98、用碳酸钠溶液吸收过量SO2: CO32-+H2O+2SO2=CO2↑+2HSO3-99、硫酸铜溶液中通入硫化氢:H2S+Cu2+=CuS↓+2H+100、硫酸铜溶液中加入硫化钠溶液:S2-+Cu2+=CuS↓101、电解饱和食盐水: 2Cl-+2H2O 2OH-+H2↑+Cl2↑102、电解硫酸铜溶液:2Cu2++2H2O 2Cu↓+O2↑+4H+103、电解氯化铜溶液: Cu2++2Cl- Cu↓+Cl2↑104、电解熔融氯化钠: 2Na++2Cl-(熔融) 2Na+Cl2↑105、电解熔融氧化铝: 4Al3+ +6O2- 4Al+3O2↑106、二氧化锰与浓盐酸共热: MnO2+2Cl-+4H+ Mn2++Cl2↑+2H2O107、氯气通入冷的氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O108、氯气通入热的氢氧化钾溶液中:3Cl2+6OH-=5Cl-+ClO3-+3H2O109、次氯酸钙溶液通入过量的二氧化碳:ClO-+H2O+CO2=HClO+HCO3-110、次氯酸钠溶液中加入浓盐酸: ClO-+Cl-+2H+=Cl2↑+H2O111、氯酸钾与浓盐酸: ClO3-+5Cl-+6H+=3Cl2↑+3H2O112、硫化钠、亚硫酸钠混合液中加入稀硫酸:2S2-+SO32-+6H+=3S↓+3H2O113、NO2溶于水: 3NO2+H2O=2H++NO3-+NO↑114、NO2通入亚硫酸钠溶液: SO32-+NO2=SO42-+NO↑115、硫化钠的第一步水 S2-+H2O HSO3-+OH-116、碳酸钠的第一步水 CO32-+H2O HCO3-+OH-117、氯化钡溶液与硫酸反应: Ba2++SO42-=BaSO4↓118、硫溶于热的氢氧化钠溶液: 3S+6OH-=2S2-+SO32-+3H2O119、醋酸钡溶液与硫酸反应:Ba2++2CH3COO-+2H++SO42-=BaSO4↓+2CH3COOH 120、醋酸与氢氧化钾溶液反应: CH3COOH+OH-=CH3COO-+H2O121、醋酸与氨水反应:CH3COOH+NH3•H2O=CH3COO-+NH4++2H2O122、苯酚溶于氢氧化钠溶液: C6H5OH+OH-=C6H5O-+H2O123、苯酚与氯化铁溶液反应: 6C6H5OH+Fe3+=[Fe(C6H5O)6]3-+6H+ 124、苯酚钠溶于醋酸溶液: C6H5O-+CH3COOH=C6H5OH+CH3COO-125、苯酚钠溶液中通入少量CO2:C6H5O-+H2O+CO2=C6H5OH+HCO3-126、碳酸钠溶液中加入过量苯酚:C6H5OH+CO32-=C6H5O-+HCO3-127、碳酸钙跟甲酸反应:CaCO3+HCOOH=Ca2++CO2↑+H2O+HCOO-128、甲酸钠跟盐酸反应: HCOO-+H+=HCOOH129、小苏打溶液与甲酸溶液反应:HCOOH+HCO3-=CO2↑+H2O+HCOO-130、Na2C2O4溶液中加入酸性高锰酸钾溶液:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O131、酸性高锰酸钾溶液与双氧水:5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O 132、酸性氯化亚铁溶液与双氧水:2Fe2++H2O2+2H+=2Fe3++2H2O133、SO2通入酸性高锰酸钾溶液:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ 134、乙烯通入酸性高锰酸钾溶液生成CO2:5C2H4+12MnO4-+36H+=10CO2↑+12Mn2++28H2O135、乙酸乙酯与氢氧化钠溶液:CH3COOCH2CH3+OH-=CH3COO-+HOCH2CH3 136、硬脂酸甘油酯与氢氧化钠溶液:(C17H35COO)3(C3H5O3)+3OH-=3C17H35COO-+CH2(OH)CH(OH)CH2OH 137、氯乙烷在氢氧化钠溶液中水CH3CH2Cl+OH-=CH3CH2OH+Cl-138、硝酸银溶液中滴入少量氨水:Ag++NH3•H2O=AgOH↓+NH4+139、硝酸银溶液中滴加氨水至过量:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O 140、葡萄糖发生银镜反应:CH2(OH)(CHOH)4CHO+2[Ag(NH3)2]++2OH-=CH2(OH)(CHOH)4COO-+NH4++3NH3+H2O+2Ag↓141、硫酸铜溶液中加入氢氧化钠溶液:Cu2++2OH-=Cu(OH)2↓142、硫酸铜溶液中加入少量氨水:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+143、硫酸铜溶液中加入过量氨水:Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O 144、硫酸锌溶液中加入少量氨水:Zn2++2NH3•H2O=Zn(OH)2↓+2NH4+145、硫酸锌溶液中加入过量氨水:Zn2++4NH3•H2O=[Zn(NH3)4]2++4H2O第一章 卤素第一节 氯气1、NaCl 2Cl Na 22−−→−+点燃2、22CuCl Cl Cu −−→−+点燃 3、32FeCl 2Cl 3Fe 2−−→−+点燃 4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃6、523PCl Cl PCl →+7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()(9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)(10、O H NaCl NaClO Cl NaOH 222++→+ 11、↑++−→−+∆2222Cl O H 2MnCl MnO HCl 4 12、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓) 13、2O HCl 2HClO 2+−−→−见光第二节 氯化氢 14、↑+→+HCl NaHSO SO H NaCl 442(浓) 15、↑+−→−+∆HCl SO Na NaCl NaHSO 424 16、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓)(14、15结合) 17、33HNO AgCl AgNO HCl +↓→+18、33NaNO AgCl AgNO NaCl +↓→+19、33KNO AgCl AgNO KCl +↓→+20、↑++→+2223CO O H CaCl CaCO HCl 2第三节 氧化还原反应21、O H Cu H CuO 22+−→−+∆22、O H 2NO 4CO HNO 4C 2223+↑+↑→+ 23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++−→−+∆)((极稀)24、4243324SO H 15PO H 6P Cu 5O H 24CuSO 15P 11++→++25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓) 26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++−→−+∆)((极稀) 27、O H 31SO K SO Fe 9SO Cr SO H 31O Fe 6O Cr K 2423423424243722+++→++)()(28、↑+↑+→++2223CO 3N S K S C 3KNO 2第四节 卤族元素29、HF 2F H 22→+30、HBr 2Br H 22→+31、HI 2I H 22→+32、22Br NaCl 2Cl NaBr 2+→+33、22I KCl 2Cl KI 2+→+34、22I KBr 2Br KI 2+→+35、33NaNO AgBr AgNO NaBr +↓→+36、33KNO AgI AgNO KI +↓→+37、2Br Ag 2AgBr 2+−−→−光照第二章 摩尔 反应热第一节 摩尔38、22CO O C →+39、↑+→+22H MgCl HCl 2Mg第二节 气体摩尔体积40、22H ZnCl HCl 2Zn +→+第三节 物质的量浓度41、O H 2SO Na SO H NaOH 224242+→+第四节 反应热42、kJ 5.393CO O C 22+−−→−+(气)(气)(固)点燃43、kJ 6.483O H 2O H 2222+→+(气)(气)(气) 44、kJ 6.571O H 2O H 2222+→+(液)(气)(气) 45、kJ 3.131H CO O H C 22-+−→−+∆(气)(气)(气)(固) 第三章 硫 硫酸第一节 硫46、S Cu S Cu 22−→−+∆47、FeS S Fe −→−+∆ 48、S H H S 22−→−+∆49、2CS C S −−→−+高温 50、22SO O S −−→−+点燃 51、O H 3SO K S K 2KOH 6S 32422++−→−+∆第二节 硫的氢化物和氧化物 52、↓+−→−∆S H S H 22 53、2222SO 2O H 2(O 3S H 2+−−→−+点燃足)54、↓+−−→−+S 2O H 2(O S H 2222点燃不足) 55、↓+−−→−+S 3O H 2SO S H 2222点燃 56、HBr 2S Br S H 22+↓→+57、↑+→+S H FeCl HCl 2FeS 2258、4224SO H CuS S H CuSO +↓→+59、HAc 2PbS S H PbAc 22+↓→+60、O H NaHS NaOH S H 22+→+61、O H S Na NaOH NaHS 22+→+62、O H 2S Na NaOH 2S H 222+→+(60、61结合) 63、HCl 2FeCl 2S FeCl 2S H 232++↓→+64、↑+→+S H FeSO FeS SO H 2442(稀) 65、3222SO H O H SO ⇔+66、3OV 22SO 2O SO 252∆−−→←+ 67、4223SO H O H SO →+68、↑++→+22424232SO O H SO Na SO H SO Na 69、O H SO Na NaOH 2SO 2322+→+70、32CaSO CaO SO →+71、O H CaSO OH Ca 2SO 2322+↓→+)(72、23232HSO Ca O H CaSO SO )(→++73、O H 2S 3S H 2SO 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++75、42222SO H HBr 2O H 2Br SO +→++76、42424422SO H 2SO K MnSO KMnO 2O H 2SO 5++→++第三节 硫酸的工业制法77、↑+−−→−+23222SO 8O Fe 2O 11FeS 4高温78、3OV 22SO 2O SO 252∆−−→←+ 79、4232SO H SO O H →+第四节 硫酸 硫酸盐80、O H 2SO 2CO SO H 2C 22242+↑+↑−→−+∆(浓) 81、O H 2SO 3SO H 2S 2242+↑−→−+∆(浓)82、O H 2SO PO H SO H P 224342+↑+−→−+∆(浓) 83、O H 2SO S SO H S H 22422++−→−+∆(浓) 84、O H 2SO CuSO SO H 2Cu 22442+↑+−→−+∆(浓) 85、HCl 2BaSO SO H BaCl 4422+↓→+ 86、NaCl 2BaSO SO Na BaCl 4422+↓→+ 87、NaCl 2BaCO CO Na BaCl 3322+↓→+ 88、↑++→+2223CO O H BaCl HCl 2BaCO 89、↑++→+222333CO O H NO Ba HNO 2BaCO )(90、↑++→+2223232CO O H S Na SO H CO Na 91、42232SO H 2O SO H 2→+92、42232SO Na 2O SO Na 2→+93、423CaSO 2O CaSO 2→+94、O H 6SO 3SO Fe SO H 6Fe 22234242+↑+−→−+∆)((浓) 95、O H SO Na SO Br SO H 2NaBr 22422242++↑+−→−+∆(浓) 96、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓) 97、O H 11C 12O H C 2SOH 11221142+−−−→−浓 第四章 碱金属第一节 钠98、O Na 2O Na 422→+99、222O Na O Na 2→+100、NaCl 2Cl Na 22−−→−+点燃 101、S Na S Na 22−−→−+研磨 102、↑+→+22H NaOH 2O H 2Na 2103、↑++→++242242H SO Na OH Cu CuSO O H 2Na 2)(第二节 钠的氧化物104、NaOH 2O H O Na 22→+105、↑+→+2222O NaOH 4O H 2O Na 2 106、3222CO Na CO O Na →+107、232222O CO Na 2CO 2O Na 2+→+ 108、O H NaCl 2HCl 2O Na 22+→+ 109、↑++→+2222O O H 2NaCl 4HCl 4O Na 110、O H CO NaCl 2HCl 2CO Na 2232+↑+→+ 111、O H CO NaCl HCl NaHCO 223+↑+→+112、O H CO CO Na NaHCO 222323+↑+−→−∆113、O H CO Na NaOH NaHCO 2323+−→−+∆ 114、O H 2CO Na CaCO OH Ca NaHCO 2232323++↓→+(少量))( 115、O H NaOH CaCO OH Ca NaHCO 2323++↓→+(足量))( 116、NaCl 2BaCO BaCl CO Na 3232+↓→+ 117、NaCl 2CaCO CaCl CO Na 3232+↓→+ 118、O H 2CO 2CaCl HCl 2HCO Ca 22223+↑+→+)( 119、O H 2CO Na CaCO NaOH 2HCO Ca 232323++↓→+)(120、O H SO NaCl HCl NaHSO 223+↑+→+第三节 碱金属元素121、O Li 2O Li 422−−→−+点燃 122、22KO O K −−→−+点燃 123、MX 2X M 22→+(M 表示氧族元素,X 代表卤族元素)124、MH 2H M 22→+125、↑+→+22H MOH 2O H 2M 2第五章 物质结构 元素周期律本章内容、性质特殊,所有化学反应方程式均融在其他章节中。
高中化学方程式大全 (完整版)

高中化学方程式大全一、非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si) (1)二、金属单质(Na,Mg,Al,Fe)的还原性 (5)三、非金属氢化物(HF,HCl,H2O,H2S,NH3) (7)四、非金属氧化物 (9)五、金属氧化物 (12)六、含氧酸 (14)七、碱 (17)八、盐 (18)一、非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si)1, 氧化性:F2 + H2 === 2HFF2 +Xe(过量)===XeF22F2(过量)+Xe===XeF4nF2 +2M===2MFn (表示大部分金属)2F2 +2H2O===4HF+O22F2 +2NaOH===2NaF+OF2 +H2O F2 +2NaCl===2NaF+Cl2F2 +2NaBr===2NaF+Br2F2+2NaI ===2NaF+I2F2 +Cl2 (等体积)===2ClF3F2 (过量)+Cl2===2ClF37F2(过量)+I2 ===2IF7Cl2 +H2 ===2HCl3Cl2 +2P===2PCl3Cl2 +PCl3 ===PCl5Cl2 +2Na===2NaCl3Cl2 +2Fe===2FeCl3Cl2 +2FeCl2 ===2FeCl3Cl2+Cu===CuCl22Cl2+2NaBr===2NaCl+Br2Cl2 +2NaI ===2NaCl+I25Cl2+I2+6H2O===2HIO3+10HCl Cl2 +Na2S===2NaCl+SCl2 +H2S===2HCl+SCl2+SO2 +2H2O===H2SO4 +2HCl Cl2 +H2O2 ===2HCl+O22O2 +3Fe===Fe3O4 O2+K===KO2S+H2===H2S2S+C===CS2S+Fe===FeSS+2Cu===Cu2S3S+2Al===Al2S3S+Zn===ZnSN2+3H2===2NH3 N2+3Mg===Mg3N2 N2+3Ca===Ca3N2 N2+3Ba===Ba3N2 N2+6Na===2Na3N N2+6K===2K3NN2+6Rb===2Rb3N P2+6H2===4PH3P+3Na===Na3P2P+3Zn===Zn3P22.还原性S+O2===SO2S+O2===SO2S+6HNO3(浓)===H2SO4+6NO2+2H2O3S+4 HNO3(稀)===3SO2+4NO+2H2ON2+O2===2NO4P+5O2===P4O10(常写成P2O5)2P+3X2===2PX3 (X表示F2,Cl2,Br2)PX3+X2===PX5P4+20HNO3(浓)===4H3PO4+20NO2+4H2O C+2F2===CF4C+2Cl2===CCl42C+O2(少量)===2COC+O2(足量)===CO2C+CO2===2COC+H2O===CO+H2(生成水煤气)2C+SiO2===Si+2CO(制得粗硅)Si(粗)+2Cl===SiCl4(SiCl4+2H2===Si(纯)+4HCl)Si(粉)+O2===SiO2Si+C===SiC(金刚砂)Si+2NaOH+H2O===Na2SiO3+2H23,(碱中)歧化Cl2+H2O===HCl+HClO(加酸抑制歧化,加碱或光照促进歧化)Cl2+2NaOH===NaCl+NaClO+H2O2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O3Cl2+6KOH(热,浓)===5KCl+KClO3+3H2O3S+6NaOH===2Na2S+Na2SO3+3H2O4P+3KOH(浓)+3H2O===PH3+3KH2PO211P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4 3C+CaO===CaC2+CO3C+SiO2===SiC+2CO二、金属单质(Na,Mg,Al,Fe)的还原性2Na+H2===2NaH4Na+O2===2Na2O2Na2O+O2===2Na2O22Na+O2===Na2O22Na+S===Na2S(爆炸)2Na+2H2O===2NaOH+H22Na+2NH3===2NaNH2+H24Na+TiCl4(熔融)===4NaCl+TiMg+Cl2===MgCl2Mg+Br2===MgBr22Mg+O2===2MgOMg+S===MgSMg+2H2O===Mg(OH)2+H22Mg+TiCl4(熔融)===Ti+2MgCl2Mg+2RbCl===MgCl2+2Rb2Mg+CO2===2MgO+C2Mg+SiO2===2MgO+SiMg+H2S===MgS+H2Mg+H2SO4===MgSO4+H22Al+3Cl2===2AlCl34Al+3O2===2Al2O3(钝化)4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg 4Al+3MnO2===2Al2O3+3Mn2Al+Cr2O3===Al2O3+2Cr2Al+Fe2O3===Al2O3+2Fe2Al+3FeO===Al2O3+3Fe2Al+6HCl===2AlCl3+3H22Al+3H2SO4===Al2(SO4)3+3H22Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O (Al,Fe在冷,浓的H2SO4,HNO3中钝化)Al+4HNO(稀)===Al(NO3)3+NO+2H2O2Al+2NaOH+2H2O===2NaAlO2+3H22Fe+3Br2===2FeBr3Fe+I2===FeI2Fe+S===FeS3Fe+4H2O(g)===Fe3O4+4H2Fe+2HCl===FeCl2+H2Fe+CuCl2===FeCl2+CuFe+SnCl4===FeCl2+SnCl2(铁在酸性环境下,不能把四氯化锡完全还原为单质锡Fe+SnCl2==FeCl2+Sn)三、非金属氢化物(HF,HCl,H2O,H2S,NH3)1,还原性:4HCl(浓)+MnO2===MnCl2+Cl2+2H2O4HCl(g)+O2===2Cl2+2H2O16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O2H2O+2F2===4HF+O22H2S+3O2(足量)===2SO2+2H2O2H2S+O2(少量)===2S+2H2O2H2S+SO2===3S+2H2OH2S+H2SO4(浓)===S+SO2+2H2O3H2S+2HNO(稀)===3S+2NO+4H2O5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2O H2S+4Na2O2+2H2O===Na2SO4+6NaOH2NH3+3CuO===3Cu+N2+3H2O2NH3+3Cl2===N2+6HCl8NH3+3Cl2===N2+6NH4Cl4NH3+3O2(纯氧)===2N2+6H2O4NH3+5O2===4NO+6H2O4NH3+6NO===5N2+6HO(用氨清除NO)NaH+H2O===NaOH+H24NaH+TiCl4===Ti+4NaCl+2H2CaH2+2H2O===Ca(OH)2+2H22,酸性:4HF+SiO2===SiF4+2H2O(此反应广泛应用于测定矿样或钢样中SiO2的含量)2HF+CaCl2===CaF2+2HClH2S+Fe===FeS+H2H2S+CuCl2===CuS+2HClH2S+2AgNO3===Ag2S+2HNO3H2S+HgCl2===HgS+2HClH2S+Pb(NO3)2===PbS+2HNO3H2S+FeCl2===2NH3+2Na==2NaNH2+H2(NaNH2+H2O===NaOH+NH3)3,碱性:NH3+HCl===NH4ClNH3+HNO3===NH4NO32NH3+H2SO4===(NH4)2SO4NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl (此反应用于工业制备小苏打,苏打)4,不稳定性:2HF===H2+F22HCl===H2+Cl22H2O===2H2+O22H2O2===2H2O+O2H2S===H2+S2NH3===N2+3H2四、非金属氧化物1.低价态的还原性:2SO2+O2===2SO32SO2+O2+2H2O===2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)SO2+Cl2+2H2O===H2SO4+2HClSO2+Br2+2H2O===H2SO4+2HBrSO2+I2+2H2O===H2SO4+2HISO2+NO2===SO3+NO2NO+O2===2NO2NO+NO2+2NaOH===2NaNO2(用于制硝酸工业中吸收尾气中的NO和NO2)2CO+O2===2CO2CO+CuO===Cu+CO23CO+Fe2O3===2Fe+3CO2CO+H2O===CO2+H22.氧化性:SO2+2H2S===3S+2H2OSO3+2KI===K2SO3+I2NO2+2KI+H2O===NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)4NO2+H2S===4NO+SO3+H2O2NO2+Cu===4CuO+N2CO2+2Mg===2MgO+C(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)SiO2+2H2===Si+2H2OSiO2+2Mg===2MgO+Si3,与水的作用:SO2+H2O===H2SO3SO3+H2O===H2SO43NO2+H2O===2HNO3+NON2O5+H2O===2HNO3P2O5+H2O===2HPO3P2O5+3H2O===2H3PO4(P2O5极易吸水,可作气体干燥剂P2O5+3H2SO4(浓)===2H3PO4+3SO3)CO2+H2O===H2CO34,与碱性物质的作用:SO2+2NH3+H2O===(NH4)2SO3SO2+(NH4)2SO3+H2O===2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,再用H2SO4处理: 2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2 生成的硫酸铵作化肥,SO2循环作原料气)SO2+Ca(OH)2===CaSO3+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO3+MgO===MgSO4SO3+Ca(OH)2===CaSO4+H2OCO2+2NaOH(过量)===Na2CO3+H2OCO2(过量)+NaOH===NaHCO3CO2+Ca(OH)2(过量)===CaCO3+H2O2CO2(过量)+Ca(OH)2===Ca(HCO3)2CO2+2NaAlO2+3H2O===2Al(OH)3+Na2CO3 CO2+C6H5ONa+H2O===C6H5OH+NaHCO3 SiO2+CaO===CaSiO3SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3===Na2SiO3+CO2SiO2+CaCO3===CaSiO3+CO2五、金属氧化物1,低价态的还原性:6FeO+O2===2Fe3O4FeO+4HNO3===Fe(NO3)3+NO2+2H2O2,氧化性:Na2O2+2Na===2Na2O(此反应用于制备Na2O)MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al. 一般通过电解制Mg和Al.Fe2O3+3H2===2Fe+3H2O (制还原铁粉)Fe3O4+4H2===3Fe+4H2O3,与水的作用:Na2O+H2O===2NaOH2Na2O2+2H2O===4NaOH+O2(此反应分两步:Na2O2+2H2O===2NaOH+H2O2 ;2H2O2===2H2O+O2. H2O2的制备可利用类似的反应: BaO2+H2SO4(稀)===BaSO4+H2O2)MgO+H2O===Mg(OH)2 (缓慢反应)4,与酸性物质的作用:Na2O+SO3===Na2SO4Na2O+CO2===Na2CO3Na2O+2HCl===2NaCl+H2O2Na2O2+2CO2===2Na2CO3+O2Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2MgO+SO3===MgSO4MgO+H2SO4===MgSO4+H2OAl2O3+3H2SO4===Al2(SO4)3+3H2O(Al2O3是两性氧化物:Al2O3+2NaOH===2NaAlO2+H2O)FeO+2HCl===FeCl2+3H2OFe2O3+6HCl===2FeCl3+3H2OFe2O3+3H2S(g)===Fe2S3+3H2O3 高中所有化学方程式Fe3O4+8HCl===FeCl2+2FeCl3+4H2O六、含氧酸1,氧化性:4HClO3+3H2S===3H2SO4+4HClHClO3+HI===HIO3+HCl3HClO+HI===HIO3+3HClHClO+H2SO3===H2SO4+HClHClO+H2O2===HCl+H2O+O2(氧化性:HClO>HClO2>HClO3>HClO4,但浓,热的HClO4氧化性很强)2H2SO4(浓)+C===CO2+2SO2+2H2O2H2SO4(浓)+S===3SO2+2H2OH2SO4+Fe(Al) 室温下钝化6H2SO4(浓)+2Fe===Fe2(SO4)3+3SO2+6H2O2H2SO4(浓)+Cu===CuSO4+SO2+2H2OH2SO4(浓)+2HBr===SO2+Br2+2H2OH2SO4(浓)+2HI===SO2+I2+2H2OH2SO4(稀)+Fe===FeSO4+H22H2SO3+2H2S===3S+2H2O4HNO3(浓)+C===CO2+4NO2+2H2O6HNO3(浓)+S===H2SO4+6NO2+2H2O5HNO3(浓)+P===H3PO4+5NO2+H2O6HNO3+Fe===Fe(NO3)3+3NO2+3H2O4HNO3+Fe===Fe(NO3)3+NO+2H2O30HNO3+8Fe===8Fe(NO3)3+3N2O+15H2O36HNO3+10Fe===10Fe(NO3)3+3N2+18H2O30HNO3+8Fe===8Fe(NO3)3+3NH4NO3+9H2O2,还原性:H2SO3+X2+H2O===H2SO4+2HX(X表示Cl2,Br2,I2)2H2SO3+O2===2H2SO4H2SO3+H2O2===H2SO4+H2O5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2O H2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl3,酸性:H2SO4(浓) +CaF2===CaSO4+2HFH2SO4(浓)+NaCl===NaHSO4+HClH2SO4(浓) +2NaCl===Na2SO4+2HClH2SO4(浓)+NaNO3===NaHSO4+HNO33H2SO4(浓)+Ca3(PO4)2===3CaSO4+2H3PO42H2SO4(浓)+Ca3(PO4)2===2CaSO4+Ca(H2PO4)23HNO3+Ag3PO4===H3PO4+3AgNO32HNO3+CaCO3===Ca(NO3)2+H2O+CO2(用HNO3和浓H2SO4不能制备H2S,HI,HBr,(SO2)等还原性气体)4H3PO4+Ca3(PO4)2===3Ca(H2PO4)2(重钙)H3PO4(浓)+NaBr===NaH2PO4+HBrH3PO4(浓)+NaI===NaH2PO4+HI4,不稳定性:2HClO===2HCl+O24HNO3===4NO2+O2+2H2OH2SO3===H2O+SO2H2CO3===H2O+CO2H4SiO4===H2SiO3+H2O七、碱1,低价态的还原性:4Fe(OH)2+O2+2H2O===4Fe(OH)32,与酸性物质的作用:2NaOH+SO2(少量)===Na2SO3+H2O NaOH+SO2(足量)===NaHSO32NaOH+SiO2===NaSiO3+H2O2NaOH+Al2O3===2NaAlO2+H2O2NaOH+Cl2===NaCl+NaClO+H2ONaOH+HCl===NaCl+H2ONaOH+H2S(足量)===NaHS+H2O2NaOH+H2S(少量)===Na2S+2H2O3NaOH+AlCl3===Al(OH)3+3NaCl NaOH+Al(OH)3===NaAlO2+2H2O (AlCl3和Al(OH)3哪个酸性强?)NaOH+NH4Cl===NaCl+NH3+H2OMg(OH)2+2NH4Cl===MgCl2+2NH3.H2O Al(OH)3+NH4Cl 不溶解3,不稳定性:Mg(OH)2===MgO+H2O2Al(OH)3===Al2O3+3H2O2Fe(OH)3===Fe2O3+3H2OCu(OH)2===CuO+H2O八、盐1,氧化性:2FeCl3+Fe===3FeCl22FeCl3+Cu===2FeCl2+CuCl2(用于雕刻铜线路版)2FeCl3+Zn===2FeCl2+ZnCl2FeCl3+Ag===FeCl2+AgCFe2(SO4)3+2Ag===FeSO4+Ag2SO4(较难反应) Fe(NO3)3+Ag 不反应2FeCl3+H2S===2FeCl2+2HCl+S2FeCl3+2KI===2FeCl2+2KCl+I2FeCl2+Mg===Fe+MgCl22,还原性:2FeCl2+Cl2===2FeCl33Na2S+8HNO3(稀)===6NaNO3+2NO+3S+4H2O 3Na2SO3+2HNO3(稀)===3Na2SO4+2NO+H2O2Na2SO3+O2===2Na2SO43,与碱性物质的作用:MgCl2+2NH3.H2O===Mg(OH)2+NH4ClAlCl3+3NH3.H2O===Al(OH)3+3NH4ClFeCl3+3NH3.H2O===Fe(OH)3+3NH4Cl4,与酸性物质的作用:Na3PO4+HCl===Na2HPO4+NaClNa2HPO4+HCl===NaH2PO4+NaClNaH2PO4+HCl===H3PO4+NaClNa2CO3+HCl===NaHCO3+NaClNaHCO3+HCl===NaCl+H2O+CO23Na2CO3+2AlCl3+3H2O===2Al(OH)3+3CO2+6NaCl 3Na2CO3+2FeCl3+3H2O===2Fe(OH)3+3CO2+6NaCl 3NaHCO3+AlCl3===Al(OH)3+3CO23NaHCO3+FeCl3===Fe(OH)3+3CO23Na2S+Al2(SO4)3+6H2O===2Al(OH)3+3H2S3NaAlO2+AlCl3+6H2O===4Al(OH)35,不稳定性:Na2S2O3+H2SO4===Na2SO4+S+SO2+H2ONH4Cl===NH3+HClNH4HCO3===NH3+H2O+CO22KNO3===2KNO2+O22Cu(NO3)3===2CuO+4NO2+O2 2KMnO4===K2MnO4+MnO2+O2 2KClO3===2KCl+3O22NaHCO3===Na2CO3+H2O+CO2 Ca(HCO3)2===CaCO3+H2O+CO2 CaCO3===CaO+CO2MgCO3===MgO+CO2。
(完整版)高中所有常见化学方程式

2Na 2 O2 + 2CO 2 = 2Na 2CO 3 + O2
5、苏打 (纯碱 )与盐酸反应
①盐酸中滴加纯碱溶液
Na 2CO 3 + 2HCl = 2NaCl + H 2O + CO 2↑
CO
2- 3
+
+
2H
=
H 2O
+
CO 2↑
②纯碱溶液中滴加盐酸,至过量
Na 2CO 3 + HCl = NaHCO 3 + NaCl
2
高中常见化学方程式
42、 NaAlO 2 溶液通入过量 CO 2
NaAlO 2 + CO 2+ 2H 2 O==Al(OH) 3↓+ NaHCO 3
AlO
-
2
+
CO 2+ 2H 2 O==Al(OH)
3 ↓+
HCO
-
3
43、硫酸铝溶液中滴过量氨水
Al 2(SO 4)3 + 6NH 3·H 2 O= 2Al(OH) 3↓+ 3(NH 4)2 SO4
高中常见化学方程式
Fe 与稀 HNO 3 反应 Fe+ 4HNO 3= Fe(NO 3)3+ NO ↑+ 2H 2O(Fe 不足 ) 3Fe+ 8HNO 3= 3Fe(NO 3)2+ 2NO ↑+ 4H 2O(Fe 过量 ) 29、 NO 2 、 O 2 的混合气通入水中无剩余气体 (了解 )
20、硫酸工业制法
+
-
2Na + 2H 2O = 2Na + 2OH + H 2 ↑
3、过氧化钠与水的反应 (放热反应、 Na 2O2 是强氧化剂,
用于漂白 )
点燃
H 2 + Cl 2
2HCl
氟气与氢气反应 (黑暗处即可爆炸 )
2Na 2O2 + 2H 2O = 4NaOH + O2 ↑ 2Na 2O2 + 2H 2O = 4Na ++ 4OH -+ O2↑ 碱性氧化物 Na 2O 与水的反应 Na 2O+ H 2O = 2NaOH 4、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源, 原因是:
完整版)高中化学方程式大全(最最完整版)

完整版)高中化学方程式大全(最最完整版) 高中化学方程式总结第一章:卤素第一节:氯气1、2Na + Cl2 → 2NaCl2、Cu + Cl2 → CuCl23、2Fe + 3Cl2 → 2FeCl34、H2 + Cl2 → 2HCl5、2P + 3Cl2 → 2PCl36、PCl3 + Cl2 → PCl57、Cl2 + H2O → HCl + HClO8、2Ca(OH)2 + 2Cl2 → Ca(ClO)2 + CaCl2 + 2H2O9、Ca(ClO)2 + CO2 + H2O → CaCO3 ↓ + 2HClO10、2NaOH + Cl2 → NaClO + NaCl + H2O (光照)11、4HCl + MnO2 → MnCl2 + 2H2O + Cl2 ↑12、2KMnO4 + 16HCl (浓) → 2MnCl2 + 2KCl + 5Cl2 ↑ + 8H2O13、2HClO → 2HCl + O2第二节:氯化氢14、NaHSO4 + HCl ↑ → NaCl + H2SO415、NaCl + H2SO4 (浓) → Na2SO4 + HCl ↑14、15结合)16、2NaCl + H2SO4 (浓)17、HCl + AgNO3 → AgCl ↓ + HNO318、NaCl + AgNO3 → AgCl ↓ + NaNO319、KCl + AgNO3 → AgCl ↓ + KNO320、2HCl + CaCO3 → CaCl2 + H2O + CO2 ↑第三节:氧化还原反应21、CuO + H2 → Cu + H2O22、C + 4HNO3 → CO2 ↑ + 4NO2 ↑ + 2H2O23、4Zn(NO3)2 → 4Zn + 10NO2 ↑ + NH4NO3 + 3H2O24、11P + 15CuSO4 + 24H2O → 5Cu3P + 6H3PO4 + 15H2SO425、KClO3 + 6HCl (浓) → 3Cl2 ↑ + KCl + 3H2O26、4Mg(NO3)2 → 4Mg + 10NO2 ↑ + N2H4(NO3)222HBr S(固)27、化学方程式:K2Cr2O76Fe3O431H2SO4Cr(2SO439Fe(2SO43K2SO431H2O。
高中化学方程式总结(重要)

高中化学方程式总结第一部分无机方程式1、钠与空气常温下反应:4Na+O2==2Na2O2、钠再空气中加热(过氧化钠为黄色固体):2Na+O2==Na2O2(加热或点燃)3、钠与水反应(现象浮、游、熔、响、红):2Na+2H2O==2NaOH+H2↑4、铁与水蒸气反应:3Fe+4H2O(g)==Fe3O4+4H2(加热)5、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O==2NaAlO2+3H2↑2Al+2OH-+2H2O==2AlO2-+3H2↑6、氧化钠与水反应:Na2O+H2O==2NaOH7、氧化钠与二氧化碳反应:Na2O+CO2==Na2CO38、过氧化钠与水反应(反应放出大量的热):2Na2O2+2H2O==4NaOH+O2↑9、过氧化钠与二氧化碳反应(防毒面具与潜水艇制氧气):2Na2O2+2CO2==2Na2CO3+O210、碳酸钠(俗称:苏打、纯碱)与盐酸反应(注意“互滴”时的现象)少量盐酸:Na2CO3+HCl==NaCl+NaHCO3CO32- + H+==HCO3-NaHCO3+HCl==NaCl+H2O+CO2↑ HCO3- + H+==H2O+CO2↑过量盐酸:Na2CO3+2HCl==2NaCl+H2O+CO2↑CO32-+2H+==H2O+CO2↑11、碳酸氢钠(俗称:小苏打)与盐酸反应:NaHCO3+HCl==NaCl+H2O+CO2↑HCO3-+H+==H2O+CO2↑12、向碳酸钠溶液中通入二氧化碳:Na2CO3+H2O+CO2==2NaHCO3CO32-+H2O+CO2==2HCO3-13、碳酸钠加热分解:2NaHCO3==Na2CO3+H2O+CO2↑(加热)14、碳酸氢钠溶液加入氢氧化钠:NaHCO3+NaOH==Na2CO3+H2O HCO3-+OH-==CO32-+H2O15、氧化铝与盐酸反应:Al2O3+6HCl==2AlCl3+3H2O Al2O3+6H+==2Al3++3H2O16、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH==2NaAlO2+H2O Al2O3+2OH-==2AlO2-+H2O17、实验室制取氢氧化铝(用可溶性铝盐和氨水反应):Al2(SO4)3+6NH3·H2O==2Al(OH)3↓+3(NH4)2SO4Al3++ 3NH3·H2O ==Al(OH)3↓+3NH4+18、氢氧化铝与盐酸反应:Al(OH)3+3HCl==AlCl3+3H2O Al(OH)3+3H+==Al3++3H2O19、加热氢氧化铝分解:2Al(OH)3==Al2O3+3H2O(加热)20、偏铝酸钠溶液与盐酸反应:NaAlO2+HCl+H2O==NaCl+Al(OH)3↓AlO2-+H++H2O==Al(OH)3↓21、偏铝酸钠溶液中通入二氧化碳:二氧化碳少量:2NaAlO2+CO2+3H2O==Na2CO3+2Al(OH)3↓2AlO2-+CO2+3H2O==CO32-+2Al(OH)3↓二氧化碳过量:NaAlO2+CO2+2H2O==Al(OH)3↓+NaHCO3AlO2-+CO2+2H2O==Al(OH)3↓+HCO3-22、氧化亚铁与盐酸反应:FeO+2HCl==FeCl2+H2O FeO+2H+==Fe2++H2O23、氧化铁与盐酸反应:Fe2O3+6HCl==2FeCl3+3H2O Fe2O3+6H+==2Fe3++3H2O24、四氧化三铁与盐酸反应:Fe3O4+8HCl==FeCl2+2FeCl3+4H2OFe3O4+8H+==Fe2++2Fe3++4H2O25、硫酸亚铁与氢氧化钠反应:FeSO4+2NaOH==Fe(OH)2↓+Na2SO4 Fe2++2OH-==Fe(OH)2↓26、实验室制取氢氧化铁(红褐色):FeCl3+3NaOH==Fe(OH)3↓+3NaClFe3++3OH-==Fe(OH)3↓27、氢氧化亚铁被氧化(现象:灰白色沉淀迅速变成灰绿色最终变成红褐色)4Fe(OH)2+O2+2H2O==Fe(OH)328、Fe3+的检验(生成血红色物质切记不是沉淀):Fe3++3SCN-==Fe(SCN)329、铁离子与铜反应(常用于腐蚀印刷电路板):2FeCl3+Cu==2FeCl2+CuCl22Fe3++Cu==2Fe2++Cu2+30、铁离子与锌反应:锌少量:2FeCl3+Zn==2FeCl2+ZnCl22Fe3++Zn==2Fe2++Zn2+锌过量:2FeCl3+3Zn==2Fe+3ZnCl22Fe3++3Zn==2Fe+3Zn2+31、氯化铁溶液里加铁粉:2FeCl3+Fe==3FeCl2 2Fe3++Fe==3Fe2+32、氢氧化铁加热分解:2Fe(OH)3==Fe2O3+3H2O(加热)33、用氢氟酸雕刻玻璃:SiO2+4HF==SiF4↑+2H2O34、二氧化硅与氢氧化钠反应(因此保存氢氧化钠溶液应用橡胶塞)SiO2+2NaOH==Na2SiO3+2H2O35、制取硅酸(硅酸钠水溶液成为水玻璃)Na2SiO3+2HCl==H2SiO3(↓)+2NaCl(沉淀符号可加可不加,以学校为准)SiO32-+2H+==H2SiO3(↓)36、水玻璃中通入二氧化碳(可以验证碳酸酸性比硅酸强)Na2SiO3+H2O+CO2==Na2CO3+H2SiO3(↓)SiO32-+H2O+CO2==CO32-+H2SiO3(↓)注意:若二氧化碳过量则生成碳酸氢盐37、实验室制取氯气:MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O(加热)38、磷与氯气反应:氯气少量:2P+3Cl2==2PCl3 氯气足量:2P+5Cl2==2PCl5(PCl3为液态,PCl5为固态)39、氯气与水反应:Cl2+H2O==HClO+HCl(可逆号)40、氯气光照分解:2HClO==2HCl+O2↑(光照)41、氯气通入氢氧化钠溶液中(生成物为84消毒液主要成分)Cl2+2NaOH==NaClO+NaCl+H2O Cl2+2OH-==ClO-+Cl--+H2O42、将氯气通入石灰乳中制漂白粉(漂白粉主要成分是氯化钙和次氯酸钙,有效成分是次氯酸钙)Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O43、漂白粉工作原理:Ca(ClO)2+2HCl==2HClO+CaCl2 ClO-+H+==HClO44、漂白粉再空气中变质(可证明碳酸酸性强于次氯酸)Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO Ca2++2ClO-+CO2+H2O==CaCO3↓+2HClO 注意:若二氧化碳过量则生成碳酸氢盐45、高锰酸钾与浓盐酸反应:2KMnO4+16HCl(浓)==2KCl+2MnCl2+5Cl2↑+8H2O46、卤素之间的置换反应:Cl2+2Br-==Br2+2Cl- Cl2+2I-==I2+2Cl- Br2+2I-==I2+2Br-47、硫与氧气点燃:S+O2==SO2(点燃)48、二氧化硫溶于水:SO2+H2O==H2SO3(可逆号)49、用氢氧化钠吸收二氧化硫:SO2+2NaOH==Na2SO3+H2O SO2+2OH-==SO32-+H2O50、向亚硫酸钠溶液中继续通入二氧化硫:Na2SO3+SO2+H2O==2NaHSO3SO32-+SO2+H2O==2HSO3-51、二氧化硫与氧化钙反应:SO2+CaO==CaSO3(高温)52、氯水中通入二氧化硫,漂白性消失:Cl2+2H2O+SO2==H2SO4+2HClCl2+2H2O+SO2==4H++SO42-+2Cl-52、实验室制取二氧化硫:Na2SO3+H2SO4(浓)==Na2SO4+SO2↑+H2O53、工业制硫酸:2SO2+O2==2SO3(可逆号)(催化剂、加热)SO3+H2O==H2SO454、三氧化硫与氧化钙反应:SO3+CaO==CaSO455、用熟石灰吸收三氧化硫:SO3+Ca(OH)2==CaSO4+H2O56、向硫化氢的水溶液(俗称氢硫酸)中通入二氧化硫:2H2S+SO2==3S↓+2H2O57、硫化氢与氧气反应:氧气少量:2H2S+O2==2S↓+2H2O(点燃)氧气足量:2H2S+3O2==2H2O+2SO2(点燃)58、硫于氢氧化钠反应:3S+6NaOH==2Na2S+Na2SO3+3H2O 3S+6OH-==2S2-+SO32-+3H2O59、二氧化硫和过氧化钠反应:O2+Na2O2==Na2SO460、大气固氮(NO是无色无味气体,有毒):N2+O2==2NO(高温或放电)61、一氧化氮被氧化(NO2是红棕色有刺激性气味有毒气体):2NO+O2==2NO262、二氧化氮溶于水:3NO2+H2O==2HNO3+NO63、一氧化氮与氧气4:3溶于水:4NO+3O2+2H2O==4HNO364、二氧化氮与氧气4:1溶于水:4NO2+O2+2H2O==4HNO365、工业制氨气:N2+3H2==2NH3(可逆号)(高温高压催化剂)66、氨气溶于水:NH3+H2O==NH3·H2O(可逆号)67、氨气和氯化氢反应(产生白烟):NH3+HCl==NH4Cl68、碳酸氢铵(俗称碳铵)加热分解:NH4HCO3==NH3↑+H2O↑+CO2↑(加热)69、硝酸铵与氢氧化钠混合加热:NH4NO3+NaOH==NaNO3+H2O+NH3↑(加热)70、实验室制取氨气:2NH4Cl+Ca(OH)2==CaCl2+2H2O+2NH3↑(加热)71、氨的催化氧化:4NH3+5O2==4NO+6H2O(催化剂、加热)72、浓硫酸和铜反应:Cu+2H2SO4(浓)==CuSO4+SO2↑+2H2O(加热)73、铁与浓硫酸加热:2Fe+6H2SO4(浓)==Fe2(SO4)3+3SO2↑+6H2O(加热)74、碳与浓硫酸反应:C+2H2SO4(浓)==CO2↑+2H2O+SO2↑(加热)75、硫于浓硫酸反应:S+2H2SO4(浓)==3SO2↑+2H2O(加热)76、硫化氢与浓硫酸反应:H2S+H2SO4(浓)==2H2O+SO2+S↓(加热)77、铜与浓硝酸反应:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2OCu+4H++2NO3-==Cu2++2NO2↑+2H2O78、铜与稀硝酸反应:3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2OCu+8H++2NO3-==3Cu2++2NO↑+4H2O79、浓硝酸与碳反应:C+4HNO3==CO2↑+4NO2↑+2H2O(加热)80、硝酸见光分解:4HNO3==4NO2↑+O2↑+2H2O(光照或加热)81、实验室制取氯化氢:NaCl+H2SO4(浓)==NaHSO4+HCl↑(加热)82、制取水煤气:C+H2O(g)==CO+H2(高温)83、铝热反应:Fe2O3+2Al==Al2O3+2Fe(高温)84、向氯化亚铁中滴入氯水:2FeCl2+Cl2==2FeCl3 2Fe2++Cl2==Fe3+第二部分电化学方程式1、铜锌原电池(硫酸做电解液)负极:Zn-2e-==Zn2+ 正极:2H++2e-==H2↑总反应:Zn+2H+==Zn2++H2↑2、铅蓄电池(放电)负极:Pb+SO42--2e-==PbSO4 正极:PbO+4H++SO42-+2e-==PbSO4+2H2O总反应:PbO2+Pb+2H2SO4==2PbSO4+2H2O3、铅蓄电池(充电)阴极:PbSO4+2e-==Pb+SO42- 阳极:PbSO4+2H2O-2e-==PbO+4H++SO42-总反应:2PbSO4+2H2O==PbO2+Pb+2H2SO44、氢氧燃料电池(酸性电解质溶液)负极:H2-2e-==2H+ 正极:O2+4e-+4H+==2H2O 总反应:2H2+O2==2H2O5、氢氧燃料电池(碱性电解质溶液)负极:H2-2e-+2OH-==2H2O 正极:O2+4e-+2H2O==4OH- 总反应:2H2+O2==2H2O 6、甲醇燃料电池(碱性电解质溶液)负极:CH3OH -6e-+8OH- = CO32-+ 6H2O 正极:3O2+12e- + 6H2O=12OH-总反应式:2CH3OH + 3O2 +4KOH==2K2CO3 + 6H2O7、甲醇燃料电池(酸性电解质溶液)负极:2CH3OH-12e-+2H2O = 12H++ 2CO2 正极:3O2+12e-+12H+ = 6H2O总反应:2CH3OH + 3O2 === 2CO2 + 4H2O8、电解氯化铜溶液阴极:Cu2++2e-==Cu 阳极:2Cl--2e-==Cl2↑总反应:CuCl2== Cu+Cl2↑(电解)9、电解氯化钠溶液(氯碱工业、工业制氯气)阴极:2H++2e-==H2↑阳极:2Cl--2e-==Cl2↑总反应:2NaCl+2H2O==2NaOH+H2↑+Cl2↑(电解)10、电解硫酸铜溶液阴极:Cu2++2e-==Cu 阳极:4OH--4e-==O2↑+2H2O总反应:2CuSO4+2H2O==2Cu+O2↑+2H2SO4(电解)11、电解氢氧化钠溶液阴极:2H++2e-==H2↑阳极:4OH--4e-==O2↑+2H2O总反应:2H2O==2H2↑+O2↑(电解)12、向铜上镀银(镀件做阴极,镀层金属做阳极,镀层金属盐溶液做电解质溶液)阴极:Ag++e-==Ag 阳极:Ag-e-==Ag+13、精炼铜反应(粗铜做阳极,精铜做阴极)阴极:Cu2++2e-==Cu 阳极:Cu-2e-==Cu2+14、析氢腐蚀负极:Fe-2e-==Fe2+ 正极:2H++2e-==H2↑总反应:Fe+2H+==Fe2++H2↑15、吸氧腐蚀负极:2Fe-4e-==2Fe2+ 正极:2H2O+O2+4e-==4OH-总反应:2Fe+O2+2H2O==2Fe(OH)2 4Fe(OH)2+O2+2H2O==4Fe(OH)3第三部分有机方程式(必修部分)1. 甲烷与氯气:CH4+Cl2CH3Cl+HCl CH3Cl+Cl2CH2Cl2+HClCH2Cl2+Cl2CHCl3+HCl CHCl3+Cl2CCl4+HCl2. 乙烯实验室制法(浓硫酸作催化剂,脱水剂)CH3CH2OH H2O + CH2=CH2 ↑3. 乙烯通入溴水中CH2=CH2 + Br2CH2BrCH2Br4.乙烯和HBr 的反应 CH 2=CH 2 + HBr 催化剂CH 3CH 2Br5. 乙烯水化制乙醇 CH 2=CH 2 + H 2O CH 3CH 2OH6. 制取聚乙烯、聚丙烯n CH 2=CH 2 催化剂n CH 3–CH=CH 2催化剂CH 3 7. 乙炔的制取 CaC 2 + 2H 2O Ca(OH)2 + ↑8. 由乙炔制聚氯乙烯+ HCl H 2C=CHCl n H 2C=CHCl催化剂9. 苯与液溴反应(需溴化铁作催化剂)+ Br 2 +HBr 10. 苯的硝化反应+ HNO 3 + H 2O11. 苯与氢气加成生成环己烷+ 3H 2 催化剂△12. 甲苯发生硝化反应+3HONO 2 浓硫酸 △ + 3H 2O13. 溴乙烷水解 CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr14. 溴乙烷消去反应 CH 3CH 2Br +NaOH CH 2=CH 2 + NaBr + H 2O15. 乙醇与钠反应 2CH 3CH 2OH + 2Na2CH 3CH 2ONa + H 2↑ 16. 乙醇催化氧化 2CH 3CH 2OH + O 2 2CH 3CHO + 2H 2OCH 2-CH 2 n Br FeBr 3浓H 2SO 4 55-60℃ —NO 2 CH 3H 2O Cu △催化剂 △ HC ≡CH HC ≡CH CH -CH 2 n Cl CH -CH 2 n醇 △CH 3NO 2NO 2O 2N17.乙醇脱水(分子间、分子内)CH 3CH 2OH H 2O + CH 2=CH 2 ↑2CH 3CH 2OH H 2O + CH 3CH 2O CH 2 CH 318. 苯酚与氢氧化钠溶液反应+ NaOH+ H 2O19. 苯酚钠溶液中通入二氧化碳+ CO 2 + H 2O + NaHCO 320. 苯酚的定性检验定量测定方法:+ 3Br 2 ↓ + 3HBr21. 丙醛制1-丙醇 CH 3CH 2CHO + H 2 催化剂△ CH 3CH 2CH 2OH22. 乙醛制乙酸 2CH 3CHO + O 2 催化剂△ 2CH 3COOH23. 银镜反应:CH 3CHO + 2Ag(NH 3)2OHH 2O + 2Ag↓+ 3NH 3 + CH 3COONH 4 甲醛的银镜反应 HCHO + 4Ag(NH 3)2OH 2H 2O + 4Ag↓+6NH 3 +(NH 4)2CO 324. 醛与新制氢氧化铜悬浊液: CH 3CHO + 2Cu(OH)2Cu 2O ↓+ 2H 2O + CH 3COOH 25. 酯化反应:CH 3COOH + CH 3CH 2OHCH 3COOC 2H 5 + H 2O26. 酯水解:27. 蔗糖水解: C 12H 22O 11(蔗糖)+H 2O→C 6H 12O 6(葡萄糖)+C 6H 12O 6(果糖)(稀硫酸、加热)28. 麦芽糖水解:C 12H 22O 11(麦芽糖)+H 2O→2C 6H 12O 6(葡萄糖)(稀硫酸、加热)29. 淀粉水解:(C 6H 10O 5)n (淀粉)+nH 2O→nC 6H 12O 6(葡萄糖)(稀硫酸、加热)第四部分 电离水解方程式1、醋酸的电离: CH 3COOH==CH 3COO -+H +(可逆号)2、碳酸的电离: H 2CO 3==H ++HCO 3-(可逆号) HCO 3-== H ++CO 32-(可逆号)3、氢氧化铁的电离:Fe(OH)3==Fe 3++3OH -(可逆号)4、碳酸根水解:CO 32-+H 2O==HCO 3-+OH - HCO 3-+H 2O==H 2CO 3+H 2O5、铁离子的水解: Fe 3++3H 2O==Fe(OH)3+3H + 浓硫酸△ —OH —ONa —ONa —OH 浓H 2SO 4 140℃OHOH Br Br Br6、碳酸根与铁离子双水解:3CO32-+2Fe3++3H2O==2Fe(OH)3↓+3CO2↑7、碳酸氢根与铁离子双水解:3HCO3-+Fe3+==Fe(OH)3↓+3CO2↑8、偏铝酸根与铝离子双水解:Al3++3AlO2-+6H2O==4Al(OH)3↓9、水的电离:H2O==H++OH-(可逆号)第五部分物质关系转化图。
(完整版)高考必备高中化学方程式大全(分类)

6HCl+KClO3==KCl+3Cl 2↑ +3H2 O
6H++5Cl –+ClO3–=3Cl 2↑ +3H2O
14HCl+K2Cr2O7===2KCl+2CrCl 3+3Cl 2↑ +7H2O 14H++6Cl – +Cr2O72–=2Cr3++5Cl 2↑ +7H2O
2H2O+2F2 ===4HF+O2
4Na+TiCl 4
4NaCl+Ti Mg+Cl2
MgCl2 Mg+Br2 MgBr2
2Mg+O2 2MgO
Mg+S MgS
2Cu+S Cu2S (Cu 2S 只能由单质制备 ) Mg+2H2O Mg(OH)2 +H2↑
2Mg+TiCl 4
Ti+2MgCl 2
Mg+2RbCl
MgCl2+2Rb
2Mg+CO2 2MgO+C
2Al+2OH–+2H2O=2AlO2– +3H2↑
2Fe+3Br2===2FeBr3 3Fe+2O2
Fe3O4
2Fe+O2
2FeO ( 炼钢过程 )
Fe+I 2 FeI 2
Fe+S FeS (FeS 既能由单质制备,又能由离子制备 )
3Fe+4H2O(g)
Fe3O4+4H2↑
Fe+2HCl===FeCl2+H2↑
二.金属单质 ( Na,Mg,Al,Fe,Cu )的还原性
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考总复习之高中化学方程式总结 化学 第一册第一章 卤素第一节 氯气1、NaCl 2Cl Na 22−−→−+点燃2、22CuCl Cl Cu −−→−+点燃 3、32FeCl 2Cl 3Fe 2−−→−+点燃 4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃6、523PCl Cl PCl →+7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()( 9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)(10、O H NaCl NaClO Cl NaOH 222++→+ 11、↑++−→−+∆2222Cl O H 2MnCl MnO HCl 4 12、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓) 13、2O HCl 2HClO 2+−−→−见光第二节 氯化氢 14、↑+→+HCl NaHSO SO H NaCl 442(浓) 15、↑+−→−+∆HCl SO Na NaCl NaHSO 424 16、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓)(14、15结合) 17、33HNO AgCl AgNO HCl +↓→+18、33NaNO AgCl AgNO NaCl +↓→+19、33KNO AgCl AgNO KCl +↓→+20、↑++→+2223CO O H CaCl CaCO HCl 2第三节 氧化还原反应21、O H Cu H CuO 22+−→−+∆22、O H 2NO 4CO HNO 4C 2223+↑+↑→+ 23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++−→−+∆)((极稀)24、4243324SO H 15PO H 6P Cu 5O H 24CuSO 15P 11++→++25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓) 26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++−→−+∆)((极稀) 27、O H 31SO K SO Fe 9SO Cr SO H 31O Fe 6O Cr K 2423423424243722+++→++)()(28、↑+↑+→++2223CO 3N S K S C 3KNO 2第四节 卤族元素29、HF 2F H 22→+30、HBr 2Br H 22→+31、HI 2I H 22→+32、22Br NaCl 2Cl NaBr 2+→+33、22I KCl 2Cl KI 2+→+34、22I KBr 2Br KI 2+→+35、33NaNO AgBr AgNO NaBr +↓→+36、33KNO AgI AgNO KI +↓→+37、2Br Ag 2AgBr 2+−−→−光照第二章 摩尔 反应热第一节 摩尔38、22CO O C →+39、↑+→+22H MgCl HCl 2Mg第二节 气体摩尔体积40、22H ZnCl HCl 2Zn +→+第三节 物质的量浓度41、O H 2SO Na SO H NaOH 224242+→+第四节 反应热42、kJ 5.393CO O C 22+−−→−+(气)(气)(固)点燃43、kJ 6.483O H 2O H 2222+→+(气)(气)(气) 44、kJ 6.571O H 2O H 2222+→+(液)(气)(气) 45、kJ 3.131H CO O H C 22-+−→−+∆(气)(气)(气)(固) 第三章 硫 硫酸第一节 硫46、S Cu S Cu 22−→−+∆47、FeS S Fe −→−+∆ 48、S H H S 22−→−+∆49、2CS C S −−→−+高温 50、22SO O S −−→−+点燃 51、O H 3SO K S K 2KOH 6S 32422++−→−+∆第二节 硫的氢化物和氧化物 52、↓+−→−∆S H S H 22 53、2222SO 2O H 2(O 3S H 2+−−→−+点燃足)54、↓+−−→−+S 2O H 2(O S H 2222点燃不足) 55、↓+−−→−+S 3O H 2SO S H 2222点燃 56、HBr 2S Br S H 22+↓→+57、↑+→+S H FeCl HCl 2FeS 2258、4224SO H CuS S H CuSO +↓→+59、HAc 2PbS S H PbAc 22+↓→+60、O H NaHS NaOH S H 22+→+61、O H S Na NaOH NaHS 22+→+62、O H 2S Na NaOH 2S H 222+→+(60、61结合) 63、HCl 2FeCl 2S FeCl 2S H 232++↓→+64、↑+→+S H FeSO FeS SO H 2442(稀) 65、3222SO H O H SO ⇔+66、3OV 22SO 2O SO 252∆−−→←+ 67、4223SO H O H SO →+68、↑++→+22424232SO O H SO Na SO H SO Na 69、O H SO Na NaOH 2SO 2322+→+70、32CaSO CaO SO →+71、O H CaSO OH Ca 2SO 2322+↓→+)(72、23232HSO Ca O H CaSO SO )(→++73、O H 2S 3S H 2SO 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++75、42222SO H HBr 2O H 2Br SO +→++76、42424422SO H 2SO K MnSO KMnO 2O H 2SO 5++→++第三节 硫酸的工业制法77、↑+−−→−+23222SO 8O Fe 2O 11FeS 4高温78、3OV 22SO 2O SO 252∆−−→←+79、4232SO H SO O H →+第四节 硫酸 硫酸盐80、O H 2SO 2CO SO H 2C 22242+↑+↑−→−+∆(浓) 81、O H 2SO 3SO H 2S 2242+↑−→−+∆(浓) 82、O H 2SO PO H SO H P 224342+↑+−→−+∆(浓) 83、O H 2SO S SO H S H 22422++−→−+∆(浓) 84、O H 2SO CuSO SO H 2Cu 22442+↑+−→−+∆(浓) 85、HCl 2BaSO SO H BaCl 4422+↓→+86、NaCl 2BaSO SO Na BaCl 4422+↓→+87、NaCl 2BaCO CO Na BaCl 3322+↓→+88、↑++→+2223CO O H BaCl HCl 2BaCO 89、↑++→+222333CO O H NO Ba HNO 2BaCO )(90、↑++→+2223232CO O H S Na SO H CO Na91、42232SO H 2O SO H 2→+92、42232SO Na 2O SO Na 2→+93、423CaSO 2O CaSO 2→+94、O H 6SO 3SO Fe SO H 6Fe 22234242+↑+−→−+∆)((浓) 95、O H SO Na SO Br SO H 2NaBr 22422242++↑+−→−+∆(浓) 96、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓) 97、O H 11C 12O H C 2SOH 11221142+−−−→−浓 第四章 碱金属第一节 钠98、O Na 2O Na 422→+99、222O Na O Na 2→+2101、S Na S Na 22−−→−+研磨 102、↑+→+22H NaOH 2O H 2Na 2103、↑++→++242242H SO Na OH Cu CuSO O H 2Na 2)(第二节 钠的氧化物104、NaOH 2O H O Na 22→+105、↑+→+2222O NaOH 4O H 2O Na 2106、3222CO Na CO O Na →+107、232222O CO Na 2CO 2O Na 2+→+108、O H NaCl 2HCl 2O Na 22+→+109、↑++→+2222O O H 2NaCl 4HCl 4O Na110、O H CO NaCl 2HCl 2CO Na 2232+↑+→+ 111、O H CO NaCl HCl NaHCO 223+↑+→+ 112、O H CO CO Na NaHCO 222323+↑+−→−∆113、O H CO Na NaOH NaHCO 2323+−→−+∆ 114、O H 2CO Na CaCO OH Ca NaHCO 2232323++↓→+(少量))( 115、O H NaOH CaCO OH Ca NaHCO 2323++↓→+(足量))( 116、NaCl 2BaCO BaCl CO Na 3232+↓→+117、NaCl 2CaCO CaCl CO Na 3232+↓→+ 118、O H 2CO 2CaCl HCl 2HCO Ca 22223+↑+→+)(119、O H 2CO Na CaCO NaOH 2HCO Ca 232323++↓→+)(120、O H SO NaCl HCl NaHSO 223+↑+→+第三节 碱金属元素22122、22KO O K −−→−+点燃 123、MX 2X M 22→+(M 表示氧族元素,X 代表卤族元素) 124、MH 2H M 22→+125、↑+→+22H MOH 2O H 2M 2 第五章 物质结构 元素周期律本章内容、性质特殊,所有化学反应方程式均融在其他章节中。
第六章 氮和磷第二节 氮气126、232N Mg N Mg 3−−→−+点燃127、322NH 2H N 催化剂高温高压−−−→←+ 128、NO 2O N 22−−→−+放电129、22NO 2O NO 2→+130、422O N NO 2⇔131、NO HNO 2O H NO 3322+→+132、322HNO 4O H 2O 3NO 4→++133、3222HNO 4O H 2O NO 4→++第三节 氨 铵盐134、Cl NH HCl NH 43→+135、3433NO NH HNO NH →+ 136、O H 6NO 4O 5NH 4223+−−→−+∆催化剂137、O H N O NH 2223+−−→−+点燃(纯) 138、O H 2CaCl NH 2OH Ca Cl NH 22324++↑−→−+∆)( 139、↑+↑−→−∆HCl NH Cl NH 34(固) 140、Cl NH HCl NH 43→+141、↑++↑−→−∆22334CO O H NH HCO NH 142、O H 2SO Na NH 2NaOH 2SO NH 2423424++↑−→−+∆)( 第四节 硝酸143、O H 2O NO 4HNO 42223++↑−−→−光或热 144、O H 2NO 2NO Cu HNO 4Cu 22233+↑+→+)((浓) 145、O H 4NO 2NO Cu 3HNO 8Cu 32233+↑+→+)((稀)145、O H 2NO 4CO HNO 4C 2223+↑+↑→+146、↑+−→−+∆34423HNO NaHSO SO H NaNO (浓) 147、kJ 907O H 6NO 4O 5(NH 42Rh Pt 23++−−→−+-(气)(气)(气)气)高温高压 148、kJ 113NO 2O NO 222+→+(气)(气)(气) 149、kJ 136NO HNO 2O H NO 3322++→+(气)(液)(液)(气) 150、O H NaNO 2NaOH 2NO NO 222+→++第六节 磷 磷酸151、32PCl 2Cl 3P 2−−→−+点燃152、52PCl 2Cl 5P 2−−→−+点燃153、3252HPO O H O P −−→−+冷水154、43252PO H 2O H 3O P −−→−+热水 155、↓+−→−+∆44342243CaSO 3PO H 2SO H 3PO Ca (浓))( 156、↓+−→−+∆424242243CaSO 2PO H Ca SO H 2PO Ca )((浓))( 157、24243243PO H Ca 3PO H 4PO Ca )((浓))(→+化学 第二册第一章 硅第二节 硅及其重要的化合物158、22SiO O Si −→−+∆159、↑+→++2322H 2SiO Na O H NaOH 2Si160、↑+−−→−+CO 2Si C 2SiO 2高温161、32CaSiO CaO SiO −−→−+高温 162、O H SiO Na NaOH 2SiO 2322+→+ 163、O H 2SiF HF 4SiO 242+→+ 164、NaCl 2SiO H O H HCl 2SiO Na 44232+↓→++ 165、O H SiO H SiO H 23244+−−−→−干燥空气 166、32322232CO Na SiO H O H CO SiO Na +↓→++第三节 硅酸盐工业简述167、↑+−−→−+232232CO SiO Na SiO CO Na 高温 168、↑+−−→−+2323CO CaSiO SiO CaCO 高温 第二章 镁 铝第二节 镁和铝的性质169、MgO 2O Mg 22−−→−+点燃170、322O Al 2O 3Al 4−→−+∆171、↑+→++222H 3NaAlO 2O H 2NaOH 2Al 2 172、22MgCl Cl Mg −−→−+点燃173、32AlCl 2Cl 3Al 2−−→−+点燃174、232N Mg N Mg 3−−→−+点燃175、32S Al S 3Al 2−−→−+点燃176、Cu MgSO CuSO Mg 44+→+ 177、Hg 3NO Al 2NO Hg 3Al 23323+→+)()(178、↑+−−→−+222H OH Mg O H 2Mg )(沸水179、↑+−−→−+∆232H 3OH Al 2O H 6Al 2)(沸水180、C MgO 2CO Mg 22+−−→−+点燃181、Fe 2O Al O Fe Al 23232+−−→−+高温 182、V 6O Al 5O V 3Al 103252+−−→−+高温 183、W O Al WO Al 2323+−−→−+高温 184、Cr 2O Al O Cr Al 23232+−−→−+高温第三节 镁和铝的重要化合物185、↑+−−→−23CO MgO MgCO 煅烧 186、O H MgO OH Mg 22+−→−∆)( 187、22OH Mg O H MgO )(缓慢−−→−+188、32MgSiO SiO MgO −−→−+高温 189、↓+→+2222OH Mg CaCl OH Ca MgCl )()( 190、↑+−−→−22Cl Mg MgCl 熔融电解191、↑+−−→−232O 3Al 4O Al 电解冰晶石192、O H 3AlCl 2HCl 6O Al 2332+→+193、O H 3SO Al SO H 3O Al 23424232+→+)(194、O H NaAlO 2NaOH 2O Al 2232+→+195、424323342SO NH 3OH Al 2O H NH 6SO Al )()()(+↓→⋅+196、O H 3O Al OH Al 22323+−→−∆)( 197、O H 3AlCl HCl 3OH Al 233+→+)( 198、O H 6SO Al SO H 3OH Al 22342423+→+)()(199、O H 2NaAlO NaOH OH Al 223+→+)(第四节 硬水及其软化200、23223HCO Ca O H CO CaCO )(→++ 201、O H CO CaCO HCO Ca 22323+↑+↓−→−∆)( 202、O H CO MgCO HCO Mg 22323+↑+↓−→−∆)( 203、O H 2CaCO 2OH Ca HCO Ca 23223+↓→+)()(204、O H 2OH Mg CaCO 2OH Ca 2HCO Mg 223223+↓+↓→+)()()(205、4224CaSO OH Mg OH Ca MgSO +↓→+)()( 206、423324SO Na CaCO CO Na CaSO +↓→+第三章 铁第一节 铁和铁的化合物 207、432O Fe O 2Fe 3−−→−+点燃208、FeS S Fe −→−+∆209、32FeCl 2Cl 3Fe 2−→−+∆210、2432H 4O Fe O H 4Fe 3+−−→−+高温(气) 211、↑+→+22H FeCl HCl 2Fe212、Cu SO Fe SO Cu Fe 2424+→+)()(213、O H FeCl HCl 2FeO 22+→+ 214、O H 3FeCl 2HCl 6O Fe 2332+→+215、4224SO Na OH Fe NaOH 2FeSO +→+)( 216、NaCl 3OH Fe NaOH 3FeCl 33+↓→+)( 217、3222OH Fe 4O H 2O OH Fe 4)()(→++218、O H FeO OH Fe 22+−→−∆)( 219、O H 3O Fe OH Fe 22323+−→−∆)( 220、O H 2FeCl HCl 2OH Fe 222+→+)(221、O H 3FeCl HCl 3OH Fe 233+→+)( 222、O H Fe H FeO 22+→+ 223、O H 3Fe 2H 3O Fe 2232+→+ 224、O H 4Fe 3H 4O Fe 2243+→+225、O H 2NO NO Fe HNO 4Fe 2333+↑+→+)((稀)第二节 炼铁和炼钢226、232CO 3Fe 2CO 3O Fe +−−→−+高温 227、↑+−−→−23CO CaO CaCO 高温228、FeO 2O Fe 22−−→−+高温229、2SiO Fe 2FeO 2Si +−−→−+高温230、MnO Fe FeO Mn +−−→−+高温231、CO Fe FeO C +−−→−+高温232、32O Al Fe 3FeO 3Al 2+−−→−+高温233、243PO Ca Fe 5CaO 3FeO 5P 2)(高温+−−→−++第四章 烃第二节 甲烷234、↑+−−→−+∆432CaO3CH CO Na NaOH COONa CH 235、O H 2CO O 2CH 2224+−−→−+点燃236、HCl Cl CH Cl CH 324+−→−+光237、HCl Cl CH Cl Cl CH 2223+−→−+光 238、HCl CHCl Cl Cl CH 3222+−→−+光 239、HCl CCl Cl CHCl 423+−→−+光240、24H 2C CH +−−→−高温第四节 乙烯241、O H CH CH OH CH CH 222C17023+↑=−−→−--。
