烯烃双烯烃配位聚合进展(黄葆同等著)思维导图
第三章烯烃炔烃和二烯烃优秀课件

或Pd- BaSO4/喹啉;] 将得到顺式烯烃。
C 2 H 5 CC 2 H 5 CP -2 催 化 剂C 2 H 5 CCC 2 H 5
H
H
采用Na(或Li)/液NH3还原炔烃将得到反式烯烃。
N a ,液 N 3H C 2 H 5
H
C 2 H 5 CC2 ) ( 3 C C 3H H -7 8 。 C
C 2C H 2 H H O
δ C + 2C δ H - 2 H δ + B δ - B r r
Br
CH2
CH2
+
Br2
NaCl 水溶液
CH2 CH2 Br Cl CH2 CH2 Br OH
实验事实 二 :
CH2 CH2 Br
CH2 CH2 + NaCl
不反应
实验事实告诉我们:该加成反应一定是分步进行的。 否则,不会有1-氯-2-溴乙烷和2-溴乙醇生成。
kJ.mol-1
112.4
kJ.mol-1
从能图可看出:
(1) 烯烃顺反异构体的稳定性是:反式 > 顺式(二者
能差为 4.2kJ.mol-1)。
Vander Waals斥力大
CH3
CH3
CH3
CH3
(2) 双键碳原子连有烷基数目↑,氢化热↓,稳定性↑。
因此,烯烃的稳定性次序为:
R R R
R
C C C CH C C R 2 H RC CH H RC R C 2C H H 2C H 2 H
C3 H
H
CC
H
C3 H
μ = 0
b.p 顺式(3.5℃)> 反式(0.9℃) 顺式异构体具有较弱的极性,分子间偶极-偶极作用力 。
第03章烯烃ppt课件

(4) 其它命名原那么同烷烃, 如:
●烯基:烯烃上去掉一个氢原子后剩下的基团。
●几个重要的烯基: CH2 CH
CH3CH CH CH2 CH CH2
乙烯基 1-丙烯基 2-丙烯基(烯丙基)
H3C C
H3C CH Cl
CH2 C CH3
CH2 C10H3 C
CH2 Cl
1-甲基乙烯基(异丙烯基)
普通不用顺反命名法
—当多烯烃主链的编号有两种能够时,规定编号由 Z 型双键一端起始。 例如:
3. 顺、反异构体的命名与〔Z〕、〔E〕构型的命名区别:
●Z/E命名法为IUPAC系统命名(适用于一切构造) ●顺、反异构体的命名指的是一样原子或基团在双键平面同一侧时 为“顺〞,在异侧时为“反〞。 ● Z、E构型指的是原子序数大的原子或基团在双键平面同一侧时 为"Z",在异侧时为"E"。
α C3H C H C2H+
XX
O NB( r 简 称 N B S ) h ν α C2H C H C2H
O
Br
2 α氢原子的氧化 —烯烃的α氢原子易被氧化,在烯烃氧化的讨论中已提到丙烯在一定条 件下可被空气催化氧化为丙烯醛。但在不同条件下,丙烯还可被氧化为 丙烯酸。
3 氨氧化反响 —丙烯在氨存在下的氧化反响叫做氨化氧化反响,简称氨氧化反响。 由此可以得到丙烯腈。 —丙烯中的甲基氧化为氰基(-CN)
a
aa
a
CC
b
b
CC
b
d
a
aa
d
CC
a
b
bCCd
有 顺 反 异 构 的 类 型
无 顺 反 异 构 的 类 型
●烯烃具有双键,其异构景象较烷烃复杂,主要包括: —碳干异构; —双键位置不同引起的官能团位置异构〔position isomerism〕; —双键不能自在旋转产生的立体异构景象--顺反异构。如:
第三章 烯烃炔烃二烯烃PPT课件

5、与H2SO4反应
H—O-SO2-OH ,一种不对称试剂(P37)
a.符合马氏规则:
b.应用:加成产物水解后,得到醇
二、氧化反应
1、与KMnO4 (P39) a.现象:KMnO4紫红色褪去 b.产物:与条件有关
(1)冷中(碱)性溶液时,得邻二醇
1、与KMnO4反应
1 - 丁 烯
2 - 丁 烯
三、顺反异构(P31-32)
顺-2-丁烯(b.p. 3.7℃) 反-2-丁烯 (b.p. 0.9℃)
Z、E命名法(次序规则法)
一个化合物的构型是Z型还是E型,要由“次序规则” 来决定 。
Z、E命名法的具体内容是: 分别比较两个双键碳原子上的取代基团按“次序规
则”排出的先后顺序,如果两个双键碳上排列顺序在前 的基团位于双键的同侧,则为Z构型,反之为E构型。
到含氢较多的碳原子上。
3、与HX(X=Br、Cl)
b.亲电加成历程(P35-36)
Ⅰ为2o碳正离子,Ⅱ为1o碳正离子,类似于自由基, 取代基越多越稳定,故Ⅰ比Ⅱ稳定,因此:
3、与HX(X=Br、Cl)
c.碳正离子的稳定性顺序(P36)
应用:
3o >2o >1o>CH3+
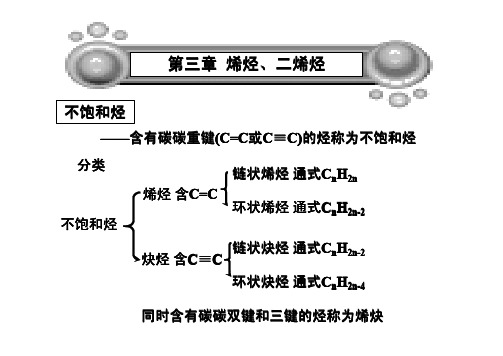
第三章 不饱和烃
第一节 烯烃的含义 第二节 烯烃的命名和异构 第三节 烯烃的化学性质 第四节 自然界的烯烃 第五节 炔烃的含义和命名 第六节 炔烃的化学性质 第七节 二烯烃
[本章作业]
P48:T1、2、 5、6、8(a-d)、 11(a、b、d、 e)、12、13、14、 16、17(a)、19、 20、21(a-d)、 22、23
3、命名时标出烯的位置,以烯结尾。 eg3:
高中化学基础知识网络图完整版(高中化学复习)

高中化学基础知识网络图完整版(高中化学复习)物理性质熔沸点较高很高低硬度硬而脆大小导电性不良绝缘体(半导体)不良传热性不良不良不良延展性不良不良不良溶解性易溶于极性溶剂不溶于任何溶剂相似相溶典型实例NaCl,KBr单质:金刚石、SiC、Si、SiO2单质:H2、O2化合物:冰、干冰.导熔融水溶液第四部分:有机化学PP 2O 5PCl 3PCl 5 HPO 3H 3PO 4Na 3PO 4Ca 3(PO 4)2 Ca (H 2PO 4)2CaHPO 4Si C SiO 2 H 2SiO 3 CaSiO 3 H 4SiO 4 Na 2SiO 3 SiH 4 SiF 4 SiCl 4 CO 2 CO H 2CO 3 Ca(HCO 3) 2 CaCO 3CaC 2 CaOCa(OH)2FeS 2S H 2SNa 2SSO 2Na 2SO 3 FeS SO 3 Na 2SO 4 BaSO 4PbSCuSBaSO 3 H 2SO 3H 2SO 4Mg 3N 2 N 2NONO 2N 2O4NH 4ClNH 3 NaNO 3 HNO 3 Cu(NO 3)2[Ag (NH 3)2]+NH 3·H 2ONO 2 (C 6H 7O 2) NO 2NO 2NO 2 n或H 2 H 2O O 2 CH3COOH CH3CH 2OH KMnO 4HgOKClO 3Na 2O 2H 2SO 4CH 4ZnNH 4Cl NH 3 Cu Ca(OH)2 Fe 3O 4 SO 2 CO 2+H 2OCl 2 HCl CH 3ClCa(ClO)2FeCl 3 CuCl 2PCl 3、PCl 5NaClO HClO C CH 2ClCH 2Cl O 2 FeCl 2CO 2l NaCll CuCl 2 H 2CH 2=CHClHBrNaBrAgBr HINaIAgIBr 2I 2非金属:按照化合价寻找各类物质,主要有氢化物、单质、氧化物、含氧酸、及其盐 有机抓住官能团的性质烃烃的衍生物糖蛋白质:多肽、氨基酸(官能团:—NH 2和—COOH ) 高分子化合物链烃 (脂肪烃) 环烃饱和链烃 烷烃:C n H 2n+2(n ≥1)R —CH 3不饱和链烃烯烃:C n H 2n (n ≥2) R —CH=CH 2二烯烃:C n H 2n-2(n ≥4)R —CH=CH —CH=CH 2 炔烃:C n H 2n-2(n ≥2) R —C ≡CH 环烷烃C n H 2n (n ≥3)芳香烃(苯和苯的同系物)C n H 2n-6(n ≥6) 天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质R卤代烃(官能团:—X ):饱和一卤代烃C n H 2n+1X(n ≥1)R —X醇 (官能团:—OH ):饱和一元醇C n H 2n+1OH(n ≥1)R —OH 醚 C n H 2n+2O (n ≥2)R —O —R 酚(苯酚)(官能团:—OH )C n H 2n-6O (n ≥2) OH 羧酸 (官能团:—COOH ):饱和一元羧酸 C n H 2n+1O 2 (n ≥1)R —COOH醛 (官能团:—CHO )C n H 2n O (n ≥1)R —CHO 酮 (官能团:—CO —)C n H 2n O (n ≥3)R —CO —R ’酯 (官能团:—COO —R ):饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 (n ≥2)R —COOR ’硝基化合物(官能团—NO 2)R —NO 2 胺(官能团—NH 2)R —NH 2单糖:葡萄糖、果糖C 6H 12O 6(互为同分异构) 二糖:蔗糖、麦芽糖C 12H 22O 11(互为同分异构)多糖:淀粉、纤维素(C 6H 12O 6)n (n 值不同)合成高分子合成塑料合成橡胶 合成纤维 有机化合物。
第三章烯烃PPT课件

4-乙基环己烯
环戊烯
1-甲基环己烯
.
3-氯环庚烯
16
顺反异构体的命名
顺反命名法: 系统名称前加一“顺(或cis)”或“反(trans)”字。
顺-2-戊烯 cis-2-pentene
反-2-戊烯 trans-2-pentene
顺反命名法有局限性,即在两个双键碳上所连接的两个基团彼此 应有一个是相同的,彼此无相同基团时,则无法命名其顺反。
这是两种不同的命名法。顺、反异构体 的命名指的是相同原子或基团在双键平面同一 侧时为"顺",在异侧时为"反"。Z、E构型指 的是原子序数大的原子或基团在双键平面同一 侧时为"Z",在异侧时为"E"。
.
19
Cl
H
Br
Cl
反- 1,2-二氯-1-溴乙烯
Trans- 1-bromo-1,2-dichloroethene
几何异构体之间在物理性质和化学性质上都可以 有较大的差别,因而容易分离。
满足条件:每个双键碳上都. 连有不同原子或原子团 9
a
C
b
a
C
b
a
C
b
a
C
d
a
C
b
c
C
d
a
C
a
c
C
d
.
10
己烯雌酚
反式(有生理活性)
顺式 (无)
治疗卵巢功能不全或
垂体功能异常引起的
各种妇科疾病
.
11
三.烯烃的命名
(1)普通命名法
➢补充:苄基和烯丙基碳正离子的相对稳定性:
PhCH2 > 3°> 2°> 1°
第三章烯烃

对于比较简单的烯烃,命名时在系统命名前面加上“顺”(cis-)或“反-”(trans-)即可。
H3C
CH3
H
H
顺-2-丁烯
cis-2-butene
H
CH3
H3C
H
反-2-丁烯
trans-2-butene
对于比较复杂的烯烃,则需要按照“顺序规则”,在系统命 名前加上Z- (同侧,顺)或E- (异侧,反) 来命名。
Hybridized orbital
2px1 2py1 2pz excitation
2s2
Ground state
2px1 2py1 2pz1
2pz1
hybridization
sp2 sp2 sp2
2s1
Excited state
hybridized state
Three hybridized orbital with same energy state formed
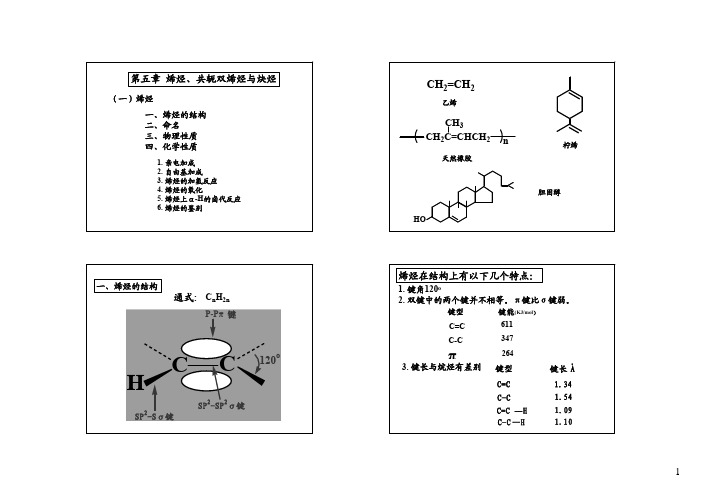
§§33--11 烯烯烃烃的的结结构构
sp2 杂化轨道的形状(与sp3 杂化轨道比较):
sp3 hybridized C
sp2 hybridized C
两者比较: 都是不对称轨道; sp2较sp3更不对称; sp2为平面结构,sp3为四面体结构。
大头更大,小头更小
1
§§33--11 烯烯烃烃的的结结构构
§§33--11 烯烯烃烃的的结结构构
乙烯(ethylene)的结构
分子式:C2H4 H2C CH2 键长与键角(乙烯与丙烯):
比较两者结构的不同
0.108nm H 121.7°
H
117°
H
0.109nm
121.5°
117°
第四章炔烃和二烯烃

2 反应是立体专一的顺式加成反应
(1)参与反应的亲双烯体顺反关系不变 )
H COOH H COOH + HOOC H H COOH COOH H COOH H
+
H
COOH
H COOH COOH H
+
H COOH
(2)当双烯体上有给电子取代基,而亲双烯体上有不饱 )当双烯体上有给电子取代基, 和基团与烯键或炔键共轭时,优先生成内型加成产物。 和基团与烯键或炔键共轭时,优先生成内型加成产物。
取代基对前线轨道能量的影响
吸电子基团,既降低 能量, 的能量。 吸电子基团,既降低HOMO能量,又降低 能量 又降低LUMO的能量。 的能量 给电子基团,既增高HOMO能量,又增高LUMO的能量。 给电子基团,既增高 能量,又增高 的能量。 能量 的能量 共轭碳链的增长,可以增高 能量和降低LUMO的能量。 的能量。 共轭碳链的增长,可以增高HOMO能量和降低 能量和降低 的能量 所以,具有给电子取代基的双烯体和吸电子取代基的亲双烯 所以,具有给电子取代基的双烯体和吸电子取代基的亲双烯 给电子取代基的双烯体和吸电子取代基的 体最易发生正常的D-A反应。 反应。 体最易发生正常的 反应
1
C H
CH2
H2C
CH
3
2
1
烯丙基
共振式
写共振式的原则要求
.
H2 C C H CH2
H2C
-
C H
CH2
H2C
+
C H
CH2
+
CH2
:
Cl CH CH2
5. 轭效应的强度和方向
• σ–p
和
σ-π的效应比π- π和P- π效应弱的多。
配位聚合-第2章-α-烯烃的定向聚合

第二章
2.1 催化剂 对IIP/Rp及Mn的影响
助催化剂中金属的影响(体系:α-TiCl3-M(Et)n-P) MEtn BeEt2 AlEt3 MgEt2 ZnEt2 IPP% 94 85 81 35 M的半径 0.35 0.51 0.66 0.74
(1) 金属半径越小,IIP越高; (2) 这对单金属机理无疑是一最大困难,它解释不了共催化 剂中 金 属性质对体系定向能力的影响
TiCl3 α-TiCl3 α-TiCl3 α-TiCl3 α-TiCl3 α-TiCl3
MM 1.1 1.1
相对速度 1.68
IPP% 80 92 93 80 96 91
5.0
γ-TiCl3
卤素取代助催化剂上的乙基后,一般引起聚合速度下降
第二章
2.1 催化剂 对IIP/Rp及Mn的影响
主催化剂与助化剂的配比也是影响催化体系定向能力、 聚合度和聚合物分子量的重要因素。
第二章
一、问题的提出
2.2 第三组分的提出
研究AlEtCl2-α-TiCl3+P体系的聚合行时发现: ①它根本不聚合 ②丙烯常规聚合体系α-TiCl3-AlEt2Cl中加入AlEtCl2后 聚合速率大大下降,AlEtCl2是一种催化剂毒物
实际上,即使不外加AlEtCl2它也会在聚合的过程中 逐步产生,使聚合速率下降,其来源有二:
2.1 催化剂 对IIP/Rp及Mn的影响
表2-1 不同Ti化合物对聚丙烯IIP的影响(体系:TiXN-AlEt3-P) TiXn α,γ,δ β TiCl3 TiCl3 TiBr3 TiI3 TiCl3 TiCl4 *R=C4H9 TiBr4 TiI4 TiCl2(OR)2* IIP 85 40~50 44 10 75 48 42 46 35
有机化学精品课件——烯 烃

卤化反应小结:
1、反应分两步进行。 2、立体化学:反式加成。 3、极性溶剂有利于反应。 例如: 乙烯通入溴的氯化钠溶液中进行反应
CH2BrCH2Br CH2=CH2
+
NaCl
Br2 H2O
CH2BrCH2Cl CH2BrCH2OH
分步进行
(2)与酸的加成 ①与HX的加成
对称烯烃+不对称试剂 H2C=CH2 + HX
π 电子结合较松散, 易参与反应。是电子 供体,有亲核性。 与亲电试剂结合 与氧化剂反应
2. 烯烃加成的三种主要类型
加 成
C C + A B C A C B
重点
亲电加成 自由基加成 催化加氢
A A A
B B B H2
A A
+ +
B B
(异裂) (均裂)
一、加成反应
加成反应:在反应过程中π键断开,双键 上的两碳原子和其他原子或原子团结合形成两个 σ键的反应
sp > sp2>sp3
• 带正电荷的基团具有吸电子的诱导效应 带负电荷的基团具有给电子的诱导效应
•烷基既有给电子的诱导效应,又有给电子的超共轭 效应
(CH3)3C- > (CH3)2CH- > CH3CH2- > CH3- 5.常见基团的诱导效应顺序:
吸电子基团
NO2>CN>F>Cl>Br>I>C C>OCH3>OH>C6H5>C=C>H
Br H3C H3C H CH3 H H H3C Br H Br H CH3 Br H H Br CH3 CH3 H Br Br H CH3
+
α-烯烃配位聚合.

TiCl4 TiCl3 TiBr3 VCl4 VCl3 Ti(C5H5)2Cl2 V(CH3COCHCOCH3)3 Ti(OC4H9)4
Al(C2H5)3 Al(C2H5)2 Cl Al(C2H5)2 Br Al(C2H5)3 Cl2 Al(i-C4H9)3 Be(C2H5)2 Mg(C2H5)5 LiC4H9
Ti
CH3
〆链终止 瞬时裂解终止(自终止) Et ~ CH-CH3 CH2 Ti 向单体转移终止 Et ~ CH-CH3 CH3 CH2 CH Ti CH2 H Ti + CH2=C~Et CH3
稳定聚丙烯链
CH2-CH3 CH2 Ti + CH2=C~Et CH3
稳定聚丙烯链
向助催化剂AlR3转移终止
α CH2 β CH-CH3
Al
再生
Ti
+
Cl
Al CH2
-
重排
Ti
+
Cl- Al
- +
CH2-CH3
CH-CH3
Et
CH2-CH | CH3
Et
新活性中心
过渡六元环配位结构
② 双金属催化机理
烷基处在双 金属中间的 桥键上
(a)
(b)
双金属的缺电子四元环
配位过渡态
接上:
单体插入钛碳弱键中间,烷基R从钛金 属移位到烯烃的另一个碳原子上
(3)α-烯烃配位聚合的反应机理
链终止或链转移反应: ① 自发的β 氢负离子链转移反应
[Cat] CH2 CH CH3 ks [Cat] H + CH2 CH CH3
② 向单体转移反应
[Cat] CH2 CH CH3 + CH2 CH CH3 ktrM [Cat] CH2 CH2 + CH2 C CH3 CH3
烯烃 二烯烃 课件
熔点/℃ 沸点/℃
顺-2-丁烯 -139.3 3.5
反-2-丁烯 -105.5 0.9
反式异构体对称性较高,晶格排列紧密,故熔点高于顺式异构体。 顺式异构体极性较强,分子间偶极-偶极相互作用力增加, 故沸点高于反式异构体。1.1x10-30
§ 3.5 烯烃的化学性质
π键键能小,易破裂, 烯烃:由于 烯烃:由于π π键进行的: ∴烯烃的反应都是围绕着 烯烃的反应都是围绕着π ① π键电子云流动, 较松散,可作为一电子源,起lewis碱 的作用,与亲电试剂发生加成反应,加成,氧化,聚合。
sp 2 sp 3
120
。
C
H C H C H H H H C C H H
2 3个sp 杂化轨道
取最大键角为120
。
未参加杂化的p轨道 2 与3个sp 杂化轨道垂直
原子轨道以“肩并肩”的方式重迭交盖所形成的共价键称为π键。
原子轨道以“肩并肩”的方式重迭交盖
π键的特性
1. C=C 双键的键长比C-C 单键缩短 C=C :0.133 nm C-C:0.154 nm 从键能看 2. π键比σ键不稳定 从结构看 3. π电子流动性较大, π电子云容易被极化 不能自由旋转 双键不能自由旋转 4. C=C 双键 ----有顺反异构现象
§ 3.4 烯烃的物理性质
烃是气体,C5-C18为液体,C19以上是固体。 以下的烯烃 1.物态:C4以下的烯 2.沸点:末端烯烃的沸点>同碳数烷烃;
↑,烯烃的沸点 ↑; 相对分子质量 相对分子质量↑ ,烯烃的沸点↑ 时, 正构烯 烃的沸点>异构烯 烃; 碳数相同 碳数相同时, 时,正构烯 正构烯烃 的沸点>异构烯烃 时, 末端烯 烃的沸点>内烯 烃(不饱和键位于碳链的中间 ); 碳架相同 碳架相同时, 时,末端烯 末端烯烃 的沸点>内烯烃 顺式烯烃的沸点>反式烯烃 ; 双键位置相同时, 双键位置相同时,顺式烯烃的沸点>反式烯烃 顺式烯烃的沸点>反式烯烃; ↑,烯、炔的熔点 ↑。 分子的对称性↑ ,烯、炔的熔点↑ 3. 熔点:分子的对称性 烃的熔点>末端烯烃; 反式烯烃的熔点>顺式烯烃 。 例如:内烯 例如:内烯烃 的熔点>末端烯烃;反式烯烃的熔点>顺式烯烃 反式烯烃的熔点>顺式烯烃。
烯烃炔烃二烯烃 ppt课件

异相催化剂
eg: Pt, Pd / CaCO3, BaSO4, Al2O3 eg: Raney Ni: * 注意:Ni二Al价+硫N化a物OH易使催N化i 剂+ 中N毒aA(lO:2S+占H据2 金属
的空d轨道)
20
在非均相催化剂的表面发生顺式加成
金属催化剂表面
烯烃的相对氢化速率: 乙烯 > 一元取代烯烃 > 二元取代烯烃 > 三元取代烯烃 > 四元取代烯烃
6.2.1 光谱信息 6.2.2 物理性质
6.2.1 光谱信息
1H-NMR
5.2
4.5-6.5
13C-NMR =C 120
1.7
13
IR
C=C stretching 1680-1620 cm-1
C-H stretching 3100-3010 cm-1
共轭体系:C=C伸缩振动移向低波数
6.5 结构, 异构 & 命名
6.5.1 炔烃的结构 6.5.2 异构化 (自学) 6.5.3 命名
6.5.1 炔烃的结构
63
6.5.2 异构 (自学) 6.5.3 命名
既含双键,又含叁键的结构
选主链:含有双键和叁键的最长链 编 号:使双键、叁键具有最低的编号
如果位号有选择,则优先照顾双键 书 写:先烯后炔
短小 细长
键长: C≡C
C-C 0.154 nm C=C 0.134 nm C≡C 0.120 nm 直线型
66
2、炔烃分子极性比烯烃略强 尽管电子云偏移大,但键长较短
sp sp3
sp2 sp3
67
6.6.2 光谱性质
1H-NMR 13C-NMR IR
第五章烯烃炔烃与双烯烃
Br
CH3
CH3 CH3-C-CHCH3
Br CH3 主要产 物
CH3 CH3-C-CH-CH3
CH3Br
c. 正碳离子重排 CH3
CH3-C-CH=CH2 HBr H
CH3 CH3-C-CHCH3
H
CH3
CH3-C-CH2CH3
CH3
Br
CH3-C-CH-CH3
CH3
H Br
CH3-C-CH2CH3
H3C OH
Hg(OAc)2 = Hg (CH3COO)2
5
CH3 CH3-C-CH=CH2
CH3
Hg(OAc)
CH3 CH3-C-CH CH2
H3C Hg(OAc)
H HO
H3C OH
CH3-C-CH-CH2
NaBH4 OH
H3C
HgOAc
H3C OH CH3-C-CH-CH3
H3C
3NaBH4 4 BF3 2(BH3)2 3NaBF4
3-甲基-2-戊烯
取代基位置 双键位置
顺反异构标记与E、Z标记
H3C C=C CH3 H3C C=C H
H
H
H
CH3
顺-2-丁烯
反-2-丁烯
A
D
C=C
B
C
A > B, D > C
Z
Z:Zusammen
A
C
C=C
B
D
A > B, D > C
E
E :Entgegen
例如:
CH 3-3CC-HC2H3 =CH1 2
O
+ RCOOH
H2O
OH
O
H+
乙烯配位聚合ppt课件

经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
3.气相流化床法(气相本体法)生产HDPE工艺
(1)聚合工艺参数 气相流化床法生产HDPE的工艺参数是
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
(3)链转移剂
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
11.3.3 乙烯配位聚合生产工艺 1.乙烯的主要技术指标 乙烯配位聚合时,溶液聚合级乙烯的纯度见表12.4。
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
2.高密聚乙烯的生产方法
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
(3)搅拌釜重稀释法 将聚合级乙烯与大部分正己烷组成循环稀释剂物流送入内部 有冷却盘管、外壳由流经覆盖整个简形壁的半圆冷却盘管的 高强度搅拌器立式圆筒聚合反应器中,在载体上的Ti/Mg、三 乙基铝助催化剂所组成催化作用下,于90℃、压力为1.8MPa 下进行聚合,反应器在充满液体情况下操作,聚合反应形成 聚乙烯固体颗粒,其颗粒基本上不溶于稀释剂中。聚合物流 经连续两个相类似反应器后,单体转化率达97%后,用离心 机将聚合物淤浆从稀释剂中分离,然后进行干燥和造粒。 生产成本与其他各法相当,但费用指数是各法中最高的。
烯烃配位聚合工艺

烯烃配位聚合摘要:本文介绍了烯烃配位聚合的起始发展情况,包括Ziegler-Natta催化剂、茂金属催化剂、非茂金属催化剂的发现及发展情况及它们的组成与特点。
作者以聚丙烯为例总结了控制聚合物规整度的方法。
最后文章简单介绍了几种聚合方法以及各自的特点。
关键字:烯烃配位聚合Ziegler-Natta催化剂茂金属催化剂非茂金属催化剂规整度1.烯烃配位聚合的起始发展1.1.高压聚乙烯从聚合热力学上分析,乙烯、丙烯是很有聚合倾向的单体,但是在很长一段时间内,未能将该单体聚合成聚乙烯和聚丙烯,这主要是动力学上的原因。
1938~1939年,英国I.C.I.公司在高温下,以氧作引发剂,使乙烯经自由基聚合制得聚乙烯。
反应式如下:图11.2. Ziegler-Natta催化剂的发现1953年德国K. Ziegler等以四氯化钛-三乙基铝(TiCl4-AlEt3)作为引发剂,在较低的温度(50~70℃)和较低的压力下,聚合得无支链、高结晶度、高熔点的高密度聚乙烯。
1954年,意大利G.Natta以四氯化钛-三乙基铝(TiCl4-AlEt3)作引发剂,使丙烯聚合得等规聚丙烯(熔点175℃)。
Ziegler-Natta所用的引发剂是金属有机化合物∕过渡金属化合物的络合体系,单体配位而后聚合,聚合产物呈定向立构。
过渡金属化合物∕金属有机化合物的一系列络合体系可以统称为Ziegler-Natta引发剂,目前已用来生产多种塑料和橡胶,例如高密度聚乙烯、等规聚丙烯、全同聚1-丁烯、全同聚4-甲基-1-戊烯、反式l,4-聚异戊二烯等可用作塑料,顺式1,4-聚丁二烯、顺式1,4-聚异戊二烯、乙丙共聚物、反式聚环戊烯等可用作橡胶。
其总年产量高达几千万吨。
因此,研究配位聚合具有重要的理论和实际意义。
1.3. 茂金属催化剂的发现1951年Miller等发现环戊二烯的蒸气与新鲜被还原的金属铁在300℃下反应生成一种橘黄色的晶体,其化学成分为C10H10Fe。
课件3:2.2.1 烯烃

空间结构: 乙烯平面结构
CH2 CH2 结构简式
(2)乙烯的结构特点
H
120°
H
120°
π键
CC σ键 120° 133pm
H
σ键
σ键
H
乙烯分子结构示意图
σ键
π键
乙烯分子中的σ键和π键
①共价键的形成:分子中的碳原子均采取sp2杂化,碳原子与氢原子形成σ键, 两碳原子之间形成双键(1个σ键和1个π键)。 ②空间结构:乙烯分子中的所有原子都位于同一平面,相邻两个键之间的 夹角约为120°。
3.根据乙烯推测2-丁烯的结构或性质,下列说法正确的是( C ) A.分子中四个碳原子在同一直线上 B.分子中所有原子都在同一平面上 C.与HCl发生加成反应只生成一种产物 D.不能发生加聚反应
解析:乙烯分子为平面结构,由乙烯分子的空间结构可知,2-丁烯分子中的四 个碳原子不可能在同一直线上,A错误。2-丁烯分子中存在甲基,所有原子不 可能在同一平面上,B错误。2-丁烯与HCl发生加成反应,产物只有一种,C正 确。2-丁烯中含有碳碳双键,可以发生加聚反应,D错误。
Br Br
键断裂
1,2-二溴乙烷
或 CH2=CH2+Br2
CH2BrCH2Br
③乙烯的聚合反应
HH …+ C=C +
HH
HH HH
催化剂
C=C + C=C + …
HH HH
H HH H H H …-C-C-C-C-C-C-…
H HH H H H
nCH2=CH2 催化剂 —CH2—CH2—n 聚乙烯
反
应
CH2=CH2+H2 催化剂 CH3CH3
CH2=CH2+H2O 催化剂 CH3CH2OH
