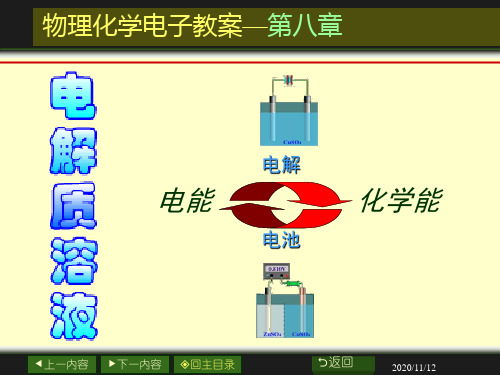
物理化学08章电解质溶液
课件无机化学08 水溶液

611
C
A
Tf 0
t/º C
拉乌尔证明: 难挥发非电解质稀溶液凝固点∆Tf (∆Tf=Tf*-Tf)下降,与溶液的质量摩尔浓 度呈正比。
T f K f m
Kf:溶剂凝固点降低常数 ; m:溶质的质量摩尔浓度。
一些常见溶剂的凝固点下降常数
溶 剂 水
0.0
苯
5.5
乙酸
16.6 3.9
萘
80.5 6.87
沸点上升实验也是测定溶质的摩尔质 量(相对分子质量)的经典实验方法之一, 但凝固点下降测得的数据更准确。
例:已知纯苯的沸点是 80.2 ℃,取 2.67 g萘(C10H8)溶于100g苯中,测 得该溶液的沸点为 80.731 ℃,试求 苯的沸点升高常数。 解: 萘的摩尔质量 128 g mol ,
所以,两种溶液的蒸汽压均为: p=2.33 kPa×0.991=2.31 kPa
溶液的质量摩尔数相同,蒸汽压也相同。
8-2-2 溶液的凝固点下降
凝固点:
在标准状况下,纯液体蒸气压和它 的固相蒸气压相等时的温度为该液体 的凝固点。
溶液的蒸气压总是低于纯溶剂的 蒸气压,所以溶液凝固点下降。
溶液的凝固点下降 ΔTf = Kf · b p/Pa B
Tb对m作图,所得直线斜率即为Kb。
一些常见溶剂的沸点上升常数
溶剂 tb/℃ 水 乙醇 丙酮 苯 乙酸 100 78.4 56.2 80.1 117.9 Kb/K· mol-1 kJ· 0.512 1.22 1.71 2.53 2.93 溶剂 氯仿 萘 硝基苯 苯酚 樟脑 tb/℃ 61.7 218.9 210.8 181.7 208 Kb/K· mol-1 kJ· 3.63 5.80 5.24 3.56 5.95
物理化学08章_电解质溶液

1、
当通电结束,阴、阳两极部溶液浓度相同, 但比原溶液各少了2mol,而中部溶液浓度不变。
2、 3
通电结束,阳极部正、负离子各少了3mol, 阴极部只各少了1mol,而中部溶液浓度仍保持不变。
3、离子的电迁移现象结果
1 向阴、阳两极迁移的正、负离子物质的量总和恰好 等 于通入溶液的总电量
1Au3 e 1Au
3
3
1 H O e 1O +H
22
42
(3) n(O2) 14n(13Au)
= 11.20 g
4.57103 mol
4 197.0 gmol1/3
Au3 3e Au
3 H O 3e 3O +H
22
42
(3) n(O2) 34n(Au) = 3 1.20 g 4.57103 mol 4 197.0 gmol1
( 2 CuSO4 )
7.17 103 S m2 mol1
二、电导的测定
R1 Rx R3 R4
若已知 l、A、c, 则可求得 、m
电导池常数
K cell
l A
1
R
R
25℃时在一电导池盛以c=0.02mol.dm-3的KCl溶液,测得其电阻为82.4Ω,若在同 一电导池中盛以c=0.0025 mol.dm-3的K2SO4 溶液,测得其电阻为326.0 Ω。已知 25℃0.02mol.dm-3的KCl溶液的电导率为0.2768s.m-1,试求:
2 4 c( K SO ) 2.799 10 s.m .mol
24
三、电导率和摩尔电导率与浓度的关系
强电解质:
浓度增加,电导率升高;
但达一最高点下降
弱电解质: 溶液电导率随浓度变化 不显著
物理化学试题及其答案

第八章 电解质溶液 (例题与习题解)例题1、已知25℃时,m ∞Λ(NaAc)=×10-4S·m 2·mol –1,m ∞Λ(HCl)=×10-4S·m 2·mol –1,m ∞Λ(NaCl)=×10-4S. m2·mol –1,求25℃时∞m Λ(HAc)。
解:根据离子独立运动定律+ m m m (NaAc) =(Na ) +(Ac )ΛΛΛ∞∞∞-+ m m m (HCl) =(H ) +(Cl )ΛΛΛ∞∞∞- + m m m (NaCl) =(Na ) +(Cl )ΛΛΛ∞∞∞- + m m m (HAc) =(H ) +(Ac )ΛΛΛ∞∞∞-+ + m m m m + m m =(H ) (Cl )(Na )(Ac ) (Na )(Cl )ΛΛΛΛΛΛ∞∞-∞∞-∞∞-+++--m m m =(HCl) (NaAc)(NaCl)ΛΛΛ∞∞∞+-=+=×10-4 (S·m 2·mol -1)例题2:一些常见离子在25℃时的λ∞±m,见P 22表,求∞m 24Λ(H SO )。
解:=∞)SO (H Λ42m )(SO λ)(H 2λ-24m m ∞+∞+0.015960.0349822+⨯=0.085924=(S·m 2·mol –1)例题3:的醋酸水溶液在25℃时的电导率为×10-2 ,计算醋酸溶液的pH 值和解离平衡常数。
解:-2-32-1m κ 1.6210Λ===1.6210(S.m .mol )c 0.01⨯⨯⨯1000+--4m H ,m Ac ,mΛ=λ+λ=(349.82+40.9)10∞∞∞⨯).mol (S.m 103.91-122-⨯=-3m -2m Λ 1.6210α===0.0451Λ 3.9110∞⨯⨯ pH =-lg(αc)=-lg(0.0451)=3.38⨯0.0122c c α0.010.045k ==1-α1-0.045⨯-5-3=1.0810(mol.dm )⨯例题4:电导测定得出25℃时氯化银饱和水溶液的电导率为10–4 S·m –1。
物理化学下

根据迁移数的定义:
表明离子迁移的速率越大,所承担运载的电量的比例越大。 根据离子迁移率的定义,
t + = U + / (U + + U - ) t - = U- / (U + + U - ) t+ + t- =1 表明迁移数大的离子对运载电量的贡献越大。
离子的电迁移率反映出离子在一定电场条件下的定向移动的快慢程度; 迁移数反映出离子承担运载电量的比例; 离子的电迁移率越大,该离子的迁移数就越大; 总之:
§ 8.2 离子的电迁移率和迁移数
电解质溶液在电场中如何导电? 阴离子向阳极移动;阳离子向阴极移动。
离子的电迁移 离子在外电场作用下发生定向移动。
离子浓度在迁移过程中发生怎样的变化? 把电解质溶液分成本体区域和电极区域(阳极区域和阴极区域): 在溶液本体区域内任意位置无论正、负离子的迁移,都会有相邻位置
原电池
化学能
电能
电解池
溶液的导电性 ——— 第八章内容;
电极电势的产生 —— 第九章内容;
外加电动势与可逆的偏差——第十章内容
电化学在科学研究和国民经济中的重要作用
1、电化学测试 pH、电导、离子选择电极(直接测定离子浓度) 、 电位滴定、 电导滴定、极谱分析、库仑分析、电化学传感器
2、电化学工业 电解(冶炼、精炼)、电镀、化学电源(燃料电池、锂离子电池) 电催化、电合成反应
电导率:电阻率的倒数称为电导率,单位是 S • m-1 ( 或Ω-1 • m-1 ) κ = 1/ρ
G= κA/l 电导率的物理意义是指长 1m、截面积为 1m2 的导体的电导; 电导率值越大,说明该导体越容易导电。
物理化学电解质溶液

温度、浓度、同离子效应等。
02
电解质溶液的离子平衡
离子平衡的概念
离子平衡是指电解质溶液中正负离子浓度之间达 到相对稳定的状态。
在离子平衡状态下,正负离子的迁移速率相等, 溶液中不存在宏观电流。
离子平衡是动态平衡,当外界条件改变时,平衡 状态会发生改变。
离子平衡的建立
电解质溶解在水中后,正负离 子会受到水分子偶极的吸引,
02
电导率的计算公式为:K=σS/L ,其中K为电导率,σ为电导, S为横截面积,L为长度。
03
电导率的大小反映了电解质溶 液中离子迁移的速率和数量, 是电解质溶液的重要物理常数 之一。
电导率与浓度的关系
随着电解质浓度的增加,离子浓度也相应增加,导致电导 率增大。
在一定浓度范围内,电导率与浓度的关系呈线性关系,可 以用Arrhenius公式表示:K=K0exp(-Ea/RT),其中K0为 常数,Ea为活化能,R为气体常数,T为绝对温度。
202X-12-30
物理化学电解质溶液
汇报人:
目 录
• 电解质溶液的基本概念 • 电解质溶液的离子平衡 • 电解质溶液的导电性 • 电解质溶液的酸碱反应 • 电解质溶液的电化学性质
01
电解质溶液的基本概念
电解质的定义
电解质
在水溶液或熔融状态下能够导电 的化合物。
导电原理
电解质在水溶液中能够电离出自 由移动的离子,这些离子在电场 作用下定向移动,形成电流,使 电解质溶液具有导电性。
02
酸碱反应速率常数的大小反映了反应的快慢程度, 可以通过实验测定或计算得出。
03
酸碱反应的速率与浓度、温度等因素有关,可以通 过改变这些因素来调控反应速率。
物理化学:第08章_电解质溶液
anion anode
返回
2020/11/12
1.电解质溶液的导电机理
在电解池中
阳极上发生氧化作用
-
- 电源 +
e-
+
e-
2Cl aq Cl2(g) 2e
阴
阳
阴极上发生还原作用
极
极
CuCl2
Cu2 aq 2e Cu(s)
电解池
上一内容 下一内容
回主目录
例题
解: 1 Au3+ e = 1 Au
3
3
OH
1 4
O2
1 2
H2O e
(1) Q zF 196500197.01.g20mgol-1 /3 Cmol1
= 1763 C
(2)
t
Q I
1763 C 0.025 A
7.05104
s
(3)
m(O2)
1 4
M
(O2)
=197.01g.20mgol1
返回
2020/11/12
1.电解质溶液的导电机理
在原电池中
阳离子移向阴极
负
负载电阻
正
极
e-
Zn
极
Cu e-
e-
阳 Zn2+ Cu2+ 阴
极 SO24-
SO24- 极
ZnSO4溶液 CuSO4溶液
在阴极上发生还原的是
Cu2 aq 2e Cu(s)
阴离子迁向阳极 在阳极上发生氧化的是
Danill电池
上一内容 下一内容 回主目录
返回
2020/11/12
2. 法拉第定律
人们把在数值上等于1 mol元电荷的电荷量称 为Faraday常数,用F表示。
电解质溶液优秀课件
离子旳电迁移现象
2023/12/28
阳极 离子旳电迁移现象
A
B
始态
阴极
4 mol
r+ 3r
终态
阳极部 A 中部 B 阴极部
2023/12/28
离子电迁移旳规律:
1.向阴、阳两极迁移旳正、负离子物质旳量总和恰好等 于通入溶液旳总电量。
2.
阳极部电解质物质的量的减少 阴极部电解质物质的量的减少
旳迁移数(transference number),用符号 tB 表达。
其定义式为:
tB def
IB I
tB 是量纲1旳量,数值上总不大于1。
因为正、负离子移动旳速率不同,所带旳电荷不 等,所以它们在迁移电量时所分担旳分数也不同。
2023/12/28
离子迁移数旳定义
迁移数在数值上还可表达为:
t
I I
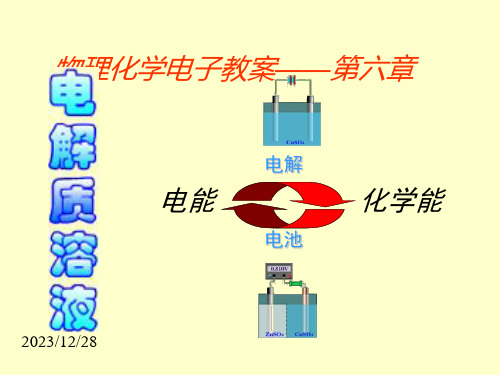
物理化学电子教案——第六章
电解
电能
电池
化学能
2023/12/28
第六章 电解质溶液
6.1 电化学旳基本概念和法拉第定律 6.2 离子旳电迁移和迁移数 6.3 电导 6.4 强电解质溶液理论简介 6.5 辅导答疑
2023/12/28
6.1电化学旳基本概念和法拉第定律
(1)基本概念
研究对象 电化学用途 两类导体 正极、负极 阴极、阳极 原电池 电解池 电流效率
迁移数旳测定措施
Hittorf 法中必须采集旳数据: 1. 通入旳电量,由库仑计中称重阴极质量旳增长而得, 例如,银库仑计中阴极上有0.0405 g Ag析出,
n(电) 0.0405 g /107.88 g mol1 3.754 104 mol
2. 电解前含某离子旳物质旳量n(起始)。 3.电解后含某离子旳物质旳量n(终了)。 4.写出电极上发生旳反应,判断某离子浓度是增长了、 降低了还是没有发生变化。 5.判断离子迁移旳方向。
电解质溶液多选题

物理化学试卷试题 1下列条件中哪二个不是摩尔电导率的定义要求的:(A) 溶液体积为 1 m (B) 电解质的物质的量为 1 mol (C) 两电极相距 1 m (D) 两电极必须平行(E) 溶液的浓度必须是 1 mol m试题 2电解质溶液的电导率与下列哪个因素有关:(A) 电极的面积 (B) 溶液的体积(C) 溶液的体积和单位体积中离子的数目 (D) 单位体积中离子数目(E) 溶液的温度试题 3下列化合物中哪二种的极限摩尔电导率能从摩尔电导率对 C 作图,外推到 C=0时而求得:(A) CH COOH (B) CH COONa (C) NH Cl(D) NH OH (E) HCOOH试题 4CaCl 摩尔电导率与其离子的摩尔电导率的关系是:(A) (CaCl ) = (Ca ) + (Cl )(B) ( CaCl ) = ( Ca ) + 2 (Cl )(C) (CaCl ) = (Ca ) + 2 (Cl )(D) (CaCl ) = 2 [ (Ca ) + (Cl )](E) ( CaCl ) = ( Ca ) + (Cl )试题 5下列那些是说明电解质溶液的导电机理:(A)离子迁移 (B) 电极反应 (C) 电解质溶液电离(D) 电解质溶液存在离子对 (E)离子都是水合的试题 6关于电解质溶液的电导,下列说法中正确的是:(A) 电解质溶液的电导,来源于离子的迁移(B) 强电解质溶液的电导随浓度增大而增加(C) 电解质溶液的电导,随温度的升高而增大(D) 弱电解质溶液的电导,随浓度增大而减少(E) 电解质溶液的电导率与电导池常数有关试题 7有关电导率和摩尔电导率的单位, 下列说法中, 正确的是:(A) 电导率的单位是 S m (B) 电导率的单位是 S m(C) 电导率的单位是 S m (D) 摩尔电导率的单位是 S m mol (E) 摩尔电导率的单位是 S m mol试题 8有关电导和电导率的单位, 下列说法中, 正确的是:(A) 电导的单位是 A V (B) 电导的单位是 S(C) 电导率的单位是 S (D) 电导率的单位是 S m(E) 电导率的单位是 S m试题 9当直流电源通过电解质溶液,电解质溶液中正、负离子发生定性迁移,那么下列判断正确的:(A) 正离子迁移的方向与电流方向一致。
第08章 电解质溶液的扩散

(Diffusion in Electrolytic Solution)
扩散是溶液的基本性质(1)
Applications:
1,测定微粒的分子量 2,估计胶体微粒的电荷 3,测定磨擦系数 4,测定溶解速度
School of Metallurgical Science and Engineering, Central South University
μi=μi0 + RTlnCi ;μF=μF0 + RTlnCf μi0 =μf0 (in dilute solution) 则两浓度面间的化学位差为: △μ=RTlnCf /Ci
School of Metallurgical Science and Engineering, Central South University
School of Metallurgical Science and Engineering, Central South University
(
x
) 2
x
2 Dt e y2 dy
2 Dt
0
如果是纯溶剂,C0’’=0,则:
c c0 ' [1 ( x )
2
2 Dt
反过来,D值为:
D
x2
1
在这一过程中所做的功为 W= △μ
若过程为一极微过程,则 δW= dμ
根据静电学基本理论:单位电荷在电场力作 用下,从x 处迁移到(x+dx)处所做功为:
δW= dφ
而电场所做的功是电场力和电荷 迁移距离 的积, 有:-Fdx = dφ
即
F d
在电场作用下, 离子迁移的推动力
dx 为电位梯度.
第八章 电解质溶液

电位梯度 V• m-1
uB为单位电位梯度(1V• m-1)时的运动 速率,与离子本性(半径、电荷、水化 程度)和溶剂的性质(如粘度)有关。
表8.1 298.15 K无限稀水溶液中离子淌度
U 10 正离子 m 2 s -1 V -1 负离子
8
U 10 2 -1 -1 m s V
定Q
1 1 3 n(Au) ? n( Au ) ? n( O 2 ) 4 3 3 1 1 ? n( O 2 ) 电流效率 3 4
理论电量 100% (物质的量一定) 实际电量
实际产物质量 100%(电量一定) 理论产物质量
§8.2 离子的电迁移率和迁移数
一、离子的电迁移现象 + 阳 极+++++ +++++ +++++ ----- ----- ----阴 +极 + + + -
I 原电池 原电池
e
+2e PbO2
PbSO4
H2SO4
PbSO4
思考题:
下列说法正确的是: (A)原电池的正极就是阳极 (B)原电池的负极发生还原反应 (C)电解池的阴极发生氧化反应 (D)电解池的阳极发生氧化反应
二、 Faraday电解定律 通电量与各电极上发生氧化或还 原反应的物质的量之间的定量关系。 法拉第常数 F
设电解质为Mv+Nv,
m
= v+ m,+ + v m,
——Kohlrausch 离子独立移动定律
由于无限稀释时的导电能力取决于离子本性,而与共 存的其他粒子的性质无关,因此在一定溶剂和T条件下, 任何离子的m 为定值,可查表。
大学物理化学下册(第五版傅献彩)知识点分析归纳

第八章电解质溶液第九章1.可逆电极有哪些主要类型?每种类型试举一例,并写出该电极的还原反应。
对于气体电极和氧化还原电极在书写电极表示式时应注意什么问题?答:可逆电极有三种类型:(1)金属气体电极如Zn(s)|Zn2+ (m) Zn2+(m) +2e- = Zn(s)(2)金属难溶盐和金属难溶氧化物电极如Ag(s)|AgCl(s)|Cl-(m), AgCl(s)+ e- = Ag(s)+Cl-(m)(3)氧化还原电极如:Pt|Fe3+(m1),Fe2+(m2) Fe3+(m1) +e- = Fe2+(m2)对于气体电极和氧化还原电极,在书写时要标明电极反应所依附的惰性金属。
2.什么叫电池的电动势?用伏特表侧得的电池的端电压与电池的电动势是否相同?为何在测电动势时要用对消法?答:正、负两端的电势差叫电动势。
不同。
当把伏特计与电池接通后,必须有适量的电流通过才能使伏特计显示,这样电池中发生化学反应,溶液浓度发生改变,同时电池有内阻,也会有电压降,所以只能在没有电流通过的情况下才能测量电池的电动势。
3.为什么Weslon标准电池的负极采用含有Cd的质量分数约为0.04~0.12的Cd一Hg齐时,标准电池都有稳定的电动势值?试用Cd一Hg的二元相图说明。
标准电池的电动势会随温度而变化吗?答:在Cd一Hg的二元相图上,Cd的质量分数约为0.04~0.12的Cd一Hg齐落在与Cd一Hg固溶体的两相平衡区,在一定温度下Cd一Hg齐的活度有定值。
因为标准电池的电动势在定温下只与Cd一Hg齐的活度有关,所以电动势也有定值,但电动势会随温度而改变。
4.用书面表示电池时有哪些通用符号?为什么电极电势有正、有负?用实验能测到负的电动势吗?答:用“|”表示不同界面,用“||”表示盐桥。
电极电势有正有负是相对于标准氢电极而言的。
不能测到负电势。
5.电极电势是否就是电极表面与电解质溶液之间的电势差?单个电极的电势能否测量?如何用Nernst方程计算电极的还原电势?5.电极电势是否就是电极表面与电解质溶液之间的电势差?单个电极的电势能否测量?如何用Nernst 方程计算电极的还原电势?答:电极电势不是电极表面与电解质溶液之间的电势差。
物理化学课后习题

第八章电解质溶液三、关键的计算题类型及例题(1) 利用强电解质的Λ∞m和公式Λ∞m=ν+Λ∞m,++ν-Λ∞m,-来计算弱电解质的Λ∞m或计算难溶盐的Λ∞m 。
例:Λ∞m(HAc)=Λ∞m(HCl)+Λ∞m(NaAc)-Λ∞m(NaCl)再如:Λ∞m(CaF2) =Λ∞m(CaCl2)+2Λ∞m(NaF)-2Λ∞m(NaCl)(2) 电导测定的应用计算例2:在298K时,测量BaSO4饱和溶液在电导池中的电阻,得到这个溶液的电导率为4.20³10-4S·m-1,已知在该温度下水的电导率为1.05³10-4 S·m-1。
求①该盐的电导率κ;②求Λ∞m(1/2 BaSO4);③BaSO4在该温度下的溶解度;④求BaSO4的K sp。
解:①根据κ(盐溶液)=κ(盐)+κ(H2O)则该盐的电导率κ为:κ(盐)= κ(盐溶液)-κ(H2O)= 4.20³10-4-1.05³10-4= 3.15³10-4S·m-1②查表得无限稀释时的离子摩尔电导率Λ∞m(1/2Ba2+)=63.64³10-4S·m2·mol-1;Λ∞m(1/2SO42-)=79.8³10-4 S·m2·mol-1根据离子独立运动定律,得:Λ∞m(1/2 BaSO4)= Λ∞m(1/2Ba2+)+ Λ∞m(1/2SO42-)= 1.434³10-2S·m2·mol-1;而Λ∞m(BaSO4)=2.869³10-2 S·m2·mol-1③根据难溶盐饱和溶液浓度的公式:c =κ(盐)/Λ∞m得:c = 3.15³10-4/2.869³10-2=1.099 ³10-2(mol/m3)=1.099 ³10-5(mol/dm3)BaSO4在该温度下的溶解度为:s(g/dm3)= c(mol/dm3)³M(g/mol)= 1.099 ³10-5³233.37=2.565³10-3④求BaSO4的K spK sp = [Ba2+][SO4 2-]= [1.099 ³10-5]2= 1.208 ³10 -10例3摩尔电导率的定义式为:Λ∞m =κ/c试问对弱电解质,c应用总计量浓度,还是解离部分的浓度?说明理由。
物理化学试卷(手动组卷)第8章电解质

题目部分,(卷面共有37题,90.0分,各大题标有题量和总分) 一、选择(27小题,共52.0分)1.(2分)有下列溶液: A 、0.001 mol ·kg -1 KCl B 、 0.001 mol ·kg -1 KOH C 、 0.001 mol ·kg -1 HCl D 、 1.0 mol ·kg -1 KCl 其中摩尔电导率最大的是 ( C ); 最小的是 ( D )。
2.(2分)25℃时,Λm (LiI)、λm (H +)、Λm (LiCl) 的值分别为 1.17×10-2,3.50×10-2 和 1.15×10-2S ·m 2·mol -1。
LiCl 中的 t +为 0.34,当假设其中的电解质完全电离时, HI 中的 t +为 : ( B )A 、 0.18B 、 0.82C 、 0.34D 、 0.663.(2分)298 K 时,无限稀释的 NH 4Cl 水溶液中正离子迁移数 t += 0.491。
已知 Λm ∞(NH 4Cl) = 0.0150 S ·m 2·mol -1 ,则: ( D )A 、 λm ∞(Cl -) = 0.00764 S ·m 2·mol -1B 、 λm ∞(NH 4+) = 0.00764 S ·m 2·mol -1C 、 淌度 U Cl -∞= 737 m 2·s-1·V -1 D 、 淌度 U Cl -∞= 7.92×10-8 m 2·s-1·V -14.(2分)用同一电导池分别测定浓度为 0.01 mol ·kg -1和 0.1 mol ·kg -1的两个电解质溶液,其电阻分别为 1000 Ω 和 500 Ω,则它们依次的摩尔电导率之比为 ( B ) A 、 1 : 5 B 、 5 : 1 C 、 10 : 5 D 、 5 : 105.(2分)LiCl 的无限稀释摩尔电导率为 115.03×10-4 S ·m 2·mol -1,在 298 K 时,测得 LiCl 稀溶液中 Li + 的迁移数为 0.3364,则 Cl - 离子的摩尔电导率 λm (Cl -)为: ( A ) A 、 76.33×10-4 S ·m 2·mol -1 B 、 113.03×10-4 S ·m 2·mol -1 C 、 38.70×10-4 S ·m 2·mol -1 D 、 76.33×102 S ·m 2·mol -16.(2分)CaCl 2 摩尔电导率与其离子的摩尔电导率的关系是: ( C )A 、 Λ∞(CaCl 2) = λm (Ca 2+) + λm (Cl -)B 、 Λ∞(CaCl 2) = ½ λm (Ca 2+) + λm (Cl -)C 、 Λ∞(CaCl 2) = λm (Ca 2+) + 2λm (Cl -)D 、 Λ∞(CaCl 2) = 2 [λm (Ca 2+) + λm (Cl -)]7.(2分)在10 cm 3 浓度为 1 mol ·dm -3 的KOH 溶液中加入10 cm 3水,其电导率将: ( B )A 、 增加B 、 减小C 、 不变D 、 不能确定 其摩尔电导率将 ( A )A 、 增加B 、 减小C 、 不变D 、 不能确定8.(2分)在CuSO 4溶液中用铂电极以0.1 A 的电流通电10 min ,在阴极上沉积的铜的质量是: ( A ) A 、19.9 mg B 、 29.0 mg C 、 39.8 mg D 、 60.0 mg 9.(2分)电解硫酸铜溶液时,析出128 g 铜(M r =64),需要通入多少电量? ( ) A 、96 500 C B 、 48 250 C C 、 386 000 C D 、 24 125 C10.(1分)298标K ,当 H 2SO 4溶液的浓度从 0.01 mol ·kg -1 增加到 0.1 mol ·kg -1时,其电导率 k 和摩尔电导率 Λm 将: ( ) A 、 k 减小 , Λm 增加 B 、 k 增加 , Λm 增加 C 、 k 减小 , Λm 减小 D 、 k 增加 , Λm 减小11.(1分)在一定温度和浓度的水溶液中,带相同电荷数的 Li +、Na +、K +、Rb +、… ,它们的离子半径依次增大,但其离子摩尔电导率恰也依次增大,这是由于: ( ) A 、 离子淌度依次减小 B 、 离子的水化作用依次减弱 C 、 离子的迁移数依次减小 D 、 电场强度的作用依次减弱 12.(2分)描述电极上通过的电量与已发生电极反应的物质的量之间的关系的是: ( ) A 、欧姆定律 B 、离子独立运动定律 C 、法拉第定律 D 、能斯特定律 13.(1分)电解质溶液中离子迁移数 (t i ) 与离子淌度 (U i ) 成正比。
物理化学电解质溶液

Λm = Λ (1−β C)
∞ m
1 ⋅ Λm/(S⋅m2 ⋅ mol-1)
NaCl NaAc HAc
-----科尔劳乌施公式 科尔劳乌施公式 将直线外推至C→0, 将直线外推至 , 得到无限稀释摩尔电导率
c1/2 电解质水溶液Λ 图5-6电解质水溶液 m与c的关系 电解质水溶液 的关系
5.2.4 离子独立运动定律及离子摩尔电导率
无限稀释时,负离子的导电能力亦与共存的正离子无关。 无限稀释时,负离子的导电能力亦与共存的正离子无关。
例一: 例一: 通电于Au(NO3)3溶液,析出 溶液,析出Au(s)=1.20g。已知 通电于 。已知M(Au)=197.0g/mol。 。 求通入电量。 求通入电量。
解:
Au +3e →Au(s)
q =∆n Z F 1.20g = ×3×96500Cm −1 =1763.45C . ol 197.0g / m ol
def
qB / q
qB—B种离子传输的电量 种离子传输的电量 q—通过溶液的总电量 通过溶液的总电量
对于只含有一种正离子和一种负离子的电解质溶 液而言, 液而言,正、负离子的迁移数分别为
t+ = q+ q+ + q− t− = q− q+ + q−
t+ + t- = 1
U+ t+ = U+ + U− U− t− = U+ + U−
大学物理化学核心教程课后参考答案第8章

第八章电化学一.基本要求1.理解电化学中的一些基本概念,如原电池和电解池的异同点,电极的阴、阳、正、负的定义,离子导体的特点和Faraday 定律等;2.掌握电导率、摩尔电导率的定义、计算、与浓度的关系及其主要应用等;了解强电解质稀溶液中,离子平均活度因子、离子平均活度和平均质量摩尔浓度的定义,掌握离子强度的概念和离子平均活度因子的理论计算;3.了解可逆电极的类型和正确书写电池的书面表达式,会熟练地写出电极反应、电池反应,会计算电极电势和电池的电动势;4.掌握电动势测定的一些重要应用,如:计算热力学函数的变化值,计算电池反应的标准平衡常数,求难溶盐的活度积和水解离平衡常数,求电解质的离子平均活度因子和测定溶液的pH等;5.了解电解过程中的极化作用和电极上发生反应的先后次序,具备一些金属腐蚀和防腐的基本知识,了解化学电源的基本类型和发展趋势;二.把握学习要点的建议在学习电化学时,既要用到热力学原理,又要用到动力学原理,这里偏重热力学原理在电化学中的应用,而动力学原理的应用讲得较少,仅在电极的极化和超电势方面用到一点;电解质溶液与非电解质溶液不同,电解质溶液中有离子存在,而正、负离子总是同时存在,使溶液保持电中性,所以要引入离子的平均活度、平均活度因子和平均质量摩尔浓度等概念;影响离子平均活度因子的因素有浓度和离子电荷等因素,而且离子电荷的影响更大,所以要引进离子强度的概念和Debye-Hückel极限定律;电解质离子在传递性质中最基本的是离子的电迁移率,它决定了离子的迁移数和离子的摩尔电导率等;在理解电解质离子的迁移速率、电迁移率、迁移数、电导率、摩尔电导率等概念的基础上,需要了解电导测定的应用,要充分掌握电化学实用性的一面;电化学在先行课中有的部分已学过,但要在电池的书面表示法、电极反应和电池反应的写法、电极电势的符号和电动势的计算方面进行规范,要全面采用国标所规定的符号,以便统一;会熟练地书写电极反应和电池反应是学好电化学的基础,以后在用Nernst 方程计算电极电势和电池的电动势时才不会出错,才有可能利用正确的电动势的数值来计算其它物理量的变化值,如:计算热力学函数的变化值,电池反应的标准平衡常数,难溶盐的活度积,水的解离平衡常数和电解质的离子平均活度因子等;学习电化学一方面要掌握电化学的基本原理,但更重要的是关注它的应用;对于可逆电池的实验可测量有:可逆电池的电动势E 、标准可逆电动势E 和电动势的温度系数pE T ∂⎛⎫ ⎪∂⎝⎭,利用这些实验的测定值,可以用来: 1 计算热力学函数的变化量,如r m r m r m r m R , , , , G G S H Q ∆∆∆∆等;2 计算电池反应的标准平衡常数,难溶盐的活度积ap K 和水的解离常数W K 等;3 根据电动势数值的正、负,来判断化学反应自发进行的方向;4 计算离子的平均活度因子γ±;5 计算未知溶液的pH 值;6 进行电势滴定7 绘制电势-pH 图,并用于金属的防腐及湿法冶金等;在这些应用中,难免要用到如何将一个化学反应设计成相应电池的问题,所以要了解如何将一些简单的化学反应设计成相应可逆电池的方法;现在使用的标准电极电势表基本上都是氢标还原电极电势,所以关于氧化电极电势可以不作要求,免得在初学时发生混淆;学习电解和极化的知识,主要是了解电化学的基本原理在电镀、电解、防腐和化学电源等工业上的应用,充分利用网络资源,都了解一些最新的绿色环保的新型化学电源,如氢-氧燃料电池和锂离子电池等;了解电解合成、电化学防腐等应用实例,拓宽知识面,提高学习兴趣,充分了解物理化学学科的实用性的一面;三.思考题参考答案1.什么是正极什么是负极两者有什么不同什么是阴极什么是阳极两者有什么不同答:比较电池中两个电极的电极电势,电势高的电极称为正极,电势低的电极称为负极;电流总是从电势高的正极流向电势低的负极,电子的流向与电流的流向刚好相反,是从负极流向正极;根据电极上进行的具体反应,发生还原作用的电极称为阴极,发生氧化作用的电极称为阳极;在原电池中,阳极因电势低,所以是负极;阴极因电势高,所以是正极;在电解池中,阳极就是正极,阴极就是负极;2.电解质溶液的电导率随着电解质浓度的增加有什么变化答:要分强电解质和弱电解质两种情况来讨论;电解质溶液的电导率是指单位长度和单位截面积的离子导体所具有的电导;对于强电解质,如HCl, H SO, NaOH24等,溶液浓度越大,参与导电的离子越多,则其电导率会随着浓度的增加而升高;但是,当浓度增加到一定程度后,由于电解质的解离度下降,再加上正、负离子之间的相互作用力增大,离子的迁移速率降低,所以电导率在达到一个最大值后,会随着浓度的升高反而下降;对于中性盐,如KCl等,由于受饱和溶解度的限制,在到达饱和浓度之前,电导率随着浓度的增加而升高;对于弱电解质溶液,因为在一定温度下,弱电解质的解离平衡常数有定值,所以在电解质的浓度增加的情况下,其离子的浓度还是基本不变,所以弱电解质溶液的电导率随浓度的变化不显着,一直处于比较低的状态;3.电解质溶液的摩尔电导率随着电解质浓度的增加有什么变化答:要分强电解质和弱电解质两种情况来讨论;电解质溶液的摩尔电导率是指,将含有1 mol 电解质的溶液,置于相距为单位距离的两个电极之间所具有的电导;由于溶液中导电物质的量已给定,都为1mol,所以,对于强电解质,当浓度降低时,正负离子之间的相互作用减弱,正、负离子的迁移速率加快,溶液的摩尔电导率会随之而升高;但不同的电解质,摩尔电导率随着浓度的降低而升高的程度也大不相同;当浓度降到足够低时,摩尔电导率与浓度之间呈线性关系,可用公式表示为(m m 1∞=-ΛΛ;所以强电解质的无限稀释的摩尔电导率可以用外推到0→c 得到;对于弱电解质溶液,因为在一定温度下,弱电解质的解离平衡常数有定值,在电解质的浓度下降的情况下,其离子的浓度基本不变,所以弱电解质溶液的摩尔电导率在一般浓度下,随浓度的变化不显着,一直处于比较低的状态;直到溶液的浓度很稀薄时,由于正负离子之间的相互作用减弱,摩尔电导率随着浓度的降低开始升高,但不成线性关系,当溶液很稀很稀时,摩尔电导率随着浓度的降低迅速升高,到0→c 时,弱电解质溶液的离子无限稀释的摩尔电导率与强电解质的一样;所以弱电解质的无限稀释的摩尔电导率可以用离子的无限稀释的摩尔电导率的加和得到,即 m m, m,∞∞∞+-=+ΛΛΛ;4.在温度、浓度和电场梯度都相同的情况下,氯化氢、氯化钾、氯化钠三种溶液中,氯离子的运动速度是否相同氯离子的迁移数是否相同答:因为温度、浓度和电场梯度都相同,所以三种溶液中氯离子的运动速度是基本相同的,但氯离子的迁移数不可能相同;迁移数是指离子迁移电量的分数,因为氢离子、钾离子、钠离子的运动速度不同,迁移电量的能力不同,所以相应的氯离子的迁移数也就不同;5.为什么氢离子和氢氧根离子的电迁移率和摩尔电导率的数值比同类离子要大得多答: 因为氢离子和氢氧根离子传导电流的方式与其它离子不同,它们是依靠氢键来传递的,所以特别快;它们传导电流时,不是靠离子本身的迁移,而是依靠氢键和水分子的翻转来传导电荷的;如果在非水溶液中,氢离子和氢氧根离子就没有这个优势;6.强电解质如4CuSO ,2MgCl 等,在其溶液的浓度不是太大的情况下,电解质的摩尔电导率与它的离子摩尔电导率之间是什么关系答:在溶液不太浓时,可以近似认为强电解质是完全解离的,其摩尔电导率就等于离子摩尔电导率的加和;但对于组成离子的电价数大于1,特别是在正、负离子的电价不对称时,在选取基本单元时要注意使粒子的荷电量相同,若粒子的荷电量不同时,要在前面乘以因子,使等式双方相等;现用以下例子来表明它们之间的关系:对于A B -型的对称电解质,它们之间的关系比较简单,如或 22 m 4 m m 4111CuSO Cu SO 222+-⎛⎫⎛⎫⎛⎫=+ ⎪ ⎪ ⎪⎝⎭⎝⎭⎝⎭ΛΛΛ 对于2A B -型的不对称电解质,由于正负离子的电价数不同,要注意选取荷电量相同的粒子作为基本单元,若荷电量不同,要在前面乘以因子,如或 2 m 2 m m 11MgCl Mg (Cl )22+-⎛⎫⎛⎫=+ ⎪ ⎪⎝⎭⎝⎭ΛΛΛ7.在电解质溶液中,如果有i 种离子存在,则溶液的总电导应该用如下的哪个计算式计算答:应该用1式计算;因为溶液的总电导等于各个离子电导的加和,即在溶液中,离子是以并联形式存在的,而不是以串联形式存在的,总的电阻不可能等于所有离子电阻的加和;8.标准电极电势是否就等于电极与周围活度为1的电解质溶液之间的电势差 答:不是;由于电极表面性质比较复杂,电极与周围电解质溶液之间的真实电势差是无法测量的;现在把处于标准状态下的电极即待测电极与标准氢电极组成电池,将待测电极作还原极即正极,并规定标准氢电极的电极电势为零,这样测出的电池电动势就作为待测电极的电极电势,称为标准氢标还原电极电势,简称为标准电极电势,用符号Ox|Red E 表示;9.为什么标准电极电势的值有正有负答:因为规定了用还原电极电势,待测电极与氢电极组成电池时,待测电极放在阴极的位置,令它发生还原反应;但是比氢活泼的金属与氢电极组成电池时,实际的电池反应是金属氧化,氢离子还原,也就是说电池的书面表示式是非自发电池,电池反应是非自发反应,电动势小于零,所以电极电势为负值;如果是不如氢活泼的金属,则与氢电极组成的电池是自发电池,电极电势为正值;10.某电池反应可以写成如下两种形式,则所计算出的电动势E ,标准摩尔Gibbs 自由能变化值和标准平衡常数的数值是否相同1 222H 2Cl H ()Cl ()2HCl()p p a += 2 222H 2Cl 11H ()Cl ()HCl()22p p a +=答:电动势E 是电池的性质,不管电池反应中电子的计量系数是多少,电动势E 总是相同的;如果从计算电池电动势的Nernst 方程看,RT zF 项分母中的z 与B B Ba ν∏项中的指数B ν之间,有固定的比例关系,所以电动势E 有定值,即12E E =;但是摩尔Gibbs 自由能的变化值和标准平衡常数值却不同,r m G ∆中的下标“m ”是指反应进度为1 mol 时的Gibbs 自由能变化值,若化学方程式中的计量系数成倍数的关系,则当反应进度都等于1 mol 时,r m G ∆的值也成倍数的关系,即r m,1r m,22G G ∆=∆;如果电池都处于标准状态,则标准摩尔Gibbs 自由能变化值的关系也是r m,1r m,2G G ∆=∆;标准平衡常数与标准Gibbs 自由能的变化值之间的关系为r m ln G RT K ∆=-,r m G ∆的数值成倍数的关系,则K 的数值就成指数的关系,即212 ()K K =;11.如果规定标准氢电极的电极电势为1 V,则各可逆电极的标准氢标还原电极电势的值有什么变化电池的电动势有什么变化答:由于单个电极的电极电势无法测量,人们不得不采用相对的电极电势;目前国际上绝大多数采用的是氢标还原电极电势,即规定标准氢电极的电极电势为0 V,将待测电极作阴极还原极,这样组成的电池的电动势就作为待测电极的标准还原电极电势Ox Red E |,即如果规定标准氢电极的电极电势为 1 V,组成电池的电动势应是个定值,即实验测定的E 不变,那即各电极的标准还原电极电势值也都增加1 V;电池的电动势是两个电极的电极电势之差,所有的电极电势都增加1 V,电动势的值不会改变,这就是为什么要取共同标准的原因;12.如何用电化学的方法,测定2H O(l)的标准摩尔生成Gibbs 自由能f m 2(H O,l)G ∆答:2H O(l)的生成反应为要设计一个电池,使电池反应与之相同;方程式中,显然2H (g)是被氧化的,将氢电极放在电池的左边作阳极,2O (g)是被还原的,将氧电极放在电池右边作阴极,这是一个氢-氧燃料电池;由于氢-氧燃料电池的电动势与电解质溶液的pH 没有关系,所以两个电极中间的介质在pH 等于114之间都可以,只要保持2H (g)和2O (g)的压力都是标准压力即可;所以设计的电池为这个电池的反应就是2H O(l)的生成反应,测定电池的标准可逆电动势E 或从标准电极电势表,查阅电极的标准电极电势,进行计算得到,就可以计算2H O(l)的标准摩尔生成Gibbs 自由能f m 2(H O,l)G ∆13.设计合适的电池,计算24Hg SO (s)的溶度活度积常数ap K ;答:24Hg SO (s)的解离反应为2+22+2Hg Hg ()a 是从第一类电极中来的,是由Hg(l)氧化而来的,所以用2+22+2Hg Hg(l)Hg ()a |电极作阳极,再用一个难溶盐电极242424SO SO ()Hg SO (s)Hg(l)a --||作阴极,因为24Hg SO (s)在还原时会放出24SO -;2+2Hg 和24SO -不能共存在一个容器内,中间要用盐桥隔开,所以设计的电池为该电池的净反应与24Hg SO (s)的解离反应一致读者可以自己检验一下;从标准电极电势表,查得两个电极的电极电势,得到电池的标准电动势E ,或用实验测定该电池处于标准态时的标准电动势E ,就可以计算难溶盐的活度积常数14.为什么实际分解电压总要比理论分解电压高答:实际分解电压要克服三种阻力:1原电池的可逆电动势,这数值通常称为理论分解电压,其绝对值用R E ||表示; 2由于两个电极上发生极化而产生的超电势a η和c η,通常称为不可逆电动势;3克服电池内阻必须消耗的电位降IR ;所以实际分解电压为这样,实际分解电压E 分解一定大于理论分解电压R E ||;15.在电解池和原电池中,极化曲线有何异同点答:它们的相同点是:无论是在原电池还是在电解池中,随着电流密度的增加,阳极的实际析出电势不断变大,阳极的极化曲线总是向电势增大的方向移动;阴极的实际析出电势不断变小,阴极的极化曲线总是向电势减小的方向移动;所不同的是,在电解池中,由于超电势的存在使实际分解电压变大,随着电流密度的增加,实际消耗的电能也不断增多;而在原电池中,由于超电势的存在,使电池的不可逆电动势小于可逆电动势,随着电流密度的增加,电池的不可逆电动势不断下降,对环境作电功的能力也下降;16.将一根均匀的铁棒,部分插入水中,部分露在空气中;经若干时间后,哪一部分腐蚀最严重为什么答:在靠近水面的部分腐蚀最严重;因为在水下部分的铁棒,虽然有2CO (g)和2SO (g)等酸性氧化物溶于水中,使水略带酸性,但H + 离子的浓度还是很低的,发生析氢腐蚀的趋势不大;铁棒露在空气中的部分,虽然与氧气接触,但无电解质溶液,构成微电池的机会较小;而在靠近水面的部分,既有氧气,又有微酸性的电解质溶液,所以很容易构成微电池,发生耗氧腐蚀,这样形成的原电池的电动势比在水中的析氢腐蚀的电动势大,因而这部分腐蚀最严重;17.以金属铂为电极,电解Na2SO4水溶液;在两极附近的溶液中,各滴加数滴石蕊试液,观察在电解过程中,两极区溶液颜色有何变化为什么答:这实际是一个电解水的过程,硫酸钠仅仅起了导电的作用;电解时,在阳极上放出氧气,阳极附近氢离子的浓度变大,使石蕊试液呈红色;在阴极上析出氢气,阴极附近氢氧根离子的浓度变大,使石蕊试液呈蓝色;18.为了防止铁生锈,分别电镀上一层锌和一层锡,两者防腐的效果是否一样答:在镀层没有被破坏之前,两种防腐的效果是一样的,镀层都起了将铁与环境中的酸性气体和水隔离的目的,防止微电池的形成,防止了铁被电化腐蚀;但是镀层一旦有破损,则两者的防腐效果就大不相同;镀锡铁俗称马口铁,锡不如铁活泼;若将锡与铁组成原电池,则锡作阴极,称为阴极保护层,而铁作阳极,这样铁被腐蚀得更快;镀锌铁俗称白铁,锌比铁活泼,组成原电池时,锌作阳极,称为阳极保护层,锌被氧化,而铁作阴极,仍不会被腐蚀;19.在氯碱工业中,电解NaCl的浓溶液,以获得氢气、氯气和氢氧化钠等化工原料;为什么电解时要用石墨作阳极答:若不考虑超电势的影响,在电解NaCl的水溶液时,根据电极电势的大小,在阳极上首先析出的是氧气,而不是氯气;由于氯气的工业价值比氧气高,所以利用氧气在石墨上析出时有很大的超电势,而氯气在石墨上析出的超电势很小,所以用石墨作阳极,在阳极上首先析出的是氯气,而不是氧气,可以利用氯气作为化工原料;20.氢-氧燃料电池在酸、碱性不同的介质中,它们的电池反应是否不同在气体压力相同时,电池的电动势是否相同答:氢、氧燃料电池的电解质溶液可以是酸性,也可以是碱性,pH 在1~14的范围内,它们的电极反应虽不相同,但电池的净反应相同;在气体压力都等于标准压力时,其标准电动势都等于是 V;具体反应式和计算式如下:1 假定是pH 7<的酸性溶液负极,氧化 22H H H ()2H ()2e p a ++-→+ +2H|H 0 V E =正极,还原22O 2H 1O ()2H ()2e H O(l)2p a ++-++→ +22O |H O,H 1.229 V E =电池净反应 1 222H 2O 21H ()O ()H O(l)2p p +→当22H O p p p ==时,2 假定是pH 7>的碱性溶液负极,氧化 22H 2OH H ()2OH ()2H O(l)2e p a ---+→+正极,还原 22O 2OH 1O ()H O(l)2e 2OH ()2p a ---++→电池净反应 2 222H 2O 21H ()O ()H O(l)2p p +→当22H O p p p ==时,四.概念题参考答案1.按物质导电方式的不同而提出的离子型导体,下述对它特点的描述,哪一点是不正确的A 其电阻随温度的升高而增大B 其电阻随温度的升高而减小C 其导电的原因是离子的存在D 当电流通过时在电极上有化学反应发生 答:A;对于离型子导体,在温度升高时,离子的水合程度下降,溶液的黏度下降,电阻是变小的;2.使2000 A 的电流通过一个铜电解器,在1 h 内,能得到铜的质量是 A 10 g B 100 g C 500 gD 2 369 g答:D;用Faraday 定律计算可得3.在298 K 时,当 H 2SO 4溶液的浓度从 mol·kg -1 增加到 mol·kg -1时,其电导率k 和摩尔电导率m 的变化分别为 A k 减小 , m 增加 B k 增加 , m 增加 C k 减小 , m 减小 D k 增加 , m 减小答:D;强电解质溶液的电导率,随溶液浓度的增加而增加,因为电导率只规定了电解质溶液的体积,是单位立方体,浓度大了,导电离子多了,电导率当然要增加;但是摩尔电导率只规定了电解质的量是1 mol,电极间的距离是单位距离,但没有固定溶液的体积,所以随溶液浓度的增加,溶液体积变小,离子间相互作用增加,因而摩尔电导率减小;4.用同一电导池,分别测定浓度为 1 mol·kg -1和 2 mol·kg -1的两个电解质溶液,其电阻分别为 1000 和 500 ,则 1 与 2 的摩尔电导率之比为A 15∶B 5∶1C 105∶D 5∶10 答: B;根据摩尔电导率的定义, m cκ=Λ,cellK l GA Rκ==,cell K 称为电导池常数,同一电导池的电导池常数相同;所以电导率之比就等于电阻的反比,代入摩尔电导率的定义式,得5.有下面四种电解质溶液,浓度均为 mol·dm -3,现已按它们的摩尔电导率m 的值,由大到小排了次序;请判定下面正确的是A NaCl > KCl > KOH > HClB HCl > KOH > KCl > NaClC HCl > NaCl > KCl > KOHD HCl > KOH > NaCl > KCl 答:B ;这4种都是1-1价的强电解质,当溶液的浓度相同时,氢离子摩尔电导率最大,其次是氢氧根离子,因为氢离子和氢氧根离子是通过氢键导电的;钾离子的离子半径虽然要比钠离子的大,但是钾离子的水合程度小,所以钾离子的摩尔电导率还是比钠离子的大;6.2CaCl 的摩尔电导率与其离子的摩尔电导率之间的关系是A 2m 2m m (CaCl )(Ca )(Cl )∞∞+∞-=+ΛΛΛB 2m 2m m1(CaCl )(Ca )(Cl )2∞∞+∞-=+ΛΛΛ C 2m 2m m (CaCl )(Ca )2(Cl )∞∞+∞-=+ΛΛΛ D 2m 2m m (CaCl )2(Ca )(Cl )∞∞+∞-⎡⎤=+⎣⎦ΛΛΛ答: C;电解质的摩尔电导率与离子摩尔电导率之间关系的通式是在表示多价电解质的摩尔电导率时,为了防止混淆,最好在摩尔电导率的后面加个括号,写明所取的基本质点,防止误解;如 m 2 m 21(CaCl ), (CaCl )2∞∞ΛΛ,两者显然是倍数的关系;7.有4个浓度都是 mol·kg -1 的电解质溶液,其中离子平均活度因子最大 的是A KClB CaCl 2C Na 2SO 4D AlCl 3答:A ;按Debye-Hückel 极限定律,I z z A -+±-=γlg ,离子强度越大,平均活度因子越小;这里KCl 的离子强度最小,所以它的平均活度因子最大;8.下列电池中,哪个电池的电动势与Cl -的活度无关A Zn│ZnCl2aq│Cl2g│PtB Zn│ZnCl2aq‖KClaq│AgCls│AgC Ag│AgCls│KClaq│Cl2g│PtD Hg│Hg2Cl2s│KClaq‖AgNO3aq│Ag答:C;原则上应写出各个电池的反应,再决定电池的电动势与Cl-是否有关,这显然要化去不少时间;快速判断的方法是看电极反应,若正、负极的反应中都有Cl-,两个电极反应中的Cl-刚好可以消去,这样Cl-的活度与电池的电动势就无关,所以只有C符合条件;A和D只有一个电极反应有Cl-,不能对消;B中虽然用了ZnCl2aq,但这是一类电极,电极反应中不会出现Cl-,所以也不能对消;9.用对消法补偿法测定可逆电池的电动势,主要是为了A 消除电极上的副反应B 减少标准电池的损耗C 在可逆情况下测定电池电动势D 简便易行答:C;在用对消法测定电池的电动势时,外加了一个与电池的电动势大小相等、方向相反的工作电源,相当于外电路的电阻趋于无穷大,忽略电池内部的电阻,所得两个电极之间的电位降,可以近似作为电池的电动势;在测定时电路中几乎无电流通过,使极化现象可以忽略不计,所得的电动势可以近似作为可逆电池的电动势;10.若算得可逆电池的电动势为负值,表示此电池反应的方向是A 正向进行B 逆向进行C 不可能进行D 反应方向不确定答:B;电池电动势为负值,表明该电池是非自发电池,不能正向进行,而逆向反应是自发的;这种情况只能出现在书面表示中,就是将电池的正、负极排反了;在实验中若将正、负极接反了,就不可能形成对消线路,也就测不到电动势,能测到的电动势都是正值;11.某电池的电池反应为2+22OH 2Hg(l)O (g)2H O(l)2Hg 4OH ()a --++=+,在等温、等压下,当电池反应达平衡时,电池的电动势E 的值必然是 A E >0 B E E= C E <0 D E =0答: D ;在等温、等压下,电池反应达平衡时,Gibbs 自由能的变化值为零,即r m G ∆=0;因为r m G zEF ∆=-,所以电动势E 也必然等于零;12.某电池在298 K 、标准压力下可逆放电的同时,放出 100 J 的热量,则该电池反应的焓变r H ∆为: A r 100 J H ∆= B r 100 J H ∆> C r 100 J H ∆<- D r 100 J H ∆=-答:C ;因为在等温时,r r r G H T S ∆=∆-∆,可逆放电时放出的热量为r T S ∆,即R r 100 J Q T S =∆=-,r r 100 J G H ∆=∆+;电池能放电,说明是自发电池,r G ∆必定小于零,所以r H ∆必须小于100 J -;13.在等温、等压下,电池以可逆方式对外作电功时的热效应Q R 等于 A R r Q H =∆ B R pE Q zFT T ∂⎛⎫= ⎪∂⎝⎭ C R pE Q zEF T ∂⎛⎫=⎪∂⎝⎭ D R Q nEF = 答:B;因为R r Q T S =∆,r pE S zF T ∂⎛⎫∆=⎪∂⎝⎭所以只有B 是正确的;平时必须熟练记住电化学与热力学的各种联系公式,才能用电动势测定方法计算热力学函数的变化值;。
江苏师范大学《物理化学》作业指导第8章 电解质溶液

L(jk9)
l(jk9)
=
mnopp
l(jk9)q(jk9)
=
"T.TU
S·m; · mol("
6.66"×"6[ ×:?7
=4.27× 10(; S·m; · mol("
ΛK () =
L(stk9)
l(stk9)
=
mnopp
l(stk9)q(stk9)
=
"T.TU
6.66"×"6[ ×"u76
10(E S·m; · mol("
(
\
\
&
(;
Λ\
− 4.311 × 10(E ) S· m; · mol(" =
K ( Cl )= Λ K (NaCl) - Λ K ( Na ) = (1.0860 × 10
6.549× 10(E S·m; · mol("
14.在某电导池中先后充以浓度均为 0.001 mol · m(E 的 HCl, NaCl 和 NaNOE 溶液,
AgNO3 的摩尔电导率为
ΛK =
L
M
6.TE:E
=S6."×"6[V S·m; ·mol(" = 9.343 × 10(E S·m; ·mol("
(;
12.291 K 时,已知 KCl 和 NaCl 的无限稀释电导率分别为Λ\
K (KCl) =1.2965 × 10
(;
S·m; ·mol(" 和Λ\
26.有下列不同类型的电解质:①HCl;②MgCl2; ③CuSO4; ④LaCl3; ⑤Al2(SO4)3。设
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
流向负极。
负极: 电势低的极称为负极,电子从负极
流向正极。
教学ppt
7
阴极、阳极
阴极: 发生还原作用的极称为阴极。
在原电池中,阴极是正极;在
(Cathode)
电解池中,阴极是负极。
阳极: 发生氧化作用的极称为阳极。
(Anode)
在原电池中,阳极是负极;在
电解池中,阳极是正极。
(3)m (O 2)0.0183m ol1 4M (O 2) 0 .0 1 8 3m o l 1 3 2 .0g m o l 1 0 .1 4 6g 4
教学ppt
20
解2 若电极反应表示为
阴极 A u3+(aq)3e A u(s)
第八章 电解质溶液
电解
电能
电池
化学能
教学ppt
1
第八章 电解质溶液
§8.1 电化学中的基本概念和电解定律 §8.2 离子的电迁移率和迁移数 §8.3 电解质溶液的电导 §8.4 电解质的平均活度和平均活度因子 §8.5 强电解质溶液理论简介
教学ppt
2
§8.1 电化学中的基本概念和电解定律
1. 原电池和电解池 电化学主要是研究电能和化学能之间的相互
电解池
阳极上发生氧化作用
2 C laq C l2(g ) 2 e
阴极上发生还原作用
C u2aq2e C u(s)
教学ppt
10
在原电池中
负
负载电阻
正
极 eZn
极
Cu e -
e-
阳 Zn 2+ C u 2+ 阴
极
S
O
24
S
O
24
极
ZnSO4溶液 CuSO4溶液
Danill电池
阳离子迁向阴极 在阴极上发生还原的是
根据电学上的计量关系
I dQ/dt
t
Q 0 Idt
若电流强度是稳定的的,则
Q I t
教学ppt
17
例题:
通电于 Au(NO3)3 溶液,电流强度 I0.025A 阴极上析出 Au(s)=1.20g 已知 M (A u)=197.0gm ol1, M (O 2)32.0gm ol 1
求:⑴ 通入电荷量 Q
转化及转化过程中有关规律的科学。
电解
电能
化学能
电池
教学ppt
3
电化学的用途
⒈电解 精炼和冶炼有色金属和稀有金属 电解法制备各种化工原料、金属 复合材料和表面特种材料 电镀法保护和精饰金属 阳极钝化和氧化着色等
⒉电池 汽车、宇宙飞船、照明、通讯、生 化和医学等方面都要用不同类型的化学 电源。
⒊ 电化学分析 ⒋ 生物电化学
电解池
电极上的反应次序由 离子的活泼性决定
教学ppt
12
在电解池中, 都用铜作电极
-
- 电源 +
e-
+
e-
Cu
Cu
阳极上发生氧化作用
C u (s ,电 极 ) C u 2 a q 2 e
阴极上发生还原作用
C u2aq2e C u(s)
CuSO4
电解池
电极有时也可发生反应
教学ppt
13
Faraday电解定律
19
解1 若电极反应表示为
阴极
1Au3+e 1Au(s)
3
3
阳极
1 2H2O(l) 1 4O2(g)H+e
( 1 ) Q z F 1 9 6 5 0 0 C m o l 1 0 . 0 1 8 3 m o l = 1 7 6 6 C
(2 )tQ I0 .1 0 7 2 6 56 C C s 17 .0 6 1 0 4s
Faraday 归纳了多次实验结果,于1833
年总结出了电解定律
⒈ 在电极界面上发生化学变化物质的量与 通入的电荷量成正比。 ⒉ 通电于若干个电解池串联的线路中,当 所取的基本粒子的荷电数相同时,在各个电 极上发生反应的物质,其物质的量相同,析 出物质的质量与其摩尔质量成正比。
教学ppt
14
人们把在数值上等于1 mol元电荷的电量称为 Faraday常数。
出1 mol M(s),即反应进度为1 mol 时,需通入的电
量为 Q
Q(1) z+eLz+F
若反应进度为 时需通入的电量为
Q() z+F
若通入任意电量Q时,阴极上沉积出金属B的物
质的量 n B 和质量 m B 分别为:
教学ppt
16
nB
Q z+F
Q mB z+F MB
这就是Faraday电解定律的数学表达式
C u2aq2e C u(s)
阴离子迁向阳极 在阳极上发生氧化的是
Z ns Z n2(aq)2e
教学ppt
11
在电解池中, 用惰性电极
-
- 电源 +
e-
+
e-
Pt
Pt
阳极上发生氧化作用
2 H 2 O l O 2 (g ) 4 H 4 e
阴极上发生还原作用
2H aq2e H 2(g)
Na2SO4
⑵ 通电时间 t
⑶ 阳极上放出氧气的质量
教学ppt
18
解1 阴极 阳极
若电极反应表示为
1Au3+e 1Au(s)
3
31 2H2O(l) Fra bibliotek 4O2(g)H+e
析出1.20g Au(s)时的反应进度为
1.20g 1.20g 0.0183m ol
M (1A u) 1197.0gm ol-1 33
教学ppt
已知元电荷电量 e 为 1.60221019C
FLe 6 .0 2 2 1 0 2 3 m o l 1 .6 0 2 2 1 0 1 9 C 96484.6C m ol 1 96500C m ol1
教学ppt
15
如果在电解池中发生如下反应:
M z z e M ( s ) 电子得失的计量系数为 z+,欲从阴极上沉积
第二类导体的特点是: A. 正、负离子作反向移动而导电 B. 导电过程中有化学反应发生 C. 温度升高,电阻下降 D. 导电总量分别由正、负离子分担
*固体电解质,如 AgBr、PbI2 等,也属于离子 导体,但它导电的机理比较复杂,导电能力不高, 本章以讨论电解质水溶液为主。
教学ppt
6
正极、负极
教学ppt
8
在电解池中
阳离子迁向阴极,在 阴极上发生还原作用
-
- 电源 +
e-
+
e-
阴
阳
极
极
电解质溶液
C a tio n C a th o d e
阴离子迁向阳极,在 阳极上发生氧化作用
A n io n A n o d e
电解池
教学ppt
9
在电解池中
-
- 电源 +
e-
+
e-
阴
阳
极
极
C uC l2
教学ppt
4
能导电的物质称为导电体,通常分为两类: 第一类导体又称电子导体,如金属、石墨等 第一类导体的特点是:
A. 自由电子作定向移动而导电 B. 导电过程中导体本身不发生变化 C. 温度升高,电阻也升高 D. 导电总量全部由电子承担
教学ppt
5
第二类导体又称离子导体,如电解质溶液、熔融电 解质等
