大一无机化学期末考试试题
《无机化学》期末考试试卷

《无机化学》期末考试试卷一、单选(共40小题,每题2分,共80分。
)(题下选项可能多个正确,只能选择其中最佳的一项。
)1.下列溶液中与血浆等渗的是:() [单选题] *A.90g/L的NaCl溶液B.9g/L的NaCl溶液(正确答案)C.100g/L的葡萄糖溶液D.50g/L的NaHCO3溶液E.20g/L的乳酸钠溶液2.下列溶液能使红细胞发生皱缩的是:() [单选题] *A.1.5g/L的NaHCO3溶液B.1.0 g/L的NaCl溶液C.9g/L的NaCl溶液D.100g/L的葡萄糖溶液(正确答案)E.20g/L的乳酸钠溶液3.欲使半透膜两侧的溶液不发生渗透现象的条件是:() [单选题] *A.两溶液酸度相等B.两溶液体积相等C.两溶液的物质的量浓度相等D.两溶液的渗透浓度相等(正确答案)E.两溶液温度一致4.配制300ml、0.10mol/L的NaOH溶液,需要称取固体NaOH(M=40)的质量为:() [单选题] *A.1.2g(正确答案)B.1.2mgC.4.0gD.4.0mgE.40g5.在下列单位中,哪一个是物质的量浓度的单位:() [单选题] *A.g·LB.g·molC.g·mLD.mol·L(正确答案)E.16.对于物质的体积分数,下列表示正确的是:() [单选题] *A.φ=VB/V(正确答案)B.ρ=mB/VC.wB=mB/mD.CB= nB/VE.E.xB=mB/M7.在生活中,常用75℅酒精消毒,这个浓度是指:() [单选题] *A.物质的量浓度B.质量浓度C.体积分数(正确答案)D.质量分数E.摩尔质量浓度8.溶液、胶体和悬浊液这三种分散系的根本区别是() [单选题] *A.是否是大分子或离子的聚集体B.能否透过滤纸或半透膜C.是否均匀、稳定、透明D.分散质微粒直径的大小(正确答案)E.没有区别9.胶粒稳定的主要原因是:() [单选题] *A.布朗运动B.胶粒带电(正确答案)C.溶剂化膜D.丁达尔现象E.渗透现象10.某可逆反应的正反应为吸热反应,欲使平衡向逆反应方向移动,可采取的措施是:() [单选题] *A.升高温度B.降低温度(正确答案)C.加催化剂D.加压E.减压11.有关催化剂的叙述不正确的是() [单选题] *A.能改变化学反应的历程B.能降低反应的活化能C.能使不反应的物质相互发生反应(正确答案)D.反应前后质量没有发生变化E.催化作用是化学作用12.增加气体反应物的压强能加快化学反应速率的原因是() [单选题] *A.增加了反应体系内分子总数B.增加了反应体系内活化分子数C.降低了化学反应的活化能D.增加了单位体积的活化分子数(正确答案)E.减少了单位体积的活化分子数13.一些药物需要保存在冰箱中,以防其变质,其主要作用是() [单选题] *A.避免与空气接触B.保持药物干燥C.避免药物受光照D.降低温度,减缓药物变质的反应速率(正确答案)E.以上都不对14.若用NH3和HCl来配置缓冲溶液,缓冲溶液的抗碱成分是:() [单选题] *B.HClC.NH4Cl(正确答案)D.NH3E.OH-15.人体血液中最重要的缓冲对的抗酸成分是:() [单选题] *A.H3PO4B.H2PO4-C.HCO3-(正确答案)D.H2CO3E.H2O16.正常人血浆的pH范围是:() [单选题] *A.7~8B.7~7.5C.7.5~8D.7.45~7.55E.7.35~7.45(正确答案)17.下列化合物中,属于两性物质的是:() [单选题] *A.HClB.NaOHC.H2O(正确答案)D.NH4Cl18.根据酸碱质子理论,下列叙述不正确的是:() [单选题] *A.H2CO3和CO32-不是共轭酸碱对B.酸越强,其共轭碱也越强(正确答案)C.酸失去质子转变成共轭碱D.酸碱反应的实质是质子的转移E.碱得到质子生成其共轭酸19.当pH=4的时候,则 [H+]的浓度为:() [单选题] *A.5B.104C.10-4(正确答案)D.4E.1020.下列酸中,属于一元弱酸的是:() [单选题] *A.HAc(正确答案)B.H2CO3C.H3PO4D.H3BO3E.H2SO321.同离子效应将使弱电解质的电离平衡:() [单选题] *A.左移(正确答案)C.不移动D.无法确定E.以上都对22.室温下,1.0mol/L氨水中,水的离子积常数为() [单选题] *A.1.0×10-10B.1.0×10-4C.1.0×10-14(正确答案)D.1.0×10-7E.2.0×10-723.下列溶液中酸性最强的是() [单选题] *A.pH=5B.pH=2C.[H+]=0.1mol/L(正确答案)D.[OH-]=10-2mol/LE.[OH-]=10-7mol/L24.在含有CrO42-和Cl-的混合溶液中加入AgNO3溶液,先有白色沉淀生产,后有砖红色沉淀生成,这种现象称为:() [单选题] *A.分步沉淀(正确答案)B.沉淀的生成C.沉淀是转化D.沉淀的溶解E.以上都不对25.在AgCl饱和溶液中加入NaCl,使其溶解度减小的现象称为() [单选题] *A.盐效应B.同离子效应(正确答案)C.缓冲效应D.配位效应E.沉淀效应26.沉淀生成的必要条件是() [单选题] *A.Ip>Ksp(正确答案)B.加入强电解质C.加入与难溶强电解质具有相同离子的盐D.Ip<KspE.加入氧化剂或还原剂27.下列化合物中,S的氧化数为+4的是:() [单选题] *A.H2SB.Na2S2O3C.Na2SO3(正确答案)D.Na2SO4E.S28.在原电池中, 发生氧化反应的是:() [单选题] *A.正极B.负极(正确答案)C.正极和负极D.正极或负极E.以上都对29.13号元素在元素周期表的位置是:() [单选题] *A.4周期ⅠA族B.4周期ⅡA族C.3周期ⅢA族(正确答案)D.4周期ⅥA族E.4周期ⅢA族30.某元素处在元素周期表的第三周期,该元素原子的电子层数为:() [单选题] *A.1B.2C.3(正确答案)D.4E.531.水的沸点“反常”,这是由于分子间存在着:() [单选题] *A.范德华力B.共价键C.氢键(正确答案)D.离子键E.E.配位键32.配合物中特征化学键是:() [单选题] *A.离子键B.共价键C.配位键(正确答案)D.氢键E.化学键33.下列盐中,难溶于水的是:() [单选题] *A.Ca(HCO3)2B.CaCO3(正确答案)C.Na2CO3D.(NH4)2CO3E.NH4Cl34.下列物质中,不能用做消毒剂的是:() [单选题] *A.氯水B.臭氧C.双氧水D.蒸馏水(正确答案)E.都不能做消毒剂35.H2O2不具备的性质是:() [单选题] *A.氧化性B.还原性C.不稳定性D.酸性E.既没有氧化性也没有还原性(正确答案)36.下列物质中与Cl2 作用能生成漂白粉的是:() [单选题] *A.CaCO3B.CaSO4C.Mg(OH) 2D.Ca(OH) 2(正确答案)E.MgSO437.下列化学药品在实验室常作氧化剂的是:() [单选题] *A.硫酸铜B.活泼金属C.高锰酸钾(正确答案)D.氯化钠E.水38.用自来水养金鱼时,通常先将自来水日晒段时间后,再注入鱼缸,其目的是()[单选题] *A.利用紫外线杀死水中的细菌B.提高水温,有利于金鱼生长C.增加水中氧气的含量D.促进水中的次氯酸分解(正确答案)E.以上说法均不正确39.下列关于Al(OH) 3性质的叙述错误的是() [单选题] *A.Al(OH) 3是两性的,其酸性与碱性相当B.可溶于酸C.Al(OH) 3是两性的,其酸性弱于碱性(正确答案)D.可溶于过量的强碱E.Al(OH) 3是碱性的40.参与构成人体和维持机体正常生理功能的元素称为:() [单选题] *A.人体微量元素B.人体常量元素C.人体必需元素(正确答案)D.人体有益元素E.人体有害元素二、是非(共10小题,每题1分,共10分。
大一无机化学期末考试试题精选[1]1
![大一无机化学期末考试试题精选[1]1](https://img.taocdn.com/s3/m/0c6a94367fd5360cbb1adb17.png)
(√ ) 1. 电子云是描述核外某空间电子出现的几率密度的概念。
(√)2. 同种原子之间的化学键的键长越短,其键能越大,化学键也越稳定。
(√)3.系统经历一个循环,无论多少步骤,只要回到初始状态,其热力学能和焓的变化量均为零。
(√)4. AgCl在NaCl溶液中的溶解度比在纯水中的溶解度小。
(×)5. 原子轨道的形状由量子数m决定,轨道的空间伸展方向由l决定。
(1)某元素原子基态的电子构型为1s22s22p63s23p5,它在周期表中的位置是:aa.p区ⅦA族 b.s区ⅡA族c.ds区ⅡB族 d.p区Ⅵ族(2)下列物质中,哪个是非极性分子:ba.H2O b.CO2 c.HCl d.NH3(3)极性共价化合物的实例是:ba.KCl b.HCl c.CCl4 d.BF3(4)下列物质凝固时可以形成原子晶体的是:ca. O2b. Pt,c. SiO2d. KCl(5)在298K,100kPa下,反应2H2(g)+O2(g)=2H2O(1) Δr H mΘ= -572 kJ·mol-1则H2O(l)的Δf H mΘ为:da.572 kJ·mol-1 b.-572 kJ·mol-1c.286 kJ·mol-1 d.-286 kJ·mol-1(6)定温定压下,已知反应B=A的反应热为Δr H m1Θ,反应B=C的反应热为Δr H m2Θ,则反应A=C的反应热Δr H m3Θ为:da.Δr H m1Θ+Δr H m2Θ b.Δr H m1Θ-Δr H m2Θc.Δr H m1Θ+2Δr H m2Θ d.Δr H m2Θ-Δr H m1Θ(7)已知HF(g)的标准生成热Δf H mΘ= -565 kJ·mol-1,则反应H2(g)+F2(g)=2HF(g)的Δr H mΘ为:d a.565 kJ·mol-1 b.-565 kJ·mol-1c.1130 kJ·mol-1 d.-1130 kJ·mol-1(8)在氨水溶液中加入固体NH4Cl后,氨水的离解度:da.没变化 b.微有上升 c.剧烈上升 d.下降(9)N的氢化物(NH3)的熔点都比它同族中其他氢化物的熔点高得多,这主要由于NH3:ca .分子量最小b .取向力最强c .存在氢键d .诱导力强(10)在一定条件下,一可逆反应其正反应的平衡常数与逆反应的平衡常数关系是:ca .它们总是相等b .它们的和等于1c .它们的积等于1d .它们没有关系(11)下列反应及其平衡常数H 2 (g)+S(s)=H 2S(g) K 1Θ;(g)SO (g)O S(s)22=+ K 2Θ,则反应S(g )H (g )O (g )SO (g )H 2222+=+的平衡常数K Θ是:da. K 1Θ+K 2Θ b .K 1Θ- K 2Θ c .K 1Θ×K 2Θ. d .K 1Θ÷K 2Θ(12)在298K 时石墨的标准摩尔生成焓Δf H m Θ为:ca .大于零b .小于零c .等于零d .无法确定(13)不合理的一套量子数(n ,l ,m ,m s )是:b a .4,0,0,21+b .4,0,-1,21- c .4,3,+3,21- d .4,2,0,21+ (14)向HAc 溶液中,加入少许固体物质,使HAc 离解度减小的是:ba .NaClb .NaAc c .FeCl 3d .KCN(15)3NH 溶于水后,分子间产生的作用力有:da .取向力和色散力b .取向力和诱导力c .诱导力和色散力d .取向力、色散力、诱导力及氢键(16)25℃时,Mg(OH)2的K sp Θ为1.2×10-11,在0.01mol · L -1的NaOH 溶液中的溶解度为:ca .1.2×10-9 mol · L -1 b .2.4×10-9 mol · L -1 c .1.2×10-7 mol · L -1 d .1.7×10-5 mol · L -1 (17)已知 E Θ(Fe 3+/Fe 2+) = 0.770V ,E Θ(Cu 2+/Cu)=0.340V ,则反应2Fe 3+(1mol ·L -1)+Cu =2Fe 2+(1mol · L -1) + Cu 2+(1mol · L -1)可以:ba .呈平衡状态b .自发正向进行c .自发逆向进行d .前三者都错(18)已知Fe 3++e = Fe 2+,E Θ= 0.770V ,测定一个Fe 3+/Fe 2+电极电势E= 0.750 V ,则溶液中必定是:da .c (Fe 3+)<1b .c ( Fe 2+)<1c .c ( Fe 2+)/ c (Fe 3+)<1d .c (Fe 3+)/ c ( Fe 2+)<1(19)角量子数l 描述核外电子运动状态的:ca .电子能量高低;b .电子自旋方向;c .电子云形状;d .电子云的空间伸展方向;(20)以下各组物质可做缓冲对的是:aa .HCOOH —HCOONab .HCl 一NaClc .HAc —H 2SO 4d .NaOH —NH 3·H 2O1. 写出具有下列指定量子数的原子轨道符号:A. n=4,l=1____4p________B. n=5,l=2 ______5d______2. 写出下列原子在基态时的电子排布(1). Mn: 1s 22s 22p 63s 23p 63d 54s 2; (2). Fe___1s 22s 22p 63s 23p 63d 64s 2;3. 等性sp 2、sp 3杂化轨道的夹角分别为__120_____._109.5____.4. 在定温定压下已知反应A=3B 的反应热为Δr H m1Θ,反应3A=C 的反应热为Δr H m2Θ,则反应9B=C 的反应热Δr H m3Θ为( Δr H m2Θ- 3Δr H m1Θ )。
大学《无机化学》期末复习题库及答案

第1章气体一、单选题1、某气体AB,在高温下建立下列平衡∶AB(g)==A(g)+B(g).若把1.00mol此气体在T=300K,P=101 kPa下放在某密闭容器中,加热到600K时,有25.0%解离。
此时体系的内部压力(kPa)为( )A.253 B.101 C.50.5 D.1262、一敞口烧瓶在7℃时盛满某种气体,欲使1/3 的气体逸出烧瓶,需加热到()A.100℃B.693 ℃C.420 ℃D.147 ℃3、实际气体和理想气体更接近的条件是( )A.高温高压 B. 低温高压 C. 高温低压 D. 低温低压4、A,B两种气体在容器中混合,容器体积为V,在温度T下测得压力为P,V A ,V B 分别为两气体的分体积,P A ,P B 为两气体的分压,下列算式中不正确的一个是( )A. PV A = n A RTB. P A V A =n A RTC. P A V= n A RVD. P A (V A+V B )= n A RT,在一定温度下发生反应:5、某容器中加入相同物质的量的NO和Cl2NOCl(g)。
平衡时,各物种分压的结论肯定错误的是NO(g)+1/2Cl2()) B. P(NO)=P(NOCl)A. P(NO)=P(Cl2) D. P(NO)>P(NOCl)C. P(NO)<P(Cl26、The height of a column of liquid supported by atmospheric pressure is inversely proportional to the density of the liquid. Mercury has a density of 13.6 g/mL. How high a column of water (density = 1.00g/mL) would be supported by an atmospheric pressure of 0.876 atm? ( )A. 9.05×103 mmB. 1.03×104 mmC. 49.0 mm7、If you purchase a balloon filled with helium and take it outside on a cold day, you will notice that it shrinks and becomes less buoyant. What gas law explains this observation? ( )A. Boyle'sB. Charles'sC. Avogadro'sD. Graham's8、A sample of gas occupies 10.0 L at 50°C. Assuming that pressure is constant, what volume will the gas occupy at 100°C?( )A. 10.0 LB. 20.0 LC. 11.5 LD. 5.0 L9、What is the Charles's law constant (in L/K) for 200 mg of carbon dioxide at 600 mm pressure? ( )A. 4.73 10–4 L/KB. 5.64 10–3 L/KC. 42.0 L/KD. 2.11 103 L/K10、At a given temperature and pressure, which gas occupies the smallest volume per unit mass? ( )A O2B. ArC. CO2D. Xe11、At what temperature (in °C) will 25.0 g of carbon dioxide (at1.00 atm) occupy. ( )A. 188°CC. –263°CD. –270°C12、What is the molar mass of a gas that has a density of 3.11 g/L at 100°C and 1.50 atm pressure? ( )A. 0.152 g/molB. 95.2 g/molC. 17.0 g/molD. 63.5 g/mol13、What volume of Ngas would be produced by the decomposition of2solid? (Assume that the gas is produced at 1.00 atm35.0 g NaN3pressure and 150°C.)( )A 28.0 LB. 9.95 LC. 18.7 LD. 56.1 L14、At what temperature would CO2 gas have the same average molecular speed as O2 gas has at 400 K? ( )A. 250 KB. 550 KC. 400 KD. 600K15、How much faster does nitrogen escape from the balloon than oxygen? ( )A. 1.07 times fasterB. 1.14 times fasterC. 0.875 times as fastD. 0.935 times as fast二、判断题(判断下列各项叙述是否正确,对,打“√”;错,打“×”。
无机化学期末考试试卷

无机化学期末考试试卷一、选择题(每题2分,共20分)1. 以下哪种元素的原子半径最大?A. 锂(Li)B. 钠(Na)C. 钾(K)D. 铯(Cs)2. 根据周期表,元素的电子排布遵循哪个原则?A. 能量最低原理B. 洪特规则C. 泡利不相容原理D. 所有上述原则3. 以下哪种化合物不属于共价化合物?A. H2OB. CO2C. NaClD. CH44. 什么是离子键?A. 原子之间通过电子共享形成的化学键B. 原子之间通过电子转移形成的化学键C. 原子内部的化学键D. 分子内部的化学键5. 以下哪种物质是强酸?A. 醋酸B. 碳酸C. 硫酸D. 氢氧化钠二、填空题(每空1分,共10分)6. 根据奥斯特瓦尔德规则,当一个物质溶解在溶剂中时,其溶解度随着温度的升高而________。
7. 金属晶体中的原子排列方式通常是________。
8. 氧化还原反应中,失去电子的物质被称为________。
9. 根据路易斯理论,一个化合物的路易斯碱是________。
10. 一个化合物的路易斯酸是________。
三、简答题(每题10分,共20分)11. 描述什么是配位化合物,并给出一个例子。
12. 解释什么是酸碱中和反应,并给出一个化学方程式。
四、计算题(每题15分,共30分)13. 给定一个化学反应:2H2 + O2 → 2H2O,计算在标准条件下(0°C,1 atm)1摩尔氢气完全反应所需的氧气摩尔数。
14. 假设你有一个含有0.25摩尔硫酸(H2SO4)的溶液,硫酸的摩尔质量是98.079 g/mol。
计算溶液中硫酸的质量。
五、论述题(共20分)15. 论述金属和非金属元素在周期表中的分布规律,并解释为什么这些规律存在。
六、实验题(共10分)16. 描述如何使用滴定法测定一个未知浓度的盐酸溶液的浓度。
七、结束语请注意,本试卷仅供学习和练习使用,实际考试内容和形式可能会有所不同。
希望同学们通过本试卷能够更好地复习和掌握无机化学的相关知识。
无机化学期末习题

期末考试习题一、单项选择题1、根据下列反应:2FeCl3 + Cu→2FeCl2 + CuCl2;2Fe3+ + Fe→3Fe2+ MnO4- + 5Fe2+ + 8H+ →Mn2+ + 5 Fe3+ +4H2O;电极电势最大的电对是()A、Fe3+/ Fe2+B、Cu 2+/ CuC、MnO4-/ Mn2+D、Fe2+/Fe2、AgCl在下列溶液中(浓度均为1mol.L-1)溶解度最大的是()A、氨水B、Na2S2O3C、KID、NaCN3、依据稀释定律,判断在弱电解质溶液中下列说法正确的是()A、在某温度下,浓度c越大,K i增大,则a不变B、在某温度下,浓度c越大,K i不变,则a减小C、在某温度下,浓度c不变,K i增大,则a增大D、在某温度下,浓度c减小,K i减小,则a不变4、在实验室中欲配制FeCl2溶液,为防止Fe2+被空气氧化应加入()A、Sn粒B、Ag片C、Fe屑D、不能处理5、下列四量子数中,用来描述原子轨道在空间的伸展方向的是()A.n B.l C.m D.m s6、在1L的容器中含有某反应物4.0mol,经过2S后,该反应还剩下2.0mol,则此反应的速率是()A、3.0mol/(L·S)B、1.5mol/(L·S)C、1.0mol/(L·S)D、0.5mol/(L·S)7.某弱酸HA 的K=1×10-5,则其0.1 mol·L-1溶液的pH值为aA. 1.0B. 2.0C. 3.0D.3.58.下列水溶液pH最小的是()。
A.NaHCO3 B.NaCO3 C.NH4Cl D.NH4Ac9.下列关于氧化值的叙述中,不正确的是( )A. 单质的氧化值为0B. 氧的氧化值为-2C. 在多原子分子中,各元素的氧化值的代数和等于0D. 氧化值可以是整数或分数10、乙二胺四乙酸(EDTA)与金属离子形成螯合物时,配位原子是()A、N原子B、O原子C、N原子和O原子D、N原子和C原子11、下列化合物的水溶液浓度均为0.10mol·L-1,其中pH最低的是()。
大学无机化学期末试卷及答案.doc

《无机化学》试题学号:姓名:座号:系别:年级:专业:总分合计人:复核人:一、单项选择题(在每小题列出的四个选项中只有一个选项是符合题目要求的,请选出正确选项并在“答题卡”的相应位置上涂黑。
多涂、少涂、错误均无分。
每小题1分,共40分)1、对于Zn2+/Zn电对,增大Zn2+的浓度,则其标准电极电势将()A 增大B 减小C 不变D 无法判断2、Cu2+离子的外层电子构型为()A 8eB 18e型C 18+2eD 9~17e型3、设氨水的解离平衡常数为K。
浓度为m mol·L-1的氨水溶液,b若将其用水稀释一倍,则溶液中OH-的浓度(mol·L-1)为()Am 21 B θb K m ⋅21 C 2/m K b ⋅θD 2m4、已知θsp K (Ag 3PO 4) = 1.4×10-16,其溶解度为 ( )A 1.1×10-4mol·L -1;B 4.8×10-5mol·L -1;C 1.2×10-8mol·L -1;D 8.3×10-5mol·L -15、下列各组物质,能自发发生反应的是 ( )A Cu 、Cu 2+;B Cr 2O 72-、Cr 3+;C MnO 2、Mn 2+;D SnCl 4、Sn 6、3d轨道的磁量子数可能是( )A 1,2,3B 0,1,2C 0,±1D 0, ±1, ±27、下列各分子中,以sp 3不等性杂化轨道成键的是 ( )A BeCl 2B PCl 3C BF 3D SiH 48、熔化下列晶体时,只需克服色散力的是 ( )A HFB AgC KFD CO 29.已知V E A /θ:Cr 2O 72- +1.36 Cr 3+ -0.41 Cr 2+ -0.86 Cr ,则判断发生歧化反应的是 ( )A 都不能B Cr 2O 72-C Cr 3+D Cr 2+ 10.下列各物质中,熔点最高的是()A K2OB MgOC CaOD Na2O11稀溶液依数性的本质是()A. 渗透压B. 沸点升高C. 蒸汽压下降D. 凝固点降低12要降低反应的活化能,可以采取的手段是( )A. 升高温度B. 降低温度C. 移去产物D. 使用催化剂13如果一个反应的吉布斯自由能变为零,则反应( )A. 能自发进行B. 是吸热反应C. 是放热反应D. 处于平衡状态14.反应A + B C,焓变小于零,若温度升高10℃,其结果是( )A.对反应没有影响B. 使平衡常数增大一倍C.不改变反应速率D.使平衡常数减小15.在HAc-NaAc缓冲溶液中,若[HAc]>[NaAc],则该缓冲溶液()A.抗酸能力强于抗碱能力B.抗酸能力弱于抗碱能力C.抗酸能力等于抗碱能力D.无法判断16.在室温下,0.0001mol.L-1NH3水溶液中的pKw是()A. 14B. 10C.4D.817.按酸碱质子理论考虑,在水溶液中既可作酸亦可作碱的物质是( )A.Cl-B. NH4+C. HCO3-D. H3O+18.AgCl在纯水中溶解度比0.10 mol·L-1 NaCl溶液中(AgCl: K sp = 1.77×10-10 ) ( )A.大B.小C.一样大D.无法判断19.CaSO4在0.1mol.L-1NaNO3溶液中的溶解度比在纯水中( )A.略有减小B.略有增加C.相等D.无法判断20.已知:Ksp,AgCl=1.8×10-10,Ksp,Ag2CrO4=1.1×10-12在等浓度的CrO42-和Cl-的混合溶液中,逐滴加入AgNO3时:()A.先产生AgCl↓B.先产生Ag2CrO4↓C.两种同时沉淀D.两者都不沉淀21.在酸性溶液中,当适量的KMnO4与Na2SO3反应时出现的现象是()A. 棕色沉淀B. 紫色褪去C.绿色溶液D.都不对22.下列电对中值最大的是( )A. (Ag+/Ag) B. (Ag(NH3)2+/Ag) C. (AgCl /Ag) D. (AgI/Ag)23.当pH = 10 时,氢电极的电极电势是- ( )A.-0.59 VB. -0.30 VC. 0.30 VD. 0.59 V24.4s电子的径向分布图有: ( )A.3个峰B.2个峰C.4个峰D.1个峰25.属于主量子数n= 3 的一个电子的四个量子数n,l,m,m s 取值正确的是( )A. 3,2,1,0B.3,2, -1,C. 3,3,1,D. 3,1, 2,26.量子力学中所说的原子轨道是指( )A.波函数ψn,l,m,ms B.电子云C.波函数ψn,l,m D.概率密度27.ψ(4,2,1)代表简并轨道中的一个轨道是( )A.4p轨道B.4d轨道C.4s轨道D.4f轨道28.下列轨道上的电子,在xy平面上的电子云密度为零的是()A.3S B.3P x C.3Pz D.3Py29.某元素原子基态的电子构型为[Ar] 3d 8 4s2 ,它在元素周期表中的位置是()A.s区B.p区C.d区D.f区30. Ag的价电子层结构是()A.3d 10 4s1 B.3d 9 4s2C.4d 10 5s1D.4d 10 4s2 31下列分子和离子中中心原子成键轨道不是sp2 杂化的是( )A.BF3 B.HCHO C.C2H4 D.NH332按分子轨道理论,O2的键级是-( )A.1 B.1C.2D.233.下列各分子中,偶极矩为零的分子为( )A.H2 O B.NH3 C.BF3 D.HCl34.下列化合物中没有氢键的是( )A.C2H4B.NH3C.HFD.H2O35.NH3中N原子采取的杂化方式是:()A. SP2B. SP3等性C. SP2dD. SP3不等性36.[Ni(en)3]2+离子中镍的价态和配位数是( )A .+2,3B . +3,6C . +2,6D . +3,3 37. Fe(Ⅲ)形成的配位数为 6 的外轨配合物中,Fe 3+离子接受孤对电子的空轨道是 ( )A .d 2sp 3B . sp 3d 2C .p 3d 3D . sd 5 38.能够用于鉴定Fe 3+的特效试剂有( )A.KSCNB. HClC. 邻二氮菲D. 赤血盐39.在热碱性溶液中,次氯酸根离子不稳定,它的分解产物是 ( )A .Cl -和Cl 2 B .Cl -和ClO 3-C .Cl -和ClO 2-D .Cl -和ClO 4- 40.在温度T 和压力p 时理想气体反应:(ⅰ)2H 2O(g)=2H 2(g)+O 2(g)θ1K ;(ⅱ)CO 2(g)=CO(g)+1/2O 2(g)θ2K 则反应:(ⅲ)CO(g)+H 2O(g)=CO 2(g)+H 2(g)的θ3K 应为( ) A θθθ213/K K K = , B θθθ213K K K ⋅= ,C θθθ213/K K K =,D θ3K =θ1K +θ2K二、判断题(判断正确答案,选项并在“答题卡”的相应位置填涂,认为正确的涂“A”错误的涂“B ”。
《无机化学》期末考试试卷附答案

《无机化学》期末考试试卷附答案一、单选(共20小题,每小题3分,共60分)1、在标准状态下, 1.0 dm3氢气的质量应为()A、0.089 gB、0.11 gC、9.0 gD、11.2 g2、扩散速率三倍于水蒸气的气体是()A、HeB、H2C、CO2D、CH43、欲配制 pH = 13.00 的溶液 10.0 dm3, 所需 NaOH 固体的质量是()(相对原子质量: Na 23 )A、 40 gB、 4.0 gC、 4.0×10-11 gD、 4.0×10-12 g4、有一种称“墨海”的带盖砚台,其结构如图所示,当在砚台中加入墨汁,在外圈加入清水,并盖严,经过足够的时间,开盖看到的情况是()A、砚中墨汁干枯,外圈水成淡墨B、砚中墨汁变淡,外圈水成淡墨,且二者浓度相同C、砚中墨汁变淡,外圈水干枯D、没有发生变化5、下列说法正确的是()A、当液体与其蒸气处于平衡时,蒸气的压力称为液体的饱和蒸气压B、液体混合物的蒸气压等于各纯组分液体的蒸气压之和C、非电解质稀溶液中某一液体组分的蒸气分压等于它在相同温度下的饱和蒸气压与其在溶液中的摩尔分数之积D、蒸气压的大小与容器体积的大小有关6、已知:2H2(g) + S2(g)2H2S(g) K p12Br2(g) + 2H2S(g)4HBr(g) + S2(g) K p2H2(g) + Br2(g)2HBr(g) K p3则K p3 等于()A、(K p1 / K p2 )1/2B、(K p2·K p1)1/2C、K p2 /K p1D、K p2·K p17、氢硫酸电离常数K1 = 1 ⨯ 10-7,K2 = 1 ⨯ 10-13,在0.1 mol·dm-3 H2S水溶液中溶液的pH值是()A、10-2B、 2C、 3D、48、用0.20 mol·dm-3 HAc和0.20 mol·dm-3 NaAc溶液直接混合(不加水),配制1.0 dm3pH = 5.00的缓冲溶液,需取0.20 mol ·dm -3HAc 溶液为( ) (p K a (HAc) = 4.75)A 、6.4 ⨯ 102cm 3B 、6.5 ⨯ 102 cm 3C 、3.5 ⨯ 102cm 3 D 、3.6 ⨯ 102cm 39、钒的电势图为 1.000.360.25()()()()VVVV V V IV V III V II ++-已知: ϕ(Zn 2+/Zn) = -0.76 V , ϕ(Sn 4+/Sn 2+) = +0.15 Vϕ(Fe 3+/Fe 2+) = +0.77 V , ϕ(S/H 2S) = +0.14 V欲将V(V) 还原到V(IV),在下列还原剂中应选用( ) A 、FeSO 4 B 、Zn C 、SnCl 2 D 、H 2S10、对于下面两个反应方程式,说法完全正确的是( )2Fe 3+ + Sn 2+Sn 4+ + 2Fe 2+Fe 3+ + 21Sn2+21Sn 4+ + Fe 2+A 、两式的 E ,m r G ∆,K C 都相等 B 、两式的 E , m r G ∆,K C 不等 C 、两式的 m r G ∆相等, E ,K C 不等 D 、两式的 E 相等, m r G ∆,K C 不等11、铅蓄电池在充电时,阳极反应是( )A 、PbSO 4 + H 2O =PbO 2 + 4H ++ SO -24+ 2e -B 、Pb + SO -24= PbSO 4+ 2e -C 、PbSO 4+ 2e -= Pb + SO -24D 、PbO 2+ 4H ++ SO -24+ 2e -= PbSO 4 + 2H 2O12、已知金属 M 的下列标准电极电势数据:( )(1) M 2+ (aq) + e - =M +(aq)1ϕ= -0.60 V(2) M 3+(aq) + 2e -= M +(aq)2ϕ= 0.20 V 则M 3+(aq) + e -= M 2+ (aq) 的ϕ是A 、0.80 VB 、-0.20 VC 、-0.40 VD 、1.00 V13、对于一个一级反应,如其半衰期t 1/2在0.0100 s 以下即称为快速反应,此时它的速率常数k 值在( )A 、 69.3 s -1以上 B 、6.39 s -1以上 C 、0.0693 s -1以上D 、6.39 s -1以下14、反应2A −→−B 为二级反应,若A 的起始浓度为1.00 mol ·dm -3,在开始反应1 h 之后减少了一半,那么2 h 后,A 的浓度将为( ) A 、 0.125B 、0.333C 、0.250D 、0.49115、在各种不同的原子中3d 和4s 电子的能量相比时( ) A 、3d 一定大于4s B 、 4s 一定大于3d C 、3d 与4s 几乎相等D 、不同原子中情况可能不同16、下列关于屏蔽效应的说法中,正确的一个是( )A 、4s 电子的屏蔽常数σ 4s 反映了4s 电子屏蔽原子核作用的大小B 、当n 和Z 相同时,某电子的σ 值愈大,该电子的能量就愈低C 、主量子数n 相同,角量子数l 不同;随l 增大,电子的屏蔽作用增大D 、当屏蔽电子数目愈多或被屏蔽电子离核愈远时,σ 值也愈大 17、下列各对分子型物质中,沸点高低次序不正确的是( ) A 、HF > NH 3 B 、 S 2(g) > O 2 C 、NH 3 > PH 3 D 、SiH 4 > PH 3 18、已知金刚石晶胞是类似于立方 ZnS 型的面心立方晶格 ,则晶胞中碳原子数是 ( ) A 、4B 、8C 、12D 、619、按分子轨道理论,-2O 的键级是 ( ) A 、1 B 、2 C 、1 D 、220、下列分子和离子中,中心原子的价层电子对几何构型为四面体,且分子(离子)空间构型为角形(V 形)的是( ) A 、+4NH B 、SO 2C 、H 3O +D 、OF 2二、填空(共20空,每空2分,共40分)1、0℃ 和标准压力下,1 dm 3水能溶解49.0 cm 3O 2 和23.5 cm 3N 2,在相同的条件下,1 dm 3水约能溶解空气 ________________________ cm 3。
大一无机化学期末试题

大一无机化学期末试题一、选择题(每题2分,共40分)1. 下列元素中,属于稀有气体的是:A. 氮B. 氧C. 铁D. 氩2. 气态金属元素是指:A. 铁B. 钠C. 铝D. 锡3. 下列元素中,属于常见碱金属的是:A. 钾B. 银C. 锰D. 锌4. 主要存在于天然矿石中的金属元素是:A. 铜B. 铁C. 镁D. 铝5. 离子化合物中正负电荷之比是:A. 1:1B. 2:1C. 3:1D. 4:16. 氟气(F2)是:A. 有色气体B. 无色气体C. 有毒气体D. 高温气体7. 水的化学式是:A. H2O2B. HO2C. H2OD. OH28. 以下元素中,最活泼的金属是:A. 钠B. 铁C. 铅D. 锌9. 下列元素中,属于卤素的是:A. 钠B. 锌C. 铜D. 氯10. 骨灰量最多的金属元素是:A. 铜B. 铁C. 锌D. 钙二、填空题(每题4分,共40分)1. 具有六方最密堆积结构的金属元素是_______。
2. 化学元素周期表的周期数是_______。
3. 金属元素的化学反应通常是_______。
4. 碱金属在水中的反应会产生_______。
5. 铜的原子序数是_______。
6. 铝的化学符号是_______。
7. 硫酸铜的化学式是_______。
8. 食盐的化学名是_______。
9. 漂白粉的化学名是_______。
10. 常见碱金属元素的化学符号是_______。
三、简答题(每题10分,共30分)1. 解释金属元素的导电性原理。
2. 什么是化学键?请举例说明。
3. 简述离子化合物的形成和性质。
4. 解释相对分子质量和相对原子质量的概念。
5. 什么是金属的氧化还原性?四、综合题(共50分)请根据以下化学反应方程式回答问题。
1. 已知反应方程式:2Na + 2H2O → 2NaOH + H2↑(1)该反应的主要产物是什么?(2)钠用量为20g,试计算钠与水反应后生成的氢气的体积是多少?(3)钠剩余的质量是多少?2. 已知反应方程式:2Al + 3CuCl2 → 2AlCl3 + 3Cu↑(1)该反应的主要产物是什么?(2)铜用量为25g,试计算该反应中消耗的铝的质量是多少?(3)反应后铝剩余的质量是多少?五、实验题(共40分)请设计一套实验步骤,制备氢氧化钠(NaOH)溶液,并确定其浓度。
大一无机化学期末试题总结省名师优质课赛课获奖课件市赛课一等奖课件

(c)4.0*10-12
(d)3.2*10-11
( )3、设氨水旳浓度为c,若将其稀释一倍,则溶液中旳c(OH-)为
(a)1/2.c
(b)1/2(Kb.c)1/2
(c) (Kb.1/2c )1/2 (d)2c
( )4、原则条件下,下列反应均向着正方向进行: Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 2Fe3++Sn2+=2Fe2++Sn4+
1、16号元素旳核外电子排布式是(
),未成对电子数( ),
周期数( ) ,族数 ( ) ,所属区( )
3、共价键旳特点是(
)和(
)
4、HPO42-旳共轭酸碱分别是(
),(
)
5、往1dm30.1mol.dm-3HAc溶液中加入某些NaAc晶体并使之溶解,
HAc旳解离度将( ),溶液旳PH(
)
6、对于反应:若升高温度(例如升高100k),则下列各项
将怎样变化(填写:不变,基本不变,增大或减小)
N2(g)+3H2(g)=2NH3(g), △r HmӨ-1
△r H mӨ(
),△rG mӨ(
), KӨ
(
),ν正(
),ν逆(
)
三、问答题(共30分)
1、比较并解释NF3分子和BF3分子空间构型(8分)
2、用溶度积规则解释为何CaCO3什么溶于HCl (6分 )
A.正向 B.逆向 C.平衡 D.无法判断
( ) 9、已知在室温下Asp =
1.1×10-12 ,Mg(OH)2 旳Ksp =7.04×10-11 ,那么溶解度最大旳
无机化学大一期末考试题

无机化学大一期末考试题
一、选择题(每题 4 分,共 16 分)
1. 无机物的电负性主要决定于以下哪个因素?
A. 元素的原子序数
B. 元素的原子量
C. 元素的价电子数
D. 元素的相对原子质量
2. 下列无机化合物中,属于氧化物类的是:
A. 钠
B. 硫酸
C. 硝酸
D. 氯气
3. 当溶液中的络合剂溶解度较大时,溶液的类型是:
A. 离子溶液
B. 离子极化溶液
C. 氨基溶液
D. 离子场溶液
4. 盐酸和硝酸都能生成反应物,这类反应称为:
A. 水解反应
B. 缩合反应
C. 酸解反应
D. 加成反应
二、填空题(每题 4 分,共 12 分)
5. 金属《——》(单词)是指金属元素和非金属元素之间的化合物。
答:化合物。
6. 受热固体不溶于水,可进行氧化降解反应,可将其分解为——(短语)。
答:无机盐和水。
7. 离子极化溶液中的作用物质,一般都是有————(复数形式)的离子。
答:两个以上。
8. 氧化还原反应中,氧化物损失电子,而还原剂————(动词)电子。
答:获得。
三、简答题(每题 10 分,共 20 分)
9. 请描述无机化学中的吉林体对电解质溶液有何影响?
答:吉林体定义为由离子溶液和凝胶相结合而形成的有机-无机复
合体。
它会影响电解质溶液的结构和性质,例如,它可以改变电解质
溶液的浓度、热力学性质、微观结构等。
此外,吉林体还可以调节溶
液的理化性质,使之合适应细胞的特性。
大一无机化学期末复习题

大一无机化学期末复习题1、已知A 、B 两种混合气体的总压力为101.325k P a ,而A 的体积分数为40%,则B 的分压为 60.792 k P a 。
2、原电池反应:Z n +C u 2+(0.01m o l ·L -1)==== Z n 2+(0.01m o l ·L -1)+ C u ,其电池符号为(-)Z n |Z n 2+(1 ||C u 2+(2|C u(+)其正极反应为C u 2++2e -=C u ;负极反应为 Z n -2e -=Z n 2+ 。
3、配平下列化学方程式:1 -272O Cr + 3S O 32-+ 8 H +=== 2C r 3++ 3S O 42-+ 4H 2O3 S +4 H N O 3==== 3S O 2 + 4 N O + 2 H 2O4、某元素的原子序数为35,则其原子的核外电子数为 35 ,有 1 个未成对电子,原子中填有电子的能级组有四个。
5、非极性分子之间存在色散力;极性分子与非极性分子之间存在诱导力,色散力,极性分子之间存在诱导力,取向力,色散力(选填色散力、诱导力、取向力)6、氢氧化二羟·四水合铝(Ⅲ)的化学式为[A l (O H )2(H 2O )4]O H ;[C r C l ·(N H 3)5]C l 2命名为二氯化·一氯五氨合铬 ;7、对于配位数为4的配离子,当形成外轨型配离子时,杂化方式为S P 3 ,空间构型为正四面体;当形成内轨型配离子时,杂化方式为d S P 2 ,空间构型为平面正四方形。
1、判断下列反应的θm f H ?,哪一个与其θm r H ?一致。
( D )A 、N 2(g ) + 3H 2(g ) = 2 N H 3(g )B 、C a O (s ) + C O 2(g ) = C a C O 3(s )C 、 C (s ,金刚石) + O 2(g ) = C O 2(g )D 、1/2H 2(g ) + 1/2B r 2(g ) = H B r (g )2、反应:4N H 3 (g )+ 5O 2 (g )?4N O (g ) + 6H 2O (l ); θm rH ? = -1170K J ·m o l -1下列哪一条件有利于使N H 3和O 2取得较高转化率?( A )A 、低温、高压B 、高温、高压C 、低温、低压D 、高温、低压3、等浓度、等体积的H C l 溶液和N H 3·H 2O 溶液混合后,混合溶液中有关离子浓度间的关系正确的是:( C )A c (N H 4+)>c (C l -)>c (O H -)>c (H +)B c (N H 4+)>c (C l -)> c (H +)>c (O H -)C c (C l -)>c (N H 4+)>c (H +)>c (O H -)D c (N H 4+)>c (C l -)> c (O H -)>c (H +)4、利用标准电极电势表判断氧化还原反应进行的方向,正确的说法是( C )A 氧化性强的物质与氧化性弱的物质起反应;B 还原性强的物质与还原性弱的物质起反应。
《无机化学》期末考试试卷及参考答案
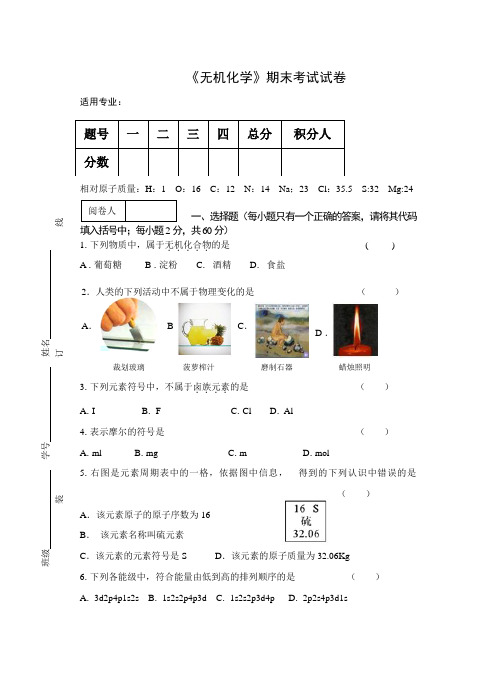
《无机化学》期末考试试卷适用专业:相对原子质量:H :1 O :16 C :12 N :14 Na ;23 Cl :35.5 S:32 Mg:24一、选择题(每小题只有一个正确的答案,请将其代码填入括号中;每小题2分,共60分) 1.下列物质中,属于无机化合物.....的是 ( ) A .葡萄糖 B .淀粉 C . 酒精 D . 食盐3.下列元素符号中,不属于卤族元素....的是 ( ) A .I B . F C .Cl D . Al4.表示摩尔的符号是 ( ) A .ml B .mg C .m D .mol5.右图是元素周期表中的一格,依据图中信息, 得到的下列认识中错误的是( )A .该元素原子的原子序数为16B . 该元素名称叫硫元素C .该元素的元素符号是SD .该元素的原子质量为32.06Kg 6.下列各能级中,符合能量由低到高的排列顺序的是 ( ) A . 3d2p4p1s2s B . 1s2s2p4p3d C . 1s2s2p3d4p D . 2p2s4p3d1s题号 一 二 三 四 总分 积分人 分数裁划玻璃A .B 菠萝榨汁C .磨制石器D .蜡烛照明2.人类的下列活动中不属于物理变化的是 ( ) 阅卷人班级 学号 姓名 - -------------------------------------装--------------------------------------------订---------------------------------------线-------------------------------------7. 5.5 mol 水的质量是 ( ) A . 18g B . 9g C . 99g D . 108g( )9.在标准状况下,任何气体的标准摩尔体积都是 ( ) A . 2.24L B . 11.2L C . 22.4L D . 224L10.下列物质的分子中属于极性分子的是 ( ) A . CO 2 B . O 2 C . HCl D . I 211.NaOH 的摩尔质量是 ( ) A . 4g B . 40 g/mol C . 40 Kg D . 28 mol12.在0.0001 mol/L 的NaOH 溶液中H +浓度为 ( ) A .10-4 mol/L B .10-10 mol/L C . 10-14 mol/L D .10-7mol/L14. 196g H 2SO 4的物质的量是 ( ) A .1mol B .2mol C .3mol D . 0.2mol 15. 浓度为0.01 mol/L 的稀盐酸的pH 是 ( ) A . 7 B . 2 C . 4 D . 816. 在标准状况下44.8L N 2气体的物质的量是 ( ) A .2mol B .1mol C .0.5mol D . 0.2mol17.配制250mL0.1mol/L 的NaOH 溶液需要NaOH 的质量是 ( ) A . 1g B . 10g C . 0.1g D .4gA . 试管B .烧瓶 D . 锥形C .容量瓶8.配制一定物质的量的浓度的溶液应选用的主要仪器是13.下列图像中不是..p 亚层电子云的是 ( ) A.C .B.D.19.配制250mL0.1mol/L 的NaCl 溶液应该选用的容量瓶的规格是 ( ) A . 250 mL B .200mL C . 100mL D . 500mL 20. 0.5mol 的水中含有的水分子个数是 ( ) A .3.01×1023B .6.02×1023C . 1.8×1023D .6.02×102221.标准状况下,与6.4gO 2的分子数目相同的CO 2气体的体积是 ( ) A . 22.4L B .11.2L C .4.48L D .2.24L22.在纯水中pH=7的原因是纯水 ( ) A . [H +]﹥[OH -] B . [H +]﹤[OH -] C . [H +]=[OH -] D .只有[H +] 无[OH -] 23.阿伏伽德罗常数是 A .5×1026B . 3.01×1022C . 6.02×1023D .3.01×1022.24.食盐属于 ( ) A .分子晶体 B .原子晶体 C . 离子晶体 D . 金属晶体 25.物质的量的国际单位是 ( ) A .千克 B .克 C .摩尔 D . 米27.非极性分子与非极性分子之间的作用力主要是 ( ) A .取向力 B .诱导力 C .色散力 D . 氢键28.在通常情况下,水的离子积常数.....是 ( ) A . 1×10-8B .1×10-7C .1×10-14D .1×10-1018.下图是元素周期表中某元素的原子结构示意图, ( ) 依据图中信息所得的结论错误的是 A .该元素的原子很容易得到电子 B .C. 该元素在第一主族 D . 该元素是碱金属元素v26.如图表示某可逆反应的化学平衡建立过程,下 列对于图像中的意义分析有错误的是A . 正反应速率在不断的减小B . 逆反应速率不断增大C .达到平衡时正反应和逆反应都停止,速率都为零D .达化学平衡时正、逆反应速率相等,29.某可逆反应的逆反应的平衡常数K 逆为4,则正反应的平衡常数K 正为( ) A .0.25 B .10 C .2 D .530. 金属铝属于 ( ) A . 原子晶体 B . 分子晶体 C .金属晶体 D .离子晶体 二、判断题(正确的打“√”,错误的打“×”;每小题1分,共10分)31.元素周期表中同一周期的元素随着原子序数的递增原子的半径由大变小 ( ) 32.元素周期表中同一主族的元素原子的最外层电子数一定相等 ( ) 33.分子是否有极性取决于整个分子中正负电荷的重心是否重合 ( ) 34.氧化还原反应的特征是有元素化合价的升降 ( ) 35. 强酸弱碱盐水解,溶液呈酸性 p H ﹤7 ( ) 36. 原电池是一种将电能转变为化学能的装置 ( ) 37. 物质的量就是指物质的质量 ( )38. 酸性溶液中[OH -]﹥[H +]﹥1×10-7mol/L ( ) 39.电子云图中的一个小黑点就代表一个电子. ( )40. 在NaAc-HAc 组成的缓冲溶液 中抗酸成分是HAc ( ) 三、填空题(每空1分,共10分)41. 硫酸四氨合铜(Ⅱ)的化学式是 。
无机化学期末试题题库(130道)

无机化学期末试题1、无机化学研究内容不包括的是()——[单选题]A 物质组成B 结构C 性质D 合成正确答案:D2、某元素处在周期表中的第三周期,该元素原子的电子层数为——[单选题]A 1B 3C 2D 4正确答案:B3、据报道,1995年我国科研人员在兰州首次合成了新核素镤-239,其原子核内有148个中子,则该元素的原子序数为——[单选题]A 148B 239C 91D 108正确答案:C4、不是共轭酸碱对的一组物质是——[单选题]A NH3, NH4+B NaOH, Na+C HS-, S2-D H2O, OH-正确答案:B5、生理盐水的质量浓度为——[单选题]A 4g/LB 9g/LC 15g/LD 50g/L正确答案:B6、2mol MgCl2 和1mol AlCl3中,Cl-的物质的量之比为——[单选题]A 3:2B 2:3C 4:3D 3:4正确答案:C7、物质的量浓度的单位是——[单选题]A mol/LB g/LC 1D g/mol正确答案:A8、下列溶液中渗透压最大的是——[单选题]A 0.1mol·L-1AlCl3B 0.1mol·L-1CaCl2C 0.1mol·L-1葡萄糖(C6H12O6)D 0.1mol·L-1NaCl正确答案:A9、下列说法正确的是——[单选题]A NaCl的质量浓度是0.1mol/LB 水的摩尔质量是18C 1mol H2的质量是2gD 1mol O的质量是32g正确答案:C10、正常人血浆(37˚C时)渗透浓度范围是——[单选题]A 210~280mmol/LB 280~320mmol/LC 280~320mol/LD 380~410mmol/L正确答案:B11、一个电对中,氧化态的氧化能力越强,则其共轭还原态的还原能力——[单选题]A 无法确定B 越强C 越弱D 影响不大正确答案:C12、将12.5g葡萄糖溶于水,配成250mL溶液,该溶液的质量浓度为——[单选题]A 25 g/LB 5.0 g/LC 50 g/LD 0.025 g/L正确答案:C13、决定多电子原子轨道能量的量子数是——[单选题]A n,lB nC lD n,l,m正确答案:A14、正常人血浆(37˚C时)渗透压范围是——[单选题]A 210~280kPaB 720~800kPaC 440~600kPaD 500~1000kPa /L正确答案:B15、下列说法正确的是——[单选题]A p轨道之间以“肩并肩”方式重叠形成σ键B p轨道之间以“头碰头”方式重叠形成π键C p轨道之间以“头碰头”方式重叠形成σ键D s轨道之间以“头碰头”方式重叠形成π键正确答案:C16、基态的电子组态是——[单选题]A [Ar]4s23d4B [Kr]4s23d4C [Ar] 3d54s1D [Xe] 3d54s1正确答案:C17、在氧化还原反应中失去电子的物质是——[单选题]A 氧化剂B 还原剂C 氧化产物D 还原产物正确答案:B18、如果将氮原子的价层电子的运动状态写成为:2,1,0,+1/2; 2, 1,0,-1/2; 2,1,1,+1/2。
大一无机化学期末考试试题精选

大一无机化学期末考试试题精选(√)2. 同种原子之间的化学键的键长越短;其键能越大;化学键也越稳定。
(√)3.系统经历一个循环;无论多少步骤;只要回到初始状态;其热力学能和焓的变化量均为零。
(√)4. AgCl在NaCl溶液中的溶解度比在纯水中的溶解度小。
(×)5. 原子轨道的形状由量子数m决定;轨道的空间伸展方向由l决定。
(1)某元素原子基态的电子构型为1s22s22p63s23p5;它在周期表中的位置是:a a.p区ⅦA族b.s区ⅡA族c.ds区ⅡB族d.p区Ⅵ族(2)下列物质中;哪个是非极性分子:ba.H2O b.CO2c.HCl d.NH3(3)极性共价化合物的实例是:ba.KCl b.HCl c.CCl4d.BF3(4)下列物质凝固时可以形成原子晶体的是:ca. O2 b. Pt; c. SiO2d. KCl(5)在298K;100kPa下;反应2H2(g)+O2(g)=2H2O(1)Δr H mΘ= -572 kJ·mol-1则H2O(l)的Δf H mΘ为:da.572 kJ·mol-1b.-572 kJ·mol-1c.286 kJ·mol-1d.-286 kJ·mol-1(6)定温定压下;已知反应B=A的反应热为Δr H m1Θ;反应B=C的反应热为Δr H m2Θ;则反应A=C的反应热Δr H m3Θ为:da.Δr H m1Θ+Δr H m2Θb.Δr H m1Θ-Δr H m2Θc.Δr H m1Θ+2Δr H m2Θd.Δr H m2Θ-Δr H m1Θ(7)已知HF(g)的标准生成热Δf H mΘ= -565 kJ·mol-1;则反应H2(g)+F2(g)=2HF(g)的Δr H mΘ为:da.565 kJ·mol-1b.-565 kJ·mol-1c.1130 kJ·mol-1d.-1130 kJ·mol-1(8)在氨水溶液中加入固体NH 4Cl 后;氨水的离解度:da .没变化b .微有上升c .剧烈上升d .下降(9)N 的氢化物(NH 3)的熔点都比它同族中其他氢化物的熔点高得多;这主要由于NH 3:ca .分子量最小b .取向力最强c .存在氢键d .诱导力强(10)在一定条件下;一可逆反应其正反应的平衡常数与逆反应的平衡常数关系是:ca .它们总是相等b .它们的和等于1c .它们的积等于1d .它们没有关系(11)下列反应及其平衡常数H 2 (g)+S(s)=H 2S (g ) K 1Θ;(g)SO (g)O S(s)22=+ K 2Θ;则反应S(g)H (g )O (g )SO (g )H 2222+=+的平衡常数K Θ是:da. K 1Θ+K 2Θ b .K 1Θ- K 2Θ c .K 1Θ×K 2Θ. d .K 1Θ÷K 2Θ(12)在298K 时石墨的标准摩尔生成焓Δf H m Θ为:ca .大于零b .小于零c .等于零d .无法确定(13)不合理的一套量子数(n ;l ;m ;m s )是:ba .4;0;0;21+b .4;0;-1;21-c .4;3;+3;21-d .4;2;0;21+(14)向HAc 溶液中;加入少许固体物质;使HAc 离解度减小的是:ba .NaClb .NaAc c .FeCl 3d .KCN(15)3NH 溶于水后;分子间产生的作用力有:da .取向力和色散力b .取向力和诱导力c .诱导力和色散力d .取向力、色散力、诱导力及氢键(16)25℃时;Mg(OH)2的K sp Θ为1.2×10-11;在0.01mol · L -1的NaOH 溶液中的溶解度为:ca .1.2×10-9 mol · L -1b .2.4×10-9 mol · L -1c .1.2×10-7 mol · L -1d .1.7×10-5 mol · L -1(17)已知EΘ(Fe3+/Fe2+)=0.770V;EΘ(Cu2+/Cu)=0.340V;则反应2Fe3+(1mol·L-1)+Cu=2Fe2+(1mol·L-1) + Cu2+(1mol·L-1)可以:b a.呈平衡状态b.自发正向进行c.自发逆向进行d.前三者都错(18)已知Fe3++e = Fe2+;EΘ= 0.770V;测定一个Fe3+/Fe2+电极电势E= 0.750 V;则溶液中必定是:da.c(Fe3+)<1 b.c( Fe2+)<1c.c( Fe2+)/ c(Fe3+)<1 d.c(Fe3+)/ c( Fe2+)<1(19)角量子数l描述核外电子运动状态的:ca.电子能量高低;b.电子自旋方向;c.电子云形状;d.电子云的空间伸展方向;(20)以下各组物质可做缓冲对的是:aa.HCOOH—HCOONa b.HCl一NaClc.HAc—H2SO4d.NaOH—NH3·H2O1.写出具有下列指定量子数的原子轨道符号:A. n=4;l=1____4p________B. n=5;l=2 ______5d______2.写出下列原子在基态时的电子排布(1). Mn: 1s22s22p63s23p63d54s2; (2). Fe___1s22s22p63s23p63d64s2;3. 等性sp2、sp3杂化轨道的夹角分别为__120_____._109.5____.4. 在定温定压下已知反应A=3B的反应热为Δr H m1Θ;反应3A=C的反应热为Δr H m2Θ;则反应9B=C的反应热Δr H m3Θ为(Δr H m2Θ- 3Δr H m1Θ)。
《无机化学》期末考试试卷及答案

《无机化学》期末考试试卷试卷(一)一、填空题(每空1分,共44分)1.当体系的状态被改变时,状态函数的变化只决定于_________,而与_________无关2.空气中的SO2与水作用并经氧化,生成___________ 使大理石转化为_________, ________,因而使雕象遭到破坏.3.已知:碘元素的电势图: 0.145V Eø0.535VIO3–IO–I2I–0.49V则:EøIO–/I2=_______, EøIO3–/I–=_____________4.电解浓度为1mol·L﹣1的H2SO4溶液(铂为电极),阴极产物是______, 阳极产物是______ 已知:Eø O2/OH﹣=1.229V, Eø H+/H2 = 0.000V, Eø S2O82﹣/SO42﹣=2.01V5.我国化学家徐光宪总结归纳出了能级的相对高低与____________________有关,且能级的高低与值有关的近似规律.6.制备胶体的方法有_______和_______.7.气体的基本特征是它的性和性。
8.在0.1mol·L-1的HAc溶液中加入0.1mol·L-1NaAc溶液,HAc的电离度将________________,这种作用被称为__________________.9.离子的结构特征一般包括: 离子电荷、、三个方面.10.已知:2A+B=2C为简单反应,此反应对A物质反应级数为___________,总反应为____________级反应.11.共价键按共用电子对来源不同分为_____________和_______________;共价键按轨道重叠方式不同分为_______________和________________。
12.亚氯酸可用_____________________反应而制得水溶液,它极不稳定迅速分解,反应式为:。
大学无机化学期末试卷附详细标准答案

《无机化学》试题学号:姓名:座号:系别:年级:专业:总分合计人:复核人:一、单项选择题(在每小题列出地四个选项中只有一个选项是符合题目要求地,请选出正确选项并在“答题卡”地相应位置上涂黑.多涂、少涂、错误均无分.每小题1分,共40分)1、对于Zn2+/Zn电对,增大Zn2+地浓度,则其标准电极电势将()A 增大B 减小C 不变D 无法判断2、Cu2+离子地外层电子构型为()A 8eB 18e型C 18+2eD 9~17e型3、设氨水地解离平衡常数为K.浓度为m mol·L-1地氨水溶液,b若将其用水稀释一倍,则溶液中OH-地浓度(mol·L-1)为()Am 21 B θb K m ⋅21 C 2/m K b ⋅θ D 2m4、已知θsp K (Ag 3PO 4) = 1.4×10-16,其溶解度为 ( )A 1.1×10-4mol·L -1; B 4.8×10-5mol·L -1; C 1.2×10-8mol·L -1; D 8.3×10-5mol·L -15、下列各组物质,能自发发生反应地是 ( )A Cu 、Cu 2+; B Cr 2O 72-、Cr 3+; C MnO 2、Mn 2+;D SnCl 4、Sn 6、3d轨道地磁量子数可能是( ) A 1,2,3 B 0,1,2 C 0,±1 D 0, ±1, ±27、下列各分子中,以sp 3不等性杂化轨道成键地是 ( )A BeCl 2 B PCl 3 C BF 3 D SiH 48、熔化下列晶体时,只需克服色散力地是 ( )A HF B Ag C KF D CO 29.已知V E A/θ:Cr 2O 72- +1.36 Cr 3+ -0.41 Cr 2+ -0.86 Cr ,则判断发生歧化反应地是 ( )A 都不能 B Cr 2O 72- C Cr 3+ D Cr 2+10.下列各物质中,熔点最高地是()A K2OB MgOC CaOD Na2O11稀溶液依数性地本质是()A. 渗透压B. 沸点升高C. 蒸汽压下降D. 凝固点降低12要降低反应地活化能,可以采取地手段是( )A. 升高温度B. 降低温度C. 移去产物D. 使用催化剂13如果一个反应地吉布斯自由能变为零,则反应( )A. 能自发进行B. 是吸热反应C. 是放热反应D. 处于平衡状态14.反应A + B C,焓变小于零,若温度升高10℃,其结果是( )A.对反应没有影响B. 使平衡常数增大一倍C.不改变反应速率D.使平衡常数减小15.在HAc-NaAc缓冲溶液中,若[HAc]>[NaAc],则该缓冲溶液()A.抗酸能力强于抗碱能力B.抗酸能力弱于抗碱能力C.抗酸能力等于抗碱能力D.无法判断16.在室温下,0.0001mol.L-1NH3水溶液中地pKw是()A. 14B. 10C.4D.817.按酸碱质子理论考虑,在水溶液中既可作酸亦可作碱地物质是( )A.Cl-B. NH4+C. HCO3-D. H3O+18.AgCl在纯水中溶解度比0.10 mol·L-1 NaCl溶液中(AgCl: K sp = 1.77×10-10 ) ( )A.大B.小C.一样大D.无法判断19.CaSO4在0.1mol.L-1NaNO3溶液中地溶解度比在纯水中( )A.略有减小B.略有增加C.相等D.无法判断20.已知:Ksp,AgCl=1.8×10-10,Ksp,Ag2CrO4=1.1×10-12在等浓度地CrO42-和Cl-地混合溶液中,逐滴加入AgNO3时:()A.先产生AgCl↓B.先产生Ag2CrO4↓C.两种同时沉淀D.两者都不沉淀21.在酸性溶液中,当适量地KMnO4与Na2SO3反应时出现地现象是()A. 棕色沉淀B. 紫色褪去C.绿色溶液D.都不对22.下列电对中值最大地是( )A. (Ag+/Ag) B. (Ag(NH3)2+/Ag) C. (AgCl /Ag) D. (AgI/Ag)23.当pH = 10 时,氢电极地电极电势是- ( )A.-0.59 VB. -0.30 VC. 0.30 VD. 0.59 V24.4s电子地径向分布图有: ( )A.3个峰B.2个峰C.4个峰D.1个峰25.属于主量子数n= 3 地一个电子地四个量子数n,l,m,m s 取值正确地是( )A. 3,2,1,0B.3,2, -1,C. 3,3,1,D. 3,1, 2,26.量子力学中所说地原子轨道是指( )A.波函数ψn,l,m,ms B.电子云C.波函数ψn,l,m D.概率密度27.ψ(4,2,1)代表简并轨道中地一个轨道是( )A.4p轨道B.4d轨道C.4s轨道D.4f轨道28.下列轨道上地电子,在xy平面上地电子云密度为零地是()A.3S B.3P x C.3Pz D.3Py29.某元素原子基态地电子构型为[Ar] 3d 8 4s2 ,它在元素周期表中地位置是()A.s区B.p区C.d区D.f区30. Ag地价电子层结构是()A.3d 10 4s1 B.3d 9 4s2C.4d 10 5s1D.4d 10 4s2 31下列分子和离子中中心原子成键轨道不是sp2 杂化地是( )A.BF3 B.HCHO C.C2H4 D.NH332按分子轨道理论,O2地键级是-( )A.1 B.1C.2D.233.下列各分子中,偶极矩为零地分子为( )A.H2 O B.NH3 C.BF3 D.HCl34.下列化合物中没有氢键地是( )A.C2H4B.NH3C.HFD.H2O35.NH3中N原子采取地杂化方式是:()A. SP2B. SP3等性C. SP2dD. SP3不等性36.[Ni(en)3]2+离子中镍地价态和配位数是()A .+2,3B . +3,6C . +2,6D . +3,3 37. Fe(Ⅲ)形成地配位数为 6 地外轨配合物中,Fe 3+离子接受孤对电子地空轨道是 ( )A .d 2sp 3B . sp 3d 2C .p 3d 3D . sd 5 38.能够用于鉴定Fe 3+地特效试剂有( )A.KSCN B. HCl C. 邻二氮菲 D. 赤血盐39.在热碱性溶液中,次氯酸根离子不稳定,它地分解产物是 ( )A .Cl -和Cl 2 B .Cl -和ClO 3-C .Cl -和ClO 2-D .Cl -和ClO 4- 40.在温度T 和压力p 时理想气体反应:(ⅰ)2H 2O(g)=2H 2(g)+O 2(g)θ1K ;(ⅱ)CO 2(g)=CO(g)+1/2O 2(g)θ2K 则反应:(ⅲ)CO(g)+H 2O(g)=CO 2(g)+H 2(g)地θ3K 应为( )A θθθ213/K K K = , B θθθ213K K K ⋅= ,C θθθ213/K K K =,D θ3K =θ1K +θ2K二、判断题 (判断正确答案,选项并在“答题卡”地相应位置填涂,认为正确地涂“A”错误地涂“B ”.多涂、少涂、错误均无分,每小题1分,共10分)41.当主量子数n=4,共有4s,4p,4d,4f四个原子轨道. ()42.在任何原子中,3p轨道地能量总比3s轨道地能量高. ()43.由极性键形成地分子一定是极性分子.()44.共价键仅存在于共价型化合物中.()45.在相同原子间形成双键比形成单键地键长要短.()46.BF3分子是非极性分子,而B—F键是极性键.()47.先达到溶度积Ksp地先沉淀.()48.在氧化还原电对中,其氧化态地氧化能力越强,则其还原态地还原能力越弱.()49.通常情况下外轨型配合物地配位原子比内轨型配合物地配位原子地电负性大.()50.通H2S于Al2(SO4)3溶液中,得到Al2S3沉淀. ()三、完成题(本题共15分)(类型说明:完成或填空)51. 完成并配平下列反应(每小题2分,共10分)(1)、Cr2O72- + H+ + Fe2+ =(2)、MnO4- +H2O2 + H+ =(3)、Fe3+ +Cu =(4)、Cu2+ + I- =(5)、AgBr +S2O32- =52..填空(本题5分)元素符号S Ar ____ ____元素名称____ ____ 铜钼所属周期____ ____ ____ ____所属族____ ____ ____ ____价电子层地结____ ____ ____ ____构四、计算题(本题35分)53.已知Ka(HAc)=1.0×10-5 ,在20.0ml0.20mol.L-1 HAc中加入0.20mol.L-1 NaOH溶液,计算:(本题8分)(1)加入10.0mL NaOH溶液,混合溶液地pH为多少?(2)加入20.0mL NaOH溶液,混合溶液地pH为多少?54.(本题10分)试设计一个电池,使其进行下列反应Fe3++Ag Ag++Fe2+(1)写出电池地表示式,并计算298.15K时该电池反应地平衡常数θK;若将过量银粉加到浓度为0.1mol·kg-1地Fe(NO3)3溶液中,求当反应达到平衡后Ag+地浓度为多少?(已知Fe3+/Fe2+和Ag+/Ag地VE A/θ分别为0.771、0.799)55. (本题8分)298K 时,在NH 4Cl 溶液中有0.01 mol·kg-1地Fe 2+,若要使Fe 2+生成Fe(OH)2沉淀,需将pH 调节到多少才开始沉淀?(已知θSP K (Fe(OH)2)=4.87×10-17)56. (本题9分) 已知298K 时,化学反应 CO(g) + NO(g) → CO 2(g) +21N 2(g) θm f H ∆(KJ/mol) -110.52 90.25 -393.51 0 θm S (J/mol·K) 197.56 210.65 213.6 191.5θm f G ∆(KJ·mol) -137.15 86.57 -394.36 0 求此反应地θm r H ∆,θm r S ∆和θm r G ∆(298K),并讨论利用此反应净化汽车尾气中NO 和CO 地可能性.标准答案及评分标准(按试题顺序排列)一、单项选择题(在每小题列出地四个选项中请选出正确选项并在“答题卡”地相应位置上涂黑.多涂、少涂、错误均无分.每小题1分,共40分)ADCBD CBDAB CDDD B ACABA BAACB CBCCC DCCAD CBABC二、判断题(判断正确答案,选项并在“答题卡”地相应位置填涂,认为正确地涂“A”错误地涂“B ”.多涂、少涂、错误均无分,每小题1分,共10分)41.B 42.B 43.B 44.B 45.A46.A 47.A 48.A 49.A50.B 四、完成题(共15分)51. 配平下列各反应方程式: (本题10分)(1)Cr 2O 7- +14 H + + 6Fe 2+ = 2 Cr 3+ +6 Fe 3+ +7 H 2O2)、2MnO 4- +5H 2O 2 + 6H + = 2Mn 2+ +5 O 2 + 8H 2O3)、2Fe 3+ +Cu = 2 Fe 2+ + Cu 2+4)、2Cu 2+ +4 I - = 2CuI + I 25)、AgBr +2S 2O 32- = [Ag{S 2O 32-}2]3- + Br -52. 填空元素符号S Ar __Cu__ __Mo_ 元素名称__硫__ __氩__ 铜 钼 所属周期 __3__ ___3_ __4__ ___5_ 所属族 __6A__ ___零_ __1B__ __6B__价电子层地结构_3S 23P 4_ __3S 23P 6 3d 104S 1 _4d 55S 1___四、计算题(共35分)53. [H +]=Ka·NaAc HAcC C(1)加入10.0mL NaOH 溶液,混合溶液地pH 为5.0(2)加入20.0mL NaOH 溶液,混合溶液地pH 为9.054. 3解:解(1)反应式中Ag 被氧化成Ag +,Fe 3+被还原成Fe 2+,故设计地电池为 (-)Ag│Ag + (1m )‖Fe 3+(2m ), Fe 2+ (3m )│Pt (+))(0286.07998.0771.0//23V E Ag Ag Fe Fe -=-=-=+++θθθϕϕ485.0059.0)0286.0(1059.0lg -=-⨯==θθnE K 故328.0=θK (2)设平衡时Ag +地浓度为x mol·kg -1,则 Ag + Fe 3+ Ag + + Fe 2+平衡时 0.1-xx x 328.01.02=-=x x K θ 得)(08.01-⋅=kg mol x55、解 查表知θSP K (Fe(OH)2)=4.87×10-17因为 Fe(OH)2(s)Fe 2+(aq)+2OH -(aq) 所以θSP K (Fe(OH)2)=m (Fe 2+)·2m (OH) m (OH -)==⨯=-+01.01087.4)())((1722Fe m OH Fe K SP θ 6.98×10-8 pOH =-lg m (OH _)=-lg(6.98×10-8)=7.16 pH =14-pOH =6.8456解:),(),(),(21),(22g NO H g CO H g N H g CO H H m f m f m f m f m r θθθθθ∆-∆-∆+∆=∆ 25.90)52.110(0)51.393(---+-=)(24.3731-⋅-=mol KJ),(),(),(21),(22g NO S g CO S g N S g CO S S m m m m m r θθθθθ--+=∆ 65.21056.1975.191216.213--⨯+=)(9.9811--⋅⋅-=K mol J ),(),(),(21),()298(22g NO G g CO G g N G g CO G K G m f m f m f m f m r θθθθθ∆-∆-∆+∆=∆57.86)15.137(036.394---+-=)(78.3431-⋅-=mol KJ ⑵)(1077.3109.9824.37333K rG rH T m m --⨯=⨯--=∆∆=θθ转 当反应T <T 转(3.77×103K )时都可自发进行.版权申明本文部分内容,包括文字、图片、以及设计等在网上搜集整理.版权为个人所有This article includes some parts, including text, pictures, and design. Copyright is personal ownership.h8c52。
无机化学期末复习试题含答案

无机化学期末复习试题含答案题目一:反应速率和化学平衡1. 解释什么是反应速率?如何用实验方法测定反应速率?答案:反应速率是指反应物消耗或生成物生成的速度。
可以通过实验方法测定反应物的浓度随时间的变化来确定反应速率。
2. 什么是化学平衡?写出化学平衡的特点。
答案:化学平衡是指反应物与生成物在特定条件下反应速率相等的状态。
化学平衡的特点包括反应物与生成物浓度不再发生明显变化,反应物与生成物的浓度比例固定,且不受反应物初始浓度的影响。
3. 根据平衡常数的大小判断以下反应是偏向产物还是偏向反应物。
3A. N2O4(g) ⇌ 2NO2(g) Kc = 4.6 ×10^‐33B. 2SO2(g) + O2(g) ⇌ 2SO3(g) Kc = 2.8 ×10^2答案:3A反应是偏向反应物,3B反应是偏向产物。
题目二:金属与非金属元素的反应1. 铁与硫反应生成什么化合物?写出反应方程式。
答案:铁与硫反应生成硫化铁(FeS),反应方程式:Fe(s) + S(s) → FeS(s)2. 铝与氧反应生成什么物质?写出反应方程式。
答案:铝与氧反应生成氧化铝(Al2O3),反应方程式:4Al(s) + 3O2(g) → 2Al2O3(s)3. 锌与硫酸反应生成什么物质?写出反应方程式。
答案:锌与硫酸反应生成硫酸锌和氢气,反应方程式:Zn(s) +H2SO4(aq) → ZnSO4(aq) + H2(g)题目三:物质的氧化还原反应1. 什么是氧化还原反应?简要说明氧化和还原的定义。
答案:氧化还原反应是发生氧化和还原过程的化学反应。
氧化是指物质失去电子,增加氧原子数,或者减少氢原子数;还原是指物质获得电子,减少氧原子数,或者增加氢原子数。
2. 编写离子方程式来描述以下氧化还原反应:2A. 锌和硫酸反应答案:Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)2B. 铜和硝酸反应答案:Cu(s) + 2HNO3(aq) → Cu(NO3)2(aq) + H2O(l) + NO2(g)3. 在以下反应中,哪个物质被氧化?哪个物质被还原?3A. 2Na + Cl2 → 2NaCl答案:氯气(Cl2)被还原,钠(Na)被氧化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(√ ) 1. 电子云是描述核外某空间电子出现的几率密度的概念。
(√)2. 同种原子之间的化学键的键长越短,其键能越大,化学键也越稳定。
(√)3.系统经历一个循环,无论多少步骤,只要回到初始状态,其热力学能和焓的变化量均为零。
(√)4. AgCl在NaCl溶液中的溶解度比在纯水中的溶解度小。
(×)5. 原子轨道的形状由量子数m决定,轨道的空间伸展方向由l决定。
(1)某元素原子基态的电子构型为1s22s22p63s23p5,它在周期表中的位置是:a a.p区ⅦA族 b.s区ⅡA族c.ds区ⅡB族 d.p区Ⅵ族(2)下列物质中,哪个是非极性分子:ba.H2O b.CO2c.HCl d.NH3(3)极性共价化合物的实例是:ba.KCl b.HCl c.CCl4 d.BF3(4)下列物质凝固时可以形成原子晶体的是:ca. O2 b. Pt, c. SiO2d. KCl(5)在298K,100kPa下,反应2H2(g)+O2(g)=2H2O(1) ΔrHmΘ= -572 kJ·mol-1则H2O(l)的ΔfHmΘ为:da.572 kJ·mol-1 b.-572 kJ·mol-1c.286 kJ·mol-1 d.-286 kJ·mol-1(6)定温定压下,已知反应B=A的反应热为Δr Hm1Θ,反应B=C的反应热为ΔrHm2Θ,则反应A=C的反应热Δr Hm3Θ为:da.Δr Hm1Θ+ΔrHm2Θ b.ΔrHm1Θ-ΔrHm2Θc.Δr Hm1Θ+2ΔrHm2Θ d.ΔrHm2Θ-ΔrHm1Θ(7)已知HF(g)的标准生成热Δf HmΘ= -565 kJ·mol-1,则反应H2(g)+F2(g)=2HF(g)的Δr HmΘ为:da.565 kJ·mol-1 b.-565 kJ·mol-1 c.1130 kJ·mol-1 d.-1130 kJ·mol-1(8)在氨水溶液中加入固体NH4Cl后,氨水的离解度:d a.没变化 b.微有上升 c.剧烈上升 d.下降(9)N的氢化物(NH3)的熔点都比它同族中其他氢化物的熔点高得多,这主要由于NH3:ca.分子量最小 b.取向力最强c .存在氢键d .诱导力强(10)在一定条件下,一可逆反应其正反应的平衡常数与逆反应的平衡常数关系是:ca .它们总是相等b .它们的和等于1c .它们的积等于1d .它们没有关系(11)下列反应及其平衡常数H 2 (g)+S(s)=H 2S(g) K 1Θ;(g)SO (g)O S(s)22=+K 2Θ,则反应S(g)H (g )O (g )SO (g )H 2222+=+的平衡常数K Θ是:da. K 1Θ+K 2Θ b .K 1Θ- K 2Θ c .K 1Θ×K 2Θ. d .K 1Θ÷K 2Θ(12)在298K 时石墨的标准摩尔生成焓Δf H m Θ为:ca .大于零b .小于零c .等于零d .无法确定(13)不合理的一套量子数(n ,l ,m ,m s )是:ba .4,0,0,21+ b .4,0,-1,21-c .4,3,+3,21- d .4,2,0,21+(14)向HAc 溶液中,加入少许固体物质,使HAc 离解度减小的是:ba .NaClb .NaAc c .FeCl 3d .KCN(15)3NH 溶于水后,分子间产生的作用力有:da.取向力和色散力 b.取向力和诱导力c.诱导力和色散力 d.取向力、色散力、诱导力及氢键的K spΘ为1.2×10-11,在0.01mol · L-1的NaOH溶液中的溶解度(16)25℃时,Mg(OH)2为:ca.1.2×10-9 mol · L-1 b.2.4×10-9 mol · L-1c.1.2×10-7 mol · L-1 d.1.7×10-5 mol · L-1(17)已知 EΘ(Fe3+/Fe2+) = 0.770V,EΘ(Cu2+/Cu)=0.340V,则反应2Fe3+(1mol·L-1)+Cu=2Fe2+(1mol· L-1) + Cu2+(1mol· L-1)可以:ba.呈平衡状态 b.自发正向进行c.自发逆向进行 d.前三者都错(18)已知Fe3++e = Fe2+,EΘ= 0.770V,测定一个Fe3+/Fe2+电极电势E= 0.750 V,则溶液中必定是:da.c(Fe3+)<1 b.c( Fe2+)<1c.c( Fe2+)/ c(Fe3+)<1 d.c(Fe3+)/ c( Fe2+)<1(19)角量子数l描述核外电子运动状态的:ca.电子能量高低; b.电子自旋方向;c .电子云形状;d .电子云的空间伸展方向;(20)以下各组物质可做缓冲对的是:aa .HCOOH —HCOONab .HCl 一NaClc .HAc —H 2SO 4d .NaOH —NH 3·H 2O1. 写出具有下列指定量子数的原子轨道符号:A. n=4,l=1____4p________B. n=5,l=2 ______5d______2. 写出下列原子在基态时的电子排布(1). Mn: 1s 22s 22p 63s 23p 63d 54s 2; (2). Fe___1s 22s 22p 63s 23p 63d 64s 2;3. 等性sp 2、sp 3杂化轨道的夹角分别为__120_____._109.5____.Δr H m2Θ,则反应9B=C 的反应热Δr H m3Θ为( Δr H m2Θ- 3Δr H m1Θ )。
5. CaO(s)+ CO 2(g)= CaCO 3(s)的平衡常数表达式为( K Θ =1/P CO2 )。
6. 25℃时Ag 2CrO 4的溶解度为( 6.1 ×10-4)。
(K sp Θ(Ag 2CrO 4)=9.0×10-10)。
7. 已知: Zn 2+ + 2e - E Θ(Zn 2+/Zn )= -0.762 8V, 那么21Zn 2+ + e -21Zn E Θ(Zn 2+/Zn ) = (-0.762 8V )由此可知,标准电极电势E Θ由( 物质的电势 )决定,与电极反应中(计量系数)无关。
8. 某元素电子构型为[Ar]3d 54s 2,此元素位于( 4 )周期,( 7 )族。
9. 命名下列配合物:a. [Ni(en)2]Cl2( 二氯化二-乙二胺合镍(II) ) b. Na3[AlF6]( 六氟合氯酸钠 )1、用四个量子数描述基态C原子外层p轨道上2个电子的运动状态?2. BF3分子构型是平面三角形,而NF3分子构型是三角锥形,试用杂化轨道理论解释.3. CH4、H2O、NH3中心原子杂化态皆是sp3,其键角大小是否相同?为什么?其空间构型各为何?2、化学Ag++Fe2+=Fe3++Ag在原电池中发生,试写出原电池符号和电极反应。
2. 浓度均为0.01mol·L-1的Cl—和CrO42-的混合溶液中,逐滴加入AgNO3溶液,何种离子先沉淀当第二种离子沉淀时先沉淀离子的浓度是多少(K spΘ(AgCl)=2×10-10,K spΘ(Ag2CrO4)=1×10-12)解:AgCl先沉淀 [Cl-]=2×10-5D )3.下列关系式中错误的是:A、H=U+PVB、ΔU(体系)+ ΔU(环境)=0C、ΔG=ΔH-TΔSD、ΔG(正反应)×ΔG(逆反应)=1( A )6.在298K的温度下石墨的标准生成自由能为:A、等于零B、大于零C、小于零D、无法确定D )8.对于等温等压下进行的任一反应,下列叙述正确的是:A 、Δr S m 越小反应速度越快B 、Δr H m 越小反应速度越快C 、Δr G m 越小反应速度越快D 、Ea 越小反应速度越快( D )9.下列四个量子数(依次为n ,l ,m ,m s )不合理的一组是:A 、(3、1、0、+21)B 、(4、3、1、-21)C 、(4、0、0、+21)D 、(2、0、1、-21)B )10.下列四个量子数所描述的电子运动状态中,能量最高的电子是:A 、(4、1、0、+21)B 、(4、2、1、-21)C 、(4、0、0、+21)D 、(4、1、1、-21)( D )11.下列分子中C 原子形成共价键时,原子轨道采取SP 3杂化的是:A 、CO 2B 、CH 2=CH 2C 、CH ≡CHD 、CH 4( C )12.二氧化碳和碘分子之间存在的作用力是:A 、取向力B 、诱导力C 、色散力D 、以上三者都存在( A )13.按照酸碱质子理论,下列既能做质子酸又能做质子碱的是:A 、HCO 3-B 、NH 4+C 、H 3O +D 、NO 3-B )14.下列溶液(浓度均为0.10 mol ·L -1)pH 值最大的是:A 、NaAc 溶液(K a =1.76×10-5)B 、NH 3H 2O 溶液(K b =1.78×10-5)C 、K 2S 溶液(K 2=7.1×10-15)D 、HCN 溶液(K a =4.0×10-10)( B )15.下列两溶液等体积混合后,具有缓冲能力的是:A 、0.5mol ·L -1HCl 和0.5mol ·L -1NaAcB 、0.1mol ·L -1HCl 和0.2mol ·L -1NaAcC 、0.2mol ·L -1HCl 和0.1mol ·L -1NaAcD 、HCl 和NaAc 无论浓度体积怎么样变化都不能组成缓冲溶液( C )16.在难溶电解质BaSO 4的饱和溶液中加入下列物质后,BaSO 4的溶解度增大的是:A 、Na 2SO 4B 、BaCl 2C 、KNO 3D 、H 2SO 4( C )17.已知某难溶电解质A 2B 的K SP =3.2×10-17,则该难溶物的溶解度为:A 、5.6×10-9mol ·L -1B 、3.2×10-6mol ·L -1C 、2.0×10-6mol ·L -1D 、8.9×10-9mol ·L -1( D )18.下列化合物中,正负离子间附加极化作用最强的是:A 、AgFB 、AgClC 、AgBrD 、AgI( D )19.下列分子间能形成氢键的是:A 、HF ——HIB 、H 2O ——H 2SeC 、NH 3——H 3AsD 、NH 3——H 2O( D )20.在XeF4分子中,中心原子“Xe”的价层电子对数是:A、3对B、4对C、5对D、6对5.可逆反应 2A(g)+B(g)===D(g)+E(g) 达到平衡时,其平衡常数表示式为Kc=P(D)P(E)/P(A)P(A)P(B)P*,K p与 K c的关系为K p=K c (RT-1)。
