循环伏安法知识小结
循环伏安法原理及结果分析精选文档

循环伏安法原理及结果分析精选文档TTMS system office room 【TTMS16H-TTMS2A-TTMS8Q8-循环伏安法原理及应用小结1 电化学原理1.1 电解池电解池是将电能转化为化学能的一个装置,由外加电源,电解质溶液,阴阳电极构成。
阴极:与电源负极相连的电极(得电子,发生还原反应)阳极:与电源正极相连的电极(失电子,发生氧化反应)电解池中,电流由阳极流向阴极。
1.2 循环伏安法1)若电极反应为O+e-→R,反应前溶液中只含有反应粒子O,且O、R在溶液均可溶,控制扫描起始电势从比体系标准平衡电势(φ平)正得多的起始电势(φi)处开始势作正向电扫描,电流响应曲线则如图0所示。
图0 CV扫描电流响应曲线2)当电极电势逐渐负移到(φ平)附近时,O开始在电极上还原,并有法拉第电流通过。
由于电势越来越负,电极表面反应物O的浓度逐渐下降,因此向电极表面的流量和电流就增加。
当O的表面浓度下降到近于零,电流也增加到最大值Ipc,然后电流逐渐下降。
当电势达到(φr)后,又改为反向扫描。
3)随着电极电势逐渐变正,电极附近可氧化的R粒子的浓度较大,在电势接近并通过(φ平)时,表面上的电化学平衡应当向着越来越有利于生成R的方向发展。
于是R 开始被氧化,并且电流增大到峰值氧化电流Ipa,随后又由于R的显着消耗而引起电流衰降。
整个曲线称为“循环伏安曲线”1.3 经典三电极体系经典三电极体系由工作电极(WE)、对电极(CE)、参比电极(RE)组成。
在电化学测试过程中,始终以工作电极为研究电极。
其电路原理如图1,附CV图(图2):扫描范围-0.25-1V,扫描速度50mV/S,起始电位0V。
图1 原理图图2 CBZ的循环伏安扫描图图2所示CV扫描结果为研究电极上产生的电流随电位变化情况图。
1)横坐标Potential applied(电位)为图1中电压表所测,即Potential applied=P(WE)-P(RE)所有的电位数值都是相对于氢离子的电位值,规定在标准情况下,氢离子的电位为0。
循环伏安法原理及结果分析知识分享

循环伏安法原理及应用小结1 电化学原理1.1 电解池电解池是将电能转化为化学能的一个装置,由外加电源,电解质溶液,阴阳电极构成。
阴极:与电源负极相连的电极(得电子,发生还原反应)阳极:与电源正极相连的电极(失电子,发生氧化反应)电解池中,电流由阳极流向阴极。
1.2 循环伏安法1)若电极反应为O+e-→R,反应前溶液中只含有反应粒子O,且O、R在溶液均可溶,控制扫描起始电势从比体系标准平衡电势(φ平)正得多的起始电势(φi)处开始势作正向电扫描,电流响应曲线则如图0所示。
图0 CV扫描电流响应曲线2)当电极电势逐渐负移到(φ平)附近时,O开始在电极上还原,并有法拉第电流通过。
由于电势越来越负,电极表面反应物O的浓度逐渐下降,因此向电极表面的流量和电流就增加。
当O的表面浓度下降到近于零,电流也增加到最大值Ipc,然后电流逐渐下降。
当电势达到(φr)后,又改为反向扫描。
3)随着电极电势逐渐变正,电极附近可氧化的R粒子的浓度较大,在电势接近并通过(φ平)时,表面上的电化学平衡应当向着越来越有利于生成R的方向发展。
于是R开始被氧化,并且电流增大到峰值氧化电流Ipa,随后又由于R的显著消耗而引起电流衰降。
整个曲线称为“循环伏安曲线”1.3 经典三电极体系经典三电极体系由工作电极(WE)、对电极(CE)、参比电极(RE)组成。
在电化学测试过程中,始终以工作电极为研究电极。
其电路原理如图1,附CV图(图2):扫描范围-0.25-1V,扫描速度50mV/S,起始电位0V。
图1 原理图图2 CBZ的循环伏安扫描图图2所示CV扫描结果为研究电极上产生的电流随电位变化情况图。
1)横坐标Potential applied(电位)为图1中电压表所测,即Potential applied=P(WE)-P(RE)所有的电位数值都是相对于氢离子的电位值,规定在标准情况下,氢离子的电位为0。
当恒电位仪向工作电极提供负的电位时,其电源连接情况如图1所示,即工作电极与电源的负极相连,作为阴极工作发生还原反应;反之则作为阳极发生氧化反应。
循环伏安法介绍全解[荟萃知识]
![循环伏安法介绍全解[荟萃知识]](https://img.taocdn.com/s3/m/d35f5991195f312b3169a58e.png)
Fig.1 循环伏安法原理:(a) 循环电位扫描 (b) 循环伏安谱
精制内容
6
Fig.2 电解过程的伏安曲线
精制内容
7
电极表面的传质过程
电极表面存在三种传质过程, 分别是:
1) 扩散 2.)电迁移 3) 对流
若电解采用微铂电极为工作电极、 且溶液不充分搅拌时,会促使耗 竭区提前出现。这种现象称极化 现象。
形成峰2
精制内容
33
形成峰3
精制内容
34
• 再次阳极扫描时,对苯二酚又被氧 化为苯醌 ,形成峰4 ,而对-胺基 苯酚又被氧化为对-亚胺基苯醌, 形成与峰1完全相同的峰5。
精制内容
35
精制内容
24
可逆电极过程的循环伏安法曲线图
精制内容
25
对于部分可逆(也称准可逆)电极过程来 说,极化曲线与可逆程度有关,一般来
说, △Ep >59/n mV,且峰电位随电压扫
描速度ν的增大而变大,阴极峰变负,阳 极峰边正 。
ipc/ipa可能大于1,也可能小于或等于1,
仍正比于 。准可逆电极电程的循环伏 安法曲线如4.17B图所示
精制内容
9
(iii) Easy to remove diffusion
Hg microelectroladyeerson mercury drop surface
when the drop falls
(螺线管)
(聚氨酯)
0.05~ 0.5mm diameter
精制内容
(活塞)
(金属垫圈))
10
精制内容
精制内容
4
二、电解池的伏安行为
当外加电压达到镉离子的电解 还原电压时,电解池内会发生 如下的氧化还原反应。
化学实验报告——循环伏安法测乙酰氨基酚

循环伏安法测乙酰氨基酚一、实验目的和要求1、采用循环伏安法测定小儿泰诺糖浆中对乙酰氨基酚的浓度;2、学习用循环伏安法研究乙酰氨基酚的电化学氧化机理的方法。
二、实验内容和原理伏安分析法是一定电位下测量系统的电流,得到伏安特性曲线,根据伏安特性曲线进行定性定量分析的一种电化学方法。
物质的结构不同导致其氧化还原电位不同,这是伏安分析法定性分析的基础。
流过电极的电子数=参与反应的离子数×离子价态,i ∝反应物的数量∝反应物的浓度,这是伏安分析法定量分析的依据。
时间-电压曲线:电流-电压曲线:电极上所加电位称为激励信号。
如果电位激励信号为线性,则所获得的电流响应与电位的关系称为线性伏安扫描;如果电位激励信号是三角波信号,所获得的电流响应与电位激励信号的关系称为循环伏安扫描。
循环扫描时,扫描电压呈等腰三角形。
如果前半部扫描(电压上升部分)为化合物在电极上被氧化的阳极过程,则后半部扫描(电压下降部分)为还原产物重新被还原的阴极过程。
因此.一次三角波扫描完成一个氧化过程和还原过程的循环,故称为循环伏安法。
两个峰电流值及其比值,两个峰电位值及其差值是循环伏安法中最为重要的参数。
阳极扫描峰值电位E ap与阴极扫描峰值电位E cp的差值(△E p)可以用来检测电极反应是否是能斯特反应。
当一个电极反应的△E p接近2.3RT/nF(59/n mV,25℃),以及氧化峰与还原峰电流值之比接近于1时,可以判断该反应为能斯特反应,即可逆反应。
当电极反应不可逆时,氧化峰与还原峰的峰值电位差值相距较大,相距越大,不可逆程度越大。
氧化峰电流与还原峰电流值的差距也反映了电极反应的可逆性。
一般地,利用不可逆波来获取电化学动力学的一些参数,如电子传递系数以及电极反应速率常数k ,电化学反应中的质子参与情况以及电催化问题等。
循环伏安法可以测定电活性物质的浓度,能够提供较多的有关电活性物质与电极表面发生电子转移的信息量,是研究电化学反应机理的最佳手段之一。
【干货】电化学基础测试知识系列(五):循环伏安法详解

【⼲货】电化学基础测试知识系列(五):循环伏安法详解循环伏安法(Cyclic Voltammetry)是⼀种常⽤的电化学研究⽅法。
该法控制电极电势以不同的速率,随时间以三⾓波形⼀次或多次反复扫描,电势范围是使电极上能交替发⽣不同的还原和氧化反应,并记录电流-电势曲线。
根据曲线形状可以判断电极反应的可逆程度,中间体、相界吸附或新相形成的可能性,以及偶联化学反应的性质等。
常⽤来测量电极反应参数,判断其控制步骤和反应机理,并观察整个电势扫描范围内可发⽣哪些反应,及其性质如何。
对于⼀个新的电化学体系,⾸选的研究⽅法往往就是循环伏安法,可称之为“电化学的谱图”。
本法除了使⽤汞电极外,还可以⽤铂、⾦、玻璃碳、碳纤维微电极以及化学修饰电极等。
循环伏安技术因功能多样化⽽成为⼀种被电化学家⼴泛使⽤的技术,但是⼤部分时间是⽤于实验室级的元件上。
实际上,⼤的器件将使⽤成百上千安培的⾮常⼤的电流,这在技术上难以处理。
在实验室级别或材料研究级别中,循环伏安是⼀种精确的技术。
它可以:1)定性和半定量研究;1)通过⼤范围的扫描速率扫描动⼒学分析;3)决定电压窗⼝。
1. 极化曲线和循环伏安的区别(什么是循环伏安?)线性伏安测试技术即电位随着时间线性的变化,从⽽测量电流随电压变化的过程。
⼀般把线性伏安技术分为两类:当扫速⾜够慢时,电极表⾯基本处于稳态,这时我们把电流随电压的响应称为稳态极化曲线,简称极化曲线,此时的电流为法拉第电流;当扫速较快时,电极表⾯处于暂态,我们将其称为伏安曲线,此时的电流包括法拉第和⾮法拉第电流。
这两者的响应是不同的(如图1),在电化学测试过程中有着不同的应⽤。
如果把伏安曲线的输⼊信号改成循环三⾓波,那么其响应就称为循环伏安曲线(如图2)。
得到的电流电压曲线包括两个分⽀,如果前半部分电位向阴极⽅向扫描,电活性物质在电极上还原,产⽣还原波,那么后半部分电位向阳极扫描时,还原产物⼜会重新再电极上氧化,产⽣氧化波。
第五章伏安法测电阻与等效电路知识点总结及练习
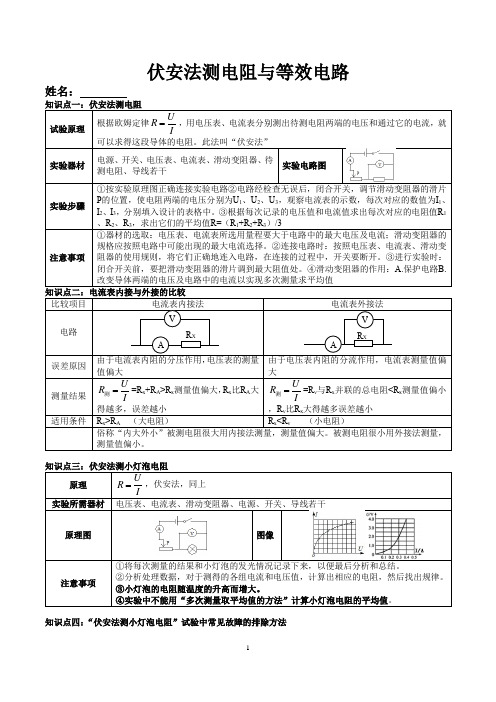
伏安法测电阻与等效电路 姓名:知识点一:伏安法测电阻试验原理 根据欧姆定律U R I=,用电压表、电流表分别测出待测电阻两端的电压和通过它的电流,就可以求得这段导体的电阻。
此法叫“伏安法”实验器材 电源、开关、电压表、电流表、滑动变阻器、待测电阻、导线若干 实验电路图实验步骤 ①按实验原理图正确连接实验电路②电路经检查无误后,闭合开关,调节滑动变阻器的滑片P 的位置,使电阻两端的电压分别为U 1、U 2、U 3,观察电流表的示数,每次对应的数值为I 1、I 2、I 3,分别填入设计的表格中。
③根据每次记录的电压值和电流值求出每次对应的电阻值R 1、R 2、R 3,求出它们的平均值R=(R 1+R 2+R 3)/3注意事项 ①器材的选取:电压表、电流表所选用量程要大于电路中的最大电压及电流;滑动变阻器的规格应按照电路中可能出现的最大电流选择。
②连接电路时:按照电压表、电流表、滑动变阻器的使用规则,将它们正确地连入电路,在连接的过程中,开关要断开。
③进行实验时:闭合开关前,要把滑动变阻器的滑片调到最大阻值处。
④滑动变阻器的作用:A.保护电路B.改变导体两端的电压及电路中的电流以实现多次测量求平均值知识点二:电流表内接与外接的比较比较项目 电流表内接法 电流表外接法电路 误差原因由于电流表内阻的分压作用,电压表的测量值偏大 由于电压表内阻的分流作用,电流表测量值偏大 测量结果 U R I =测=R x +R A >R x 测量值偏大,R x 比R A 大得越多,误差越小 U R I=测==R v 与R x 并联的总电阻<R x 测量值偏小,R v 比R x 大得越多误差越小适用条件 R x >R A ==(大电阻) R x <R v=====(小电阻)俗称“内大外小”被测电阻很大用内接法测量,测量值偏大。
被测电阻很小用外接法测量,测量值偏小。
知识点三:伏安法测小灯泡电阻原理U R I =,伏安法,同上 实验所需器材 电压表、电流表、滑动变阻器、电源、开关、导线若干原理图 图像注意事项①将每次测量的结果和小灯泡的发光情况记录下来,以便最后分析和总结。
循环伏安法原理及结果分析复习课程

循环伏安法原理及结果分析循环伏安法原理及应用小结1 电化学原理1.1 电解池电解池是将电能转化为化学能的一个装置,由外加电源,电解质溶液,阴阳电极构成。
阴极:与电源负极相连的电极(得电子,发生还原反应)阳极:与电源正极相连的电极(失电子,发生氧化反应)电解池中,电流由阳极流向阴极。
1.2 循环伏安法1)若电极反应为O+e-→R,反应前溶液中只含有反应粒子O,且O、R 在溶液均可溶,控制扫描起始电势从比体系标准平衡电势(φ平)正得多的起始电势(φi)处开始势作正向电扫描,电流响应曲线则如图0所示。
图0 CV扫描电流响应曲线2)当电极电势逐渐负移到(φ平)附近时,O开始在电极上还原,并有法拉第电流通过。
由于电势越来越负,电极表面反应物O的浓度逐渐下降,因此向电极表面的流量和电流就增加。
当O的表面浓度下降到近于零,电流也增加到最大值Ipc,然后电流逐渐下降。
当电势达到(φr)后,又改为反向扫描。
3)随着电极电势逐渐变正,电极附近可氧化的R粒子的浓度较大,在电势接近并通过(φ平)时,表面上的电化学平衡应当向着越来越有利于生成R的方向发展。
于是R开始被氧化,并且电流增大到峰值氧化电流Ipa,随后又由于R的显著消耗而引起电流衰降。
整个曲线称为“循环伏安曲线”1.3 经典三电极体系经典三电极体系由工作电极(WE)、对电极(CE)、参比电极(RE)组成。
在电化学测试过程中,始终以工作电极为研究电极。
其电路原理如图1,附CV图(图2):扫描范围-0.25-1V,扫描速度50mV/S,起始电位0V。
图1 原理图图2 CBZ的循环伏安扫描图图2所示CV扫描结果为研究电极上产生的电流随电位变化情况图。
1)横坐标Potential applied(电位)为图1中电压表所测,即Potential applied=P(WE)-P(RE)所有的电位数值都是相对于氢离子的电位值,规定在标准情况下,氢离子的电位为0。
当恒电位仪向工作电极提供负的电位时,其电源连接情况如图1所示,即工作电极与电源的负极相连,作为阴极工作发生还原反应;反之则作为阳极发生氧化反应。
循环伏安法原理及结果分析

实验操作步骤
配置电解质溶 液
组装循环伏安 法实验装置
设定实验参数
开始实验并记 录数据
分析实验结果
实验过程中的注意事项
确保电极的清洁度,避免污染 和干扰
控制好扫描速率,避免过快或 过慢影响实验结果
选择合适的电解质和参比电极, 保证实验的准确性和可靠性
注意实验环境的温度和湿度, 避免影响实验结果
实验数据的记录与处理
循环伏安法的应用范围
电化学反应:可用于研究电化学反应的动力学过程和机理
氧化还原反应:可用于研究氧化还原反应的机理和动力学参数
电池性能测试:可用于评估电池的电化学性能和反应机理 电镀和金属表面处理:可用于研究电镀和金属表面处理的电化学过程和机 理
循环伏安法的优缺点
优点:能够同时研究电 极的氧化还原过程,可 以用于电化学反应的动 力学研究
循环伏安法的原理
循环伏安法是一种电化学分析方法,通过循环扫描电极电位来研究电极反 应的可逆性和反应机理。
在循环伏安法中,电极电位在一定范围内循环变化,从而得到电流随电位 变化的曲线,即循环伏安曲线。
通过循环伏安曲线的形状和变化规律,可以判断电极反应的可逆性、反应 机理以及反应速率常数等参数。
循环伏安法在电化学、电分析化学、环境科学等领域具有广泛的应用价值。
记录实验过程中的电压、电流数据 对数据进行处理,绘制电压电流曲线 分析曲线特征,确定电极反应过程 根据数据处理结果,得出结论并解释原因
Part Four
循环伏安法结果分 析
结果分析的方法
峰电流和峰电 位的计算
峰电流和峰电 位的变化规律
峰电流和峰电 位的影响因素
结果分析的注 意事项
结果分析的步骤
Part Six
循环伏安法介绍

循环伏安法介绍基本定义循环伏安法是指在电极上施加一个线性扫描电压,从起始电位以一定的速率扫描到一个顶点电位,再从该顶点电位扫描到另一个顶点电位的两阶段,此扫描可以在两个顶点电位之间多次重复。
循环伏安方法应用极为广泛。
根据曲线形状可以判断电极反应的可逆程度,中间体、相界面吸附或新相形成的可能性,以及偶联化学反应的性质等。
对于一个新的电化学体系,首选的研究方法往往就是循环伏安法,可称之为〃电化学的谱图〃。
激励信号(A)-UBOdTιme(s)循环伏安法的激励信号图该法控制电极电势以不同的速率,随时间以三角波形一次或多次反复扫描,电势范围是使电极上能交替发生不同的还原和氧化反应,并记录电流-电势曲线。
2、关键参数、参数的可设置范围及通常的设置范围最初电位(V):扫描起始点。
可设置范围10~∙10;依据体系的差异,水相体系T殳设置在±2.0V,有机相可以扩展到±5.0V,电池或串联电池体系还会更大。
最终电位(V):扫描最终点。
参数设置同上。
顶点电位I(V):电位扫描的最高限制。
参数设置同上。
顶点电位2(V):电位扫描的最低限制。
参数设置同上。
静置时间(S):电位扫描开始前的静置时间。
可设置范围1~100000。
通常设置为几秒或几十秒内。
扫描速率(V∕s):电位变化率,可设置范围IXIO-4~10000;稳态测量T殳数mV∕s,一般电极过程研究和测量可由数mV/s到数V∕s,快速表面反应电极过程动力学研究或超微电极快速扫描最高可以设置到数kV∕s o高扫描会有大电流,应注意考虑溶液电阻影响。
循环次数:1~500000次;全部点数:每个扫描周期的默认数据采集量为2000个点。
全部点数为2000X循环次数。
研究体系及实验曲线31、玻碳电极,1mMK3[Fe(CN)6]+1MKCI三电极体系:WE-GCE;RE-SCE;CE-Pt丝。
参数设置:o针对该体系,在扫速为0.001V/S以下时,避免实验时间过长,扫描范围选择为0.4~0.05V;选择在扫速为0.001〜0.01V/s时,扫描范围选择为0.5~-0.05V,避免扫描电位过负出现析氢现象;当扫速较高时,可以通过溶液电阻校正获得比较理想的实验曲线。
循环伏安法原理及结果分析

循环伏安法原理及应用小结1 电化学原理电解池电解池是将电能转化为化学能的一个装置,由外加电源,电解质溶液,阴阳电极构成。
阴极:与电源负极相连的电极(得电子,发生还原反应)阳极:与电源正极相连的电极(失电子,发生氧化反应)电解池中,电流由阳极流向阴极。
循环伏安法1)若电极反应为O+e-→R,反应前溶液中只含有反应粒子O,且O、R在溶液均可溶,控制扫描起始电势从比体系标准平衡电势(φ平)正得多的起始电势(φi)处开始势作正向电扫描,电流响应曲线则如图0所示。
图0 CV扫描电流响应曲线2)当电极电势逐渐负移到(φ平)附近时,O开始在电极上还原,并有法拉第电流通过。
由于电势越来越负,电极表面反应物O的浓度逐渐下降,因此向电极表面的流量和电流就增加。
当O的表面浓度下降到近于零,电流也增加到最大值Ipc,然后电流逐渐下降。
当电势达到(φr)后,又改为反向扫描。
3)随着电极电势逐渐变正,电极附近可氧化的R粒子的浓度较大,在电势接近并通过(φ平)时,表面上的电化学平衡应当向着越来越有利于生成R的方向发展。
于是R开始被氧化,并且电流增大到峰值氧化电流Ipa,随后又由于R的显著消耗而引起电流衰降。
整个曲线称为“循环伏安曲线”经典三电极体系经典三电极体系由工作电极(WE)、对电极(CE)、参比电极(RE)组成。
在电化学测试过程中,始终以工作电极为研究电极。
其电路原理如图1,附CV图(图2):扫描范围,扫描速度50mV/S,起始电位0V。
图1 原理图图2 CBZ的循环伏安扫描图图2所示CV扫描结果为研究电极上产生的电流随电位变化情况图。
1)横坐标Potential applied(电位)为图1中电压表所测,即Potential applied=P(WE)-P(RE)所有的电位数值都是相对于氢离子的电位值,规定在标准情况下,氢离子的电位为0。
当恒电位仪向工作电极提供负的电位时,其电源连接情况如图1所示,即工作电极与电源的负极相连,作为阴极工作发生还原反应;反之则作为阳极发生氧化反应。
循环伏安法原理及结果分析

循环伏安法原理及结果分析循环伏安法,听起来挺高大上的,其实说白了就是一种电化学分析的好工具。
它能帮我们研究材料的电化学特性,还能分析反应机理,真是科学界的小金库。
咱们一步一步来聊聊它的原理和结果分析。
首先,咱们得明白什么是循环伏安法。
它是利用电流与电压的关系来研究反应过程的。
简单来说,电流就像是水流,而电压就像是水龙头的开关。
我们通过调节电压,让电流在样品中流动,然后记录下来。
这就像给实验室里的小“鱼”施加不同的“水流”,看它们怎么游动,太有趣了!循环伏安法的基本原理就是这个。
电压从一个点变到另一个点,再反向变回去,形成一个完整的“循环”。
在这个过程中,电流会随着电压的变化而变化。
科学家们把这个过程叫做“电流-电压曲线”,它就像一幅精美的画,展现了反应的所有秘密。
接下来,咱们看看结果分析。
首先,咱们会得到一个电流-电压的曲线图,这就像一张地图,指引我们探索反应的深度。
图中有两个很重要的峰值,分别叫做氧化峰和还原峰。
氧化峰代表着物质失去电子的过程,而还原峰则是物质获取电子的过程。
就像一场电子的“争夺战”,谁先出手,谁先获得胜利,这一切都在曲线图上展现无遗。
接下来,咱们分析一下这些峰值的高度和位置。
峰高代表反应的速率,峰位则跟材料的性质有很大关系。
比如,如果氧化峰位移得很远,那可能说明反应动力学比较复杂,反应不是那么简单。
反之,如果峰位很接近,那反应就可能比较简单,效率也高。
不仅如此,循环伏安法还可以帮助我们了解材料的稳定性。
通过反复扫描电压,我们可以观察到峰值是否有变化。
如果峰值变高或变宽,说明材料可能发生了某些变化,这可能是因为材料的降解或者反应机制的改变。
再说说“转速”。
在循环伏安法中,转速就是扫描速率。
扫描速率越快,电流变化也越快。
这就像你骑自行车,骑得越快,风吹得也越猛。
不过,扫描速率太快也可能导致一些问题,比如电流信号可能变得不稳定,反而会影响实验结果的准确性。
因此,选择合适的扫描速率是非常关键的。
循环伏安法比电容公式推导

循环伏安法比电容公式推导循环伏安法(Cyclic Voltammetry,CV)是一种常用的电化学研究方法,在材料科学、能源存储等领域有着广泛的应用。
其中,通过循环伏安法来推导比电容公式是理解和分析电化学电容器性能的重要环节。
咱们先来说说循环伏安法到底是咋回事。
想象一下,你有一个电化学电池,就像一个小小的魔法盒子。
然后呢,你给这个盒子施加一个电压,从低到高,再从高到低,不断地循环这个过程。
在这个过程中,电流会随着电压的变化而变化,就像一个调皮的小精灵在跳来跳去。
循环伏安法得到的曲线通常会有一些特征,比如氧化峰和还原峰。
这些峰的位置和形状能告诉我们很多关于电极材料的信息,比如它的氧化还原反应活性啦,反应的可逆性啦等等。
接下来,咱们就要进入正题,推导比电容公式啦!假设我们在进行循环伏安测试时,得到的电流-电压曲线是一个比较理想的形状。
咱们先看一下比电容(C)的定义,它表示单位电压变化下电极存储电荷的能力。
那怎么从循环伏安曲线中得到这个比电容呢?这就得从电流(I)和扫描速率(v)说起啦。
在循环伏安曲线中,电流和电压是有关系的。
我们假设在某个电压区间内,电流和电压呈线性关系。
那么电流(I)就可以表示为:I = av + b ,这里的 a 和 b 是常数。
然后呢,我们对这个式子进行积分。
积分的区间就是我们所关注的电压区间。
经过一番复杂但有趣的数学运算(这里就不详细展开啦,不然会把大家绕晕的),最终我们可以得到比电容的公式:C =(∫IdV)/(vΔV) 。
这里的∫IdV 就是电流-电压曲线下的面积,v 是扫描速率,ΔV 是电压的变化范围。
有一次我在实验室带着学生做这个实验的时候,就遇到了一个小插曲。
有个学生特别着急,还没等仪器稳定就开始记录数据,结果得到的曲线乱七八糟的。
我就跟他说:“别着急,做实验就像煲汤,得小火慢炖,才能出好味道。
”后来他静下心来,重新做,终于得到了漂亮的曲线,也成功推导出了比电容公式,那高兴劲儿就甭提了!总之,循环伏安法比电容公式的推导虽然有点复杂,但只要我们耐心细致,就一定能搞明白。
循环伏安法知识小结

利用循环xx确定反应是否为可逆反应1.氧化峰电流与还原峰电流绝对值相等,即二者绝对值比值始终为一,与扫描速率,换向电势,扩散系数无关。
2.氧化xx与还原xx电位差约为59mV利用循环xx确定反应是否为可逆反应1.氧化峰电流与还原峰电流之比的绝对值等于12.氧化峰与还原峰电位差约为(59/n)mV (25摄氏度时)一般这两个条件即可判断扩散反应或者是吸附反应:改变扫描速率,看峰电流是与扫描速率还是它的二次方根成正比,若是与扫描速率成线性,就是表面控制过程,与二次方根成线性,就是扩散控制利用循环xx确定反应是否可逆1:氧化峰和还原峰的电流比是否相等,若相等则可逆。
有时对同一体系,扫描速率不同也会在一定程度上影响其可逆性的一般而言,扫速越大其电化学反应电流也就越大。
2:氧化峰和还原峰电位差等于59/nmV,若大于,则是准可逆体系。
这种确定onset potential的方法的依据是什么呢?我看有的文献上直接是作一条切线,但这样误差也很大,很主观随意。
以前我们老师上电极过程动力学的时候说准确的onset potential其实是很难被确定的。
只能估计大致的范围。
求法可以说有好几种,据我所知就有两种,一种是楼上说的切线法,一种是我说的10%或20%法哪种方法不重要,重要的只在自己的样品之间比。
另外,我不知道你的样品是什么,就我所熟知的电催化剂而言,其实评价它的好坏,起始电位固然重要,但更看重它的峰形以及质量单位电流密度。
、切线法是有这个问题,所以用峰高的10%来定,人为因素要小一些啦。
其实说来说去又变成了起始电位测不准啦!循环xx法中对电流正负的认为规定很多书上都把还原反应电流规定为正,一般不说正电流或负电流,而说阳极电流或阴极电流。
阳极反应的电流是阳极电流,对应的峰为氧化峰,阴极反应的电流是阴极电流,对应的峰为还原峰。
电流的正负是人为规定的,习惯上还原峰电流规定为正,氧化峰电流为负,但是也有相反的情况,不能按照电流的正负来区分氧化峰或还原峰,从电位上可以判断,通常氧化峰位于还原峰较正的位置上,也就说,峰电位较正的峰是氧化峰,峰电位较负的峰是还原峰,这是极化造成的结果。
循环伏安法需注意的

循环伏安法需注意的一、什么是循环伏安法循环伏安法(Cyclic Voltammetry)是一种常用的电化学分析技术,用于研究电化学反应动力学、测量电极表面的电化学活性以及分析样品中的化学物质等。
它通过在电化学系统中施加一系列电位扫描,从而获得电流-电势曲线,通过分析这些曲线可以得到各种有关电化学反应的信息。
二、循环伏安法的基本原理循环伏安法是基于法拉第第一电动力学定律和法拉第第二电动力学定律,采用三电极系统进行实验。
电化学系统中包括工作电极(WE),参比电极(RE)和计数电极(CE)。
工作电极不断在一定电位范围内进行电位扫描,并记录相应的电流变化。
根据电极电势与电流的关系,可以推断出电化学反应的动力学参数。
三、循环伏安法的实验步骤执行循环伏安法实验时,需要注意以下步骤:1. 设定实验参数根据实验要求,设置扫描速率、起始电位、终止电位和电位范围等实验参数。
这些参数的选择应结合具体研究目的和样品特性。
2. 准备电化学池和溶液搭建三电极系统,确保电极清洁无污染。
准备适当的电解液,根据实验需求选择合适的溶液体系,并保证电解液的质量和浓度。
3. 进行电流校正在实验前,应进行电流校正以保证实验结果的准确性。
根据电极的响应性能,利用标准电流源对电流进行校正。
4. 开始电位扫描调整实验仪器,设定相应的电流采集频率和电位扫描速率等参数。
开始进行电位扫描,并记录电流和电位的变化。
通常循环伏安法会进行多次循环扫描,以观察电化学反应的可逆性和稳定性。
5. 数据处理和分析通过电流-电位曲线可以获得许多有关电化学反应的信息。
对实验数据进行初步处理和分析,包括峰电位、峰电流、氧化还原峰的形状和位置等。
进一步分析这些结果,可以得到电化学反应的动力学参数、电荷转移机理等。
四、循环伏安法的应用领域循环伏安法广泛应用于多个领域,包括:1. 锂电池循环伏安法可以用于研究锂电池的电化学行为,如锂离子的嵌入和脱嵌过程、电解液的氧化还原反应等。
循环伏安法知识小结

利用循环伏安确定反应是否为可逆反应1.氧化峰电流与还原峰电流绝对值相等,即二者绝对值比值始终为一,与扫描速率,换向电势,扩散系数无关。
2.氧化峰与还原峰电位差约为59mV利用循环伏安确定反应是否为可逆反应1.氧化峰电流与还原峰电流之比的绝对值等于12.氧化峰与还原峰电位差约为(59/n)mV (25摄氏度时)一般这两个条件即可判断扩散反应或者是吸附反应:改变扫描速率,看峰电流是与扫描速率还是它的二次方根成正比,若是与扫描速率成线性,就是表面控制过程,与二次方根成线性,就是扩散控制利用循环伏安确定反应是否可逆1:氧化峰和还原峰的电流比是否相等,若相等则可逆。
有时对同一体系,扫描速率不同也会在一定程度上影响其可逆性的一般而言,扫速越大其电化学反应电流也就越大。
2:氧化峰和还原峰电位差等于59/nmV,若大于,则是准可逆体系。
这种确定onset potential的方法的依据是什么呢?我看有的文献上直接是作一条切线,但这样误差也很大,很主观随意。
以前我们老师上电极过程动力学的时候说准确的onset potential其实是很难被确定的。
只能估计大致的范围。
求法可以说有好几种,据我所知就有两种,一种是楼上说的切线法,一种是我说的10%或20%法哪种方法不重要,重要的只在自己的样品之间比。
另外,我不知道你的样品是什么,就我所熟知的电催化剂而言,其实评价它的好坏,起始电位固然重要,但更看重它的峰形以及质量单位电流密度。
、切线法是有这个问题,所以用峰高的10%来定,人为因素要小一些啦。
其实说来说去又变成了起始电位测不准啦!循环伏安法中对电流正负的认为规定很多书上都把还原反应电流规定为正,一般不说正电流或负电流,而说阳极电流或阴极电流。
阳极反应的电流是阳极电流,对应的峰为氧化峰,阴极反应的电流是阴极电流,对应的峰为还原峰。
电流的正负是人为规定的,习惯上还原峰电流规定为正,氧化峰电流为负,但是也有相反的情况,不能按照电流的正负来区分氧化峰或还原峰,从电位上可以判断,通常氧化峰位于还原峰较正的位置上,也就说,峰电位较正的峰是氧化峰,峰电位较负的峰是还原峰,这是极化造成的结果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
利用循环伏安确定反应就是否为可逆反应
1、氧化峰电流与还原峰电流绝对值相等,即二者绝对值比值始终为一,与扫描速率,换向电势,扩散系数无关。
2。
氧化峰与还原峰电位差约为59mV
利用循环伏安确定反应就是否为可逆反应
1。
氧化峰电流与还原峰电流之比得绝对值等于1ﻫ2.氧化峰与还原峰电位差约为(59/n)mV (25摄氏度时)
一般这两个条件即可
判断扩散反应或者就是吸附反应:
改变扫描速率,瞧峰电流就是与扫描速率还就是它得二次方根成正比,若就是与扫描速率成线性,就就是表面控制过程,与二次方根成线性,就就是扩散控制
利用循环伏安确定反应就是否可逆
1:氧化峰与还原峰得电流比就是否相等,若相等则可逆、ﻫ有时对同一体系,扫描速率不同也会在一定程度上影响其可逆性得一般而言,扫速越大其电化学反应电流也就越大。
ﻫ2:氧化峰与还原峰电位差等于59/nmV,若大于,则就是准可逆体系、
这种确定onset potential得方法得依据就是什么呢?我瞧有得文献上直接就是作一条切线,但这样误差也很大,很主观随意。
以前我们老师上电极过程动力学得时候说准确得onset potential其实就是很难被确定得。
只能估计大致得范围、求法可以说有好几种,据我所知就有两种,一种就是楼上说得切线法,一种就是我说
得10%或20%法哪种方法不重要,重要得只在自己得样品之间比。
另外,我不知道您得样品就是什么,就我所熟知得电催化剂而言,其实评价它得好坏,起始电位固然重要,但更瞧重它得峰形以及质量单位电流密度、
、切线法就是有这个问题,所以用峰高得10%来定,人为因素要小一些啦。
其实说来说去又变成了起始电位测不准啦!
循环伏安法中对电流正负得认为规定
很多书上都把还原反应电流规定为正,一般不说正电流或负电流,而说阳极电流或阴极电流。
阳极反应得电流就是阳极电流,对应得峰为氧化峰,阴极反应得电流就是阴极电流,对应得峰为还原峰。
电流得正负就是人为规定得,习惯上还原峰电流规定为正,氧化峰电流为负,但就是也有相反得情况,不能按照电流得正负来区分氧化峰或还原峰,从电位上可以判断,通常氧化峰位于还原峰较正得位置上,也就说,峰电位较正得峰就是氧化峰,峰电位较负得峰就是还原峰,这就是极化造成得结果。
瞧扫描方向,由正向负方向扫出得峰就就是还原峰,由负往正方向扫就就是氧化峰,也就就是对应得负扫与正扫,我们用得就是上海辰华得工作站,也就是颠倒得,一般我们把数据导出再用ORIGIN75处理数据,把图形倒过来。
习惯上,将流入电极表面得电流,定义为负,流出电极表面得电流定义为正,前者为阴极,还原,后者为氧化。
仪器得cv图,可以根据扫描电位得方向,向负电位方向扫,肯定就是先出现得还原电流峰,所以哪个先出来,就就是还原峰,不用拘泥于坐
标轴。
循环伏安测试得原理:
1.若电极反应为O+e—→R,反应前溶液中只含有反应粒子O、且O、R 在溶液均可溶,控制扫描起始电势从比体系标准平衡电势(φ平)正得多得起始电势(φi)处开始势作正向电扫描,电流响应曲线则如附图所示。
2。
当电极电势逐渐负移到(φ平)附近时,O开始在电极上还原,并有法拉第电流通过。
由于电势越来越负,电极表面反应物O得浓度逐渐下降,因此向电极表面得流量与电流就增加。
当O得表面浓度下降到近于零,电流也增加到最大值Ipc,然后电流逐渐下降。
当电势达到(φ
后,又改为反向扫描。
3ﻫ、随着电极电势逐渐变正,电极附近可氧r)
化得R粒子得浓度较大,在电势接近并通过(φ平)时,表面上得电化学平衡应当向着越来越有利于生成R得方向发展。
于就是R开始被氧化,并且电流增大到峰值氧化电流Ipa,随后又由于R得显著消耗而引起电流衰降。
整个曲线称为“循环伏安曲线”。
循环伏安得其它应用ﻫ(1)电极可逆性得判断循环伏安法中电压得扫描过程包括阴极与阳极两个方向,因此从所得得循环伏安法图得氧化波与还原波得峰高与对称性中可判断电活性物质在电极表面反应得可逆程度、若反应就是可逆得,则曲线上下对称,若反应不可逆,则曲线上下不对称、
(2)电极反应机理得判断循环伏安法还可研究电极吸附现象、电化学反应产物、电化学—化学耦联反应等,对于有机物、金属有机化合物
及生物物质得氧化还原机理研究很有用。
ﻫ测试得时候,以等腰三角形得脉冲电压加在工作电极上,得到得电流电压曲线包括两个分支,如果前半部分电位向阴极方向扫描,电活性物质在电极上还原,产生还原波,那么后半部分电位向阳极方向扫描时,还原产物又会重新在电极上氧化,产生氧化波。
因此一次三角波扫描,完成一个还原与氧化过程。
循环,
您好,循环伏安法就是一种测试方法,不就是电镀得一种手段。
ﻫ循环伏安一般就是给电极施加恒定扫描速度得电压持续得观察电极表面电流与电位得关系,可以用来表征电极表面发生得反应以及探讨电极反应得机理、ﻫ而电镀就是给电极施加恒定得电流使得金属离子在镀件表面沉积,现在常见得电镀锡、电镀铜、电镀锌、电镀镍、电镀铬与电镀贵金属等。
您说得电镀铂就就是贵金属一种、
所以说,两者没有必然得关系。
一般就是先进行电镀,然后进行循环伏安表征。
这可能就是她们之间得一点联系吧。
这就是电分析方面得,标准曲线还就是通过紫外或者红外等其她手段测量比较好,通过CV测量得话,得需要做一批不同浓度得CV曲线,通过曲线特征峰得积分面积从而确定浓度与峰面积之间得关系,然后绘制出标准曲线。
这样就可以用来测定未知物得浓度了!
物理吸附就是通过范德华力之间作用得,不能通过CV曲线来测量。
化学吸附就是分子之间得相互作用,就是可以通过CV曲线测量得。
一般得,如果峰值电流与浓度之间呈现线性关系,则可以认为就是化
学吸附。
当然通过特征峰分析也就是可以得。
希望能对您有帮助,您可以查瞧一些电化学测量方面得书籍。
循环伏安可以用于电沉积金属得,实际就是就就是在CV过程中,金属盐或者酸发生还原被还原成单质得。
循环伏安法,这里有篇很好得综述介绍,我这里再把链接发下,这就是前不久有站友问到这个问题我发上来得,链接就是:。
