如何使用Image-Pro Plus分析划痕实验
Imageproplus使用指南.
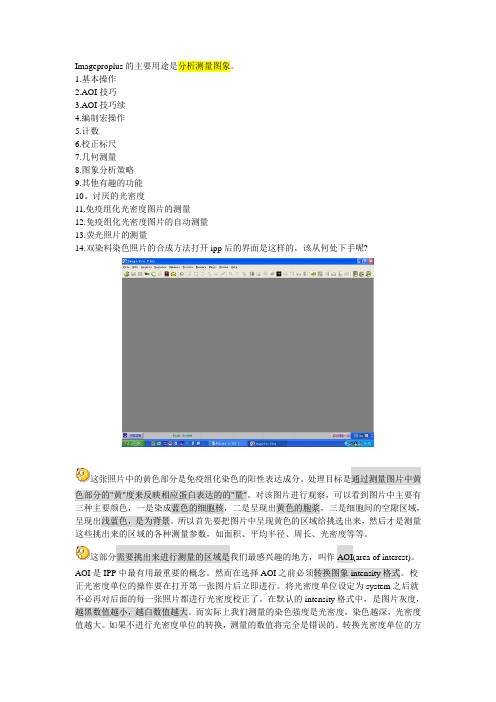
Imageproplus的主要用途是分析测量图象。
1.基本操作2.AOI技巧3.AOI技巧续4.编制宏操作5.计数6.校正标尺7.几何测量8.图象分析策略9.其他有趣的功能10。
讨厌的光密度11.免疫组化光密度图片的测量12.免疫组化光密度图片的自动测量13.荧光照片的测量14.双染料染色照片的合成方法打开ipp后的界面是这样的,该从何处下手呢?这张照片中的黄色部分是免疫组化染色的阳性表达成分。
处理目标是通过测量图片中黄色部分的"黄"度来反映相应蛋白表达的的"量"。
对该图片进行观察,可以看到图片中主要有三种主要颜色,一是染成蓝色的细胞核,二是呈现出黄色的胞浆,三是细胞间的空隙区域,呈现出浅蓝色,是为背景。
所以首先要把图片中呈现黄色的区域给挑选出来,然后才是测量这些挑出来的区域的各种测量参数,如面积、平均半径、周长、光密度等等。
这部分需要挑出来进行测量的区域是我们最感兴趣的地方,叫作AOI(area of interest)。
AOI是IPP中最有用最重要的概念。
然而在选择AOI之前必须转换图象intensity格式。
校正光密度单位的操作要在打开第一张图片后立即进行。
将光密度单位设定为system之后就不必再对后面的每一张照片都进行光密度校正了。
在默认的intensity格式中,是图片灰度,越黑数值越小,越白数值越大。
而实际上我们测量的染色强度是光密度,染色越深,光密度值越大。
如果不进行光密度单位的转换,测量的数值将完全是错误的。
转换光密度单位的方法如下:点击:measure--carliberation--intensity,调出intensity校正窗口。
然后在窗口中点new 按纽,再点一下下面的std optical density选项,这时可以看到窗口中的直线变成了反向的曲线。
然后还要点一下最上面的system按纽。
最后点close关闭窗口。
这样就把程序系统的灰度单位转换成了光密度单位。
细胞划痕实验操作步骤

细胞划痕实验操作步骤
细胞划痕实验(scratch assay)是一种简单、有效的方法,用于研究细胞迁移能力,常用于评估细胞愈合、癌细胞侵袭能力等。
下面是一个基本的细胞划痕实验操作步骤:
1. 细胞播种
在适宜的培养皿中(如6孔板)播种细胞,通常需达到90%以上的培养皿底面覆盖度,以形成一个单层细胞层。
这一步骤确保细胞能均匀分布在培养皿底部。
2. 形成划痕
在细胞长至接近合并(通常是培养24小时后)时,使用一个标准的200μl吸头尖、刻度尺或专用的划痕工具,在细胞层上轻轻划出一条直线,形成一个“划痕”。
要尽量保持划痕的宽度和长度一致,以方便后续的比较分析。
3. 清洗细胞
使用磷酸盐缓冲液(PBS)轻轻清洗培养皿1-2次,以去除漂浮的和受损的细胞。
4. 添加新的培养基
向培养皿中添加含有或不含有测试药物的新鲜培养基。
这一步是为了研究特定因子对细胞迁移能力的影响。
5. 拍摄初始照片
在划痕后立即使用倒置显微镜拍摄划痕的照片,作为实验的起始点。
6. 培养和定时拍照
将细胞置于37°C、5% CO2的细胞培养箱中培养。
在特定时间点(如6、12、24小时)取出,使用相同的显微镜设置拍摄划痕的照片,记录细胞迁移和划痕愈合的过程。
7. 数据分析
使用图像分析软件(如ImageJ)分析划痕愈合前后的面积或宽度变化。
通过比较划痕愈合的面积百分比或划痕宽度的变化,评估细胞迁移能力。
细胞划痕实验的结果可以通过计算划痕愈合的百分比来定量分析细胞迁移速度,为研究细胞迁移机制提供了一种简单有效的方法。
ImagePro的使用

(4)HSV模型
每一种颜色都是由色相(Hue),饱和度(Saturation)和色明度 (Value)所表示的颜色模型.
(5)其他颜色模型
一. 概述
使用Imagpe-Pro Plus处理图片数据
(二) 相关术语 6. 阈值
一个领域或一个系统的界限称为阈,其数值称为阈值.各科 学领域中均有阈值.
在图像处理中,阈值是指将颜色分割为黑白两种颜色的临 界像素值.IPP扩展了阈值的应用范围到彩色上,定义了红 绿蓝三种颜色通道各自的阈 值.
4
16
5
32
6
64
7
128
8
256
像中,位深表示每个像素可能有的灰度级数.
一. 概述
使用Imagpe-Pro Plus处理图片数据
(二) 相关术语 4. 图像分辨率 用于量度位图图像内数据量多少的一个参数. 分辨率的表示 PPI:每英寸像素数 每一个方向上的像素数量:如640×480 DPI:图形的长度与宽度
亮度(Intensity)来描述色彩 的颜色模型.
一. 概述
使用Imagpe-Pro Plus处理图片数据
(二) 相关术语 5.颜色模型
一. 概述
(3) CMY模型 计算机在农业上的应用
由青色(Cyan), 洋红(Magenta), 黄色(Yellow)叠加产生各种 颜色的颜色模型.出版印刷常用的颜色模型.
使用Imagpe-Pro Plus处理图片数据
(三)利用 segmentation工具 完成色彩分割 1. 基于直方图模型
文件:保存当前分割类别或载入以前保存的分割类别信 息.载入类别时,就是准确地重复上一次的选择,这对以同 样选色标准测量大批图片很有用.
Image Pro Plus教程

分析测量图象软件Imagepro-Plus教程一、入门Imageproplus(IPP)的主要用途是分析测量图象。
本人使用该程序进行生物图象分析有一段时间,写此帖的主要目的还是与大家交流使用心得,并总结一下使用方法。
如果你是刚接触IPP,最好先从本帖看起,并同时打开你电脑上的IPP程序照着操作。
学会一个软件需要花一段时间的,两分钟不可能学会。
两小时也太短。
但我相信,照着我这几个帖子作下来,至少是可以用IPP干一点事情了。
打开IPP后的界面是这样的,该从何处下手呢?既然是处理图片,当然是先要打开一张要处理的图片嘛这张照片中的黄色部分是免疫组化染色的阳性表达成分。
处理目标是通过测量图片中黄色部分的"黄"度来反映相应蛋白表达的的“量”。
对该图片进行观察,可以看到图片中主要有三种主要颜色,一是染成蓝色的细胞核,二是呈现出黄色的胞浆,三是细胞间的空隙区域,所以首先要把图片中呈现黄色的区域给挑选出来,这部分区域是我们最感兴趣的地方,叫作AOI(area of interest)。
AOI是IPP中最有用最重要的概念。
如何能够准确地选取AOI就是使用IPP的关键操作。
一旦准确地选取了AOI,下面的测量分析就好办了。
对不同的图片,需灵活地使用各种适当的AOI工具,就这张图片来说,AOI是黄色区域,因此用颜色分类的AOI工具是最有效的。
点击measure---count/size,弹出分类测量窗口在窗口中选中manual,再点击select color,弹出颜色选择窗口segmentation,这个工具是IPP最有特色的颜色选取工具之一。
用好这个工具是使用IPP的要点。
对于目标颜色鲜明的图片,用吸管工具是最简单的。
点一下吸管图标,在目标区域点一下,就可以选中该点的颜色,当然一下是不可能完全选中所需要指定的全部区域,可以在未选中的地方接着再点,这样多次选取,直到把想选中的区域全部选中为止。
在这张示例图中,选中的蓝色细胞核部分被标上了红色。
image-pro-plus教程

i m a g e-p r o-p l u s教程-CAL-FENGHAI.-(YICAI)-Company One1Image pro plus 教程1. 打开图片:打开软件双击图标,弹出窗口点击OK就行了。
进入软件,会弹出:直接叉掉。
打开图片点击工具栏第一的图标“open document”选择图片:界面变成这样:↓2. 设置标尺设置标尺点击”Measure”→Calibration(标度)→Spatial,弹出设置标尺的对话框(如下图)Spatial Calibration。
给标尺命名点击对话框右下角“From resolution”,见上图,将标尺命名为所选图片的名称,也可以点击“Name”右边的下拉箭头(见上图),选择已有的标尺(加入你的SEM图是5W倍的,而你之前处理过5W倍的图片,建立过5W倍的标尺,那么你就可以在下拉菜单里直接找出那个标尺)设置标尺长度点击“Image”,出现一个白色的标尺,见下图,和“Scaling”对话框,在“Scaling”对话框内输入1(对应图片的标尺是1um,如果你的图片标尺是100nm的话,此处应输入100)鼠标右键点击,将标尺拖到图片标尺的位置,见下图。
并调整标尺大小,使之与图片标尺一样大小。
在“Scaling”对话框内点击“OK”。
回到“Spatial Calibration”对话框。
设置标尺单位下面要设置标尺的单位。
因为我们选择的图片标尺是1um,这里我们要选择um 为单位。
点击“Spatial Calibration”对话框里的“Unit”下拉箭头,出现很多单位,其中um和nm是我们常用的。
如果你的标尺单位是nm,这里就要选择nm。
如下图所示:将标尺应用到图片上以上,我们设置好了标尺的长度和标尺单位,下面我们将标尺应用到我们的图片上面:在“Spatial Calibration”对话框点击“Apply”,再点击“Mark”,出现“Spatial Calibration Marker”对话框。
image-pro-plus教程

i m a g e-p r o-p l u s教程-CAL-FENGHAI.-(YICAI)-Company One1Image pro plus 教程1. 打开图片:打开软件双击图标,弹出窗口点击OK就行了。
进入软件,会弹出:直接叉掉。
打开图片点击工具栏第一的图标“open document”选择图片:界面变成这样:↓2. 设置标尺设置标尺点击”Measure”→Calibration(标度)→Spatial,弹出设置标尺的对话框(如下图)Spatial Calibration。
给标尺命名点击对话框右下角“From resolution”,见上图,将标尺命名为所选图片的名称,也可以点击“Name”右边的下拉箭头(见上图),选择已有的标尺(加入你的SEM图是5W倍的,而你之前处理过5W倍的图片,建立过5W倍的标尺,那么你就可以在下拉菜单里直接找出那个标尺)设置标尺长度点击“Image”,出现一个白色的标尺,见下图,和“Scaling”对话框,在“Scaling”对话框内输入1(对应图片的标尺是1um,如果你的图片标尺是100nm的话,此处应输入100)鼠标右键点击,将标尺拖到图片标尺的位置,见下图。
并调整标尺大小,使之与图片标尺一样大小。
在“Scaling”对话框内点击“OK”。
回到“Spatial Calibration”对话框。
设置标尺单位下面要设置标尺的单位。
因为我们选择的图片标尺是1um,这里我们要选择um 为单位。
点击“Spatial Calibration”对话框里的“Unit”下拉箭头,出现很多单位,其中um和nm是我们常用的。
如果你的标尺单位是nm,这里就要选择nm。
如下图所示:将标尺应用到图片上以上,我们设置好了标尺的长度和标尺单位,下面我们将标尺应用到我们的图片上面:在“Spatial Calibration”对话框点击“Apply”,再点击“Mark”,出现“Spatial Calibration Marker”对话框。
imageproplus教程

Image pro plus 教程1. 打开图片:打开软件双击图标,弹出窗口点击OK就行了。
进入软件,会弹出:直接叉掉。
打开图片点击工具栏第一的图标“open document”选择图片:界面变成这样:↓2. 设置标尺设置标尺点击”Measure”→Calibration(标度)→Spatial,弹出设置标尺的对话框(如下图)Spatial Calibration。
给标尺命名点击对话框右下角“From resolution”,见上图,将标尺命名为所选图片的名称,也可以点击“Name”右边的下拉箭头(见上图),选择已有的标尺(加入你的SEM图是5W倍的,而你之前处理过5W倍的图片,建立过5W倍的标尺,那么你就可以在下拉菜单里直接找出那个标尺)设置标尺长度点击“Image”,出现一个白色的标尺,见下图,和“Scaling”对话框,在“Scaling”对话框内输入1(对应图片的标尺是1um,如果你的图片标尺是100nm的话,此处应输入100)鼠标右键点击,将标尺拖到图片标尺的位置,见下图。
并调整标尺大小,使之与图片标尺一样大小。
在“Scaling”对话框内点击“OK”。
回到“Spatial Calibration”对话框。
设置标尺单位下面要设置标尺的单位。
因为我们选择的图片标尺是1um,这里我们要选择um为单位。
点击“Spatial Calibration”对话框里的“Unit”下拉箭头,出现很多单位,其中um和nm是我们常用的。
如果你的标尺单位是nm,这里就要选择nm。
如下图所示:将标尺应用到图片上以上,我们设置好了标尺的长度和标尺单位,下面我们将标尺应用到我们的图片上面:在“Spatial Calibration”对话框点击“Apply”,再点击“Mark”,出现“Spatial Calibration Marker”对话框。
如下图:Style:表示标尺样式,我一般用第一个。
Marker length:标尺长度,因为图片标尺是1um,刚才我们设置的标尺长度也是1um,所以这里标尺长度为1。
Imageproplus使用教程

Imageproplus使⽤教程Image Pro Plus使⽤⽅法(ipwin32) 陈冠-中南⼤学材料院⼀、添加标尺1.⾸先打开⼀张图⽚,选择Measure→Calibration→Spatial界⾯如下所⽰。
2.点击New→Name(可以按照倍数命名,如1000x)→Unit(µm)→Pixels/Unit(选择Pixels/unit)→Image(第⼀个),得到右图界⾯。
在Scaling界⾯点击,出现Local Zoom界⾯,此界⾯可以显⽰标尺摆放的细节。
.3.将绿⾊⼯字型摆放到图⽚标尺处,然后将Scaling界⾯的10µm改成100µm,然后点击OK。
关掉原来的页⾯就⾏了。
4.标尺已经新建好了,下次使⽤前把标尺调出来就⾏了。
点击,选择需要的标尺。
每次打开新图⽚,都要重新选择标尺。
⼆、定量分析1.打开⼀张图⽚,点击,出现如下页⾯。
2.点击,出现如下页⾯。
此时是系统默认的选取颜⾊,你也可以点击,然后重新拾取⾃⼰想要统计的颜⾊。
然后点击close,在count/size界⾯点击count进⾏计算。
3.count/size界⾯,选择measure的选项。
点击select measurements...左侧有相关选项,包括area、diameter等测量选项,点击后会出现在右侧窗⼝,然后选择measure就返回到count/size界⾯。
查看相关结果,如下所⽰。
选择statistic,4.有时统计的时候部分孔粘合在⼀起,可以通过“count/size--Eidt---watershed split”将其分开,同样可以通过view查看数据结果,但是此时不能再点击count,否则⼜会合并在⼀起。
5.过滤(除去不合适的)就是把部分不需要的过滤掉,过滤的标准可以选择很多,⽐⽅说太⼩或者太⼤、不圆等等均可以过滤掉。
例如,在filter ranges 中选择area识别过滤(或者其他过滤标准),然后调整下⾯start和end,然后点击measure即可,通过图⽚窗⼝可以查看到过滤后的情况通过蓝⾊区域读取过滤的信息。
image pro plus教程

Image pro plus 教程1. 打开图片:1.1 打开软件双击图标,弹出窗口点击OK就行了。
进入软件,会弹出:直接叉掉。
1.2 打开图片点击工具栏第一的图标“open document”选择图片:界面变成这样:↓2. 设置标尺2.1 设置标尺点击”Measure”→Calibration(标度)→Spatial,弹出设置标尺的对话框(如下图)Spatial Calibration。
2.2 给标尺命名点击对话框右下角“From resolution”,见上图,将标尺命名为所选图片的名称,也可以点击“Name”右边的下拉箭头(见上图),选择已有的标尺(加入你的SEM图是5W倍的,而你之前处理过5W倍的图片,建立过5W倍的标尺,那么你就可以在下拉菜单里直接找出那个标尺)2.3 设置标尺长度点击“Image”,出现一个白色的标尺,见下图,和“Scaling”对话框,在“Scaling”对话框输入1(对应图片的标尺是1um,如果你的图片标尺是100nm的话,此处应输入100)鼠标右键点击,将标尺拖到图片标尺的位置,见下图。
并调整标尺大小,使之与图片标尺一样大小。
在“Scaling”对话框点击“OK”。
回到“Spatial Calibration”对话框。
2.4 设置标尺单位下面要设置标尺的单位。
因为我们选择的图片标尺是1um,这里我们要选择um为单位。
点击“Spatial Calibration”对话框里的“Unit”下拉箭头,出现很多单位,其中um和nm 是我们常用的。
如果你的标尺单位是nm,这里就要选择nm。
如下图所示:2.5 将标尺应用到图片上以上,我们设置好了标尺的长度和标尺单位,下面我们将标尺应用到我们的图片上面:在“Spatial Calibration”对话框点击“Apply”,再点击“Mark”,出现“Spatial Calibration Marker”对话框。
如下图:Style:表示标尺样式,我一般用第一个。
手把手教你使用Imagepro-Plus(1.入门

手把手教你使用Imagepro-Plus(1.入门)(修订0700905) - Welcome to Forum
mxh8174
2006-07-12 10:22
非常感谢,我已从网上下载下来了一个图像分析软件可是自己研究了好一阵还是一 头雾水,谢谢无私的奉献,使我有为实验节省了一点经费。祝工作顺利!
发贴: 2 积分: 0 得票: 0 状态: 离线
锦上添花:SCI论文修改润饰
举报
2006-04-21 07:54 陈老师,可否给我发一个中文说明书呢?英文水平太差了!感谢哦! andybalake@
• 国际著名遗传学家谈家桢院士迎来百岁华诞
举报
2006-04-22 17:23
jss2004
• 【交流】甘露醇的临床应用误区及经验
2006-09-22 15:59 受益非浅,谢谢
举报
发贴: 64 积分: 3 得票: 5 状态: 离线
• "星光灿烂"的大地
举报
/bbs/post/view?bid=10&id=3554359&sty=1&tpg=2&ppg=2&age=0(第 7/12 页)2008-9-20 7:55:05
SCI医学论文翻译
举报
/bbs/post/view?bid=10&id=3554359&sty=1&tpg=2&ppg=2&age=0(第 2/12 页)2008-9-20 7:55:05
手把手教你使用Imagepro-Plus(1.入门)(修订0700905) - Welcome to Forum
医学文献看不懂怎么办?
举报
2005-12-30 11:03
手把手教你使用Imagepro-plus(第二版)

教你使用Imagepro Plus第二版作 者 hbchendl编辑 doctor_li目录第一篇 Imagepro plus基础入门 (1)1.图像分析入门 (1)2.图像分析软件-Imagepro plus (2)3.简单的测量操作过程 (3)4.选择测量对象的工具 (6)5.选择测量对象的工具(续) (9)6.简单的测量方法 (13)7.最重要的测量工具count/size (14)8.提高测量效率的必须技术-宏操作 (20)9.修饰图片 (22)10.计量-关于标尺的操作 (23)11.如何在图片上加标尺 (26)12.灰度相关的事 (29)第二篇 Imagepro plus应用实例 (30)1.细胞计数 (30)2.免疫组化照片密度分析 (32)3.免疫组化照片密度(自动)分析 (38)4.细胞核的免疫组化照片密度分析 (40)5.荧光强度分析 (41)6.合成荧光照片 (42)7.Western Blot照片的密度分析 (43)第一篇 Imagepro plus基础入门第一篇 Imagepro plus基础入门1.图像分析入门什么是图像分析?好象很多人对此还很糊涂呢,所以有必要首先回答一下这个问题。
图像分析就是通过分析图片的方法来测量图片上测量对象的测量数值。
举例来说吧,如果需要测量一个足球的直径,就可以使用一根皮尺,绕着足球最大周长量一下,得到最大周长的值,直径就是周长除以圆周率。
或者用一个大卡尺直接去量足球的直径。
这,叫作测量。
还有一个方法,在足球边上放一根直尺,然后用数码相机拍摄下足球与其旁边的直尺的照片,然后在图像分析软件上先测量照片上足球图像的直径,再与直尺图像进行比较,最后得到足球的实际直径尺寸数值。
这,叫作图像分析。
图像分析是一种间接的测量方法,在许多情况下,无法进行实际的测量时,使用图像分析的方法能有效地完成准确的测量。
采用图像分析的方法进行测量分析时,一般是下列这个过程:1.明确需要测量分析的对象。
【图片分析】如何应用imageJ进行细胞划痕面积分析?

细胞划痕(wound healing)法是简捷测定细胞迁移运动和修复能力的方法,常用于肿瘤细胞运动的研究。
当我们人为的划开一个“伤口”后,划痕边缘的细胞便努力迁移覆盖中间的空白区域,使伤口愈合。
然而迁移的形状并不是规律的,通过细胞迁移会形成各异的形状。
在细胞划痕实验结束后,我们需要对细胞划痕实验数据统计分析处理。
然而,面对细胞划痕形态多样的“愈合伤口”,统计二维的面积是目前最常用最适合的方法。
细胞划痕实验中常用的获取选区的方法有方差(variance)滤波法(插件法),查找边缘(find-edges)法。
imageJ软件,在面积统计方面非常适合,对于划痕实验数据的统计利用imageJ即可轻松实现。
今天小编就基于imageJ软件来详细介绍下如何进行划痕实验分析。
01插件法1、插件安装插件下载地址:rs.fr/attachments/download/1992/MRI_Wound_Healing_Tool.ijm将下载的插件“MRI_Wound_Healing_Tool.ijm”文件放到安装目录下的macros/toolsets文件夹。
2、重启ImageJ,然后点击ImageJ工具栏的>>按钮,可得插件位置;3、单击后在新工具栏中出现两个图标,第一个按钮是打开插件官网的帮助界面,“m”是用来测量的。
左键单击第二个按钮“m”开始测量,右键单击“m”设置参数。
4、插件内置有两种方法,默认是方差滤波法;(1)打开需要测量的图片,直接左键单击m图标,秒出结果,不过从本次结果来看,红色选区轮廓线离细胞有点距离,细胞划痕面积会偏小。
(2)以上为默认参数。
如果效果不好,可以根据下面的参数说明进行调参:右键点击“m”按钮设置参数。
比如将Variance filter radius值改小一点,将Threshold改大一点,点击OK;再次点击m 图标,这回划痕面积和选区轮廓线也更贴近细胞一点;●Variance filter radius(方差滤波器半径):要根据图片分辨率来设置,默认是10px,主要是用来识别划痕边缘,越大计算越慢,而且会导致测量得到划痕面积偏小;●Threshold(阈值):将由方差滤波器得到的图像转换为蒙版;如果调小一点选区会更精细,但会丢失掉一部分选区;调大一点,对于划痕区域识别会更准,但对边缘轮廓线会进行近似处理;具体可用查找边缘法中的threshold建立选区的操作体验一下。
imagej计算划痕方法

imagej计算划痕方法
在ImageJ中,您可以使用以下步骤计算划痕宽度:
1. 首先打开需要分析的划痕图片。
2. 然后选择“Analyze”菜单,在下拉菜单中选择“Set Scale”。
在弹出的对话框中输入已知的实际距离,例如划痕的实际宽度,并选择适当的单位。
点击“OK”按钮应用标尺校正。
3. 接下来,选择“Analyze”菜单,在下拉菜单中选择“Plot Profile”。
沿着划痕的方向拖动十字标尺,生成一个划痕宽度的分布图。
4. 在生成的划痕宽度分布图中,您可以看到每个像素点的宽度值。
通过这些值,您可以计算出划痕的平均宽度。
通过以上步骤,您可以在ImageJ中准确地计算出划痕的宽度。
请注意,您需要提前了解划痕的实际宽度以便进行标尺校正。
image proplus 操作规程

Image-Pro®Plus 6.0(IPP) 操作规程1.简介Image-Pro®Plus (IPP)是一款运行在windows操作系统环境的付费图像分析软件。
目前最新的版本是6.0。
该软件可分析常见格式的图像,如.jpg,.tif,.bmp等。
IPP可以用来分析图片中目标区域的多种参数,如数量,面积,长度,角度,光密度等。
通过该软件可以得到统计结果,并且可以直接将结果输出到Microsoft Office Excel。
2.系统要求IPP可以运行在目前windows各版本的操作系统中,如Windows 2000,XP,Vista和7. 至少需要奔腾三(1.0Ghz)处理器,512M内存(推荐1G),3G剩余硬盘空间。
3.工具使用IPP分析图片,最重要的是在图片上选取要分析的目标区域,该区域被称之为感兴趣的区域(Area of interest, AOI)。
在IPP中选取目标区域常用的工具有很多,我们在这里仅介绍分析Western Blot和RT-PCR图片使用到工具——Irregular Tool。
该工具有自动和手动两种方式,分别对应“Wand”和“Trance”。
3.1 开启Irregular Tool如图1所示,点击红圈处按钮,即可开启Irregular Tool。
图13.2 Wand开启“Irregular Tool”后,会出现图2中的工具框,此时显示“Trace”,对应的模式是“Wand”图2此工具的使用方法是用鼠标左键点击目标区域(如WB 中的条带),直至选中满意的目标区域为止。
软件会自动识别AOI,如果选中的AOI不能很好的覆盖目标区域,可以调节“Range”中的数字,一般来说条带越深该数字应越大,反之越小。
“Smooth”中的数字一般为1。
3.3 Trace对于界限模糊或者背景很深的图片,用“Wand”可能很难选到满意的AOI,这时可以使用手动选取AOI的工具“Trace”。
Imageproplus使用指南
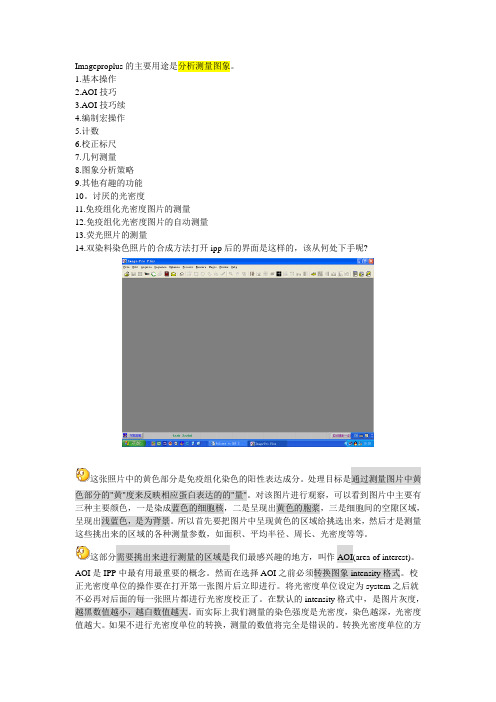
Imageproplus的主要用途是分析测量图象。
1.基本操作2.AOI技巧3.AOI技巧续4.编制宏操作5.计数6.校正标尺7.几何测量8.图象分析策略9.其他有趣的功能10。
讨厌的光密度11.免疫组化光密度图片的测量12.免疫组化光密度图片的自动测量13.荧光照片的测量14.双染料染色照片的合成方法打开ipp后的界面是这样的,该从何处下手呢?这张照片中的黄色部分是免疫组化染色的阳性表达成分。
处理目标是通过测量图片中黄色部分的"黄"度来反映相应蛋白表达的的"量"。
对该图片进行观察,可以看到图片中主要有三种主要颜色,一是染成蓝色的细胞核,二是呈现出黄色的胞浆,三是细胞间的空隙区域,呈现出浅蓝色,是为背景。
所以首先要把图片中呈现黄色的区域给挑选出来,然后才是测量这些挑出来的区域的各种测量参数,如面积、平均半径、周长、光密度等等。
这部分需要挑出来进行测量的区域是我们最感兴趣的地方,叫作AOI(area of interest)。
AOI是IPP中最有用最重要的概念。
然而在选择AOI之前必须转换图象intensity格式。
校正光密度单位的操作要在打开第一张图片后立即进行。
将光密度单位设定为system之后就不必再对后面的每一张照片都进行光密度校正了。
在默认的intensity格式中,是图片灰度,越黑数值越小,越白数值越大。
而实际上我们测量的染色强度是光密度,染色越深,光密度值越大。
如果不进行光密度单位的转换,测量的数值将完全是错误的。
转换光密度单位的方法如下:点击:measure--carliberation--intensity,调出intensity校正窗口。
然后在窗口中点new 按纽,再点一下下面的std optical density选项,这时可以看到窗口中的直线变成了反向的曲线。
然后还要点一下最上面的system按纽。
最后点close关闭窗口。
这样就把程序系统的灰度单位转换成了光密度单位。
如何使用Image-Pro-Plus分析划痕实验

划痕攻略之如何使用Image-Pro Plus分析划痕实验划痕实验大家做了不少,但是如何能快速地将实验结果量化呢?今天给大家介绍如何用Image-Pro Plus分析划痕实验。
我们先回顾一下划痕实验的实验原理和步骤实验原理:细胞划痕法是测定肿瘤细胞的运动特性的方法之一,是在体外培养的单层细胞上划痕致伤,观察肿瘤细胞的迁移情况。
实验步骤:1、培养板接种细胞之前先用marker笔在6孔板背面画横线标记(方便拍照时定位同一个视野)。
2、细胞消化后接入6孔板,数量以贴壁后铺满板底为宜(数量少时可培养一段时间至铺满板底)。
3、细胞铺满板底后,用10pL枪头垂直于孔板制造细胞划痕,尽量保证各个划痕宽度一致。
4、吸去细胞培养液,用PBS冲洗孔板三次,洗去划痕产生的细胞碎片。
5、加入含有4)ig/mL丝裂霉素(防止细胞增殖过快)的完全/基础培养基,拍照记录。
6、将培养板放入培养箱培养,不同时间点取出拍照。
7、I mage-Pro Plus分析实验结果。
划痕实验的结果是以照片的形式呈现的,那么如何将这一大批的图片进行量化呢?下面我给大家介绍一下运用Image-Pro Plus来分析划划痕实验结果。
我用的是Image-Pro Plus 6.0版本(需要的小伙伴可以私信拿安装包)1 .首先打开Image-Pro Plus,在File菜单栏下的open那里选择你要分析的图片或者把你要分析的图片直接拖入软件中(fig.l)。
& H » C 团隐口圈也帽I穴,ss糅"斜曲旨M ii或K段i® m囹贸期Fig.l2 .选择工具栏里的计算和测量工具即红色箭头所指(Fig.2)。
_1;;c-P' - Au.一- J ■..: P-- :-PXCr\ <_C:?-'/r:.G-- !• -. J3—Ale Edit Acquire Sequence Enhance Process Measure Macro Window HelpFig.2□ O G 备/ ■州Q 雷吹卅B •H AO IQ [L (9 9 屈贸易3.在count/Size小窗口里选择measure下拉栏里的select measurements选择我们要分析的面积(Area)和宽度(Box width) (Fig.3)隙□ O G 色,Q 州急 帽 lx 卅 * H g k 1叫HAETE 曲IL 略圈弱刷Fig.34. 选择划痕面积的工具有三种(红圈出部分),可根据实验情况选择一种进行分 析(fig.4)。
【教程】如何快速测量细胞划痕宽度?

【教程】如何快速测量细胞划痕宽度?聊点学术细胞划痕实验可谓是性价比超高的一个小实验了。
可以在不额外购买实验设备的情况下,一定程度地评价肿瘤细胞或者成纤维细胞的迁移能力。
在课题组经(Pin)费(Qiong)的限制下,这个实验成为很多老板的最爱。
细胞划痕实验本身的操作很简单,网上有很多教程,此处不赘述。
当你辛辛苦苦拿到了下面这张照片时,说明你已经成功了一大半。
接下来的工作就是测量,本文将以此为例,写出测量的图文教程。
1. 下载并安装Image Pro Plus。
(公众号后台回复“IPP”,即可获取软件)2. 点击File→Open,打开你需要测量的图片。
3. 增强细胞划痕边界的信号,以提高IPP识别准确度。
点击Process,点击过滤器Filters。
4. 在Filters弹窗中,依次选择以下参数,需要做3步。
(4.1)在Edge选项下,选择Sobel。
然后鼠标拖右侧的小窗口,将细胞划痕的边缘拖到这个窗口处,意在增强这个边界。
点击Apply之后,可以看到目标图片已经发生改变,边界更加清晰了。
(4.2)在Morphological选项下,选择Close。
然后鼠标拖右侧的小窗口,使得细胞占满这个窗口。
此步意在通过算法将细胞区域中的空隙都填充上颜色,以提高IPP的自动识别准确度。
点击Apply之后,可以看到目标图片再次发生改变。
(4.3)在Enhancement选项下,选择Lopass,选择5X5,然后鼠标拖右侧的小窗口,使得划痕边界处在这个窗口。
此步骤意在调整划痕边界的平滑度。
点击Apply之后,可以看到目标图片又一次发生改变。
5. 增强图片的对比度。
(5.1)点击Enhance,选择Contrast Enhancement,调出下面的设置界面弹窗。
(5.2)拉动图中的曲线,以获取合适的对比度。
(当然你也可以点击弹窗中Save选项,保存这个对比度文件。
后面测量其它图片时,到了这一步可以点击Load调出设置文件。
手把手教你用imagej计算细胞划痕实验面积

⼿把⼿教你⽤imagej计算细胞划痕实验⾯积
本来是⾃⼰⼀直在园⼦⾥找教程,结果能找到的有⽤的信息都是需要积分才能看,⼏乎找遍全
园⼦,也没有⼀个系统的教程。
于是,我决定⾃⼰写⼀个帖⼦帮助那些跟我⼀样没有积分,需要帮助的战友,因为经历了之前
的焦躁、⽆奈、急切,太理解这种⼼情了。
⾸先,你需要下载⼀个image j的软件,这个很好找,园⼦⾥也有,就不赘述了。
下⾯开始正式使⽤
1.打开软件选择你要处理的图⽚
2.增强对⽐选择process enhance contrast
3.选择Normalize 将 satura...改为0.3
4.平滑边缘如图选择smooth
5.寻找边缘如图选择
6.调整阈值如图两个值分别调整为0 20后apply(图上我弄得是0 18)
7.最后⼀步就可以选择区域啦选择魔棒⼯具选出划痕区域
8.计算⾯积
第⼀次发帖如有不对请批评指正
在园⼦⾥看到⼀句话很好实验是简单的,道路是曲折的,时间就是⽤来浪费的,科研就是⾃娱
⾃乐使劲折腾。
最近实验不顺,希望攒攒⼈品!。
细胞划痕的面积怎么定量统计?此神器助你发高分

细胞划痕的面积怎么定量统计?此神器助你发高分人为地在单层贴壁细胞上划出一条笔直、粗细均匀的“伤痕”,只要计算出不同实验组前后划痕面积的比值即可比较侵袭以及迁移能力强弱。
别人家高分文章的图是这个样子的,是不是很高阶?峰值计算?迁移热点都能展示吗?今天给大家先介绍一下划痕的面积计算,并不是用尺子量!此神器就是…还是…神通的Image J!Image J!Image J!它法力无边:可用于分析DNA电泳和western blotting条带的灰度值,细胞计数,细胞共定位,细胞划痕面积……使尽洪荒之力,终于让本仙get到如下方法,现倾情分享给大家,拿走不谢!我们就来细致的学习一下如何用它来计算细胞划痕面积(简单7步,保证你能学会哦)1、导入图片:File→open:打开要测量的划痕图2、转换图片格式:Image→Type→8-bit (调成灰度图片,此步骤非常重要,必须转换)3、找到划痕边缘:Process→Find Edges4、加强对比:Process→SharpenPS:此步骤截图看起来没有在电脑上实际操作明显,但很重要5、Image→Adjust→ThresholdA红框:设置Default为B&W,即默认值为黑&白;B绿框:适当调节绿框中的值使细胞的亮度更明显(也可以使用默认值,调节的终点以划痕中间出现零星白点为佳),如本例中从默认67调到了61,效果如下:6、再重复步骤3,即Process→Find Edges,效果如下图:然后将下图操作界面直接关掉:7、结果分析:Anal yze→Analyze Particles将1框中参数改为10000-Infinity将2中Display Results、Summarize以及Add to Manager打钩将3中Show值参数改为Outlines最后点击OK8、结果出来啦:上图左蓝色曲线包围的面积即为测量的划痕区,中间为划痕区示意图,右图红色框内的数值即为我们测得的划痕区面积值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
划痕攻略之如何使用Image-Pro Plus分析划痕实验划痕实验大家做了不少,但是如何能快速地将实验结果量化呢?今天给大家介绍如何用Image-Pro Plus分析划痕实验。
我们先回顾一下划痕实验的实验原理和步骤
实验原理:细胞划痕法是测定肿瘤细胞的运动特性的方法之一,是在体外培养的单层细胞上划痕致伤,观察肿瘤细胞的迁移情况。
实验步骤:1、培养板接种细胞之前先用marker笔在6孔板背面画横线标记(方便拍照时定位同一个视野)。
2、细胞消化后接入6孔板,数量以贴壁后铺满板底为宜(数量少时
可培养一段时间至铺满板底)。
3、细胞铺满板底后,用10μL枪头垂直于孔板制造细胞划痕,尽量
保证各个划痕宽度一致。
4、吸去细胞培养液,用PBS冲洗孔板三次,洗去划痕产生的细胞碎
片。
5、加入含有4μg/m L丝裂霉素(防止细胞增殖过快)的完全/基础培
养基,拍照记录。
6、将培养板放入培养箱培养,不同时间点取出拍照。
7、Image-Pro Plus分析实验结果。
划痕实验的结果是以照片的形式呈现的,那么如何将这一大批的图片进行量化呢?下面我给大家介绍一下运用Image-Pro Plus来分析划划痕实验结果。
我用的是Image-Pro Plus 6.0版本(需要的小伙伴可以私信拿安装包)
1.首先打开Image-Pro Plus,在File菜单栏下的open那里选择你要分析的图片或者把你要分析的图片直接拖入软件中(fig.1)。
Fig.1
2.选择工具栏里的计算和测量工具即红色箭头所指(Fig.2)
Fig.2
3.在count/Size小窗口里选择measure下拉栏里的select measurements 选择我们要分析的面积(Area)和宽度(Box width)(Fig.3)
Fig.3
4.选择划痕面积的工具有三种(红圈出部分),可根据实验情况选择一种进行分析(fig.4)。
Fig.4
4.1第一种方法,在工具栏里选择矩形,直接圈出划痕面积(Fig.5)。
此方法较适用于细胞划痕平整,细胞尚未开始迁移的实验结果。
Fig.5
4.2第二种方法,在工具栏里选择圆形,圈出划痕面积(圆形叠加的方法
选择工具栏的下拉栏里的Add再把圈圈移至需要圈的位置就可以了此方法较麻烦,每增加一个圈圈就需要重复一次此步骤)(Fig.6),此方法较适用于划痕边缘不整齐或中间有部分已经愈合的实验结果。
Fig.6
4.3 第三种方法,在工具栏里点击再用鼠标点击划痕的任意位置,调整至所圈面积最合适为止(Fig.7)。
此方法最为简便,但是只适用于细胞形态明显的细胞,对于一些细胞轮廓较虚的细胞很难识别。
Fig.7
5.根据第四步的方法圈好划痕的面积后,在count/Size小窗口里选择Edit下拉栏里的convert AOI to object(Fig.8),就可以把圈出来的地方转化成面积和宽了。
选择View里的measurement data(Fig.9),就能看到我们想要的数据啦(Fig.10)。
6.简单五步就能快速地将划痕结果量化了,惊不惊喜,意不意外。
用得到的面积除以宽度就能得到迁移距离,迁移率=(0h的迁移距离-其他时间点迁移距离)/0h迁移距离,轻松搞定划痕实验啦。
Fig.8
Fig.9
Fig.10。
