初中化学酸碱盐溶解性表 ()
酸碱盐溶解性表

溶解性口诀
钾,钠,铵,盐,硝酸盐,
都能溶解水中间.
盐酸盐不容银,亚汞,
硫酸盐不容钡和铅,
碳酸盐照顾溶钾钠铵
溶解性口诀一
钾钠铵盐溶水快,①
硫酸盐除去钡铅钙。
②
氯化物不溶氯化银,
硝酸盐溶液都透明。
③
口诀中未有皆下沉。
④
注:
①钾钠铵盐都溶于水;
②硫酸盐中只有硫酸钡、硫酸铅、硫酸钙不溶;
③硝酸盐都溶于水;
④口诀中没有涉及的盐类都不溶于水;
溶解性口诀二
钾、钠、铵盐、硝酸盐;
氯化物除银、亚汞;
硫酸盐除钡和铅;
碳酸、磷酸盐,只溶钾、钠、铵。
说明,以上四句歌谣概括了8类相加在水中溶解与不溶的情况。
溶解性口诀三
钾钠铵硝皆可溶、盐酸盐不溶银亚汞;
硫酸盐不溶钡和铅、碳磷酸盐多不溶。
多数酸溶碱少溶、只有钾钠铵钡溶
溶解性口诀四
钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)
盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)
再说硫酸盐,不容有钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)
其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物)
只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)
最后说碱类,钾、钠、铵和钡。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)另有几种微溶物,可单独记住。
溶解性口诀五
钾钠铵盐硝酸盐
完全溶解不困难
氯化亚汞氯化银
硫酸钡和硫酸铅
生成沉淀记心间
氢硫酸盐和碱类
碳酸磷酸硝酸盐
可溶只有钾钠铵。
酸碱盐溶解性表

NO3-
Cl-
SO42-
CO32-
H+
(H2O)
溶、挥(HNO3)
溶、挥(HCl)
溶(HHale Waihona Puke SO4)溶、挥(H2CO3)
K+
溶(KOH)
溶(KNO3)
溶(KCl)
溶(K2SO4)
溶(K2CO3)
Na+
溶(NaOH)
溶(NaNO3)
溶(NaCl)
溶(Na2SO4)
溶(Na2CO3)
NH4+
溶、挥(NH3·H2O)
不(Ag2CO3)
酸碱性溶解性表(附化学式)
酸碱盐溶解性识记口诀:
钾、钠、铵盐、硝酸盐;(钾盐、钠盐、铵盐、硝酸盐均可溶于水)
氯化物除银、亚汞;(氯化物除氯化银、氯化亚汞外均可溶于水)
硫酸盐除钡和铅;(硫酸盐除硫酸钡、硫酸铅外均可溶于水)
碳酸盐只溶钾、钠、铵。多数酸溶碱少溶、只有钾钠铵钡溶
溶(MgSO4)
微(MgCO3)
Al3+
不Al(OH)3
溶Al(NO3)3
溶(AlCl3)
溶Al2(SO4)3
---
Mn2+
不Mn(OH)2
溶Mn(NO3)2
溶(MnCl2)
溶(MnSO4)
不(MnCO3)
Zn2+
不Zn(OH)2
溶Zn(NO3)2
溶(ZnCl2)
溶(ZnSO4)
不(ZnCO3)
Fe2+
溶(NH4NO3)
溶(NH4Cl)
溶(NH4)2SO4
溶(NH4)2CO3
Ba2+
溶Ba(OH)2
初中化学酸碱盐溶解性表以及口诀 (新的)

课题1之---常见酸碱盐的溶解性(导学案)课型:新授课主备:邓爵华审核:化学组一、学习目标:1、强化酸碱盐化学式的读写。
2、加深对酸碱盐间发生复分解反应的条件、实质的理解。
3、初步认识盐的分类方法。
4、重点掌握常见酸碱盐的溶解性及其应用。
二、难点:从酸碱盐的溶解性去理解酸碱盐间发生复分解反应的实质。
三、教学过程:1、知识回顾:指出下列物质中那个是酸?那些是碱?那些是盐?1.H2O2.NaCl3.KNO34.KMnO45.CaCO36.H2SO47.H2O28.NaHCO39.Cu(OH)210.NaNO 211.Ca(OH)212.N213.MnO214.H215.NH4Cl属于酸的有(填序号,下同):;属于碱的有:;属于盐的有:。
因为酸的构成特点是:H++酸根离子碱的构成特点是:金属离子(或NH4+)+OH-盐的构成特点是:金属离子(或NH4+)+酸根离子2、根据酸碱盐的构成特点,自学课本114页的常见酸碱盐的溶解性表,①、强化酸碱盐化学式的读写(写出化学式):酸:硫酸碳酸盐酸;碱:氢氧化钠氢氧化钙;盐:氯化钠硫酸铜;碳酸钠硝酸钙。
②、盐的种类较多,为更好的识别、掌握它们,就要给它们分门别类,化繁为简:盐的分类常按所含或的类型来分类;③、归纳酸碱盐的溶解性,并熟记,以便更好应用:酸:酸全溶碱:氢氧铵钠钾钡溶盐:铵钠钾盐硝酸盐(全溶);氯化盐不溶硫酸盐不溶;碳酸盐溶3、学以致用应用一:判断常见的酸碱盐的溶解性考点:某碱或盐加入水中能否形成溶液强化练习1、下列物质加入水中能形成溶液的是()A、Cu(OH)2B、CaCO3C、BaSO4D、(NH4)2CO32、下列各组物质全部能溶于水的是:A、H2SO4CuSO4NaOHAgNO3B、CuCl2Na2SO4Mg(OH)2FeCl2C、KOHAgClKNO3Na2CO3D、Al(OH)3ZnSO4Ca(NO3)2(NH4)2SO4应用二:判断酸碱盐之间的复分解反应可否发生(即是否满足复分解反应的条件)复分解反应发生的条件:生成物中:①有水生成②有气体生成③有沉淀生成三者之一复分解反应发生的条件即体现出复分解反应的实质,即反应物的离子相互结合反应形成:水或气体或沉淀的过程。
完整)初中化学酸碱盐溶解性表以及口诀

完整)初中化学酸碱盐溶解性表以及口诀
盐的分类可以分为盐酸盐、硝酸盐、碳酸盐、硫酸盐、钠盐、钾盐、镁盐、钙盐、亚铁盐和铁盐等多种类型。
其中,盐酸盐包括NaCl和KCl,硝酸盐包括NaNO3和KNO3,碳酸盐包括Na2CO3、MgCO3、FeCO3和CaCO3,硫酸盐包括
Na2SO4、K2SO4、MgSO4、FeSO4和CaSO4,钠盐包括NaCl、NaNO3、Na2CO3、Na2SO4和NaNO3等。
钾盐包括KCl、KNO3和K2CO3等。
酸碱盐的溶解性与阳离子和阴离子的组合有关。
在20℃下,H+、NH4+、K+、Na+、Ba2+、Ca2+、Mg2+、Al3+、
Mn2+、Zn2+、Fe2+、Fe3+和Cu2+等阳离子与NO3-、Cl-和
SO42-等阴离子结合时,大多数都能溶解。
但是,AgCl只有微溶,BaSO4只有微溶,而碳酸盐只有K+、Na+、NH4+等阳离
子才能溶解,碱类只有K+、Na+、NH4+和Ba2+、Ca(OH)2、CaSO4、Ag2SO4等阳离子才能溶解。
为了记忆这些酸碱盐的溶解性,可以使用口诀:“钾钠铵
硝酸盐全溶,盐酸盐只有AgCl不容,硫酸盐只有BaSO4不容,
碳酸盐只溶K+、Na+、NH4+,碱类只溶K+、Na+、NH4+和Ba2+、Ca(OH)2、CaSO4、Ag2SO4”。
初中化学酸、碱和盐的溶解性表

溶
溶
溶
不
Ag+
-
溶
不
微
不
“溶”表示那种物质可溶于水,
“不”表示不溶于水,
“微”表示微溶于水,
“挥”表示挥发性,
“---”表示那种物质不存在或遇到水就分解了
Mg(OH)2,Al(OH)3,AgCl,BaSO4,BaCO3等均为白色沉淀
Cu(OH)2蓝色沉淀
Fe(OH)3红褐色沉淀
溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液
部分酸、碱和盐的溶解性表(20℃)
OH-
NO3-
Cl-
SO42-
CO32-
H+
溶、挥
溶、挥
溶
溶、挥
NH4+
溶溶Leabharlann 溶溶溶K+
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
不
不
Ca2+
微
溶
溶
微
不
Mg2+
不
溶
溶
溶
微
Al3+
不
溶
溶
溶
-
Mn2+
不
溶
溶
溶
不
Zn2+
不
溶
溶
溶
不
Fe2+
不
溶
溶
溶
不
Fe3+
不
溶
溶
溶
-
Cu2+
不
初中溶解性表

NO3
SO4
CO3
PO4
H
hno3
硝酸
溶挥
HCl盐酸溶挥
H2SO4
硫酸溶
H2CO3
碳酸溶挥
H3PO4
磷酸溶
K
KOH
氢氧化钾溶
kno3硝酸钾溶
KCl
氯化钾溶
K2SO4
硫酸钾溶
K2CO3碳酸钾溶
KPO4
磷酸钾溶
Na
NaOH氢氧化钠溶
NaNO3
硝酸钠溶
KCl
氯化钠溶
Na2SO4硫酸钠
溶
Na2CO3
碳酸钠溶
碳酸亚铁
不
Fe3(PO4)2磷酸亚铁不
Fe
+3
Fe(OH)3氢氧化铁
不
Fe(NO3)3硝酸铁
溶
氯化铁溶
Fe2(SO4)3硫酸铁溶
Fe2(CO3)3碳酸铁不
FePO4
磷酸铁不
Cu
+2
Cu(OH)2
氢氧化铜不
CU(NO3)2硝酸铜
溶
CuCl2氯化铜
溶
CuSO4硫酸铜
溶
CuCO3碳酸铜不
CU3(PO4)2磷酸铜不
溶
AlCl3
氯化铝溶
Al2(SO4)3硫酸铝溶
A%磷酸铝不
Z+n
Zn(OH)2
氢氧化锌不
Zn(NO3)2硝酸锌
溶
ZnCl2
氯化锌溶
ZnSO4硫酸锌
溶
ZnCO3
碳酸锌不
Zn3(PO4)2磷酸锌不
Fe
+2
Fe(OH)2
氢氧化亚铁不
Fe(NO3)2
酸碱盐溶解性表和口诀(精华版)
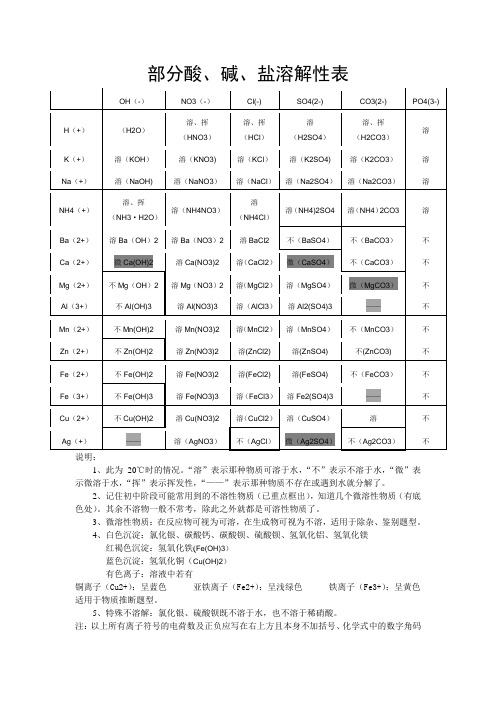
说明:
1、此为20℃时的情况。
“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“——”表示那种物质不存在或遇到水就分解了。
2、记住初中阶段可能常用到的不溶性物质(已重点框出),知道几个微溶性物质(有底色处)。
其余不溶物一般不常考,除此之外就都是可溶性物质了。
3、微溶性物质:在反应物可视为可溶,在生成物可视为不溶,适用于除杂、鉴别题型。
4、白色沉淀:氯化银、碳酸钙、碳酸钡、硫酸钡、氢氧化铝、氢氧化镁
红褐色沉淀:氢氧化铁(Fe(OH)3)
蓝色沉淀:氢氧化铜(Cu(OH)2)
有色离子:溶液中若有
铜离子(Cu2+):呈蓝色亚铁离子(Fe2+):呈浅绿色铁离子(Fe3+):呈黄色适用于物质推断题型。
5、特殊不溶解:氯化银、硫酸钡既不溶于水,也不溶于稀硝酸。
注:以上所有离子符号的电荷数及正负应写在右上方且本身不加括号、化学式中的数字角码
应写在右下方,这里是为了方便打字,请谅解。
部分酸碱盐溶解性背诵口诀
①钾钠铵盐硝酸盐,
完全溶解不困难。
②硫酸盐中钡不溶,
盐酸盐中只银难,
硫酸钡和氯化银,
两种沉淀记心间。
③碳酸盐溶钾钠铵,
碳酸铝铁银碱无。
④硫酸钙银盐微溶,
微溶还有碳酸镁。
⑤碱有钾钠铵钡溶,
氢氧化钙是微溶,
其他全都不能溶。
⑥常见诸酸皆可溶,
记住挥酸盐硝碳。
注:口诀仅供参考,本身并不完全准确,但是能促进记忆。
初中化学酸碱盐溶解性表

阳离子--NO Cl-SO S SO CO SiO PO 阴离子OH343343+溶、挥溶、挥溶溶、挥溶、挥溶、挥不溶HNH4溶、挥溶溶溶溶溶溶溶溶+溶溶溶溶溶溶溶溶溶KNa+溶溶溶溶溶溶溶溶溶Ba2+溶溶溶不溶不不不不Ca2+微溶溶微微不不不不2+不溶溶溶溶微微不不MgAl 3+不溶溶溶---不不2+不溶溶溶不不不不不MnZn2+不溶溶溶不不不不不Cr3+不溶溶溶---不不Fe2+不溶溶溶不不不不不Fe3+不溶溶溶---不不Sn2+不溶溶溶不---不Pb2+不溶微不不不不不不Bi 3+不溶-溶不不不-不Cu2+不溶溶溶不不不不不Hg+-溶不微不不不-不Hg2+-溶溶溶不不不-不Ag+-溶不微不不不不不溶解性口诀一钾, 钠,铵,盐, 硝酸盐 ,都能溶解水中间.盐酸盐不溶银, 亚汞 ,硫酸盐不溶钡和铅,微溶有钙银碳酸盐多不溶,溶者只有钾钠铵(除了镁,微溶)钾 , 钠 , 铵,钡碱都溶(钙微溶)溶解性口诀二钾钠铵盐溶水快,① 硫酸盐除掉钡铅钙。
② 氯化物不溶氯化银,硝酸盐溶液都透明。
中未有皆下沉。
④ 注:①钾钠铵盐都溶于水;②硫酸盐中只有硫酸钡、硫酸铅、硫酸钙不溶;酸盐都溶于水;④口诀中没有波及的盐类都不溶于水;③口诀③硝溶解性口诀三钾、钠、铵盐、硝酸盐;说明,以上四句歌谣归纳了氯化物除银、亚汞;硫酸盐除钡和铅;8类相加在水中溶解与不溶的状况。
碳酸、磷酸盐,只溶钾、钠、铵。
溶解性口诀四钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶。
多半酸溶碱少溶、只有钾钠铵钡溶溶解性口诀五钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)再说硫酸盐,不容有钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)其他几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物)只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)最后说碱类,钾、钠、铵和钡。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)还有几种微溶物,可独自记着。
酸碱盐溶解性表
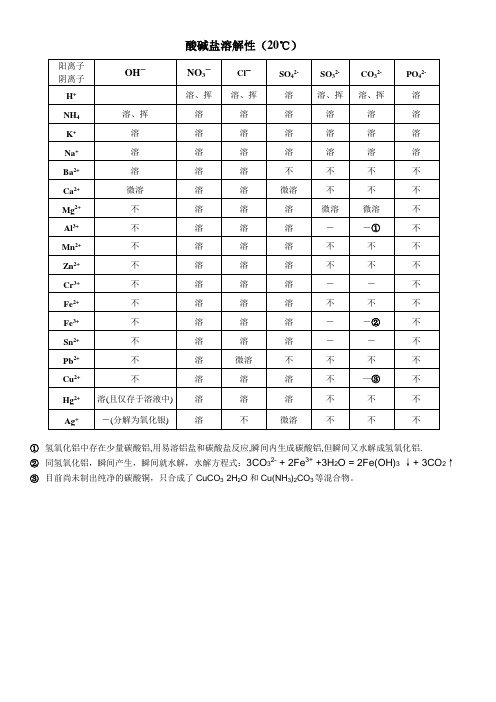
3目前尚未制出纯净的碳酸铜,只合成了CuCO3·2H2O和Cu(NH3)2CO3等混合物。
溶
不
不
不
Zn2+
不
溶
溶
溶
不
不
不
Cr3+
不
溶
溶
溶
-
-
不
Fe2+
不
溶
溶
溶
不
不
不
Fe3+
不
溶
溶
溶
-
-②
不
Sn2+
不
溶
溶
溶
-
-
不
Pb2+
不
溶
微溶
不
不
不
不
Cu2+
不
溶
溶
溶
不
—③
不
Hg2+
溶(且仅存于溶液中)
溶
溶溶Biblioteka 不不不Ag+
-(分解为氧化银)
溶
不
微溶
不
不
不
1氢氧化铝中存在少量碳酸铝,用易溶铝盐和碳酸盐反应,瞬间内生成碳酸铝,但瞬间又水解成氢氧化铝.
酸碱盐溶解性(20℃)
阳离子
阴离子
OH—
NO3—
Cl—
SO42-
SO32-
CO32-
PO42-
H+
溶、挥
溶、挥
溶
溶、挥
溶、挥
溶
NH4
溶、挥
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
阳离子
阴离子 OH -
NO 3
Cl -
SO 4 S SO 3 CO 3 SiO 3 PO 4 H +
溶、挥 溶、挥 溶 溶、挥 溶、挥 溶、挥 不 溶 NH 4 溶、挥
溶 溶 溶 溶 溶 溶 溶 溶 K + 溶 溶 溶 溶 溶 溶 溶 溶 溶 Na + 溶 溶 溶 溶 溶 溶 溶 溶 溶 Ba 2+ 溶 溶 溶 不 溶 不 不 不 不 Ca 2+ 微 溶 溶 微 微 不 不 不 不 Mg 2+ 不 溶 溶 溶 溶 微 微 不 不 Al 3+ 不 溶 溶 溶 - - - 不 不 Mn 2+ 不 溶 溶 溶 不 不 不 不 不 Zn 2+ 不 溶 溶 溶 不 不 不 不 不 Cr 3+ 不 溶 溶 溶 - - - 不 不 Fe 2+ 不 溶 溶 溶 不 不 不 不 不 Fe 3+ 不 溶 溶 溶 - - - 不 不 Sn 2+ 不 溶 溶 溶 不 - - - 不 Pb 2+ 不 溶 微 不 不 不 不 不 不 Bi 3+ 不 溶 - 溶 不 不 不 - 不 Cu 2+ 不 溶 溶 溶 不 不 不 不 不 Hg + - 溶 不 微 不 不 不 - 不 Hg 2+ - 溶 溶 溶 不 不 不 - 不 Ag +
-
溶
不
微
不
不
不
不
不
+ 酸、碱、盐溶解性表(20℃)
-
2-
2-
2-
2-
2-
3-
注释:
1、此为20℃时的情况。
“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“——”表示那种物质不存在或遇到水就分解了。
2、记住初中阶段可能常用到的不溶性物质(已重点框出),知道几个微溶性物质(有底色处)。
其余不溶物一般不常考,除此之外就都是可溶性物质了。
3、微溶性物质:在反应物可视为可溶,在生成物可视为不溶,适用于除杂、鉴别题型。
4、白色沉淀:氯化银、碳酸钙、碳酸钡、硫酸钡、氢氧化铝、氢氧化镁 红褐色沉淀:氢氧化铁(Fe(OH)3) 蓝色沉淀:氢氧化铜(Cu(OH)2) 有色离子:溶液中若有 铜离子(Cu 2+):呈蓝色 亚铁离子(Fe 2+):呈浅绿色
铁离子(Fe 3+):呈黄色 适用于物质推断题型。
5、特殊不溶解:氯化银、硫酸钡既不溶于水,也不溶于稀硝酸。
盐类的溶解性简记:
钾钠铵盐全部溶,
硝酸盐遇水无隐踪, 硫酸盐不溶钡和铅,
盐酸盐不溶银亚汞,碳酸盐大多沉水中。
