高考化学备考之铁及其化合物压轴突破训练∶培优 易错 难题篇含答案解析
高考化学铁及其化合物(大题培优 易错 难题)及答案

高考化学铁及其化合物(大题培优易错难题)及答案一、高中化学铁及其化合物练习题(含详细答案解析)1.已知A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:①A+B→白色沉淀,加入稀硝酸,沉淀不溶解。
②B+D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色。
③C+D→白色沉淀,继续加D溶液,白色沉淀逐渐消失。
(1)则各是什么物质的化学式为:A_______、B_______、C_______、D_______。
(2)现象②中所发生的反应的化学方程式为:__________________________________、______________________________。
(3)现象③中所发生反应的离子方程式为:__________________________________、________________________________。
【答案】BaCl2 FeSO4 AlCl3 NaOH; FeSO4 + 2NaOH=Fe(OH)2↓+ Na2SO4 4Fe(OH)2 + O2+ 2H2O=4Fe(OH)3 Al3+ + 3OH-=Al(OH)3↓ Al(OH)3 + OH-=AlO2- + 2H2O【解析】【分析】①A+B→白色沉淀,加入稀硝酸,沉淀不溶解应,则生成的白色沉淀为BaSO4,②B+D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色,是Fe(OH)2的转化为Fe(OH)3,故A 为BaCl2,B为FeSO4,D为NaOH,则C为AlCl3,氯化铝溶液与NaOH溶液反应生成白色沉淀Al(OH)3,Al(OH)3能溶解在NaOH溶液中,符合③中现象。
【详解】(1)根据以上分析可知A、B、C、D依次为BaCl2、FeSO4、AlCl3、NaOH;(2)现象②先生成白色沉淀,在空气中放置,沉淀由白色转化为红褐色时所发生的反应的化学方程式为:FeSO4 + 2NaOH=Fe(OH)2↓+ Na2SO4,4Fe(OH)2+O2+2H2O=4Fe(OH)3;(3)现象③中所发生反应的离子方程式为:Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O。
2020-2021高考化学培优 易错 难题(含解析)之铁及其化合物推断题及答案解析
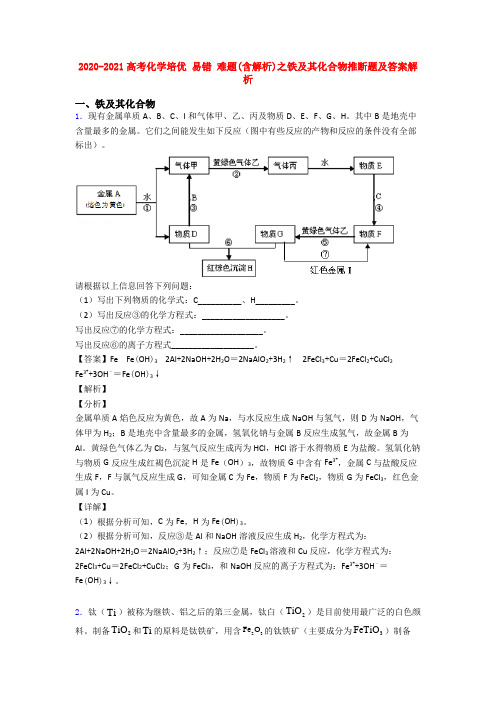
2020-2021高考化学培优 易错 难题(含解析)之铁及其化合物推断题及答案解析一、铁及其化合物1.现有金属单质A 、B 、C 、I 和气体甲、乙、丙及物质D 、E 、F 、G 、H 。
其中B 是地壳中含量最多的金属。
它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:(1)写出下列物质的化学式:C__________、H_________。
(2)写出反应③的化学方程式:___________________。
写出反应⑦的化学方程式:___________________。
写出反应⑥的离子方程式___________________。
【答案】Fe Fe (OH )3 2Al +2NaOH +2H 2O =2NaAlO 2+3H 2↑ 2FeCl 3+Cu =2FeCl 2+CuCl 2 Fe 3++3OH ﹣=Fe (OH )3↓【解析】【分析】金属单质A 焰色反应为黄色,故A 为Na ,与水反应生成NaOH 与氢气,则D 为NaOH ,气体甲为H 2;B 是地壳中含量最多的金属,氢氧化钠与金属B 反应生成氢气,故金属B 为Al 。
黄绿色气体乙为Cl 2,与氢气反应生成丙为HCl ,HCl 溶于水得物质E 为盐酸。
氢氧化钠与物质G 反应生成红褐色沉淀H 是Fe (OH )3,故物质G 中含有Fe 3+,金属C 与盐酸反应生成F ,F 与氯气反应生成G ,可知金属C 为Fe ,物质F 为FeCl 2,物质G 为FeCl 3,红色金属I 为Cu 。
【详解】(1)根据分析可知,C 为Fe ,H 为Fe (OH )3。
(2)根据分析可知,反应③是Al 和NaOH 溶液反应生成H 2,化学方程式为:2Al +2NaOH +2H 2O =2NaAlO 2+3H 2↑;反应⑦是FeCl 3溶液和Cu 反应,化学方程式为:2FeCl 3+Cu =2FeCl 2+CuCl 2;G 为FeCl 3,和NaOH 反应的离子方程式为:Fe 3++3OH ﹣=Fe (OH )3↓。
高考化学 铁及其化合物 培优 易错 难题练习(含答案)附答案解析

高考化学铁及其化合物培优易错难题练习(含答案)附答案解析一、高中化学铁及其化合物1.化学反应多姿多彩,其中的颜色多种多样,试根据图中框图,按要求填写下列问题(1)A的名称是______________,B的化学式是_________。
(2)反应①的化学方程式________________________;反应②的离子方程式_____________________________;B和氯气的化学方程式____________________________。
【答案】(1)氧化铁;Fe(2)Fe2O3+3CO 2Fe+3CO2;Fe+Cu2+=Cu+ Fe2+;2Fe+3Cl22FeCl3【解析】【分析】【详解】试题分析:红棕色粉末A为氧化铁,在高温下被一氧化碳还原,生成黑色粉末B为铁,与蓝色溶液反应生成红色固体C为铜,铁与盐酸反应生成浅绿色溶液为氯化亚铁。
(1)根据上述分析,A是氧化铁,B是铁,故答案为氧化铁;Fe;(2)反应①的化学方程式为Fe2O3+3CO 2Fe+3CO2,故答案为Fe2O3+3CO2Fe+3CO2;反应②的离子方程式为Fe+Cu2+=Cu+ Fe2+,故答案为Fe+Cu2+=Cu+ Fe2+;B和氯气的化学方程式为2Fe+3Cl22FeCl3,故答案为2Fe+3Cl22FeCl3。
考点:考查了无机推断的相关知识。
2.某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如右图所示:已知①A、B、C、D、G含有同种元素。
②纯A(单质)B溶液D固体G溶液颜色银白色黄色红棕色浅绿色③E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G。
依据以上信息填空:(1)写出D的化学式:______________。
(2)G生成C的过程中所出现的现象为_____________写出对应的离子方程式_________________(3)写出反应A→B的化学方程式:_______________________。
高考化学培优 易错 难题(含解析)之铁及其化合物推断题附详细答案

高考化学培优 易错 难题(含解析)之铁及其化合物推断题附详细答案一、铁及其化合物1.下列各物质是中学化学中常见的物质,甲为常见金属单质,丙为黄绿色的单质气体,乙、丁是常见无色气态非金属单质,其它均为化合物,C 常温下为一种液体,B 、D 分别为黑色粉末和黑色晶体,G 为淡黄色固体,J 为生活中常见的调味品,I 为红褐色固体,F 为棕黄色溶液。
①是实验室制取丁的反应之一。
各物质间的转化如下图所示,回答下列问题(部分生成物未列出):(1)物质I 的化学式为________;F 中阴离子是______________;(2)反应①的化学方程式为为____________;(3)B 与K 的反应是实验室制取丙的反应,其离子方程式为____________;(4)反应②的化学方程式为_____________;(5)若E 与G 以物质的量比为1:1投入足量水中,反应的化学方程式为_________;生成1mol 气体转移电子的个数为__________。
【答案】Fe(OH)3 Cl - 2H 2O 22MnO 2H 2O+O 2 MnO 2+4H ++2Cl -ΔMn 2++Cl 2↑+2H 2O 3Fe + 4H 2O(g)高温Fe 3O 4 +4H 2 4FeCl 2+4Na 2O 2 + 6H 2O = 4Fe(OH)3↓+8NaCl + O 2↑ 6N A【解析】【分析】丙为黄绿色单质气体,所以丙为Cl 2,B 与K 的反应是实验室制取丙的反应,且B 为黑色粉末,则B 为MnO 2,K 为HCl ;①是实验室制取丁的反应之一,则该反应为双氧水在二氧化锰的催化作用下制取氧气的反应,所以C 为H 2O ,丁为氧气;G 为淡黄色固体,且可以生成氧气,则G 应为Na 2O 2,则J 为生活中常见的调味品,应为NaCl ,I 为红褐色固体应为Fe(OH)3;F 为棕黄色溶液,应含Fe 3+,E 与氯气反应可生成F ,则F 为FeCl 3,E 为FeCl 2;氯化铁可以与单质铁反应生成氯化亚铁,所以甲为铁单质,Fe 可以在高温条件下与水反应生成氢气和四氧化三铁,所以乙为氢气,D 为Fe 3O 4。
高考化学备考之铁及其化合物推断题压轴突破训练∶培优 易错 难题篇及答案解析

高考化学备考之铁及其化合物推断题压轴突破训练∶培优易错难题篇及答案解析一、铁及其化合物1.利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子并得到副产物ZnO。
制备流程如图所示:(已知ZnO能溶于强碱)已知:Zn及其化合物的性质与Al及其化合物的性质相似。
请回答下列问题:(1)用NaOH溶液处理废旧镀锌铁皮的目的是________(填字母)。
A 去除油污B 溶解镀锌层C 去除铁锈D 钝化铁皮(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是抽滤______。
(3)加适量H2O2 目的是________ 溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是_____。
(4)副产物ZnO常用于制备锌单质。
我国早有炼锌技术的记载,明代宋应星著的《天工开物》中有“升炼倭铅”的记载:“每炉甘石十斤,装载入一泥罐内……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红冷定毁罐取出…即倭铅也。
”该炼锌工艺过程涉及主要反应的化学方程式为_________,(注:炉甘石的主要成分为碳酸锌,“倭铅”是指金属锌)。
(5)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。
若需配制浓度为0.01 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________g K2Cr2O7[保留4位有效数字,已知M r(K2Cr2O7)=294]。
配制该标准溶液时,下列仪器中用不到的有________(填编号)。
①电子天平②烧杯③量筒④玻璃棒⑤250 mL容量瓶⑥胶头滴管⑦移液管(6)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将________(填“偏大”“偏小”或“不变”)。
【答案】AB 洗涤、灼烧将部分亚铁离子氧化成铁离子防止Fe2+被氧化 ZnCO3+2C 高温Zn+3CO↑ 0.7350 ③⑦偏大【解析】【分析】【详解】(1)A.氢氧化钠溶液与油污反应生成高级脂肪酸盐,具有去除油污作用,A符合题意;B.根据Zn及化合物的性质与Al及化合物的性质相似,Zn也能和氢氧化钠溶液反应,氢氧化钠溶液起到溶解镀锌层,B符合题意;C.氢氧化钠和铁不反应,C不符合题意;D.氢氧化钠不能钝化铁皮,故D不符合题意;答案为:AB;(2)调节溶液A的pH可产生Zn(OH)2沉淀,抽滤就可以得到氢氧化锌沉淀,洗涤除去附着的离子,高温灼烧氢氧化锌分解得到ZnO;(3)Fe3O4中有+3价铁,因此加适量H2O2目的是将部分亚铁离子氧化成铁离子,将亚铁离子和铁离子达到Fe3O4中+2价铁与+3价铁的比例关系,持续通入N2,主要防止Fe2+被氧化;故答案为:将部分亚铁离子氧化成铁离子;防止Fe2+被氧化;(4)该炼锌工艺参加反应的物质是煤炭饼和炉甘石(碳酸锌),得到的物质是倭铅(金属锌)和CO,联想初中所学高炉炼铁原理,则炼锌过程涉及主要反应的化学方程式为ZnCO3+2C 高温Zn+3CO↑;(5)m(K2Cr2O7)=0.01 mol·L-1×0.250 L×294 g·mol-1=0.7350 g,电子天平用于准确称量固体质量,烧杯用于溶解固体,玻璃棒用于搅拌和引流,容量瓶用于配制溶液,胶头滴管用于加水定容。
高考化学知识点过关培优 易错 难题训练∶铁及其化合物推断题含答案解析

高考化学知识点过关培优 易错 难题训练∶铁及其化合物推断题含答案解析一、铁及其化合物1.钛(Ti )被称为继铁、铝之后的第三金属,钛白(2TiO )是目前使用最广泛的白色颜料。
制备2TiO 和Ti 的原料是钛铁矿,用含23Fe O 的钛铁矿(主要成分为3FeTiO )制备2TiO 的流程如下:(1)步骤①加Fe 的目的是________________________;步骤②冷却的目的是__________________。
(2)考虑成本和废物的综合利用等因素,水浸后的废液中应加入_______处理。
(3)由金红石(2TiO )制取单质钛(Ti )的过程为,其中反应42800C TiCl 2Mg2MgCl Ti ︒++在氩气气氛中进行的理由是______________________________。
【答案】将3+Fe 还原为2+Fe 析出绿矾(42FeSO 7H O ⋅) 生石灰(或碳酸钙、碱) 高温下镁或钛与2O 、2N 等反应【解析】【分析】根据钛铁矿中23Fe O 、3FeTiO 与浓硫酸反应的溶液中加入铁粉、过滤后,滤液冷却得到硫酸亚铁晶体推知,铁粉与铁离子发生反应得到亚铁离子。
水浸后的溶液成酸性。
【详解】(1)分析题图可知,钛铁矿中的铁最终转化成副产品绿矾,所以要将+3价Fe 转化为+2价Fe ;降低温度,减小了42FeSO 7H O ⋅的溶解度,有利于绿矶结晶析出。
(2)水浸过程发生的离子反应为2223TiO 2H O H TiO 2H +++=↓+,废液呈酸性,所以处理水浸后的废液应加入CaO 、3CaCO 或碱。
(3)由于Ti 和Mg 易与空气中的2O 、2N 等反应,故该反应应在氩气气氛中进行。
2.A 、B 、C 、D 均为中学化学中常见的物质,它们之间转化关系如图(部分产物和条件已略去),请回答下列问题:(1)若A 为CO 2气体,D 为NaOH 溶液,则B 的化学式为_________。
高考化学 铁及其化合物 培优 易错 难题练习(含答案)附答案

高考化学 铁及其化合物 培优 易错 难题练习(含答案)附答案一、高中化学铁及其化合物练习题(含详细答案解析)1.下列物质之间有如下反应关系:已知由E 转化成C 的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。
回答:(1)写出下列物质的化学式:A______,B______,D________,甲_______,乙_______,丙__________。
(2)写出E →C 反应的化学方程式:_____________________。
【答案】Fe 2O 3 FeCl 3 FeCl 2 Cl 2 NaOH KSCN 4Fe (OH )2 +O 2 + 2H 2O =4Fe (OH )3【解析】【分析】E 转化成C 的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色,则E 为Fe (OH )2,C 为Fe (OH )3,A 为红棕色粉末,则A 为Fe 2O 3,B 为FeCl 3,D 为FeCl 2,乙为NaOH ,由D →B 的转化可知,甲为氯气或氯水等,由血红色溶液可知,丙为KSCN ,据此解答。
【详解】(1)根据以上分析可知A 、B 、D 、甲、乙、丙分别是Fe 2O 3;FeCl 3;FeCl 2;Cl 2;NaOH ;KSCN ;(2)E →C 反应的化学方程式为:4Fe (OH )2+O 2+2H 2O =4Fe (OH )3。
2.某pH 1=的溶液X ,其中可能含有3Al +、2Ba +、4NH +、2Fe +、3Fe +、2-3CO 、2-4SO 、2-3SiO 、3NO -中的一种或几种,取200 mL 该溶液进行实验,其现象及转化如图.已知:反应过程中有一种气体是红棕色.请回答下列问题:(1)仅由强酸性条件便可判断溶液X 中一定不存在的离子有________.(2)溶液X 中,关于3NO -的判断一定正确的是________(填字母).a .一定有b .一定没有c .可能有(3)①中产生气体A 的离子方程式为_____________________________________________________.(4)⑦中生成沉淀K 的离子方程式为_____________________________________________________.(5)溶液X 中不能确定的离子是_____________________用实验证明该离子一定不存在的化学方法为______________________________________________________________________________________.(6)若实验测定A .F .K 均为001 mo .l ,试确定沉淀C 及其物质的量范围:_________.【答案】23CO -、23SiO - b 2332 3Fe 4H NO 3Fe NO 2H O -↑+++++++ ()22233 AlO CO 2H O Al OH HCO --↓+++ 3Fe + 取少量溶液X 于试管中,加入几滴KSCN 溶液,溶液不变红色,说明无3Fe +(其他答案合理也可) 沉淀为4BaSO ()4BaSO 006mol n .≥【解析】【详解】由反应①加入的Ba(NO 3)2溶液及pH= 1,结合溶液中可能含有的离子等信息可判断气体A 为NO ,气体D 为NO 2,溶液E 为HNO 3,因此溶液中含有还原性的离子,即含有Fe 2+;由反应④加入过量NaOH 溶液及溶液中可能存在的离子判断气体F 为NH 3,溶液I 为NH 4NO 3,溶液中含有NH 4+; pH= 1的溶液中不可能含有CO 32-、SiO 32-, 故沉淀C 为BaSO 4;根据图示关系及可能存在的离子可知沉淀G 为Fe(OH)3,溶液J 为FeCl 3;沉淀K 为Al(OH)3。
高考化学培优 易错 难题(含解析)之铁及其化合物推断题附答案

高考化学培优 易错 难题(含解析)之铁及其化合物推断题附答案一、铁及其化合物1.钛(Ti )被称为继铁、铝之后的第三金属,钛白(2TiO )是目前使用最广泛的白色颜料。
制备2TiO 和Ti 的原料是钛铁矿,用含23Fe O 的钛铁矿(主要成分为3FeTiO )制备2TiO 的流程如下:(1)步骤①加Fe 的目的是________________________;步骤②冷却的目的是__________________。
(2)考虑成本和废物的综合利用等因素,水浸后的废液中应加入_______处理。
(3)由金红石(2TiO )制取单质钛(Ti )的过程为,其中反应42800C TiCl 2Mg2MgCl Ti ︒++在氩气气氛中进行的理由是______________________________。
【答案】将3+Fe 还原为2+Fe 析出绿矾(42FeSO 7H O ⋅) 生石灰(或碳酸钙、碱) 高温下镁或钛与2O 、2N 等反应【解析】【分析】根据钛铁矿中23Fe O 、3FeTiO 与浓硫酸反应的溶液中加入铁粉、过滤后,滤液冷却得到硫酸亚铁晶体推知,铁粉与铁离子发生反应得到亚铁离子。
水浸后的溶液成酸性。
【详解】(1)分析题图可知,钛铁矿中的铁最终转化成副产品绿矾,所以要将+3价Fe 转化为+2价Fe ;降低温度,减小了42FeSO 7H O ⋅的溶解度,有利于绿矶结晶析出。
(2)水浸过程发生的离子反应为2223TiO 2H O H TiO 2H +++=↓+,废液呈酸性,所以处理水浸后的废液应加入CaO 、3CaCO 或碱。
(3)由于Ti 和Mg 易与空气中的2O 、2N 等反应,故该反应应在氩气气氛中进行。
2.某固体化合物A ,按图所示发生系列变化,已知E 溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。
回答下列问题:(1)物质A是___(填化学式)。
(2)反应②的离子反应方程式为___。
高考化学二轮 铁及其化合物 专项培优 易错 难题及答案解析

高考化学二轮铁及其化合物专项培优易错难题及答案解析一、高中化学铁及其化合物1.已知A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:①A+B→白色沉淀,加入稀硝酸,沉淀不溶解。
②B+D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色。
③C+D→白色沉淀,继续加D溶液,白色沉淀逐渐消失。
(1)则各是什么物质的化学式为:A_______、B_______、C_______、D_______。
(2)现象②中所发生的反应的化学方程式为:__________________________________、______________________________。
(3)现象③中所发生反应的离子方程式为:__________________________________、________________________________。
【答案】BaCl2 FeSO4 AlCl3 NaOH; FeSO4 + 2NaOH=Fe(OH)2↓+ Na2SO4 4Fe(OH)2 + O2+ 2H2O=4Fe(OH)3 Al3+ + 3OH-=Al(OH)3↓ Al(OH)3 + OH-=AlO2- + 2H2O【解析】【分析】①A+B→白色沉淀,加入稀硝酸,沉淀不溶解应,则生成的白色沉淀为BaSO4,②B+D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色,是Fe(OH)2的转化为Fe(OH)3,故A 为BaCl2,B为FeSO4,D为NaOH,则C为AlCl3,氯化铝溶液与NaOH溶液反应生成白色沉淀Al(OH)3,Al(OH)3能溶解在NaOH溶液中,符合③中现象。
【详解】(1)根据以上分析可知A、B、C、D依次为BaCl2、FeSO4、AlCl3、NaOH;(2)现象②先生成白色沉淀,在空气中放置,沉淀由白色转化为红褐色时所发生的反应的化学方程式为:FeSO4 + 2NaOH=Fe(OH)2↓+ Na2SO4,4Fe(OH)2+O2+2H2O=4Fe(OH)3;(3)现象③中所发生反应的离子方程式为:Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O。
高考化学培优 易错 难题(含解析)之铁及其化合物及答案解析

高考化学培优易错难题(含解析)之铁及其化合物及答案解析一、高中化学铁及其化合物练习题(含详细答案解析)1.利用如图可以从不同角度研究含铁物质的性质及其转化关系。
图中甲~己均含铁元素。
回答下列问题:(1)K2FeO4常用作杀菌消毒剂,从铁元素化合价的角度分析是因其具有____性;下列关于乙的说法正确的是______(填标号)。
a.属于酸性氧化物,能与碱反应b.属于碱性氧化物,能与酸反应c.属于两性氧化物,既能与酸反应,又能与碱反应(2)已知甲与稀硝酸反应的化学方程式为甲+HNO3―→戊+己+NO↑+H2O(方程式未配平)。
若产物中戊和己的物质的量之比为3∶1,则甲与HNO3的物质的量之比为____。
(3)戊与烧碱溶液反应生成丙,放置一段时间后丙转化为丁,丙转化为丁的化学方程式为______,现象为______。
【答案】氧化 b 1∶3 4Fe(OH)2+O2+2H2O=4Fe(OH)3白色沉淀迅速变为灰绿色,最后变为红褐色【解析】【分析】根据图像可知,甲为铁;乙为氧化物且为+2价,为FeO;丙、丁为氢氧化物,分别为+2、+3价,分别为氢氧化亚铁、氢氧化铁。
【详解】(1)K2FeO4中铁元素的化合价是+6价,在反应中Fe元素能得电子表现强氧化性,常用作杀菌消毒剂。
根据图可知,铁元素的+2价氧化物是FeO,属于碱性氧化物,能与酸反应生成盐和水。
(2)根据图可知,戊和己分别是铁元素的+2价和+3价盐,铁与硝酸反应生成的戊和己分别是Fe(NO3)2和Fe(NO3)3,HNO3在反应中被还原为NO,氮元素的化合价由+5价降为+2价;设反应生成Fe(NO3)3的物质的量为1 mol,则生成Fe(NO3)2的物质的量为3mol,则参加反应的Fe(甲)的物质的量为4mol,根据电子守恒可得3mol+3mol×2=n(NO)×3,n(NO)=3mol;根据N原子守恒可知参加反应的n(HNO3)=n(NO)+n[Fe(NO3)2]×2+n[Fe(NO3)3]×3=12mol,则铁与HNO3的物质的量之比为4∶12=1∶3。
高考化学备考之铁及其化合物压轴突破训练∶培优 易错 难题篇附详细答案(1)

高考化学备考之铁及其化合物压轴突破训练∶培优易错难题篇附详细答案(1)一、高中化学铁及其化合物练习题(含详细答案解析)1.现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
请根据以上信息完成下列各题:(1)写出下列物质的化学式:B_______、丙__________。
(2)写出黄绿色气体乙的一种用途___________,反应过程⑦可能观察到的实验现象是______。
对应的化学方程式是_______。
(3)反应③中的离子方程式是_________。
【答案】Al HCl 杀菌消毒、强氧化剂、漂白白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Al+2OH- +2H2O=2AlO2-+3H2↑【解析】【分析】金属A颜色反应为黄色证明A为金属Na,Na与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应产生H2,说明B为金属Al,黄绿色气体乙为Cl2,气体甲是H2,H2和Cl2反应生成丙为HCl,HCl溶于水得到的物质E为盐酸溶液,盐酸与金属C反应产生F溶液是金属氯化物,该氯化物与Cl2还可以反应产生G,G与NaOH溶液反应生成红褐色沉淀H为Fe(OH)3,则G为FeCl3,推断物质F为FeCl2;判断C为Fe,以此解答该题。
【详解】根据上述分析可知A是Na,B是Al,C为Fe,气体甲是H2,气体乙是Cl2,气体丙是HCl;D是NaOH,E是盐酸,F是FeCl2,G是FeCl3,H是Fe(OH)3。
(1)根据上述分析可知,物质B是Al,丙是HCl;(2)黄绿色气体乙是Cl2,该物质可以与水反应产生HCl和HClO,HClO具有强氧化性,可作氧化剂,氧化一些具有还原性的物质,也用于杀菌消毒或用于物质的漂白;(3)FeCl2与NaOH溶液发生反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,Fe(OH)2具有还原性,容易被溶解在溶液中的氧气氧化,发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3,固体由白色迅速变为灰绿色,最后变为红褐色,因此可观察到的实验现象是白色沉淀迅速变成灰绿色,最终变成红褐色;(4)反应③是Al与NaOH溶液发生反应产生NaAlO2和H2,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑。
高考化学备考之铁及其化合物压轴突破训练∶培优 易错 难题篇含答案解析(1)
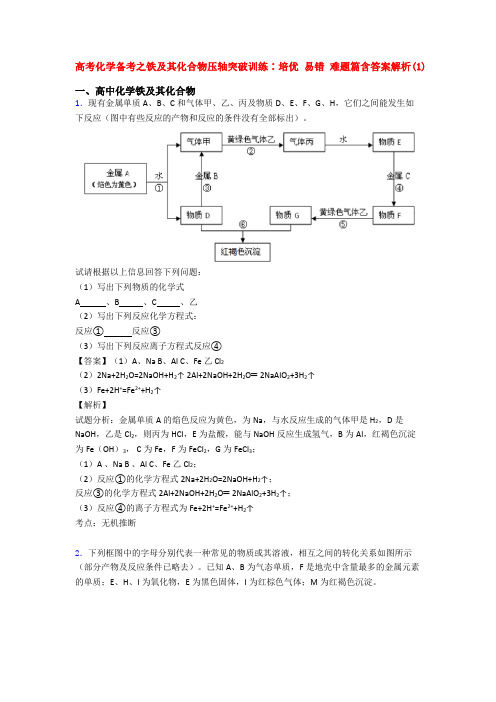
高考化学备考之铁及其化合物压轴突破训练∶培优易错难题篇含答案解析(1)一、高中化学铁及其化合物1.现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
试请根据以上信息回答下列问题:(1)写出下列物质的化学式A 、B 、C 、乙(2)写出下列反应化学方程式:反应①反应③(3)写出下列反应离子方程式反应④【答案】(1)A、Na B、Al C、Fe 乙 Cl2(2)2Na+2H2O=2NaOH+H2↑ 2Al+2NaOH+2H2O═2NaAlO2+3H2↑(3)Fe+2H+=Fe2++H2↑【解析】试题分析:金属单质A的焰色反应为黄色,为Na,与水反应生成的气体甲是H2,D是NaOH,乙是Cl2,则丙为HCl,E为盐酸,能与NaOH反应生成氢气,B为Al,红褐色沉淀为Fe(OH)3, C为Fe,F为FeCl2,G为FeCl3;(1)A 、Na B 、Al C、Fe 乙 Cl2;(2)反应①的化学方程式2Na+2H2O=2NaOH+H2↑;反应③的化学方程式2Al+2NaOH+2H2O═2NaAlO2+3H2↑;(3)反应④的离子方程式为Fe+2H+=Fe2++H2↑考点:无机推断2.下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去)。
已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀。
请回答下列问题:(1)A在B中燃烧的现象是__________________________________________。
(2)D+E→B的反应中,被氧化与被还原的物质的物质的量比是_________________________。
(3)G+J→M的离子方程式是____________________________________。
高考化学备考之铁及其化合物压轴突破训练∶培优 易错 难题篇及详细答案(1)

高考化学备考之铁及其化合物压轴突破训练∶培优易错难题篇及详细答案(1)一、高中化学铁及其化合物1.下图为一些常见物质的转化关系图(部分反应物与生成物未标出)。
A、C、E、G为单质,其中A、C、G为金属,E为气体。
B为常见无色液体,L为红褐色固体,I的焰色反应呈紫色。
常温下A、G投入J的浓溶液无明显现象,K是反应①所得溶液中的唯一溶质。
⑴A在元素周期表中的位置为_______,H的电子式为________。
⑵写出有关反应的离子方程式:反应①的离子方程式为__________。
反应②的离子方程式为__________。
⑶反应③中每生成1 mol E,转移电子的物质的量为__________。
【答案】第四周期Ⅷ族 3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O 2Al+2OH-+2H2O=2AlO2-+3H2↑ 1 mol【解析】【分析】A、C、E、G为单质,其中A、C、G为金属,L为红褐色固体,L为Fe(OH)3,B为常见无色液体,B为H2O,由元素守恒及转化可知,D为Fe3O4,G为Al,A为Fe,E为H2,I的焰色反应呈紫色,I中含K元素,由元素守恒及转化可知,C为K,F为KOH,I为KAlO2,K与氢气化合生成KH,所以H为KH,常温下A、G投入J的浓溶液无明显现象,K是反应①所得溶液中的唯一溶质,J为硝酸,K为硝酸铁,然后结合单质及化合物的性质来解答。
【详解】A、C、E、G为单质,其中A、C、G为金属,L为红褐色固体,L为Fe(OH)3,B为常见无色液体,B为H2O,由元素守恒及转化可知,D为Fe3O4,G为Al,A为Fe,E为H2,I的焰色反应呈紫色,I中含K元素,由元素守恒及转化可知,C为K,F为KOH,I为KAlO2,K与氢气化合生成KH,所以H为KH,常温下A、G投入J的浓溶液无明显现象,K是反应①所得溶液中的唯一溶质,J为硝酸,K为硝酸铁,(1)由上述分析可知,A为Fe,位于元素周期表中第四周期Ⅷ族,H为KH,其电子式为;(2)反应①的离子方程式为3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,反应②的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;(3)反应③为KH+H2O=KOH+H2↑,H元素的化合价由-1升高为0,则每生成1molE(KOH),转移电子的物质的量为1mol×(1-0)=1mol。
高考化学 铁及其化合物 培优 易错 难题练习(含答案)及详细答案

高考化学铁及其化合物培优易错难题练习(含答案)及详细答案一、高中化学铁及其化合物练习题(含详细答案解析)1.A是一种红棕色金属氧化物;B、D是金属单质;J是一种难溶于水的白色化合物,受热易分解。
回答下列问题:(1)A、E、J、G的化学式分别为___、___、___、___。
(2)C转化为I的离子方程式为___。
(3)H和I反应生成J的离子方程式为___。
(4)如何检验E溶液中大量存在的阳离子?___。
【答案】Fe2O3 FeCl2 Al(OH)3 Fe(OH)3 Al2O3+2OH-═2AlO2-+H2O Al3++3AlO2-+6H2O═4Al(OH)3↓取E溶液2mL于试管中,滴入几滴KSCN溶液,无现象,再滴入几滴氯水,溶液呈血红色,则含有Fe2+【解析】【分析】A是一种红棕色金属氧化物,则A是Fe2O3,红褐色沉淀G为Fe(OH)3,分解可以生成氧化铁,则F是 Fe(OH)2.B、D是金属单质,Fe2O3和B在高温下能反应生成金属单质D,则该反应是铝热反应,B是Al,D是Fe,C是Al2O3,J是一种不溶于水的白色化合物,受热容易分解成C,则J是Al(OH)3,由转化关系可知,I是NaAlO2,H是AlCl3;铁和盐酸反应生成氯化亚铁和氢气,E和氨水反应生成 Fe(OH)2,则E是 FeCl2,以此解答该题。
【详解】(1)由以上分析可知,则A为Fe2O3,E是FeCl2,J是Al(OH)3,G是Fe(OH)3;(2)氧化铝是两性氧化物,与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-═2AlO2-+H2O;(3)铝离子和偏铝酸根之间双水解而不共存,反应的离子方程式为Al3++3AlO2-+6H2O═4Al(OH)3↓;(4)E是FeCl2,检验亚铁离子,可取E溶液2mL于试管中,滴入几滴KSCN溶液,无现象,再滴入几滴氯水,溶液呈血红色,则含有Fe2+。
2.已知A为常见的金属单质,根据如图所示的关系:(1)确定A、B、C、D、E、F的化学式:A____________,B____________,C____________,D____________,E____________,F____________。
备战高考化学培优 易错 难题(含解析)之铁及其化合物推断题附答案

备战高考化学培优易错难题(含解析)之铁及其化合物推断题附答案一、铁及其化合物1.X、Y、Z、W 为四种常见元素,其中 X、Y、Z 为短周期元素。
ZX4分子是由粗Z提纯Z的中间产物,X的最高价氧化物对应的水化物为无机酸中的最强酸,Y的离子在同周期中离子半径最小,其氧化物有两性且可用于制造一种极有前途的高温材料,Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料,W原子的最外层电子数小于4且W 的常见化合价有+3、+2,WX3的稀溶液呈黄色,回答下列问题:(1)X在元素周期表的位置________________,其简单阴离子的结构示意图为____________________,用电子式表示X的氢化物的形成过程______________________________。
(2)Z的氧化物在通讯领域用来作_______________。
锗与Z是同一主族元素,它可用来制造半导体晶体管。
研究表明:有机锗具有明显的抗肿瘤活性,锗不与 NaOH溶液反应但在有H2O2存在时可与NaOH溶液反应生成锗酸盐,反应的化学方程式为:_______________________________(3)W(OH)2在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为:____________________________________,若灼烧W(OH)2固体得到___________。
【答案】第三周期ⅦA族光导纤维 Ge + 2H2O2 +2NaOH = Na2GeO3 + 3H2O 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 Fe2O3【解析】【分析】根据元素的性质及用途等信息分析元素的种类;根据核外电子排布情况确定在元素周期表中的位置;根据物质的性质及反应的现象书写反应方程式,及用相关化学用语表示物质的组成和结构。
【详解】Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料,则Z为硅;ZX4分子是由粗Z提纯Z的中间产物,X的最高价氧化物对应的水化物为无机酸中的最强酸,则X 为氯;Y的离子在同周期中离子半径最小,其氧化物有两性且可用于制造一种极有前途的高温材料,则Y为铝;W原子的最外层电子数小于4且W的常见化合价有+3、+2,WX3的稀溶液呈黄色,则W为铁;(1)X为氯元素,在元素周期表的位置为:第三周期ⅦA族;氯离子的结构示意图为:;用电子式表示HCl的形成过程:;(2)Z为硅,二氧化硅在通讯领域用作光导纤维;根据题干信息知锗NaOH溶液在有H2O2存在时反应生成锗酸盐,反应的化学方程式为:Ge + 2H2O2 + 2NaOH = Na2GeO3 + 3H2O;(3)反应现象知该反应为氢氧化亚铁被氧化为氢氧化铁,反应的化学方程式为:4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3,Fe(OH)3不稳定,灼烧分解得到固体Fe2O3。
备战高考化学培优 易错 难题(含解析)之铁及其化合物推断题含答案解析

备战高考化学培优易错难题(含解析)之铁及其化合物推断题含答案解析一、铁及其化合物1.A~I分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出)。
已知H为固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是___。
(2)反应①的化学方程式为___。
(3)反应③的离子方程式为___。
(4)反应⑧的化学方程式为___。
(5)反应⑥过程中的现象是____。
(6)1molI发生反应后生成的A高温下与足量的水蒸气反应,生成的气体换算成标准状况下占___L。
【答案】铁元素 8Al+3Fe3O44Al2O3+9Fe Fe3O4+8H+=2Fe3++Fe2++4H2O Al2O3+2NaOH=2NaAlO2+H2O 生成的白色沉淀在空气中迅速变成灰绿色,最后变成红褐色 33.6 【解析】【分析】F是红褐色难溶于水的沉淀,则F为氢氧化铁;E能在空气中转化为F,且E是C和氢氧化钠反应生成,则E为氢氧化亚铁,C为氯化亚铁;B能与盐酸反应生成氯化亚铁和D,则B 为四氧化三铁,D为氯化铁;A在空气中燃烧能够生成四氧化三铁,则A为铁单质;四氧化三铁与I在高温条件下反应生成铁单质,I又能与氢氧化钠反应,推知I为铝单质,与四氧化三铁在高温条件下发生铝热反应,生成H为氧化铝;铝和氧化铝都能与氢氧化钠反应生成G,则G为偏铝酸钠。
【详解】(1)A为铁、B为四氧化三铁、C为氯化亚铁、D为氯化铁、E氢氧化亚铁、F为氢氧化铁,则六种物质中都含有铁元素,故答案为:铁元素;(2)①是铝与四氧化三铁发生铝热反应,其反应的方程式为8Al+3Fe3O44Al2O3+9Fe,故答案为:8Al+3Fe3O44Al2O3+9Fe;(3)③是四氧化三铁与盐酸反应,其反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O,故答案为:Fe3O4+8H+=2Fe3++Fe2++4H2O;(4)⑧是氧化铝与氢氧化钠发生反应,反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O,故答案为:Al2O3+2NaOH=2NaAlO2+H2O;(5)⑥氢氧化亚铁在空气中转化为氢氧化铁,其现象为生成的白色沉淀在空气中迅速变成灰绿色,最后变成红褐色,故答案为:生成的白色沉淀在空气中迅速变成灰绿色,最后变成红褐色;(6)1mol铝与四氧化三铁反应生成铁单质与氧化铝,生成的铁单质再与水蒸气反应生成氢气,根据得失电子守恒可知,铝失去的电子数等于生成氢气得到的电子数,可列式1×3=2×n(H2),则n(H2)=1.5mol,则标准状况下,氢气的体积V(H2)=1.5mol×22.4L/mol=33.6L,故答案为33.6。
2020-2021备战高考化学 铁及其化合物 培优 易错 难题练习(含答案)附详细答案
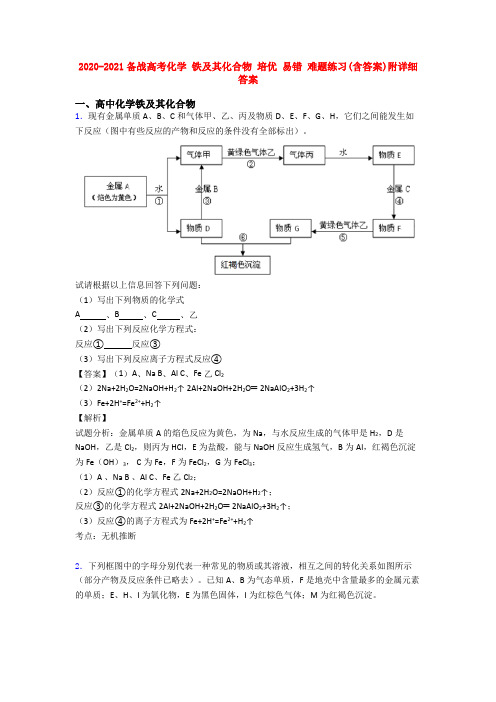
2020-2021备战高考化学铁及其化合物培优易错难题练习(含答案)附详细答案一、高中化学铁及其化合物1.现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
试请根据以上信息回答下列问题:(1)写出下列物质的化学式A 、B 、C 、乙(2)写出下列反应化学方程式:反应①反应③(3)写出下列反应离子方程式反应④【答案】(1)A、Na B、Al C、Fe 乙 Cl2(2)2Na+2H2O=2NaOH+H2↑ 2Al+2NaOH+2H2O═2NaAlO2+3H2↑(3)Fe+2H+=Fe2++H2↑【解析】试题分析:金属单质A的焰色反应为黄色,为Na,与水反应生成的气体甲是H2,D是NaOH,乙是Cl2,则丙为HCl,E为盐酸,能与NaOH反应生成氢气,B为Al,红褐色沉淀为Fe(OH)3, C为Fe,F为FeCl2,G为FeCl3;(1)A 、Na B 、Al C、Fe 乙 Cl2;(2)反应①的化学方程式2Na+2H2O=2NaOH+H2↑;反应③的化学方程式2Al+2NaOH+2H2O═2NaAlO2+3H2↑;(3)反应④的离子方程式为Fe+2H+=Fe2++H2↑考点:无机推断2.下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去)。
已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀。
请回答下列问题:(1)A在B中燃烧的现象是__________________________________________。
(2)D+E→B的反应中,被氧化与被还原的物质的物质的量比是_________________________。
(3)G+J→M的离子方程式是____________________________________。
2020-2021高考化学培优 易错 难题(含解析)之铁及其化合物及详细答案

2020-2021高考化学培优易错难题(含解析)之铁及其化合物及详细答案一、高中化学铁及其化合物练习题(含详细答案解析)1.已知A、B、C、D四种物质均含有铁元素,彼此转化关系如下:请回答:(1)反应①称为铝热反应(属于置换反应),写出该反应的化学方程式:__、其中Al作__剂。
(2)反应④的离子方程式为:__。
(3)新配制的C溶液中应加入__,以防止其转化为D。
检验D溶液中阳离子的常用试剂是__(填化学式),实验现象为__。
【答案】2Al+Fe2O3高温2Fe+Al2O3还原剂 2Fe2++H2O2+2H+=2Fe3++2H2O 铁粉(屑) KSCN (或NH4SCN)溶液变红(或呈现血红色)【解析】【分析】氧化铁与铝单质在高温下发生铝热反应,生成A,则A为Fe,铁和水蒸气在高温下反应生成B,B为黑色磁性氧化物,则B为Fe3O4,Fe3O4中铁元素的化合价含有+2、+3价,与盐酸反应生成FeCl3和FeCl2,铁与过量盐酸反应生成FeCl2,则C为FeCl2,FeCl2与双氧水反应生成FeCl3,则D为FeCl3,据此分析解答。
【详解】(1)反应①称为铝热反应(属于置换反应),该反应的化学方程式:2Al+Fe2O3高温2Fe+Al2O3,反应中Al有0价变为+3价,化合价升高,失电子,被氧化,作还原剂;(2)反应④为FeCl2与双氧水反应生成FeCl3,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;(3)C为FeCl2,D为FeCl3,亚铁离子具有还原性,易被氧化,新配制的FeCl2溶液中应加入铁粉(屑),以防止其转化为FeCl3。
检验三价铁离子常用试剂是KSCN(或NH4SCN),三价铁离子遇SCN-变为血红色溶液。
2.A、B、C、D四种化合物,其中A、C、D焰色反应均为黄色,而B的焰色反应为紫色,A、C和盐酸反应均得到D,将固体C加热可得到A,若在A的溶液中通入一种无色无味气体,又可制得C,若B的溶液滴加到硫酸亚铁溶液会先后出现白色沉淀→灰绿色沉淀→红褐色沉淀E。
高考化学压轴题之铁及其化合物(高考题型整理,突破提升)附答案

高考化学压轴题之铁及其化合物(高考题型整理,突破提升)附答案一、高中化学铁及其化合物练习题(含详细答案解析)1.已知A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:①A+B→白色沉淀,加入稀硝酸,沉淀不溶解。
②B+D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色。
③C+D→白色沉淀,继续加D溶液,白色沉淀逐渐消失。
(1)则各是什么物质的化学式为:A_______、B_______、C_______、D_______。
(2)现象②中所发生的反应的化学方程式为:__________________________________、______________________________。
(3)现象③中所发生反应的离子方程式为:__________________________________、________________________________。
【答案】BaCl2 FeSO4 AlCl3 NaOH; FeSO4 + 2NaOH=Fe(OH)2↓+ Na2SO4 4Fe(OH)2 + O2+ 2H2O=4Fe(OH)3 Al3+ + 3OH-=Al(OH)3↓ Al(OH)3 + OH-=AlO2- + 2H2O【解析】【分析】①A+B→白色沉淀,加入稀硝酸,沉淀不溶解应,则生成的白色沉淀为BaSO4,②B+D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色,是Fe(OH)2的转化为Fe(OH)3,故A 为BaCl2,B为FeSO4,D为NaOH,则C为AlCl3,氯化铝溶液与NaOH溶液反应生成白色沉淀Al(OH)3,Al(OH)3能溶解在NaOH溶液中,符合③中现象。
【详解】(1)根据以上分析可知A、B、C、D依次为BaCl2、FeSO4、AlCl3、NaOH;(2)现象②先生成白色沉淀,在空气中放置,沉淀由白色转化为红褐色时所发生的反应的化学方程式为:FeSO4 + 2NaOH=Fe(OH)2↓+ Na2SO4,4Fe(OH)2+O2+2H2O=4Fe(OH)3;(3)现象③中所发生反应的离子方程式为:Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学备考之铁及其化合物压轴突破训练∶培优易错难题篇含答案解析一、高中化学铁及其化合物练习题(含详细答案解析)1.某固体化合物A,按图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。
回答下列问题:(1)物质A是___(填化学式)。
(2)反应②的离子反应方程式为___。
(3)反应④的化学反应方程式为___。
【答案】Fe(OH)3 Fe2O3+6H+=2Fe3++3H2O 4Fe(OH)2+O2+2H2O=4Fe(OH)3【解析】【分析】已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色说明A为氢氧化铁,Fe(OH)3,A加热分解生成B为Fe2O3,C为H2O,依据流程分析判断D为FeCl3,X为Fe,E为FeCl2 溶液,据此分析。
【详解】已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色说明A为氢氧化铁,Fe(OH)3,A加热分解生成B为Fe2O3,C为H2O,依据流程分析判断D为FeCl3,X为Fe,E为FeCl2 溶液。
(1)依据推断可知A为Fe(OH)3;(2)反应②是盐酸和氧化铁发生的复分解反应,反应的离子反应方程式为Fe2O3+6H+=2Fe3++3H2O;(3)反应④是氢氧化亚铁和氧气水发生反应生成氢氧化铁的也还原反应,反应的化学反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
2.已知A、B、C、D四种物质均含有铁元素,彼此转化关系如下:请回答:(1)反应①称为铝热反应(属于置换反应),写出该反应的化学方程式:__、其中Al作__剂。
(2)反应④的离子方程式为:__。
(3)新配制的C溶液中应加入__,以防止其转化为D。
检验D溶液中阳离子的常用试剂是__(填化学式),实验现象为__。
【答案】2Al+Fe2O3高温2Fe+Al2O3还原剂 2Fe2++H2O2+2H+=2Fe3++2H2O 铁粉(屑) KSCN (或NH4SCN)溶液变红(或呈现血红色)【解析】【分析】氧化铁与铝单质在高温下发生铝热反应,生成A,则A为Fe,铁和水蒸气在高温下反应生成B,B为黑色磁性氧化物,则B为Fe3O4,Fe3O4中铁元素的化合价含有+2、+3价,与盐酸反应生成FeCl3和FeCl2,铁与过量盐酸反应生成FeCl2,则C为FeCl2,FeCl2与双氧水反应生成FeCl3,则D为FeCl3,据此分析解答。
【详解】(1)反应①称为铝热反应(属于置换反应),该反应的化学方程式:2Al+Fe2O3高温2Fe+Al2O3,反应中Al有0价变为+3价,化合价升高,失电子,被氧化,作还原剂;(2)反应④为FeCl2与双氧水反应生成FeCl3,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;(3)C为FeCl2,D为FeCl3,亚铁离子具有还原性,易被氧化,新配制的FeCl2溶液中应加入铁粉(屑),以防止其转化为FeCl3。
检验三价铁离子常用试剂是KSCN(或NH4SCN),三价铁离子遇SCN-变为血红色溶液。
3.已知有以下物质相互转化:请回答下列问题:(1)写出B的化学式___________,D的化学式为____________;(2)写出由E转变成F的化学方程式________。
(3)写出D转化成H的离子方程式_________。
(4)除去溶液B中混有的少量G溶液的最适宜方法是________。
【答案】FeCl2 KCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Ag++Cl-=AgCl↓向溶液B中加入足量铁粉,再经过滤操作【解析】【分析】D和硝酸银、稀硝酸的混合溶液反应生成沉淀H和焰色反应呈紫色的溶液可知,H为AgCl,D为KCl,白色沉淀E在空气中变成红褐色沉淀F可知E为Fe(OH)2,F为Fe(OH)3,所以G为FeCl3,A为Fe,B为FeCl2,C为NaOH,据此解答。
【详解】(1)由分析可知,B为FeCl2,D为KCl,故答案为:FeCl2;KCl;(2)E为Fe(OH)2,F为Fe(OH)3,反应的方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;(3)D为KCl,H为AgCl,D转化为H的离子方程式为:Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓;(4)FeCl2中混有的少量FeCl3,可用过量的铁粉将FeCl3转化为FeCl2,过量的铁粉用过滤除去,故答案为:向溶液B中加入足量铁粉,再经过滤操作。
【点睛】白色沉淀迅速变为灰绿色,最后变为红褐色所涉及的反应正是E到F:4Fe(OH)2+2H2O+O2=4Fe(OH)3。
4.已知A是一种常见金属,F 是一种红褐色沉淀,试根据图中转化关系,回答下列问题。
(1)写出A、C、F、G的化学式:A_________,C________,F________,G_________。
(2) 检验D中阳离子的方法为________________________(3) 保存C溶液时要加固体A的原因__________________(4) 写出下列转化的离子方程式或化学方程式。
①E→F 的化学反应方程式:_________________________②C→D的离子反应方程式:_________________________【答案】Fe FeCl2 Fe(OH)3 Fe2O3取D溶液少许于试管中,加入几滴KSCN溶液,溶液变红色,证明含Fe3+(答案合理即可) 防止Fe2+被O2氧化变质 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Fe2++Cl2=2Fe3++2Cl-【解析】【分析】A是一种常见金属,F是一种红褐色沉淀,由转化关系可知F为Fe(OH)3,A为Fe,Fe与氧气反应生成B为Fe3O4,四氧化三铁与盐酸反应得到氯化亚铁与氯化铁,故Fe与盐酸反应得到X为氢气、C为FeCl2,可推知E为Fe(OH)2、D为FeCl3,G为Fe2O3。
【详解】(1)根据分析可知A为Fe,C为FeCl2,F为Fe(OH)3,G为Fe2O3,故答案为:Fe;FeCl2;Fe(OH)3;Fe2O3;(2)D为FeCl3,含有阳离子为Fe3+,检验Fe3+离子的方法为:取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液变红色,证明有Fe3+,故答案为:取D溶液少许于试管中,加入几滴KSCN溶液,溶液变红色,证明含Fe3+(答案合理即可);(3)FeCl2易被空气中氧气氧化,保存FeCl2溶液时加固体Fe,防止Fe2+被氧气氧化,故答案为:防止Fe2+被氧气氧化;(4)E转化为F是氢氧化亚铁被氧气氧化生成氢氧化铁,现象是:白色沉淀迅速变成灰绿色,最后变成红褐色;反应化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,C→D反应离子方程式为:2Fe2++Cl2═2Fe3++2Cl-;故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;2Fe2++Cl2=2Fe3++2Cl-。
【点睛】本题涉及Fe元素单质化合物的性质及转化,物质的颜色是推断突破口,再结合转化关系推断各物质,掌握元素化合物的性质是解题的关键。
5.金属A能够被磁铁所吸引.A及其A的化合物之间有如下的转化关系:(1)写出A、C的化学式:A_____;C_____.(2)检验B中阳离子的试剂是_____.(3)写出下列反应的化学方程式或离子方程式:A→D 的离子方程式_____E→C 的化学方程式_____【答案】Fe Fe(OH)3 KSCN溶液或NaOH溶液 Fe+2H+═Fe2++H2↑4Fe(OH)2+2H2O+O2═4Fe(OH)3【解析】【分析】金属A能够被磁铁所吸引,则A是Fe,Fe在氯气中燃烧生成B为FeCl3,Fe和HCl反应生成FeCl2和H2,FeCl3和Fe反应生成FeCl2,则D为FeCl2,B和NaOH反应生成红褐色的C 为Fe(OH)3,D和NaOH溶液反应生成的白色E为Fe(OH)2,Fe(OH)2和氧气、水反应生成Fe(OH)3。
【详解】(1)通过以上分析知,A、C分别是Fe、Fe(OH)3,故答案为:Fe; Fe(OH)3;(2)B为氯化铁,铁离子用KSCN或NaOH溶液检验,铁离子和KSCN混合后溶液呈血红色,和NaOH反应生成红褐色沉淀,所以可以用KSCN或NaOH溶液检验,故答案为:KSCN溶液或NaOH溶液;(3)Fe和稀盐酸反应生成氯化亚铁和氢气,离子方程式为Fe+2H+=Fe2++H2↑,氢氧化亚铁和氧气、水反应生成氢氧化铁,反应方程式为4 Fe(OH)2+2H2O+O2═4 Fe(OH)3,故答案为:Fe+2H+=Fe2++H2↑;4 Fe(OH)2+2H2O+O2=4 Fe(OH)3。
【点睛】本题以Fe及其化合物之间的转化为载体考查无机物推断,明确物质性质是解本题关键。
本题的突破口为C的颜色。
本题的易错点为氢氧化亚铁氧化的方程式的书写。
6.已知有以下物质相互转化。
其中A为金属试回答:(1)写出B的化学式________________,D的化学式________________。
(2)写出由D转变成H的化学方程式________________。
(3)写出向G溶液加入A的有关离子反应方程式________________。
(4)写出E转变为F的实验现象为:_________________________化学方程式:___________________。
【答案】FeCl2 KCl KCl+AgNO3=AgCl↓+KNO3 2Fe3++Fe =3Fe2+生成白色沉淀,迅速变成灰绿色,最后变成红褐色 4Fe(OH)2+O2+2H2O═4Fe(OH)3【解析】【分析】依据转化关系中的反应现象可以判断,白色沉淀E为Fe(OH)2,红褐色沉淀F为Fe(OH)3,D 溶液加入硝酸酸化的硝酸银生成白色沉淀H为AgCl,生成的溶液中含有钾离子,证明D溶液为KCl,依据转化关系得到,C为KOH,B为FeCl2,F溶解于盐酸,说明加盐酸溶解生成的G为FeCl3,判断A为Fe;【详解】D和硝酸银反应生成白色沉淀H,H不溶于稀硝酸,所以H是氯化银,则D中含有氯离子,D和硝酸银混合溶液进行焰色反应呈紫色,则D中含有钾元素,所以D是氯化钾,白色沉淀E和氧气反应生成红褐色沉淀F,则F是氢氧化铁,E是氢氧化亚铁,氢氧化铁和盐酸反应生成氯化铁溶液,所以G是氯化铁,氯化铁和A反应生成B,B和C反应生成氯化钾和氢氧化亚铁,所以A是铁,B是氯化亚铁,C是氢氧化钾。
(1) 通过以上分析知,B是氯化亚铁,D是氯化钾,B和D的化学式分别是:FeCl2、KCl,故答案为:FeCl2;KCl;(2) D是KCl,H为AgCl,D转变成H的化学方程式为KCl+AgNO3=AgCl↓+KNO3,故答案为:KCl+AgNO3=AgCl↓+KNO3;(3) G为FeCl3,A为Fe,它们之间的反应发生氧化还原反应,2Fe3++Fe =3Fe2+,故答案为:2Fe3++Fe =3Fe2+;(4) E是氢氧化亚铁,F是氢氧化铁,氢氧化亚铁和氧气。
