专题有关氮的氧化物溶于水的计算
(完整word)关于氮的氧化物溶于水的计算小节

关于氮的氧化物相关计算总结摘要:NO 2、NO 、O 2混合气体,通入水中充分反应后求剩余气体的体积,或根据反应前后气体的体积变化求原混合气体的组成,是高考中气体的计算的重点、难点、热点。
计算时应抓住反应规律,依据具体反应,利用关系式法、差量法、电子守恒法等方法进行求解。
关键词:氮的氧化物 NO 2 NO 关系式法 差量法 电子守恒法NO 2、NO 、O 2混合气体,通入水中充分反应后求剩余气体的体积,或根据反应前后气体的体积变化求原混合气体的组成,是高考中气体的计算的重点、难点、热点。
计算时应抓住反应规律,依据具体反应,利用关系式法、差量法、电子守恒法等方法进行求解。
1。
关系式法计算时经常用到的四个重要化学方程式:3NO 2+H 2O==2HNO 3+NO ① 2NO+O 2==2NO 2 ②将化学方程式①、②叠加得:4NO 2+O 2+2H 2O==4HNO 3 ③ 4NO+3O 2+2H 2O==4HNO 3 ④利用化学方程式③解答NO 2、O 2混合气体溶于水的计算有三种类型: (1)当V NO2∶V O2=4∶1,完全反应,无气体剩余;(2)当V NO2∶V O2<4∶1,O 2过量,剩余O 2; (3)当V NO2∶V O2>4∶1,NO 2过量,剩余NO.利用化学方程式④解答NO 、O 2混合气体溶于水的计算也有三种类型:(1) 当V NO ∶V O2<4∶3时,O 2过量,剩余O 2; (2) 当V NO ∶V O2=4∶3时,完全反应,无气体剩余; (3)当V NO ∶V O2>4∶3时,NO 过量,剩余NO.2。
差量法NO 2溶于水转变成硝酸时体积会减小,利用期反应前后体积的变化量可进行计算。
例1 将盛有N 2和NO 2混合气体25mL 的量筒倒立于水槽里,过一段时间后,气体体积缩小到15mL ,后不再变化(同温同压下),原混合气体中N 2和NO 2的体积比是 [ ] A .4∶1 B .2∶3 C .1∶4 D .2∶1解析 :混合气体中的N 2既不溶于水,也不与水反应,只有NO 2溶于水 3NO 2+H 2O==2HNO 3+NO △V 3 1 3—1=2 x 25—15=10答案为B 。
氮的氧化物溶于水的计算

氮的氧化物溶于水的计算氮的氧化物指的是氮与氧元素形成的化合物,包括一氧化氮(NO)、二氧化氮(NO2)和三氧化二氮(N2O3)。
这些化合物在大气中存在,并且会溶解于水中,通过以下计算可以了解氮的氧化物在水中的溶解性和相关的化学反应。
首先,我们来讨论一氧化氮(NO)。
一氧化氮是一种无色气体,其溶解度随温度和帕斯卡定律成正相关。
根据Henry定律,气体在液体中的溶解度与气体分压成正比。
换句话说,溶解度可以通过气体的分压来确定。
NO在水中的溶解度可以通过以下公式计算:溶解度(mol/L) = K * P其中,K是Henry定律的Henry常数,P是NO的分压。
当NO的分压为1 atm时,其在25°C下的溶解度约为0.0013 mol/L。
随着温度的升高,溶解度会增加,因为温度升高会使气体分压增加。
接下来,我们转向二氧化氮(NO2)。
二氧化氮是一种红棕色气体,其在水中会发生一系列复杂的反应。
首先,二氧化氮会与水反应生成硝酸(HNO3)和亚硝酸(HNO2):2NO2+H2O->HNO3+HNO2其中,硝酸是一种强酸,亚硝酸是一种较弱的酸。
此外,二氧化氮还可以通过以下反应转化为一氧化氮:2NO2<->2NO+O2最后,我们来讨论三氧化二氮(N2O3)。
N2O3+H2O->2HNO2与二氧化氮类似,硝酸是一种强酸,亚硝酸是一种较弱的酸。
总结起来,氮的氧化物在水中会发生一系列的化学反应,包括一氧化氮的溶解、二氧化氮和三氧化二氮的与水反应。
这些反应导致水溶液中存在硝酸和亚硝酸,这些化合物在环境中有重要的生物地球化学循环作用。
然而,需要注意的是以上只是理论计算,实际情况可能受到多种因素的影响,包括温度、压力、其他溶质的存在等。
因此,在实际实验中需要综合考虑这些因素来确定氮的氧化物在水中的溶解度和化学反应行为。
关于氮的氧化物与水反应的计算
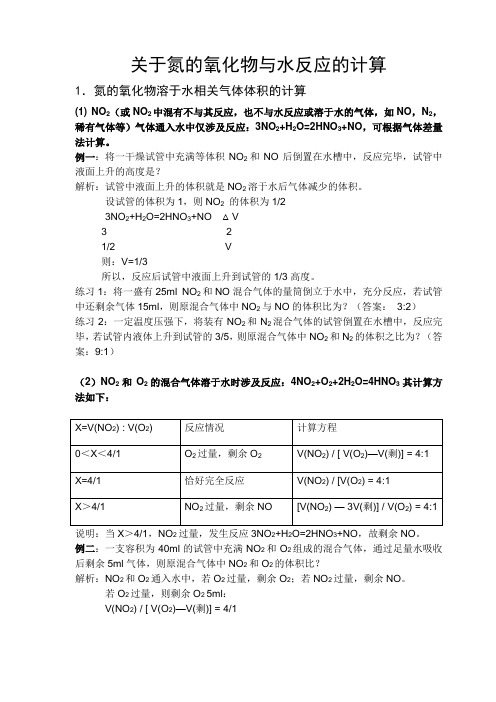
关于氮的氧化物与水反应的计算1.氮的氧化物溶于水相关气体体积的计算(1) NO2(或NO2中混有不与其反应,也不与水反应或溶于水的气体,如NO,N2,稀有气体等)气体通入水中仅涉及反应:3NO2+H2O=2HNO3+NO,可根据气体差量法计算。
例一:将一干燥试管中充满等体积NO2和NO后倒置在水槽中,反应完毕,试管中液面上升的高度是?解析:试管中液面上升的体积就是NO2溶于水后气体减少的体积。
设试管的体积为1,则NO2的体积为1/23NO2+H2O=2HNO3+NO △V3 21/2 V则:V=1/3所以,反应后试管中液面上升到试管的1/3高度。
练习1:将一盛有25ml NO2和NO混合气体的量筒倒立于水中,充分反应,若试管中还剩余气体15ml,则原混合气体中NO2与NO的体积比为?(答案:3:2)练习2:一定温度压强下,将装有NO2和N2混合气体的试管倒置在水槽中,反应完毕,若试管内液体上升到试管的3/5,则原混合气体中NO2和N2的体积之比为?(答案:9:1)(2)NO2和O2的混合气体溶于水时涉及反应:4NO2+O2+2H2O=4HNO3其计算方法如下:说明:当X>4/1,NO2过量,发生反应3NO2+H2O=2HNO3+NO,故剩余NO。
例二:一支容积为40ml的试管中充满NO2和O2组成的混合气体,通过足量水吸收后剩余5ml气体,则原混合气体中NO2和O2的体积比?解析:NO2和O2通入水中,若O2过量,剩余O2;若NO2过量,剩余NO。
若O2过量,则剩余O2 5ml:V(NO2) / [ V(O2)—V(剩)] = 4/1∵V(NO2) / [ V(O2)—5] = 4/1 (1)V(NO2) + V(O2) = 40ml (2)∴V(NO2) = 28ml V(O2) = 12ml∴原混合气体中V(NO2) : V(O2) = 28:12 = 7:3若NO2过量,剩余NO5ml:[V(NO2) — 3V(剩)] / V(O2) = 4/1∵[V(NO2) — 3X5 ] / V(O2) = 4/1 (1)V(NO2) + V(O2) = 40ml (2)∴V(NO2) = 35ml V(O2) = 5ml∴原混合气体中V(NO2) : V(O2) = 35:5 = 7:1练习:一定温度压强下:将一支容积为15ml的试管充满NO2后,倒置于盛水的水槽中,当试管内液面高度不再变化时,在相同条件下通入O2,若要使试管内液面仍保持在原高度,则通入O2的体积?(答案:8.75ml根据4NO2+O2+2H2O=4HNO3解题)(3)NO和O2的混合气体溶于水时涉及反应:4NO+3O2+2H2O=4HNO3其计算方法如下:例三:一定条件下,将等体积的NO和O2的混合气体置于试管中,并将试管倒立于水槽中,充分反应后剩余气体的体积约为原总体积的?解析:假设试管的体积为1,则V(NO) ,V(O2) 各占1/2体积4NO + 3O2 + 2H2O = 4HNO34 31/2 1/2∴O2过量,剩余O2V(NO) / [ V(O2)—V(剩)] = 4:3代入:V(NO) = V(O2) = 1/2V(剩) = 1/8∴反应后剩余气体的体积约为原总体积的1/8说明:当然这道题用反应方程直接计算剩余的O2也可以。
氮的氧化物溶于水的计算

氮的氧化物溶于水的计算云南省云天化中学 冯学萍(1) NO 和O 2 混合气体通入水由2NO + O 2 = 2NO 2 和3NO 2 + H 2O = 2HNO 3 +NO 得总反应为:4NO + 3O 2 + 2H 2O = 4HNO 3等于4/3 恰好完全反应可知当体积比V (NO )/V (O 2小于4/3 剩余气体O 2 大于4/3 剩余气体NO(2) NO 2和O 2 混合气体通入水由3NO 2 + H 2O = 2HNO 3 +NO 和2NO + O 2 = 2NO 2得总反应为:4NO 2 + O 2 + 2H 2O = 4HNO 3 等于4/1 恰好完全反应 可知当体积比V (NO 2)/V (O 2小于4/1 O 2过量,剩余气体O 2大于4/1 NO 2过量,剩余气体NO(3) NO 、NO 2和O 2 三种混合气体通入水先按3NO 2 + H 2O = 2HNO 3 +NO 把生成的NO 体积再加上原来混合气体中NO 体积,现在实际上等同于(1)种情况,即可计算。
例1:将盛有100mL NO 和O 2的混合气体的烧瓶倒立于水中,充分反应后,还剩余30mL 的无色气体,求原混合气体中的NO 和O 2的体积分别为多少?解:剩余的30mL 气体可能为NO ,或可能为O 2 ,设参加反应的NO 体积为xmL ,O 2体积为y mL 。
由反应4NO + 3O 2 + 2H 2O = 4HNO 3 ΔV 减少4 3 7xmL ymL 100mL —30mL解出x=40mL ,y=30mL当剩余的30mL 气体为NO 时,原混合气体中的NO 的体积为70mL 和O 2的体积为30mL ; 当剩余的30mL 气体为O 2时,原混合气体中的NO 的体积为40mL 和O 2的体积为60mL 。
答:略。
例2:将盛有12mL NO 2和O 2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL 的无色气体,求原混合气体中的NO 和O 2的体积分别为多少?解:依据化学方程式:①4NO 2 + O 2 + 2H 2O = 4HNO 3和②3NO 2 + H 2O = 2HNO 3 +NO ,设混合气体中O 2的体积为x mL ,剩余的气体有两种可能:(1)若O 2过量,剩余O 2,则只发生反应①:4NO 2 + O 2 + 2H 2O = 4HNO 34 1 12—x mL x —2mL解出x=4 mL ,则NO 2的体积为8 mL(2)若NO 2过量,剩余NO ,发生反应①和②, 由反应①:4NO 2 + O 2 + 2H 2O = 4HNO 3414x mL x mL由反应②3NO 2 + H 2O = 2HNO 3 +NO 3 1 12—x —4x mL 2mL解出x=1.2mL ,则NO 2的体积为10.8 mL答:略。
高中化学-氮的氧化物计算

氮的氧化物溶于水的计算
标况下,将盛满NO、NO2、O2混合气体 的集气瓶,倒置于水中,完全溶解,无
气体剩余,设其产物不扩散,则所得溶
液的物质的量浓度(M)的取值范围为
(
)
A、 0<M<1/22.4 B 1/39.2<M<1/28
C、1/28<M<1/22.4 D 1/39.2<M<1/22.4
氮的氧化物溶于水的计算
氮的氧化物溶于水的计算
(1) NO2或NO2与N2(非O2)的混合气体溶于水时 可依据:3NO2+H2O = 2HNO3+NO利用气体体 积变化差值进行计算。
(2) NOO2 +2H2O =4HNO3可知,当体积比
=4︰1,恰好完全反应
V(NO2):V(O2) > 4︰1,NO2过量剩余气体为NO <4︰1, O2过量,剩余气体为O2
氮的氧化物溶于水的计算
练习3. 标准状况下,将盛有 等体积的NO与O2的试管,倒 立于水槽中,反应后,试管内 液体上升的高度大约是试管体 积的几分之几?得到溶液的物 质的量浓度为多少?
氮的氧化物溶于水的计算
取10ml装有NO2和O2 的混合气体的量筒倒置 于水槽中,最后余下气 体1ml,求原混合气体中 NO2 的体积。
氮 的 氧 化 物 溶 于 水 的 计 算`
(3)NO和O2同时通入水中,其反应是: 4NO+3O2+2H2O = 4HNO3,当体积比
=4︰3,恰好完全反应
V(NO):V(O2) > 4︰3,NO过量剩余气体为NO
<4︰3, O2过量,剩余气体为O2
氮的氧化物溶于水的计算
值得注意的是: 4NO2+O2和4NO+3 O2从组成上均相当与 2N2O5的组成。即(2)、(3)两种情况中的总反应式都 与N2O5+ O2 2HNO3等效。这不仅是记忆(2)(3)二式的 方法,也为上述问题的解决提供了新的思路。即利用混合 气体中N、O原子个数比进行分析判断:
关于氮氧化物溶于水

7、将amLNO、bmLNO2、xmLO2混 合于同一试管里,将试管口倒插入水 中,充分反应后试管内气体消失,则 x对a、b的函数关系式f[x(a、b)]是 A. (a+b)/2 C. (3a+b)/4 B. (2a+b)/3 D. (4a+b)/5
C(HNO3)=1/39.2 mol/L
例4 将体积为10mL的试管倒置于盛水的水槽中, 先向试管中注入一定量的NO,再通入O2,两种气 体共为10mL,水面逐渐上升,至余3mL气体时为 止。求 (1)原混合气体中NO和O2各多少毫升? (2)通入O2为多少毫升时,使管内的气体仍为 10mL? (3)通入O2为多少毫升时,使管内的气体与原 N现用向上排空气法收集 NO2,并将收集 NO2后的集气瓶倒置于水槽中,反应停 止后,一部分水进入集气瓶,形成稀硝酸(假设溶质不 向外扩散)(气体体积在标准状况下测定,空气中N2、 O2体积比为4:1,其他成分忽略不计,不计2NO2 N2O4) (1)当收集到的NO2为amL时,所得HNO3的物质的量浓度 为_____。 (2)若与水作用后,集气瓶中余下的气体全部是N2时, 原来收集到的NO2的体积为__________。 (3)若与水作用后,集气瓶中余下的气体是N2和O2时, 则原来收集到的NO2的体积V的范围是__________。 (4)若收集到的NO2体积为3a/4mL,计算所得硝酸的物质 的量浓度。
例题
把10mLNO、NO2的混合气体通 入倒立在水槽的盛满水的量筒中,
片刻以后量筒里留下5mL气体。求
原混合气体中NO、NO2的体积。
V(NO2)=7.5mL V(NO)=2.5mL
09: 氮氧化物与O2混合后溶于水的计算规律与方法

氮氧化物与O2混合后溶于水的计算规律与方法一、计算原理:1、反应原理3 NO2+H2O→ 2HNO3+NO①4 NO2+O2+ 2 H2O→ 4HNO3②4 NO+ 3O2+ 2 H2O→ 4HNO3③2、计算原理①气体减少的体积为液面上升的体积,也即HNO3溶液的体积。
②气体减少的体积可以用差量法计算(根据相应的反应方程式)。
③注意过量问题的分析。
二、计算类型:(1)NO2或(NO、NO2混合气体)跟水反应:只有一种情况,二氧化氮完全与水反应,按反应①进行计算。
(2)NO2、O2同时跟水反应:V(NO2):V(O2)=4:1 时,完全反应,按反应②进行计算;V(NO2):V(O2)﹤ 4:1 时,O2过量,剩余气体为O2,按反应②进行计算;V(NO2):V(O2)﹥ 4:1 时,NO2过量,剩余气体为NO,分别利用反应②、①进行两次计算。
(3)NO、O2同时跟水反应:V(NO):V(O2)= 4:3 时,完全反应,按反应③进行计算;V(NO):V(O2)﹤ 4:3 时,O2过量,剩余气体为O2,按反应③进行计算;V(NO):V(O2)﹥ 4:3 时,NO过量,剩余气体为NO,NO不能与水反应,按反应③进行计算。
(4)NO、NO2、O2同时跟水反应:先按反应①进行计算,将按①计算后得到的一氧化氮量与原气体中含有的一氧化氮量相加,转化为第三种类型的题,按反应③进行计算。
Tips:①在进行计算时,灵活应用极值法、假设法、或得失电子守恒法进行求解。
②注意有关循环氧化、由多步反应合并所得总反应。
注意各种类型的气体混合与之相对应的反应方程式。
三、典型例题与练习:1.在标准状况下,将 NO 2 、NO 、O 2 混合后充满容器,倒置在水中,完全溶解,无气体剩余,若产物不扩散,则所得溶液物质的量浓度的数值范围是() A .0<c <1 B . 1 <c < 1 C . 1 <c < 1 D . 1 <c < 1 22.4 39.2 22.4 39.2 28 28 22.42.将盛有 N 2 和 NO 2 混合气体的试管倒立与水中,经足够时间后,试管内气体的体积缩小为原体积的 3/5,则原混合气体中 N 2 和 NO 2 的体积比是( )A .1:1B .2:3C .1:3D .3:13.将标准状况下 NO 2 和O 2 按体积比 4:1 混合后充入一干燥烧瓶中,把烧瓶倒置于水中,瓶内液体逐渐上升,假设烧瓶内溶液不扩散,最终烧瓶内溶液溶质的物质的量浓度为()1 -1 4 1 -1 4 1 -1 4 -1A . mol ⋅ LB . ⨯ mol ⋅ LC . ⨯ mol ⋅ LD . 5 mol ⋅ L 22.4 7 22.4 5 22.4 4.将一充满 NO 的试管倒扣于水槽中,然后向试管中通入一定量的O 2 ,试管中恰好充满水时,通入的O 2与原 NO 的体积比和所得溶液的物质的量浓度分别为(假设生成的溶质不向外扩散,且为标准状况)( )A .3:4;1/22.4B .4:3;1/22.4C .1:4;1/11.2D .4:1;1/11.25.把 40mL NO 和 NO 2 的混合气体与 20mL O 2 同时通入倒立在水槽里盛满水的量筒中,充分反应后,量筒里还剩下 5mL 气体。
氮的氧化物溶于水生成硝酸的浓度计算

杨香涛
24 4 2 11
2 NO和 O 2混合 溶 于水 生成 硝 酸 例 2 在 标 准 状 况 下 将 NO与 O ,以 4: 3 的体 积 比充 人 一 干 燥 烧 瓶 后 倒 立 水 槽 中 , 液 体 逐 渐 上 升 至 烧 瓶 底 部 , 最 后 进 入 烧 瓶 中 求 溶 液 的物 质 的 量浓 度 ? 解析 : 标 准 状 况 下 气 体 的 体 积 比 等 于 在 其 物 质 的量 之 比 , 因此 设 NO 的 物 质 的 量 为 4 则 O2 物 质 的量 为 3 又 根 据 2 x, 的 X, NO +
河 北理 科 教 学研 究
问题 讨 论
( HN03 ):4X +2X :6Xmo l
因 为 硝 酸 溶 液 的体 积 等 于 气 体 体 积 的减 少 , 以 C( 所 HNO )= i s
o‘ lL
根 据 题 意 : 瓶 的体 积 等 于 溶 液 的体 积 , 烧
得
C Na 第 2 = 。l ( O= H ) _ m_ 4 l 『
说明 :
1 的体 积 比充 人 一 干燥 烧 瓶 后 倒 立 于 水 槽
中, 液体 逐 渐 上 升 至 烧 瓶 底部 , 最 后 进 入 烧 求
瓶 中溶 液 的物 质 的 量 浓 度 ?
( ) 2气 体 中 如 果 混 有 如 N2 NO 稀 1 NO 、
有气 体等不溶 于 水 的气体 , 们生 成 硝酸 溶 它 液的物质的量浓度不 变 , 为 仍 mn‘ ~. L I
=
44 8 × 1 3 0 L
说 明 : 要 是 NO 与 0 只 2混 合 溶 于 水 , 不 管 是 NO 过 量 , 是 0 还 2过 量 , 们 生 成 硝 酸 它
氮的氧化物溶于水的相关计算

有关NO、NO2气体溶于水的相关计算一、NO的相关计算1.V L装满NO的试管倒扣于盛水的水槽中,然后间歇的向试管中通入O2,现象为,发生反应的化学方程式为,当通入 L O2时液体刚好充满整个试管。
2.将a L充满NO和O2的试管倒扣于盛水的水槽中,若液体充满整个试管,则原试管中充入的NO和O2的体积比;若为标准状况下,则所得溶液溶质的物质的量浓度为 mol/L(假设试管中的溶质不扩散)。
3.将盛有12mlNO气体的试管倒立于盛水的水槽中,通入一定量的O2,充分反应后试管内气体体积为4ml,则通入O2的体积为 ml。
4.将一定量的NO和10mlO2同时通入盛满水并倒立于水槽的试管中,足够长的时间后,试管内剩余气体为4ml,则原通入的NO为ml。
5.一支试管的容积为16ml,长度为20cm,内充8mlNO和8mlO2,将其倒立于盛水的水槽中,反应上升的高度约为 cm。
二、NO2的相关计算1.V L 装满NO2的试管倒扣于盛水的水槽中,然后间歇的向试管中通入O2,现象为,发生反应的化学方程式为当通入 L O2时,液体刚好充满整个试管。
2.a L 装满NO2和O2混合气体的试管倒扣于盛水的水槽中,若液体充满整个试管,则原试管中NO2和O2体积比;若为标况下则所得溶液溶质的物质的量浓度为 mol/L(假设试管中的溶质不扩散)。
3.有O2和NO2混合气体12ml,被水充分收后,余下2ml气体,则原混合气体中的组成可能是:①②4.有一支试管充满NO2和O2混合气体,将之倒立水中,水面上升至试管容积的3/4处停止,原混合气体中O2的体积分数。
5.a L装满NO2和O2混合气体的试管倒扣于盛水的水槽中:①若得到b LO2,则原混合气体中NO2体积为 L,O2为 L。
②若得到b L NO,则原混合气体中NO2体积为 L,O2为L。
三、NO、NO2混合气体的相关计算1.一定条件下,将装有一定体积的NO、6体积NO2和4.5体积O2试管倒立于水中,充分反应后剩余1.5体积气体,则原混合气体中,NO的体积为或2.把80 mlNO和NO2的混合气体与40 mlO2混合后一起通入装满水倒扣于水槽中的量筒,充分作用后剩余10 ml气体,则原混合气体中NO2的体积为3.V ml NO和NO2的混合气体用水吸收后,得到a ml无色气体A,将此无色气体A与等体积O2混合,再用水充分吸收后,收集到5 ml无色气体B,试回答:①A气体是,B气体是②A气体的体积是 ml③V的取值范围为。
氮的氧化物溶于水的计算

a
a
A.b
B.2b
a C.a+2b
a D.2a+b
人教版化学·必修1
返回导航 上页 下页
解析:由质量守恒可知,反应前后氮原子数和氧原子数不变。 答案:C
人教版化学·必修1
返回导航 上页 下页
2.将盛有12 mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2
mL无色气体,则原混合气体中O2的体积是________。
氮的氧化物溶于水的计算
氮的氧化物溶于水的计算 氮的氧化物溶于水的计算 1.相关反应原理 3NO2+H2O===2HNO3+NO① 2NO+O2===2NO2② 由方程式①×2+②得: 4NO2+O2+2H2O===4HNO3③ 由方程式①×2+②×3 得: 4NO+3O2+2H2O===4HNO3④
答案:1.2 mL或4 mL
答案:C
3.将盛有N2和NO2混合气体的试管倒立于水中,经 过足够长的时间后,试管内气体的体积缩小为原来的
一半,则原混合气体中N2和NO2的体积比是( )
A.1∶1
B.1∶2
C.1∶3
D.3∶1
解析:设NO2的体积为x,N2的体积为 (1-x),由题意结合化学方程式
3NO2+H2O===2HNO3+NO↑,可得x +(1-x)=1/2,x=3/4,1-x=1/4,N2 和NO2的体积比为1∶3。
mL;
所以原混合气体中V(NO)=40 mL-30 mL=10 mL,
则V(NO2)∶V(NO)=30 mL∶10 mL=3∶1。 [答案] C
返回导航 上页 下页
人教版化学·必修1
[题组训练]
返回导航 上页 下页
1.在体积为V L的密闭容器中,通入a mol NO和b mol O2。反应后容器内氮原子数 和氧原子数之比为( )
有关氮氧化物溶于水的计算技巧

氮的氧化物溶于水的计算方法对有关氮的氧化物溶于水的计算,同学们在学习中往往感到困难。
其原因是这一溶解过程是通过循环往复的变化才达到平衡的。
但仔细分析可知:这些过程所涉及的化学反应不外乎就是下面两个:3NO2+H2O=2HNO3+NO…..①2NO+O2=2NO2………………②所以,解答这类习题的关键就在对这两个方程的处理上。
解答时可以采用消中间量法,将其中与前后反应相关的中间量消去,得到一总的反应式即可简便地解题。
为此,本文就谈谈利用总反应式解答这类习题的方法。
一、总反应式的推导按照混和气体的种类可以分两大类。
一类是互不反应的两种气体混和溶于水,如N2和NO2、NO和NO2等,由于它们之间并不发生反应,因此,解这类习题时是比较简单的,不需对方程式进行合并,故本文不打算再赘述。
另一类是相互要发生反应,如NO 和O2;NO2和O2;NO、NO2和O2的混和气等,其情况就比较复杂,下面着重讨论如下:1.NO和O2混和溶于水此时可将前述①式×2,②式×3,将NO2从反应体系中消掉,即得总反应式:3NO2+H2O=2HNO3+NO ×2+) 2NO+O2=2NO2 ×3——————————————4NO+3O2+2H2O=4HNO3……③2.NO2和O2混和溶于水此时,NO2与水反应生成的NO是反应的中间产物,照第1种办法处理,将①式x2与②式合并即得总反应式:4NO2+O2+2H2O=4HNO3……④3.NO、NO2和O2混和溶于水这时的情况就更复杂,一般可将①、②两式相加即得总反应式:NO+NO2+O2+H2O=2HNO3…⑤运用上述五个反应式,即可方便地进行有关氮的氧化物的计算习题的解答。
二、总反应式的应用1.判断反应体系中气体间量的关系(1)由③式可知:①当VNO∶VO2=4∶3 时,两种气体恰好完全反应,此时体系中没有气体剩余。
②当VNO∶VO2<4∶3 时,O2过量,剩余为气体O2。
高一化学课件 氮的氧化物溶于水的计算

将3支试管均倒置于水槽中,充分反应后,
试管中剩余气体的体积分别为V1、V2、V3,
则大小关系是Biblioteka V1>V2>V3
总反应式:4NO2 + O2 + 2H2O = 4HNO3
V(NO2):V(O2)=4:1 恰好反应,无气体剩余
结论: V(NO2):V(O2)<4:1 O2过量,剩余O2
V(NO2):V(O2)>4:1 NO2过量,NO剩余
2.NO2和O2混合气体溶于水
▪ 例题1:将4体积NO2和2体积O2充分混合于 某烧瓶中,然后倒立于水槽中,待液面不 再变化,剩余气体是什么?体积是多少?
NO和N2 1:1
1.NO2(或和NO、N2混合)气体溶于水
▪ 练习:某烧瓶中盛满NO2和NO混合气(两 者体积比3:2),现将烧瓶倒立于水槽中, 待充分反应后,剩余气体的成分是什么? 剩余气体与原混合气的体积比为多少?
NO 3:5
2.NO2和O2混合气体溶于水
分析反应原理: 3NO2 + H2O = 2HNO3 + NO 2NO + O2 = 2NO2
▪ 练习:某盛满NO2气体的量筒倒置于水槽中, 待液面不再上升后,测得剩余气体体积为 35毫升,试计算原NO2气体的体积。
3NO2 + H2O = 2HNO3 + NO
105毫升
1.NO2(或和NO、N2混合)气体溶于水
▪ 例题2:某烧瓶中盛满NO2和N2混合气(两 者体积比3:1),现将烧瓶倒立于水槽中, 待充分反应后,剩余气体的成分是什么? 体积比为多少?
V(NO):V(O2)=4:3 恰好反应,无气体剩余
结论: V(NO):V(O2)<4:3 O2过量,剩余O2
氮的氧化物溶于水的计算

4、NO与O2同时溶于水
4NO + 3O2+ 2H2O = 4HNO3 = 4:3 恰好完全反应,气体无剩余 V(NO) V(O2) > 4:3 NO过量,NO剩余 < 4:1 O2过量,O2剩余
【例4】将盛有12mLNO气体的试管倒扣于水槽中, 向试管中通入一定量的O2,充分反应后,试管内还 剩余4mL无色气体,则通入的O2体积可能是多少?
NO2过量,继续与H2O反应,NO > 4:1 剩余
< 4:1 O2过量,O2剩余
【例3】将盛满NO2和O210mL的试管倒扣于水槽中, 充分反应后,结果剩余2mL的无色气体,则原混合 气体中NO2和O2的体积比为多少? 【变式】将盛满NO2和O2的试管倒扣于水槽中,充 分反应后,结果剩余1/5体积的无色气体,则原混合 气体中NO2和O2的体积比为多少?
氮的氧化物溶于水的 相关计算
1、NO2溶于水
3NO2 + H2O = 2HNO3 + NO
【例1】将充满NO2的试管倒扣在水槽中,充分反应 后试管内剩余2mL,原试管的体积为多大?
Page
2Leabharlann 2、NO2与既不溶于水又不与水、NO2反应的气 体(如N2、NO等)同时溶于水
3NO2 + H2O = 2HNO3 + NO 列方程组法、差量法
【例2】在一定温度和压强下,将充满NO2和N2混合 气体10mL的试管倒立于水槽中,充分反应后,气体 体积缩小为4mL。求原混合气体中NO2和N2的体积 比。
Page
3
3、NO2与O2同时溶于水
4NO2 + O2+ 2H2O = 4HNO3 = 4:1 恰好完全反应,气体无剩余 V(NO2) V(O2)
氮的氧化物溶于水的计算 (上课)

若剩余2mL为O2: 通入V(O2) =12mL
若剩余2mL为NO:通入V(O2) =8.5mL
例2、标准状况下,将56mL NO和NO2组成的 混合气用100mL水吸收,吸收过程中慢慢通 入O2,当通入O2量达32mL时恰好使所有气体 均被完全吸收,试计算:原56mL混合气中NO 和NO2的体积各为多少毫升?
四. NO、 NO2 、的混合气体溶于水
先考虑 3NO2 + H2O = 2HNO3 + NO , 求出NO体积 再利用 4NO + 3O2 + 2H2O = 4HNO3 进行计算
例1.常温下盛有10mLNO和10mLNO2组成的混
合气体的大试管倒立水中,当向其中缓缓
通入O2一段时间后,试管内残留2mL气体,
氮的氧化物溶于水的计算
一、NO2(NO2+N2或NO2+NO)溶于水 反应: 3NO2+H2O = 2HNO3+NO
常用方法:差量法
3NO2 — NO — 2△V
例1:一试管中充满了N2、NO2的混合气体共aL, 倒立水中,充分反应后,剩余气体bL,求NO2和N2 的体积。 3(a-b) / 2 例2:一定条件下,将等体积的NO和NO2的混合气体 置于试管中,并将试管倒立于水槽中,充分反应 后,液面上升的高度是试管的( 1 / 3 ) 3. 在一定温度和压强下,装有NO和NO2混合气的试 管倒立于水中,充分反应后,试管内气体体积缩 小为原体积的3/5,则原混合气中NO和NO2的体积比 为( 2:3 )
2、某NO和NO2的混合气体,在标况下的密 度是1.875 g / L ,将1支充满该混合气体的 试管倒置于盛有足量水的水槽中,直到水位 不再上升为止。问: (1)剩余气体的体积是原混合气体的体积 的多少倍? (2)若原混合气体的体积为 40 ml ,在剩 余气体中应通入多少O2,才能使试管中恰好 充满液体?
(完整版)氮氧化物溶于水的计算
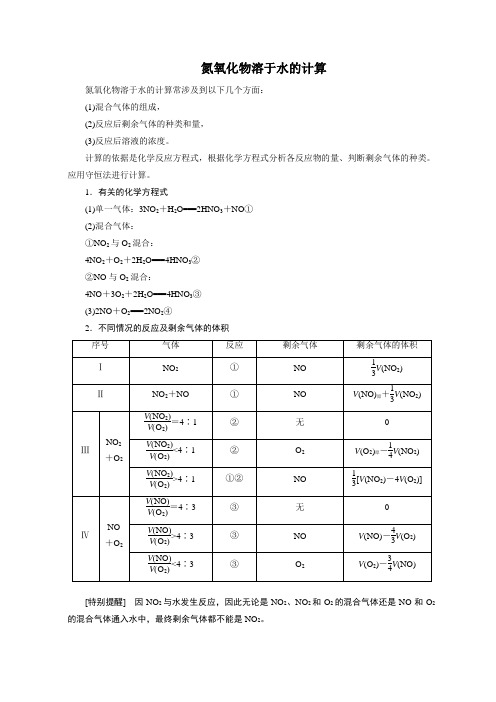
氮氧化物溶于水的计算氮氧化物溶于水的计算常涉及到以下几个方面:(1)混合气体的组成,(2)反应后剩余气体的种类和量,(3)反应后溶液的浓度。
计算的依据是化学反应方程式,根据化学方程式分析各反应物的量、判断剩余气体的种类。
应用守恒法进行计算。
1.有关的化学方程式(1)单一气体:3NO2+H2O===2HNO3+NO①(2)混合气体:①NO2与O2混合:4NO2+O2+2H2O===4HNO3②②NO与O2混合:4NO+3O2+2H2O===4HNO3③(3)2NO+O2===2NO2④2.不同情况的反应及剩余气体的体积[特别提醒]因NO2与水发生反应,因此无论是NO2、NO2和O2的混合气体还是NO和O2的混合气体通入水中,最终剩余气体都不能是NO2。
[例] 用排水法收集12 mL NO 于试管中,然后向倒立于水槽中的该试管内间歇地通入O 2共12 mL ,下面的说法中,正确的是( )A .剩余NOB .剩余NO 2C .试管中气体为红棕色D .试管内气体先变为红棕色,后红棕色消失,反复几次,最后剩余无色气体 [解析] 向NO 中间歇通入O 2发生的反应为 2NO +O 2===2NO 2 ①3NO 2+H 2O===2HNO 3+NO ②由①×3+②×2得:4NO +3O 2+2H 2O===4HNO 3 等体积的NO 和O 2反应最终剩余O 2。
[答案] DNO ――→O 2 NO 2――→H 2ONO (无色)(红棕色)(无色)1.在NO 2被水吸收的反应中,发生还原反应的物质和发生氧化反应的物质的质量比为( ) A .3∶1 B .1∶3 C .1∶2D .2∶3解析:3N +4O 2+H 2O===2H N +5O 3+N +2O,3 mol NO 2中,有2 mol 氮的价态升高,1 mol 氮的价态降低,所以发生还原反应的NO 2与发生氧化反应的NO 2的质量比为1∶2。
