有色冶金原理
有色冶金原理
有色冶金的酸碱性,习惯上用硅酸度表示,有时也用碱度表示。
认识三元系图
简单三元系图 如左下图所示,A,B,C 代表三种不同组元, 分别代表三种不同组元的初晶 区,边上的点(1、2、3)为 克 二元结晶点
化合物稳定性的判断:组成点在其对应的初晶区内则为稳定化合物。
CS-C2S-C2AS三元系图分析
(1)生产能力低,反应速度慢; (2)对设备的腐蚀性大; (3)流程长,液固分离困难.
火法冶金与湿法冶金的优缺点比较
第一章:冶金炉渣
炉渣,熔化后称为熔渣,是各种氧化物的熔体。在冶炼过程的技术经济指标在很大程度上与炉渣有关。
冶金炉渣的作用
①使脉石集中与金属或锍分离。 ②作为一种介质,其中进生着许多极为重要的冶金反应。 ③金属液滴或锍液滴的沉降分离(对机械夹杂损失起着决定性的作用) ④决定最高的冶炼温度(大致为炉渣熔化后温度加上一定过热的温度(150~250℃)) ⑤对杂质的脱除和浓度加以控制。 ⑥作为一种中间产物,杂质中含金属量高。 ⑦可调节电极插入渣中的深度调节电炉的功率。(起热传递作用)
三元系图的点线面
三元系图的点线面判断
二次结晶线与三元不变点与基元三角形的判断
二次结晶线的判断:任一结晶线相邻的两给元和点的连线与该结晶线上任一点作出的切线相交则此结晶线为共晶线,反之则为包晶线。--切线相交原则。(也可与三元不变点联系:共晶点上相连的结晶线全为共晶线,包晶点相连的结晶线至少有一条是包晶线)
冶炼对炉渣的要求
①熔点低(能耗)②密度低(与主体金属分层)③适当组成(如酸碱度)④腐蚀性小(保护炉衬)
炉渣的组成,对于大多数炉渣和钢渣,这三种氧化物是FeO、CaO、SiO2,对高炉和某些有色冶金炉渣则为CaO、Al2O3、SiO2。 组成炉渣的各种氧化物可分为三类: (1)碱性氧化物:CaO、MnO、Feo、MgO等,这类氧化物能供给氧离子O2-,如:CaO=Ca2++O2- (2)酸性氧化物: SiO2 、P2O5等,这类氧化物能吸收氧离子而形成络合阴离子,如:SiO2+2O2-=SiO44- (3)两性氧化物:Al2O3、ZnO等,这类氧化物在酸性氧化物过剩时可供给氧离子面呈碱性,而碱性氧化物过剩时则对会吸收氧离子面呈酸性,如:Al2O3=2Al3++3O2- Al2O3+O2-=2AlO2-
有色冶金原理第二章化合物的离解生成反应

CPFeO 48.79 8.73 10 3T 2.8105T 2
CPO2
1 29.96 1 4.18103T
2
2
1 1.67105T 2 2
12
代入式(2-9):
G
264428 70.92T
T 16.32ln
T 298
298 T
1
18.50
103
T 2
2982 2T
298
1.97 10 5 1
MexOy Me2O MeO Me2O3 MeO2 Me2O5
n
2
2
2/3 1
2/5
且氧化物的吉布斯自由能图只能适用于标准状态:即 参与反应的物质中,凝聚相 (固、液相) 为定组成化合物, 气相为101325 Pa。若凝聚相为不定组成化合物,固溶体或 溶液则不适用。
17
三、ΔGθ-- T关系式
18
4
二、ΔGTθ与温度的关系
—— ΔGTθ一T关系式(捷姆金—许华兹曼速算式)
推导过程
根据热力学第二定律,在等温等压条件下
ΔGTΘ=ΔHTΘ_TΔSTΘ
(2-3)
式(2-3)中,上标“Θ”为保准状态,即固体、液体为纯物质,
气体为101325Pa,ΔGTΘ为反应的标准吉布斯自由能变化, ΔHTΘ为反应的标准焓变化,ΔSTΘ为反应的标准熵变化,T为 绝对温度。
T CP 298 T
dT
H
298
TS298
T
1 T
T
298 CPdT
T 298
1 T
CPdT
6
根据分部积分法公式 udV uV Vdu
设 V 1 ,则dV dT / T 2 ,设 u CP dT
有色冶金原理

表 4.1 各种气态硫在不同温度下及P总=101325 Pa时的分压(Pa)
图 4.1 各种硫化物的离解压对数与温度关系曲线
图 4.2 硫化物的吉布斯自由能图
表4.2 一般的Me-S-O系中的反应及平衡关系式
图4.3 Me-S-O系等温平衡图
表4.3 Cu-S-O系标准吉布斯自由能数据
硫化物比氧化物容易氯化
思考题
1、什么是氯化冶金,基本过程及主要方法有哪些? 2、理解氯化物的∆Gᶱ~T关系图意义; 3、金属氧化物氯化时为何需要加入还原剂?写出氯化时加C 反应的原理; 4、金属硫化物的氯化过程为何较其氧化物容易? 5、NaCl作为氯化剂时,对金属硫化物和金属氧化物的氯化程 度如何,工业上如何操作? 6、能否用碳、氢作还原剂来还原其他金属氯化物?
图4.8 S-O系吉布斯自由能图
着火温度并非一定值,而与硫化物的颗粒大小有关。 硫化物氧化过程影响因素: 1、温度; 2、颗粒外表面的固体反应物膜层的厚度及致密程度; 3、物料的物料化学性质。粒度、孔隙度; 4、气流中O2、SO2、SO3的浓度等。
表4.8 某些硫化物的着火温度与其颗粒大小的关系
方法及分类
方法: 第一步,使均匀的熔融粗金属中产生多相体系(如金 属-渣,金属-金属,金属-气体); 第二步,把上述产生的各两相体系用物理方法分离 。 分类: (l) 金属一法系; (2) 金属一金属系: (3) 全属一气体系。
• •
• • •
第五章 氧化物和硫化物的火法氯化
金属氯化物与相应金属的其它化合物比较,大都具有低熔 点、高挥发性和易溶于水等性质,因此将矿石中的金属氧化 物转变为氯化物,并利用上述性质将金属氯化物与一些其它 化合物和脉石分离。 氯化冶金 就是将矿石(或冶金半成品)与氯化剂混合,在一定条件下 发生化学反应,使金属变为氯化物再进一步将金属提取出来 的方法 氮化冶金主要包括氯化过程、氯化物的分离过程、从氯化 物中提取金属等三个基本过程。 • 在多数的冶金原料中,金属并非以氯化物形态存在,因此 从原料中制取金属氯化物的氯化过程,是氯化冶金最基本 和最重要的过程。
冶金 研究生 参考书目

冶金研究生参考书目
以下是冶金工程相关研究生专业的部分参考书目:
1.《钢铁冶金学》(炼铁部分),王筱留编,冶金工业出版社,2001年。
2.《现代冶金学钢铁冶金卷》(炼钢部分),朱苗勇编,冶金工业出版社,2005
年。
3.《有色金属冶金学》,邱竹贤,冶金工业出版社,2008年。
4.《冶金专业英语》(钢铁冶金部分),侯向东,冶金工业出版社,2014年第二
版。
5.《冶金工程专业英语》(有色冶金部分),李进,冶金工业出版社,2013年。
6.《冶金原理》,李洪桂主编,科学出版社,2005。
7.《有色冶金原理》,傅崇说主编,冶金工业出版社,1997。
8.《钢铁冶金原理》,黄希祜主编,冶金工业出版社,2005。
以上是部分相关参考书目,建议根据具体研究方向和目标院校进一步选择适合的参考书目。
冶金原理讲授教学大纲

冶金原理教学大纲一、课程在培养方案中的地位、目的和任务本课程系冶金专业的主业课程。
本课程是在无机化学、物理化学和冶金概论的基础上进行的。
通过学习,使学生掌握冶金过程的基本原理和使用原理分析问题解决问题的方法,为今后的专业学习和工作实践奠定基础。
二、课程的基本要求1、了解重要基本概念和基本原理的定义和含义;2、能运用所学的理论对基本冶金过程进行定性、定量分析;3、能够初步解决具体的研究问题;4、不要背诵公式定理,而要在理解的基础上学会灵活运用。
各章的基本要求:1.冶金熔体a.冶金熔体的基本概念和特点;三元相图相平衡(初晶面,划分三角形,平衡线、平衡点的性质,冷却过程分析,等温截面图)。
要求能够熟练的进行冷却过程分析,会根据相图选择合理的熔体成分;b.了解各种冶金熔体的结构理论,特别是对于冶金炉渣,要求会应用所学的理论解释相关现象;c.了解冶金熔体的物理化学性质及其变化规律,能够使用公式进行简单的计算,以及正确的查图都区有关参数;d.掌握熔渣的酸碱性、氧化性的表示方法,会用来初步分析问题;了解渣与金属间的反应;e.会读图获取熔体的热力学参数。
2.热力学基础a.了解热力学的性质和应用,严格与动力学相区分;b.掌握吉布斯自由能图的构筑和应用方法、图中线的斜率的变化规律,会计算化合物的分解压。
c.掌握绘制热力学平衡的方法,能够熟练的绘制Me-O系、Me-O-S系的平衡图、电势-pH图,会举一反三建立其他体系的平衡图如Me-Cl-O系的平衡图等;并能用来初步解决具体问题,如解释冶金现象、选择工艺条件等;d.掌握碳的燃烧反应特别是布多尔反应的平衡关系,掌握氢的燃烧反应及C-H-O系的平衡,会进行平衡计算并建立变价金属氧化物用CO和H2、C还原的平衡图;明确熔渣中金属氧化物的还原的对比关系;理解真空还原、金属热还原的原理;e.掌握不同标准状态的换算关系,并会运用活度进行精炼的平衡计算,了解熔析精炼、区域熔炼的原理。
有色冶金原理

有色冶金原理
有色冶金是指除了铁、钢和黑色金属外的其他金属及其合金的冶金学科。
它涉及到的金属包括铜、铝、锌、镁、铅、镍、钴、锡、锑、铱、铑、钼、钯、铑、铅、钨、钴、镍、锡、银、金等。
有色冶金原理是指研究有色金属冶炼过程中的物理、化学及冶金学原理。
它主要涉及到有色金属的提取、炼制、精炼和加工等过程,以及金属的物理、化学性质变化以及其与其他元素的配合形成合金等方面。
在有色冶金原理中,一个重要的原理是金属的提取。
不同金属的提取方法各异,但都基于物理和化学原理。
例如,铜可以通过火法炼铜、湿法炼铜等方法进行提取。
火法炼铜是指将铜矿石加热到高温,使其融化,再通过各种化学反应将铜从矿石中分离出来。
湿法炼铜是通过浸出、萃取等方法将铜离子从矿石中溶解出来。
此外,有色冶金原理还包括金属合金的制备和加工技术。
金属合金是在金属中加入其他元素,以改善其性能和热处理特性。
不同金属合金的制备方法也有所不同,常见的方法包括熔炼、溶液热处理和机械合金化等。
在有色冶金原理中,了解金属的晶体结构和相变规律也非常重要。
金属的晶体结构决定了其物理和力学性能,而相变规律则反映了金属在不同温度和压力下的相变行为。
总之,有色冶金原理是研究有色金属冶炼过程中的物理、化学及冶金学原理的学科。
通过了解和应用这些原理,可以更好地进行有色金属的提取、炼制和加工,提高金属的品质和性能。
有色冶金原理

有色冶金原理有色冶金是指以有色金属(即不含铁的金属)为原料进行冶炼和加工的一种冶金工艺。
有色金属具有良好的导电、导热、耐腐蚀等特性,因此在电子、航空航天、军工等领域有着广泛的应用。
有色冶金原理是指对有色金属冶炼和加工过程中的物理、化学现象进行研究和探索,以及相关工艺技术的原理和规律。
首先,有色冶金原理涉及到有色金属的提取和精炼过程。
有色金属的提取主要包括矿石选矿、破碎、浮选、冶炼等步骤。
在这一过程中,需要考虑矿石的成分和性质,选择合适的提取方法,控制冶炼过程中的温度、氧化还原条件等参数,以确保提取出高纯度的有色金属。
其次,有色冶金原理还涉及到有色金属的合金化和加工过程。
合金是由两种或两种以上金属或非金属元素按一定的比例混合而成的固溶体或非固溶体。
在合金化过程中,需要考虑不同金属元素的相容性、晶体结构、热处理工艺等因素,以调整合金的力学性能、耐腐蚀性能等特性。
另外,有色冶金原理还包括了有色金属的成型加工和表面处理。
成型加工包括锻造、轧制、挤压、拉拔等工艺,通过这些工艺可以改善金属的组织结构,提高其力学性能。
表面处理则包括镀层、喷涂、阳极氧化等工艺,可以提高金属的耐腐蚀性能、美观性和使用寿命。
总的来说,有色冶金原理是一门综合性的学科,涉及到物理、化学、材料学等多个学科的知识。
在实际应用中,需要综合考虑原材料的性质、工艺的条件、设备的特点等因素,以确保有色金属冶炼和加工的质量和效率。
有色冶金原理的研究不仅可以为工程技术提供理论依据,还可以推动有色金属工业的发展,促进相关领域的技术进步和创新。
综上所述,有色冶金原理是有色金属冶炼和加工过程中的基础理论和技术原理,对于提高有色金属的品质和开发新型有色金属材料具有重要意义。
通过对有色冶金原理的深入研究和应用,可以促进有色金属工业的发展,推动相关领域的科技进步,为社会经济的发展做出贡献。
有色冶金原理第八章溶剂萃取和离子交换

有 -水 RT =ln a水 a有
e a 有 -水 RT 水
a有 c有 有
c水 水
其中c为摩尔浓度, 为活度系数。
当溶质浓度较低时,活度系数都接近于1,有,水 为 常数,故有C有/C水为常数,即
K为分配常数
K= C有/C水
分配定律仅适用于溶质浓度较低,接近理想体系, 溶质和溶剂不发生化学作用,溶质以同种的分子状态分 配在两相的情况。
电子-活化中心型的配位键,这种键比水分子键更牢固。
②各种有机碱及其盐或者是各种有机酸及其盐,能与水溶液接触时发
生萃取分子中的无机阴离子或阳离子和水溶液中的同名离子之间的 离子交换过程。
1.4.1 中性萃取剂:
代表者:酮,醇,醚 ,中性的焓磷、含硫和含氮的有 机化合物。
从结构上看,中性萃取剂分子中均含有能使氧原子 通向体系空间的活性基团,如羟基,磷酰基,亚硫酰基等, 氧原子能直接与被萃取金属化合物中的金属阳离子配位或 者间接地通过氢键与金属结合而形成中性络合物。
(2)烊盐形成能力决定与含氧萃取剂的碱性,萃取剂碱性越 强越有利于萃取,其次序:取代酰胺>酮>醇>醚
烊盐萃取要在高酸度条件下进行 胺盐萃取
主要萃取剂有伯、仲、叔胺以及季胺盐。 注:除了阴离子交换机理外,还存在一种所谓的加合反应
机理。
1.4.3 用阳离子交换萃取剂进行的萃取
用有机酸及其盐以及螯合剂对金属阳离子进行萃取 的过程,被萃取的金属阳离子交换萃取剂中的阳离子 (H+)的过程发生在相同的界面上,所以萃取机理属于 相间阳离子交换。
第十二章 溶剂萃取和离子交换
第十二章 (一)溶剂萃取
(二)离子交换
(一)溶剂萃取
1.1 溶剂萃取
有色冶金原理第三章-氧化物的还原

5
→在标准状态下,在氧势图(或氯势图等) 中位置低于MeA的元素才能作为还原剂 将MeA还原。
→在标准状态下,MeA的分解压必须大于 MeX的分解压,即: PA(MeA) > PA(XA)
6
2、在非标准状态下还原反应进行的热力学条件
ቤተ መጻሕፍቲ ባይዱ
2CO(g) + O2(g) = CO2(g)
△rGθ(3-3) = -564840 + 173.64T J·mol-1
△rHθ298(3-2) = -565400
J·mol-1
(反应3-3) (式3-3)
15
(3)碳的完全燃烧反应
C(s) + O2(g) = CO2(g)
△rGθ(3-4) = -394133 - 0.84T J·mol-1
△rHθ298(3-8) = 90031
J·mol-1
(式3-9)
H2O+C = H2+CO △rGθ(3-9) = 140248 - 146.36T
△rHθ298(3-9) = 13153
J·mol-1 J·mol-1
(反应3-9) (式3-10)
34
四、燃烧反应气相平衡成分计算
多组份同时平衡气相成分计算的一般途径 平衡组分的分压之和等于总压,即ΣPi=P总。 根据同时平衡原理,各组分都处于平衡状态。
500 -445241 46.50
1000 -386561 20.189
1500 -327881 11.41
2000 -26920 7.02
29
在通常的冶炼温度范围内,氢的燃烧反应进行得十分完全, 平衡时氧的分压可忽略不计。
有色冶金原理第三章-氧化物的还原

碳的完全燃烧反应:△Gθ<<0
碳的不完全燃烧反应:△Gθ<<0
19
2、布多尔反应(C-O系优势区图) 该反应3-2体系的自由度为:f=c-p+2=2-2+2=2 →在影响反应平衡的变量(温度、总压、气相组成)中,
有两个是独立变量。
反应3-2为吸热反应,随着温度升高,其平衡常数增 大,有,利于反应向生成CO的方向迁移。 →在总压P总一定的条件下,气相CO%增加。 在C-O系优势区图中,平衡曲线将坐标平面划分为二 个区域: I——CO部分分解区(即碳的稳定区)
5
→在标准状态下,在氧势图(或氯势图等)
中位置低于MeA的元素才能作为还原剂
将MeA还原。 →在标准状态下,MeA的分解压必须大于 MeX的分解压,即: PA(MeA) > PA(XA)
6
2、在非标准状态下还原反应进行的热力学条件 1)降低生成物活度aXA、aMe 当生成物XA不是纯物质,而是处于某种溶液(熔体) 中或形成另一复杂化合物时,其活度小于1,对反应
金属元素在自然界很少以单质形态存在 有色金属矿物大多数是硫化物或氧化物 炼铁所用矿物及很多冶金中间产品主要是氧化物 形态
钛、锆、铅等金属的冶金中间产品为氯化物
还原反应在从这些矿物提取金属的过程中起着重 要作用 还原过程实例: 高炉炼铁、锡冶金、铅冶金、火法炼锌、钨冶 金……/钛冶金……
△rGθ(3-7) = -30459.1+28.14T J· mol-1 △rHθ298(3-7) = -41120 反应3-7为放热反应。 J· mol-1
(反应3-7)
(式3-7)
反应3-7的 △rGθ值为CO燃烧反应与氢燃烧反应之差。
有色冶金原理(傅崇说版)部分课后习题解答 3

第三章习题与思考题1.求碳的气化反应(布多尔反应)在 1173K,总压为 3× 101325Pa 时气相中CO 的平衡浓度。
已知:CO2+C=2CO,ΔG θ =170707.2-174.47T,J2.某容器内充满 1300K的CO2+CO+O2 混合气体和NiO, 问应控制氧气分压多大,NiO 才能够被还原为Ni2CO+O2=2CO2, ΔG θ =-564840+173.64T,J2Ni+O2=2NiO, ΔG θ =-468189.6+169.79T,J3.直径为20mm,密度3.25g·cm- 3 的铁矾精矿球团在 1123K 用CO 还原, 通过减重法测得还原度R与还原时间的关 系为:时间(t), min 10 20 30 40 50 60 70R,% 12 23 32 40 46 52 59(1)用作图法判断还原反应的限制环节。
(2)还原气体的浓度为1mol,求反应的速度常数。
解答:1.解: 2 100 %[] 24 P P P K K CO K P P =-++× 总 总 (P 48)logKp= 173 . 1 112315 . 19 1173 473 . 174 2 . 170707 = ´ ´ + - Kp=33.48%CO= 10100 3 48 . 33 4 48 . 33 2 48 . 33 2 ú ú û ù ê ê ë é ´ + + - =92.4 2.解: 2CO+O 2=2CO 2, ΔG θ =-564840+173.64T,J (1) (P 50)-)2Ni+O 2=2NiO, ΔG θ=-468189.6+169.79T,J (2)2NiO+2CO=2Ni+2CO 2, ΔG θ =-96650.4+3.85 T,J (3) 22 3 ln ln ÷ ÷ ø ö ç ç è æ - = - = D CO CO P P RT Kp RT G q 22 ÷ ÷ øö ç ç è æ CO CO P P =4813.82 2CO+O 2=2CO 2, ΔG θ =-564840+173.64T,J ΔG 1 θ =-564840+173.64T= 22 ln ÷ ÷ ø ö ç ç è æ - CO CO P P RT 2 1 O P × 564840+173.64×1300=-8.314×1300ln4813.82 21 O P ×P O2`=1.14×10 -5 ×101325=1.15×10 -5 Pa 3.解:(1)判断(P 66) ( ) [ ] 3 1 1 1 R - - 、 ( ) ú û ù ê ë é - - - 3 2 1 3 21 R R 与t 是否成 直线对应,动力学区、控散区。
有色冶金原理第八章溶剂萃取和离子交换课件

锌的溶剂萃取
总结词
锌的溶剂萃取是一种有效的锌提取方法,通过选择合适的萃取剂将锌离子从碱性 溶液中萃取出来,实现锌的分离和富集。
详细描述
锌的溶剂萃取通常在碱性条件下进行,常用的萃取剂有羧酸类、酚类和胺类等。 萃取过程中,锌离子与萃取剂发生反应生成可溶性的配合物,从而实现锌的分离 。经过反萃取后,锌离子被还原成金属锌,可用于制备锌锭或锌合金。
03 溶剂萃取在有色冶金中的 应用
铜的溶剂萃取
总结词
铜的溶Байду номын сангаас萃取是一种常用的铜提取方法,通过选择合适的萃取剂将铜离子从酸性溶液中萃取出来,实现铜的分离 和富集。
详细描述
铜的溶剂萃取通常在酸性条件下进行,常用的萃取剂有胺类、磷类和硫代磷类等。萃取过程中,铜离子与萃取剂 发生反应生成可溶性的配合物,从而实现铜的分离。经过反萃取后,铜离子被还原成金属铜,可用于制备电解铜 或铜合金。
离子交换动力学是研究离子交换反应速率和反应 机制的学科,对于优化分离过程和提高分离效率 具有重要意义。
2
离子交换反应速率受到多种因素的影响,如离子 交换剂的性质、溶液的组成和浓度、温度和压力 等。
3
通过研究离子交换动力学,可以了解反应速率与 各影响因素之间的关系,从而为实际应用提供理 论依据和指导。
离子交换技术发展趋势
研究新型离子交换剂,提高离子选择性和吸附容量;开发复合离子交换剂,提 高对特定离子的吸附效果;研究离子交换过程中的动力学机制,优化离子交换 过程。
THANKS FOR WATCHING
感谢您的观看
应用条件与范围选择
溶剂萃取技术适用于处理大量溶液, 尤其是对特定离子的选择性要求较高 的场合,如重金属离子分离、放射性 元素分离等。
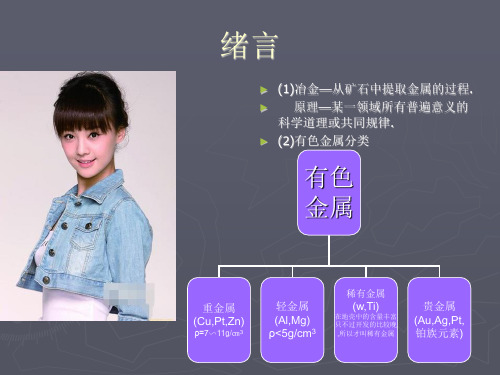
有色金属冶金概论(完整资料).doc

此文档下载后即可编辑课程教学大纲课程名称:有色金属冶金概论课程名称:Introduction to Metallurgy of Non-Ferrous Metals课程号:061899课程类型:专业课学时:36学时适用对象:冶金工程专业本科生先修课程:《冶金化工过程与设备》、《冶金热力学及动力学》、《冶金传输原理》。
一、课程的性质、目的与任务本课程是冶金工程专业本科生的专业课,为限选课;目的是使钢铁冶金专业方向的学生扩大专业面,以适应市场经济的需要。
本课程的讲授完成如下任务:了解常用有色金属的性质和用途;掌握常用有色金属冶金的主要原理、主要生产工艺。
二、课程的内容及学时分配:第一部分:绪论(建议学时数:2学时)本部分的学习目的和要求:本部分首先从课程的性质引入,讲解有色金属的分类及各种金属的所属类别,介绍有色金属提取过程的特点,对有色金属的提取方法进行归纳性总结。
通过本部分的学习,应了解各种有色金属所属的类型,熟悉有色金属的分类依据,掌握有色金属提取过程的特点。
本部分的教学内容:有色金属提取过程的特点;有色金属的提取方法。
本部分的重点和难点:有色金属提取过程的特点。
第二部分:铜冶金(建议学时数:10学时,其中包括讨论课2学时)本部分的学习目的和要求:通过对本部分的学习,学生应了解湿法炼铜的工艺;熟悉连续炼铜的工艺、基本原理;对比钢铁冶金流程,掌握火法炼铜的工艺流程及各主要单元过程的基本原理。
本部分的教学内容:本部分从铜及其主要化合物的性质、用途入手,讲授炼铜的原料,火法炼铜、湿法炼铜工艺流程、基本原理。
在火法炼铜部分,主要讲授硫化铜精矿的硫酸化焙烧和氧化焙烧的工艺、基本原理;讲授造锍熔炼的基本原理;讲授冰铜吹炼、粗铜的火法精炼、电解精炼的工艺、基本原理;讲授连续炼铜的工艺、基本原理。
简单介绍湿法炼铜部分。
本部分的重点和难点:硫化铜精矿的硫酸化焙烧和氧化焙烧的工艺、基本原理;造锍熔炼的基本原理;冰铜吹炼、粗铜的火法精炼、电解精炼的工艺、基本原理。
有色冶金原理第八章溶剂萃取和离子交换

(1)物质在水相和有机相内部以及经两相界面通过 的传质速度。
(2)在每一个相内或在相间界面上进行化学反应的 速度。
PPT文档演模板
有色冶金原理第八章溶剂萃取和离子 交换
•萃取后的水相
•传质方向 •萃取后的有机相
•R——萃余液 •E——萃合液
•分界面 PPT文档演模板•图12-2 在水相和有机相界面上进行扩散和多相化学有色反冶应金原时理浓第八交度章换分溶剂配萃示取和意离图子
PPT文档演模板
有色冶金原理第八章溶剂萃取和离子 交换
2.5 离子交换的动力学
树脂和溶液中的离子交互反应,包括如下5个步骤:
(1)溶液中的例子向树脂表面扩散,通过围绕树脂表面的 液体薄膜交界层,达到树脂表面;
(2)到达树脂表面的离子进入树脂的交联网孔中,在树脂 颗粒内部扩散;
(3)扩散进入树脂颗粒内部的离子与树脂中可交换离子 (功能基的可离解离子)发生交换反应;
根据原液的特点,合理选择使用萃取剂和稀释剂是 溶剂萃取成败的关键。
萃取剂:是指能与被萃取物(金属离子)相结合, 并使被萃取物转入有机相的试剂。
理想的萃取剂满足:
有选择性,即较高的分离系数;
高的萃取容量;
在萃合液反萃后易于再生;
易于水相分离;
操作安全;
PPT文档演模板
价廉。
有色冶金原理第八章溶剂萃取和离子 交换
控制,而在低浓度时受外部扩散的控制。
PPT文档演模板
有色冶金原理第八章溶剂萃取和离子 交换
例1:从含铀的氯化物溶液中用三辛基氧膦(TOPO)萃取铀 被认为是一种有希望的方法。今对含铀浓度为0.65g·L-1的 氯化浸出液用5%TOPO的煤油溶液进行萃取试验,如下:
有色冶金原理溶剂萃取和离子交换

E
被萃物在有机相中的量 被萃物的原始总量
100
c有V有 c有V有 c水V水
100
D 100 D V水 V有
例题1
分配比越大,萃取率越高;V水/V有越小,则萃取率越 高,萃取剂萃取金属离子的能力越强。
分离系数: 等于溶质1和溶质2的分配比D1和D2的比值
D1 D2
水
,G
0
①中性萃取剂,这是一类有机化合物,其分子能与被萃取的溶质形成
电子-活化中心型的配位键,这种键比水分子键更牢固。
②各种有机碱及其盐或者是各种有机酸及其盐,能与水溶液接触时发
生萃取分子中的无机阴离子或阳离子和水溶液中的同名离子之间的 离子交换过程。
1.4.1 中性萃取剂:
代表者:酮,醇,醚 ,中性的焓磷、含硫和含氮的有 机化合物。
利用离子交换树脂可解决下列问题:
优先提取贫溶液中的金属并得到被提取金属更富集的溶 液(例如从铀矿浸出液中提取铀;从处理含金矿的碱性溶 液中提取金;从冶金废弃溶液中提取一系列有色和稀有金 属);
分离性质相似的元素:稀土元素,Zr和Hf以及其他;
制取高纯度软化水; 各种生产溶液的净化除杂质。 例题3
2.2 离子交换树脂
实际应用中,要求 ≥2 。
例题2
1.3 萃取剂、稀释剂及盐析剂
根据原液的特点,合理选择使用萃取剂和稀释剂是溶剂 萃取成败的关键。
萃取剂:是指能与被萃取物(金属离子)相结合,并使 被萃取物转入有机相的试剂。
理想的萃取剂满足: 有选择性,即较高的分离系数;
高的萃取容量; 在萃合液反萃后易于再生; 易于水相分离; 操作安全; 价廉。
树脂进行离子交换的能力,与活性基的离解程度有关。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C、镁与氢发生反应生成氢化镁,被用于储氢合金的开发(Mg2Ni) D、与TiCl4反应:金属钛生产的方法
E、腐蚀性:(1)化学腐蚀:耐碱(PH>10.2)、不耐酸(低浓度 和高温的氢氟酸除外)
(2)土壤腐蚀:耐粘土腐蚀,有氯化物时腐蚀厉害
特点:可作为原料的天然矿物资源种类多,分布广,易获得; 可利用电、油、天然气等多种能源进行生产; 工艺过程简单,投资少,建厂速度快; 生产过程不产生有毒废弃物,对环境污染小。
缺点:产能低,机械化程度差,所用还原剂价格贵。
在国外,电解法镁产量占镁的总产量约80%
在国内,则是热法占主导地位,占了97%。
有色冶金原理
5
2.1.3 Raw Materials and Production Processes
1、Raw Materials
有色冶金原理
6
2、Production Processes
It is possible to divide the magnesium production technologies into two main types:
有色冶金原理
9
热还原法:1913年开始研究,1924年由安吉平等(俄国)完 成。1941年Pidgeom(皮江,加拿大)建立了硅铁还原白云 石的试验厂并获得成功,称为皮江法炼镁。随后,加拿大政府 在安大略白云石矿附近采用皮江法建厂,1942年投产。
1947年 法国开始研究连续生产的硅热法,1959年第一 台熔渣导电半连续还原炉投产,1964年开始工业生产。
金属镁无磁性,有较强的韧性、延展性,有良好的导电、 导热性、阻尼性、减振性、切削加工性 。其减振性能、磁 屏蔽性能远优于铝合金。
镁合金的比强度高于铝合金和钢 ,比刚度与铝合金和钢相 当,耐磨性能优于低碳钢和压铸铝合金 。
有色冶金原理
3
镁的化学性质
A、与氧的亲和力大,其表面易被空气氧化;镁在其熔 点以上易 在空气中燃烧,发出眩目的白光。
有色冶金原理
13
1 菱镁矿煅烧生产氧化镁 对于煅烧所用的矿石,要求其中的MgO>45%,
SiO2<1.2%,CaO<1.5%。 菱镁矿煅烧的实质是碳酸盐的分解:
碳酸镁分解反应自由能及分解压与温度关系:
用于生产氯化镁时,煅烧温度一般不超过
800℃,此时得出的氧化镁化学活性较好,
有利氯化反应
有色冶金原理
(3)电化学腐蚀:牺牲阳极
有色冶金原理
4
镁的用途
金属镁无磁性,抗冲击而不产生火花,具有良好 的导热、散热性能,不易破裂,可以通过阳极氧化、 染色,抗疲劳强度和减震性能较好。
镁合金单位质量的机械强度大,消震性能好,易 于切削加工,且造价低廉。
镁和镁合金成为现代汽车、电子、通信等行业的 首选材料,被誉为“21世纪的绿色工程材料”。
有色金属冶金学
Non-ferrous Metallurgy
Magnesium Metallurgy 镁冶金(一)
有色冶金原理
1
2.1 概述(Introduction)
1808年 英国医生Davy从利泻盐(MgSO4)中制备镁汞齐 1828 Brutus和A.Bussy 钾蒸气还原融熔氯化镁制取纯镁 1833 Faraday 电解融熔氯化镁 镁的工业生产,开始于1853年——化学家Bunsem在磁坩埚中 电解无水氯化镁生产出纯镁和氯气 1886年德国Bremen市郊建厂,采用电解无水光卤石 1907年德国法兰克福电化学公司大规模生产Mg-Al、Mg-Zn, 扩大了镁在航空、汽车的应用; 1919年道屋化学公司(美国)采用含水氯化镁经脱水然后电 解 1923年I.G.染料公司(德国)用菱镁矿加碳氯化然后电解法 十九世纪初,电解熔融氯化镁具有工业规模,使得镁成为工业金 属
(1) 氯化镁熔盐电解法(Electrochemical methods):包括氯化镁的生产和电解 制镁两大过程。根据氯化镁制取工艺的 不同,可分为DOW工艺、I. G. Farben 工艺、Magnola工艺等。有色冶金原理7有色冶金原理
8
(2) 热还原法(Thermal Reduction Methods):利用某种还 原剂从含镁化合物中还原制得金属镁。根据还原剂的不同, 又分为硅热法(如皮江法)、碳化物热还原法和碳热法。
碳热还原:30~40年代进行过,二战期间美、英曾生产,但中 间产品——镁粉易燃、易爆,1947年停产,至今未采用。
中国:
旧中国没有镁工业,日本侵占东北时期建立过电解法镁厂、 碳化钙还原镁厂,1943年-1945年共产镁700吨,主要运往日 本,战后设备全部破坏。
“一五”期间,苏联援建菱镁矿氯化、电解工艺,1957年 投产(抚顺)。60~70年代曾开展卤水脱水、电解、小型硅热 还原试验。1980年前后全部停产(规模小、工艺设备不完善)
20世纪60年代,法国发明半连续热还原法。
我国从上世纪50年代开始镁工业生产。
有色冶金原理
2
2.1.2 镁的性质和用途
纯镁是银白色的金属,硬度小。熔点650℃。沸点1107℃。 密度1.74g/cm3,只有铝的2/3、钛的2/5、钢的1/4;镁合金比 铝合金轻36%、比锌合金轻73%、比钢轻77%。
镁 (4)氧化镁氯化法(中国)——氧化镁
有色冶金原理
12
氧化镁的生产及其氯化
氧化镁既可用于制取电解炼镁所需的无水氯化 镁,又可用于热还原法直接生产金属镁。作为 炼镁用的氧化镁,要求具有较高的纯度及良好 的化学活性;而对于热还原的氧化镁,还要求 能充分排出其所含的H2O和CO2。 目前,生产氧化镁的主要方法是菱镁矿煅烧法 和氢氧化镁法。
有色冶金原理
10
有色冶金原理
11
2.2 Magnesium Electrolysis
2.2.1 Preparation of Magnesium Chloride Salts from Natural Raw Materials
(1)DOW Process(美国)——海水 (2)Amax Process(美国)——盐湖水 (3)Norsk Hydro Process(挪威)—氯化
