【中学思维导图】图解人教版高中化学选修3物质结构与性质
高中化学选修三-物质结构与性质-全套课件

b.电子云扩展程度
同类电子云能层序数n越大,电子能量越 大,活动范围越大电子云越向外扩张
2、原子轨道
①定义
电子在原子核外的一个空间运动状态
②原子轨道与能级
ns能级 ns轨道
npx轨道 简
np能级 npy轨道 npz轨道
并 轨 道
nd能级
ndz2轨道
ndx2—y2轨道
从K至Q ,能层离核越远,能层能量越大 每层最多容纳电子的数量:2n2
2、能级
同一个能层中电子的能量相同的电子亚层
能级名称:s、p、d、f、g、h…… 能级符号:ns、np、nd、nf…… n代表能层 最多容纳电子的数量 s:2 p:6 d:10 f:14
能层: 一 二
三
KL
M
四…… N ……
能级: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
全满规则 半满规则
四、电子云与原子轨道
1、电子云 以量子力学为基础
①电子云 处于一定空间运动状态的电子在原子核外空间 的概率密度分布的形象化描述
小黑点:概率密度 单位体积内出现的概率 小黑点越密概率密度越大
小黑点不是电子!
②电子云轮廓图 电子出现的概率约为90%的空间 即精简版电子云
③电子云轮廓图特点 a.形状 ns能级的电子云轮廓图:球形 np能级的电子云轮廓图:双纺锤形
2s
2p
F ↑↓ ↑ ↓ ↑ ↓ ↑
原子结构的表示方法 原子结构示意图
电子排布式 O原子:1s2 2s2 2p4
电子排布图
1s2 2s2
2p4
O原子
六、能量最低原理、基态与激发态、光谱
1、能量最低原理
人教版高中化学选修3 物质结构与性质 第三章 第三节 金属晶体(第2课时)

2014年7月30日星期三
11
金属晶体的原子堆积模型
三维空间里非密置层的 金属原子的堆积方式
(1) 第二层小球的球心 正对着 第一层小球的球心
2014年7月30日星期三
(2) 第二层小球的球心 正对着 第一层小球形成的空穴
12
金属晶体的原子堆积模型
(1)简单立方堆积
Po
简 单 立 方 晶 胞
2014年7月30日星期三 13
金属晶体的原子堆积模型
石墨是层状结构的混合型晶体
2014年7月30日星期三
41
金属晶体的原子堆积模型
思考题
(1)六方紧密堆积的晶胞中: 金属原子的半径r与六棱柱的边长a、高h有什么 关系? (2)面心立方紧密堆积的晶胞中: 金属原子的半径r与正方体的边长a有什么关系?
2014年7月30日星期三
42
( 1) ABAB… 堆积方式
2014年7月30日星期三
( 2) ABCABC… 堆积方式
25
金属晶体的原子堆积模型
俯视图
1 6 2 3 4
1 6
2
3 4
5
5
A
B
第二层小球的球心对准第一层的 1、3、5 位 (▽)或对准 2、4、6 位(△)。 关键是第三层,对第一、二层来说,第三层可 以有两种最紧密的堆积方式。
上下层各4
6 7 2 3
2014年7月30日星期三
19
金属晶体的原子堆积模型
②金属原子半径 r 与正方体边长 a 的关系:
b a
a a
2a
a
2a
b = 3a b = 4 r 3a=4r
2014年7月30日星期三 20
金属晶体的原子堆积模型
人教版高中化学选修3 物质结构与性质 第一章 第一节 原子结构(第1课时)

K
L
M
N
O
1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p …
2
2
2
8
6
2
6 10 2
18
6 10 14 2
32
6 …
…
2014年7月12日星期六
23
能层与能级
【学与问】1.原子核外电子的每一个能层最多可容纳 的电子数与能层的序数(n)间存在什么关系?
能层最多可容纳的电子数为2n2个。
2014年7月12日星期六 9
开天辟地—原子的诞生
汤姆生原子模型
汤姆生
2014年7月12日星期六
10
开天辟地—原子的诞生
α粒子散射实验(1909年) ——原子有核 卢 卢瑟福和他的助手做了著名 瑟 α粒子散射实验。根据实验, 卢瑟福在1911年提出原子有 福 核模型。 原 卢瑟福原子模型(又称行星 子 原子模型):原子是由居于 模 原子中心的带正电的原子核 和核外带负电的电子构成。 型 原子核的质量几乎等于原子
2014年母相同的不同能级中所容纳 的最多电子数是否相同?
不同能级中的s级,所容纳的电子数 是相同的,但是能量是不同的。
2014年7月12日星期六 26
能层与能级
总结:
①能层的能级数等于该能层序数。 ②任一能层的能级总是从s能级开始。 ③在每一能层中,能级符号与能量大小的顺序是: ns<np<nd<nf…
新课标人教版高中化学课件系列
选修3 物质结构与性质 第一章 原子结构与性质
第一节 原子结构 第1课时
2014年7月12日星期六
1
原子结构
【教学目标】
1.了解人类认识原子的历史
人教版高中化学选修3 物质结构与性质 第二章 第三节 分子的性质(第1课时)

键的极性和分子的极性
O
C
O
F1
F合=0
F2
180º
2014年7月23日星期三
C=O键是极性键, 但从分子总体而言 CO2是直线型分子, 两个C=O键是对称 排列的,两键的极 性互相抵消( F合 =0),∴整个分子 没有极性,电荷分 布均匀,是非极性 分子
11
键的极性和分子的极性
(正电中心与负电中心不重合)
2014年7月23日星期三
7
键的极性和分子的极性
Cl
Cl
Cl
Cl
共用电子对
Cl2分子中,共用电子对不偏向,Cl原子 都不显电性,为非极性分子 ∴以非极性键结合的分子均为非极性分子
2014年7月பைடு நூலகம்3日星期三 8
键的极性和分子的极性
δ+ H Cl
δ-
H
Cl
共用电子对 HCl分子中,共用电子对偏向Cl原子, ∴Cl原子一端相对地显负电性,H原子 一端相对地显正电性,整个分子的电荷 分布不均匀,∴为极性分子 ∴以极性键结合的双原子分子为极性分子
同种非金属元素原子间形 成的共价键是非极性键 不同种非金属元素原子间形 成的共价键是极性键
2014年7月23日星期三
4
键的极性和分子的极性
指出下列物质中的共价键类型
1、O2
2 、CH4
非极性键
极性键 极性键 (H-O-O-H) 极性键 非极性键 非极性键 极性键
5
3 、CO2
4、 H2O2 5 、Na2O2
2014年7月23日星期三 9
键的极性和分子的极性
思考
含有极性键的分子一定
是极性分子吗? 分析方法:物理模型法
高中化学思维导图

高中化学第二章化学物质及其变化策一节物魔的组成、性质和分类广阙壹异形偉1凰袄旰竺乌歼晶体叫�✓� 哎元正竺叶;日已畿干竺·干昌体l知能提升叫/""'』T化仑物构戌高子竺屯真于晶体、--v,、-、.,、--v---'安戎俜度岭戎角度知道分子.颠干、寞子、元聿等概念的含义及褒示方湛知道物澄宣化.化学查化和喇珊性质`化半性匮正确地对无机恤进行分类,尤其毓分辨碱.喊,丛、氧化物釴从不阳的角度区分化学反应炎型区分溶液.湟液.胶体,了解胶体的性赋判断闯位景、何晕凳形体、阿分异构体`阿系柳熟记井正碱书写常见元鬻的名称和符号正檐书写常见的电干式,结构示宣团.化掌式、分子式,结构式和结构荀式廷斛化合价的概念和颠则.榷娥化合价正确书写化学式或攘鸯化学式求出化合价知谱际.守恒定律的含义。
正噙书写化学方栈式、热化学方槐式,寓子方程式、电韬反应式高中化学第二章化学物质及其变化第二节寓子反应2电解撰和非龟鳞质均为化合物、单厥和漫合辏既不是电赋咧也不是非电航质3俸一些準濬性盐晶然在水中涫斛瘦不大.但涫于水的全却电寓,所以是强电解咦4电觥厚漕渭的马电性猩码由白由移功的寓千的电倩益和坟霆决定,与电鹹质的道砚无关知识缺陷.如:滇漕.有色”与飞量渭-.不械掌■物质的溶滇性.擒展阔的化孛反应审题不编.如:忽略了噩设的限劓篆件挖峰不力如:溶潦的黯碱性一整胄干具青惺篡化性思戴不全.如复杂问陋需夷定性和定量绩合酌擅是化合笥,其次在木滚液或饿酗状芯熊否弄电恩蝶髯侧伴惊学化学04,撞酗`遠咧、大多数盐,水溶液中完全龟高1霸臻`蜗碱、少数盐,水滚液中沉分龟寓湾质被濡爆糟威急蝗尽赃伸你学化掌OO常见可生咸沉池的霞千阳了工三已邓归,.•• 噜窃一.义寸、S心:·.PO只so:-a-.o, 飞,·.,�、O il二0才、汉牙c,'噜'f古、M,i'l s只OH气col飞虹。
人教版高中化学选修3 物质结构与性质 第一章 第一节 原子结构(第1课时)精品PPT课件

开天辟地—原子的诞生
质子(正电) 原子核 原子 (正电) 中子(不带电) 不显 电性 核外电子 分层排布 (负电) 与物质化学性质密切相关
2020/10/26
18
能层与能级
二、能层与能级
(1)能层
在多电子的原子核外电子的能量是不同的, 按电子的能量差异,可以将核外电子分成不 同的能层。
2020/10/26
开天辟地—原子的诞生
问题:宇宙大爆炸是怎么回事?物质是由原子构成的,那 么原子是怎样诞生的呢? P4
1932年勒梅特首次提出了现代大爆炸宇宙理论
宇宙大爆炸
2h后 诞生
大量的氢 大量的氦 极少量的锂
原子核的 熔合反应
合成
其他元素
2020/10/26
4
开天辟地—原子的诞生
一、开天辟地—原子的诞生
思考与交流 阅读课本P4
2020/10/26
5
开天辟地—原子的诞生
人类认识原子的过程
人类在认识自然的过 程中,经历了无数的艰 辛,正是因为有了无数 的探索者,才使人类对 事物的认识一步步地走 向深入,也越来越接近 事物的本质。随着现代 科学技术的发展,我们 现在所学习的科学理论, 还会随着人类对客观事 物的认识而不断地深入 和发展。
19
能层与能级
核外电子分层排布
依据核外电子的能量不同:
离核远近:近
远
能量高低:低
高
1
2
3
4
5
6
7
K
L
M
N
O
P
Q
2020/10/26
20
能层与能级
原子核外电子分层排布规律:
(1)各能层最多能容纳2n2个电子。
人教版高中化学选修3 物质结构与性质 第二章 第三节 分子的性质(第2课时).ppt

范德华力大小: CI4> CCl4 >CF4 >CH4
2014年7月24日星期四
8
范德华力及其对物质性质的影响
练习: 下列变化过程只是克服了范德华力 的是( C )
A、食盐的熔化
B、水的分解
C、碘单质的升华 D、金属钠的熔化
2014年7月24日星期四
9
氢键及其对物质性质的影响
沸点/℃100
75 50 25 0 -25 -50 -75 -100 -125 -150 CH 4 NH3 HF
新课标人教版高中化学课件系列
选修3 物质结构与性质 第二章 分子结构与性质
第三节 分子的性质 第2课时
2014年7月24日星期四
1
范德华力及其对物质性质的影响
我们知道:分子内部原子间存在 相互作用——化学键,形成或破坏 化学键都伴随着能量变化。 物质三相之间的转化也伴随着能 量变化。这说明:分子间也存在着 相互作用力。
液态水中的氢键
2014年7月24日星期四
22
氢键及其对物质性质的影响
2014年7月24日星期四
23
氢键及其对物质性质的影响
2014年7月24日星期四
24
氢键及其对物质性质的影响
练习:
下列关于氢键的说法中正确的是( C ) A. 每个水分子内含有两个氢键
B. 在所有的水蒸气、水、冰中都含有氢键 C. 分子间能形成氢键,使物质的熔沸点升高 D. HF稳定性很强,是因为其分子间能形成氢键
2014年7月24日星期四
6
范德华力及其对物质性质的影响
思考:
分子间 将干冰气化,破坏了CO2分子晶体的作用力 —————
共价键 将CO2气体溶于水,破坏了CO2分子的————
人教版高中化学选修3 物质结构与性质 第二章 第二节 分子的立体构型(第1课时)

2014年7月20日星期日
21
价层电子对互斥理论
ABn 型分子的VSEPR模型和立体结构
电子对数 目 电子对的空 间构型 成键电子 对数 孤电子 对数 电子对的 排列方式 分子的 空间构型 实 例
2
直线
2
0
直 线形
BeCl2 CO2
3 3 三角型 2
0
三角形
BF3 SO3
1
V形
SnBr2 PbCl2
2014年7月20日星期日 17
价层电子对互斥理论
化学式 HCN SO2 NH2- BF3 H 3O + SiCl4 CHCl3 NH4+ SO42-
2014年7月20日星期日
价层电子对数 结合的原子数 孤对电子对数
2 3 4 3 4 4 4 4 4
2 2
0 1
2 3 3 4 4 4 4
2
0 1 0 0 0 0
1 0 0 0
2 2 2 3 3
4 4 4
直线形 V形 V形 平面三角形 三角锥形 正四面体 四面体 正四面体
26
2014年7月20日星期日
价层电子对互斥理论
1、下列物质中分子立体结构与水分子相似的是 A.CO2 B.H2S B C.PCl3 D.SiCl4 2、下列分子立体结构其中属于直线型分子的是 A.H2O B.CO2 BC C.C2H2 D.P4 3、下列分子立体结构其中属正八面体型分子的 A.H3O + B.CO32— D C.PCl5 D.SF6
新课标人教版高中化学课件系列
选修3 物质结构与性质 第二章 分子结构与性质
第二节 分子的立体构型 第1课时
2014年7月20日星期日
1
高中化学思维导图

核外电于
l各层电子数 电子扫怖阶层排布)一·电子层 (K、L M、N..)
」←→原子结构示意图
质 子数=核电而数=核外电子数 =原子序数 质 量数(A) =质子数(Z) +中于数(NJ 元素的相对尿子质(同位东相对原子质量x同位素原子个数百分比)
L』且且歪曲,离叫子键 ;通过静电作用
一一于。化, 合H 物,,_一→ 离〔于晶体
t 化 平川 方 式 程
遵守质n守恒元律 且
湛卢氧化还原规律
寸
「强电解质的电离 电离方程式→」弱电解质的电离
离子方程式 ---l「禹F反应的实质
」离子方程式的书写 「与化学方程式的本质区别
热化学方释式→ 」热化学方程式的书写
「一 电解的电极反应 电极反应式-I」-电池的电极反应 电解总方程式
溶液浓度(mol L一I )
机 卜煌的衍生物卤代虹、醇、酣、薛、接酸、酣等
化一卡-榕.单街、一糖、多棺
合 卡-蛋自质氨基酸、_:Ji!;、多肤 物 」合成高分子化合物。聚乙:怡、酣自主树脂、聚酣纤维等
�世丁寓草E古兰兰碱在E氧化物
生告碱
之
坠Z主
纵向关 系一斗
」非金属单原-�酸忡氧化物旦旦酸盟+盐
芳查常以元素及其化合物知识为载体。 付1 一是化学的重要理论知识,是学习元素及其化合物的指导’性基础理论D
平衡移动原现→f- 温度:升高说度,平衡|句吸热方向移动;降低温度,半衡向放热方向移动
」 催化l'fiJ:对化学平衡状态无影响
.
在一定温度下,骂 一个可逆反威达到化学平衡时,生成物浓度慕之积
概念J一与反应物浓度辛苦之积的比值是 一个常数 ,这个常数称平衡常数。
当可逆反应:mA(g)+曲(g)守主庐(cg问D(g)在一定温度达到
高中化学选修3:物质结构与性质-知识点总结

选修三物质结构与性质总结一.原子结构与性质.1、认识原子核外电子运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义.电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图.离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小.电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子层.原子由里向外对应的电子层符号分别为K、L、M、N、O、P、Q.原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7.2.(构造原理)了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示1~36号元素原子核外电子的排布.(1).原子核外电子的运动特征可以用电子层、原子轨道(亚层)和自旋方向来进行描述.在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子.(2).原子核外电子排布原理.①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道.②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子.③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同.洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d54s1、29Cu [Ar]3d104s1.(3).掌握能级交错1-36号元素的核外电子排布式.ns<(n-2)f<(n-1)d<np3.元素电离能和元素电负性第一电离能:气态电中性基态原子失去1个电子,转化为气态基态正离子所需要的能量叫做第一电离能。
常用符号I1表示,单位为kJ/mol。
人教版高中化学选修3 物质结构与性质 第一章 第一节 原子结构(第4课时)

电子云与原子轨道
电子云轮廓图——原子轨道
S能级的原子轨道是球形对称的.
2014年7月15日星期二 8
电子云与原子轨道
原子轨道
电子云形状
①s电子云呈球形,在半径相同的球面上, 电子出现的机会相同; ②p电子云呈哑铃形 (或纺锤形); ③d电子云是花瓣形;
④f电子云更为复杂。
2014年7月15日星期二 22
泡利原理和洪特规则
2014年7月15日星期二
23
泡利原理和洪特规则
练习:写出 24Cr
29Cu
电子排布式
22s22p63s23p63d54s1 Cr 1s 24
22s22p63s23p63d104s1 Cu 1s 29
洪特规则特例:
2014年7月15日星期二
24
泡利原理和洪特规则
Li: 1s22s1
泡利原理和洪特规则
科学探 究
观察下图,这些图称为原子的 电子排布图。
2.当电子排在同一个能级内时,有什么规律?
当电子排布在同一能级的不同轨道时,总是优先单 独占据一个轨道,而且自旋方向相同。---洪特规则
2014年7月15日星期二
20
泡利原理和洪特规则
洪特规则
对于基态原子,电子在能量相同 的轨道上排布时,将尽可能分占不同 的轨道并且自旋方向相同。
小黑点不表示电 子,只表示电子在 这里出现过一次。 小黑点的疏密表示 电子在核外空间内 出现的机会的多少。
电子云只是形象地表示 电子出现在各点的概率高低, 而实际上并不存在。
2014年7月15日星期二
6
电子云与原子轨道
电子轮廓图的制作
常把电子出现的概率约为90%的空间 圈出来,人们把这种电子云轮廓图称为 原子轨道。 P10 最后一段
探索世界把握规律,高中政治,人教版思维导图

探索世界把握规律时代精神精华哲学基本问题联系第一方面的save 是第二saves的前提 基础二对一是深化 展开区别内容第一方面思存本源第二方面思存同一性思维能否正确认识存在地位第一最重要的方面第二基本问题的从属方面意义第一物新only标准 两大阵营第二可不可知论不可知论忽略了社会实践的发展和人类的认识能力的提高基本派别基本观点古代唯物主义否神创说,世界物质近代形而上学唯物主义原子本源辩证唯物主义 历史唯物主义物决意 意对物能动社本质上 客观物体社活本质 物质的常见观点五行,荀子(阴阳),范缜(形神),王夫之(气理)狄德罗,培根物质本质,物决意,意对物反社会存在决社会意识,。
反作用合理性唯物根向,本质正确自科基础 丰展唯物科学的 世界观方法论 无产阶级 思想武器局限性缺少科学依据,把复杂问题简单化机械性,形而上学性,历史观的唯心主义无,这是最好的共同性根本观点上一致的,都承认物质本原,物质第一性意识第二性,物质决定意识探索世界本质认识规律理解含义含义(know)规律是事物运动过程中固有的本质的,必然的,稳定的联系理解(know)固有的规律的客观性本质规律的联系,隐藏在事物现象之间必然的确定不一,必然如此的稳定不多变不易逝note(konw)哲学≠具体规律,共性与个性,一般与个别规律≠规律现象规律客观性∴无好坏之分规律是联系,联系不一定是规律规律有条件的客观规律性 主观能动性 辩证关系辩证关系客观不移,否则惩罚主观能动,能认用规方法论尊客规律 主观能动 基础前提主观能动 认利规律 必要条件反对错误倾向反对夸大意识 能动作用 唯意识主义片面客观 安于现状 无所作为 因循守旧正确发挥主观能动性人能够能懂地认识世界目的性 自觉选择性 能动创造性not only外部现象but also 本质规律人能够能动地改造世界反映客观 指导改造by实践观念变现实 创造目的事物意识能动性受客观规律制约正确意识 符合客观 正确指导 预期目标方法论要求尊重规律 正确发挥 主观能动 正确意识 克服错误把握世界规律世界普遍联系的联系的普遍性 客观性 多样性普遍性原理:anything and otherthing,事物各个部分之间相互联系 世界整体 普遍联系方法论:普遍联系 观点看题既要看到。
初中化学知识思维导图
已知某一反应物计算另一种物质
【分析】图像型计算
【分析】无数据或缺数据型化学方程式计算
质量守恒定律概念 化学方程式的概念及意义
有关化学方程式的计算
考法
质量守恒定律
乳化现象
溶解时的吸热和放热现象 溶解过程中的热量变化
饱和溶液与不饱和溶液概念
溶液概念及组成
溶液及溶解现象
饱和溶液与不饱和溶液转化
固体的溶解度
气体的溶解度
趋势图-平缓和陡升组合
趋势图-陡升和下降组合
趋势图-下降+陡升+平缓组合
趋势图-先升后降 溶解度曲线和溶液综合
溶解度曲线应用
溶解度曲线含义
降温结晶 蒸发结晶
混合物分离方法
溶解度
溶质析出大小比较 状态转换方法选择
动点问题
流程类计算
文字表述型计算
曲线图型计算
实验操作图型计算
溶质质量分数及其计算
酸碱盐间转化关系
pH与溶液酸碱度的关系
溶液酸碱度的表示方法
pH的测定方法
pH曲线
pH曲线变化趋势
根据曲线图判断溶液成分
化学肥料
常用化肥的种类和作用 合理使用化肥和农药
化肥的简易鉴别
考法
微观角度认识化学
质量守恒定律的验证
质量守恒定律的微观解释
质量守恒定律探究实验
解释宏观现象
化学式的推断
元素组成判断
质量守恒定律应用确定反应物或生成物质量
确定物质的相对原子质量
确定化学反应类型
化学方程式配平
化学方程式的书写
根据微观示意图书写方程式
【技巧】含杂质化学方程式的计算
【技巧】差量法计算
【分析】表格型计算
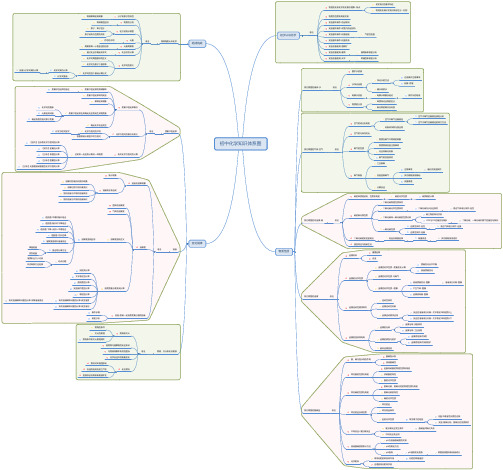
高中化学《选修三 物质结构与性质》知识归纳

《选修三物质结构与性质》知识归纳一、能层与能级1、能层(电子层:n):在多电子原子中,核外电子的能量是不同的,按照电子的能量差异将其分成不同能层。
由里向外,分别用字母:K、L、M、N、O、P、Q表示相应的第一、二、三、四、五、六、七能层。
各能层最多容纳的电子数为2n2;在同一个原子中,离核越近,电子能量越低2、能级:同一能层里的电子的能量也可能不同,又将其分成不同的能级,通常用s、p、d、f等表示,同一能层里,各能级的能量按s、p、d、f的顺序升高,即:E(s)<E(p)<E(d)<E(f)①K层指包含一个能级,即s能级;L层包含两个能级,s和p能级;M层包含三个能级,s、p和d能级;N层包含四个能级,s、p、d、f能级②每个能层中,能级符号的顺序是ns、np、nd、nf……③s、p、d、f……可容纳的电子数依次是1、3、5、7……的两倍④同一能级容纳的电子数相同3、电子云:原子核外电子绕核高速运动是没有确定的轨道的,就好像一团“带负电荷的云雾”笼罩在原子核周围,这种“带负电荷的云雾”称之为电子云。
电子云密集(单位体积内小黑点多)的地方,电子出现的机会多;反之,电子云稀疏(单位体积内小黑点少)的地方,电子出现的机会少。
即电子云表示电子在核外单位体积内出现几率的大小,而非表示核外电子多少4、原子轨道:不同能级上的电子出现概率约为90%的电子云的空间轮廓图称为原子轨道(1)原子轨道的形状①s电子的原子轨道都是球形的,每个s能级各有1个原子轨道,能层序数越大,s原子轨道的半径越大;能量:E1s<E2s<E3s,随着能层序数的增大,电子在离核更远的区域出现的概率减小,电子云越来越向更大的空间扩展②p电子的原子轨道是纺锤形(哑铃形),每个p能级有3个轨道,它们互相垂直,分别以p x、p y、p z为符号。
p原子轨道的平均半径也随能层序数增大而增大③能级与原子轨道数和容纳的电子数的关系能级s(球形)p(纺锤形)d f原子轨道1357容纳的电子数261014二、基态原子的核外电子排布式1、构造原理:多电子的核外电子排布总是按照能量最低原理,由低能级逐步填充到高能级。
化学总复习(1-3单元)思维导图

D
鉴别三种白色固体
实验步骤 实验现象 结论
加水 不溶解 碳酸钙
加盐酸
产生气泡 碳酸钠
物理性质
颜色、状态、共性、个性等, 性质与用途的关系
防锈 措施
铁生锈
纯金属
保护金属 的有效途径
与氧气反应 化学性质
与盐酸、 稀硫酸反应 与盐溶液 反应
铝的耐腐蚀性 真金不怕火炼
的条件
金属活动性 顺序及其应用
金属资源的 利用与保护
第三单元 物质构成的奥秘
分子 概念 组成
定义 性质 小、动、有间隔
构成
构成 原子
由分子构成 的物质
H2 O2、N2、Cl2 H2O、CO2 、HCl等
分类
定义
性质 小、动、有间隔
核外电子排布
分布
元素
物质
元素符号
元素 周期表
构成
结构
由原子构成 的物质
元素符号 表示的意义
离子
Fe Cu Mg 、 He Ne、 C S P等
反应后溶液 质量的计算
溶解度
固体 溶解度 影响 因素
溶液 的浓度
结晶 方法
溶质的 质量分数
相关计算
概念
溶解性 内因: 溶质和溶剂的性质 划分方法 外因:温度
溶解度 曲线
蒸发结晶 降温结晶
液体的 体积分数
75%的 酒精溶液
溶液的配制 固体配制
计算 称量 溶解
溶液稀释
计算 量取 溶解
表示的意义: 点、交点、线 相关应用:
常见的酸
定义 实质
H++OH-=H2O
酸
中和 反应
PH
碱的通性
ቤተ መጻሕፍቲ ባይዱ
人教版高中化学选修3 物质结构与性质 第一章 第一节 原子结构(第2课时)

1s1 1s22s22p63s1 1s22s22p63s23p1
12
钠 Na
铝 Al
2014年7月13日星期日
构造原理与电子排布式
原子结构示意图
电子排布式
Li: 1s22s1
练一练
请写出4~10号元素原子的电子排布式。
2014年7月13日星期日 13
构造原理与电子排布式
4
铍Be 1s2 2s2
5
新课标人教版高中化学课件系列
选修3 物质结构与性质 第一章 原子结构与性质
第一节 原子结构 第2课时
2014年7月13日星期日
1
构造原理与电子排布式
【教学目标】
1.能根据构造原理用电子排布式表示1-36原子核 外电子的排布
2014年7月13日星期日
2
构造原理与电子排布式
问题探究 根据已有知识,试写出K原子
注意书写:1s2
2014年7月13日星期日
2s22p6 3s23p64s2 3d6
15
构造原理与电子排布式
练习:请根据构造原理,写出下列元素基态 原子的电子排布式: (1)Ne (2)S (3)29Cu (4)32Ge
1s22s22p6 1s22s22p63s23p4 1s22s22p63s23p63d104s1 1s22s22p63s23p63d104s24p2
。 。 。 。
2014年7月13日星期日
16
构造原理与电子排布式
练习:请写出第四周期21—36号元素原子的基态电 子排布式。
钪Sc: 钛Ti: 钒V: 铬Cr: 锰Mn:
1s22s22p63s23p63d14s2 1s22s22p63s23p63d24s2 1s22s22p63s23p63d34s2 1s22s22p63s23p63d54s1 1s22s22p63s23p63d54s2
高中化学选修3知识点图示大全

高中化学选修3知识点图示大全第一章原子结构与性质一.原子结构1.能级与能层2.原子轨道3.原子核外电子排布规律(1)能量最低原理现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。
构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。
(2)泡利(不相容)原理:基态多电子原子中,不可能同时存在4个量子数完全相同的电子。
换言之,一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓”表示),这个原理称为泡利(Pauli)原理。
(3)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特(Hund)规则。
比如,p3的轨道式为或,而不是。
洪特规则特例:当p、d、f轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。
即p0、d0、f0、p3、d5、f7、p6、d10、f14时,是较稳定状态。
前36号元素中全空状态的有4Be 2s22p0、12Mg 3s23p0、20Ca 4s23d0;半充满状态的有:7N 2s22p3、15P 3s23p3、24Cr 3d54s1、25Mn 3d54s2、33As 4s24p3;全充满状态的有10Ne 2s22p6、18Ar 3s23p6、29Cu 3d104s1、30Zn 3d104s2、36Kr 4s24p6。
4.基态原子核外电子排布的表示方法(1)电子排布式①用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式,例如K:1s22s22p63s23p64s1。
②为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相应稀有气体的元素符号外加方括号表示,例如K:[Ar]4s1。
(2)电子排布图(轨道表示式)每个方框或圆圈代表一个原子轨道,每个箭头代表一个电子。
如基态硫原子的轨道表示式为二.原子结构与元素周期表1.原子的电子构型与周期的关系(1)每周期第一种元素的最外层电子的排布式为ns1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中考化学九阴真经免费d=0a49d28856374b059add6943c24a6b9129547aa319d24ebf 七彩教育网:(无需注册,免费下载中小学试题和课件)
中学物理化学实验免费视频课程在线看/8ko6kCR
更多思维导图(初高中各科)/blog/static/3440450120140921622359/ 中学物理化学实验免费视频课程在线看/8ko6kCR 存储+赚钱收益网盘推荐 /zQMUfzy
中考化学九阴真经免费订阅 /cgi-bin/qf_invite?id=0a49d28856374b059add6943c24a6b9129547aa319d24ebf 七彩教育网:(无需注册,免费下载中小学试题和课件)
中考化学九阴真经免费订阅 /cgi-bin/qf_invite?id=0a49d28856374b059add6943c24a6b9129547aa319d24ebf 七彩教育网:(无需注册,免费下载中小学试题和课件)
中考化学九阴真经免费订阅 /cgi-bin/qf_invite?id=0a49d28856374b059add6943c24a6b9129547aa319d24ebf 七彩教育网:(无需注册,免费下载中小学试题和课件)
中学物理化学实验免费视频课程在线看/8ko6kCR
更多思维导图(初高中各科)/blog/static/3440450120140921622359/ 中学物理化学实验免费视频课程在线看/8ko6kCR 存储+赚钱收益网盘推荐 /zQMUfzy
中学物理化学实验免费视频课程在线看/8ko6kCR
更多思维导图(初高中各科)/blog/static/3440450120140921622359/ 中学物理化学实验免费视频课程在线看/8ko6kCR 存储+赚钱收益网盘推荐 /zQMUfzy
中考化学九阴真经免费订阅 /cgi-bin/qf_invite?id=0a49d28856374b059add6943c24a6b9129547aa319d24ebf 七彩教育网:(无需注册,免费下载中小学试题和课件)
中学物理化学实验免费视频课程在线看/8ko6kCR
更多思维导图(初高中各科)/blog/static/3440450120140921622359/ 中学物理化学实验免费视频课程在线看/8ko6kCR 存储+赚钱收益网盘推荐 /zQMUfzy
中学物理化学实验免费视频课程在线看/8ko6kCR
更多思维导图(初高中各科)/blog/static/3440450120140921622359/ 中学物理化学实验免费视频课程在线看/8ko6kCR 存储+赚钱收益网盘推荐 /zQMUfzy
中学物理化学实验免费视频课程在线看/8ko6kCR
更多思维导图(初高中各科)/blog/static/3440450120140921622359/ 中学物理化学实验免费视频课程在线看/8ko6kCR 存储+赚钱收益网盘推荐 /zQMUfzy
中考化学九阴真经免费订阅 /cgi-bin/qf_invite?id=0a49d28856374b059add6943c24a6b9129547aa319d24ebf 七彩教育网:(无需注册,免费下载中小学试题和课件)
