2018年度验证计划
CNAS-RL02:2018《能力验证规则》

CNAS-RL02能力验证规则Rules for Proficiency Testing 中国合格评定国家认可委员会目录前言 (2)1 范围 (3)2 引用文件 (3)3 术语和定义 (3)4 对合格评定机构的要求 (4)5 对CNAS的要求 (7)6 其他说明 (7)附录A(资料性附录)能力验证活动适宜性核查表 (8)附录B(规范性附录)能力验证领域和频次表 (10)前言中国合格评定国家认可委员会(英文缩写:CNAS)将能力验证与现场评审作为CNAS对合格评定机构能力进行评价的两种主要方式,为了确保CNAS认可的有效性,保证CNAS认可质量,促进合格评定机构的能力建设,特制定本规则。
本规则规定了CNAS能力验证的政策和要求,包括对合格评定机构的要求和对CNAS的要求。
本规则内容为强制性要求。
本规则中的“注”是对条款的解释和说明。
本规则于2007年制订,2010年换版修订,2015年6月换版后第1次修订,2016年换版修订,本次修订主要是根据ISO/IEC 17011:2017《合格评定认可机构要求》标准的变化,对第4、5和6条款的内容进行了修改,同时,为方便合格评定机构使用,将CNAS AL07:2015《CNAS能力验证领域和频次表》作为本规则的附录B,本文件实施之日起,CNAS AL07:2015《CNAS能力验证领域和频次表》废止。
能力验证规则1 范围本规则适用于申请CNAS认可或已获准CNAS认可的合格评定机构,包括检测和校准实验室(含医学领域实验室)、标准物质/标准样品生产者以及检验机构(相关时)。
2 引用文件本文件引用了下列文件中的全部或部分条款。
所引用的文件不注明其发布日期,请各相关方注意使用这些文件的有效版本(包括其修订案)。
2.1 CNAS-R01《认可标识使用和认可状态声明规则》2.2 GB/T 27000《合格评定词汇和通用原则》(ISO/IEC 17000,IDT)2.3 ISO/IEC 17011《合格评定认可机构要求》2.4 ISO/IEC 17043《合格评定能力验证的通用要求》(GB/T 27043)2.5 APLAC MR001《建立和保持认可机构间APLAC互认协议的程序》2.6 ILAC-P9《ILAC对参加能力验证活动的政策》3 术语和定义GB/T 27000中的定义适用于本规则,同时,本规则还引用以下术语和定义:3.1 实验室间比对:按照预先规定的条件,由两个或多个实验室对相同或类似的物品进行测量或检测的组织、实施和评价。
2018年度验证计划

2018年度验证计划编号:VMP-001-2018**************有限公司目录1.概述 (3)1.1确认/验证方针 (3)1.2指导原则 (4)1.3参考文件 (4)2.目的 (4)3.组织机构及职责 (4)3.1验证组织机构 (4)3.2验证职责 (4)4.简介 (5)4.1厂房、设施和设备简介 (5)4.2工艺简介 (7)4.3品种目录 (7)5.风险评估 (7)6.验证计划 (9)1.概述1.1确认/验证方针为了确保影响产品质量的关键要素,包括厂房设施、生产设备、生产工艺、分析方法等符合GMP规定的要求,保证患者的用药安全。
因此,本公司特制订如下情况需进行验证:验证;关键工艺参数和关键工艺步骤应进行验证;当验证状态发生漂移时应进行再验证;关键的工艺/设备/设施等应进行定期再验证;当发生的变更影响产品质量时,所涉及的变更应经过验证;检验方法、仪器发生变化时应进行验证。
1.2指导原则本次验证严格按照2010版GMP及其实施指南要求,参照WHO及ISPE有关技术指南的要求,在风险评估的基础上确定验证项目的范围及程度,对验证过程中出现的偏差和变更进行评估,确保所生产的药品符合预定用途和注册要求。
1.3参考文件《药品生产质量管理规范》(2010年版)《药品生产质量管理规范》(2010年版)附录-《确认与验证》药品GMP实施指南《中国药典》(2015年版)2.目的为公司的整个验证工作的实施提供指导,确保本公司的验证工作按照规定有序进行,符合GMP有关验证的要求。
其内容包括:确认/验证方针、指导原则、参考文件、组织机构及职责、确认/验证的范围及程度、确认/验证进度等。
3.组织机构及职责3.1验证组织机构根据验证工作需要,成立验证小组,小组成员由生产部、质量部、工程部等相关部门人员组成。
具体如下:组长:****组员:****(质量部部长)****(生产部部长)****(工程部部长)3.2验证职责3.2.1 验证小组职责①负责验证方案的审批;②负责组织协调验证各项工作,以保证验证方案规定项目的顺利实施;③负责验证数据及方法的审核;④负责验证报告的审批。
2018 能力验证规则

2018 能力验证规则2018能力验证规则一、背景介绍2018年能力验证规则是为了评估个人或组织在特定领域内的技能和能力而制定的一套规则。
这些规则旨在确保评估的公正性和准确性,以便为个人或组织提供可靠的能力证明。
二、规则细则1. 参与者资格:参与者必须具备相关领域的知识和技能,且符合参与条件。
每个领域都有特定的资格要求,如教育背景、工作经验等。
2. 评估方法:评估可以通过考试、实际操作、项目展示等方式进行。
评估方法必须与所评估的能力一致,且具有可信度和有效性。
3. 评估标准:评估标准需要明确、具体,以便评估者和被评估者都能理解。
标准可以包括知识点、技能要求、工作表现等方面。
4. 评估流程:评估流程应明确每个环节的目标和要求,包括报名、资格审核、评估准备、评估过程、评估结果等。
流程应具有可操作性和可追溯性。
5. 评估结果:评估结果应准确反映被评估者的能力水平,可以采用等级制度或得分制度。
结果应公正、客观,且可以被验证和认可。
6. 保密性:评估过程中涉及的个人信息和评估内容应严格保密,只能用于评估目的。
评估结果可以根据参与者的意愿进行公布。
7. 评估机构:评估机构应具备相应的资质和专业能力,并遵守相关法律法规和伦理准则。
评估机构应公开透明,接受监督和评估。
8. 评估周期:评估可以定期进行,以确保能力的持续发展和更新。
评估周期可以根据领域的特点和需求确定,一般为1年或2年。
9. 能力认证:通过评估的个人或组织可以获得相应的能力认证,以证明其在特定领域内的能力水平。
认证可以通过证书、徽章等形式进行。
10. 维护和更新:评估规则需要定期维护和更新,以适应领域的发展和变化。
评估规则的修订应经过充分的讨论和专业意见的参与。
三、意义和影响2018年能力验证规则的制定和实施对个人和组织都具有重要意义和影响:1. 对个人来说,能力验证规则可以帮助他们了解自己在特定领域的能力水平,指导个人发展和职业规划。
同时,能力认证也可以增加个人的竞争力和信任度。
CNAS-RL02 2018能力验证规则

CNAS-RL02能力验证规则Rules for Proficiency Testing 中国合格评定国家认可委员会目录前言 (2)1 范围 (3)2 引用文件 (3)3 术语和定义 (3)4 对合格评定机构的要求 (4)5 对CNAS的要求 (7)6 其他说明 (7)附录A(资料性附录)能力验证活动适宜性核查表 (8)附录B(规范性附录)能力验证领域和频次表 (10)前言中国合格评定国家认可委员会(英文缩写:CNAS)将能力验证与现场评审作为CNAS对合格评定机构能力进行评价的两种主要方式,为了确保CNAS认可的有效性,保证CNAS认可质量,促进合格评定机构的能力建设,特制定本规则。
本规则规定了CNAS能力验证的政策和要求,包括对合格评定机构的要求和对CNAS的要求。
本规则内容为强制性要求。
本规则中的“注”是对条款的解释和说明。
本规则于2007年制订,2010年换版修订,2015年6月换版后第1次修订,2016年换版修订,本次修订主要是根据ISO/IEC 17011:2017《合格评定认可机构要求》标准的变化,对第4、5和6条款的内容进行了修改,同时,为方便合格评定机构使用,将CNAS AL07:2015《CNAS能力验证领域和频次表》作为本规则的附录B,本文件实施之日起,CNAS AL07:2015《CNAS能力验证领域和频次表》废止。
能力验证规则1 范围本规则适用于申请CNAS认可或已获准CNAS认可的合格评定机构,包括检测和校准实验室(含医学领域实验室)、标准物质/标准样品生产者以及检验机构(相关时)。
2 引用文件本文件引用了下列文件中的全部或部分条款。
所引用的文件不注明其发布日期,请各相关方注意使用这些文件的有效版本(包括其修订案)。
2.1 CNAS-R01《认可标识使用和认可状态声明规则》2.2 GB/T 27000《合格评定词汇和通用原则》(ISO/IEC 17000,IDT)2.3 ISO/IEC 17011《合格评定认可机构要求》2.4 ISO/IEC 17043《合格评定能力验证的通用要求》(GB/T 27043)2.5 APLAC MR001《建立和保持认可机构间APLAC互认协议的程序》2.6 ILAC-P9《ILAC对参加能力验证活动的政策》3 术语和定义GB/T 27000中的定义适用于本规则,同时,本规则还引用以下术语和定义:3.1 实验室间比对:按照预先规定的条件,由两个或多个实验室对相同或类似的物品进行测量或检测的组织、实施和评价。
年度验证主计划模板

**年度验证主计划文件编号:起草人/日期:审核人/日期:批准人/日期:执行日期:目的:建立验证总规划,规范所有验证工作范围:公司所有验证工作职责:验证委员会、验证小组内容:1.概述1.1****药业有限公司***经济开发区,占地13.5万平方米,建有办公楼、制剂楼、综合楼、锅炉房、污水处理等附属设施。
1.2我公司整个厂区包括:办公区、质量控制区、药品生产区(针剂车间、固体车间、中药提取和合成车间)、仓储区(原辅料库、包材库存、成品库及中药材库)等。
公用系统包括:空气净化系统、纯化水系统、注射用水系统、压缩空气系统等。
1.3我公司整个厂区路面平整。
生产、行政、生活和辅助区已全部分开。
对厂区的环境进行了绿化,种植了对环境、空气无污染的树木、灌木、草坪。
1.4针剂车间由冻干粉针剂和小容量注射剂组成,洁净级别分为A/B级区、C级区。
年生产能力1000万支,其中冻干剂400万支,水针剂600万支。
1.5固体车间分为片剂生产线和片剂胶囊生产线,洁净级别为D级。
1.6综合车间一层为中药前处理和提取生产线,洁净级别为D级;二层为化学原料药合成生产线,洁净级别分为A/B级区、C级区、D级区和一般生产区。
2.目的实施GMP的最终目的是防止生产过程中药品的污染、混淆和差错的发生,保证药品质量。
而验证作为GMP的重要组成部分,就是为GMP的最终目的服务的。
公司验证工作的整体目标就是证明任何可能影响产品质量的所有因素均符合GMP要求,即可证明按特定生产工艺能保证产品质量始终如一、符合预定要求。
3.组织机构、人员与职责3.1验证委员会****药业有限公司成立验证委员会,验证委员会设主任一名,副主任一名,验证委员会的成员主要由公司质量控制室、设备动力部、生产部及各车间负责人构成。
验证委员会下设5个验证小组。
3.2验证组织机构图3.3验证委员会组成及职责3.3.3.3.2验证委员会职责主要负责验证的总体策划与协调,验证文件的审核与批准,并为验证提供足够的资源。
环境保护部标准样品研究所
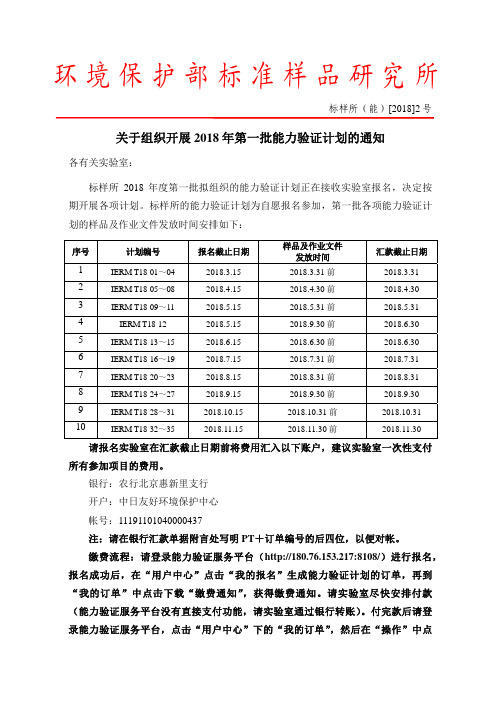
环境保护部标准样品研究所标样所(能)[2018]2号关于组织开展2018年第一批能力验证计划的通知各有关实验室:标样所2018年度第一批拟组织的能力验证计划正在接收实验室报名,决定按期开展各项计划。
标样所的能力验证计划为自愿报名参加,第一批各项能力验证计划的样品及作业文件发放时间安排如下:序号计划编号报名截止日期样品及作业文件发放时间汇款截止日期1 IERM T18-01~04 2018.3.15 2018.3.31前 2018.3.312 IERM T18-05~08 2018.4.15 2018.4.30前2018.4.303 IERM T18-09~11 2018.5.15 2018.5.31前 2018.5.314 IERM T18-12 2018.5.15 2018.9.30前2018.6.305 IERM T18-13~15 2018.6.15 2018.6.30前 2018.6.306 IERM T18-16~19 2018.7.15 2018.7.31前2018.7.317 IERM T18-20~23 2018.8.15 2018.8.31前 2018.8.318 IERM T18-24~27 2018.9.15 2018.9.30前2018.9.309 IERM T18-28~31 2018.10.15 2018.10.31前 2018.10.3110 IERM T18-32~35 2018.11.15 2018.11.30前2018.11.30请报名实验室在汇款截止日期前将费用汇入以下账户,建议实验室一次性支付所有参加项目的费用。
银行:农行北京惠新里支行开户:中日友好环境保护中心帐号:11191101040000437注:请在银行汇款单据附言处写明PT+订单编号的后四位,以便对帐。
缴费流程:请登录能力验证服务平台(http://180.76.153.217:8108/)进行报名,报名成功后,在“用户中心”点击“我的报名”生成能力验证计划的订单,再到“我的订单”中点击下载“缴费通知”,获得缴费通知。
ISO22000:2018确认、验证、验证结果的评价与分析控制程序

ISO22000:2018确认、验证、验证结果的评价与分析控制程序确认、验证、验证结果的评价与分析控制程序1 目的通过确认、证实各控制措施或控制措施的组合能使相应的食品安全危害达到预期的控制水平;通过验证、证明各控制措施或控制措施的组合确实达到了预期的控制水平。
2 适用范围适用于对控制措施组合进行确认;适用于对食品安全管理体系进行验证。
3 职责3.1 食品安全小组负责对操作性前提方案OPRP和HACCP计划进行确认;负责对前提方案PRP、操作性前提方案OPRP和HACCP计划进行验证。
3.2 品控部、食品安全小组成员负责CCP的验证;品控部负责最终产品的检验。
3.3 综合部负责组织进行食品安全管理体系的内部审核;负责组织对验证结果进行评价和分析。
4 工作程序4.1 控制措施组合的确认4.1.1 操作性前提方案OPRP的确认4.1.1.1 确认的时机(1)在操作性前提方案OPRP实施之前。
(2)在下列情况下。
根据需要,对操作性前提方案OPRP做必要的修改,在修改后的操作性前提方案OPRP实施之前,要对其进行确认。
①原料的改变;②产品或加工的改变;③复查时发现数据不符或相反;④重复出现同样的偏差;⑤有关危害或控制手段的新信息(原来依据的信息来源发生变化):⑥生产中观察到异常情况;⑦出现新的销售或消费方式。
4.1.1.2 确认的内容确认的内容见“操作性前提方案OPRP确认记录表”。
4.1.1.3 确认的实施食品安全小组用“操作性前提方案OPRP确认记录表”对操作性前提方案OPRP进行确认,确认的结果记录在“操作性前提方案OPRP 确认记录表”的相关栏目中。
4.1.1.4 确认结果的处理当确认结果表明操作性前提方案OPRP不能对相应的食品安全危害进行预期的控制时,应对操作性前提方案OPRP进行修改、重新评价和确认。
4.1.2 HACCP计划的确认(1)在HACCP计划实施之前。
(2)在下列情况下,应对危害分析的输入进行必要的更新重新进行必要的危害分析,并对HACCP计划进行必要的修改,在修改后的HACCP计划实施之前,要对其进行确认:①原料的改变;②产品或加工的改变;③复查时发现数据不符或相反;④重复出现同样的偏差;⑤有关危害或控制手段的新信息(原来依据的信息来源发生变化):⑥生产中观察到异常情况;⑦出现新的销售或消费方式。
国家食品药品监管总局2018年能力验证计划
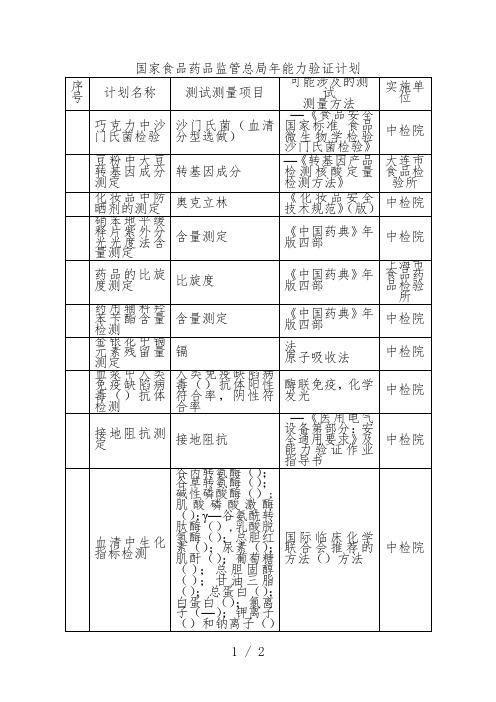
序号
计划名称
测试测量项目
可能涉及的测试
测量方法
实施单位
巧克力中沙门氏菌检验
沙门氏菌(血清分型选做)
—《食品安全国家标准 食品微生物学检验 沙门氏菌检验》
中检院
豆粉中大豆转基因成分测定
转基因成分
—《转基因产品检测核酸定量检测方法》
大连市食品检验所
化妆品中防晒剂的测定
奥克立林
人类免疫缺陷病毒()抗体阳性符合率,阴性符合率
酶联免疫,ห้องสมุดไป่ตู้学发光
中检院
接地阻抗测定
接地阻抗
—《医用电气设备第部分:安全通用要求》及能力验证作业指导书
中检院
血清中生化指标检测
谷丙转氨酶();谷草转氨酶();碱性磷酸酶();肌酸磷酸激酶();γ—谷氨酰转肽酶(),乳酸脱氢酶();总胆红素();尿素();肌酐();葡萄糖();总胆固醇();甘油三脂();总蛋白();白蛋白();氯离子(—);钾离子()和钠离子()
《化妆品安全技术规范》(版)
中检院
硝苯地平缓释片紫外分光光度法含量测定
含量测定
《中国药典》年版四部
中检院
药品的比旋度测定
比旋度
《中国药典》年版四部
上海市食品药品检验所
药用辅料羟苯苄酯含量检测
含量测定
《中国药典》年版四部
中检院
金银花中镉元素残留量测定
镉
法
原子吸收法
中检院
血浆中人类免疫缺陷病毒()抗体检测
国际临床化学联合会推荐的方法()方法
中检院
报名方式:请于年月日前,登录中国药检能力验证服务平台()报名。
验证总计划及年度验证计划

1.考证目标与本文件的目的考证目标GMP是保证生产出切合既定质量标准药品的独一手段,而考证是证明和保证重点生产因素,包含设备、系统、仪器设备、生产工艺、剖析方法、洁净规程以及消毒 / 灭菌规程切合既定要求的公认方法。
没有优秀有效的考证工作,就谈不上GMP管理系统的有效,也就没法保证药品的质量。
所以,考证工作是 GMP管理的最重要工作之一。
基于考证工作的这样重要性,本企业将考证工作放在 GMP管理的重要地点,并赐予高度重视。
为此提出以下考证目标:充足认识,高度重视;成立规程、依规行事;客观记录、谨慎结论;资源保证。
所有新的重点方法、规程、工艺及新的重点系统、设备在投入使用前应经考证。
当发生的更改影响产质量量时,所波及的更改应经过考证。
当考证状态发生漂移时应进行再考证。
重点工艺参数和重点工艺步骤应进行考证。
查验方法发生变化时应进行考证。
本文件的目的本考证总计划( VMP)依据本企业考证管理规程(文件号 XXXXX)拟订,归纳地描绘了本企业应当进行的考证和确认活动的管理原则,包含考证目标、组织机构、范围领域、文件管理、计划安排、实行程序、简要方法和可接受标准等,以保证本企业的考证工作依照规定获取优秀执行,知足 GMP有关考证的要求。
本考证总计划是企业考证工作的跨年度的通用指导性管理文件,企业有关部门可依据详细状况以“年度(阶段)考证计划”详细化当年的考证活动,也能够“项目(如新建车间、特别项目)考证计划”对“年度考证计划”进一步细化,以清楚文件,方便工作。
2一般概括企业简介企业基本状况企业全称是,企业成立于 ____年,特意从事于 ____类产品的研究、开发和商品化生产。
企业现有 XX 个生产车间 , 车间面积合计 _____多平方米,切合中国 GMP标准,已经过 XX 认证。
_____年本企业原料药的年产量达XX。
简要介绍企业平面布局状况、品种状况、车间状况、生产能力状况、库房状况、其余建筑物状况。
验证主计划、项目验证计划和年度验证计划

验证主计划、项目验证计划和年度验证计划ValidationMaster Plans Vs Project Validation Plans验证主计划和项目验证计划As with all validation life-cycledocuments, a validation master plan is a formal document produced by thepharmaceutical manufacturer. The plan should require that all validation documentationis under a strict document control procedure with issue and revision ofdocuments controlled by means of an approval tables, identifying the name,signature, date, and level of authority of the signatory.与所有验证生命周期文件一样,验证主计划(VMP)是一个生产商编写的正式文件。
该计划要求所有验证文件是在一个严格的文件控制流程里面,该文件的发布和修订由一个审批表控制,确定名称、签名、日期和签字人的权限级别。
A validation master plan should describethe purpose and level of the plan and must be consistent with establishedpolicies and the GMP risk and criticality analysis. The document must beapproved and state the period after which the plan is to be reviewed.验证主计划应描述计划的目的和水平,必须符合既定的政策和GMP风险及危害性分析。
2018年度验证计划

2018年度验证计划编号:VMP-001-2018**************有限公司目录1.概述..............1.1确认/验证方针.....................1.2指导原则.................1.3参考文件 (4)2.目的 (4)3.组织机构及职责 (5)3.1验证组织机构 (5)3.2验证职责 (5)4.简介 (6)4.1厂房、设施和设备简介 (6)4.2工艺简介 (8)(1)前处理:①中药饮片→称量→提取→过滤→储罐→浓缩→干燥→备用②中药饮片→称量→混合→粉碎→灭菌→备用(2)制剂:取干膏、药粉按标准要求配料→(制粒→干燥→整粒)→混合→填充胶囊→抛光→铝塑包装→外包装4.3品种目录 (8)5.风险评估 (8)6.验证计划 (9)1.概述1.1确认/验证方针为了确保影响产品质量的关键要素,包括厂房设施、生产设备、生产工艺、分析方法等符合GMP规定的要求,保证患者的用药安全。
因此,本公司特制订如下情况需进行验证:所有新的关键方法、规程、工艺及新的关键系统、设备在投入使用前应经验证;关键工艺参数和关键工艺步骤应进行验证;当验证状态发生漂移时应进行再验证;关键的工艺/设备/设施等应进行定期再验证;当发生的变更影响产品质量时,所涉及的变更应经过验证;检验方法、仪器发生变化时应进行验证。
1.2指导原则本次验证严格按照2010版GMP及其实施指南要求,参照WHO及ISPE有关技术指南的要求,在风险评估的基础上确定验证项目的范围及程度,对验证过程中出现的偏差和变更进行评估,确保所生产的药品符合预定用途和注册要求。
1.3参考文件《药品生产质量管理规范》(2010年版)《药品生产质量管理规范》(2010年版)附录-《确认与验证》药品GMP实施指南《中国药典》(2015年版)2.目的为公司的整个验证工作的实施提供指导,确保本公司的验证工作按照规定有序进行,符合GMP有关验证的要求。
验证总计划及年度验证计划

... . .1. 验证方针与本文件的目的1.1验证方针GMP是保证生产出符合既定质量标准药品的唯一手段,而验证是证明和保证关键生产要素,包括设施、系统、仪器设备、生产工艺、分析方法、清洁规程以及消毒/灭菌规程符合既定要求的公认方法。
没有良好有效的验证工作,就谈不上GMP管理体系的有效,也就无法保证药品的质量。
因此,验证工作是GMP管理的最重要工作之一。
鉴于验证工作的如此重要性,本公司将验证工作放在GMP管理的重要位置,并给予高度重视。
为此提出下列验证方针:●充分认识,高度重视;建立规程、依规行事;客观记录、慎重结论;资源保证。
所有新的关键方法、规程、工艺及新的关键系统、设备在投入使用前应经验证。
●当发生的变更影响产品质量时,所涉及的变更应经过验证。
●当验证状态发生漂移时应进行再验证。
●关键工艺参数和关键工艺步骤应进行验证。
●检验方法发生变化时应进行验证。
1.2本文件的目的本验证总计划(VMP)根据本公司验证管理规程(文件号XXXXX)制定,概括地描述了本公司应该进行的验证和确认活动的管理原则,包括验证方针、组织机构、围领域、文件管理、计划安排、实施程序、简要方法和可接受标准等,以确保本公司的验证工作按照规定得到良好执行,满足GMP有关验证的要求。
本验证总计划是公司验证工作的跨年度的通用指导性管理文件,公司有关部门可根据具体情况以“年度(阶段)验证计划”具体化当年的验证活动,也可以“项目(如新建车间、特别项目)验证计划”对“年度验证计划”进一步细化,以清晰文件,方便工作。
2一般概述2.1公司简介●公司基本情况公司全称是,公司成立于____年,专门从事于____类产品的研究、开发和商品化生产。
公司现有XX 个生产车间,车间面积共计_____多平方米,符合中国GMP标准,已通过XX认证。
_____年本公司原料药的年产量达XX。
简要介绍公司平面布局情况、品种情况、车间情况、生产能力情况、仓库情况、其他建筑物情况。
2018年检验科室间质评计划

2018年检验科室间质评计划
为提高检验质量,保证检验结果的准确性,按照检验科室间质评管理制度要求,经科室质量小组讨论,报医务科批准,计划2018年参加江西省临床检验室间质量评价计划如下:
一、参加卫计委临检中心质评:核酸检测(病毒学)乙肝1项。
二、参加江西省临床检验室间质量评价13项:临床化学、全血细胞计数、临床微生物、感染性疾病血清标志物A、特殊蛋白、尿液干化学、出凝血试验、临床形态学、脂类分析、糖化血红蛋白、临床PCR、肿瘤标志物、血型。
三、参加江西省疾控的能力验证试验:HIV、梅毒TPPA、梅毒RPR。
所有质评项目的网上申请、付款、质控品接收、发放工作由质量工作小组负责实施。
质评样品的测定、按时上报、结果分析总结由各专业组长实施,质量小组负责督导检查。
检验科质量小组
2018年1月2日。
国家认监委办公室关于开展2018年度能力验证工作的通知

国家认监委办公室关于开展2018年度能力验证工作的通知文章属性•【制定机关】国家认证认可监督管理委员会•【公布日期】2018.03.20•【文号】认办实〔2018〕5号•【施行日期】2018.03.20•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】认证认可正文国家认监委办公室关于开展2018年度能力验证工作的通知认办实〔2018〕5号各直属检验检疫局,各省、自治区、直辖市质量技术监督局(市场监督管理部门),各资质认定(计量认证)行业评审组,各项目承担单位,各有关检验检测机构:为贯彻落实《国务院关于加强质量认证体系建设促进全面质量管理的意见》(国发〔2018〕3号)关于加强检验检测认证认可事中事后监管力度的要求,规范检验检测市场,提升检验检测机构资质认定制度实施的有效性,根据《检验检测机构资质认定管理办法》(质检总局令第163号)和国家认监委《实验室能力验证实施办法》(认监委公告2006年第9号)的有关规定,国家认监委决定在社会重点关注的检验检测领域组织开展2018年度能力验证工作。
现将有关事项通知如下:一、能力验证计划的设置国家认监委能力验证计划分设A、B、C三类项目。
(一)A类项目:由国家认监委征集、审核并发布的能力验证项目。
取得国家认监委颁发的检验检测机构资质认定(CMA)证书,且相关检验检测项目(参数或者方法标准)已经取得资质认定的检验检测机构必须参加。
鼓励省级质量技术监督局(市场监督管理部门)颁发资质认定证书的检验检测机构,获得实验室认可的检验检测机构,以及企业、高校等其他检验检测机构自愿参加。
2018年度A类项目共19项(见附件1)。
(二)B类项目:由国家认监委征集、审核并发布的能力验证项目,鼓励各类检验检测机构自愿参加。
2018年度B类项目共18项(见附件2)。
(三)C类项目:由国家认监委确定的能力验证组织者组织实施的能力验证项目(包括实验室间比对)。
能力验证组织者包括国家认可机构认可的“能力验证提供者(PTP)”,也包括其他具备相关技术能力、具有能力验证组织经验的技术机构。
2018 能力验证规则

2018 能力验证规则2018年能力验证规则引言:2018年,作为一个新的起点,我们制定了一系列能力验证规则,以帮助我们提升工作效率、规范工作流程并提高工作质量。
本文将详细介绍这些规则,帮助我们更好地理解和遵守。
一、准时完成任务在2018年,我们强调准时完成任务的重要性。
我们将任务的截止日期设定为最后期限,并鼓励大家提前安排时间,合理分配工作以保证任务的及时完成。
只有在特殊情况下,才能提出延期申请,并经过相关审批。
二、合作与沟通团队合作是我们取得成功的关键之一。
在2018年,我们鼓励成员之间积极互动,及时交流。
每周定期开展团队会议,分享进展和遇到的问题,并共同寻找解决方案。
同时,我们还提倡跨团队合作,促进知识共享和经验互补。
三、高效工作提高工作效率是我们的目标之一。
在2018年,我们推行了一系列高效工作的方法和工具。
例如,合理安排工作时间,设置专注时间段,避免被其他事务打断。
使用任务管理工具,记录和跟踪任务进度。
同时,合理分配工作量,避免过度负荷和资源浪费。
四、持续学习与提升在2018年,我们鼓励成员持续学习和自我提升。
通过参加培训课程、研讨会和读书分享会等形式,不断更新知识和技能。
同时,我们鼓励成员之间互相学习,共同成长。
定期进行个人能力评估,找出自身的短板并积极改进。
五、规范文档和报告在2018年,我们注重规范文档和报告的编写。
要求文档内容准确、清晰,并遵循一定的格式规范。
报告应包含必要的背景信息、分析和结论,并根据读者的需求进行适当的调整。
避免语法错误和拼写错误,提高文档的可读性和专业性。
六、保护机密信息在2018年,我们高度重视保护机密信息的安全性。
成员必须严格遵守保密协议,并确保机密信息不被外泄。
对于需要处理机密信息的成员,需要进行相应的培训和授权,并严格遵守相关规定和流程。
七、客户满意度客户满意度是我们工作的最终目标。
在2018年,我们将客户需求放在首位,提供高质量的产品和服务。
及时回复客户咨询和问题,并积极寻求解决方案。
IATF16949-2018应急计划验证报告(模拟演练)_IT

应急计划验证报告(模拟演练)一、主题:针对影响汽车产品持续供应的突发紧急情况措施应对有效性验证。
二、范围:对信息系统的网络攻击:1) 公司网站、网页出现非法言论事件紧急处置措施2) 黑客攻击事件紧急处置措施3) 病毒事件紧急处置措施4) 软件系统遭破坏性攻击的紧急处置措施5) 数据库安全紧急处置措施6) 广域网外部线路中断紧急处置措施7) 局域网中断紧急处置措施8) 设备安全紧急处置措施三、活动时间:2018年12月26日四、负责人:崔国明五、参与人员:高层管理人员相关部门长及相关人员:崔海龙、张跃、陈宏杰、孙晓丽、杜宇、石聪、高崇鑫、刘儒惠六、活动安排:•文件备份:工厂内所有公共盘现存的文件资料如销售、计调、品质、生产、采购、财务资料等,自动进行备份。
•生产转移:工厂厂房若发生意外,个别或整个生产线已遭受破坏不能立即恢复时,为能维持正常生产,满足客户要求,个别或全部工种将需要处理或转移至已外协的工厂。
发生生产停止的紧急情况后重新开始生产之后,以及在常规停机过程未得到遵循的情况下,确认制造的产品持续符合顾客规范。
七、验证过程纪实:根据应急问题的发现的途径不同,分别由部门总经理、内审员、分管副总对纠正和预防措施的实施进行确认,并对措施的实施情况进行监控和验证,直至措施项关闭。
监控、验证内容主要包括以下几个方面:1. 各项措施是否全部落实;2. 是否达到预期效果;3. 有关记录是否保留;4. 涉及客户的,是否最终使客户满意。
5. 每年由ISO9001&IATF16949标准和ISO27001标准外部审核人员对应急处理情况进行检查。
八、模拟验证结果:根据模拟紧急事故出现时按照公司指定的应急计划进行应对基本能保证订单的准时交付。
编制:审核:日期:2018.12.261/1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2018年度验证计划编号:VMP-001 -2018 RRRRRRRRRRR RRR公司目录1.概述 (4)1.1确认/验证方针 (4)1.2指导原则 (4)1.3参考文件 (4)2.目的 (4)3.组织机构及职责 (4)3.1验证组织机构 (4)3.2验证职责 (5)4.简介 (6)4.1 厂房、设施和设备简介 (6)4.2工艺简介 (8)4.3品种目录 (8)5.风险评估 (9)6.验证计戈U (10)1.概述1.1确认/验证方针为了确保影响产品质量的关键要素,包括厂房设施、生产设备、生产工艺、分析方法等符合GMP规定的要求,保证患者的用药安全。
因此,本公司特制订如下情况需进行验证:所有新的关键方法、规程、工艺及新的关键系统、设备在投入使用前应经验证;关键工艺参数和关键工艺步骤应进行验证;当验证状态发生漂移时应进行再验证;关键的工艺/设备/设施等应进行定期再验证;当发生的变更影响产品质量时,所涉及的变更应经过验证;检验方法、仪器发生变化时应进行验证。
1.2指导原则本次验证严格按照20RR版GMP及其实施指南要求,参照WH(及ISPE有关技术指南的要求,在风险评估的基础上确定验证项目的范围及程度,对验证过程中出现的偏差和变更进行评估,确保所生产的药品符合预定用途和注册要求。
1.3参考文件《药品生产质量管理规范》(20RR年版)《药品生产质量管理规范》(20RR年版)附录-《确认与验证》药品GMP实施指南《中国药典》(2015年版)【MeiWei_81 重点借鉴文档】2.目的为公司的整个验证工作的实施提供指导,确保本公司的验证工作按照规定有序进行,符合GMP有关验证的要求。
其内容包括:确认/验证方针、指导原则、参考文件、组织机构及职责、确认/验证的范围及程度、确认/验证进度等。
3.组织机构及职责3.1验证组织机构根据验证工作需要,成立验证小组,小组成员由生产部、质量部、工程部等相关部门人员组成。
具体如下:组长:RRRR组员:RRR(R 质量部部长)RRR(R 生产部部长)RRR(R 工程部部长)3.2验证职责3.2.1验证小组职责①负责验证方案的审批;②负责组织协调验证各项工作,以保证验证方案规定项目的顺利实施;③负责验证数据及方法的审核;④负责验证报告的审批。
3.2.2工程部职责①负责厂房设备设施的验证及再验证工作;②参与验证活动,确保验证进度;③根据验证结果修订相关厂房设备文件及记录;3.2.3质量部职责①负责验证方案的起草与修订;②负责工艺、清洁验证工作的取样并出具检测报告;③负责空气净化系统、纯化水系统的取样检测;④负责检验仪器、检验方法的验证工作;⑤负责验证工作的中的监督检查,确保验证进度;【MeiWei_81 重点借鉴文档】⑥负责验证工作中的偏差处理及变更控制工作;⑦负责起草验证报告。
⑧根据验证结果修订相关质量文件及记录;3.2.4生产部职责①组织协调工艺、清洁验证活动,确保验证进度;②负责工艺、清洁验证数据的收集;③参与厂房设施设备的验证工作;④根据验证结果修订相关生产文件及记录;4.简介4.1 厂房、设施和设备简介RRRRRRRRRRR限公司占地面积RRRRRR本企业共有RR个RRRR生产车间,由RRRRRR有限公司按照20RR版GMP要求设计,RRRRRR有限公司建造。
1#厂房建筑东西向总长度97.1 米,南北向宽度为50 米。
该厂房的东部为三层:一层由北向南布置有锅炉房、消防控制室、餐厅、阴凉库(2 间)、劳保仓库和泵房,二层为化验室,由北向南布置有空调机房、阳性对照室、准备室、微生物限度室、试剂室、样品室、仪器室、高温室、天平室、液相色谱室、标准溶液室、理化室、气瓶室、气相色谱室、样品前处理室、更衣室及盥洗室;三层为办公用房,由北向南依次布置有留样室、稳定性考察室、办公室(10 间)及盥洗室。
该厂房的西部为生产车间:其西部布置有药材前处理和提取车间;北部布置有药材库及动力机房房、高低压配电室、制水间;南部为洁净生产区;东部布置有原辅料料包材仓库、成品仓库。
中药硬胶囊剂生产车间包括前处理组(含中药粉碎和提取)、收膏组、制剂组、外包装组、仓库、动力区。
(1)前处理组位于1#厂房西部,属一般生产区,建筑面积约825 平方米,有拣选工作台1个,洗药机1台,润药池2个,切药机1 台,剁药机1台,药材干燥设备1台,粉碎机组1 台,湿热灭菌柜1 台,提取罐3 台,药液储罐2 台,双效浓缩机组1台,单效浓缩机组1 台,沉淀罐1 台,酒精回收机组1台,酒精储罐2 台,溶剂回收罐1 台,发酵罐1 台。
以上设备均为优质不锈钢材质,【MeiWei_81 重点借鉴文档】现阶段能满足企业生产需要。
物料由药材库直接传入前处理组,人员由前处理组北侧人员通道进入。
(2)收膏组位于1#厂房中西部,属D级洁净区,建筑面积约300平方米。
收膏洁净区有收膏混膏、微波干燥灭菌、净料粉碎等工序,有符合GMf要求的微波干燥箱1 台、干膏粉碎机1 台。
收膏组人员从1#厂房南侧进入洁净区,前处理组通过管路和收膏洁净区西侧的气闸将物料传入收膏组,收膏组将加工处理好的物料从收膏洁净区东侧的气闸传至制剂组,废弃物由收膏组北侧的传递窗传出。
洁净区操作者按批准的各项规程操作,有严格的质量监控,有效降低微生物污染和交叉污染,避免混淆和差错。
(3)制剂组位于1#厂房中部,属D级洁净区,建筑面积约1000平方米。
制剂洁净区有混合配料、制粒干燥、胶囊充填、内包装等工序,有符合GMP要求的混合机1 台、槽式混合机1 台、摇摆式颗粒剂1 台、沸腾干燥机1 台、热风循环烘箱1 台、胶囊充填机3 台、铝塑包装机3 台。
制剂组人员从1#厂房南侧进入洁净区,制剂洁净区北侧通过气闸与原辅料包材库相连,完成内包装后的待包装品从洁净区内包间的传递口直接传至外包装组,废弃物由制剂组东侧的传递窗传出。
洁净区操作者按批准的各项规程操作,有严格的质量监控,有效降低微生物污染和交叉污染,避免混淆和差错。
(4)外包装组位于1#厂房南侧,属一般生产区,建筑面积约170平方米,有2 条包装生产线。
外包装组与包材库、成品库相连,方便存取。
人员分工明确,责任到人,有效地避免各种人为的差错。
(5)仓库分为药材库、原辅料包材库和成品库,其中药材库位于1#厂房北侧,分为常温库与阴凉库;原辅料包材库位于1#厂房东侧,分为标签库、原辅包材库、阴凉库;成品库位于1#厂房东侧,分为常温库与阴凉库。
(6)动力区分为锅炉房、配电室、动力机房、制水间,其中锅炉房位于1# 厂房东北角,有1.7 吨锅炉1 台,主要为生产提供蒸汽;配电室位于1#厂房北侧,主要为生产提供电力;动力机房位于1#厂房北侧,主要有3台空调机组、1 台制冷机组、1 套压缩空气设备,主要为洁净区提供洁净空气和洁净压缩空气;制水间位于动力机房南侧,有0.5吨/h双级反渗透制纯化水机组一套,主要为【MeiWei 81重点借鉴文档】洁净区提供纯化水。
4.2工艺简介(1)前处理:①中药饮片-称量-提取-过滤-储罐-浓缩-干燥-备用②中药饮片T称量T混合T粉碎T灭菌T备用(2)制剂:取干膏、药粉按标准要求配料—(制粒—干燥—整粒)—混合—填充胶囊—抛光—铝塑包装—外包装4.3品种目录5.风险评估5.1厂房设施设备再确认参照《药品GMF指旨南-质量管理体系》第97-98页的“厂房、设施、设备等完成确认之后应通过变更管理系统进行控制,所有影响产品质量的变更等都应有正式的申请、记录并批准。
在没有发生较大的变更的情况下,可以通过对维护、校准、工作日志、偏差、变更等的定期回顾,确保厂房、设施、设备等的确认状态。
这种周期性的回顾可视为再确认。
当发生改造、变更或反复出现故障时,需通过风险评估确定是否进行再确认,以及再确认的范围和程度。
”内容, 在厂房、设施、设备等完成确认的情况下,如发生变更,需立即停止生产,进行再确认合格后方可使用;如无变更,在HVAC系统和纯化水系统正式运行1年后,其余厂房、设施、设备正式运行2年后通过对维护、校准、工作日志、偏差、变更等的定期回顾进行再确认。
如增加新设施设备,需对相关设备进行确认合格后方可使用5.2工艺验证根据《药品生产质量管理规范(20RR年修订)》的规定,我公司因企业搬迁【MeiWei_81重点借鉴文档】生产设备、生产环境等发生变更,存在影响产品质量的因素,在新厂址未生产过的品种应完成连续三个成功批次的工艺验证。
参照《药品GMP旨南-质量管理体系》第103-104页的规定,生产工艺的再验证,可分为以下两种情况:(1)当发生可能影响产品质量的变更或出现异常情况时,应通过风险评估确定是否需进行再验证以及确定再验证的范围和程度。
(2)生产工艺在完成首次验证后,应定期进行再验证以确定它们仍保持验证状态并仍能满足要求,再验证的频率可以由企业根据产品、剂型等因素自行制定。
周期性的再验证可以采用同步验证的方式、回顾的方式或两者相结合的方式进行。
5.3清洁再验证参照《药品GMF旨旨南-质量管理体系》第116页的规定“每个清洁程序应定期进行再验证,验证的频率由企业根据实际情况制定。
对日常清洁程序监测结果的回顾可以作为周期性再验证。
”在已完成清洁验证的情况下,如清洁程序发生变更并可能影响清洁效果、设备发生变更并可能影响到清洁效果、当分组或最差条件发生变化并可能影响到验证结论、日常监测中发现异常结果时,应立即停产,进行清洁再验证合格后方可继续生产;如无变更,在正式生产2年后,通过对日常清洁程序监测结果的回顾进行再验证。
6.验证计划根据风险评估内容特制订本年度验证计划2018年验证计划一览表R注:未列入本计划的验证可根据需要及时提出由验证小组批准进行。
