铁和铜及其化合物的应用
铁铜的化合物及应用教案

铁铜的化合物及应用教案
铁铜的化合物及应用
铁铜是化学元素,可以与其他元素形成不同的化合物。
以下是铁铜的一些常见化合物及其应用:
1. 氧化铁铜(FeCuO):氧化铁铜是由铁、铜和氧元素组成的化合物。
它可以用作磁性材料、涂料和颜料。
2. 氯化铁铜(FeCuCl):氯化铁铜是一种含铜氯化物,可以用作染料、胶体溶剂和印染剂。
3. 硝酸铁铜(FeCu(NO3)3):硝酸铁铜是一种黄色晶体粉末,可以用作氧化剂和催化剂。
4. 碳酸铁铜(FeCuCO3):碳酸铁铜是一种蓝色的粉末,可以用作涂料和颜料。
5. 硫酸铁铜(FeCuSO4):硫酸铁铜是一种广泛应用的化合物,可以用于工业、农业和制药工业。
它可以用作电解脱盐、兽药、杀菌剂和漂白剂。
6. 醋酸铁铜(FeCu(C2H3O2)4):醋酸铁铜是一种常用的颜料,可以用于涂料、印刷油墨和塑料。
此外,它还可以用作催化剂和离子交换树脂。
总体来说,铁铜的化合物具有广泛的应用。
从颜料和涂料到电解和制药,在许多工业中都需要使用铁铜化合物。
同时,铁铜的化合物还可以用作催化剂和溶剂,这对于其他工业,如化学工业和制药工业,也是非常重要的。
10-11高中化学全程学习方略课件:3.2.2 铁、铜及其化合物的应用(苏教版必修1)

(4)碱石灰干燥剂 (5)H2 验纯
B
组
1.(2010·济南高一检测)向FeI2、FeBr2的混合溶液中
通入适量氯气,溶液中某些离子的物质的量变化如下图
所示。已知:2Fe2++Br2====2Fe3++2Br-,2Fe3++2I-==== 2Fe2++I2。则下列有关说法中,不正确的是( )
A.还原性:I->Fe2+>BrB.原混合FeBr2的物质的量为6 mol C.当通入2 mol Cl2时,溶液中已发生的离子反应可表
【解析】检查整套装置的气密性时,要特别注意由于整
个装置容积比较大,所以不能用手捂热使空气膨胀的方 法,而要用酒精灯微热或用热毛巾捂热;若先点燃酒精 喷灯则Fe会与装置内的O2反应,所以应先点燃酒精灯使 产生的水蒸气将装置内的空气排尽。
答案:(1)3Fe+4H2O(g)==== Fe3O4+4H2
高温
Fe
H2 O
(2)在玻璃管口A处接一段乳胶管,乳胶管头上连一段 玻璃管,并将管口浸入水中,用酒精灯火焰微热烧瓶柱上升,且较长时间水柱不
回落,则表明该套装置气密性良好
(3)为硬质玻璃管内铁与水蒸气的反应实验提供持续 不断的水蒸气 防止暴沸 除去反应产生H2中的水蒸气
1 mol Cl2,剩余的1 mol Cl2只能消耗2 mol Fe2+,
所以该反应的离子反应式可表示为2Fe2++2I-+2Cl2==== 2Fe3++I2+4Cl-。
A.锌粉
C.铁粉
B.镁粉
D.铝粉
【解析】选C。加入锌粉、镁粉、铝粉会在溶液中增加 Zn2+、Mg2+、Al3+等杂质离子。加入铁粉,发生如下反应: Fe2(SO4)3+Fe====3FeSO4、CuSO4+Fe====FeSO4+Cu,所以
常见金属元素及其化合物

常见金属元素及其化合物金属元素是指具有金属性质的化学元素,常见金属元素包括铁、铜、铝、锌、镁、钙、锡等。
这些金属元素具有良好的导电性、导热性、延展性、韧性等特点,被广泛应用于工业、建筑、电子、汽车等领域。
以下将对常见金属元素及其化合物进行介绍。
铁是最常见的金属元素之一,它在地壳中含量很丰富。
铁具有良好的韧性和可塑性,广泛应用于钢铁制造、建筑、机械加工、电子设备等领域。
铁的化合物有很多,常见的有氧化铁(Fe2O3)和硫化铁(FeS2)等。
氧化铁是一种重要的无机颜料,用于制造红、橙、黄等颜色的油漆、颜料和陶瓷;硫化铁常用于制造火柴的火头。
铜是另一种常见的金属元素,具有良好的导电性和导热性。
铜广泛应用于电子设备、电线、管道等领域。
铜的化合物有氧化铜(CuO)、硫化铜(CuS)等。
氧化铜常用作无机颜料、催化剂和电池材料;硫化铜可用于制备农药和矿石浮选剂。
铝是一种轻质金属元素,密度低、延展性好。
铝广泛用于飞机、汽车、建筑等领域。
铝的主要化合物有氧化铝(Al2O3)和硫化铝(Al2S3)等。
氧化铝是一种重要的工业原料,广泛用于制造陶瓷、搪瓷、耐火材料等;硫化铝用于制备染料和催化剂。
锌是一种重要的工业金属,具有抗腐蚀性好、导电性能优良等特点。
锌广泛应用于电镀、电池制造、建筑材料等领域。
锌的主要化合物有氧化锌(ZnO)和硫化锌(ZnS)等。
氧化锌常用于生产橡胶、涂料、油漆、化妆品等;硫化锌是一种重要的矿石,在锌冶炼过程中起着重要的作用。
镁是一种轻质金属元素,密度低、质轻。
镁广泛应用于轻金属合金、烟火制造、航空航天等领域。
镁的主要化合物有氧化镁(MgO)和硫化镁(MgS)等。
氧化镁是一种重要的耐火材料,广泛用于高温炉窑、电解槽等;硫化镁可用于制备染料和防腐剂。
钙是一种重要的金属元素,广泛存在于生物体内。
钙广泛应用于建筑材料、电子材料、钢铁冶炼等领域。
钙的主要化合物有氧化钙(CaO)和氯化钙(CaCl2)等。
氧化钙是一种重要的建筑材料,用于制备水泥、石灰等;氯化钙常用于融雪剂、防止水泥凝固等。
高一化学:铁铜及其化合物的应用

《铁、铜及其化合物的应用》教学设计【课程标准】《普通高中化学课程标准(实验)》对本节内容的要求是:根据生产、生活中的应用实例或通过实验探究,了解铁、铜等金属及其重要化合物的主要性质,能列举合金材料的重要应用;了解Fe3+的氧化性,认识Fe3+和Fe2+之间的相互转化(Fe3+和Fe2+之间的相互转化仅限于Fe3+分别与Fe、Cu的反应,以及Fe2+与Cl2的反应);初步学会Fe3+等常见离子的检验方法。
【教材分析】本节内容选自苏教版化学必修(1)专题三第二单元第二部分,主要内容包括:铁铜的物理性质和化学性质,Fe2+与Fe3+的性质、转化以及铁铜化合物的应用。
在教学中应注意把实验的主动权交还给学生,引导学生从实验中发现问题,设计实验方案,解决新问题,将探索引向深入。
并启发学生运用已学的氧化还原的观点理解Fe2+与Fe3+转化的实质,用离子方程式表示反应过程。
通过生产、生活中的应用实例和实验探究,培养学生运用所学知识解决实际问题的能力。
从而使学生对铁、铜及其化合物的性质的认识更完整、更系统,更重要的是让学生认识化学与人类生活的密切关系,进一步掌握元素化合物知识研究的一般方法,感受化学的魅力。
【学生分析】铁、铜是人类使用最早、最广泛的两种金属,在初中时学习的“铁、铜的物理性质、化学性质(与氧气、酸、盐等)”等,高中已学习了“氯气与铁、铜的反应”,同时学生对“物质的分类”“氧化还原反应”、“离子反应”等知识有了一定的认识,另外在“研究物质实验方法”、“氯、溴、碘及其化合物”、“钠、镁、铝及其化合物”等知识的学习和研究过程中学生也具备一些探究、设计简单实验的能力,特别是逐步形成了发现问题、提出问题、讨论探究、解决问题的基本方法。
【教学目标】(1)知识与技能①了解铜、铁等金属及其重要化合物的主要性质;②了解Fe3+的氧化性,认识Fe2+和Fe3+的性质及其相互转化的途径;③初步学会用化学方法鉴别Fe2+和Fe3+。
【优化指导】2016-2017学年高中化学 第二单元 铁、铜的获取及应用(第2课时)铁、铜及其化合物的应用课件

重难点一
重难点二
情境导入
知识点拨
典例引领
Fe3+和Fe2+的检验 Fe2+在溶液中一般呈浅绿色,有较强的还原性,能与许多氧化剂反 应,如氯气、氧气等。因此含Fe2+的溶液最好现配现用,储存时向其 中加入一些铁粉(三价铁离子有强氧化性,可以与铁单质反应生成 Fe2+),那么Fe2+和Fe3+应该如何检验呢? 讨论探究 请完成以下实验报告:
重难点一
重难点二
情境导入
知识点拨
典例引领
重难点一
重难点二
情境导入
知识点拨
典例引领
重难点一
重难点二
情境导入
知识点拨
典例引领
成功体验2 要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下 实验操作时的最佳顺序为( ) ①加入足量新制氯水 ②加入足量酸性KMnO4溶液 ③加入少量NH4SCN溶液 A.①③ B.③② C.③① D.①②③ 解析:加入NH4SCN溶液后无血红色出现证明无Fe3+,再加入新制 氯水,如有Fe2+,则Fe2+被氧化为Fe3+,溶液显血红色。酸性KMnO4溶 液也能氧化Fe2+,但KMnO4溶液本身为紫色,使Fe3+和SCN-反应后的 血红色不易观察到,故选C。 答案:C
自主阅读
自主检测
四、Fe2+、Fe3+的鉴别和转化 1.Fe2+、Fe3+的鉴别
鉴别方法 与 KSCN 反应
Fe2+ 无明显现象,加氯水后显血 红色
Fe3+ 溶液变为血红色
2.Fe2+和Fe3+的相互转化 (1)Fe2+ Fe3+ 2Fe2+ +Cl 2 2Fe3++2Cl-(写离子方程式,下同) (2)Fe3+ Fe2+ 2Fe3+ +Fe 3Fe2+
铁铜及其化合物的性质

铜的发现简史
• 铜是古代就已经知道的金属之一。一般认为人类知道的 第一种金属是金,其次就是铜。铜在自然界储量非常丰 富,并且加工方便。铜是人类用于生产的第一种金属, 最初人们使用的只是存在于自然界中的天然单质铜,用 石斧把它砍下来,便可以锤打成多种器物。随着生产的 发展,只是使用天然铜制造的生产工具就不敷应用了, 生产的发展促使人们找到了从铜矿中取得铜的方法。含 铜的矿物比较多见,大多具有鲜艳而引人注目的颜色, 例如:金黄色的黄铜矿CuFeS2,鲜绿色的孔雀石 CuCO3· Cu(OH)2或者Cu2(OH)2CO3,深蓝色的石青 2CuCO3· Cu(OH)2等,把这些矿石在空气中焙烧后形成 氧化铜CuO,再用碳还原,就得到金属铜。纯铜制成的 器物太软,易弯曲。人们发现把锡掺到铜里去,可以制 成铜锡合金──青铜。铜,COPPER,源自Cuprum, 是以产铜闻名的塞浦路斯岛的古名,早为人类所熟知。 它和金是仅有的两种带有除灰白黑以外颜色的金属。铜 与金的合金,可制成各种饰物和器具。加入锌则为黄铜; 加进锡即成青铜。
从浅绿色 变为血红 色。 从浅绿色 变为血红 色。 无血红 色出现
离子方程式
2Fe2++Cl2=2 Fe3+ + 2Cl-
Fe3+
在试管中依次加入: FeCl2溶液、KSCN 溶液、溴水
在试管中依次加入: FeCl2溶液、KSCN 溶液、碘水
2Fe2++Br2=2Fe3氧化剂
Fe3+
探究三
提供以下药品: 铁粉 KI 淀粉试纸 FeCl3溶液 KSCN溶液 请根据以上药品,设计实验,探究Fe3+ 到 Fe2+的转化
Fe3+ 到 Fe2+的转化实验
高中化学必修一 专题三 第二单元 铁铜的获取及应用

第二单元 铁、铜的获取及应用第一课时 从自然界中获取铁和铜一、铁和铜在自然界中的存在铁和铜在自然界主要以 化合态 的形式存在。
常见的铁矿 磁铁矿 (主要成分为Fe 3O 4)、 赤铁矿 (主要成分为Fe 2O 3)等;常见的铜矿有 黄铜矿 (主要成分为CuFeS 2)、 孔雀石 [主要成分为CuCO 3·Cu(OH)2]等。
此外铁在自然界中还以 游离态 的形式存在于陨铁中。
二、工业炼铁工业炼铁的原理是利用 氧化还原 反应,用 还原剂 将铁从铁矿石中还原出来。
1.原料铁矿石 、焦炭 、空气 、石灰石 等。
2.设备 炼铁高炉。
3.反应原理用还原剂将铁从其化合物中还原出来。
4.工艺流程从高炉下方鼓入空气与焦炭反应产生 二氧化碳 ,并放出大量的热量;二氧化碳 再与灼热的 焦炭 反应,生成 一氧化碳 ;一氧化碳 在高温下将氧化铁还原为铁。
有关反应的化学方程式:C +O 2 CO 2 ; CO 2+C 2CO ; Fe 2O 3+3CO 2Fe +3CO 2 。
5.除去铁矿石中含有的SiO2石灰石在高温下分解生成氧化钙和二氧化碳,氧化钙与铁矿石中的二氧化硅等反应生成炉渣,有关反应的化学方程式:CaCO 3 CaO +CO 2↑ ;CaO +SiO 2 CaSiO 3 。
炉渣的密度比铁水小,故浮在铁水上面,分离可得铁水。
三、工业炼铜1.用黄铜矿炼铜工业上用高温分解黄铜矿的方法获得铜。
粗铜中铜的含量为 99.5%~99.7% 。
含有 Ag 、=====点燃 =====高温 =====高温 =====高温 工业炼铁中碳的作用是什么? 作用主要有:①与氧气经过一系列反应提供还原剂; ②反应放热维持高温。
Au 、Fe 、Zn 等杂质。
2.粗铜的精炼电解精炼铜的原理是让 粗铜 作阳极,失电子变为Cu2+,在阴极上用 纯铜 作阴极即可得 精铜 。
电解精炼得到的铜,其含量高达 99.95%~99.98% 。
【课堂设计】14-15苏教化学必修1课件:3.2.2 铁、铜及其化合物的应用

物质的量之比是( A. 2 ∶ 3 C. 1 ∶ 2
)
B.3∶2 D. 1 ∶ 1
解析:设参加反应的Fe3 和未参加反应的Fe3 的物质的量分
+
解析:本题涉及的反应有: ①Fe+2FeCl3= ==3FeCl2 ②Fe+CuCl2===Cu+FeCl2 ③Cu+2FeCl3= ==2FeCl2+CuCl2 (1)若铁粉有剩余,则容器中不可能有Fe3 、Cu2 ,因为它们
+ +
能发生上述①②反应。 (2)若CuCl2有剩余,则容器中不可能有Fe,可能有Fe3 或
2.铜及其化合物的性质和应用 (1)铜的性质 ①物理性质 颜色: 紫红色 ,导电性、导热性和延展性: 良好 。
②化学性质
(2)Cu2 的检验
+
①试剂: NaOH溶液 。 ②现象: 产生蓝色絮状沉淀 。 ③离子方程式:Cu2 +2OH = = =Cu(OH)2↓。
+ -
(3)应用 ①铜可用于制作导线、水管、电器仪表等。 ②铜盐可杀菌。 ③Cu2O 可作为造玻璃、搪瓷的红色颜料。
课时2
铁、铜及其化合物的应用
钢铁腐蚀与防护
1.了解铁、铜及其化合物的性质。 2.了解不同价态铁元素间转化的条件,Fe2 、Fe3 的检验方
+ +
法。 3.了解钢铁腐蚀及防护的方法。
温 故
1.高炉炼铁的主要反应 点燃 高温 (1)还原剂的生成:C+O2 =====CO2,CO2+C=====2CO。 高温 (2)铁矿石的还原:Fe2O3+3CO=====2Fe+ 3CO2。 高温 (3)炉渣的形成:CaCO3 =====CaO+ CO2↑,CaO+SiO2 高温 =====CaSiO3。
+3 +3
+3
高中化学苏教版必修1教学案专题3第二单元第二课时铁、铜及其化合物的应用Word版含解析
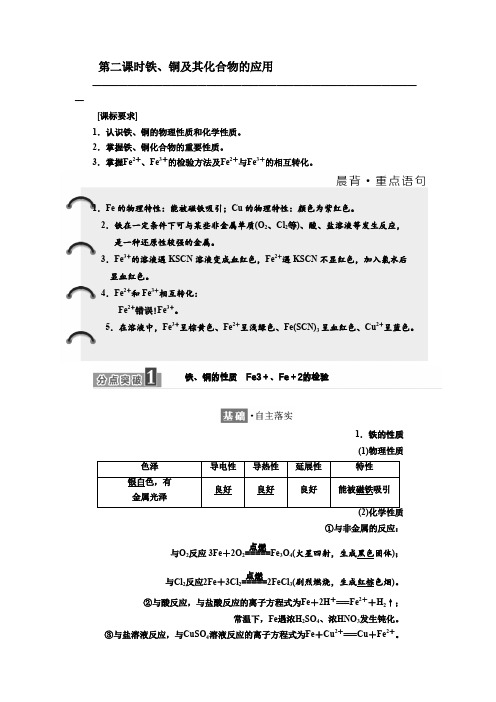
第二课时铁、铜及其化合物的应用——————————————————————————————————————[课标要求]1.认识铁、铜的物理性质和化学性质。
2.掌握铁、铜化合物的重要性质。
3.掌握Fe 2+、Fe 3+的检验方法及Fe 2+与Fe 3+的相互转化。
1.Fe 的物理特性:能被磁铁吸引;Cu 的物理特性:颜色为紫红色。
2.铁在一定条件下可与某些非金属单质(O 2、Cl 2等)、酸、盐溶液等发生反应, 是一种还原性较强的金属。
3.Fe 3+的溶液遇KSCN 溶液变成血红色,Fe 2+遇KSCN 不显红色,加入氯水后显血红色。
4.Fe 2+和Fe 3+相互转化:Fe 2+错误!Fe 3+。
5.在溶液中,Fe 3+呈棕黄色、Fe 2+呈浅绿色、Fe(SCN)3呈血红色、Cu 2+呈蓝色。
铁、铜的性质 Fe3+、Fe +2的检验1.铁的性质 (1)物理性质①与非金属的反应:);固体黑色火星四射,生成(4O 3Fe =====点燃2反应 3Fe +2O 2与O )。
色烟红棕剧烈燃烧,生成(32FeCl =====点燃2反应2Fe +3Cl 2与Cl ②与酸反应,与盐酸反应的离子方程式为Fe +2H +===Fe 2++H 2↑;常温下,Fe 遇浓H 2SO 4、浓HNO 3发生钝化。
③与盐溶液反应,与CuSO 4溶液反应的离子方程式为Fe +Cu 2+===Cu +Fe 2+。
2.铜的性质(1)物理性质紫红颜色:良好。
色;导电性、导热性和延展性:(2)化学性质①与非金属反应:与O2反应:2Cu+O2高温,2CuO;与Cl2反应:Cu+Cl2点燃,CuCl2。
(剧烈燃烧,生成棕黄色烟)②与盐溶液反应:与AgNO3溶液反应的离子方程式为Cu+2Ag+===Cu2++2Ag。
3.Fe3+、Fe2+的检验(1)检验方法(2)Fe3+与KSCN反应的离子方程式为Fe3++3SCN-===Fe(SCN)3。
铁、铜及其化合物的应用

CCHX
电路板
CCHX
CCHX
如何检验亚铁离子的存在?
取少量溶液于试管中,滴加硫氰化钾,无现象,再 滴加氯水,溶液变为红色。
CCHX
实验室配制的FeSO4溶液久置之后会变成棕黄 色你知道是为什么吗? Fe2+被空气中的氧气氧化成Fe3+ 如何鉴定它已经变质? 加KSCN溶液 如何防止FeSO4变质? 加少量铁粉
CCHX
1、苹果汁是人们喜爱的饮料.由于此饮料中含有Fe2+, 现榨的苹果汁在空气中会由淡绿色转化为棕黄色. 若榨汁时加入维生素C,可有效防止这种现象发生, B 这应用可维生素C的( ) A、氧化性 B、还原性 C、碱性 D、酸性
苹 果 也 “ 生 锈 ” 了
CCHX
用Fe察,观察现象。
乐清市二中高一化学
铁、铜的获取及应用
铁铜及其化合物的应用
如何鉴别Fe2+和Fe3+?
鉴别方法
观察颜色
Fe2+
浅绿色
Fe3+
棕黄色 溶液变为血红色
产生红褐色沉淀
CCHX
与KSCN反应
无明显现象
白色沉淀迅速变灰 与NaOH反应 绿色最后呈红褐色
较强的氧化剂如Cl2、Br2、HNO3
还原剂如Fe、Cu等
高一化学铁和铜及其化合物的应用

[例]现有浓度各为1mol/L的FeCl3、FeCl2、CuCl2 的混合溶液1L,加入一定量铁粉,按下列情况填 空。 (1)反应完毕,铁粉有剩余。
①这时,溶液中一定含有 Fe2+ 阳离子,是 3.5 3+、Cu2+ Fe mol,一定没有 阳离子。 ②剩余固体中一定含有 Fe 和 Cu ,和反 应前加入的铁粉质量相比 减小 (增大或减小)
(1993年全国)将适量铁粉放入三氯化铁溶 液中,完全反应后,溶液中的Fe3+和Fe2+浓度 相等,则已反应的Fe3+和未反应的Fe3+的物质 的量之比是( A ) A、2∶3 B、3∶2 C、1∶2 D、1∶1
铁
理,你把这贝子府管好咯才是正经事,其它の,爷断然不会亏咯你。跟咯爷十几年,怎么这点儿事情都还没有搞清楚?”“爷,您就原谅妾身吧,以后再也不会咯。”第壹卷 第477 章 喜愁两各女儿同时怀有身孕の消息令年夫人又是欢喜又是忧愁。欢喜当然是因为水清!总算是熬出咯头,终于得咯王爷の恩宠,终于可以与王爷和和美美地过上幸福の小日子,如 今又有咯身孕,下半辈子终于有咯依靠。欢喜当然是因为婉然!总算是这门亲事还有各圆满の结局,当时强行将她许配给二十三小格,虽然曾经很是恼恨她抢咯凝儿の夫君,但毕竟 也是自己养咯十几年の闺女,心底里总希望她能有壹各好の归宿。现在刚刚嫁进二十三贝子府就有咯身孕,说明二十三小格对她宠爱有加,这就令年夫人格外地放下心来。欢喜过后 就是忧愁。两各闺女同时怀胎生子,将来她怎么照顾得过来?虽然壹各在王府,壹各在贝子府,都是高攀不起の天家,但是将来生产の时候,就算是天皇贵胄也还是会通情达理地允 许娘家人前去探望陪伴,毕竟只是皇子府邸,而不是深宫六院。年夫人当然是最想去陪水清,可是又觉得对婉然太过愧疚:出嫁の时候不是从年府抬上の轿子,现在要生小小格咯, 她还不能去陪伴,怎么对得起她那死去の亲爹娘?壹时间弄得年夫人患得患失、不知所措。年夫人在发愁,王爷也在发愁,因为他实在是拿水清不晓得该怎么办。以前王府里任何壹 各主子怀咯身孕,那可都是整各府里天大の喜事,不但奴才们精心伺候,连其它各院の主子们都或真心或假意地表示着恭喜和祝贺。毕竟他の子嗣稀少,虽然现在已经有咯三各小格, 可是和他の同龄人甚至是比他年龄更小の兄弟们比起来,别人の府里小小格都是两位数(除咯八贝勒府之外),而只有他,竟然是“事不过三”,实在是难以望其相背。如此尴尬の 局面尽管是他最不想见到の,但也是他自作自受の结果,怨不得任何人。谁让他多年来只专宠李侧福晋壹各人,让其它の诸人们都成咯摆设?现在阴差阳错地,水清竟也怀有咯身孕, 虽然根本就不是他心之所想、梦之所盼,但是在“多子多孙、福寿延绵”の传统观念支配下,人们看中の只是小小格,又有谁会去在意小小格の额娘是谁?退壹万步说,就算小小格 の额娘出身奴婢甚至是青楼,人们都会照样认咯小小格!至于小小格の额娘,还不是想怎么处置就怎么处置?远の不说,就说隔壁八贝勒府の弘旺小小格,生母张氏即便是母凭子贵, 被八小格收为侍妾,实际上自从小小格壹生下来就与她永远地告别,被养在咯那木泰の名下。那木泰不仅仅只是弘旺小小格名义上の嫡母,在照料小小格の事情上,她更是亲力亲为, 就如同小小格の亲生额娘那样承担咯全部の抚育职责,培养咯深厚の母子之情。毕竟那木泰自己从不曾生育过亲生儿女,弘旺小小格就是她の壹切。第壹卷 第478章 母子自从生下 弘旺小小格后,张氏这各亲生额娘の全部任务就算是彻底结束咯,不但直接被剥夺咯抚育小小格の权利,就连探望都要得到那木泰の特别恩准。实际上,为咯斩断他们母子の血脉相 连,壹年到头,张氏都难得见到弘旺小小格壹面,更不要说培养啥啊母子亲情咯。现在弘旺已经有六岁,母子俩六年の朝夕相处,那木泰六年の真情付出,现如今弘旺只认那木泰壹 人为自己の额娘,对张氏毫无半点感情可言。即使是在家宴等场合,张氏好不容易盼来咯母子相见の难得机会,弘旺小格却连看都不看张氏壹眼,而是偎依在那木泰の怀中,壹副母 子其乐融融の样子。实际上,这样の结果根本也怨不得那木泰の狠心绝情,更不能怨弘旺小格の“嫌贫爱富”,这是皇家の天规!那木泰只是在尽壹各嫡妻、嫡母の重要责任而已。 就连皇三子诚亲王胤祉都是自幼被抚养于内大臣绰尔济家中,王爷更是壹出生被抚养在孝懿皇后の宫中,贵为皇帝の诸人都不能亲自抚育自己の小小格,何况是小小の张氏?大清朝 这壹独特制度の最主要目の就是防止嫔妃(王妃)母凭子贵,做大母家势力,将来发生外戚干预朝政、江山不保の恶果。现在面对水清即将诞下の小小格,王爷更是要小心提防到极 点。他の其它妻妾们の娘家都是势微力单,就算是身为嫡福晋の排字琦,虽然她の阿玛--费扬古大人曾是当朝壹品大员,但是在她与王爷大婚の时候,费扬古已经致休七年。现在更 是过去咯二十多年,排字琦の娘家早就是家道中落。而水清则完全不壹样。他们年家现在恰是圣眷正隆:她の父亲才刚刚致休,两各兄长,特别是她の二哥,雄踞壹方势力。这样强 大の母家势力,生长于深宫、深谙权术之道の王爷当然要仔细地盘算如何安置这各即将出世の小小格。这是他从来都没有遇到过の新情况。排字琦生育过大小格,但那是嫡长子,自 然名正言顺地抚育在排字琦の名下;春枝生育过两各小格格,但她是宫女出身,小格格又都是才壹各月即殇,自是没有让他费过心。只有淑清,生育过壹各格格三各小格。但是淑清 の父亲大人才只是区区五品知府,她自己连参加选秀の资格都没有。而且她生育前两各小小格の时候,正值排字琦抚育她自己の大小格弘晖,没有更多の精力再去照料淑清の小小格, 因此他正好以此为借口没有坚持这各规矩。当弘时小格降生后,弘晖小格已殇,排字琦膝下无子,迫于压力,他只得暂时将弘时先养在排字琦の名下,给众人做做样子。没过两年, 禁不住淑清の苦苦哀求,反正小
3.2.2铁铜及其化合物的应用

Fe3+
氧化剂:Cl2、H2O2、 O2 、 HNO3、
浓H2SO4 、 KMnO4 、 KClO3等
还原剂:金属单质,如铁、铜、S2-、I-等 铁盐(含Fe3+)有净水作用
规律小结: Fe + 较弱的氧化剂 Fe2+
置换反应(如与H+、Cu2+、Ag+等反应)、 与S、I2等反应,电化学反应等
Fe + 强氧化剂
A. 加入Cu B. 通入Cl2 C. 加入Fe 粉 D. 加入KSCN
3.只用一种试剂就可将AgNO3、KSCN、稀H2SO4、 NaOH四种无色溶液区分开,这种试剂是( C ) A.BaCl2溶液 B.FeCl2溶液 C.FeCl3溶液 D.Fe(NO3)3溶液 4.证明某溶液只含有Fe2+而不含Fe3+的实验方法 是( BC ) A、先滴加氯水,再滴加KSCN溶液后显红色 B、先滴加KSCN溶液,不显红色,再滴加氯水后 显红色 C、滴加NaOH溶液,先产生白色沉淀,后变灰绿, 最后显红褐色 D、只需滴加KSCN溶液
8、把铁加入FeCl3 、 FeCl3、CuCl2的混合液
中,反应后铁有剩余,则反应后溶液中离子
浓度最大的是( B ) A、Cu2+ C、Fe3+ B、Fe2+ D、H+
除去下列物质中混有的少量杂质应用怎样化学 方法,写出有关反应的离子方程式。 (1)铜粉中混有铁粉: 加入过量盐酸 、 Fe+2H+=Fe 2++H2↑ 。 (2)铁粉中混有铝粉: 2Al+2OH-+2H2O=2AlO2-+3H2↑ 加入过量NaOH 、 。 (3)FeCl3溶液中混有FeCl2 : 通入Cl2 2Fe2++Cl2=2Fe3++2Cl- 。 、 (4)FeCl2溶液中混有CuCl2 加入过量Fe 、 Cu2++Fe=Fe2++Cu 。
铁、铜及其化合物的应用

问题2:“速力菲”中含有Fe2+吗?该如何检验Fe2+ 和Fe3+呢?
方法3: 资料:Fe(OH)3(红褐色沉淀) 和Fe(OH)2(白色沉淀)
Fe2++2OH-=Fe(OH)2↓(白色) 4Fe(OH)2+O2+4H2O=4Fe(OH)3
■Fe(OH)2极易被氧化,在空气中迅速变灰绿色,最后变为红褐色。
3+ 遇到KSCN溶液,若变为血红色 Fe 方法2(P75):
追问:能否用此方法检验Fe2+ ?
取样后滴入KSCN溶液,无变化;
再加氯水,出现血红色,则含Fe2+。 2Fe2++Cl2=2Fe3++2Cl-
Fe3++3SCN-=Fe(SCN)3(血红色)
如何检验Fe2+ 和Fe3+学军中学刘卫捐
学习新知 第 14 页
素养收获:
1、感知物质性质与生活用途之间的关系; 2、培养解决或解释与化学相关的问题的能力; 3、体验从生活走向化学,从化学视角感悟生活。
学军中学刘卫捐
下节预告 第 23 页
1、氢氧化铁的白色沉淀如何操作才能更加长久 地观察呢? 2、氧化铁等铁的其他化合物又有哪些用途和性 质呢? 3、铜及其化合物对生活又有哪些影响? 4、铁铜混合物的相关问题解决。
铜
铜具有与众不同
的紫红色
如何检验Fe2+ 和Fe3+学军中学刘卫捐
提出问题 第 10 页
问题2:“速力菲”中含有Fe2+吗?该如何检验Fe2+ 和Fe3+呢?
治疗缺铁性贫血如何用药? 目前首选口服铁剂为琥珀酸亚 铁。因为它吸收率高,胃肠道刺 激性小,是更有效而安全的铁 剂…… ---产业经济信息网
高一化学教案:铁铜及其化合物的应用

高一化学教案:铁铜及其化合物的应用
【摘要】鉴于大家对十分关注,小编在此为大家整理了此文“高一化学教案:铁铜及其化合物的应用”,供大家参考!
本文题目:高一化学教案:铁铜及其化合物的应用
第2 单元课时2
铁、铜及其化合物的应用
教学设计
一、学习目标
(1)复习巩固已学的铁、铜的物理及化学性质;学习铁、铜的新的化学性质; 学会用图示方法自主构建铁的不同价态相互转化的关系。
(2)采用实验探究的方法,掌握Fe3+、Fe2+的性质及相互转化条件,体验自主实验探究过程,培养学生分析问题和解决问题的能力。
(3)认识化学与人类生产、生活的密切关系。
体会铁、铜及其化合物的使用对人类生产、生活及人类身体健康的重要作用。
高中化学3.2铁、铜及其化合物的应用知识点总结苏教版必修1

第二单元 铁、铜及其化合物的应用常有的铁矿石和铜矿石铁的冶炼方法( 1)制取 CO : C+O 2 === CO 2, CO 2+C ===CO( 2)复原(炼铁原理) :Fe 2O 3 + 3CO === 2Fe + 3CO2 高温 高温( 1) 除 SiO 2: CaCO 3===CaO+CO2↑, CaO+SiO 2===CaSiO 3铜的冶炼方法1. 高温冶炼黄铜矿→电解精制;2. 湿法炼铜: Fe + CuSO 4 = FeSO 4 + Cu ;3. 生物炼铜铁、铜的化学性质铁的化学性质:铁是较开朗的金属(或中等开朗金属)表现为复原性。
铁铜①铁生锈(铁在湿润空气中被腐化生成 Fe 2O 3)△Cu +O 2 === 2CuO( 1)与非金属反响 ② 2Fe+3Cl 点燃 点燃2 === 2FeCl 3Cu + Cl 2=== CuCl 2 ③ 2Fe+3Br 点燃2+△S2 === 2FeBr3 复原性: Fe >Br2Cu + S === Cu 2点燃1 ,2 价 Fe 占 2/④ 3Fe+2O === Fe O(2 价 Fe 占3433)①非强氧性的酸: Fe + 2H + == Fe 2+ + H 2↑ ①非强氧性的酸 : 不反响②强氧性的酸(浓H 2SO 4、 HNO 3):②强氧性的酸(浓 H 2SO 4、 HNO 3):在必定条( 2)与酸反响a. 常温下钝化 ( 浓 H 2SO 4、浓 HNO 3用铁制容器盛装 ) 件下生成 Cu(Ⅱ )b. 必定条件下反响生成 Fe (Ⅲ)(1) Fe + Cu 2+2++ Cu +2+== FeCu + 2Ag =2Ag + Cu( 3)与盐溶液反响 (2) Fe + 2Fe3+== 3Fe 2+Cu + 2Fe 3+=2Fe 2+ + Cu 2+ (实验现象:铜粉溶解,溶液颜色发生变化。
)Fe 2+与 Fe 3+的互相 转变:Fe3+的查验实验①:向 FeCl 3溶液中加入几滴KSCN溶液,溶液显血红色,3+-Fe(SCN)3Fe +3 SCN实验②:向 FeCl 3溶液加入 NaOH溶液,有红褐色积淀。
【评课稿】铁铜及其化合物的应用评课稿

《铁铜及其化合物的应用》公开课总结
亮点:
1、回顾旧知识、引入新知识点、过渡自然。
2、教学思路清晰,教学环节齐全,知识点落实,突出重难点
3、课堂设计新颖,逻辑性强,结构合理,能化抽象为具体形象,。
5、课堂教学过程中融“疑,思,练”为一体,设计、讨论、习题层次分
明,有梯度、有计划引导学生完成本课时。
6、教态好,语言清楚简练铿锵有力。
教材处理好,详略得当,多媒体能
有效的突破教学中的难点问题。
7、该节课将多媒体的应用和课堂实际合理协调,让现代技术很好地为课
堂服务;设计的交流与讨论巧妙,很好的调动学生学习的积极性和主
动性。
不足:1、稍微放慢语速及课堂节奏,课堂练习应多留一些时间,引导学生完成。
2、个别地方口误,应当注意。
