中药饮片备案申请表
医疗机构炮制中药饮片备案申请表

用法用量
附 件
■《医疗机构执业许可证》复印件
■从事制备中药饮片工作的药学技术人员名册
■从事直接接触中药饮片工作人员的有效健康证明复印件
■制备场所布局图
■与制备及检验中药饮片相适应的设施设备目录
■质量标准和制备工艺
■市场上没有供应品种的证明文件
声 明
我们保证:①本申请遵守国家法律法规的规定;②申请表内容及所提交备案的资料均真实,未侵犯他人的权益,一并提交的电子文件与打印文件内容完全一致。
申请人:
法定代表人(签字):
日期: 年 月 日 (公 章)制备中药饮片备案表
备案日期 年 月 日 编号:
备
案
机
构
信
息
单位名称
(加盖公章)
《医疗机构执业许可证》编号
地址
联系人
联系电话
法定代表人
联系电话
中
药
饮
片
基
本
信
息
中药饮片
名 称
通用名称
汉语拼音
药材来源
(产 地)
饮片规格
主要制备工艺(含辅料)
辅料信息
名 称
生产企业
执行标准
包装材料信息
名 称
生产企业
执行标准
增补品种中药饮片炮制规范申请表

声 明
我们保证:本申请表内容及所提交的资料、样品均真实、来源合法,未侵犯他人的权益,其中试验研究的方法和数据均为本中药饮片所采用的方法和由本饮片得到的试验数据。
如查有不实之处,我们承担由此导致的一切法律后果。
品种名称
申请
药用历史文献资料及
固定电话
移动电话
参加研究单位
安全性文献记载情况
□文献记载为有毒 □文献记载为无毒 □无文献记载
申报资料
申请表
□有
中药饮片名称及命名依据
□有
证明性材料
□有
药用历史文献资料及中药材的资源情况
□有
炮制工艺研究资料
□有
中药饮片炮制规范(草案)及其起草说明
□有
安全性研究资料
□有 □免报
三批样品自检报告书
□有
稳定性研究资料
□有 □免报
与本项目有关的其他资料
□有 □免报
起草单位
法定代表人(签名)
年 月
(加盖公章)
注:本表原件一式四份,报自治区药监局。
中药材的标准情况
□ 国家药品标准附录中收载来源 □ 地方医学流派
□ 中医药文献有记载 □ 我区民间习用
□ 医院及中医师推荐 □我区中医临床用药经验和用药特色
□ 国家药材标准 □ 地方药材标准
起草单位
单位性质
□药品生产企业 □药品经营企业
□医疗机构 □大专院校或科研院所
□其它
起草单位地址
邮政编码
联系人
全国通用中医诊所备案申请表

中医诊所备案信息表编号:注:1、本表格一式三份。
一份由申请人(申请机构)留存,一份由备案的县级人民政府中医药主管部门存档,一份由上级人民政府中医药主管部门存档。
2、执业人员按照实际在诊所执业人员填写,没有的填写无。
3、个人举办的诊所,涉及法人机构事项不需要填写。
填写说明:信息表是拟举办中医诊所备案时需提交的材料之一,个人或法人机构举办中医诊所,均需填写此表。
一、编号(次项审批部门填写)二、具体填写项目说明(一)诊所名称应符合《医疗机构管理条例》及其《实施细则》关于医疗机构命名的要求。
(二)诊所地址为诊所所在的具体地址。
(三)法人名称举办诊所的法人机构法人证书标识的名称。
个人举办诊所的,不填写此项。
(四)法人资质证明编号包括事业单位法人证书、企业法人证书和工商登记执照、社会和行业组织登记证书等。
个人举办诊所的,不填写此项。
(五)法定代表人法人机构举办诊所,法定代表人应填写法人机构法定代表人。
个人举办诊所的,不填写此项。
(六)主要负责人个人举办诊所的,应填写举办人身份证姓名。
法人机构举办诊所的,主要负责人为法人机构任命(聘任)的诊所负责人,并符合《中医诊所备案管理暂行办法》规定要求。
(七)诊所房屋平面布局图指诊所使用房屋按照比例标识,并注明功能分布和面积大小的平面布局图。
(八)诊所设备清单诊所配备的所有设备清单,设备名称应和医疗器械注册证名称一致。
(九)所有制形式1.个人举办诊所的,所有制形式为私人所有制;2.法人机构举办诊所的,所有制形式按照法人机构所有制形式(国有、集体、股份、私有等)确定。
(十)经营性质分为营利性医疗机构和非营利性医疗机构,由申请人自行选择。
(十一)诊疗范围1.诊所仅配备具有规定学历的执业医师,诊疗范围按照1994年原卫生部印发的《医疗机构诊疗科目名录》要求备案诊疗科目。
2.诊所仅配备具有中医(专长)医师资格的医师,诊疗范围按照中医(专长)医师资格考核确定的执业范围进行备案,包括中医药技术方法和治疗病证范围。
中药饮片生产企业新增饮片生产品种备案表.doc
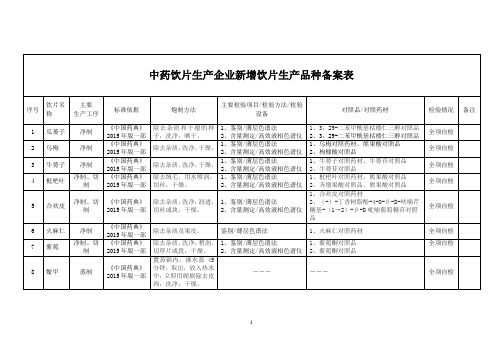
2、牛蒡苷对照品
全项自检
4
枇杷叶
净制、切制
《中国药典》2015年版一部
除去绒毛,用水喷润,切丝,干燥。
1、鉴别/薄层色谱法
2、含量测定/高效液相色谱仪
1、枇杷叶对照药材、熊果酸对照品
2、齐墩果酸对照品、熊果酸对照品
全项自检
5
合欢皮
净制、切制
《中国药典》2015年版一部
全项自检
40
黄芪粉
净制、细粉
《四川省中药饮片炮制规范》2015年版
取黄芪,除去杂质,洗净,干燥,粉碎成细粉。
1、鉴别/薄层色谱法
2、含量测定/高效液相色谱仪
1、黄芪甲苷对照品、黄芪对照药材
2、黄芪甲苷对照品、毛蕊异黄酮葡萄糖苷对照品
全项自检
41
粉葛粉
净制、细粉
《四川省中药饮片炮制规范》2015年版
除去杂质,洗净、干燥,粉碎成细粉。
2、3,29-二苯甲酰基栝楼仁三醇对照品
全项自检
2
乌梅
净制
《中国药典》2015年版一部
除去杂质,洗净,干燥。
1、鉴别/薄层色谱法
2、含量测定/高效液相色谱仪
1、乌梅对照药材、熊果酸对照品
2、枸橼酸对照品
全项自检
3
牛蒡子
净制
《中国药典》2015年版一部
除去杂质,洗净,干燥。
1、鉴别/薄层色谱法
2、含量测定/高效液相色谱仪
2、水葡萄糖对照品、齐墩果酸对照品
全项自检
45
天冬
净制、切制
《中国药典》2015年版一部
除去杂质,迅速洗净,切薄片,干燥。
―――
―――
常州中药饮片备案登记情况汇总表

常州市中药饮片备案登记情况汇总表
序号
供货企业名称
备案登记单位名称
备案品种
1
河南宛西制药股份有限公司
江苏亚邦医药物流中心有限公司
炙甘草、麸炒白芍、麸炒白术、山药、钩藤、当归、丹参、党参片、山楂、佛手、紫苏梗、白芷、百部、夏枯草、前胡、骨碎补白及
常州人寿天医药连锁有限公司
5
南通三越中药饮片有限公司
常州人寿天医药连锁有限公司
炒鸡内金、金钱白花蛇、九香虫、土鳖虫、全蝎、桑螵蛸、百合、乌药、烫狗脊、紫苑、蜜紫苑、海金沙、灵芝、蜜百部、熟地黄、猪苓、当归、醋三棱、陈皮、地骨皮、合欢皮、红花、白术、赤芍、玫瑰花、槐花、丁香、川芎、炒苦杏仁、山楂、栀子、麸炒枳壳、粉萆薢、醋五味子、酒女贞子、紫苏子、炒决明子、淮小麦、醋香附、醋延胡索、天花粉、干姜、广藿香、土茯苓、大血藤、山豆根、酒萸肉、川牛膝、小茴香、盐车前子、车前草、甘松、龙胆、白鲜皮、盐补骨脂、泽泻、党参、金钱草、荷叶、炒酸枣仁、半枝莲、茯神、白花蛇舌草
8
常州泰和国药制品有限公司
常州泰和国药制品有限公司
枸杞子、粉葛、茯苓、党参、麸炒白术、当归、白花蛇舌草、蒲公英、焦栀子、板蓝根、麸炒白芍、茯神、丹参、熟地黄、红花、黄连、鸡血藤、制何首乌、山药、炒麦芽、川牛膝、桂枝、春柴胡、夏枯草、地黄、半枝莲、薤白、炒酸枣仁、桑叶、百合、淫羊藿、大青叶、酒女贞子、川芎、炙黄芪、焦山楂、玉竹、炒苍术、炒菟丝子、酒萸肉、煅牡蛎、醋香附、太子参、防风、炒决明子、牡蛎、麸炒枳壳、天麻、赤芍、炙甘草、鱼腥草、玄参、山楂、郁金、麸炒山药、盐沙苑子、麻黄根、佛手花、牛膝、瘪桃干、燀苦杏仁、醋乌梅、侧柏叶、蝉蜕、蜜紫菀、紫菀、仙茅、盐车前子、大黄、炒苍耳子、荷梗、天花粉、小通草、知母、百部、合欢皮、蒸黄精、鹿角片、白术、五加皮、锁阳、木瓜、桑椹、花椒、娑罗子、骨碎补、炒牡丹皮、酒黄芩、海螵蛸、炒莱菔子、煅珍珠母、石榴皮、仙鹤草、炙鸡内金、蛇床子、牡丹皮、艾叶、薏苡仁、白参片、白鲜皮、巴戟天、甘草、炒赤芍、金沸草、蛇莓、干姜、龙骨、儿茶、煅龙骨、金银花、盐杜仲、制干蟾皮、续断、海金沙、苍术、酒九香虫、土鳖虫、连翘、淡竹叶、黄芪、野菊花、青蒿、木香、榧子、菟丝子、瞿麦、苦丁茶、盐补骨脂、紫河车、矮地茶、铁树叶、荆芥、盐益智仁、炒稻芽、橘络、石燕、鱼脑石、金荞麦、海浮石、煅蛤壳、炒扁豆衣、郁李仁、蜜前胡、前胡、夜明砂、灯心草、刺五加、地肤子、杠板归、白茅根、酒牛膝、侧柏炭、黄芩、秦艽、蜜款冬花、明党参、蜜麻黄、制远志、炒火麻仁、蒲黄炭、辛夷、地枫皮、藕节、鸡内金、挂金灯、猪苓、肿节风、浮小麦、蜜枇杷叶、玉米须、胖大海、龙胆、金钱草、炒党参、酒苁蓉、焦六神曲、旋覆花、蜣螂虫、麸炒泽泻、煨葛根、马齿苋、淮小麦、卷柏
黄山市中药饮片生产企业饮片生产品种备案表
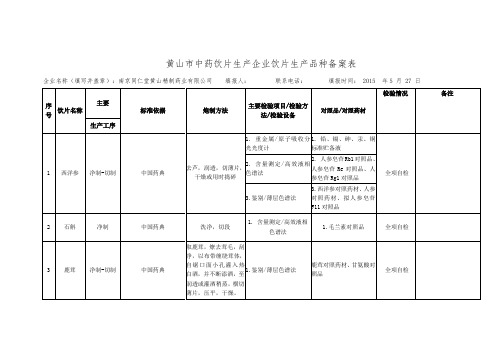
黄山市中药饮片生产企业饮片生产品种备案表企业名称(填写并盖章):南京同仁堂黄山精制药业有限公司填报人:联系电话:填报时间: 2015 年5 月 27 日序号饮片名称主要标准依据炮制方法主要检验项目/检验方法/检验设备对照品/对照药材检验情况备注生产工序1 西洋参净制-切制中国药典去芦,润透,切薄片,干燥或用时捣碎1. 重金属/原子吸收分光光度计1. 铅、镉、砷、汞、铜标准贮备液全项自检2. 含量测定/高效液相色谱法2. 人参皂苷Rb1对照品、人参皂苷Re对照品、人参皂苷Rg1对照品3.鉴别/薄层色谱法3.西洋参对照药材、人参对照药材、拟人参皂苷F11对照品2 石斛净制中国药典洗净,切段1. 含量测定/高效液相色谱法1.毛兰素对照品全项自检3 鹿茸净制-切制中国药典取鹿茸,燎去茸毛,刮净,以布带缠绕茸体,自锯口面小孔灌入热白酒,并不断添酒,至润透或灌酒稍蒸,横切薄片,压平,干燥。
1.鉴别/薄层色谱法鹿茸对照药材、甘氨酸对照品全项自检4 冬虫夏草净制中国药典,安徽省中药饮片炮制规范2005年版取原药材,除去杂质1.含量测定/高效液相色谱法腺苷对照品全项自检5 三七粉直接口服饮片中国药典取三七,洗净,干燥,碾细粉。
1.含量测定/高效液相色谱法人参皂苷Rb1对照品、人参皂苷Re对照品、人参皂苷Rg1对照品、三七皂苷R1对照品全项自检2.鉴别/薄层色谱法6 菊花净制中国药典,安徽省中药饮片炮制规范2005年版取原药材,除去梗、叶及杂质,筛去灰屑1.鉴别/薄层色谱法1.菊花对照药材、绿原酸对照品2.木犀草苷对照品、3,5-O-双咖啡酰基奎宁酸对照品全项自检2.含量测定/高效液相色谱法7 太子参净制《中国药典》2010年版第一增补本取原药材,除去杂质,抢水洗净,干燥1.鉴别/薄层色谱法 1.太子参对照药材全项自检8 金银花净制中国药典,安徽省中药饮片炮制规范2005年版取原药材,除去杂质,抢水洗净,干燥1. 重金属/原子吸收分光光度计1. 铅、镉、砷、汞、铜标准贮备液全项自检2. 含量测定/高效液相色谱法2.绿原酸对照品,木犀草苷对照品9 西红花净制中国药典,安徽省中药饮片炮制规范2005年版取原药材,除去杂质及黄色花丝,除去灰屑1.鉴别/薄层色谱法 1.西红花对照药材全项自检2.含量测定/高效液相色谱法2.西红花苷-I对照品、西红花苷-Ⅱ对照品3.吸光度/紫外分光光度计10 玫瑰花净制中国药典,安徽省中药饮片炮制规范2005年版取原药材,除去梗、叶及杂质,筛去灰屑全项检验11 龙眼肉净制中国药典,安徽省中药饮片炮制规范2005年版取原药材,除去杂质 1.鉴别/薄层色谱法 1.龙眼肉对照药材全项检验12 党参切制《中国药典》2010版第二增补本除去杂质,洗净,润透,切厚片,干燥1.鉴别/薄层色谱法 1.党参炔苷对照品全项检验13 当归净制《中国药典》2010版第一增补本除去杂质,洗净,润透,切薄片,晒干或低温干燥。
医疗机构应用传统工艺配制中药制剂备案表、备案、变更备案、度报告资料要求、取消备案申请表(一)

医疗机构应用传统工艺配制中药制剂备案表、备案、变更备案、度报告资料要求、取消备案申请表(一)随着传统中药的应用广泛,医疗机构应运用传统工艺配制中药制剂,以满足患者对于中药治疗的需求。
然而,这些中药制剂需要进行备案,以确保其质量和安全性。
下面就介绍医疗机构应用传统工艺配制中药制剂备案表、备案、变更备案、度报告资料要求和取消备案申请表的相关内容。
一、备案表医疗机构应先完善备案表,此表格内应该涵盖以下信息:1、生产单位的基本信息,包括单位名称、注册地址、联系方式等;2、制剂名称、剂型、规格和成分;3、制标要求,包括药品标签、说明书的规范、用法、用量等;4、生产工艺、质量控制和稳定性的主要实验结果;5、承担该药品质量负责人的诊所、医院等单位的名称和联系方式。
二、备案完成备案表后,即可进行备案。
地方药监局或省级以上市场监督管理部门应该组织专业人员对备案的中药制剂进行质量监管,确保其符合国家有关法律规定和药典标准。
三、变更备案如果中药制剂需要有关方面进行调整,医疗机构应根据变更情况进行变更备案,并补充修改当前备案表。
变更备案可能包括更改剂型、规格、成分、生产工艺、制标要求等。
四、度报告资料要求每年医疗机构应该向药监局提供中药制剂度报告,该度报告的资料要求包括:1、生产单位的批发销售情况;2、采用的原料、生产设备使用状况等的变化;3、质量监管形势;4、药品质量不合格情况;5、自行召回或举报药品信息等情况。
五、取消备案申请表如果医疗机构需要取消中药制剂的备案,应该在准备取消备案前向备案颁发机构提交取消备案申请表。
该取消备案申请表应包括以下信息:1、药品的名称、剂型、规格,以及生产企业名称和其他必要的信息;2、申请取消备案的理由和依据;3、停产时间等相关信息。
在完成以上内容后,方可申请取消备案。
总之,医疗机构应根据上述规范制定相关制度和文件,严格遵守相关法规和流程,确保中药制剂的质量安全。
中药饮片生产品种备案办事指南

中药饮片生产品种备案办事指南
可参考以下指南:
一、备案办理前准备
1、申报企业必须有营业执照、组织机构代码证书、质量管理体系认
证证书及中药饮片生产许可证等证件。
2、请准备中药饮片备案申报表及中药饮片生产品种备案审核报告。
3、备案申报产品材料包括:包装样品及说明书;证明文件(原材料
认证书、中药饮片生产许可证和中药检测报告);技术文件(配制方法、
生产文件、原料收发记录等),等其他相关材料。
二、备案申报流程
2、提交备案申报材料,经审核签字,提交省级药检机构审核,审核
结果有效期为一年,达到合格标准后发放备案证书。
3、收到备案证书后需要签署备案回执,并缴纳相应费用,缴费后发
放实物备案证书。
三、备案申报注意事项
1、企业及备案产品信息必须真实、准确,不得捏造、更改或隐瞒真
实情况。
2、企业应按省级药检机构要求,及时提供申报材料,保证资料齐全。
3、同一时间内提出的备案申请每次不得超过10个品种,控制申报数量,以保证申报质量。
1486452946药品备案采购审批表
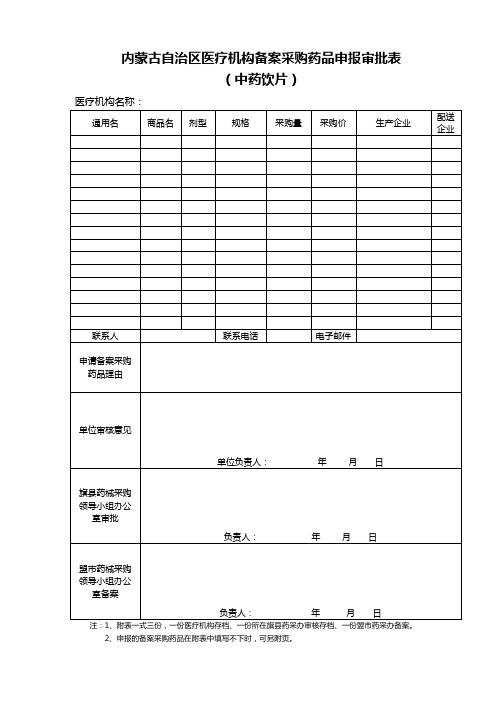
内蒙古自治区医疗机构备案采购药品申报审批表
(蒙成药)
医疗机构名称:
通用名
商品名
剂型
规格
采购量
采购价
生产企业
配送企业
联系人
联系电话
电子邮件
申请备案采购药品理由
单位审核意见
单位负责人: 年 月 日
旗县药械采购领导小组办公室审批
负责人: 年 月 日
盟市药械采购领导小组办公室备案
负责人: 年 月 日
注:1、附表一式三份,一份医疗机构存档、一份所在旗县药采办审核存档、一份盟市药采办备案。
2、申报的备案采购药品在附表中填写不下时,可另附页。
内蒙古自治区医疗机构备案采购药品申报审批表
(耗材)
医疗机构名称:
通用名
商品名
剂型
规格
采购量
采购价
生产企业
配送企业
联系人
联系电话
电子邮件
申请备案采购药品理由
内蒙古自治区医疗机构备案采购药品申报审批表
(中药饮片)
医疗机构名称:
通用名
商品名
剂型
规格
采购量
采购价
生产企业
配送企业
联系人
联系电话
电子邮件
申Hale Waihona Puke 备案采购药品理由单位审核意见
单位负责人:年月日
旗县药械采购领导小组办公室审批
负责人: 年 月 日
盟市药械采购领导小组办公室备案
负责人: 年 月 日
注:1、附表一式三份,一份医疗机构存档、一份所在旗县药采办审核存档、一份盟市药采办备案。
单位审核意见
单位负责人: 年 月 日
进口中药材定点加工或存放企业备案申请表
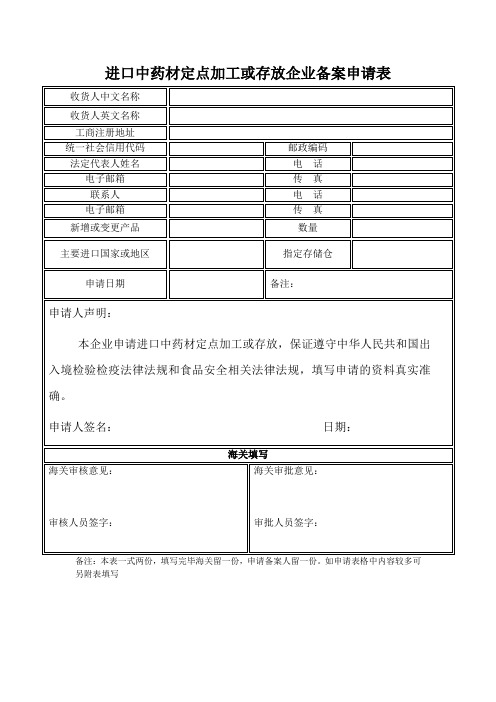
收货人中文名称
收货人英文名称
工商注册地址
统一社会信用代码
邮政编码
法定代表人姓名
电话
电子邮箱
传真
联系人
电话
电子邮箱
传真
新增或变更产品
数量
主要进口国家或ห้องสมุดไป่ตู้区
指定存储仓
申请日期
备注:
申请人声明:
本企业申请进口中药材定点加工或存放,保证遵守中华人民共和国出入境检验检疫法律法规和食品安全相关法律法规,填写申请的资料真实准确。
申请人签名:日期:
海关填写
海关审核意见:
审核人员签字:
海关审批意见:
审批人员签字:
备注:本表一式两份,填写完毕海关留一份,申请备案人留一份。如申请表格中内容较多可另附表填写
药物临床试验审查备案申请表

①依临床试验性质而定,试验需要则必备
②注明版本号或日期,如有英文版本需同时递送
7、研究者手册(注明版本号及日期,如有英文版本需同时递送)
8、研究原始记录(注明版本号及日期,如有英文版本需同时递送)
9、病例报告表(注明版本号及日期,如有英文版本需同时递送)
10、受试者信息卡(注明版本号及日期,如有英文版本需同时递送)
主要研究者签字:
日期:
机构办秘书签字:
日期:
注:上述资料中的某些文件不适用于本研究过程,可删除;以下各项顺序号依次提前。
18、中心伦理的批件复印件,或其他伦理委员会对申请研究项目重要决定的说明
19、试验用药品检验合格报告
20、产品说明书(阳性对照药和已上市产品需要)
21、保险合同
22、申办方相关资质证明:
①包括GMP证书及药品生产许可证等
②或/及申办方委托CRO的证明
23、研究项目经费来源说明
24、其他(如承诺书等)
药物临床试验审查(备案)申请表
项目名称
申请文件
1、CFDA药物临床试验申请受理通知书复印件;
2、关于“自受理缴费之日起60日内,未收到药审中心否定或质疑意见”的说明
3、临床试验方案摘要
4、试验方案(注明版木号及日期,申பைடு நூலகம்方及主要研究者签字或盖章,如有英文版本需同时递送)
5、知情同意书(注明版本号及日期,如有英文版本需同时递送)
11、受试者日记(注明版本号及日期,如有英文版本需同时递送)
12、临床试验小组成员名单(本院)
13、研究者履历(签名,签署日期)
14、研究者GCP证书复印件
15、主要研究者遵照GCP要求开展工作的声明(签名,签署日期)
中药饮片生产品种备案办事指南

中药饮片生产品种备案一、备案项目名称:中药饮片生产品种备案二、备案内容:中药饮片生产企业生产的中药饮片三、备案依据:广东食品药品监督管理局《关于严格中药饮片生产准入及加强监管有关问题的通知》(粤食药监安…2011‟170号)四、备案数量及方式:无五、备案条件:中药饮片生产企业在通过许可和认证后要增加生产品种的六、申请材料目录:资料编号1、《**市中药饮片生产企业生产品种备案表》2份;资料编号2、《备案品种所需对照品、对照药材目录表》资料编号3、备案品种检验所需的对照品、对照药材的购买单据复印件;资料编号4、备案品种的生产工艺验证资料和生产工艺规程,备案品种原药材和加工后中药饮片检验规程,每个备案品种随机提交一批生产记录、一批原药材和加工后中药饮片检验记录(以上均提供复印件);七、申请材料要求:(一)申请材料使用A4纸打印,并装订成册;(二)申请材料中需提交复印件的,申请单位须在复印件中注明“此复印件与原件相符”字样或文字说明,并加盖申请单位红章。
八、申请表格:1、**市中药饮片生产企业生产品种备案表2、备案品种所需对照品、对照药材目录表九、备案申请受理机关:佛山市食品药品监督管理局受理地点:佛山市禅城区榴苑路20号,佛山市食品药品监督管理局安监科十、备案决定机关:佛山市食品药品监督管理局十一、备案程序:申办人提交申请材料——市局安监科审查及出具备案意见——办理备案——核发备案表十四、备案收费:无十五、备案年审或年检:无十六、咨询与投诉机构咨询:**市食品药品监督管理局药品安全监管科十七、受理咨询电话:**市食品药品监督管理局药品安全监管科:82789928**市中药饮片生产企业生产品种备案表企业名称(盖章):填报日期:饮片名称执行标准制法工艺验证报告文件编号工艺规程文件编号委托检验项目注:1、备案表一式两份,须加盖企业印章,其中一份加盖市局安监科印章后由企业保存,另一份存放在市局安监科备案。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
成都市中药饮片备案申请表
企业名称(填写并盖章):填报人:联系电话:填报时间:年月日
序号
饮片名称
主要生产工序
标准依据
炮制方法
主要检验项目/检验方法/检验设备
对照品/对照药材
检验情况
备注
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23Βιβλιοθήκη 24252627
28
29
30
31
32
33
34
35
36
37
38
备注:1、“饮片名称”请填写国家药品标准和地方中药饮片炮制规范收录的饮片名称。
2、有委托检验项目请在备注栏填写检验项目和委托检验单位,无委托检验项目的品种请填写全项自检。
3、申请核减品种仅需填写表格中前四个项目内容,并在备注栏里写明核减。
