铜族元素锌族元素PPT课件
知识总结——铜族元素和锌族元素
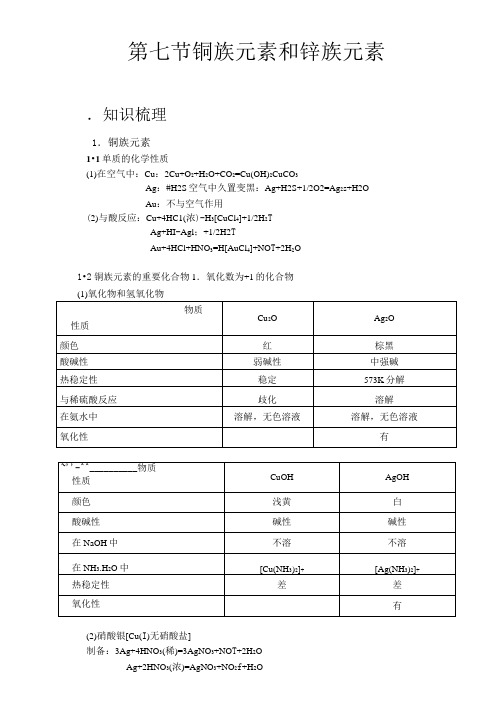
第七节铜族元素和锌族元素.知识梳理1.铜族元素1•1单质的化学性质(1)在空气中:Cu:2Cu+O2+H2O+CO2=Cu(OH)2CuCO3Ag:#H2S空气中久置变黑:Ag+H2S+1/2O2=Ag2s+H2OAu:不与空气作用(2)与酸反应:Cu+4HC1(浓)-H3[CuCl4]+1/2H2TAg+HI-Agl;+1/2H2TAu+4HCl+HNO3=H[AuCl4]+NO T+2H2O1•2铜族元素的重要化合物1.氧化数为+1的化合物(2)硝酸银[Cu(I)无硝酸盐]制备:3Ag+4HNO3(稀)=3AgNO3+NO T+2H2OAg+2HNO3(浓)=AgNO3+NO2f+H2O遇蛋白质生成黑色蛋白银,对有机组织有破坏作用,使用时勿使皮肤接触,在医药上用作消毒剂和腐蚀剂。
大量AgNO3用于制造照相底片上的卤化银,是重要的化学试剂。
(3)卤化物:①CuX2Cu2++2X-+SO2+2H2O-CuX;+4H++SO42-Cu2++2Cl-+Cu-2CuCl-2H[CuCl2]2Cu2++4I-=2CuI;+I2;CuX主要性质:在潮湿含氧环境下稳定性差:4CuCl+O2+4H2O=3CuOCuCl2^3H2O+2HCl8CuCl+O2=2Cu2O+4Cu2++8Cl-在相应卤化物中形成较稳定的卤配离子:CuX+X-=^CuX2-(无色)有一定氧化性:4CuI+Hg=Cu2[HgI4]+2Cu白暗红此反应用于检验实验室空气中的汞含量。
②AgX性质:见光分解:AgBr-Ag+Br因此AgBr用作感光材料。
(4)硫化物:Cu2S,Ag2S:黑色;难溶于水;溶于热浓硝酸3Cu2s+16HNO3(浓)一6Cu(NO3)2+3s;+4NO f+8H2O3Ag2s+8HNO3(浓)一6Ag(NO3)2+3S;+2NO f+4H2O2.氧化数为+2的化合物(1)氢氧化铜和氧化铜CuSO4+2NaOH=Cu(OH)2J+Na2SO4Cu(OH)2O①氧化铜热稳定性:在高温时明显分解2CuO1237K>Cu2O+1/2O2加热可被H2、CO、NH3还原3CuO+2NH3=3Cu+3H2O+N2②氢氧化铜(浅蓝色)微显两性(以碱性为主),可溶于浓强碱:Cu(OH)2+2OH-[Cu(OH)4]2-溶于氨水Cu(OH)2+4NH3^^[Cu(NH3)4](OH)2(2)氯化铜CuCl2无水CuCl2为共价化合物,结构为链状,其中Cu采取dsp2杂化方式。
第16章 铜锌族元素

[Ti(H2O)6
]3+的吸收光谱
可见光互补图
14
§16.2 水溶液体系不同氧化态物种 的氧化-还原性质 的氧化 还原性质
见教材p.196图7-1,△Gθ /F-Z图 图 , 见教材 图
△Gθ /F-Z图: 有关的 φθA / V 图 Cu+/Cu Ag+/Ag Au+/Au (Cu2+/Cu +0.522 +0.80 +1.68 +0.34) Zn2+/Zn Cd2+/Cd Hg2+/Hg (Hg22+/Hg -0.76 -0.40 +0.85 +0.789) M 还 原 性 降 Mn+ 氧 化 性 升
8
主族(除 族金属性、 主族 除IIIA外)和IIIB族金属性、非金 外和 族金属性 因素占主导地位) 因素占主导地位 属性递变规律性 ( r因素占主导地位) IA IIA IIIB……IVA VA VIA VIIA 金 非 属 金 活 属 泼 活 性 泼 渐 性 强 渐 弱
9
4. 熔沸点与升华热 熔沸点与
dx2-y2和 d z2 统称 eg 轨道 群论 ,或dγ 轨道 (晶体场理论), 轨道(群论 群论) 晶体场理论), 晶体场理论
dxy ,dxz 和 dyz 统称 t2g 轨道 群论 ,或dε 轨道 (晶体场理论)。 轨道(群论 群论), 晶体场理论)。 晶体场理论
13
例. [Ti(H2O)6]3+的颜色
o
自由离子 的d 轨道
假想的球型场中 假想的球型场中 球型场 离子的d 例中心离子的 轨道
正八面体场中 正八面体场中 中心离子的d 中心离子的 轨道
《无机化学》课件——第19章 铜副族元素和锌副族元素

2 [ Ag(CN)2 ]- + Zn —— [ Zn(CN)4 ]2- + 2 Ag
闪银矿 Ag2S,角银矿 AgCl 的处 理就有所不同,生成 [ Ag(CN)2 ]- 的 反应如下:
Ag2S + 4 NaCN —— 2 Na [ Ag(CN)2 ] + Na2S
固态 CuCl2 具有链状结构。
每个 Cu 处于 4 个 Cl 形成的 平面正方形的中心:
在浓溶液中 CuCl2 是黄色 的,这是由于生成 [ CuCl4 ]2- 配位单元的缘故。
稀溶液中水分子多, CuCl2 变为 [ Cu(H2O)4 ] Cl2,由于水合 显蓝色。
目前这种方法已经被严令禁 止使用。
另一种方法是氰化法提金,用 NaCN 溶液浸取矿粉,将金溶出:
4 Au + 8 CN- + 2 H2O + O2 —— 4 [ Au(CN)2 ]- + 4 OH-
用 Zn 还原 [ Au(CN)2 ]- 得 Au
2 [ Au(CN)2 ]- + Zn —— [ Zn(CN)4 ]2- + 2 Au
4 Cu2++ 8 OH- + N2H4 —— 2 Cu2O + N2 + 6 H2O
Cu2O 呈弱碱性,溶于稀酸,并 立即歧化为 Cu 和 Cu2+:
Cu2O + 2H+ —— Cu + + Cu2+ + H2O
Cu2O 十分稳定,在 1235 ℃ 熔化但不分解。
Cu2O 溶于氨水,生成无色的 络离子:
2. 铜副族元素的提取
铜副族和锌副族优秀课件

前言
铜副族(I B): 原子核外价层电子的构型 :(n-1)d10ns1 常见氧化态:
铜 (+1,+2 ) 银 (+1) 金 (+1,+3)
铜、银、金被称为“货币金属”。 在自然界中,铜、银、金可以以单质状态、也可以以化 合态存在。
铜储量居世界第三位。以三种形式于自然界:
Cu(OH)2 -0.08 CuO2 -0.360 Cu
Ag2O3 0.739 AgO 0.607 Ag2O 0.342 Ag Au(OH)3 1.45 Au
Zn2+ -0.7618 Zn
Cd2+ >-0.6 Cd22+ <-0.2 Cd
-0.4030
Hg2+ 0.92
Hg22+ 0.789 Hg
自然铜:又称游离铜,很少;
硫化物矿:辉铜矿Cu2S、黄铜矿CuFeS2 等; 含氧矿物:赤铜矿Cu2O、黑铜矿CuO、
孔雀石CuCO3·Cu(OH)2、 胆矾CuSO4·5H2O等。
银主要是以硫化物形式存在的,除了较少的闪银矿Ag2S 外,硫化银常与方铅矿共存。
金矿主要是以自然金形式存在,包括散布在岩石中的岩 脉金和存在于沙砾中的冲积金两大类。
而Cu与配位能力较弱的配体作用时,要在氧气存在 下方能进行:
2 Cu + 8 NH3+O2 +2 H2O 2 [Cu(NH3)4]2+ + 4 OH-
铜在生命系统中起着重要作用,人体有30多种含 有铜的蛋白质和酶。血浆中的铜几乎全部结合在 铜蓝蛋白中,铜蓝蛋白具有亚铁氧化酶的功能, 成CuO。在高温下 CuO又分解为Cu2O。
银和金没有铜活泼,高温下在空气中也是稳定的。 与卤素作用,与硫作用,都反映出铜、银、金的活泼 性是逐渐减弱的。 铜与一些强配体作用放出H2,如CN-
无机化学教学课件 19章 铜、锌副族

元素概述
Instruction to the elements
铜副族元素
Cuprum Subgroup Elements
锌副族元素
Zinc Subgroup Elements
2020/3/11
19-0 元素概述
Instruction to the elements
s区与ds区金属的电子构型的异同
最外层 次外层
H2O 和两个
S
O
2 4
结合。加
热时,先失去两个非氢键水
分子,再失去另外两个氢键
水分子,最后失去以氢键与
结合的水分子。
无水硫酸铜为白色粉末,难溶于乙醇或乙醚,具有很强的吸水性,吸水 后呈现蓝色。
当硫酸铜加热到 923 K 时,发生分解反应:
2020/3/11
ds区 在周期表中 的位置
2020/3/11
本章教学要求
1.了解ds区元素的特点; 2.了解重点元素Cu、Ag、Zn、Hg
的存在、分离、性质和用途; 3. 掌握重点元素单质及化合物的性质,
会用结构理论和热力学解释它们的某些化学现象;
2020/3/11
19-0 19-1 19-2
C u 2 O + 4 N H 3 + H 2 O 2 [ C u ( N H 3 ) 2 ] + + 2 O H
Cu2O 主要用作玻璃、搪瓷工业的红色颜料。 CuOH 极不稳定,至今尚未制得 CuOH。
(2)卤化物
CuX,除CuF(易歧化)是红色外,其余的都是白色,除CuF外都是难溶
Au + 4HCl + HNO3 == HAuCl4 + NO + 2H2O
第18章-铜族元素 锌族元素

第18章铜族元素锌族元素18.1 铜族元素18.1.1通性铜族元素:周期表ds区,第IB副族,包括铜(c opper)、银(s ilver)、金(g old)三种元素。
价电子构型为(n-1)d10ns1,最外电子层只有一个s电子,次外层为18个电子。
铜族元素与碱金属元素的性质差异主要体现在以下三点:●铜族元素的最外层电子受到的有效核电荷较大,使铜族元素的电离能高,原子半径小,密度大,化学活性差。
●铜族元素有多种氧化态,主要有+Ⅰ、+Ⅱ、+Ⅲ三种,而碱金属的氧化态只有+Ⅰ。
●碱金属从Na到Cs,金属活泼性增高;铜族元素恰恰相反,从铜到金化学活性逐渐降低。
从Cu到Au,原子半径增加不大,而核电荷却有明显增加,次外层18电子的屏蔽效应又小,使核对电子的吸引力增大,因而金属活泼性依次减弱。
铜族元素通性及变化规律:●从Cu到Au形成一价水合离子的活性越来越弱,金属的活泼性减弱。
●Cu+在高温和固态时很稳定--- ①d10全充满的稳定构型电子;②铜的第二电离能比第一过渡系任何元素都大的缘故。
但在溶液中Cu+不稳定,易歧化成Cu2+和Cu----Cu2+的水和热很大。
●一价离子具有18电子构型,有很强的极化能力和明显的变形性,本族元素易形成共价化合物;●原子中(n-1)d、n s、n p轨道的能量相差不大,有能级较低的空轨道,所以有很强的形成配合物的倾向。
18.1.2单质的物理性质和化学性质1.物理性质铜族元素单质的密度较大,熔沸点较高,但硬度较小。
它们都有很好的延展性,特别是金,1克金能抽成长达3 km的金丝或压成厚约0.0001mm的金箔,500 张的总厚度比头发丝的直径还薄些。
铜族元素都有良好的导电性和导热性。
银的导电性在金属中位居首位,铜列次席。
铜族金属之间以及和其它金属之间,都很容易形成合金,其中铜合金种类很多,历史也最久远,如青铜(80%Cu,15%Sn, 5%Zn)质地坚韧、易铸;黄铜(60%Cu、40%Zn)广泛用于制作仪器零件;白铜(50~70%Cu,18~20%Ni,13~15%Zn)主要用作刀具等。
第13章过渡元素(一) 铜族和锌族元素
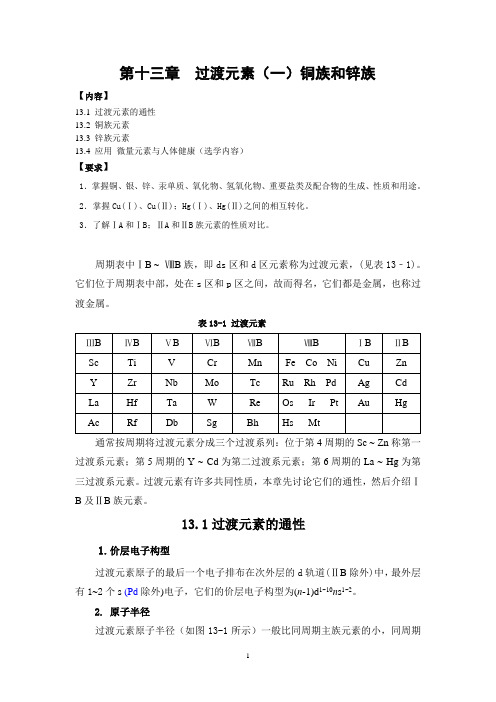
第十三章过渡元素(一)铜族和锌族【内容】13.1 过渡元素的通性13.2 铜族元素13.3 锌族元素13.4 应用微量元素与人体健康(选学内容)【要求】1.掌握铜、银、锌、汞单质、氧化物、氢氧化物、重要盐类及配合物的生成、性质和用途。
2.掌握Cu(Ⅰ)、Cu(Ⅱ);Hg(Ⅰ)、Hg(Ⅱ)之间的相互转化。
3.了解ⅠA和ⅠB;ⅡA和ⅡB族元素的性质对比。
周期表中ⅠB ~ⅧB族,即ds区和d区元素称为过渡元素,(见表13﹣1)。
它们位于周期表中部,处在s区和p区之间,故而得名,它们都是金属,也称过渡金属。
表13-1 过渡元素通常按周期将过渡元素分成三个过渡系列:位于第4周期的Sc ~ Zn称第一过渡系元素;第5周期的Y ~ Cd为第二过渡系元素;第6周期的La ~ Hg为第三过渡系元素。
过渡元素有许多共同性质,本章先讨论它们的通性,然后介绍ⅠB及ⅡB族元素。
13.1过渡元素的通性1.价层电子构型过渡元素原子的最后一个电子排布在次外层的d轨道(ⅡB除外)中,最外层有1~2个s (Pd除外)电子,它们的价层电子构型为(n-1)d1~10n s1~2。
2. 原子半径过渡元素原子半径(如图13-1所示)一般比同周期主族元素的小,同周期元素从左到右原子半径缓慢减小,到铜族前后又稍增大。
同族元素从上往下原子半径增大,但第二、第三过渡系(除ⅢB外)由于镧系收缩使同族元素原子半径十分接近,导致元素性质相似。
图13-1过渡元素原子半径3. 氧化态过渡元素有多种氧化态,因其最外层s电子和次外层部分或全部d电子都可作为价电子参与成键,一般可由+2依次增加到与族数相同的氧化态(Ⅷ族除Ru、Os外,其它元素尚无Ⅷ氧化态),这种氧化态的显著特征以第一过渡系最为典型。
表13-2第一过渡系元素的氧化数(下划线表示常见的氧化态)由13-2表可看出随着原子序数的增加,氧化数先是逐渐升高,后又逐渐降低。
这种变化主要是由于开始时3d轨道中价电子数增加,氧化数逐渐升高,当3d轨道中电子数达到5或超过5时,3d轨道逐渐趋向稳定。
无机化学 第17章铜族和锌族元素

O2
2
不可用铜器盛氨水
7
[Cu(NH3 ) 4 ] (蓝)
4Au O2 8CN 2H 2 O 4[Au(CN)2 ] 4OH
17.3
铜族元素的主要化合物
1 . 氧化物及氢氧化物
加热Cu(OH)2、Cu2(OH)2CO3、Cu(NO3)2都可 以得到CuO:
Cu(OH)2 CuCO3 2CuO H2O CO2 Cu(OH)2 CuO H2O
H 2SO 4 Ag 2S(s, 黑)
21
Ag+的鉴定:
HCl AgCl Ag
NH 3
Ag(NH )
3 2
Br AgBr(s)
S2 O 3 3
-
HNO 3
Ag 2S(s) S Ag(CN)
2-
2
CN AgI(s) I Ag(S O ) 3 2 3 2 I AgI(趋势较小) 2
导热率(Hg=1)
51.3
57.2
39.2
3
熔沸点较低(相对于其他过渡金属): ①原子半径较大、结构不够紧密 ②次外层充满,电子不参与成键,价电 子较少 良好导电导热性和良好的延展性 1gAu可拉3.4km金丝,金也可被压成 0.0001mm厚的金箔 Cu、Ag、Au和许多金属形成合金 Cu-Zn 黄铜 Cu-Sn-Zn 青铜 60-40 80 -15 -5 Cu —— Ni —— Zn 白铜 50~70 - 13~15 - 13~25 4
Au 4HCl(浓) HNO3 (浓) H[AuCl4 ] NO(g) 2H 2 O
6
与沉淀剂、配合剂的作用
4Ag 2H2S O2 2Ag2S 2H2O
铜族元素和锌族元素

and Zinc Subgroup (2010级使用) 2011.4
寄
语
• 祝各位同学: • 在大学第一年即将结束的时间里目标明,学业成! • 愉快而充实的度过人生中最美好的大学时光! • 在专业学习上,会学、乐学加真学! • 在竞争与挑战面前冲向同仁们前面! • 珍惜这段最重要的经历,确立更高的人生奋斗 • 目标,不断的努力,不断的进取, 为人生的辉 • 煌积淀坚实的力量!
例如,NaCl和AgCl,前者易溶而后者难溶。同样,锌族元素与
碱土金属元素既有相似之处,也有明显的差异。例如MgO和 ZnO都难溶于水,但前者显碱性而后者显两性。
IB
II B
d 区元素的电子分别填充在 3d 亚层、4d 亚层和 5d 亚层
上 . 1996年2月德国科学家宣布发现112号元素, 使第四过渡 系的空格终于被填满.
二、铜族元素
铜(copper, cuprum) 银(silver, argentum) 金(gold, aurum) 位于长周期表中IB族,通常称为铜族元素, 又称货币金属。
(一)通性
已知铜族元素价电子构型为(n-1)d10ns1,铜族元素原子不仅 可以失去ns电子,也可进一步失去部分d电子。因此铜族元素 都有+1、+2、+3三种氧化态。但由于其稳定性不同,铜常见的 氧化态为+2,银为+1,金为+3。
Cu2S 颜色 Ksp 25 ℃ 稳定性 黑
CuS 黑
Ag2S 黑
ZnS 白
CdS 黄
HgS 黑
2.010-47
8.510-45
6.310-50
8、铜、锌副族

]+
Br-
AgBr
CN-
S2O32-
[Ag(S2O3)2]3-
AgI
Ag(CN)2]-
Ksp
AgCl 1.8×10–10
NH3 · 2O H
Ag(NH3)2+ K稳 1.1×107 Br –
AgI Ksp 8.9×10–17 CN–
I–
Ag(S2O2)23– K稳4.0×1013
S2O32–
AgBr Ksp 5.0×10–13
氧化性
2.硝酸银 [Cu(Ⅰ)无硝酸盐]
(1) 制备: 3Ag+4HNO3(稀)=3AgNO3+NO↑ +2H2O Ag+2HNO3(浓)=AgNO3+NO2↑+H2O 比较:①用稀硝酸比浓硝酸:a.价格便宜 用率高;但反应速率慢。 ②银常从精练铜的阳极泥中得到,故含有杂质铜。 b.利
除杂方法1: a. 2AgNO3
mCu2S+nFeS →冰铜(密度大沉于下层)
(4)转炉熔炼得到粗铜(98%):
2Cu2S+3O2=2Cu2O+2SO2↑
2 Cu2O+ Cu2S=6Cu+SO2↑
(5)电解精炼:
在CuSO4和H2SO4混合液的电解槽内,以
粗铜为阳极,纯铜99.95%为阴极,低压下(约 0.5V)电解。在阴极上得到99.95%的纯铜,在 阳极泥中回收Au,Ag,Pt,Pd,及Se,Te等, 电解液回收Ni。
康铜: 60%Cu,40%Ni
18K金: 75%Au,12.5%Ag,12.5%Cu
14K金: 58%Au,14—28%Ag,14—28%Cu
金汞齐:金与汞的合金
第十八部分铜锌副族教学-精选

O
所以不可用铜器盛氨水
[Cu(N2 H3)4 ]
2+
Ag 对S、H2S非常敏感;
2 A 22 S H g O 2 22 S A 22 g O H
银器年久变黑
2019/9/10 6
2.与酸的反应 均不置换非氧化性稀酸(HCI、H2SO4)中的
H+ ;生成难溶物或配合物,使单质还原能力增强。
2019/9/10 15
Cu(OH)2:浅兰絮状沉淀,两性偏碱, 能溶于酸,氨水,浓强碱。
Cu(OH)2=CuO+H2O Cu(OH)2+2H+=Cu2++2H2O Cu(OH)2+2NaOH(浓)=Na2[Cu(OH)4]
检验糖尿病:红色 有病,蓝色没病
葡萄糖 Cu2O↓(砖红)
Cu(OH)2+4NH3=Cu(NH3)42++2OH-
碱式碳酸铜 Au、Ag不与O2发生反应 当有沉淀剂或配合剂存在时,可反应。
2019/9/10 5
M CA uA ,g,u
4M O 222 H O 8C N 4[M 2](4 CO NH )
4C O 2 u22 H O 8N 3 H 4[C3)u 2](无 N) H 色 OH
2C uC I+ CI 2
2C uC I2 · 2 H2 O△Cu 2 ( OH )2 C I2 + 2 HC I+ 2H 2 O
2019/9/10 21
(6)CuSO4 无水CuSO4是白色粉末,吸水性强,吸水
后显兰色。难溶乙醇、乙醚。可用来检验和除 去乙醇、乙醚等有机溶剂中的微量水分。
波尔多液: CuSO4·5H2O:CaO:H2O=1:1:100 主要组分Cu2(OH)2SO4,农业、果园杀菌剂。 (7)硫化物
铜族元素和锌族元素共85页

66、节制使快乐增加并使享受加强。 ——德 谟克利 特 67、今天应做的事没有做,明天再早也 是耽误 了。——裴斯 泰洛齐 68、决定一个人的一生,以及整个命运 的,只 是一瞬 之间。 ——歌 德 69、懒人无法享受休息之乐。——拉布 克 70、浪费时间是一桩大罪过。——卢梭
铜族元素和锌族元素
51、没有哪个社会可以制订一部永远 适用的 宪法, 甚至一 条永远 适用Байду номын сангаас 法律。 ——杰 斐逊 52、法律源于人的自卫本能。——英 格索尔
53、人们通常会发现,法律就是这样 一种的 网,触 犯法律 的人, 小的可 以穿网 而过, 大的可 以破网 而出, 只有中 等的才 会坠入 网中。 ——申 斯通 54、法律就是法律它是一座雄伟的大 夏,庇 护着我 们大家 ;它的 每一块 砖石都 垒在另 一块砖 石上。 ——高 尔斯华 绥 55、今天的法律未必明天仍是法律。 ——罗·伯顿
锌族元素PPT演示课件

5
合金
由于锌族元素的熔点低,使得本族元素易于形成 合金。
其中汞的合金称为汞齐,除铁系元素外,所有
金属皆可形成相应的汞齐。汞齐中的其他金属仍 然保留其原有性质。汞齐一方面在化学性质上与 其它合金相似,同时又有其特点:由于汞在常态 下是液体,因此当其它金属溶解在汞中形成汞齐 时,若溶解的金属较少,则形成的汞齐是液态或 糊状的。
6
闪锌矿
7
辰砂:HgS
8
(二)单质的性质
物理性质:
都是银白色的金属,锌表面因有一层
ZnCO3·3Zn(OH)2而略显蓝灰色,熔沸点较低,不仅 低于碱土金属,还低于铜族元素,按锌到汞的顺序
下降。这是由于锌族元素的d 电子不参与成键,且
s 电子成对,成键能力较弱,因此, 锌族元素参与
形成金属键的电子少,金属键较弱。其中,Hg 的
21
5、配合物
由于锌族的离子为18电子层结构,具有很强的极化力与明 显的变形性,因此比相应主族元素有较强的形成配合物的 倾向。在配合物中,常见的配位数为4,Zn2+的配位数为4 或6。
(1) 氨配合物
Zn2+、Cd2+离子与氨水反应,生成稳定的氨配合物: Zn2++4NH3 == [Zn(NH3)4]2+ K稳=1.0×1016
活泼性
1.与碱土金属(指元素周期表中ⅡA族元素,包括铍 (Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)、镭 (Ra)六种元素)相比:
由于锌族元素次外层具有18个电子,它对核的屏蔽作用 小,有效核电荷较大,对最外层电子吸引力较强,其 第一、第二电离势之和以及电负性都比碱土金属大, 因此活泼性小于碱土金属。Biblioteka 121. 氧化物与氢氧化物:
铜族元素和锌族元素共85页文档

6、最大的骄傲于最大的自卑都表示心灵的最软弱无力。——斯宾诺莎 7、自知之明是最难得的知识。——西班牙 8、勇气通往天堂,怯懦通往地狱。——塞内加 9、有时候读书是一种巧妙地避开儿
铜族元素和锌族元素
16、自己选择的路、跪着也要把它走 完。 17、一般情况下)不想三年以后的事, 只想现 在的事 。现在 有成就 ,以后 才能更 辉煌。
18、敢于向黑暗宣战的人,心里必须 充满光 明。 19、学习的关键--重复。
20、懦弱的人只会裹足不前,莽撞的 人只能 引为烧 身,只 有真正 勇敢的 人才能 所向披 靡。
Thank you
过度元素之锌与铜PPT(完整版)

铜的一些性质
• 铜(Cu)的原子序数是29,是 一种过渡金属。 铜呈紫红色光
泽的金属,密度克/立方厘米。 熔点1083.4±0.2℃,沸点 2567℃。常见化合价+1和+2。 铜是人类发现最早的金属之一,
也是最好的纯金属之一,稍硬、
极坚韧、耐磨损。还有很好的
延展性,导热和导电性。铜和
人体缺铜可适量增加摄入含铜较高 的食物,如鱼、虾、蟹、玉米、豆制品 等。
锌的基本性质
• 锌化学符号是Zn,它的原子序数是30。 锌是一种蓝白色金属。密度为克/立方 厘米,熔点为419.5℃。在室温下,性 较脆;100~150℃时,变软;超过 200℃后,又变脆。锌的化学性质活泼, 在常温下的空气中,表面生成一层薄而 致密的碱式碳酸锌膜,可阻止进一步氧 化。当温度达到225℃后,锌氧化激烈。 锌在空气中很难燃烧,在氧气中发出强 烈白光。锌易溶于酸,也易从溶液中置 换金、银、铜等。锌是一种常用有色金 属,是古代铜、锡、铅、金、银、汞、 锌等7种有色金属中提炼最晚的一种, 是第四常见的金属,仅次于铁、铝及铜。 锌能与多种有色金属制成合金,其中最 主要的是锌与铜、锡、铅等组成的黄铜 等,还可与铝、镁、铜等组成压铸合金。 锌主要用于钢铁、冶金、机械、电气、 化工、轻工、军事和医药等领域。
锌的一些主要用途
(1)镀锌 锌具有优良的抗大气腐蚀性能,在常温下表
面易生成一层保护膜,因此锌最大的用途是用于镀锌工业。 被主要用于钢材和钢结构件的表面镀层(如镀锌板),广泛 用于汽车、建筑、船舶、轻工等行业。近年来西方国家开 始尝试直接用锌合金板做屋顶覆盖材料,其使用年限可长 达120-140年,而且可回收再用,而用镀锌铁板作屋顶材 料的使用寿命一般为5-10年。近年来,钢带热浸镀锌量有 显著增长。电镀锌也有使用,但该法一般用于较薄的镀层 和不同的表面光洁度。使用含锌粉的涂料是涂层的另一种 方法;对于与水连续接触的物体,如用于船舶、桥梁和近 海油气井架的大的钢构件,只须和大的锌块连接,便可得 到保护,不过锌块要定期更换。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ksp逐渐减小 2Cu2+ +4I- 2CuI I2
S2O32- I- +S4O62热浓HCl中,铜粉还原CuCl2,最终可得CuCl白色沉淀
Cu2+ +Cu+4HCl(浓) 2[CuCl2 ]- (土黄)+4H+
H2O
CuCl
还原剂还原CuX2,可得CuX
2Cu
2+
+2X-
+SO
2
+2H
2.单质的化学性质
◆ 与氧气反应 2Cu+O2 2CuO(黑) 2Cu+O2 +H2O+CO2 Cu(OH)2 CuCO3 潮湿空气生成铜锈
Ag Au与氧气不反应,当有沉 淀剂或配合剂存在时,可反应
4M+O2 +2H2O+8CN- 4[M(CN)2 ]- +4OH-
M=Cu,Ag,Au
4Cu+O2 +2H2O+8NH3 4[Cu(NH3 )2 ]+ (无色)+4OH-
铜族元素锌族元素
本章主要内容
● (一) Cu Ag Zn Hg的单质及 化合物性质和用途
● (二) Cu+和Cu2+, Hg+和Hg2+的 相互转化
● (三) IA族和IB族,IIA和IIB族 性质的不同
(ds区,I B、IIB族)
周期
四 五 六
IB (n-1)d10ns1
Cu Ag Au 铜族
2O
2CuX
4H
+
+SO
24
2CuCl2 +SnCl2 2CuCl SnCl4 ● Cu+表现一定氧化性
2CuI(白)+2Hg Hg2I2 (黄)+2Cu
检测Hg ● CuCl在空气中可被氧化
4CuCl+O2 +4H2O 3CuO CuCl2 3H2O+2HCl
● 与氢卤酸反应
Cu2O+4HX 2[CuX2 ]- +2H+ +H2O
H2O
CuX
Cu2O + 2HCl ══ 2CuCl(白)↓ + H2O
A(V) Cu2+ 0.56 CuCl 0.124 Cu CuX不歧化
● 与NH3反应
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]+ + 2OH-
红色
无色
(很快被空气中的氧氧化)
4[Cu(NH3 )2 ]+ +8NH3 +2H2O+O2 4[Cu(NH3 )4 ]2+ +4OH-
无色
蓝色
∴ 可用[ Cu(NH3)2 ] + 除去混合气体中的O2
◆ CuX
除CuF 为红色外,其它都为白色, 都难溶于水, 溶解度逐渐减小
CuCl CuBr CuI CuSCN CuCN Cu2S
● 银反应相似 (困难些) 2Ag+2H2SO4 (浓) Ag2SO4 +SO2 2H2O
● 金与HNO3, 浓H2SO4不反应,但Au可溶于“王水”
Au+HNO3 +4HCl H[AuCl4 ]+NO 2H2O
18.1.3 存在和冶炼
1. 存在 2. 冶炼
单质:Cu,Ag,Au 矿物:孔雀石:Cu2(OH)2CO3
18.1.4 铜族化合物
铜的化合物 (+1 +2) 1. 铜(+I)的化合物 ◆ Cu2O
● 碱性铜酸盐溶液用葡萄糖还原,得Cu2O 2[Cu(OH)4 ]2- CH2OH(CHOH)4CHO
Cu2O 4OH- +CH2OH(CHOH)4COOH+H2O 测定醛含量,检测糖尿病
● CuO加热分解,得Cu2O 4CuO(黑) 2Cu2O(红) O2
O2
[Cu(NH3)4 ]2+ (蓝)
不可用铜器盛氨水
2Ag+2H2S+O2 2Ag2S+2H2O 银器年久变黑
◆ 与卤素反应 程度逐渐下降
Cu(常温) Ag(慢) Au(加热,干燥)
◆ 与酸反应
非氧化性酸
● Cu、Ag、Au不与稀酸反应,但在空气
中Cu可以缓慢溶于稀H2SO4,HCl
2Cu+2H2SO4 +O2 2CuSO4 +2H2O 2Cu+4HCl+O2 2CuCl2 +2H2O ● Cu与热浓HCl反应
同族比较 (Z*与r互相制约)
IB IIB Cu Zn Ag Cd Au Hg
Z*显著增大占主导 r 增大占次要 金属性渐弱
与主族规律相反!
§18.1 铜 族 元 素 18.1.1 铜族元素的通性
● 电离能高,原子半径小,密度大, 化学活性差
● 多种氧化态(+1, +2, +3) ● 离子有很强的极化能力和变形性,
易形成共价化合物 ● 很强的形成配合物的倾向
相似性
递变性
随着原子序数递增
● 金属活泼性依次减弱 ● Cu+在高温和固态时很稳定,
溶液中Cu+不稳定,易歧化
18.1.2 单质的性质
1. 单质的物理性质
● 特征颜色:Cu(紫红),Ag(白),Au(黄) ● 铜族元素密度大 ● 熔点、沸点较其它过渡金属低 ● 导电性、导热性好,且Ag>Cu>Au ● 延展性好;易形成合金
与过渡金属 接近一些,氧 化态可变
II B (n-1)d10ns2
Zn Cd Hg 锌族
与主族金属接 近一些,氧化 态以+2为主
同周期,IB---IIB族比较
性质
IB
价电子构型 (n-1)d10ns1
原子半径r/pm
<
金属活泼性
<
II B (n-1)d10ns2
(n-1)d电子未参与 成键,性质与过渡 元素有较大差别
2Cu+8HCl(浓) 2H3[CuCl4 ]+H2
氧化性酸 ● 铜与HNO3, 浓H2SO4反应
Cu+4HNO3 (浓) Cu(NO3 )2 +2NO2 2H2O 3Cu+8HNO3 (稀) 3Cu(NO3 )2 +2NO 4H2O Cu+2H2SO4 (浓) CuSO4 +SO2 2H2O
◆ Cu2O
● 因晶粒大小不同呈黄,桔黄,鲜红或深棕,不溶于水 ● 热稳定性非常高(1508K熔化),基本属共价化合物 ● 碱性氧化物,遇酸歧化
Cu2O+H2SO4 (稀) CuSO4 +Cu H2O A(V) Cu2+ 0.153 Cu+ 0.521 Cu
3Cu2 O +14HNO3 ══ 6Cu(NO3)2 + 2NO + 7H2O
辉银矿:Ag2S 碲金矿:AuTe2
氰化法提炼金和银
Ag2S+ 4NaCN= Na[Ag(CN)2] + Na2S 4Ag + 8NaCN + 2H2O + O2 = 4Na[Ag(CN)2] + 4NaOH 4Au+8NaCN+2H2O+O2 = 4Na[Au(CN)2] + 4NaOH 2Na[Ag(CN)2] + Zn = 2Ag + 4Na2[Zn(CN)4]
