第二节氨铵盐2精品PPT课件
合集下载
课件2:5.2.2 氨和铵盐

2.铵盐的化学性质 (1)受热易分解
(2)与碱溶液反应 3.NH4+的检验
NNNNNNNNNHHHHHHHHH444444CH+CH+444CH+++lClC+==lC=O=OO=OO=△O=△3=H3△=H==3=H====-==-==△-=N==△N==△N====H=====△H=H=△==△=3N=33N=↑N==↑↑=H=+NHH++NN33H3H↑HHH↑H↑+3C++3C3↑C↑l↑H+lH+lH+22OH2OHOH2+2+O2+OOCCCOOO22↑↑2↑
未知液加入强碱共热,产生使湿润的红色石蕊试纸变蓝色的气体,
则证明含NH4+。
当堂检测
1.下列叙述正确的是( ) A.液氨用作制冷剂发生的是化学反应 B.氨气溶水得到氨水发生的只是物理变化 C.分离液态空气制取氮气属于氮的固定 D.氮气与氢气化合生成氨气属于人工固氮 【答案】D
2.(2021·宁夏银川市·银川一中高一期末)下列有关氨水和氯水的说 法正确的是( ) A.含有的微粒种类相同 B.敞口放置后溶液的pH均可能减小 C.都能与SO2发生氧化还原反应 D.均具有强氧化性和挥发性 【答案】B
5.(2020·阿克苏市高一期末)已知氨气极易溶于水,而难溶于有机溶 剂CCl4。下列装置中不适宜做氨气的尾气吸收的是( )
A
B
C
D
【答案】C
本节内容结束
更多精彩内容请登录:
4.氨气的还原性
①催化氧化: ②被CuO氧化:
42424NNNNNHHHHH33333++ + + +55353OOOCC2uu22===催OO催 催===△ 化===△ △ 化 化=======剂剂 剂△ △=======444==NNN33OOOCC+uu+ ++ +666HHHNN22222OOO+ +33HH22OO 222NNNHHH333++ +333CCCull22O========△=NN=22=+ +3C66uHH+CCllN2+3H2O
氨、铵盐ppt2 通用

催化剂 高温、高压 △ 2NH3
2NH4Cl + Ca(OH)2 == CaCl2 + 2NH3↑+ 2H2O
装置: 固+固-加热装置 收集: 向下排空气法 检验:A. B.
与制
O2
相同
湿润的红色石蕊试纸
蘸有浓盐酸的玻璃棒接近集气瓶口
此外还可用向生石灰中加入浓氨水的方法制取氨气。
典型例题
例题
小结:
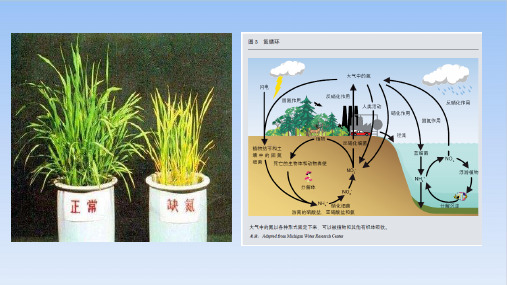
铵态氮肥应如何保存?
(2)与碱反应
固体与固体反应需加热,如实验室制氨气。 溶液中反应的离子方程式为: NH4 +
+
OH-====
△
NH3↑+ H2O
或 NH4+ + OH-==== NH3·H2O
问题 铵盐在作肥料时应注意什么事项?
三.氨的制法 N2 + 3H2 (1)工业制法: (2)实验室制法 原理:
高二化学必修章
节氨 铵盐
导入
2004年4月21日
杭州市一制冷车间发生氨气泄漏
2004年4月20日上午10时,杭州 市一制冷车间发生氨气泄漏事件, 整个厂区是白茫茫的一片,方圆 数百米,空气中弥漫着一股浓烈 的刺激性气味,进入厂区呼吸都 感到困难。厂区内寒气逼人。 市消防中心接到报案后立即制 定方案,出动上百名消防队员, 十余量消防车……
1、为什么在氨气泄漏时工厂里会寒气逼人?
2、消防队员应该如何去收集弥漫在大气中的氨气? 3、被困在其中的人应该怎样做才能不吸入氨气保证安全?
检测:
1、氨气是——色,有——性气味气体。密度比空气——, 液氨汽化时——大量热,利用这一性质常用液氨作——。
2、检验氨气是否充满试管的方法是————,观察 到的现象是———间构型:
氨和铵盐ppt课件

弱碱
NH3·H2O
NH3
3.氨与酸反应(1)氨与氯化氢相遇时的现象是 ,反应的化学方程式是 。(2)工业上用氨、二氧化碳和水制取碳酸氢铵的化学方程式是 。(3)工业上用硫酸吸收氨的化学方程式是 。
产生白烟
NH3+HCl
===NH4Cl
1.向盛有少量硫酸铵溶液(或氯化铵溶液、硝酸铵溶液)的试管中加入氢氧化钠溶液并加热,用镊子夹住一片湿润的红色石蕊试纸放在试管口,观察到的现象是 ,反应的离子方程式是 。
红色石蕊试纸变蓝
H2O
2.铵盐溶液与碱溶液反应的离子方程式(1)铵盐溶液与烧碱溶液混合后加热: 。(2)铵盐稀溶液与烧碱稀溶液混合: 。(3)铵盐浓溶液与烧碱浓溶液混合: 。
吸收水蒸气,干燥氨气
向下排空气
(4)验满方法①把湿润的红色石蕊试纸置于试管口,试纸变 ;②将蘸有浓盐酸的玻璃棒置于试管口,有 产生。(5)尾气处理可在导管口放一团用 浸湿的棉花球。
3.根据铵盐的性质,分析应当怎样合理地储存和施用铵态氮肥?提示 贮存铵态氮肥时,为了防止受热分解,应密封包装并放在阴凉通风处;施肥时应将铵态氮肥埋在土下,且不能与碱性物质(如草木灰)混用。
特别提示
(1)铵盐受热分解都有氨生成,但硝酸铵受热分解最终生成氮气或氮氧化物。(2)分别用试管加热氯化铵和单质碘时,都由固体变为气体,而在试管口遇冷又凝结为固体,其本质不同,前者为化学变化,后者为物理变化。(3)检验溶液中含有NH 时,需要加入浓碱溶液并加热,其目的是利用氨气的生成与检验。
1
2
3
√
3.下列关于氨气、液氨、氨水的叙述正确的是A.氨气、液氨、氨水的成分相同,均为纯净物B.蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒相互靠近,有白烟生成C.氨水的密度比水小,且浓度越大,密度越大D.氨水的溶质为NH3·H2O,是氨水中含量最多的微粒
NH3·H2O
NH3
3.氨与酸反应(1)氨与氯化氢相遇时的现象是 ,反应的化学方程式是 。(2)工业上用氨、二氧化碳和水制取碳酸氢铵的化学方程式是 。(3)工业上用硫酸吸收氨的化学方程式是 。
产生白烟
NH3+HCl
===NH4Cl
1.向盛有少量硫酸铵溶液(或氯化铵溶液、硝酸铵溶液)的试管中加入氢氧化钠溶液并加热,用镊子夹住一片湿润的红色石蕊试纸放在试管口,观察到的现象是 ,反应的离子方程式是 。
红色石蕊试纸变蓝
H2O
2.铵盐溶液与碱溶液反应的离子方程式(1)铵盐溶液与烧碱溶液混合后加热: 。(2)铵盐稀溶液与烧碱稀溶液混合: 。(3)铵盐浓溶液与烧碱浓溶液混合: 。
吸收水蒸气,干燥氨气
向下排空气
(4)验满方法①把湿润的红色石蕊试纸置于试管口,试纸变 ;②将蘸有浓盐酸的玻璃棒置于试管口,有 产生。(5)尾气处理可在导管口放一团用 浸湿的棉花球。
3.根据铵盐的性质,分析应当怎样合理地储存和施用铵态氮肥?提示 贮存铵态氮肥时,为了防止受热分解,应密封包装并放在阴凉通风处;施肥时应将铵态氮肥埋在土下,且不能与碱性物质(如草木灰)混用。
特别提示
(1)铵盐受热分解都有氨生成,但硝酸铵受热分解最终生成氮气或氮氧化物。(2)分别用试管加热氯化铵和单质碘时,都由固体变为气体,而在试管口遇冷又凝结为固体,其本质不同,前者为化学变化,后者为物理变化。(3)检验溶液中含有NH 时,需要加入浓碱溶液并加热,其目的是利用氨气的生成与检验。
1
2
3
√
3.下列关于氨气、液氨、氨水的叙述正确的是A.氨气、液氨、氨水的成分相同,均为纯净物B.蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒相互靠近,有白烟生成C.氨水的密度比水小,且浓度越大,密度越大D.氨水的溶质为NH3·H2O,是氨水中含量最多的微粒
氨、铵盐 PPT课件2 通用

通过今天的学习我们要解决以下几个问题:
1、了解氨的物理性质,掌握氨的化学性质 及氨的实验室制法 2、了解铵盐的性质.
3、掌握铵离子的检验方法
一、氨
• 1、氨的物理性质
•氨是没有颜色、有刺激性气味的气体,
标况下密度0.771g/L,比空气轻。易 液化,液态氨汽化时要吸收大量的热, 常作致冷剂。
2、氨分子结构 电子式: 结构式:
a
4、如图所示:烧瓶中充满干燥气体a, 将滴管中的液体b挤入烧瓶内,轻轻震 荡烧瓶,然后打开弹簧夹,烧杯中的
液体呈喷泉状喷出,则a、b可能是: A、a为HCl气体,b为H2O B、 a为CO2气体,b为浓NaOH溶液 C、a为Cl2气体,b为饱和NaCl溶液 D、a为Cl2气体,b为浓NaOH溶液
(4)、氨气的用途
1、制氮肥、硝酸、铵盐、纯碱等的
重要原料; 2、制合成纤维、塑料、染料等的 重要原料; 3、作致冷根离子构成的化合物 特殊——不含金属元素的离子化合物。
2、物理性质:易溶于水,晶体
3、化学性质 (1)铵盐受热分解反应 △ 氯化铵: NH4Cl ==== NH3↑+ HCl↑ △ 碳酸铵:(NH4)2CO3 === 2NH3↑+ CO2↑+H2O △ 碳酸氢铵: NH4HCO3 === NH3↑+ CO2↑+H2O 问题
高二化学必修第一章
第二节
氨
铵盐
甘南州合作藏族中学:段小 花
导入
2004年4月21日
杭州市一制冷车间发生氨气泄漏
2004年4月20日上午10时,杭州 市一制冷车间发生氨气泄漏事件, 整个厂区是白茫茫的一片,方圆 数百米,空气中弥漫着一股浓烈 的刺激性气味,进入厂区呼吸都 感到困难。厂区内寒气逼人。 市消防中心接到报案后立即制 定方案,出动上百名消防队员, 十余量消防车……
氨和铵盐-高中化学必修二课件

实验成功的关键: a.NH3纯度尽可能高,且装满 ;b.烧瓶干燥; c.装置气密性 好;
形成喷泉实验的条件: ①极易溶解于水的气体,如NH3、HCl等可进行喷泉实验。 ②气体极易与某种溶液反应,如SO2、CO2、Cl2与浓NaOH溶 液,NH3与稀盐酸;
(2)与酸反应 【实验探究】氨能否直接 与酸反应生成铵盐? 实验操作:将盛有氨气的集 气瓶倒扣在盛有氯化氢气体 的集气瓶上,观察现象。 实验现象:大量白烟生成 。 实验原理: NH3 + HCl = NH4Cl。 应用:可利用此性质检验氨气管道是否泄漏。
第二节 氮及其化合物 第2课时 氨和铵盐
学习目标
1.认识氨气的溶解性,氨与水的反应,以及氨的还原性。 2..认识铵盐的受热分解、铵盐与碱的反应,认识铵态氮 肥的使用问题,了解它们在生产中的应用。
新课导入
科学史:
德国化学家哈伯(F.Haber,1868-1934)从1902年开始研究由氮气 和氢气直接合成氨。于1908年申请专利,即“循环法”,在 此基础上,他继续研究,于1909年改进了合成氨,氨的含量 达到6%以上。这是目前工业普遍采用的直接合成法。反应过 程中为解决氢气和氮气合成转化率低的问题,将氨产品从合 成反应后的气体中分离出来,未反应气和新鲜氢氮气混合重 新参与合成反应。
蓝色
产生NH3
△
反应的化学方程式是_N_H__4_C_l_+__N_a_O__H_=_=_=_=_=__N_H__3↑__+__H__2O__+__N_a_C__l ; 离子方程式为__N__H_+ 4_+__O__H_- __=_=△_=_=_=_N__H_3_↑__+__H__2O____。 思考与讨论: 如何检验某溶液中是否含有NH4+ ?
氨和铵盐课件

硫酸铵的反应进行合成。
3
氨的制备
氨可以通过在氮气和氢气的存在下 在催化剂的作用下进行合成。
其他方法
还有其他多种制备氨和铵盐的方法, 如氯化铵的热分解等。
氨和铵盐的应用领域
农业领域
氨和铵盐广泛用于肥料的生 产,提高土壤肥力和作物产 量。
化工领域
氨和铵盐是制造化学品和药 物的重要原料,涉及多个行 业。
水处理
铵盐可用于水处理,净化水 源和去除有害物质。
氨和铵盐的环境影响和安全性
1 氨的环境影响
2 铵盐的安全性
氨排放对空气和水体有污染风险,但合 理使用和处理可最大程度减少影响。
铵盐有爆炸的风险,需在储存、运输和 使用时采取必要的安全措施。
氨和铵盐的市场前景
全球需求增长
全球农业、化工和医药行业对氨和铵盐的需求持续增长。
3 药物生产
氨是制造各种药物的 重要原料,例如抗生 素和止痛药。
铵盐的性质及用途
1 肥料
铵盐是一种重要的氮源肥料,可为植物提供营养。
2 防腐剂
铵盐具有防腐性能,可用于食品、木材和皮革工业。
3 化学反应
铵盐可用作氧化剂或还原剂,在许多化学反应中发挥重要作用。
氨和铵盐的制备方法
1
铵盐的合成
2
铵盐可通过酸性或碱性溴化铵和亚
氨和铵盐ppt课件
让我们一起探索氨和铵盐的奇妙世界。从它们的性质、用途,制备方法,应 用领域,环境影响和安全性,到市场前景,这个精彩的ppt课件将带您了解这 一话题的方方面面。
氨的性质及用途
1 多功能气体
氨具有臭味并具有独 特的刺激性。它用于 肥料、化学品和制冷 剂的生产。
2 酸洗剂
氨可以用作金属材料 的清洗和去除氧化层 的酸性溶液。
5.2.2 氨和铵盐-课件-高一下学期化学人教版(2019)必修第二册

,使水进入烧瓶。观察并描述现象,分 析出现这些现象的可能原因。
环节一:设计实验 探究氨气 实验5-6——喷泉实验
✓ 实验现象 烧杯中的酚酞溶液由玻璃管进入烧瓶,形成红色喷泉。
✓ 实验结论:①氨极易溶于水 ②氨水显碱性
NH3+H2OFra bibliotekNH3·H2O
NH4++OH-
环节一:设计实验 探究氨气 氨气的物理性质
△
2NH3 + 3Cl2 === N2 + 6HCl
△
8NH3 + 3Cl2 === N2 + 6NH4Cl
检验氯气管道是否漏气
环节二:展示样品 探究铵盐 氨气的化学性质
环节二:展示样品 探究铵盐 认识铵盐
硫酸铵
氯化铵
• 物理性质
硫酸铵
碳酸氢铵
尿素
环节二:展示样品 探究铵盐 氨气的化学性质
催化剂
C.液氨作为清洁能源的反应原理是 4NH3 + 5O2 =△== 4NO + H2O D.加热可除去NH4Cl中的少量NaHCO3
谢谢观看!
单击此处添加副标题内容
D.氨水中加入氯化铁溶液:Fe2++2NH3·H2O===2NH+4 +Fe(OH)2↓
环节三:整合知识 练习提升
习题追踪
4.某同学探究氨气和铵盐的性质,对相关实验操作及现象描述正确的是
√A.室温下测定等浓度的氨水和NaOH溶液的pH,比较NH3·H2O和NaOH的碱性强弱
B.向试管中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口,若试纸不变蓝, 则原溶液中无
环节三:整合知识 练习提升 习题追踪
2.下列关于氨的说法正确的是 A.氨是非电解质,氨水是电解质,NH4+具有金属阳离子的一些性质 B.氨溶于水后,大部分以NH3分子形式存在,所以氨水显弱碱性
环节一:设计实验 探究氨气 实验5-6——喷泉实验
✓ 实验现象 烧杯中的酚酞溶液由玻璃管进入烧瓶,形成红色喷泉。
✓ 实验结论:①氨极易溶于水 ②氨水显碱性
NH3+H2OFra bibliotekNH3·H2O
NH4++OH-
环节一:设计实验 探究氨气 氨气的物理性质
△
2NH3 + 3Cl2 === N2 + 6HCl
△
8NH3 + 3Cl2 === N2 + 6NH4Cl
检验氯气管道是否漏气
环节二:展示样品 探究铵盐 氨气的化学性质
环节二:展示样品 探究铵盐 认识铵盐
硫酸铵
氯化铵
• 物理性质
硫酸铵
碳酸氢铵
尿素
环节二:展示样品 探究铵盐 氨气的化学性质
催化剂
C.液氨作为清洁能源的反应原理是 4NH3 + 5O2 =△== 4NO + H2O D.加热可除去NH4Cl中的少量NaHCO3
谢谢观看!
单击此处添加副标题内容
D.氨水中加入氯化铁溶液:Fe2++2NH3·H2O===2NH+4 +Fe(OH)2↓
环节三:整合知识 练习提升
习题追踪
4.某同学探究氨气和铵盐的性质,对相关实验操作及现象描述正确的是
√A.室温下测定等浓度的氨水和NaOH溶液的pH,比较NH3·H2O和NaOH的碱性强弱
B.向试管中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口,若试纸不变蓝, 则原溶液中无
环节三:整合知识 练习提升 习题追踪
2.下列关于氨的说法正确的是 A.氨是非电解质,氨水是电解质,NH4+具有金属阳离子的一些性质 B.氨溶于水后,大部分以NH3分子形式存在,所以氨水显弱碱性
【课件】氨和铵盐课件高一下学期化学人教版(2019)必修第二册

打开止水夹,用热毛巾对烧瓶热 敷或者用冷毛巾对烧瓶冷敷都可以引发 喷泉。
引发喷泉的方式:形成内外压强差
1、减小内压法 2、增大外压法
增大外压法
课堂练习
如图所示:烧瓶中充满干燥气体 a,将胶头滴管中的液体 b 挤入烧瓶内,轻轻震荡烧瓶,然后打开弹簧夹,烧杯中的液 体呈喷泉状喷出,则 a、b 不可能是 ( C)
A.a 为 HCl 气体,b 为 H2O B.a 为 CO2 气体,b 为浓 NaOH 溶液 C.a 为 Cl2 气体,b 为饱和 NaCl 溶液 D.a 为 Cl2 气体,b 为浓 NaOH 溶液
(2)化学性质 ①与水反应
一水合氨,是一种弱碱,只有一 小部分发生电离。
NH3 + H2O
NH3·H2O
A.氨气、液氨、氨水的成分相同,均为纯净物 B.蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒相互靠近,有白烟生成 C.氨水的密度比水小,且浓度越大,密度越大 D.氨水的溶质为NH3·H2O,是氨水中含量最多的微粒
解析 氨水是混合物,氨水的密度随浓度的增大而减小,氨水中水的含量最多。
2. 铵盐 (1) 概念:由铵根离子(NH4+)和酸根离子构成的化合物
NH4+ + OH-
氨气是一种碱性气体 注:
能使酚酞溶液变红 能使红色石蕊试纸变蓝
a. 氨水属于混合物,一水合氨属于纯净物;
b. 氨气属于非电解质,一水合氨属于电解质。
△ NH3·H2O=====NH3↑+H2O
②与酸反应
NH3 + HCl = NH4Cl 现象:有大量白烟产生
烟是一种固体小颗粒 原因:NH3 与 HCl 相遇迅速反应生成 NH4Cl 固体小颗粒 思考:浓氨水遇浓硫酸、浓硝酸也会产生白烟吗 ?
人教版高二化学教学课件氨 铵盐02

第二节
氨
铵盐
一、氨(NH3)
1.氨的物理性质
(1)无色、有刺激性气味的气体 (2)在标准状况下,密度小于空气 (3)易液化,液氨常用作制冷剂 (4)对人有刺激作用,接触要小心
氨水跟水的 密度比,哪 个大?
一、氨(NH3)
2.氨的化学性质
(1)氨分子的结构 氨分子结构模型 H 共用电子对 H •× • H× H N •N • 根据氨分子结构,能推断 ו 出氨分子是极性分子还是 H 孤对电子对 H 非极性分子吗? 三角锥形 极性分子 如何判定分子的极性? 电子云分布均匀 非极性分子 电子云分布不均匀 极性分子
△
NH4Cl NH3↑+ HCl↑ NH3 + HCl NH4Cl △ NH4 HCO3 NH3 ↑+ H2O + CO2↑
铵盐受热分解规律:①生成氨气和对应的酸 ②酸的沸点低会挥发 ③酸不稳定继续分解 ④硝酸铵受热不产生氨气
二、铵盐
(一)铵盐的化学性质
2.铵盐与碱的反应
(NH4)2SO4 + 2NaOH
课堂练习:
3.把含硫酸铵和硝酸铵的混合液aL分成两等份。 一份加入bmol NaOH并加热,恰好把NH3全部 赶出;另一份需消耗cmol BaCl2,沉淀反应恰 好完全,则原溶液中NO3-的浓度为( ) B A.
b-2c a
B.
2b-4c a
C.
2b-c a
D.
b-4c a
标准状况下气体溶解度
极易溶:HCl(1∶ 500) NH3(1∶ 700) 易溶:SO2(1∶ 40) 能溶:CO2(1∶ 2) Cl2(1∶ 2) H2S(1∶ 2.6)
二、铵盐
你知道什么叫铵盐吗?
氨
铵盐
一、氨(NH3)
1.氨的物理性质
(1)无色、有刺激性气味的气体 (2)在标准状况下,密度小于空气 (3)易液化,液氨常用作制冷剂 (4)对人有刺激作用,接触要小心
氨水跟水的 密度比,哪 个大?
一、氨(NH3)
2.氨的化学性质
(1)氨分子的结构 氨分子结构模型 H 共用电子对 H •× • H× H N •N • 根据氨分子结构,能推断 ו 出氨分子是极性分子还是 H 孤对电子对 H 非极性分子吗? 三角锥形 极性分子 如何判定分子的极性? 电子云分布均匀 非极性分子 电子云分布不均匀 极性分子
△
NH4Cl NH3↑+ HCl↑ NH3 + HCl NH4Cl △ NH4 HCO3 NH3 ↑+ H2O + CO2↑
铵盐受热分解规律:①生成氨气和对应的酸 ②酸的沸点低会挥发 ③酸不稳定继续分解 ④硝酸铵受热不产生氨气
二、铵盐
(一)铵盐的化学性质
2.铵盐与碱的反应
(NH4)2SO4 + 2NaOH
课堂练习:
3.把含硫酸铵和硝酸铵的混合液aL分成两等份。 一份加入bmol NaOH并加热,恰好把NH3全部 赶出;另一份需消耗cmol BaCl2,沉淀反应恰 好完全,则原溶液中NO3-的浓度为( ) B A.
b-2c a
B.
2b-4c a
C.
2b-c a
D.
b-4c a
标准状况下气体溶解度
极易溶:HCl(1∶ 500) NH3(1∶ 700) 易溶:SO2(1∶ 40) 能溶:CO2(1∶ 2) Cl2(1∶ 2) H2S(1∶ 2.6)
二、铵盐
你知道什么叫铵盐吗?
高中化学高一化学PPT课件氨和铵盐24页PPT

1、最灵繁的人也看不见自己的背脊。——非洲 2、最困难的事情就是认识自己。——希腊 3、有勇气承担命运这才是英雄好汉。——黑塞 4、与肝胆人共事,无字句处读书。——周恩来 5、阅读使人充实,会谈使人敏捷,写作使人精确。——培根
1、不要轻言放弃,否则对不起自己。,常是愿意 去做,并愿意去冒险的人。“稳妥”之船,从未能从岸边走远。-戴尔.卡耐基。
梦 境
3、人生就像一杯没有加糖的咖啡,喝起来是苦涩的,回味起来却有 久久不会退去的余香。
高中化学高一化学PPT课件氨和铵盐 4、守业的最好办法就是不断的发展。 5、当爱不能完美,我宁愿选择无悔,不管来生多么美丽,我不愿失 去今生对你的记忆,我不求天长地久的美景,我只要生生世世的轮 回里有你。
铵盐PPT课件

(4)收集:向下排空气法
(5)验满:
①湿润的红色石蕊试纸变蓝 (唯一的一种碱性气体);
②蘸有浓HCl的玻璃棒接近 试管口产生白烟。
➢棉花的作用:
通过浸湿稀硫酸起到环保作用。
➢干燥氨气的常用试剂:
①CaO、碱石灰等碱性干燥剂 ②无水CaCl2不能用来干燥NH3(形成CaCl2.8NH3)
➢实验室中其余的制氨气的方法:
A的化学式应该是_______N_H4_I_____;
A受热变化的化学方程式是_________。
2 NH4I=2NH3↑+I2↑+H2↑
3.用一种白色固体A和一种黄色固体B做如下 实验:①A与等物质的量的一元强酸和一元强 碱都能完全作用,依次生成有毒气体C和极易 溶于水的气体D。②B在空气中燃烧生成气体 E。E与C反应又生成B。③将D通入滴有石蕊 的水中,溶液呈蓝色,再通入E,过量时溶液 由蓝变红。④将E与空气混合通入装有催化剂 的灼热的玻璃管,气体出口处有白雾生成。 则(填化学式)
四、教学过程
一、导入新课
出示长城图片,万里长城是中华民族的一个象征。 谁能说一说古代的长城主要起什么作用?(防御作用) 长城在古代防御外族入侵方面确实起了很大作用。然 而近代以来,面对列强的入侵和现代化武器,长城已 渐渐失去以往的作用,但是不屈的中国人民并没有因 为失去了长城的屏障而望天兴叹,相反,他们一直与 外敌做着不屈不挠的斗争,特别是在抗日战争中,从 大江南北到黄河两岸,中国人民用自己的血肉和不屈 的脊梁,筑起了一道新的长城。同学们,你们知道我 们的先辈是如何抗击凶恶的日本侵略者的吗?
(1)写出A~F物质的化学式。
(2)写出E→F的化学方程式: ____________。
(3)鉴别物质F中阴离子的方法是_______。
(5)验满:
①湿润的红色石蕊试纸变蓝 (唯一的一种碱性气体);
②蘸有浓HCl的玻璃棒接近 试管口产生白烟。
➢棉花的作用:
通过浸湿稀硫酸起到环保作用。
➢干燥氨气的常用试剂:
①CaO、碱石灰等碱性干燥剂 ②无水CaCl2不能用来干燥NH3(形成CaCl2.8NH3)
➢实验室中其余的制氨气的方法:
A的化学式应该是_______N_H4_I_____;
A受热变化的化学方程式是_________。
2 NH4I=2NH3↑+I2↑+H2↑
3.用一种白色固体A和一种黄色固体B做如下 实验:①A与等物质的量的一元强酸和一元强 碱都能完全作用,依次生成有毒气体C和极易 溶于水的气体D。②B在空气中燃烧生成气体 E。E与C反应又生成B。③将D通入滴有石蕊 的水中,溶液呈蓝色,再通入E,过量时溶液 由蓝变红。④将E与空气混合通入装有催化剂 的灼热的玻璃管,气体出口处有白雾生成。 则(填化学式)
四、教学过程
一、导入新课
出示长城图片,万里长城是中华民族的一个象征。 谁能说一说古代的长城主要起什么作用?(防御作用) 长城在古代防御外族入侵方面确实起了很大作用。然 而近代以来,面对列强的入侵和现代化武器,长城已 渐渐失去以往的作用,但是不屈的中国人民并没有因 为失去了长城的屏障而望天兴叹,相反,他们一直与 外敌做着不屈不挠的斗争,特别是在抗日战争中,从 大江南北到黄河两岸,中国人民用自己的血肉和不屈 的脊梁,筑起了一道新的长城。同学们,你们知道我 们的先辈是如何抗击凶恶的日本侵略者的吗?
(1)写出A~F物质的化学式。
(2)写出E→F的化学方程式: ____________。
(3)鉴别物质F中阴离子的方法是_______。
第二节第二课时 氨和铵盐课件高一下学期化学人教版必修第二册
变蓝纸
,则说明已经集满。
喷泉实验
观察实验,思考回答以下问题:
1.喷泉形成的基本原理是什么? 烧瓶内气压与大气压存在一定的压强差,外界大气压大于烧
瓶内气压,大气压将水压入烧瓶内。 2.喷泉实验成功的关键是什么? 3.哪些气体能形成喷(泉1)?装置气密性好;(2)氨气和装置要干燥
(1)极易溶于水的气体
可知n(NOSO4H)=0.004 mol× =0.01 mol,所以样品的纯度为
氯化铵受热分解:NH4Cl NH3↑+HCl↑
;
碳酸氢铵受热分解:NH4HCO3 NH3↑+CO2↑+H2O
。
自学检测
2.NH4+的检验
NH4+
无色气体
试纸 变蓝
名称 俗名
硫酸铵 硫铵
氯化铵 氯铵
碳酸氢铵 碳铵
硝酸铵 碳酰二胺
( C )。
A.①是氨气发生装置 C.③是氨气发生装置
B.②是氨气吸收装置 D.④是氨气收集、检验装置
习题巩固
2.如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨 水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确
的是( A )。
选项
实验现象
A
浓盐酸附近产生白烟
B
浓硫酸附近无明显现象
将湿润的红色石蕊试纸靠近管口,
(1)材料性能与关键结构单元
(4)原子序数小于36的元素X和Y,在周期表中既处于同一周期又位于同一族,且Y的原子序数比X大2,则Y的基态原子的价层电子排布式是______,X在参与化学反应时,1个原子失
去的电子数为__________。
+ 解析:(1)题中“恒压密闭容器”所隐含的信息是随着反应的进行,容器体积会发生改变。506 K,M点时生成的CH3OH为 0.25 mol,根据“三段式”法计算得:
氨、铵盐 PPT课件1 人教版

•
8、有些事,不可避免地发生,阴晴圆缺皆有规律,我们只能坦然地接受;有些事,只要你愿意努力,矢志不渝地付出,就能慢慢改变它的轨迹。
•
9、与其埋怨世界,不如改变自己。管好自己的心,做好自己的事,比什么都强。人生无完美,曲折亦风景。别把失去看得过重,放弃是另一种拥有;不要经常艳羡他人,人做到了,心悟到了,相信属于你的风景就在下一个拐弯处。
将氨气通入硝酸或硫酸中,写出反应 的方程式:
NH3 + HNO3 = NH4NO3 2NH3 + H2SO4 = (NH4)2SO4 NH3 + HCl = NH4Cl
实质:
NH3 +H+ =NH4+
利用该性质工业上可制氮肥
4. 氨气的用途
性质特点
易液化,液氨 汽化时吸热
易溶于水 跟水反应 碱性(跟酸反应)
NH3·H2O
NH4++OH-
氨水中的微粒: 3种分子: H2O、NH3、 NH3·H2O 3种离子: NH4+、OH- 、H+
NH3·H2O = NH3 ↑+ H2O
⑵ 氨与酸的反应
NH3 + HCl == NH4Cl
思 考 氨气是否与所有的酸反应都有白烟生成呢? :
结论:氨气与挥发性酸(盐酸、硝酸等) 反应才有白烟生成 (此为检验氨气方法之一)
氨气泄漏
2004年4月20日上午10时,杭州市一制 冷车间液氨储存罐破裂,造成大量氨气 泄露,整个厂区被一片白雾笼罩,厂区 内寒气逼人。空气中弥漫着一股浓烈的 刺激性气味,令人眼睛刺痛,连呼吸都 感到困难。消防员赶到后,马上展开了 救援工作……
第二节 氨 铵盐
一、氨
1. 氨的结构
人教版高中化学必修二课件氨铵盐

*。注本浓身意H受12:S热O铵要4、盐分不无解能水。用CNaHC4NlO2、3或P(2NOH45)均2C与O3。N因H3为反它应们
注意2:消石灰不能用NaOH、KOH代替。因为它们 易潮解结块,不利于NH3产生;高温下腐蚀试管。
一、氨NH3:
3、氨的化学性质: (1)与水反应:zx```x``k NH3+H2ONH3·H2ONH4++OH*氨涉水及中氨存水在浓哪度些时粒,子氨?水的溶质是NH3,而 不是NH3·H2O。
高中化学课件
灿若寒星整理制作
氮族元素 zxx``k
氨铵盐
第一课时
一、氨NH3:
写出分子式、电子式、结构式、空间构型。
1、氨的存在、物理性质: 无色刺激性气味的气体。 喷—泉极实易验溶于水(相似相溶、氢键),氨水是弱 碱。 易液化(氢键),液氨气化时吸收大量热 —致冷剂。
*氨水的密度小于水的密度,所以氨水的 浓度越大,密度越小。
一、氨NH3:
2、“氨ห้องสมุดไป่ตู้的碱实制验弱室碱制”:法:
2NH4Cl+Ca(OH)2==CaCl2+2NH3+2H2O 问题1:原料试剂用溶液还是固体?为什么? 问题2:用怎样的发生装置?决定因素是? 问题3:如何收集氨气?怎样检验是否集满? 问题4:氨气对人体有害吗?如何尾气处理? 问题5:如何干燥氨气? 用碱石灰、干燥管
(2)与酸反应:写出NH3分别与HCl、HNO3 、 H*与2S挥O4发反性应酸的如化H学X方、程H式NO。3在空气中相遇形 成白烟是NH3的检验方法之一。 *NH3检验之二—湿润的红色石蕊试纸变蓝
一、氨NH3:
3、氨的化学性质:zx````x``k
问(3)题-3价21:氮通根的常据还最化原低合性价:非分金析属NH元3还素应被有氧的化性后质的? 产a.在物纯是氧什中么燃?烧:4NH3+3O2==2N2+6H2O b.催化氧化: 4NH3+5O2==Pt4NO+6H2O *将已烧知红在的一铂定丝条接件近下锥NH形3能瓶被中C浓l2氨氧水化的,表写面出, 会可看能到的铂化丝学持反续应红方热程、式并。有少量白烟产生的 现烟当象 的N。 有H3铂关足丝反量持应时续 方:红程28NN热式HH的。33++原33CC因ll22==是NN,22++写66HN出HC产l4C生l 白
注意2:消石灰不能用NaOH、KOH代替。因为它们 易潮解结块,不利于NH3产生;高温下腐蚀试管。
一、氨NH3:
3、氨的化学性质: (1)与水反应:zx```x``k NH3+H2ONH3·H2ONH4++OH*氨涉水及中氨存水在浓哪度些时粒,子氨?水的溶质是NH3,而 不是NH3·H2O。
高中化学课件
灿若寒星整理制作
氮族元素 zxx``k
氨铵盐
第一课时
一、氨NH3:
写出分子式、电子式、结构式、空间构型。
1、氨的存在、物理性质: 无色刺激性气味的气体。 喷—泉极实易验溶于水(相似相溶、氢键),氨水是弱 碱。 易液化(氢键),液氨气化时吸收大量热 —致冷剂。
*氨水的密度小于水的密度,所以氨水的 浓度越大,密度越小。
一、氨NH3:
2、“氨ห้องสมุดไป่ตู้的碱实制验弱室碱制”:法:
2NH4Cl+Ca(OH)2==CaCl2+2NH3+2H2O 问题1:原料试剂用溶液还是固体?为什么? 问题2:用怎样的发生装置?决定因素是? 问题3:如何收集氨气?怎样检验是否集满? 问题4:氨气对人体有害吗?如何尾气处理? 问题5:如何干燥氨气? 用碱石灰、干燥管
(2)与酸反应:写出NH3分别与HCl、HNO3 、 H*与2S挥O4发反性应酸的如化H学X方、程H式NO。3在空气中相遇形 成白烟是NH3的检验方法之一。 *NH3检验之二—湿润的红色石蕊试纸变蓝
一、氨NH3:
3、氨的化学性质:zx````x``k
问(3)题-3价21:氮通根的常据还最化原低合性价:非分金析属NH元3还素应被有氧的化性后质的? 产a.在物纯是氧什中么燃?烧:4NH3+3O2==2N2+6H2O b.催化氧化: 4NH3+5O2==Pt4NO+6H2O *将已烧知红在的一铂定丝条接件近下锥NH形3能瓶被中C浓l2氨氧水化的,表写面出, 会可看能到的铂化丝学持反续应红方热程、式并。有少量白烟产生的 现烟当象 的N。 有H3铂关足丝反量持应时续 方:红程28NN热式HH的。33++原33CC因ll22==是NN,22++写66HN出HC产l4C生l 白
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
写在最后
经常不断地学习,你就什么都知道。你知道得越多,你就越有力量 Study Constantly, And You Will Know Everything. The More
You Know, The More Powerful You Will Be
谢谢你的到来
学习并没有结束,希望大家继续努力
2、用红色石蕊试纸或浓盐酸检验 逸出的氨气
铵与碱反应的性质利用之二
——NH3的实验室制法
(1)原料:
NH4NO3在加热时会发生爆炸性的分解 (NH4)2CO3分解产生的CO2,使制得氨气
含较多的杂质
KOH、NaOH具有吸湿性,易结块,不
利于产生NH3
高温下KOH、NaOH腐蚀玻璃能力更强
(2)原理:2NH4Cl+Ca(OH)2===CaCl2+2NH3↑+2H2O (3)装置: 固+固,加热
铵盐可作为氮肥,如何保存氮肥?
练习
下列物质分解后不留残渣的是 () (A)NaHCO3 (B)NH4HCO3 (C)NH4Cl (D)Cu(NO3)2
答案:B C
(2)、铵盐与碱的反应——都能产生氨气
实验: 10%NaOH
10%NaOH
(NH4)2SO4
NH4NO3
根据实验写出反应的离子方程式
(2)与碱反应: NH4++OH-=NH3·H2O==NH3 +H2O
结构
氨分子中有三个N—H极 NH4+中,4个键的键长、键角、 性键、键角为107º18´。分 键能都相等,键角为109°28′
子构型为三角锥型
分子构型为正四面体
相关 互系
NH3
酸 碱
NH4+
2. 铵盐的物理性质
铵盐均为无色或白色的离子晶体
铵盐均可溶
3. 铵盐的化学性质
(1)、热稳定性差——铵盐均受热分解
*注意1:铵盐与碱固体间反应时不能写离 子方程式。
*注意2:铵盐与碱溶液间反应时浓溶液或加 热产生氨气,稀溶液不加热生成NH3 • H2O。 *问题1:氯化铵受热时的现象是升华吗?
*问题2:为什么铵肥施用时要埋在土下并 及时灌水?
铵与碱反应的性质利用之一 ——铵根离子的检验
检验方法:
1、先将其与强碱共热逸出NH3
③不能用浓硫酸或五氧化二磷(酸性干燥剂)
➢除了利用上述方法之外,
实验室有无其它简单可行 的方法来制得氨气?
浓氨水 CaO
练习
能用于干燥氨气的干燥剂是( )
(A)浓硫酸
(B)无水CaCl2 (C)碱石灰
(D)P2O5
答案:C
三、氮肥
1:尿素 CO(NH2)2白色或浅黄色针状结晶或小 颗粒,溶于水,中性,含氮量45 ~ 46%。 2:碳酸氢铵(碳铵)NH4HCO3白色结晶,吸湿 性很强,易潮解,溶于水,弱碱性, 结硬块,含 氮量17%。 3:氯化铵 NH4CL 白色或淡黄色结晶,有吸湿性, 溶液于水,酸性,含氮量25%。 4:硝酸铵 NH4NO3 白色结晶,易潮解,结硬块, 溶于水,微酸性,含氮量34%。 5;硫酸铵(NH4)2SO4 硫铵或肥田粉,白色粒状 结晶,吸湿性不大,不易结块,含氮量20%左右。
第一章 氮族元素
第二节 氨 铵盐
一、氨气
1、强极性键构成的极性分子
2、能与酸反应,形成配位键(孤对电子)
3、还原性(N处于最低价态-3)
二、铵盐
1. 铵盐的结构
铵盐均为离子化合物
氨分子与铵根离子的区别
构成
由一个氮原子和三个氢 原子构成的不显电性的 分子
由一个氮原子和四个氢原 子构成的带一个单位正电 荷的阳离子
Learning Is Not Over. I Hope You Will Continue To Work Hard
演讲人:XXXXXX 时 间:XX年XX月XX日
规律: (分三种情况)
对热稳定的非氧化性酸的铵盐,受热分解生成NH3和相应的
酸(NH4Cl)
对热不稳定的非氧化性酸的铵盐受热分解生成NH3和相应酸
的分解产物[(NH4)2CO3]
氧化性酸的铵盐,受热分解情况复杂,产物可能为NH3或N2
或氮的氧化物等[NH4NO3、(NH4)2SO4]
铵盐分解不一定都有氨气产生
与所学哪些气体的制备装置类似? (4)收集 向下排空气法 (5)验满
①湿润的红色石蕊试纸变蓝(唯一的一种碱性气体) ②蘸有浓HCl的玻璃棒接近试管口产生白烟
棉花的作用: 防止空气对流些?
①CaO、碱石灰、固体氢氧化钠等碱性干燥剂 ②不能用无水CaCl2用来干燥NH3 (形成 CaCl2.8NH3)
