选修三 第二章 第3节 分子的性质 第二课时学案
人教版高中化学选修三教案-分子的性质 第二课时

第三節分子的性質[講]範德華力:分子之間存在著相互作用力。
範德華力很弱,約比化學鍵能小l一2數量級。
相對分子品質越大,範德華力越大;分子的極性越大,範德華力也越大。
[板書](2)大小判斷:1 影響分子間作用力的主要因素:分子的相對分子品質、分子的極性等2 組成和結構相似的物質,相對分子品質越大,分子間作用力越大。
3 分子的極性越強,分子間作用力越大。
[學與問]怎樣解釋鹵素單質從F2~I2的熔、沸點越來越高?[彙報]相對分子品質越大,範德華力越大,熔、沸點越來越高。
[板書]2、分子間作用力對物質的熔、沸點的影響:範德華力越大,物質的熔沸點越高。
[投影][講]能量遠小於化學鍵能,分子間作用力一般只有每摩爾幾千焦至幾十千焦,比化學能小1-2個數量極,分子間作用力主要影響分子晶體類型物質的物理性質,而化學鍵主要影響物質的化學性質。
存在於分子之間,且分子間充分接近時才有相互間的作用力,如固體和液體物質中。
[問]夏天經常見到許多壁虎在牆壁或天花板上爬行,卻掉不下來,為什麼?[講]壁虎為什麼能在天花板土爬行自如?這曾是一個困擾科學家一百多年的謎。
用電子顯微鏡可觀察到,壁虎的四足覆蓋著幾十萬條纖細的由角蛋白構成的納米級尺寸的毛。
壁虎的足有多大吸力?實驗證明,如果在一個分幣的面積土布滿100萬條壁虎足的細毛,可以吊起20kg重的物體。
近年來,有人用電腦模擬,證明壁虎的足與牆體之間的作用力在本質上是它的細毛與牆體之間的範德華力。
[投影][設問]你是否知道,常見物質中,水是熔、沸點較高的液體之一?你是否知道,冰的密度比液態的水小?[投影]為什麼水、氟化氫和氨的沸點出現反常。
[板書]四、氫鍵及其對物質性質的影響[講]為了解釋水的這些奇特性質,人們提出了氫鍵的概念。
氫鍵是除範德華力外的另一種分子間作用力,它是由已經與電負性很強的原子形成共價鍵的氫原子(如水分子中的氫)與另一個分子中電負性很強的原子(如水分子中的氧)之間的作用力。
选修三 第二章 第3节 分子的性质 第二课时学案

第三节分子的性质第二课时【学习目标】1.范德华力、氢键及其对物质性质的影响2.能举例说明化学键和分子间作用力的区别3.例举含有氢键的物质【学习过程】【知识梳理】二、范德华力及其对物质性质的影响范德华力:分子间普遍存在的作用力,又叫分子间作用力。
范德华力很弱,约比化学键小l一2数量级。
〔探究〕:(1)范德华力大小结论1:范德华力很弱,比化学键的键能小得多。
(2)范德华力与相对分子质量的关系:范德华力结论2:相对分子质量越大,范德华力越大。
(3)范德华力与分子的极性的关系:结论3:分子的极性越大,范德华力越大。
三、氢键及其对物质性质的影响非金属元素的氢化物在固态时是分子晶体,其熔沸点和其分子量有关.对于同一主族非金属元素而言,从上到下,分子量逐渐增大,熔沸点应逐渐升高.而HF、H2O、NH3却出现反常,为什么?说明在HF、H2O、NH3分子间还存在除分子间作力之外其他作用.这种作用就是氢键。
1. 氢键:(1)氢键的表示:氢键可以用A—H…B表示。
(2)形成氢键的一般条件:电负性很强的原子形成共价键的氢原子(如水分子中的氢)与另一个分子中电负性很强的原子(3)分子内氢键和分子间氢键2. 氢键对物质性质的影响(1)分子间氢键,使物质的熔、沸点升高:(2)分子间内氢键,使物质的熔、沸点降低:思考:氢键是否属于“化学键”?它与化学键、分子间作用力(范德华力)有什么关系?化学键>氢键>范德华力【典题解悟】例1. 下列物质的沸点,从高到低的顺序正确的是()A.HI>HBr>HCl>HFB.CI4>CBr4>CCl4>CF4C.NaCl>Na Br>KBrD.Na>Mg>Al解析:HI、HBr、HCl三个分子结构相似,相对分子质量依次减小,范德华力依次减弱,熔、沸点依次变小,而HF中还存在氢键,故HF的熔、沸点反常,为最大,则沸点大小顺序为HF>HI>HBr>HCl;而CI4、CBr4、CCl4、CF4结构相似,相对分子质量依次减小,范德华力依次减弱,熔、沸点依次变小;NaCl、NaBr、KBr中存在离子键,离子所带电荷相同,离子间距依次变大,故离子键的作用力依次变小,沸点依次变小;Na、Mg、Al是金属,它们的原子最外层价电子数依次为1、2、3,Na+、Mg2+、Al3+半径依次变小,故金属键的作用力依次增大,沸点依次变大。
选修三第二章第三节《分子的性质》的学案设计

选修三第二章第三节《分子的性质》的学案设计(第一课时:键的极性和分子的极性)【目标导示】:1.了解极性共价键和非极性共价键;2.结合常见物质分子立体结构,能够辨认常见的极性分子和非极性分子;3.了解化学键的极性与分子极性的关系。
【学习重点】:多原子分子中,极性分子和非极性分子的判断。
【内容导航】:1.键的极性从共用电子对是否有偏移可把共价键分为极性键和非极性键,键的极性是指_____________________。
(1)极性键:由________的原子形成的共价键。
成键电子对在两原子间____________。
(2)非极性键:由________的原子形成的共价键。
成键电子对在两原子间____________。
请判断:在O2、HCl、CH4、PCl3、H2O、CO2、H2O2、CH3CH2OH、P4中,只含非极性键的分子是__________________________,只含极性键的分子是___________________________,既含极性键又含非极性键的分子有______________________________________。
【点拔】:①键的“极性”其含义是指:共用电子对的偏移。
不同种原子形成的共价键可能有极性,也可能无极性。
②键的极性大小(强弱)是指共用电子对偏移程度,共用电子对偏移程度越大,键的极性越大(越强)。
③形成共价键的两种元素的原子的电负性相差越大,键的极性越大。
2.分子的极性(1)极性分子:正电中心和负电中心_____,使分子的某一部分呈正电性,另一部分呈负电性的分子。
(2)非极性分子:正电中心和负电中心______的分子。
3.键的极性和分子极性的关系(1)只含非极性键的分子一定是非极性分子。
(2)含有极性键的分子有没有极性,必须依据分子中极性键的极性的向量和是否等于零而定,等于零时是非极性分子,否则是极性分子。
(3)共价键的极性与分子的极性的关系可总结如下:一般规律:a以极性键结合成的双原子分子是____________。
人教版高中化学选修三教案-2.3 分子的性质 第二课时_最新修正版

第三节分子的性质[讲]范德华力:分子之间存在着相互作用力。
范德华力很弱,约比化学键能小l一2数量级。
相对分子质量越大,范德华力越大;分子的极性越大,范德华力也越大。
[板书](2)大小判断:1 影响分子间作用力的主要因素:分子的相对分子质量、分子的极性等2 组成和结构相似的物质,相对分子质量越大,分子间作用力越大。
3 分子的极性越强,分子间作用力越大。
[学与问]怎样解释卤素单质从F2~I2的熔、沸点越来越高?[汇报]相对分子质量越大,范德华力越大,熔、沸点越来越高。
[板书]2、分子间作用力对物质的熔、沸点的影响:范德华力越大,物质的熔沸点越高。
[投影][讲]能量远小于化学键能,分子间作用力一般只有每摩尔几千焦至几十千焦,比化学能小1-2个数量极,分子间作用力主要影响分子晶体类型物质的物理性质,而化学键主要影响物质的化学性质。
存在于分子之间,且分子间充分接近时才有相互间的作用力,如固体和液体物质中。
[问]夏天经常见到许多壁虎在墙壁或天花板上爬行,却掉不下来,为什么?[讲]壁虎为什么能在天花板土爬行自如?这曾是一个困扰科学家一百多年的谜。
用电子显微镜可观察到,壁虎的四足覆盖着几十万条纤细的由角蛋白构成的纳米级尺寸的毛。
壁虎的足有多大吸力?实验证明,如果在一个分币的面积土布满100万条壁虎足的细毛,可以吊起20kg重的物体。
近年来,有人用计算机模拟,证明壁虎的足与墙体之间的作用力在本质上是它的细毛与墙体之间的范德华力。
[投影][设问]你是否知道,常见物质中,水是熔、沸点较高的液体之一?你是否知道,冰的密度比液态的水小?[投影]为什么水、氟化氢和氨的沸点出现反常。
[板书]四、氢键及其对物质性质的影响[讲]为了解释水的这些奇特性质,人们提出了氢键的概念。
氢键是除范德华力外的另一种分子间作用力,它是由已经与电负性很强的原子形成共价键的氢原子(如水分子中的氢)与另一个分子中电负性很强的原子(如水分子中的氧)之间的作用力。
新人教版高二化学选修3:分子的性质(第2课时)教案 Word版

第二課時教學目標1、範德華力、氫鍵及其對物質性質的影響2、能舉例說明化學鍵和分子間作用力的區別3、例舉含有氫鍵的物質4、採用圖表、比較、討論、歸納、綜合的方法進行教學5、培養學生分析、歸納、綜合的能力教學重點分子間作用力、氫鍵及其對物質性質的影響教學難點分子間作用力、氫鍵及其對物質性質的影響教學過程[創設問題情景]氣體在加壓或降溫時為什麼會變成液體或固體?學生聯繫實際生活中的水的結冰、氣體的液化,討論、交流。
[結論]表明分子間存在著分子間作用力,且這種分子間作用力稱為範德華力。
[思考與討論]仔細觀察教科書中表2-4,結合分子結構的特點和數據,能得出什麼結論?[小結]分子的極性越大,範德華力越大。
[思考與交流]完成“學與問”,得出什麼結論?[結論]結構相似時,相對分子品質越大,範德華力越大。
[過渡]你是否知道,常見的物質中,水是熔、沸點較高的液體之一?冰的密度比液態的水小?為了解釋水的這些奇特性質,人們提出了氫鍵的概念。
[閱讀、思考與歸納]學生閱讀“三、氫鍵及其對物質性質的影響”,思考,歸納氫鍵的概念、本質及其對物質性質的影響。
[小結]氫鍵是除範德華力之外的另一種分子間作用力。
氫鍵是由已經與電負性很強的原子(如水分子中的氫)與另一個分子中電負性很強的原子(如水分子中的氧)之間的作用力。
氫鍵的存在大大加強了水分子之間的作用力,使水的熔、沸點教高。
[講解]氫鍵不僅存在於分子之間,還存在於分子之內。
一個分子的X-H鍵與另一個分子的Y相結合而成的氫鍵,稱為分子間氫鍵,如圖2-34 一個分子的X-H鍵與它的內部的Y相結合而成的氫鍵稱為分子內氫鍵,如圖2-33 [閱讀資料卡片]總結、歸納含有氫鍵的物質,瞭解各氫鍵的鍵能、鍵長。
[小結]本節主要是分子間作用力及其對物質性質的影響,氫鍵及其對物質性質的影響。
練習1.下列各組物質的晶體中,化學鍵類型相同,熔化時所克服的作用力也完全相同的是A.CO2和SiO2B.NaCl和HClC.(NH4)2CO3和CO(NH2)2D.NaH和KCl2.你認為下列說法不正確的是A.氫鍵存在於分子之間,不存在於分子之內B.對於組成和結構相似的分子,其範德華力隨著相對分子品質的增大而增大C.NH3極易溶於水而CH4難溶於水的原因只是NH3是極性分子,CH4是非極性分子D.冰熔化時只破壞分子間作用力3.沸騰時只需克服範德華力的液體物質是A.水B.酒精C.溴D.水銀4.下列物質中分子間能形成氫鍵的是A.N2 B.HBr C.NH3 D.H2S5.以下說法哪些是不正確的?(1) 氫鍵是化學鍵(2) 甲烷可與水形成氫鍵(3) 乙醇分子跟水分子之間存在範德華力⑷碘化氫的沸點比氯化氫的沸點高是由於碘化氫分子之間存在氫鍵6.乙醇(C2H5OH)和二甲醚(CH3OCH3)的化學組成均為C2H6O,但乙醇的沸點為78.5℃,而二甲醚的沸點為-23℃,為何原因?7.你認為水的哪些物理性質與氫鍵有關?試把你的結論與同學討論交流。
选修三第二章第三节《分子的性质》第二课时的学案设计

选修三第二章第三节《分子的性质》的学案设计(第二课时:分子间作用力及其对物质性质的影响)【目标导示】:1.了解xxx力的实质及其对物质性质的影响;2.了解氢键的实质和正确的表示方法;3.了解氢键的特点、形成条件以及对物质性质的影响。
【学习重点】:1.xxx力对物质性质的影响;2.氢键的形成及其对物质性质的影响。
【内容导航】:1.xxx力及其对物质性质的影响(1)概念:xxx力是________之间普遍存在的_________________,它使得许多物质能以一定的凝聚态(固态或液态)存在。
(2)特征:xxx力很________,比化学键的键能小____________数量级。
(3)影响因素:①分子的极性越大,xxx力越大。
如HCl、HBr、HI的xxx力由大到小的顺序是_________________。
②结构和组成相似的物质,相对分子质量越大,xxx力越大。
如Br2、Cl2、F2、I2中,xxx力由大到小的顺序是____________________;CCl4、CI4、CBr4、CF4中,xxx力由大到小的顺序是_____________________。
(4)对物质性质的影响:xxx力主要影响物质的物理性质,如熔、沸点。
结构和组成相似的物质,xxx力越大,物质的熔、沸点越________。
这是因为xxx力越大,物质气化和液化时所需能量越_______之故。
按此规律:Br2、Cl2、F2、I2熔、沸点由高到低的顺序是__________________;H2Se、H2Te、H2S沸点由高到低的顺序是__________________。
(5)壁虎能在天花板上爬行自如的本质原因:壁虎能在天花板上爬行自如,而不会掉下,这说明壁虎的足与墙体(或天花板)之间存在着一种作用力,通过计算机模拟实验得到证明,这种作用力本质上是_____________________________________________________________。
(人教版选修3)第二章 《分子结构与性质》教学设计

(人教版选修3)第二章《分子结构与性质》教学设计第三节分子的性质(第一课时键的极性和分子的极性)【交流7】⑦金属元素和非金属元素间可能存在共价键,如AlCl3等。
【典例1】下列叙述中正确的是()A.不同种元素的原子形成的分子中不可能含有非极性键B.离子化合物中不可能含有非极性键C.只由非金属元素形成的化合物中不可能含有离子键D.共价化合物中不可能含有离子键【答案】D【解析】A项,如H2O2中含非极性键,错误;B项,如Na2O2中含非极性键,错误,C项,只由非金属元素形成的化合物如NH4Cl是含有离子键的离子化合物,错误;D项,含有离子键的化合物一定是离子化合物,离子化合物中可能含有共价键,共价化合物中不能含离子键,正确。
【典例2】CO2的资源化利用是解决温室效应的重要途径。
以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应:NH3+CO2+H2O下列有关三聚氰酸的说法正确的是()A.分子式为C3H6N3O3B.分子中既含极性键,又含非极性键C.属于共价化合物D.生成该物质的上述反应为中和反应【答案】C【解析】依据碳原子4价键结构和氮原子3价键结构补上H原子后分别数出C、H、O、N的个数可知:它的分子式为C3H3N3O3,是仅有极性键(不同种元素原子间形成的共价键)形成的共价化合物,故A项、B项错误,C项正确;该反应是非电解质之间的反应,不是酸与碱反应生成盐和水的反应,所以不是中和反应,D项错误。
【板书】活动二、分子的极性【思考】阅读教材P45页内容,思考什么是极性分子和非极性分子?请举例说明。
【交流1】(1)极性分子:如果分子中正电中心与负电中心不重合,使分子的某一部分呈正电性(δ+),另一部分呈负电性(δ-),这样的分子是极性分子,如HCl、NH3等。
【交流2】(2)非极性分子:如果分子中正电中心与负电中心重合,这种分子是非极性分子,如CO2等。
【交流3】思维程序:【讨论1】(1)结合教材P45页图2-26,思考键的极性与分子的极性及分子立体构型有何关系?完成下表内容.【投影】分子类型键的极性分子立体构型分子极性代表分子双原子分子A2非极性键直线(不对称)非极性N2等AB极性键直线(对称)极性CO、HF等三原子分子AB2直线(对称)非极性CO2、CS2、BeCl2等V形(不对称)极性H2O、H2S、SO2等部分正电性,但整个分子仍显电中性。
2.3《分子的性质》教案 新人教选修3

第三节分子的性质第一课时教学目标1、了解极性共价键和非极性共价键;2、结合常见物质分子立体结构,判断极性分子和非极性分子;3、培养学生分析问题、解决问题的能力和严谨认真的科学态度。
重点、难点多原子分子中,极性分子和非极性分子的判断。
教学过程创设问题情境:(1)如何理解共价键、极性键和非极性键的概念;(2)如何理解电负性概念;(3)写出H2、Cl2、N2、HCl、CO2、H2O的电子式。
提出问题:由相同或不同原子形成的共价键、共用电子对在两原子出现的机会是否相同?讨论与归纳:通过学生的观察、思考、讨论。
一般说来,同种原子形成的共价键中的电子对不发生偏移,是非极性键。
而由不同原子形成的共价键,电子对会发生偏移,是极性键。
提出问题:(1)共价键有极性和非极性;分子是否也有极性和非极性?(2)由非极性键形成的分子中,正电荷的中心和负电荷的中心怎样分布?是否重合?(3)由极性键形成的分子中,怎样找正电荷的中心和负电荷的中心?讨论交流:利用教科书提供的例子,以小组合作学习的形式借助图示以及数学或物理中学习过的向量合成方法,讨论、研究判断分子极性的方法。
总结归纳:(1)由极性键形成的双原子、多原子分子,其正电中心和负电中心重合,所以都是非极性分子。
如:H2、N2、C60、P4。
(2)含极性键的分子有没有极性,必须依据分子中极性键的极性向量和是否等于零而定。
当分子中各个键的极性的向量和等于零时,是非极性分子。
如:CO2、BF3、CCl4。
当分子中各个键的极性向量和不等于零时,是极性分子。
如:HCl、NH3、H2O。
(3)引导学生完成下列表格一般规律:a.以极性键结合成的双原子分子是极性分子。
如:HCl、HF、HBrb.以非极性键结合成的双原子分子或多原子分子是非极性分子。
如:O2、H2、P4、C60。
c.以极性键结合的多原子分子,有的是极性分子也有的是非极性分子。
d.在多原子分子中,中心原子上价电子都用于形成共价键,而周围的原子是相同的原子,一般是非极性分子。
人教版高二化学选修3教学案:第二章 第三节 分子的性质含答案

1.了解共价键的极性及分子的极性及其产生的原因。
2.知道范德华力、氢键对物质性质的影响。
3.了解影响物质溶解性的因素及相似相溶原理。
4.了解手性分子在生命科学等方面的应用。
5.了解无机含氧酸分子酸性强弱的原因。
细读教材记主干1.共价键依据电子对是否偏移分为非极性键和极性键,依据电子云的重叠方式分为σ键和π键。
2.分子间作用力是化学键吗?其主要影响物质的物理性质还是化学性质?提示:不是,其主要影响物质的物理性质,如熔、沸点,溶解性等。
3.极性分子中一定有极性键,含极性键的分子不一定是极性分子。
非极性分子中可能有极性键,也可能含有非极性键。
4.分子的相对分子质量越大,范德华力越大,其熔、沸点越高。
若分子之间存在氢键,会使物质的熔、沸点升高。
5.非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂;溶质和溶剂之间形成氢键,可增大其溶解度。
6.无机含氧酸的通式(HO)m RO n,若成酸元素R相同,n值越大,酸性越强。
[新知探究]1.键的极性2.分子的极性3.键的极性和分子极性的关系(1)只含非极性键的分子一定是非极性分子。
(2)含有极性键的分子有没有极性,必须依据分子中极性键的极性的向量和是否等于零而定,等于零时是非极性分子。
[名师点拨]分子极性的判断方法只含非极性键→非极性分子(单质分子,如Cl2,N2,P4,I2)等[对点演练]1.(2016·桓台高二检测)下列含有极性键的非极性分子是( )①CCl4②NH3③CH4④CO2⑤N2⑥H2O ⑦HFA.②③④⑤B.①③④⑤C.①③④ D.以上均不对解析:选C ①CCl4中含有极性键,空间结构为正四面体,正负电荷的中心重合,属于非极性分子;②NH3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,属于极性分子;③CH4中含有极性键,空间结构为正四面体,正负电荷的中心重合,属于非极性分子;④CO2含有极性键,空间结构为直线型,属于非极性分子;⑤N2是由非极性键构成的非极性分子;⑥H2O中含有极性键,空间结构为V型,属于极性分子;⑦HF是极性键形成的极性分子;含有极性键的非极性分子是①③④,C项正确。
【优选整合】人教版高中化学选修三2-3-2分子的性质(第二课时)学案2.docx
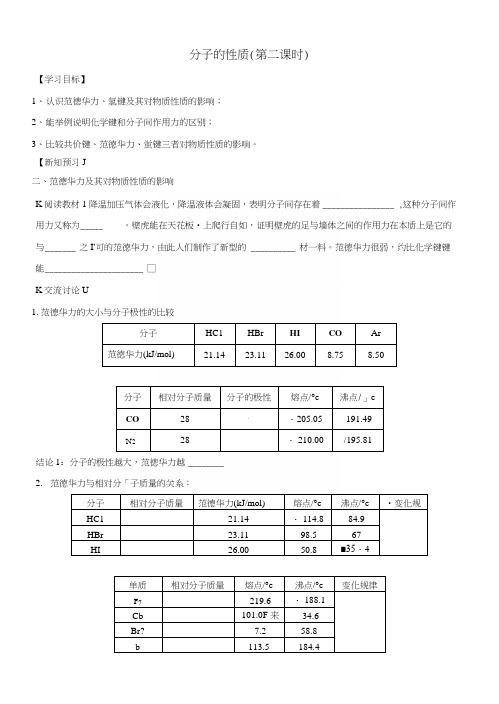
分子的性质(第二课时)【学习目标】1、认识范德华力、氢键及其对物质性质的影响;2、能举例说明化学键和分子间作用力的区别;3、比较共价键、范徳华力、蛍键三者对物质性质的影响。
【新知预习J二、范德华力及其对物质性质的影响K阅读教材1 降温加压气体会液化,降温液体会凝固,表明分子间存在着________________ ,这种分子间作用力又称为_____ 。
壁虎能在天花板•上爬行自如,证明壁虎的足与墙体之间的作用力在本质上是它的与_______ 之I'可的范徳华力,由此人们制作了新型的 __________ 材一料。
范徳华力很弱,约比化学键键能______________________ □K交流讨论U1.范德华力的大小与分子极性的比较分子HC1HBr HI CO Ar范徳华力(kJ/mol)21.1423.1126.008.758.50分子相对分子质量分子的极性熔点/°c沸点/」cCO281・205.05-191.49N228・ 210.00-/195.81结论1:分子的极性越大,范徳华力越________2.范徳华力与相对分「子质量的关系:分子相对分子质量范德华力(kJ/mol)熔点/°c沸点/°c•变化规HC121.14・ 114.8-84.9HBr23.11-98.5-67HI26.00-50.8■35・4单质相对分子质量熔点/°c沸点/°c变化规律F7-219.6・ 188.1Cb-101.0F 来-34.6Br?-7.258.8b113.5184.4结论2:分子的相对分子质量越大,范一德华力越三、氢键及其对物质性质的影响K 自主探究』非金属元素的氢化物熔沸点高低和相对分子质量有关。
沸点/O 0075对•于同一主族非金属元素氢化物而言,从上到下,相对分子质量逐渐增大,分子间作力逐渐增强,熔沸点应逐渐升高。
而HF 、出0、NH3却出现反常,CH-为正常的,为什么?说明在HF 、H 20> NH3分子间还存在除分子间作用力之外其他作用,这种作用就是 ___________ o1、 ___________________________ 氢键:是由已经与电负性很 的原子形成共价键的氢原子(如水分子屮的氢)与另一个分子中电负性很的原子(如水分子中的氧)之间的作用力。
高中化学 第二章 第三节分子的性质 教案 新人教版选修3

"四川省德阳五中高中化学第二章第三节分子的性质教案新人教版选修3 "【教学流程图】【引导归纳】从H2分子是非极性分子,HCl分子是极性分子不难得出分子极性的概念。
【板书】非极性分子:正电中心与负电中心重合的分子极性分子:正电中心与负电中心不重合的分子【提问】以下双原子分子中,哪些是极性分子,哪些是非极性分子?N2 O2Cl2 CO【引导学生归纳】以极性键结合的双原子分子为极性分子;以非极性键结合的双原子分子为非极性分子【多媒体展示】CO2、H2O、NH3、BF3、CH4等分子模型【方法引领】对于多原子分子,该如何分析?以CO2为例,从概念出发分析正电中心与负电中心是否重合,表示如下图:另外,为了加深理解,我们也可以通过物理学中的【教学流程图】【强调】尽管人们把氢键也称作“键”,但与化学键比较,氢键属于一种较弱的作用力,其大小介于范德华力和化学键之间,约为化学键的十分之几,不属于化学键。
【讲】下面,让我们回到之前的问题,为什么水、氟化氢和氨的沸点出现反常。
如上图所示,NH3、HF和H2O的沸点反常,分子间形成氢键会使物质的熔点和沸点升高,这是因为固体熔化或液体汽化时必须破坏分子间的氢键,从而需要消耗较多能量的缘故。
【板书】5、氢键对物质的影响:分子间氢键使物质熔点升高分子内氢键使物质熔点降低【讲】以水为例,由于水分子间形成的氢键,增大了水分子间的作用,使水的熔沸点比同周期元素中H2S高。
当水结冰时,体积膨胀,密度减小。
这些反应的性质均与氢键有关。
【投影】【讲】在水蒸气中水以单个H2O 分子形式存在;在液态水中,经常是几个水分子通过氢键结合起来,形成(H2O)n;在固态水(冰)中,水分子大范围地以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减少,因此冰能浮在水面上。
水的这种性质对水生物生存有重要的意义。
【讲】除此之外,接近水的沸点时,用实验测定的水蒸气的相对分子质量比用化学式H2O计算出来的相对分子质量大一些。
2016-2017学年人教版高中化学选修三 2.3分子的性质第2课时(教案1)

普通高中课程标准实验教科书—化学选修3人教版]第二课时复习]分子的极性判断标准,分子间作用力对物质性质的影响。
过渡]今天我们利用已学过的分子结构理论,继续研究物质的其它性质。
板书]四、溶解性讲述]物质相互溶解的性质十分复杂,有许多制约因素,如温度、压强等。
从分子结构的角度,存在“相似相溶”的规律。
蔗糖和氨易溶于水,难溶于四氯化碳;而萘和碘却易溶于四氯化碳,难溶于水。
如果分析溶质和溶剂的结构就可以知道原因了:蔗糖、氨、水是极性分子,而萘、碘、四氯化碳是非极性分子。
通过对许多实验的观察和研究,人们得出了一个经验性的“相似相溶”的规律:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
板书]1、“相似相溶”的规律:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
讲述]水是极性溶剂,根据“相似相溶”,极性溶质比非极性溶质在水中的溶解度大。
如果存在氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越好。
相反,无氢键相互作用的溶质在有氢键的水中的溶解度就比较小。
板书]2、溶解度影响因素:溶剂的极性、溶剂和溶质之间的氢键作用、讲述]此外,“相似相溶”还适用于分子结构的相似性。
例如,乙醇的化学式为CH3CH20H,其中的一OH与水分子的一OH相近,因而乙醇能与水互溶;而戊醇CH3CH2CH2CH2CH20H中的烃基较大,其中的一OH跟水分子的一OH的相似因素小得多了,因而它在水中的溶解度明显减小。
板书] 分子结构的相似性。
强调]另外,如果遇到溶质与水发生化学反应的情况,如SO2与水发生反应生成亚硫酸,后者可溶于水,因此,将增加SO2的溶解度。
思考练习]1、比较NH3和CH4在水中的溶解度。
怎样用相似相溶规律理解它们的溶解度不同?2.为什么在日常生活中用有机溶剂(如乙酸乙酯等)溶解油漆而不用水?3、在一个小试管里放入一小粒碘晶体,加入约5mL蒸馏水,观察碘在水中的溶解性(若有不溶的碘,可将碘水溶液倾倒在另一个试管里继续下面的实验)。
人教版高中化学选修3_《物质结构与性质》第二章教学案

人教版高中化学选修3_《物质结构与性质》第二章教学案第二章分子结构与性质教材分析本章比较系统的介绍了分子的结构和性质,内容比较丰富。
首先,在第一章有关电子云和原子轨道的基础上,介绍了共价键的主要类型σ键和π键,以及键参数——键能、键长、键角;接着,在共价键概念的基础上,介绍了分子的立体结构,并根据价层电子对互斥模型和杂化轨道理论对简单共价分子结构的多样性和复杂性进行了解释。
最后介绍了极性分子和非极性分子、分子间作用力、氢键等概念,以及它们对物质性质的影响,并从分子结构的角度说明了“相似相溶”规则、无机含氧酸分子的酸性等。
化学2已介绍了共价键的概念,并用电子式的方式描述了原子间形成共价键的过程。
本章第一节“共价键”是在化学2已有知识的基础上,运用的第一章学过的电子云和原子轨道的概念进一步认识和理解共价键,通过电子云图象的方式很形象、生动的引出了共价键的主要类型σ键和π键,以及它们的差别,并用一个“科学探究”让学生自主的进一步认识σ键和π键。
在第二节“分子的立体结构”中,首先按分子中所含的原子数直间给出了三原子、四原子和五原子分子的立体结构,并配有立体结构模型图。
为什么这些分子具有如此的立体结构呢?教科书在本节安排了“价层电子对互斥模型”和“杂化轨道理论”来判断简单分子和离子的立体结构。
在介绍这两个理论时要求比较低,文字叙述比较简洁并配有图示。
还设计了“思考与交流”、“科学探究”等内容让学生自主去理解和运用这两个理论。
在第三节分子的性质中,介绍了六个问题,即分子的极性、分子间作用力及其对物质性质的影响、氢键及其对物质性质的影响、溶解性、手性和无机含氧酸分子的酸性。
除分子的手性外,对其它五个问题进行的阐述都运用了前面的已有知识,如根据共价键的概念介绍了键的极性和分子的极性;根据化学键、分子的极性等概念介绍了范德华力的特点及其对物质性质的影响;根据电负性的概念介绍了氢键的特点及其对物质性质的影响;根据极性分子与非非极性分子的概念介绍了“相似相溶”规则;根据分子中电子的偏移解释了无机含氧酸分子的酸性强弱等;对于手性教科书通过图示简单介绍了手性分子的概念以及手性分子在生命科学和生产手性药物方面的应用第二章分子结构与性质第一节共价键第一课时教学目标:1.复习化学键的概念,能用电子式表示常见物质的离子键或共价键的形成过程。
选修三 第二章 第3节 分子的性质_第二课时教案

第三节分子的性质第二课时【教案目标】1.范德华力、氢键及其对物质性质的影响2.能举例说明化学键和分子间作用力的区别3.例举含有氢键的物质4.采用图表、比较、讨论、归纳、综合的方法进行教案5.培养学生分析、归纳、综合的能力【教案重点、难点】分子间作用力、氢键及其对物质性质的影响。
【教案过程】[讲述]分子的极性是分子中化学键的极性的向量和。
只含非极性键的分子也不一定是非极性分子<如O3);含极性键的分子有没有极性,必须依据分子中极性键的极性的向量和是否等于零而定。
当分子中各个键的极性的向量和等于零时,是非极性分子,否则是极性分子。
[学生]自学科学视野—表面活性剂和细胞膜回答下列问题:1、什么是表面活性剂?亲水基团?疏水基团?肥皂和洗涤剂的去污原理是什么?2、什么是单分子膜?双分子膜?3、为什么双分子膜以头向外而尾向内的方式排列?[板书]二、范德华力及其对物质的影响[创设问题情景]气体在加压或降温时为什么会变成液体或固体?学生联系实际生活中的水的结冰、气体的液化,讨论、交流。
[讲述]降温加压气体会液化,降温液体会凝固,这一事实表明,分子之间存在着相互作用力。
范德华(vandcrWaRls>是最早研究分子间普遍存在作用力的科学家,因而把这类分子问作用力称为范德华力。
[思考与讨论]仔细观察教科书中表2-7,结合分子结构的特点和数据,能得出什么结论?[结论]分子的极性越大,范德华力越大。
[板书]1、范德华力很弱,约比化学键能小l一2数量级。
相对分子质量越大,范德华力越大;分子的极性越大,范德华力也越大。
[思考与讨论]仔细观察教科书中表2-8,怎样解释卤素单质从F2~I2的熔、沸点越来越高?[板书]2、相对分子质量越大,范德华力越大,熔、沸点越来越高。
[过渡]你是否知道,常见的物质中,水是熔、沸点较高的液体之一?冰的密度比液态的水小?为了解释水的这些奇特性质,人们提出了氢键的概念。
[阅读、思考与归纳]学生阅读“三、氢键及其对物质性质的影响”,思考,归纳氢键的概念、本质及其对物质性质的影响。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三节分子的性质
第二课时
【学习目标】
1.范德华力、氢键及其对物质性质的影响
2.能举例说明化学键和分子间作用力的区别
3.例举含有氢键的物质
【学习过程】
【知识梳理】
二、范德华力及其对物质性质的影响
范德华力:分子间普遍存在的作用力,又叫分子间作用力。
范德华力很弱,约比化学键小l一2数量级。
〔探究〕:(1)范德华力大小
分子HCl HBr HI CO Ar
范德华力
21.14 23.11 26.00 8.75 8.50
(kJ/mol)
共价键键能
431.8 366298.7 745
(kJ/mol)
结论1:范德华力很弱,比化学键的键能小得多。
(2)范德华力与相对分子质量的关系:
分子HCl HBr HI
相对分子质量
范德华力
21.14 23.11 26.00
(kJ/mol)
熔点/ºC -114.8 -98.5 -50.8
沸点/ºC -84.9 -67 -35.4
单质相对分子质量熔点/ºC 沸点/ºC
F2-219.6 -188.1
Cl2-101.0 -34.6
Br2-7.2 58.8
I2113.5 184.4
结论2:相对分子质量越大,范德华力越大。
(3)范德华力与分子的极性的关系:
分子相对分子质量分子的极性熔点/ºC 沸点/ºC
CO 28 -205.05 -191.49
N228 -210.00 -195.81
结论3:分子的极性越大,范德华力越大。
三、氢键及其对物质性质的影响
非金属元素的氢化物在固态时是分子晶体,其熔沸点和其分子量有关.对于同一主族非金属元素而言,从上到下,分子量逐渐增大,熔沸点应逐渐升高.而HF、H2O、NH3却出现反常,为什么?
说明在HF、H2O、NH3分子间还存在除分子间作力之外其他作用.这种作用就是氢键。
1. 氢键:
(1)氢键的表示:氢键可以用A—H…B表示。
(2)形成氢键的一般条件:电负性很强的原子形成共价键的氢原子(如水分子中的氢)与另一个分子中电负性很强的原子
(3)分子内氢键和分子间氢键
2. 氢键对物质性质的影响
(1)分子间氢键,使物质的熔、沸点升高:
(2)分子间内氢键,使物质的熔、沸点降低:
思考:氢键是否属于“化学键”?它与化学键、分子间作用力(范德华力)有什么关系?
化学键>氢键>范德华力
【典题解悟】
例1. 下列物质的沸点,从高到低的顺序正确的是()
A.HI>HBr>HCl>HF
B.CI4>CBr4>CCl4>CF4
C.NaCl>Na Br>KBr
D.Na>Mg>Al
解析:HI、HBr、HCl三个分子结构相似,相对分子质量依次减小,范德华力依次减弱,熔、沸点依次变小,而HF中还存在氢键,故HF的熔、沸点反常,为最大,则沸点大小顺序为HF>HI>HBr>HCl;而CI4、CBr4、CCl4、CF4结构相似,相对分子质量依次减小,范德华力依次减弱,熔、沸点依次变小;NaCl、NaBr、KBr中存在离子键,离子所带电荷相同,离子间距依次变大,故离子键的作用力依次变小,沸点依次变小;Na、Mg、Al是金属,它们的原子最外层价电子数依次为1、2、3,Na+、Mg2+、Al3+半径依次变小,故金属键的作用力依次增大,沸点依次变大。
答案:BC
例2. 下列事实与氢键有关的是( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
解析:A选项与化学键有关,水加热到很高的温度都难以分解说明O—H键能大,不易
答案:B
【当堂检测】
1.当SO3晶体熔化或气化时,下列各项中发生变化的是()
A.分子内化学键B.分子间距离C.分子构型D.分子间作用力
2.下列说法正确的是()()A.氢键是一种化学键
B.甲烷可与水形成氢键
C.乙醇与水分子之间既有范德华力又有氢键
D.碘化氢的沸点比氯化氢高的原因是碘化氢分子存在氢键
3.关于氢键,下列说法正确的是()
A.每一个水分子内含有两个氢键
B.冰、水和水蒸气中都存在氢键
C.DNA中的碱基互补配对是通过氢键来实现的
D.H2O是一种非常稳定的化合物,这是由于氢键所致
4.水分子间由于氢键的存在,易发生缔合现象,可把水写成(H2O)n。
在冰中的n值为5,即每个水分子都被其他4个水分子包围形成变形四面体。
如右图所示的(H2O)5单元是由无限个这样的四面体通过氢键相互连接成一个庞大的分子晶体即冰。
下列有关叙述正确的是()A、2mol冰中有4mol氢键
B、1mol冰中有4mol氢键
C、平均每个水分子只有2个氢键
D、平均每个水分子只有5/4个氢键
5.下列化合物中氢键最强的是( )
A.CH3OH B.HF C.H2O D.NH3
6.下列现象中,其原因与氢键存在无关的是( )
A、水的熔沸点比较高
B、HCl的熔沸点比HF高
C、NH3极容易溶于水
D、邻位羟基苯甲醛的沸点比对位羟基苯甲醛沸点低
7.下列说法正确的是( )
A.含有极性键的分子一定是极性分子
B.范德华力就是分子间的万有引力
C、氢键就是氢原子和其他原子形成的化学键
D、氢键的作用力大小介于范德华力和化学键之间
8.下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是
A.液溴和苯分别受热变为气体
B.干冰和氯化铵分别受热变为气体
C.二氧化硅和铁分别受热熔化
D.食盐和葡萄糖分别溶解在水中
9. H2O与H2S结构相似,都是V型的极性分子,但是H2O的沸点是100℃,H2S的沸点是—60.7℃。
引起这种差异的主要原因是()
A.范德华力
B.共价键
C.氢键
D.相对分子质量
10. 干冰熔点很低是由于()。
A.CO2是非极性分子
B.C=O键的键能很小
C.CO2化学性质不活泼
D.CO2分子间的作用力较弱
参考答案
1.BD
2.C 3.C 4.A 5.B 6.C 7.D 8.A 9.C 10.D。
