第五章 重排反应
合集下载
药物合成反应 第五章 重排反应

• (1) the key intermediate of the rearrangement is the nitrogen- or sulfur ylide;
• (2) the R1 group has to be able to stabilize carbanions, so it is often an electronwithdrawing group;
反应机理
O R-C-R'
+
H+
OH
OH R-C-R'
+
-H
+
OH R-C-R' O-OCR" O
R-C-R'
O R"COO-HR R' C O NhomakorabeaO
H O
R´重排 O-O键断裂 -H+
O R-C-OR'
O
C R"
-R´´COO- ,
R3C- > R2CH- ,
>
CH 2
>
>RCH2- > CH3-
3. 从杂原子到碳原子的重排
Examples
Arndt-Eistert synthesis • 1. 反应通式
• 2. 反应机理
• 3. 应用特点 • 羧酸同系化C+1
第三节 碳原子到杂原子重排
一、Beckmann重排
OH
• 1. 反应通式
H+ O R´-C-NHR
R' C=N R
酮肟在酸性催化剂的作用下重排成酰胺 的反应称为贝克曼重排。
(5)拜耳-魏立格氧化重排
O RCR' + CH3COOOH
• (2) the R1 group has to be able to stabilize carbanions, so it is often an electronwithdrawing group;
反应机理
O R-C-R'
+
H+
OH
OH R-C-R'
+
-H
+
OH R-C-R' O-OCR" O
R-C-R'
O R"COO-HR R' C O NhomakorabeaO
H O
R´重排 O-O键断裂 -H+
O R-C-OR'
O
C R"
-R´´COO- ,
R3C- > R2CH- ,
>
CH 2
>
>RCH2- > CH3-
3. 从杂原子到碳原子的重排
Examples
Arndt-Eistert synthesis • 1. 反应通式
• 2. 反应机理
• 3. 应用特点 • 羧酸同系化C+1
第三节 碳原子到杂原子重排
一、Beckmann重排
OH
• 1. 反应通式
H+ O R´-C-NHR
R' C=N R
酮肟在酸性催化剂的作用下重排成酰胺 的反应称为贝克曼重排。
(5)拜耳-魏立格氧化重排
O RCR' + CH3COOOH
第五章重排的反应

第五章 重排反应
重排反应: 在同一个有机分子中,由于试剂或介质的影响,一个基
团或原子从一个原子迁移到另一个原子上,形成的新分子 中,碳骨架发生了变化(其中氢的迁移不会改变碳骨架),这 种反应称为重排反应。
W
A
BC
D
1
2
3
4
A为迁移起点原子
W
A B C D AB为1,2重排
AC为1,3重排
1
2
3
4 AD为1,4重排
卤代物与此类似:
-Cl
Cl
Cl
Cl
Cl
碳正离子在环上,得缩环产品:
NaNO2/HOAc NH2 HNO2 (HONO)
-N2
碳正离子不在环上,得扩环产品:
CH2NH2 (HONO)
CH2
-N2
H2O
CH2OH
H2O
OH
1ቤተ መጻሕፍቲ ባይዱ形成C+ 形式
(1)卤代烃 Ag+ AlCl3 (CH3)3C-CH2Cl Ag (AgNO3) (CH3)3C-CH2+AgCl
CC OH OH
4) 半频哪醇(semipinacol)
R2 R3 R1 C C R4
OH L
L = -X, -NH2,-SPh...
(1) 四取代邻乙二醇的重排 四取代连乙二醇中,如果R相同,反应简单,只得到
一种产物。 如果R不相同,反应复杂,产品取决于连乙二醇的结
构及迁移基团的能力。 X 对称的邻乙二醇的重排
(3) 羟基位于脂环上的连乙二醇的重排 重排时可引起环的扩大或缩小。两个羟基处于a或e
键不同时,产物不同。
OH OH
Ph Ph
H 2SO 4/Et2O r.t. 2 h
重排反应: 在同一个有机分子中,由于试剂或介质的影响,一个基
团或原子从一个原子迁移到另一个原子上,形成的新分子 中,碳骨架发生了变化(其中氢的迁移不会改变碳骨架),这 种反应称为重排反应。
W
A
BC
D
1
2
3
4
A为迁移起点原子
W
A B C D AB为1,2重排
AC为1,3重排
1
2
3
4 AD为1,4重排
卤代物与此类似:
-Cl
Cl
Cl
Cl
Cl
碳正离子在环上,得缩环产品:
NaNO2/HOAc NH2 HNO2 (HONO)
-N2
碳正离子不在环上,得扩环产品:
CH2NH2 (HONO)
CH2
-N2
H2O
CH2OH
H2O
OH
1ቤተ መጻሕፍቲ ባይዱ形成C+ 形式
(1)卤代烃 Ag+ AlCl3 (CH3)3C-CH2Cl Ag (AgNO3) (CH3)3C-CH2+AgCl
CC OH OH
4) 半频哪醇(semipinacol)
R2 R3 R1 C C R4
OH L
L = -X, -NH2,-SPh...
(1) 四取代邻乙二醇的重排 四取代连乙二醇中,如果R相同,反应简单,只得到
一种产物。 如果R不相同,反应复杂,产品取决于连乙二醇的结
构及迁移基团的能力。 X 对称的邻乙二醇的重排
(3) 羟基位于脂环上的连乙二醇的重排 重排时可引起环的扩大或缩小。两个羟基处于a或e
键不同时,产物不同。
OH OH
Ph Ph
H 2SO 4/Et2O r.t. 2 h
药物合成反应_第五章_重排反应

重 排
1
(CH3)3C-CH2OH
③烯烃+氢离子
-H2O H+
(CH3)3C-CH2
Wagner-Meerwein
(CH3)3C-CH=CH 2 +
Ag
(CH3)3C-CH-CH3
OCH3
H3C
Cl
④重氮盐放氮 H3C C CH2Cl (CH3)3 C-CH 3NH2 CH 3
重排的顺序:
∨
∨
CH3 CH3
CH2 CH2
莰烯
CH2
TsOH C6H6 H3C
CH3
CH3
CH3
CH2
CH3
CH3
反应机理:
重 排
1
Pinacol
邻二醇类化合物在酸催化下,失去一分子水重排生成醛或酮的反应,称为Pinacol重排。
反应机理:
R1
R2 R3 H C C R4 OHOH
R1
R2 R3 R3 1,2-迁移 C C R4 R1 C C R4 - H OH OHR2
O O OR Br Br Br Br O O O OR
重 排
4
Wolff/Arndt-Eistert
α-重氮酮在银、银盐或铜存在条件下,或用光照射或热分解都消除氮分子而重排为烯酮,
生成的烯酮进一步与羟基或胺类化合物作用得到酯类、酰胺或羧酸的反应称为Wolff重排。
反应机理:
R' C C N N O R
Ph CH3 Ph
Ph CH3 Ph C C CH3
Ac2O/ZnCl2
CH3 C O C Ph
CH3 Ph C O C Ph CH3
C
C
CH3
第五章--重排反应

△
1 23
2 OH
3
1 CH3 190℃
3
1 CH3
△
2 OH
OH CH3
CH3 OH
O CH3
CH3 O
Curtius (库尔悌斯) 反应
酰基叠氮化物在惰性溶剂中加热分解生成异氰酸酯
异氰酸酯水解则得到胺:
反应机理
实例
Schmidt (施密特)反应
羧酸、醛或酮分别与等摩尔旳叠氮酸(HN3)在强酸(硫酸、聚磷 酸、三氯乙酸等)存在下发生分子内重排分别得到胺、腈及 酰胺:
(CH3)3C-CH3NH2
NaNO2 HCl
(c)-OH, 加 H+ (-H2O)
(CH3)3C-CH2N2Cl
-N2 (CH3)3C-CH2
△
(CH3)3C-CH2OH
H+ -H2O
(CH3)3C-CH2
(CH3)3C-CH2=CH2 H+ (CH3)3C-CH-CH3
2 迁移基团迁移顺序
OCH3
Ph
Semipinacol重排
RR R C CR
OH Y
OH
Cl
C
H C
Ph
HNO2
Cl
Ph NH2
RR R CCR
OH
OH
H
C C Ph
Cl
Ph
O H
C C Ph Ph
O OH
+ CH3NO2
HO CH2NH2
HO CH2
O
CH2NO2 [H]/Ni
HNO2
OH
三、二苯基乙二酮 ——二苯乙醇酸型重排
R PCl5 + R' C
OH N
1 23
2 OH
3
1 CH3 190℃
3
1 CH3
△
2 OH
OH CH3
CH3 OH
O CH3
CH3 O
Curtius (库尔悌斯) 反应
酰基叠氮化物在惰性溶剂中加热分解生成异氰酸酯
异氰酸酯水解则得到胺:
反应机理
实例
Schmidt (施密特)反应
羧酸、醛或酮分别与等摩尔旳叠氮酸(HN3)在强酸(硫酸、聚磷 酸、三氯乙酸等)存在下发生分子内重排分别得到胺、腈及 酰胺:
(CH3)3C-CH3NH2
NaNO2 HCl
(c)-OH, 加 H+ (-H2O)
(CH3)3C-CH2N2Cl
-N2 (CH3)3C-CH2
△
(CH3)3C-CH2OH
H+ -H2O
(CH3)3C-CH2
(CH3)3C-CH2=CH2 H+ (CH3)3C-CH-CH3
2 迁移基团迁移顺序
OCH3
Ph
Semipinacol重排
RR R C CR
OH Y
OH
Cl
C
H C
Ph
HNO2
Cl
Ph NH2
RR R CCR
OH
OH
H
C C Ph
Cl
Ph
O H
C C Ph Ph
O OH
+ CH3NO2
HO CH2NH2
HO CH2
O
CH2NO2 [H]/Ni
HNO2
OH
三、二苯基乙二酮 ——二苯乙醇酸型重排
R PCl5 + R' C
OH N
第五章_重排反应

CH3— C — C — CH3
+
—
O — BF3
_
CH3
CH3— C — C — CH3
— —
— —
O
CH3
+
OH OH
OH O
— —
R
— —
— —
— —
— —
— —
R — C — C—R
3
1
H
+
R — C — C— R R
3
1
2
R ~ + —H
3:
R — C — C —R R
3
1
2
脂环族氨基醇和脂环族卤代醇则发生环扩大或环缩小反应:
在上述过程中,叔碳正离子(Ⅰ)重排成质子化酮的动力 是具有未共享电子对的氧对碳正离子(Ⅱ)有更大的稳定作用, 同时碳正子(Ⅱ)亦容易从羟基上脱去质子而生成稳定的最后 产物。
在反应过程中,凡是能生成类似的碳正离子者,都能发生 此类重排。
例如,与Pinacol醇结构相似的α,β-卤代醇、氨基醇和环氧 化物、α -羟基酮等在相应的条件下的类似重排反应(通常称为 半Pinacol重排,这种情况不能象Pinacol醇那样可以选择正离子 中心):
(CH3)2C
CHCH3
— N2
OH NH2 CH3 CH3 C OH CHCH3
重排
OH N2 CH3
—
CH3— C — CHCH3
+
CH3— C — C H(CH3)2
O
—
OH
—H
+
— —
CH3 CH3
CH3 CH3
— —
—
CH3— C —— C — CH3 O
中南大学有机合成__第5章____重排反应

Asymmetric Baeyer-Villiger Reaction with Hydrogen Peroxide Catalyzed by a Novel Planar-Chiral Bisflavin. Murahashi, S. Ono, Y. Imada, Angew. Chem. Int. Ed., 2002, 41, 2366-2368.
2013-1-9
第三章
17
补充:Hofmann(霍夫曼)降解反应
O
机理
O RCNH2 Br2 OH-
RCNH2
NaOH + Br2
RNH2
O RCNHBr
OH -H2O
-
O R-C-N
O
Br
-Br
-
O R C N
R
N C O
H2O
R NH C OH
-CO2
RNH2
实例
O
(CH3)3CCH2CONH2
• 3-氨基-2,3-二甲基-2-丁醇与亚硝酸作用
O
NaNO2 H2SO4
HO NH2 HO N2+
- N2
HO
- H+
2013-1-9
第三章
7
反呐咵重排--新戊醇在酸催化下脱水
OH
H+
OH2 +
2013-1-9
第三章
8
补充:Demjanov rearrangement
• The Demjanov rearrangement (named after its discoverer Nikolai Demyanov) is the chemical reaction of primary amines with nitrous acid to give rearranged alcohols. Both ring enlargement or contraction can occur.
药物合成反应第五章 重排反应

重排反应中键的裂解和形成方式: 异裂(离子型) 均裂(游离基型) 环状过渡态(σ键迁移型)
离子型重排反应: 1.阴离子型重排(亲核重排)
C— A— Y Z -Y C— A Z C— A — Z
2.阳离子型重排(亲电重排)
X— B— C Y -Y X— B— C B— C X
3.游离基型重排反应: 重排反应中间体呈游离基状态
O
O COEt
*
5 0%
COEt
+ *
5 0%
*
O Ar X R
M eO Ar M eO H
OR X
-X
-
OAr R
O M eO Ar R
-
R Ar C O 2M e
M eO H
R Ar C O 2M e
• 碳负离子缺少共振稳定时 • 卤代酮羰基无可烯醇化的氢时 • 二卤代酮时
五 、Wolff(沃尔夫)重排 和Arndt-Eistert (阿恩特-埃斯特尔特)
例:
C 2H 5 C C 2H 5 Br CONH2 N a O Br H 2O
C 2H 5 C 2H 5 C O
(3)构型保持
Ph H2 H * C O N H B r 2 /N a O H C C 2 CH3 Ph H2 H * C C NH2 CH3
(4)当酰胺分子的适当位置有羟基、氨基存在时, 可以分子内成环。
HO HNO2
CH2 O
O HBr Cl C Ph C H Ph
A g N O 2 /E tO H Cl
O C
H C
Ph Ph
HO
Ph SPh
O Ph
HO O
CH3 Ph
Ph
O CH3
第五章、重排反应

第五章、重排反应
化学反应中,一般碳的骨架不变。分子的碳架或官能团的位置发生改 变的反应称之为分子重排反应。重排反应在分子内进行,故称之为分 子重排反应。 重排反应为烃基或氢原子在分子内进行迁移的反应。迁移可以是基团、 原子。所以可以称基团或原子的迁移的反应为重排反应。 重排反应常在试剂作用下(酸、碱、金属离子)、加热或光照或其他
物理因素下发生。
第一节 缺电子重排
重排反应分为:缺电子重排、富电子重排和芳环重排。 缺电子重排反应:通过缺电子原子发生的重排反应为缺电子重排反应。
一、碳正离子的重排
碳原子重排分为:碳烯重排和碳正离子重排。
_ Nu : R C C L _ _L R
+
R C C Nu
C
C _ H+ R C C
_ Nu : R C C
(双分子还原)
例:
CH3 NO2 _ Zn, OH EtOH CH3 H3C H
+
H3C NH2
CH3 NH2
NHNH
二、Fries(傅瑞斯)重排
酚酯在lewis酸作用下,重排转化为酚酮的重排反应:
OCOR AlCl3 OH O C R + OH
(低温为主)
(高温为主)
O C
R
OH o C H3C COCH3 OH O H3C
例:
Cl C O C6H5
EtONa EtOH
C6H5 COOH
例:
Cl O
EtONa EtOH
COOEt
RONa ROH NaOH
COOR
COOH
机 理:
Cl
_ OR _
Cl O O
_ OR
O
OR _ O
化学反应中,一般碳的骨架不变。分子的碳架或官能团的位置发生改 变的反应称之为分子重排反应。重排反应在分子内进行,故称之为分 子重排反应。 重排反应为烃基或氢原子在分子内进行迁移的反应。迁移可以是基团、 原子。所以可以称基团或原子的迁移的反应为重排反应。 重排反应常在试剂作用下(酸、碱、金属离子)、加热或光照或其他
物理因素下发生。
第一节 缺电子重排
重排反应分为:缺电子重排、富电子重排和芳环重排。 缺电子重排反应:通过缺电子原子发生的重排反应为缺电子重排反应。
一、碳正离子的重排
碳原子重排分为:碳烯重排和碳正离子重排。
_ Nu : R C C L _ _L R
+
R C C Nu
C
C _ H+ R C C
_ Nu : R C C
(双分子还原)
例:
CH3 NO2 _ Zn, OH EtOH CH3 H3C H
+
H3C NH2
CH3 NH2
NHNH
二、Fries(傅瑞斯)重排
酚酯在lewis酸作用下,重排转化为酚酮的重排反应:
OCOR AlCl3 OH O C R + OH
(低温为主)
(高温为主)
O C
R
OH o C H3C COCH3 OH O H3C
例:
Cl C O C6H5
EtONa EtOH
C6H5 COOH
例:
Cl O
EtONa EtOH
COOEt
RONa ROH NaOH
COOR
COOH
机 理:
Cl
_ OR _
Cl O O
_ OR
O
OR _ O
第五章 重排反应

CO NH2
CH3OBr -400C 68%
NHCOCH3
上有-OH、 C=C时 3 当 α -C上有-OH、-NH2、-X、C=C时,生 成醛。 成醛。
NaOBr H2 O -NH3
R CH CO NH2 X
R CH NH2 X
RCHO
RCH
CH CONH2
NaOBr
R CH
δ-
δ+ δ-
H2 O -NH3 R CH2 CHO
C6H17
O HN
H N
O O
CH3O
O HN
H N
O OCH3 O
O HN
H N
O O C O OCH3
O
O
H2O △
O HN
H N
OH COOH O
(阿脲酸) 阿脲酸)
四
Cl O H RO
Favorski重排 Favorski重排
Cl O SN2 O O RO OR
COOR
ROH
COOR
+ RO
酰脲 的酰胺在NaOH+H 中溶解度小,难于水解, >C8的酰胺在NaOH+H2O中溶解度小,难于水解, 而与未重排的酰胺反应,生成酰脲, 而与未重排的酰胺反应,生成酰脲,使伯胺 收率降低。 收率降低。
改用RONa+ROH(如 改用RONa+ROH(如MeONa+MeOH) RONa+ROH(
NaOBr / H2O C11H23 CO NH2 Br2 / CH3ONa / CH3OH C11H23 CO NHC NH C11H23 O C11H23 NHCOO CH3 △ H2 O C11H23 NH2
第五章-重排反应

12
二、 Pinacol重排
(邻二醇或邻二官能团合成醛酮的方法)
药 学 院 药 物 合 成 反 应
定义:在酸催化下,邻二叔醇失去一分子水, 重排成醛或酮的反应称Pinacol重排。
R1发生1,2-迁移
1
2
1
2
邻二醇
羰基类化合物
13
二、 Pinacol重排
反应机理:
(☆☆☆☆☆)
邻二醇
不对称的质子化酮
RCONH2 + NaOBr R N C O H2O RNH2
机理:
R C NH2 O OH Br2 R C NHBr O R N C O
R C N Br O
• 供电性R速度快于 吸电性R • 重排后R保留原来 手性
40
H2O/OH
RNH2 + CO3
2
36
15
二、 Pinacol重排 2、影响因素
i. 碳正离子稳定性的影响
ii. 立体化学因素的影响
iii.迁移基团迁移能力的影响
iv.反应条件的影响
16
i. 碳正离子稳定性的影响
关键:不对称连二醇类化合物重排的方向决定于羟基失去后,所 生成碳正离子的稳定性,通常与基团迁移能力的大小无关 。
不对称的邻二醇
OH COOH O
29
4)Favorski 卤化酮重排 法沃尔斯基重排
(☆☆☆)
定义: -卤代酮在亲核碱(NaOH, RONa等)条件下,发生重排,α-基团迁移到 卤素位置,得到羧酸盐、酯或酰胺的反应称为Favorski卤化酮重排反应。
R EtONa/EtOH O C X C CH3 NaOH R R C COOEt α-卤代酮的反应 COOH
二、 Pinacol重排
(邻二醇或邻二官能团合成醛酮的方法)
药 学 院 药 物 合 成 反 应
定义:在酸催化下,邻二叔醇失去一分子水, 重排成醛或酮的反应称Pinacol重排。
R1发生1,2-迁移
1
2
1
2
邻二醇
羰基类化合物
13
二、 Pinacol重排
反应机理:
(☆☆☆☆☆)
邻二醇
不对称的质子化酮
RCONH2 + NaOBr R N C O H2O RNH2
机理:
R C NH2 O OH Br2 R C NHBr O R N C O
R C N Br O
• 供电性R速度快于 吸电性R • 重排后R保留原来 手性
40
H2O/OH
RNH2 + CO3
2
36
15
二、 Pinacol重排 2、影响因素
i. 碳正离子稳定性的影响
ii. 立体化学因素的影响
iii.迁移基团迁移能力的影响
iv.反应条件的影响
16
i. 碳正离子稳定性的影响
关键:不对称连二醇类化合物重排的方向决定于羟基失去后,所 生成碳正离子的稳定性,通常与基团迁移能力的大小无关 。
不对称的邻二醇
OH COOH O
29
4)Favorski 卤化酮重排 法沃尔斯基重排
(☆☆☆)
定义: -卤代酮在亲核碱(NaOH, RONa等)条件下,发生重排,α-基团迁移到 卤素位置,得到羧酸盐、酯或酰胺的反应称为Favorski卤化酮重排反应。
R EtONa/EtOH O C X C CH3 NaOH R R C COOEt α-卤代酮的反应 COOH
第五章 重排反应 5.2

R CH2 O R'
R''Li
R R'
CH OH
R''Li
R CH O R' R R' CH OLi
基团迁移能力取决于形成碳负离子的稳定性,一般认为: CH2=CHCH2- > C6H5CH2- > CH3- > C2H5-, p-NO2C6H4- > C6H5R PhLi R O2N O C H O2N O C Li
Me
N(CH3)2 CH CH CH2 32% % CH3 CH2 N CH2 CH CH2 CH3 CH3
Sommelet 重排
NaNH2 liq.NH3
N(CH3)2 CH CH2 CH CH2 18% % N(CH3)2
X
季铵盐的结构对重排的影响
CH2 CH CH CH2
50% %
Stevens 重排
椅式过渡态,按同面- 椅式过渡态,按同面-同面 迁移, 键的断裂和形成, 迁移,即σ键的断裂和形成, X 两端的构型保持不变。因此, 两端的构型保持不变。因此, 产物立体选择性很高。 类船式 能量高 产物立体选择性很高。
H3C CH3
CH3
S
CH3 H CH3
H H
E H3C
CH3 E
R H
H CH3
药物合成基础
第五章 重排反应
5.3 从杂原子到碳原子的重排
5.3 从杂原子到碳原子的重排 碳原子有活性氢原子或其它基团的有机分子,在强碱的作用下,被夺去 碳原子有活性氢原子或其它基团的有机分子,在强碱的作用下, 氢原子,形成带有一对电子的过渡态,然后烃基进行分子内1,2-迁移, 氢原子,形成带有一对电子的过渡态,然后烃基进行分子内 -迁移, 生成稳定的负离子, 生成稳定的负离子,改变了分子的骨架
R''Li
R R'
CH OH
R''Li
R CH O R' R R' CH OLi
基团迁移能力取决于形成碳负离子的稳定性,一般认为: CH2=CHCH2- > C6H5CH2- > CH3- > C2H5-, p-NO2C6H4- > C6H5R PhLi R O2N O C H O2N O C Li
Me
N(CH3)2 CH CH CH2 32% % CH3 CH2 N CH2 CH CH2 CH3 CH3
Sommelet 重排
NaNH2 liq.NH3
N(CH3)2 CH CH2 CH CH2 18% % N(CH3)2
X
季铵盐的结构对重排的影响
CH2 CH CH CH2
50% %
Stevens 重排
椅式过渡态,按同面- 椅式过渡态,按同面-同面 迁移, 键的断裂和形成, 迁移,即σ键的断裂和形成, X 两端的构型保持不变。因此, 两端的构型保持不变。因此, 产物立体选择性很高。 类船式 能量高 产物立体选择性很高。
H3C CH3
CH3
S
CH3 H CH3
H H
E H3C
CH3 E
R H
H CH3
药物合成基础
第五章 重排反应
5.3 从杂原子到碳原子的重排
5.3 从杂原子到碳原子的重排 碳原子有活性氢原子或其它基团的有机分子,在强碱的作用下,被夺去 碳原子有活性氢原子或其它基团的有机分子,在强碱的作用下, 氢原子,形成带有一对电子的过渡态,然后烃基进行分子内1,2-迁移, 氢原子,形成带有一对电子的过渡态,然后烃基进行分子内 -迁移, 生成稳定的负离子, 生成稳定的负离子,改变了分子的骨架
第五章 重排反应

H2O
H R N
O OH RNH2
酰基叠氮可由叠氮化钠与酰化剂反应得到,酰肼与亚 硝酸反应也可形成酰基叠氮。加热重排不需太高温度,大 约100℃左右即可进行。
当羧酸与叠氮酸反应时,经叠氮酸加成反应,生成产物 也可失去一分子氮引起向缺电子氮原子的重排反应,结果 生成胺盐,这个反应是在酸性条件下进行的,称为Schmidt 反应。
.CCl3 1.00 >19
:CBr2 1.00 0.4
Br2 1.00 0.6
3-甲基1-丁烯 0.17
3.2
1.9
13.5
一些与环状共轭体系相连的卡宾如环丙烯卡宾和环庚三 烯卡宾,在这些分子中,空的P轨道参与共轭体系,不显示 明显的缺电子特征,实际上是环丙烯正离子和卓鎓离子的 共轭碱。
+
+
二、卡宾的制备 1、重氮化合物分解制备卡宾 低分子量的重氮甲烷具有毒性、不稳定,在实验室中, 重氮甲烷的制备是由苯磺酰甲胺或苯二甲酰甲胺亚硝化后 再用碱反应制备的。
R hv R O Ar hv CN OMe hv Ar
R R Ar Ar
R R Ar CN OMe Ar
R R Ar Ar Ar MeO
O +
R R
C:
O+
-
O +
Ar NC Ar Ar
C:
O
Ar Ar
O+
-
O +
C:
4、多卤化物的2-消除形成卡宾 无β-氢原子的卤化物在用强碱处理时,进行α-消除卤化 氢形成卡宾,其他的如有机汞化物也可以进行α-消除反应形 成卡宾。
HNO2
O R R O
CH2N2+
第五章 重排反应

的顺序为芳基>烷基(3。>2 。 >1 。)>氢。
CH3 CH2OH H CH3 CH2OH2 H2O CH3 CH2 H CH3 H CH3
CH3
CH2 -N2
CH2NH2 CH3
NaNO2 HCl CH CH2
CH3 CH2 CH2 N CH3 CH CH3
N
H
(2) wagner—Meerwein重排(原菠烷重排)
5.1.6 羧酸与叠氮酸作用(Schmidt反应)
在硫酸存在下,羧酸与叠氮酸反应生成胺
RCOOH + HN3 H2SO4 RNH2 + CO2 + N2
CH3CH2NH2 85% Cl
NH2 H 61%
CH2CH2COOH NaN3 + H2SO4/C6H5 Cl
COOH H
50 ℃
NaN3 + H2SO4/CHCl3 40℃
RCOCl RCONHNH 2 NaN3 HNO 2 RCON3 RNCO C2H 5OH RNHCO2C2H 5 H 2O RNH 2 H2O RNH2
机理:
O RCOCl + NaN3 R C N3
-N2
O R C N RN C O
H2O
RNH2
Hofmann重排类似Curtius重排,适用于多数
O RCHO + CH2N 2
O + CH3CHN2 (C2H5)O
R H
CH 2
H+
O RCOCH3 + R
O CH3 92%
由阿拉伯糖四乙酸酯以62%产率生成1-脱氧果糖 四乙酸酯。
CHO (CHOCOCH3)3 + CH2N2 CHOCOCH3 H 3C O (CHOCOCH3)3 CHOCOCH3
CH3 CH2OH H CH3 CH2OH2 H2O CH3 CH2 H CH3 H CH3
CH3
CH2 -N2
CH2NH2 CH3
NaNO2 HCl CH CH2
CH3 CH2 CH2 N CH3 CH CH3
N
H
(2) wagner—Meerwein重排(原菠烷重排)
5.1.6 羧酸与叠氮酸作用(Schmidt反应)
在硫酸存在下,羧酸与叠氮酸反应生成胺
RCOOH + HN3 H2SO4 RNH2 + CO2 + N2
CH3CH2NH2 85% Cl
NH2 H 61%
CH2CH2COOH NaN3 + H2SO4/C6H5 Cl
COOH H
50 ℃
NaN3 + H2SO4/CHCl3 40℃
RCOCl RCONHNH 2 NaN3 HNO 2 RCON3 RNCO C2H 5OH RNHCO2C2H 5 H 2O RNH 2 H2O RNH2
机理:
O RCOCl + NaN3 R C N3
-N2
O R C N RN C O
H2O
RNH2
Hofmann重排类似Curtius重排,适用于多数
O RCHO + CH2N 2
O + CH3CHN2 (C2H5)O
R H
CH 2
H+
O RCOCH3 + R
O CH3 92%
由阿拉伯糖四乙酸酯以62%产率生成1-脱氧果糖 四乙酸酯。
CHO (CHOCOCH3)3 + CH2N2 CHOCOCH3 H 3C O (CHOCOCH3)3 CHOCOCH3
第五章 重排反应(Rearrangement reaction)
CH3
+
C CH2
CH3
C CH2 CH3
1,2-烷基迁移
CH3
+
C CH2 CH3 CH3
CH3
H+
CH3 C CH CH3
CH3
转变成更稳定的正离子是重排的一个动力,另外,转变成中 性化合物也是重排的一种动力,有时为促进重排,常在离去基或
其β-位上引入活性基团。如庚醇(heptanol)在三苯基膦的作用
原子或基团发生迁移。如下列化合物在酸催化下重排,得氢迁
移产物醛或酮。
H Ph Ph C C
OH OH
CH3(CH2)4 O
HCl(g) CH3 25 。C ,3h
CH3 CH2CCH2OH O OH
TsOH/C6H6
Ph Ph C C
OH
CH3(CH2)4 O
CH3
CH3 CH2CHCHO O
(90%) (80%)
5
下,经重排、水解得双环[2.2.1]庚醇:
OH NHTs Ph3P/DEAD
OPPh3
NHTs Ph3P=O
+
NHTs H
Ar O ArCO2
O
NHTs
(80%)
除此之外,碳正离子也可通过其他方式形成,如烯烃的卤加成, 氨基的重氮化等形式。
Br2 50。C Br
+ Br Br
+
Br Br
6
苯基迁移
HO
OH
HO
O
在脂环系统中,若两个羟基均处于同一脂环上,且呈顺式,
此时,离去基团(⊕OH2)与迁移基团互成反式,经重排得相 应的酮;若两个羟基呈反式,发生σ键迁移,得缩环产物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH2N2
PhCOOAg/EtOH
CH2COOH 多一个碳的酸
O光
O
N2
C O H2O
COOH
Curtius (库尔悌斯)反应
酰基叠氮化物在惰性溶剂中加热分解生成异氰酸酯
异氰酸酯水解则得到胺:
第二节 由碳原子到杂原子的重排
H3C H3C
C
C
CH3
CH3 61%
H3C CH C
H3C
H3C
CH2
31%
(H3C)3C
C H
CH2
3%
二 Pinacol 邻二醇(或邻二官能团)合成酮的方法
RR
H+
R
RCCR
R C CR
OH OH
OR
机理:
RR R C CR
OH OH
H+
RR
R C CR
OH
R R C CR
OH R
H+
R
-H+
OO CC G
G为吸电子基时,G所在的芳环迁移(实际产物为混合物)
OO
CC
G
OH
应用实例:
OCH3
CC OO
OCH3 KOH/n-BuOH/H2O
回流
OCH3 OH
C COOH
2 94%
CH2COOH
CO CO
KOH/H2O
CH2COOH
OH (HOOCCH2)2 C COOH
柠檬酸
四 Favorski (法沃尔斯基)重排
OO
KOH
Ar C C Ar
△
机理:
OH O Ar C C OK
Ar
O O OH Ar C C
Ar
OO Ar C C OH
Ar
OO Ar C C OH
Ar
OH O Ar C C O
Ar
特点:①碱(无机碱醇溶液), 若有机碱(CH3ONa, t-BuOK)的酯
OH O Ar C C OR
Ar
②酮的结构
一、Wangner-Meerwein重排 醇或卤代烃在酸催化下进行亲核取代或消除反应
时烯烃进行亲电加成时发生的重排
R2
R1 R4 C C R5
H+(-H2O)
R3 OH
R1 R4 R2 C C R5
R3
重排
R1 R2
C
R4 C R5 R3
H2O(-H+)
R1 R2
OH C
R4 C R5 R3
1 形成C+ 形式 (a)卤代烃 Ag+ AlCl3 (CH3)3C-CH2Cl Ag (AgNO3) (CH3)3C-CH2+AgCl (b)含-NH2,重氮化放氮
>
Cl
>
> R3C- > R2CH-
> RCH3- > CH3- > H-
Ag+
H3C C CH2Cl CH3
H3C
C
C H
CH3
H3C C CH2 CH3
∨ ∨
CH3
Ag+
H3C C CH2Cl
CH3
H3C C CH2CH3 CH3
H3C C CHCH3 CH3
CH3 H
Ph C C OTs
△
CH3 CH3
(CH3)3C-CH3NH2
NaNO2 HCl
(c)-OH, 加 H+ (-H2O)
(CH3)3C-CH2N2Cl
-N2 (CH3)3C-CH2
△
(CH3)3C-CH2OH
H+ -H2O
(CH3)3C-CH2
(CH3)3C-CH2=CH2 H+ (CH3)3C-CH-CH3
2 迁移基团迁移顺序
OCH3
O
R
C R
C
CH3
X
EtONa/EtOH NaOH NaNH2
R R C COOEt
CH3 R R C COOH CH3
RO R C CNH2
CH3
α-卤 代 酮 的 反 应
α-基团迁移到卤素位置
机理:
R
H2 O CC
H C
(EtO-) R' EtONa
R
H C
O C
H C
R' -X
X
X
' ' H H
RCCR
OH R
R RCCR
OR
1. 四取代乙二醇 (a)四个取代基相同,单一产物
(b)对称
R1 R1 R2 C C R2
OH OH
得单一产物
CH3CH3
Ph
Ph C C Ph H2SO4 Ph C C CH3
OH OH
冷却
CH3O
迁移基团电荷密度越高越有利于迁移
(C)
R' R R' C C R
H3C
H C C Ph CH3 CH3
苯的迁移速度为甲基的3000倍
反应实例
H3C CH2 CH2Br AgNO3 H3C CH2 CH2
Br H3C CH CH3
H3C
H C CH3 Br
H O CH2OH
O CH2
H (H3C)3C C CH3 △
OH
(H3C)3C C H
CH3
O
O
(H3C)2C CH(CH3)2
OH OH
Ph CH3
Ph CH3
H2SO4
Ph C C CH3 冷 却 Ph C C CH3
OH OH
OH
Ph CH3
Ac2O/ZnCl2
Ph C C CH3 OH OAc
Ph Ph C C CH3
CH3 O Ph
Ph C C Ph O CH3
(d)羟基位于脂环上的连乙二醇
HO OH R
R
OH Ph
HH
R C C R EtONa R C C R
C
aC b
O
O OEt
a) R
H C
H C
R'
COOEt
H
R
H2 H CC
R'
COOEt
b) R
H C
H C
R'
EtOOC H
R
H C
H2 C
R'
COOEt
O EtONa
*
Cl
O -ClH
*
Cl
O EtONa
*
OEt
O
*
O
O
*
COEt
+
COEt
*
50%
Ph
O PhPhΒιβλιοθήκη Semipinacol重排
RR R C CR
OH Y
OH
Cl
C
H C
Ph
HNO2
Cl
Ph NH2
RR R CCR
OH
OH
H
C C Ph
Cl
Ph
O H
C C Ph Ph
O OH
+ CH3NO2
HO CH2NH2
HO CH2
O
CH2NO2 [H]/Ni
HNO2
OH
三、二苯基乙二酮 ——二苯乙醇酸型重排
50%
O
O
Cl C CH3
EtONa
O EtO
EtONa
C 所连接的取代基越少越稳定
COOEt CH2
主
CH2COOEt
五 Wolff(沃尔夫)重排 和 Arndt-Eistert α-重氮酮重排成乙烯酮
R' C C N N 光 或 热 R' C C + N2
OR
Ag +或 Cu2+
OR
R
OCC
R'
第五章 重排反应
Chapter 5: Rearrangement Reaction
OH
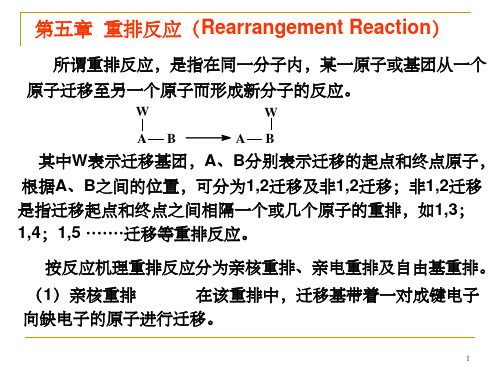
定义:同一分子内部一个原子重排到另一个原子,形 成新分子。
W
W
AB
AB
A:重排起点原子,B:重排终点原子,W:重排基团
分类: 离子型机理(亲核重排,亲电重排)
自由基重排
周环机理重排(σ-键迁移重排)
第一节 从碳原子到碳原子的重排
O C CH R
H2O R'OH NH3 R'NH2
RCH2COOH RCH2COOR' RCH2CONH2 RCH2CONHR'
阿恩特-埃斯特尔特(Arndt-Eistert)合成
R'COOH R'COX + CH2N2
R'COCH=N2 H2O R'CH2COOH 制备多一个碳的羧酸
COCl
