周环反应(简)
周环反应

-
-
-
-
+
-
顺旋
+ +
+
-
结论:加热下,顺旋成键。 结论:加热下,顺旋成键。 成键
光照下
分子处于激发态, 分子处于激发态,其HOMO为ψ3 为
hν 对旋
+ +
hν
+
顺旋
-
-
-
-
+
-
hν 对旋
+ +
不成键
结论:光照下,对旋成键 结论:光照下,对旋成键
CH3 H H CH3
(E,E)-2,4-hexadiene
加热条件
+ ll
165℃ 90MPa
HOMO
LUMO
LUMO [ 4+2 ] 环加成反应(热 应) 热反
HOMO
HOMO*
LUMO
LUMO [ 4+2 ] 环加成光反应禁阻
HOMO*
• 参与加成的是一个分子的 参与加成的是一个分子的HOMO和另一个分子的 和另一个分子的LUMO, 电子 和另一个分子的 由一个分子的HOMO流向另一个分子的 流向另一个分子的LUMO; 由一个分子的 流向另一个分子的 ; 正常的D 反应由双烯体提供HOMO, LUMO。 正常的D-A反应由双烯体提供HOMO, 亲双烯体提供 LUMO。 吸电子基可降低亲双烯体LUMO能量 给电子基可升高双烯体 能量; 吸电子基可降低亲双烯体 能量 HOMO能量 两者均使反应容易进行。 能量, 两者均使反应容易进行。 能量
第十七章
周 环 反 应
Pericyclic reaction
自由基反应:反应中间体为自由基( 1、自由基反应:反应中间体为自由基(R· ) 离子型反应: 2、离子型反应:反应中间体为离子 周环反应:反应过程中,无中间体生成, 3、周环反应:反应过程中,无中间体生成,反应中 化学键的断裂和生成同步进行。过渡态是环状的协 化学键的断裂和生成同步进行。 同反应。 同反应。
简述周环反应的应用原理

简述周环反应的应用原理1. 周环反应的概述周环反应,又称周反应,是一种常见的有机合成方法,属于环加成反应的一种。
它通过将两个或多个反应物合成一个环状产物,通常是在芳香烃环上进行。
周环反应在有机合成中应用广泛,可以构建复杂的化合物骨架,制备各类有机化合物。
2. 周环反应的基本原理周环反应的基本原理是通过一个可控的反应过程将多个反应物合成一个环状产物。
这种反应通常需要一个促进剂(催化剂),以调节反应的速率和选择性。
周环反应的机理多种多样,具体取决于所使用的反应物和催化剂。
其中一种常见的周环反应机理是通过阴离子亲核取代反应来实现的。
在反应中,亲电试剂(通常是含有不饱和键的化合物)与芳香烃环上的一个负离子进行反应,形成一个中间产物。
中间产物进一步经历质子化、脱水、负离子再亲核等步骤,最终生成环状产物。
3. 周环反应的应用周环反应在有机合成中具有广泛的应用,可以用于合成天然产物、药物、农药等有机化合物。
以下是周环反应的一些常见应用:•合成天然产物:周环反应可以模拟天然界中的生物合成途径,合成复杂的天然产物。
例如,利用周环反应可以合成类固醇激素、黄酮类化合物等。
•制备药物:周环反应在制备药物中扮演重要的角色。
通过合成特定的环状结构,可以制备出具有特定活性的化合物,如抗癌药物、抗菌药物等。
•设计新型催化剂:周环反应在催化剂设计方面的应用日益重要。
研究人员不断探索新的催化剂,以提高反应的效率和产物的选择性。
•构建有机杂化材料:周环反应可以用于构建有机杂化材料,如多环芳香烃、聚合物等。
这些材料在光电器件、催化剂和传感器等领域中具有潜在的应用价值。
4. 周环反应的优点和挑战周环反应作为一种重要的有机合成方法,具有以下优点:•高效性:周环反应可以在较短的反应时间内生成复杂的环状产物,具有高效性。
•多样性:周环反应可以应用于不同类型的反应物,实现多样化的有机合成。
•选择性:通过选择合适的反应条件和催化剂,可以控制周环反应的产物选择性,生成特定的环状产物。
第十六章 周环反应

周环反应主要包含三种类型: 周环反应主要包含三种类型: 电环化反应(electrocyclic reaction) 电环化反应( )
环加成反应( 环加成反应(cycloaddition reaction) )
+
σ-迁移反应(sigmatropic rearrangement) 迁移反应( 迁移反应 )
CH 3 H H CH 3 顺对
CH 3 H CH 3 H
CH 3 H CH 3 H
hv 对 对
二、含4n+2个π电子的体系 个 电子的体系
以6电子的2,4,6-辛三烯的分子轨道为例: 电子的2 辛三烯的分子轨道为例:
辛三烯的分子轨道 Ψ6 Ψ5 Ψ4 Ψ3 Ψ2 Ψ1
基态 激发态
LUMO LUMO
Me Me Me
Me
+
Me
Me
光
Me Me
二、[4+2]加成 加成 例如丁二烯和乙烯形成环丁烯: 例如丁二烯和乙烯形成环丁烯:
+
分析[4+2]加成反应的FMO可发现,1,3-丁二烯和乙烯的 分析[4+2]加成反应的FMO可发现,1,3- [4+2]加成反应的FMO可发现 加成, 热反应时为对称性允许: 加成,当热反应时为对称性允许:
第一节 电环化反应
在线型共轭体系的两端,由两个π电子生成一个新的σ 在线型共轭体系的两端,由两个π电子生成一个新的σ键 或其逆反应都称为电环化反应。例如: 或其逆反应都称为电环化反应。例如:顺-3,4-二甲基环 丁烯的开环就是电环化反应。 丁烯的开环就是电环化反应。
Me H H Me CH3 CH3
周环化反应
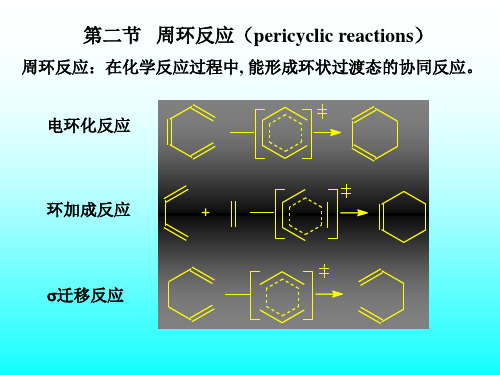
周环反应:在化学反应过程中, 能形成环状过渡态的协同反应。
电环化反应
环加成反应
+
迁移反应
1-1周环反应
1.定义: 在最近的五十年里,有机化学家研究有机化学机理,
主要有两种。一种是游离基型反应,一种是离子型反应,它们都生 成稳定或不稳定的中间体。 离子型或游离基型反应: 反应物→中间体→产物 另一种机理是,在反应中不形成离子或游离基的中间体,而认为 是有电子重新组织经过四或六中心环的过渡态而进行的。这类反应 不受溶剂极性的影响,不被碱或酸所催化,没有发现任何引发剂对 反应有什么关系。这类反应似乎表明化学键的断裂和生成是同时发 生的。这种一步完成的多中心反应叫周环反应。
• 三.前线轨道. • 福井认为最高的已占分子轨道(HOMO)上的 电子被束缚得最松弛,最容易激发到能量最低 的空轨道(LUMO)中去。这些轨道是处于前 线轨道(FMO),前线轨道理论认为:化学 键的形成主要是由FMO的相互作用决定的。 分子的HOMO与LUMO能量接近,容易组成 新轨道。
• 2-3 电环化反应
周环反应:反应物→产物
2.周环反应的特征: ①反应进行的动力,是加热或光照。 ②反应进行时,有两个以上的键同时断 裂或形成,是多中心一步反应。 ③反应时作用物的变化有突出的立体选 择性。 ④在反应过渡态中原子排列是高度有序 的。
1-2 分子轨道理论
• 几个原子轨道线性组合,形成几个分子轨道, 比原子轨道能量低的为成键轨道,比原子轨 道能量高的为反键轨道。其电子填充符合 Pauli原理和Hund规则。
其它烯烃的轨道对称性与乙烯相同,因此,[2+2]环化 加成在面对面的情况下,热反应是禁阻的,光反应是
第十一章 周环反应

电子数(1+j) 4n [1,3] 4n+2 [1,5]
反应条件 光照 加热
立体选择 同面迁移 同面迁移
第四节 σ迁移反应
2. [1,j]碳迁移
第四节 σ迁移反应
2. [1,j]碳迁移
第四节 σ迁移反应
3. [i,j]碳迁移
3 2 1 3' 2' 1'
周环反应中前线轨道的性质决定着反应的途径
第一节 周环反应
二、前线轨道理论和对称守恒原则 2、对称守恒原则
Robert B. Woodward (1917–1979) 美国 1965年获奖
随分子轨道能级的 增加,对称性也由 对称转向不对称
第一节 周环反应
二、前线轨道理论和对称守恒原则 2、对称守恒原则 周环反应的成键过程是分子轨道重新组合的过程, 反应中分子轨道的对称性必须守恒
二、电环化反应解释
前线轨道为HOMO轨道 1. 2,4-己二烯的电环化反应——4n体系
第二节 电环化反应
第二节 电环化反应
2. 2,4,6-辛三烯的电环化反应 ——4n体系
第二节 电环化反应
第二节 电环化反应
3. 电环化选择规律
共轭体系 电子数
顺 对 旋 旋
4n+2
4n
禁阻
h
允许
允许
第一节 周环反应
一、周环反应 电环化反应
1. 周环反应
环加成反应
σ迁移反应
第一节 周环反应
电环化反应和 σ迁移反应是分子内反应 环加成反应一般是分子间反应 2. 周环反应特点 (1) 协同反应
(2) 不要酸碱催化,也不受溶剂极性影响,但受光或热制约
周环反应一电环化反应

周环反应的类型
01
02
03
电环化反应
通过电子转移形成环状结 构,通常涉及π键的异构 化。
分子内环化反应
分子内的重排反应,形成 新的C-C键或C-H键。
电子转移反应
涉及电子从一种原子或基 团转移到另一种原子或基 团,导致电子密度的重新 分布。
周环反应的特点
高效性
周环反应通常在温和条件下进行,且不需要 金属催化剂,因此具有高效性。
改进电环化反应的工艺流程,降低能耗和资源消耗,实现绿色化学合成。
探索与其他有机反应的串联和组合,以实现多步骤合成的高效转化,为复 杂分子的合成提供新的途径。
电环化反应的挑战与
05
展望
面临的挑战
反应条件苛刻
电环化反应通常需要在高温、高 压或强电场等极端条件下进行, 这增加了实验操作的难度和危险 性。
电环化反应的分类
1. 分子内的电环化反应
发生在同一分子内的π键体系发生重排的反应。
2. 分子间的电环化反应
发生在不同分子间的π键体系发生重排的反应。
3. 离子性电环化反应
涉及离子参与的电环化反应,通常与离子型亲电试剂或离子型亲核 试剂相关。
电环化反应的机理
• 电环化反应通常涉及四个步骤:电子转移、构型重排、π键转移和电子重新排列。在电子转移阶段,一个或多个电子从给体 分子转移到受体分子,形成正离子或负离子中间体。在构型重排阶段,中间体发生构型变化,以便于π键转移。在π键转移 阶段,π键体系从一个分子转移到另一个分子。在电子重新排列阶段,电子重新排布以形成新的π键体系。
纳米材料制备
通过电环化反应可以制备具有特殊 结构和性质的纳米材料,在材料科 学、电子学等领域具有潜在应用价 值。
周环反应

35
[1,5] H 迁移
实际反应中, [1,5] H同面 迁移(热允许) 十分普遍,而光 反应(异面迁移) 很少
同面迁移(热允许,光禁阻) 异面迁移(热禁阻,光允许)
36
37
24.3.3 [3, 3]迁移 Cope重排
[3,3] 迁移
C1—C1’之间的键断裂, 同时C3—C3’之间的键形 成,相当于两个烯丙基, 其HOMO轨道键同面迁移, 过渡态的轨道对称性匹配, 空间因素也无阻碍。(类 似于6个电子的体系,热 允许)
11
加热条件 (前线轨道理论)
LUMO
HOMO
基态
对称性允许
对称性禁阻
12
光照条件
(前线轨道理论)
4 LUMO
3 HOMO
2
1
第一激发态
对称性禁阻
对称性允许
13
电开环反应
14
含6个电子的体系(电环化反应)
15 CH3CH=CHCH=CHCH=CHCH 3
6个电子的体系(电环化反应)
加热:对旋对称性允许; 顺旋对称性禁阻
光照:顺旋对称性允许;对旋对称性禁阻
16
动态平衡
热关环
17
4m 个 电子体系
4m+2 个电子体系
18
电环化反应选择规律
4m个 电子:热允许,顺旋(光禁阻) 光允许,对旋(热禁阻)
4m+2个 电子:热允许,对旋(光禁阻) 光允许,顺旋(热禁阻)
19
示例
乙烯分子轨道
29
[2 + 2] 体系的环加成 光照条件
反键轨道
p 轨道
p
轨道
成键轨道
乙烯分子轨道
30
常见的周环反应(简)

快速构建骨架
一步周环反应可以快速构 建复杂的分子骨架,大大缩 短有机合成路线,提高合成 效率和产率。
周环反应在材料科学中的应用
高性能聚合物
周环反应可以用于制备环状单 体,从而合成出具有高度热稳 定性和机械性能的高分子材料 。
金属有机框架
以周环反应为基础的拓扑反应 可以构建出复杂的金属有机框 架材料,用于吸附、分离和催 化等领域。
什么是周环反应
周环反应是一种常见的分子环化反应,涉及碳碳键的形成。它在有机合成 中广泛应用,可用于构建复杂环状分子。该反应的机理包括路径选择、区 域选择性和立体选择性等多个考量因素。
AL 作者:艾说捝
周环反应的定义
环结构形成
周环反应是指通过使两个或多个基团在 分子内环化而形成环状结构的化学反应 。
生物化学反应
周环反应在生物化学中有重要应用,如 在核酸、蛋白质等生物大分子的合成和 修饰中发挥关键作用。
周环反应的创新思路
基于新型反应活性物种
探索利用各种过渡金属催化 剂、特殊结构有机小分子等 诱发新型反应中间体参与的 周环反应新路径。
基于绿色可持续化学
开发原子经济性高、无副产 物排放的清洁高效绿色周环 反应途径,实现化学过程的环 境友好性。
多相催化体系
周环反应可以构建复杂的催化剂载体, 实现对反应物和过渡态的精确调控,在 多相催化过程中有广泛应用。
生物酶催化
生物酶内部的周环结构在催化活性中心 的构筑和调控方面起关键作用,周环反 应是酶促反应的重要基础。
周环反应的研究方法
分析表征
利用各种光谱、显微镜等分析手段,对反应中间体、过渡态等进行精确测定和表征。
理论计算
采用量子化学计算方法,如密度泛函理论等,预测和解释反应机理、动力学、热力学参数。
周环反映

周 环 反 应一、 基本内容1、周环反应是指在反应进程中,键的断裂与形成是以一个闭合环状过渡态、相互作用的轨道中的电子对重新组合为特征的协同反应。
也就是说,键的断裂与形成都在一个闭合环状过渡态中进行。
因此,周环反应具有如下特点:(1)反应进行时,有两支以上的键几乎同时断裂或形成。
(2)反应具有高度的立体选择性。
(3)反应进行的动力是加热或光照。
2、周环反应主要有三大类型:电环化反应、环加成反应和σ-迁移反应。
二、 重点与难点由周环反应的定义和特点可知,对分子轨道理论、过渡态及立体化学的理解和相关知识的运用是非常重要的。
本章特别强调对前线轨道理论在电环化反应中的运用。
本章的难点是合理地写出一具体反应的合理的反应产物,这要求对轨道的对称性及过渡态的能量加以合理的分析和判断。
三、 精选题及其解1、预测下列化合物电环化时产物的结构:(1)H CH 3H CH3(2)(3)H CH 3H CH 3hν(5)CH 3H CH 3H(4)解说明:我们以本题为例来探讨一下如何运用前线轨道理论,以及如何对反应加以正确的分析、写出合理的产物。
题(1)是电环化反应。
在反应条件下,反应物A有开环和关环两种反应途径。
关环反应的π电子数由反应物决定,为4π电子体系;开环反应的π电子数由产物决定为6π电子体系。
关环反应产物B 极不稳定(中间的四元环的两支σ键互为反式),说明形成该产物的过渡态的能量极高,反应不能进行。
因此,该反应经对旋开环形成产物C 。
若要验证一下答案的正确性,可将化合物C 在同样条件下的关环产物写出,如果写出的产物是A,说明答案是正确的。
因为,由A 到C 和由C 到A 的变化的过渡态是一样的。
2、用前线轨道理论解释1(1)的产物的正确性。
解 先画出化合物C 的π分子轨道如下:前线轨道分别为最高占有轨道HOMO 和最低空轨道LUMO 。
电环化反应轨道对称性取决于最高占有轨道的对称性。
(1)H CH 3H H CH 3HCH3(4)(5)3CH 3(1)HHH看成4π电子体系AB对旋开环C如用下图表示A 由到B 的关环反应的过渡态,可以看出标记为a 的那支碳碳键需跨面形成,这对小环化合物是不可能的。
周环反应

例:
175℃
H CH3 H
hν
CH3 H CH3 H
顺-3,4-二甲基 3,4环丁烯
3,4)-2,4( Z,E )-2,4- 反-3,4-二甲基 环丁烯 己二烯
CH3 CH3 H CH3 H H CH3 H
hν
H CH3 CH3 H
反-5,6-二甲基-1,35,6-二甲基-1,3Z,Z,E)(Z,Z,E)环己二烯 2,4,62,4,6-辛三烯 2.立体选择性解释 2.立体选择性解释
1.
H Ph
2.
HH
H H
⑵.含6个Π电子的共轭体系 (注:开链共轭烯烃 电子数) 中Π电子数) 2,4,6-辛三烯: 6个P轨道形成6个分子轨道 2,4,6-辛三烯: 6个 轨道形成6
LUMO
CH3
CH
CH
CH
CH
CH
CH
CH3
HOMO
HOMO
CH3
CH
CH
CH
CH
CH
CH
CH3
CH3
CH
CH
它们的位相不同,是轨道对称性禁阻的。 它们的位相不同,是轨道对称性禁阻的。 在光照条件下: 在光照条件下: HOMO是 一个乙烯分子的 HOMO是:
LUMO是 另一个乙烯分子的 LUMO是: 它们的位相相同,是轨道对称性允许的。 它们的位相相同,是轨道对称性允许的。 因此, ]环加成反应在面对面的情况下 环加成反应在面对面的情况下, 因此,[ 2 + 2 ]环加成反应在面对面的情况下, 热反应是禁阻的,光反应是允许的。 热反应是禁阻的,光反应是允许的。
CH3 CH CH CH CH CH CH CH3
有机第七讲周环反应

CH3 CH3
H CH3
hv
对旋
H
o
(5)
20
对旋
o 100
(6)
对旋
(7)
对旋
H
(8)
CH3 CH3 顺旋
H
CH3
CH3
对旋
CH3 CH3
问题24.1 写出下列反应的产物。
Ph Ph
H
H
Ph
Ph
Ph Ph
H
Ph
Ph
H
HH HH
H
H
hv
?
80 0C
H
H
H
H
hv
?
H H
问题24.2 写出下列反应的产物。
+
环状过渡态
2. 周环反应的特点:
如何说明这些特征?
1. 反应过程中没有自由基或离子这一类活性中间体产生; 旧键断裂与新键生成同时进行,为多中心一步反应。
2. 反应条件一般只需要加热或光照,反应速率极少受溶剂 极性和酸,碱催化剂的影响,也不受自由基引发剂和抑 制剂的影响;
3. 加热得到的产物和在光照条件下得到的产物具有不同的立 体选择性,具高度立体专一性。
己三烯分子轨道 4n+2体系 节面 对称面 C2轴
6
5
A
S
5
4
S
A
4
3
A
S
3
2
S
A
2
1
A
S
1
0
S
A
6
5
4
(LUMO)
3
(HOMO)
2
1
(HOMO)
对旋
hv 顺旋
3
周环反应机理

周环反应机理
周环反应(也被称为电环反应)是一类有机化学反应,涉及到多环化合物的形成。
周环反应机理可能因反应类型和底物的不同而有所不同,下面是一个常见的周环反应机理的概述。
1.环化生成反应:周环反应通常涉及到有机分子中的双键、
三键或其他活性基团。
这些活性基团可通过内酰胺、环内醇或环内酮等反应生成稳定的环。
生成环的过程中可能涉及质子转移、亲核进攻或电子转移等步骤。
2.条件选择性:周环反应的选择性很重要,可以通过选择合
适的底物和反应条件来控制产物的形成。
例如,选择合适的溶剂、温度和催化剂等,可以有针对性地调控反应路径和产物选择。
3.反应中间体:周环反应通常涉及中间体的形成和转化。
这
些中间体可以是环间反应的临时产物,也可以是稳定的中间体,作为进一步的转化物种。
4.共轭体系:周环反应中,共轭体系的存在非常常见,因为
这些体系具有较低的反应能垒和较高的稳定性。
共轭结构可以通过电子共轭、杂化轨道等方式形成,促进周环反应的进行。
需要注意的是,周环反应可以是非常复杂的,通常需要考虑多步反应和可能的副产物。
因此,具体的周环反应机理可能涉及多个中间体和反应步骤,需要通过实验和理论研究进行详
细的探索和确认。
总结起来,周环反应是一类有机化学反应,涉及到多环化合物的形成。
它们的机理可因反应类型和底物的不同而有所不同,通常涉及环化生成、条件选择性、反应中间体和共轭体系等方面。
详细的机理研究有助于理解和应用周环反应以合成所需的化合物。
周环反应

第十七章 周环反应一、 基本内容1.周环反应是指在反应进程中,键的断裂与形成是以一个闭合环状过渡态、相互作用的轨道中的电子对重新组合为特征的协同反应。
也就是说,键的断裂与形成都在一个闭合环状过渡态中进行。
因此,周环反应具有如下特点:(1)反应进行时,有两支以上的键几乎同时断裂或形成。
(2)反应具有高度的立体选择性。
(3)反应进行的动力是加热或光照。
2.周环反应主要有三大类型:电环化反应、环加成反应和σ-迁移反应。
二、 重点与难点由周环反应的定义和特点可知,对分子轨道理论、过渡态及立体化学的理解和相关知识的运用是非常重要的。
本章特别强调对前线轨道理论在电环化反应中的运用。
本章的难点是合理地写出一具体反应的合理的反应产物,这要求对轨道的对称性及过渡态的能量加以合理的分析和判断。
三、 精选题及其解17-1 预测下列化合物电环化时产物的结构:解说明:我们以本题为例来探讨一下如何运用前线轨道理论,以及如何对反应加以正确的分析、写出合理的产物。
题(1)是电环化反应。
在反应条件下,反应物A有开环和关环两种反应1 途径。
关环反应的π电子数由反应物决定,为4π电子体系;开环反应的π电子数由产物决定为6π电子体系。
关环反应产物B 极不稳定(中间的四元环的两支σ键互为反式),说明形成该产物的过渡态的能量极高,反应不能进行。
因此,该反应经对旋开环形成产物C 。
若要验证一下答案的正确性,可将化合物C 在同样条件下的关环产物写出,如果写出的产物是A,说明答案是正确的。
因为,由A 到C 和由C 到A 的变化的过渡态是一样的。
17-2 用前线轨道理论解释17-1(1)的产物的正确性。
解 先画出化合物C 的π分子轨道如下:前线轨道分别为最高占有轨道HOMO 和最低空轨道LUMO 。
电环化反应轨道对称性取决于最高占有轨道的对称性。
如用下图表示A 由到B 的关环反应的过渡态,可以看出标记为a 的那支碳碳键需跨面形成,这对小环化合物是不可能的。
周环反应机理

周环反应机理
摘要:
1.周环反应的定义和特征
2.周环反应的理论基础
3.周环反应的分类和典型例子
4.周环反应的应用和研究进展
正文:
一、周环反应的定义和特征
周环反应(Pericyclic Reaction)是一类在反应过程中形成环状过渡态的协同反应。
这类反应具有以下特征:
1.多中心的一步反应:反应进行时键的断裂和生成是同时进行的(协同反应)。
2.反应进行的动力是加热或光照:不受溶剂极性影响,不被酸碱所催化,不受任何引发剂的引发。
3.反应有突出的立体选择性,生成空间定向产物。
二、周环反应的理论基础
周环反应的理论基础主要包括前线轨道法、能级相关法和芳香性过渡态概念。
1.前线轨道法:通过计算反应物和产物的前线轨道能级,判断反应的进行方向和速率。
2.能级相关法:通过对反应物和产物的能级进行分析,解释反应的立体选
择性和反应速率。
3.芳香性过渡态概念:在化学反应过程中,能形成环状过渡态的协同反应往往具有芳香性。
三、周环反应的分类和典型例子
周环反应可分为电环化反应和环加成反应。
典型的例子包括:
1.Diels-Alder 反应:这是一种典型的周环反应,由Diels 和Alder 于1928 年发现,是一种双烯烃与环戊二烯的加成反应。
2.电环化反应:这类反应涉及到电子的转移,如环戊二烯与氮气的反应。
3.环加成反应:这类反应涉及到两个或多个分子的加成,如蒽与亚胺的反应。
四、周环反应的应用和研究进展
周环反应在化学领域具有广泛的应用,如在有机合成、材料科学和生物化学等方面。
有机化学 周环反应

C C
C C
C C
C C
C
1
C
2
C
3
C
4
C
5 [ 1, 5 ] 迁移
C Z C
[ i , j ] 迁移
i
C C
1'
1
C C
2'
2
C C
3'
2
3
C C
4'
4
C C
5'
5
[ 3, 3 ] 迁 移
C C
1'
2
1
C C
2'
2
C C
3'
3
C C
4'
4
C C
5'
5
j
1 1' 2'
3 3'
1 1' 2'
3 3'
[ 3, 3 ] 迁 移
两分子烯烃或共轭多烯烃加成成为环状化合物的反应叫环加成反应。
环加成反应可以根据每一个反应物分子所提供的反应 电子数来分类.
+
[ 2 + 2 ]环加成
+
[ 2 + 4 ]环加成
O
+
O + O O
O O
1,3-偶极环加成反应
二、[ 2 + 2 ]环加成
+
h
H 3C H H
H C CH3 C CH3 H
△
4n+2体系 对旋允许
H
H
△
H H
H
△
H
4n体系 顺旋允许
4n+2体系 对旋允许
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Jiaying University
3. 环加成反应规则
环加成反应的选择性 电子数 4n+2 4n 热反应 允许 禁阻 光反应 禁阻 允许
25
Jiaying University
4. 环加成反应的应用
O
H
2 3 1 8 7 5 6
7
光照 对旋
3
6 2 4
8 5 1
O
O
H 4
H H
O O
O O
3.能判断电环化反应和环加成反应中的“允许” 和 “禁阻”及产物的构型。
重点:对分子轨道理论、过渡态理论及立体化学的 理解和运用,前线轨道理论在电环化反应中的应用。 难点:写出周环反应的合理产物构型。
2
Jiaying University
作业
教材P.186~188习题: 1、2、4、6、8、9、10
Jiaying University
前线轨道理论要点: (1)在周环反应中,起决定作用的是前线电子和前 线轨道(最高占据轨道HOMO和最低未占轨道LUMO)。 (2)热反应为基态反应;光反应为激发态反应。 (3)单分子反应只涉及分子的HOMO。 (4)双分子反应涉及一个分子的HOMO和另一个分子 的LUMO。 (5)有效成键需轨道对称性匹配或者说相位相同。
6
主要的三类周环反应:
1.环加成反应 Diels-Alder反应:
Jiaying University
2.电环化反应:
3.迁移反应
7
Jiaying University
电环化反应 (Electrocyclic Reactions)
一、电环化反应 在光或热的作用下,共轭烯烃转变为环烯烃或 它的逆反应——环烯烃开环变为共轭烯烃的反应。
2 3 4 5
36
2′
1
规律:1,1′断,3,3′连,双键前移。
Jiaying University
(a)Claisen重排反应 Claisen重排头尾对调,邻位被占时到对位。
* OCH2CH=CH2
OH
0 200 C
* CH2CH=CH2
H3C
* OCH2CH=CH 2 0 CH3 200 C
H3C
2 1 1' 2' 3 3'
1
2
3
4
5
[ 3, 3 ] 迁移
C C C C C C C C C C
1' 2' 3' 4' 5'
2
1
2
3
4
5
1 1' 2'
3 3'
[ 3, 3 ] 迁移
3′
CH2 CH2
1
1′
CH CH2 CH CH CH CH2
2 3 4 5
2′
3′
1′
H2C CH CH2 H2C CH CH CH CH2
O
O
光照
H H H
① Na2CO3 溶 液
H ② Pb(OAc)2
baseketene
26
协同反应具有高度立体专一性。
Jiaying University
二、环加成反应机理
基本原则: 环加成反应为双分子反应,前线轨道为一 分子的HOMO和另一分子的LUMO,两个轨道的对 称性相符合,反应允许,否则反应禁阻。
Y
1
[1,3]σ迁移
H2C CH CH CH CH CH CH2
2 3
[1,5] σ迁移
4
5
6
7
32
Jiaying University
一. 键迁移的类型和方式 反应经历环状过渡态,旧键的断裂与新键 的形成以及键的移位协同进行。 1.[ 1 , j ] 迁移 (1)1,3-σ迁移
H
3 2 1
sp3 sp2 CH3 CH3 hv H CH3 H CH3 sp3 CH 3
CH3
p轨道与sp3杂化轨道的相互转化、电子与 电子的相互转化,伴随键的重新组合。 电环化反应是可逆反应。
8
Jiaying University
1. 4n个π电子体系
H H CH3 CH3
△
顺旋1 顺旋2
H
H
CH3 CH3
Jiaying University
周环反应
学习要求 学习内容 周环反应简介 电环化反应 环加成反应 σ-迁移反应
1
学习要求
Jiaying University
1. 了解 Woodward-Hoffmann 的分子轨道对称守恒 原理的提出和基本内容。 2. 能 用 前 线 轨 道 理 论 解 释 三 类 主 要 周 环 反 应 (电环化、环加成、σ-迁移)。
反应物
离子中间体
产物
3.周环反应:通过环状过渡态而进行的反应。
4
Jiaying University
周环反应简介
在反应过程中不形成中间体,而是形成多中心 的环状过渡态。这类反应不受溶剂极性的影响,不
被碱或酸所催化,没有发现任何引发剂与反应有什
么关系。这类反应化学键的断裂和生成是同时发生 的。这种一步完成的多种心反应叫周环反应。 反应物 环状过渡态 产物
18
2. 电环化反应机理——前线轨道理论的应用 单分子反应只涉及分子的HOMO (1)4n个π电子体系 光照(激发态)
LUMO
Jiaying University
加热(基态)
3 (HOMO)
HOMO
LUMO
2 1 3 4
2(HOMO)
2 3 2 1 4 3
3
hv
HOMO
2
对旋
1
4
顺旋1
1
4
对旋允许, 顺旋禁阻。
1, 3
LUMO
LUMO
HOMO(highest
occupied
HOMO
丁 二 烯
HOMO
最高占据轨道HOMO 电子占据的能量最高 的π轨道 LUMO(Lowest unoccupied 最低未占轨道 LUMO molecular orbital):指 未被电子占据的能 量最低的空π轨道 17
molecular orbital):指被
12
Jiaying University
讨论:
H
H
× △
H
4n体系 对旋禁阻
△
4n+2体系 对旋允许
H
13
Jiaying University
3.Woodward-Hoffmann规则
电环化反应立体选择性规律 共轭多烯π 电子数 4n 加热 顺旋 对旋 光照 对旋 顺旋
4n+2
注意: (1)开环反应还要注意位阻问题 (2)本身是环状化合物的方向判断
14
Jiaying University
4. 解题思路 ① 确定π电子体系及参与成键的π电子数目; ② 成键方式( 是对旋还是顺旋); ③ 构型的表示(必要时注意位阻)。
H H
△
H H
H
△
H H
4n体系 顺旋允许
4n+2体系 对旋允许
15
Jiaying University
完成下列反应式:
H
hv
31
迁移反应
Jiaying University
在加热条件下,烯烃或共轭多烯体系中, 一个 原子的σ键迁移到另一个碳原子上,随之π键发生 转移的反应。
Y CH2
1
CH CH CH CH CH CH2
2 3 4 5 6 7
Y = C, H
Y
1
H2C CH CH CH CH CH CH2
2 3 4 5 6 7
讨论:
ph (3) ph ?
(1)
hv
?
(2) ph H H ph
?
(4)
(4n)
顺旋
加热
11
Jiaying University
2. 4n+2个π电子体系
CH3 H H CH3
△
CH3 CH3
H H
CH3 h ν
顺旋
H CH3 H
对旋
立体化学选择规律: 含4n+2个电子的共轭体系的电环化反应,热反应 按对旋方式进行,光反应按顺旋方式进行 (即热对旋, 光顺旋)。
28
Jiaying University
(2)激发态时(光照条件)
4(LUMO) 3(HOMO)
HOMO × LUMO)
2(LUMO) 1(HOMO)
激发态时(光照条件)轨道对称性不相符,反应禁阻!
29
Jiaying University
2. [2+2 ] 环加成 (4n体系)
乙烯+乙烯
(1)基态时(加热条件)
基态: 对称性不符,反应禁阻 乙 烯Ψ2
LUMO HOMO
乙 烯Ψ1
激发态: 对称性相符,反应允许 LUMO HOMO 乙 烯Ψ2
乙 烯Ψ2
30
Jiaying University
总结
4n+2 4n
环加成反应 热反应 允许 禁阻 光反应 禁阻 允许
电子数
环加成反应的立体选择性(同面-同面)
顺旋允许, 对旋禁阻。
19
Jiaying University
(2)4n+2个π电子体系
己 三 烯 ( 共 轭 三 烯 ) π 分 子 轨 道
热对旋,光顺旋
LUMO
LUMO
HOMO
HOMO
20
Jiaying University
总结
电环化反应立体选择性规律 共轭多烯π 电子数 4n 4n+2 加热 顺旋 对旋 光照 对旋 顺旋
