基因毒性杂质限度指南
EMEA基因毒性杂质限度指南

20060628 EMEA/CHMP/QWP/251344/2006基因毒性杂质限度指南(中英文对照)London, 28 June 2006CPMP/SWP/5199/02EMEA/CHMP/QWP/251344/2006TABLE OF CONTENTS 目录EXECUTIVE SUMMARY 内容摘要 (3)1. INTRODUCTION 介绍 (3)2. SCOPE 范围 (3)3. LEGAL BASIS法律依据 (3)4. TOXICOLOGICAL BACKGROUND 毒理学背景 (4)5. RECOMMENDATIONS 建议 (4)5.1 Genotoxic Compounds With Sufficient Evidence for a Threshold-Related Mechanism具有充分证据证明其阈值相关机理的基因毒性化合物 (4)5.2 Genotoxic Compounds Without Sufficient Evidence for a Threshold-Related Mechanism不具备充分证据支持其阈值相关机理的基因毒性化合物 (5)5.2.1 Pharmaceutical Assessment药学评价 (5)5.2.2 Toxicological Assessment毒理学评价 (5)5.2.3 Application of a Threshold of Toxicological Concern 毒理学担忧阈值应用 (5)5.3 Decision Tree for Assessment of Acceptability of Genotoxic Impurities基因毒性杂质可接受性评价决策树 (7)REFERENCES. 参考文献 (8)EXECUTIVE SUMMARY 内容摘要The toxicological assessment of genotoxic impurities and the determination of acceptable limits for such impurities in active substances is a difficult issue and not addressed in sufficient detail in the existing ICH Q3X guidances. The data set usually available for genotoxic impurities is quite variable and is the main factor that dictates the process used for the assessment of acceptable limits. In the absence of data usually needed for the application of one of the established risk assessment methods, i.e. data from carcinogenicity long-term studies or data providing evidence for a threshold mechanism of genotoxicity, implementation of a generally applicable approach as defined by the Threshold of Toxicological Concern (TTC) is proposed. A TTC value of 1.5 μg/day intake of a genotoxic impurity is considered to be associated with an acceptable risk (excess cancerrisk of <1 in 100,000 over a lifetime) for most pharmaceuticals. From this threshold value, a permitted level in the active substance can be calculated based on the expected daily dose. Higher limits may be justified under certain conditions such as short-term exposure periods.基因毒性杂质的毒理学评估和这些杂质在活性药物中的可接受标准的测定是一件困难的事情,并且在现有的ICH Q3X指南中也没有详细的规定。
FDA关于基因毒性杂志的指南

FDA关于基因毒性杂志的指南这是FDA关于基因毒性杂志的指南,或许对你有帮助FDA guidance on genotoxic impuritiesBy Nick Taylor, 16-Dec-2008Related topics: Materials & Formulation, QA/QC & validationThe FDA has issued draft guidance on how manufacturers shouldevaluate the safety of products that contain genotoxic and carcinogenic impurities.Genotoxic and carcinogenic properties can be acceptable traits of active pharmaceutical ingredients (APIs) but when these are impurities, which generally do not have a beneficial effect, their presence shouldbe minimised.To help manufacturers achieve the lowest technically feasible levelsof these impurities, or reduce them to quantities that convey no significant cancer risk, the US Food and Drug Administration (FDA) has issued guidance on the subject.By following the guidelines manufacturers should understand what the FDA requires to approve applications at various developmental stages and how these standards can be achieved.One recommendation is that manufacturers change the synthetic or purification routes to reduce impurity formation or increase its removal.The FDA regards 1.5μg per day as an acceptable level for impurities but this may not be appropriate in every case. In addition, higher levels may be allowed during clinical development.Further characterisation of the risks posed by the impurities by studying the mechanism of action or performing weight-of-evidence approaches can also add support to impurity specifications.Products released prior to the issuing of the guidance are covered by it if a specific safety signal highlighting increased risk is detected.Supplemental applications in previously approved products are also covered if they require a significant change to the labelling that suggests potential for increased carcinogenic risk.The complete guidance can be found here.本文转自诺贝尔学术资源网 ,?文献互助、学术交流和学术资源基因毒性杂质:基因毒性化合物指能直接或间接损伤细胞DNA,产生致突变和致癌作用的物质。
基因毒性杂质限度指南(转载中英文)

20060628 EMEA/CHMP/QWP/251344/2006 基因毒性杂质限度指南(转载中英文)London, 28 June 2006CPMP/SWP/5199/02EMEA/CHMP/QWP/251344/2006TABLE OF CONTENTS 目录EXECUTIVE SUMMARY 内容摘要 (3)1. INTRODUCTION 介绍 (3)2. SCOPE 范围 (3)3. LEGAL BASIS法律依据 (3)4. TOXICOLOGICAL BACKGROUND 毒理学背景 (4)5. RECOMMENDATIONS 建议 (4)5.1 Genotoxic Compounds With Sufficient Evidence for a Threshold-Related Mechanism具有充分证据证明其阈值相关机理的基因毒性化合物 (4)5.2 Genotoxic Compounds Without Sufficient Evidence for a Threshold-Related Mechanism不具备充分证据支持其阈值相关机理的基因毒性化合物 (5)5.2.1 Pharmaceutical Assessment 药学评价 (5)5.2.2 Toxicological Assessment 毒理学评价 (5)5.2.3 Application of a Threshold of Toxicological Concern 毒理学担忧阈值应用 (5)5.3 Decision Tree for Assessment of Acceptability of Genotoxic Impurities基因毒性杂质可接受性评价决策树 (7)REFERENCES. 参考文献 (8)EXECUTIVE SUMMARY 内容摘要The toxicological assessment of genotoxic impurities and the determination of acceptable limits for such impurities in active substances is a difficult issue and not addressed in sufficient detail in the existing ICH Q3X guidances. The data set usually available for genotoxic impurities is quite variable and is the main factor that dictates the process used for the assessment of acceptable limits. In the absence of data usually needed for the application of one of the established risk assessment methods, i.e. data from carcinogenicity long-term studies or data providing evidence for a threshold mechanism of genotoxicity, implementation of a generally applicable approach as defined by the Threshold of Toxicological Concern (TTC) is proposed. A TTC value of 1.5 μg/day intake of a genotoxic impurity is considered to be associated with an acceptable risk (excess cancer risk of <1 in 100,000 over a lifetime) for most pharmaceuticals. From this threshold value, a permitted level in the active substance can be calculated based on the expected daily dose. Higher limits may be justified under certain conditions such as short-term exposure periods.基因毒性杂质的毒理学评估和这些杂质在活性药物中的可接受标准的测定是一件困难的事情,并且在现有的ICH Q3X指南中也没有详细的规定。
EMA 关于基因毒性杂质限度指南的问答(中文)

EMA关于基因毒性杂质限度指南的问答2010-9-23背景:本问答文件的目的是对2006年出版的基因毒性杂质限度指南(EMEA/CHMP/QWP/251344/2006)进行相关内容统一和说明。
问答Q1:该指引并不要求对已批准销售的产品进行基因毒性杂质再评估,除非有一个特定的“重要原因”(cause-for-concern)。
请问什么是“重要原因”?A1:如果原料药的生产过程基本上没有改变,就不需要对基因毒性杂质进行重新评价。
但是,如果新知识表明有新原因时,例如几年前发现的甲磺酸盐药物可能形成甲磺酸烷基的基因毒性杂质,这需要进行基因毒性杂质的再评估,包括EP药典中收载的所有甲磺酸盐类产品,并出示“生产声明”。
Q2:该指引指出:即使按决策树程序其水平低于毒理学关注阈值(threshold of toxicological concern,TTC),也要尽可能地减少已知或未知的诱变杂质(mutagenic impurity)。
如果已知其诱变杂质的水平低于TTC(TTC是一个非常保守的值),为什么要还进一步减少呢?实际上这还涉及定量限在1ppm左右的分析方法,可以这样做但可能没结果,这是否有必要呢?A2:如果一个诱变杂质的水平低于毒理学关注阈值(相当于临床剂量≤1.5微克/天),就没有必要这样做。
除非它具有一个高度关注的风险结构:如N -亚硝基,黄曲霉毒素类和氧化偶氮物就需要这样做。
Q3:该指引规定:“当一个潜在的杂质包含“警示结构”(structural alerts)时,应考虑用细菌突变试验对其杂质进行的基因毒性分析”。
i)如果一个杂质能诱发“警示结构”,该杂质的致突变试验(Ames)结果为阴性时,是否就足以得出结论:该化合物不属于关注的遗传毒性杂质?是否还需要进一步的确认研究?ii)“警示结构”不存在就足以说明不属于关注杂质呢?iii)假设某杂质属于“警报结构”,但只要加以控制确保其杂质水平低于TTC,不进行常规检测是否可以接受?A3回答:i)是的。
EMEA基因毒性杂质限度指南

20060628 EMEA/CHMP/QWP/251344/2006基因毒性杂质限度指南(中英文对照)London, 28 June 2006CPMP/SWP/5199/02EMEA/CHMP/QWP/251344/2006TABLE OF CONTENTS 目录EXECUTIVE SUMMARY 内容摘要 (3)1. INTRODUCTION 介绍 (3)2. SCOPE 范围 (3)3. LEGAL BASIS法律依据 (3)4. TOXICOLOGICAL BACKGROUND 毒理学背景 (4)5. RECOMMENDATIONS 建议 (4)5.1 Genotoxic Compounds With Sufficient Evidence for a Threshold-Related Mechanism具有充分证据证明其阈值相关机理的基因毒性化合物 (4)5.2 Genotoxic Compounds Without Sufficient Evidence for a Threshold-Related Mechanism不具备充分证据支持其阈值相关机理的基因毒性化合物 (5)5.2.1 Pharmaceutical Assessment药学评价 (5)5.2.2 Toxicological Assessment毒理学评价 (5)5.2.3 Application of a Threshold of Toxicological Concern 毒理学担忧阈值应用 (5)5.3 Decision Tree for Assessment of Acceptability of Genotoxic Impurities基因毒性杂质可接受性评价决策树 (7)REFERENCES. 参考文献 (8)EXECUTIVE SUMMARY 内容摘要The toxicological assessment of genotoxic impurities and the determination of acceptable limits for such impurities in active substances is a difficult issue and not addressed in sufficient detail in the existing ICH Q3X guidances. The data set usually available for genotoxic impurities is quite variable and is the main factor that dictates the process used for the assessment of acceptable limits. In the absence of data usually needed for the application of one of the established risk assessment methods, i.e. data from carcinogenicity long-term studies or data providing evidence for a threshold mechanism of genotoxicity, implementation of a generally applicable approach as defined by the Threshold of Toxicological Concern (TTC) is proposed. A TTC value of 1.5 μg/day intake of a genotoxic impurity is considered to be associated with an acceptable risk (excess cancerrisk of <1 in 100,000 over a lifetime) for most pharmaceuticals. From this threshold value, a permitted level in the active substance can be calculated based on the expected daily dose. Higher limits may be justified under certain conditions such as short-term exposure periods.基因毒性杂质的毒理学评估和这些杂质在活性药物中的可接受标准的测定是一件困难的事情,并且在现有的ICH Q3X指南中也没有详细的规定。
EMEA基因毒性杂质限度指南

EMEA/CHMP/QWP/251344/2006基因毒性杂质限度指南(中英文对照)London, 28 June 2006CPMP/SWP/5199/02EMEA/CHMP/QWP/251344/2006 The European Agency for the Evaluation of Medicinal Products欧洲共同体药物评审委员会(EMEA)COMMITTEE FOR MEDICINAL PRODUCTS FOR HUMAN USE人用药品委员会(CHMP)GUIDLINE ON THE LIMITS OF GENOTOXIC IMPURITIES基因毒性杂质限度指南June 2002-October 2002 DESCUSSION IN THE SAFETY WORKINGPARTY安全工作组之内的讨论December 2002TRANSMISSION TO CPMPCPMP传递December 2002RELEASE FOR CONSULTATION专家讨论DEADLINE FOR COMMENTSMarch 2003建议收集最后期限DISCUSSION IN THE SAFETY WORKING June 2003-February 2004PARTY AND QUALITY WORKING PARTY安全工作组和质量工作组之间的讨论TRANSMISSION TO CPMP转移给CPMPMarch 2004RE-RELEASE FOR CONSULTATION再次放行给顾问团June 2004DEADLINE FOR COMMENTS收集意见的最后期限December 2004DISCUSSION IN THE SAFETY WORKINGPARTY AND QUALITY WORKING PARTY安全工作组和质量工作组之间的讨论February 2005-May 2006ADOPTION BY CHMP被CHMP采用28 June 2006DATE FOR COMING INTO EFFECT生效日期01January 2007KEYWORDS 关键词Impurities; Genotoxicity; Threshold of toxicological concern (TTC); Structure activity relationship (SAR)GUIDLINE ON THE LIMITS OF GENOTOXIC IMPURITIES基因毒性杂质限度指南TABLE OF CONTENTS 目录EXECUTIVE SUMMARY 内容摘要 (3)1. INTRODUCTION 介绍 (3)2. SCOPE 范围 (3)3. LEGAL BASIS法律依据 (3)4. TOXICOLOGICAL BACKGROUND 毒理学背景 (4)5. RECOMMENDATIONS 建议 (4)Genotoxic Compounds With Sufficient Evidence for a Threshold-Related Mechanism 具有充分证据证明其阈值相关机理的基因毒性化合物 (4)Genotoxic Compounds Without Sufficient Evidence for a Threshold-Related Mechanism 不具备充分证据支持其阈值相关机理的基因毒性化合物 (5)Pharmaceutical Assessment药学评价 (5)Toxicological Assessment毒理学评价 (5)Application of a Threshold of Toxicological Concern 毒理学担忧阈值应用 (5)Decision Tree for Assessment of Acceptability of Genotoxic Impurities基因毒性杂质可接受性评价决策树 (7)REFERENCES. 参考文献 (8)EXECUTIVE SUMMARY 内容摘要The toxicological assessment of genotoxic impurities and the determination of acceptable limits for such impurities in active substances is a difficult issue and not addressed in sufficient detail in the existing ICH Q3X guidances. The data set usually available for genotoxic impurities is quite variable and is the main factor that dictates the process used for the assessment of acceptable limits. In the absence of data usually needed for the application of one of the established risk assessment methods, . data from carcinogenicity long-term studies or data providing evidence for a threshold mechanism of genotoxicity, implementation of a generally applicable approach as defined by the Threshold of Toxicological Concern (TTC) is proposed. A TTC value of μg/day intake of a genotoxic impurity is considered to be associated with an acceptable risk (excess cancerrisk of <1 in 100,000 over a lifetime) for most pharmaceuticals. From this threshold value, a permitted level in the active substance can be calculated based on the expected daily dose. Higher limits may be justified under certain conditions such as short-term exposure periods.基因毒性杂质的毒理学评估和这些杂质在活性药物中的可接受标准的测定是一件困难的事情,并且在现有的ICH Q3X指南中也没有详细的规定。
基因毒性杂质控制相关文件及指南介绍
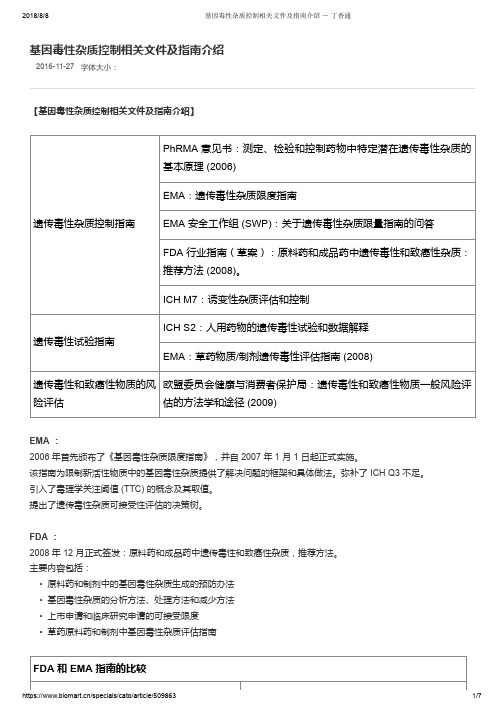
2016-11-27字体大小:基因毒性杂质控制相关文件及指南介绍【基因毒性杂质控制相关文件及指南介绍】遗传毒性杂质控制指南PhRMA 意见书:测定、检验和控制药物中特定潜在遗传毒性杂质的基本原理 (2006)EMA:遗传毒性杂质限度指南EMA 安全工作组 (SWP):关于遗传毒性杂质限量指南的问答FDA 行业指南(草案):原料药和成品药中遗传毒性和致癌性杂质:推荐方法 (2008)。
ICH M7:诱变性杂质评估和控制遗传毒性试验指南ICH S2:人用药物的遗传毒性试验和数据解释EMA:草药物质/制剂遗传毒性评估指南 (2008)遗传毒性和致癌性物质的风险评估欧盟委员会健康与消费者保护局:遗传毒性和致癌性物质一般风险评估的方法学和途径 (2009)EMA :2006 年首先颁布了《基因毒性杂质限度指南》,并自 2007 年 1 月 1 日起正式实施。
该指南为限制新活性物质中的基因毒性杂质提供了解决问题的框架和具体做法。
弥补了 ICH Q3 不足。
引入了毒理学关注阈值 (TTC) 的概念及其取值。
提出了遗传毒性杂质可接受性评估的决策树。
FDA :2008 年 12 月正式签发:原料药和成品药中遗传毒性和致癌性杂质,推荐方法。
主要内容包括:• 原料药和制剂中的基因毒性杂质生成的预防办法• 基因毒性杂质的分析方法、处理方法和减少方法• 上市申请和临床研究申请的可接受限度• 草药原料药和制剂中基因毒性杂质评估指南FDA 和 EMA 指南的比较相似点不同点推荐的鉴定和认证潜在遗传性杂质的方法相同 推荐的处理遗传毒性和致癌性杂质的方法相同FDA 指南包含致癌性杂质TTC 设定为 1.5 μg/天指南允许的 14 天内用药的 TTC 水平为 120 μg , 而非仅针对单次用药临床试验中短期暴露的 TTC 更高FDA 指南不允许根据现售药品的短期暴露情况而 提高 TTC ICH M7【基因毒性杂质的控制策略】具有阳性致癌数据的诱变杂质(第1类)---计算可接受摄入量( AI ): • M7 Addendum 中列出的 15 种化合物中有 10 个为该计算方法计算 • Carcinogenicity Potency Database (CPDB )中列明了 1574 种致癌物质的 TD50 值毒理学关注门槛---TTC 法(第 2/3 类): • ICHM7 主要讨论的方法,主要针对第 2/3 类基因毒性杂质,比如低级磺酸酯类等。
基因毒性杂质限度指南-中文

基因毒性杂质限度指南-中文《基因毒性杂质限度指南》European Medicines Agency: Guideline on the Limits of Genotoxic Impurities.CPMP/SWP/5199/02。
EMEA/CHMP/QWP/251344/2006。
London, 28 June 2006 关键词:杂质;基因毒性;毒理学关注阈值(TTC);构效关系(SAR)摘要进行基因毒性杂质的毒理学评估和这些杂质在原料药中的可接受限度的确定是个难题,并且在现有的ICHQ3X指南中并未详细规定。
现有的关于基因毒性杂质的相关数据是容易变化的,也是对杂质可接受标准如何进行评价的主要影响因素。
如果缺少风险评估方法所需要的数据,比如,致癌作用的长期研究数据或为基因毒性的阈值提供证据的数据,一般建议使用一般通用的被定义为毒理学关注阈值 (TTC)的方法。
一个“1.5ug/day”的TTC值,即相当于每天摄入1.5ug的基因毒性杂质,被认为对于大多数药品来说是可以接受的风险(一生中致癌风险小于十万分之一)。
按照这个阈值,可以根据这个预期的每日摄入量计算出原料药中可接受的杂质水平。
但是在某些情况下制定更高的限度也是合理的,例如:短期暴露。
1.前言在原料药(Q3A,新药物活性物质中的杂质)或药物制剂(Q3B,新药物制的一般概念,其中将“杂质界定”定义“是剂中的杂质)指南中描述了杂质界定获得和评估数据的过程,该数据用于建立单个杂质或在特定水平的已知杂质的生物安全性”。
对于潜在基因毒性的杂质,确定其可接受的剂量水平通常被认为是特别重要的问题,但是这个问题在现有的指南中没有被讨论。
12.适用范围本指南阐述了如何处理新原料药中基因毒性杂质的一般框架和实用方法。
该指南也适用于已有原料药的新申请,如果其合成路线、过程控制和杂质研究尚无法确保不会产生新的或更高含量的遗传毒性杂质(与EU目前批准的相同原料药相比)。
EMA关于基因毒性杂质限度指南的问答(中文)

EMA关于基因毒性杂质限度指南的问答2010-9-23背景:本问答文件的目的是对2006年出版的基因毒性杂质限度指南(EMEA/CHMP/QWP/251344/2006)进行相关内容统一和说明。
问答Q1:该指引并不要求对已批准销售的产品进行基因毒性杂质再评估,除非有一个特定的“重要原因”(cause-for-concern)。
请问什么是“重要原因”?A1:如果原料药的生产过程基本上没有改变,就不需要对基因毒性杂质进行重新评价。
但是,如果新知识表明有新原因时,例如几年前发现的甲磺酸盐药物可能形成甲磺酸烷基的基因毒性杂质,这需要进行基因毒性杂质的再评估,包括EP药典中收载的所有甲磺酸盐类产品,并出示“生产声明”。
Q2:该指引指出:即使按决策树程序其水平低于毒理学关注阈值(threshold of toxicological concern,TTC),也要尽可能地减少已知或未知的诱变杂质(mutagenic impurity)。
如果已知其诱变杂质的水平低于TTC(TTC是一个非常保守的值),为什么要还进一步减少呢?实际上这还涉及定量限在1ppm左右的分析方法,可以这样做但可能没结果,这是否有必要呢?A2:如果一个诱变杂质的水平低于毒理学关注阈值(相当于临床剂量≤1.5微克/天),就没有必要这样做。
除非它具有一个高度关注的风险结构:如N -亚硝基,黄曲霉毒素类和氧化偶氮物就需要这样做。
Q3:该指引规定:“当一个潜在的杂质包含“警示结构”(structural alerts)时,应考虑用细菌突变试验对其杂质进行的基因毒性分析”。
i)如果一个杂质能诱发“警示结构”,该杂质的致突变试验(Ames)结果为阴性时,是否就足以得出结论:该化合物不属于关注的遗传毒性杂质?是否还需要进一步的确认研究?ii)“警示结构”不存在就足以说明不属于关注杂质呢?iii)假设某杂质属于“警报结构”,但只要加以控制确保其杂质水平低于TTC,不进行常规检测是否可以接受?A3回答:i)是的。
基因毒性杂质控制相关文件及指南介绍

2016-11-27字体大小:基因毒性杂质控制相关文件及指南介绍【基因毒性杂质控制相关文件及指南介绍】遗传毒性杂质控制指南PhRMA 意见书:测定、检验和控制药物中特定潜在遗传毒性杂质的基本原理 (2006)EMA:遗传毒性杂质限度指南EMA 安全工作组 (SWP):关于遗传毒性杂质限量指南的问答FDA 行业指南(草案):原料药和成品药中遗传毒性和致癌性杂质:推荐方法 (2008)。
ICH M7:诱变性杂质评估和控制遗传毒性试验指南ICH S2:人用药物的遗传毒性试验和数据解释EMA:草药物质/制剂遗传毒性评估指南 (2008)遗传毒性和致癌性物质的风险评估欧盟委员会健康与消费者保护局:遗传毒性和致癌性物质一般风险评估的方法学和途径 (2009)EMA :2006 年首先颁布了《基因毒性杂质限度指南》,并自 2007 年 1 月 1 日起正式实施。
该指南为限制新活性物质中的基因毒性杂质提供了解决问题的框架和具体做法。
弥补了 ICH Q3 不足。
引入了毒理学关注阈值 (TTC) 的概念及其取值。
提出了遗传毒性杂质可接受性评估的决策树。
FDA :2008 年 12 月正式签发:原料药和成品药中遗传毒性和致癌性杂质,推荐方法。
主要内容包括:• 原料药和制剂中的基因毒性杂质生成的预防办法• 基因毒性杂质的分析方法、处理方法和减少方法• 上市申请和临床研究申请的可接受限度• 草药原料药和制剂中基因毒性杂质评估指南FDA 和 EMA 指南的比较相似点不同点推荐的鉴定和认证潜在遗传性杂质的方法相同 推荐的处理遗传毒性和致癌性杂质的方法相同FDA 指南包含致癌性杂质TTC 设定为 1.5 μg/天指南允许的 14 天内用药的 TTC 水平为 120 μg , 而非仅针对单次用药临床试验中短期暴露的 TTC 更高FDA 指南不允许根据现售药品的短期暴露情况而 提高 TTC ICH M7【基因毒性杂质的控制策略】具有阳性致癌数据的诱变杂质(第1类)---计算可接受摄入量( AI ): • M7 Addendum 中列出的 15 种化合物中有 10 个为该计算方法计算 • Carcinogenicity Potency Database (CPDB )中列明了 1574 种致癌物质的 TD50 值毒理学关注门槛---TTC 法(第 2/3 类): • ICHM7 主要讨论的方法,主要针对第 2/3 类基因毒性杂质,比如低级磺酸酯类等。
基因杂质限度指南

基因杂质限度指南《基因杂质限度指南》嘿,朋友!今天来跟你唠唠基因杂质限度这个事儿哈。
我一开始接触的时候也是两眼一抹黑呢。
一、基本注意事项首先呢,你得搞清楚什么是基因杂质。
简单来说,就像是一锅好汤里不小心混进去的小沙子(比喻可能不太准,但你能理解意思就行),它在基因层面上是些不该有的东西。
在检测基因杂质限度的时候,你一定要严格按照规定的流程来。
比如说取样本这个环节,可不能马虎呀。
我当时就是图快,取样本的时候没太注意规范,结果数据就不对,重新做了好几次。
这就像建房子,地基打不好,上面全白搭。
二、实用建议工具要用对喽。
检测的时候,不同的基因杂质可能需要不同的检测试剂或者仪器。
这就好比做菜,做红烧肉得用酱油来上色,做清蒸鱼就不用,得根据食材(基因杂质)的不同来选择调料(试剂和仪器)。
还有啊,要多做几个平行样呢。
比如你测三个平行样,如果结果差别很大,那就得好好找原因了。
我就有过这样的经历,三个结果差得离谱,后来发现是样本在处理的时候有一个被污染了。
三、容易忽视的点哦,对了。
这个环境因素很容易被忽视啊。
你知道吗,检测的环境如果不干净,很可能就会带来新的杂质,影响你的结果。
我当初没重视这个,后来才知道,就像在灰尘大的地方晾刚洗的衣服,衣服很容易又脏了。
还有记录的细节问题,每一步操作的时间、温度这些都得记录准确了,要不然回头你都不知道问题出在哪。
四、特殊情况有时候会遇到一些很特殊的基因结构,它们对检测试剂有特殊反应,这就需要你有更多的经验或者去查阅更多的资料。
我曾经碰到过一种很罕见的基因杂质,按常规方法检测老是不对头。
我想了好久,后来换了一种检测方法,还特别咨询了几个专家,才把它搞明白。
这就像你走在路上碰到一堵墙,常规的路走不通了,就得想办法找别的路绕过去。
五、总结要点总的来说呢,基因杂质限度这个事儿,从样本的选取到检测的过程,再到对特殊情况的应对,环境的维护和准确的记录,哪一个环节都不能出岔子。
你得要有耐心,像个细心的工匠一样,一点一点把这个活儿做好。
EMA关于基因毒性杂质限度指南的问答

EMA关于基因毒性杂质限度指南的问答本文来自网络,仅供阅读者参考!不代表本平台观点!背景:本问答文件的目的是对2006年出版的基因毒性杂质限度指南(EMEA/CHMP/QWP/251344/2006)进行相关内容统一和说明。
问答Q1:该指引并不要求对已批准销售的产品进行基因毒性杂质再评估,除非有一个特定的“重要原因”(cause-for-concern)。
请问什么是“重要原因”?A1:如果原料药的生产过程基本上没有改变,就不需要对基因毒性杂质进行重新评价。
但是,如果新知识表明有新原因时,例如几年前发现的甲磺酸盐药物可能形成甲磺酸烷基的基因毒性杂质,这需要进行基因毒性杂质的再评估,包括EP药典中收载的所有甲磺酸盐类产品,并出示“生产声明”。
Q2:该指引指出:即使按决策树程序其水平低于毒理学关注阈值(threshold of toxicological concern,TTC),也要尽可能地减少已知或未知的诱变杂质(mutagenic impurity)。
如果已知其诱变杂质的水平低于TTC(TTC是一个非常保守的值),为什么要还进一步减少呢?实际上这还涉及定量限在1ppm左右的分析方法,可以这样做但可能没结果,这是否有必要呢?A2:如果一个诱变杂质的水平低于毒理学关注阈值(相当于临床剂量≤1.5微克/天),就没有必要这样做。
除非它具有一个高度关注的风险结构:如N -亚硝基,黄曲霉毒素类和氧化偶氮物就需要这样做。
Q3:该指引规定:“当一个潜在的杂质包含“警示结构”(structural alerts)时,应考虑用细菌突变试验对其杂质进行的基因毒性分析”。
i)如果一个杂质能诱发“警示结构”,该杂质的致突变试验(Ames)结果为阴性时,是否就足以得出结论:该化合物不属于关注的遗传毒性杂质?是否还需要进一步的确认研究?ii)“警示结构”不存在就足以说明不属于关注杂质呢?iii)假设某杂质属于“警报结构”,但只要加以控制确保其杂质水平低于TTC,不进行常规检测是否可以接受?A3回答:i)是的。
EMA_关于基因毒性杂质限度指南的问答(中文)

EMA关于基因毒性杂质限度指南的问答2010-9-23背景:本问答文件的目的是对2006年出版的基因毒性杂质限度指南(EMEA/CHMP/QWP/251344/2006)进行相关内容统一和说明。
问答Q1:该指引并不要求对已批准销售的产品进行基因毒性杂质再评估,除非有一个特定的“重要原因”(cause-for-concern)。
请问什么是“重要原因”?A1:如果原料药的生产过程基本上没有改变,就不需要对基因毒性杂质进行重新评价。
但是,如果新知识表明有新原因时,例如几年前发现的甲磺酸盐药物可能形成甲磺酸烷基的基因毒性杂质,这需要进行基因毒性杂质的再评估,包括EP药典中收载的所有甲磺酸盐类产品,并出示“生产声明”。
Q2:该指引指出:即使按决策树程序其水平低于毒理学关注阈值(threshold of toxicological concern,TTC),也要尽可能地减少已知或未知的诱变杂质(mutagenic impurity)。
如果已知其诱变杂质的水平低于TTC(TTC是一个非常保守的值),为什么要还进一步减少呢?实际上这还涉及定量限在1ppm左右的分析方法,可以这样做但可能没结果,这是否有必要呢?A2:如果一个诱变杂质的水平低于毒理学关注阈值(相当于临床剂量≤1.5微克/天),就没有必要这样做。
除非它具有一个高度关注的风险结构:如N -亚硝基,黄曲霉毒素类和氧化偶氮物就需要这样做。
Q3:该指引规定:“当一个潜在的杂质包含“警示结构”(structural alerts)时,应考虑用细菌突变试验对其杂质进行的基因毒性分析”。
i)如果一个杂质能诱发“警示结构”,该杂质的致突变试验(Ames)结果为阴性时,是否就足以得出结论:该化合物不属于关注的遗传毒性杂质?是否还需要进一步的确认研究?ii)“警示结构”不存在就足以说明不属于关注杂质呢?iii)假设某杂质属于“警报结构”,但只要加以控制确保其杂质水平低于TTC,不进行常规检测是否可以接受?A3回答:i)是的。
