高中化学竞赛-中级无机化学---硼烷及其衍生物PPT课件
硼烷及其衍生物和过渡金属簇合物

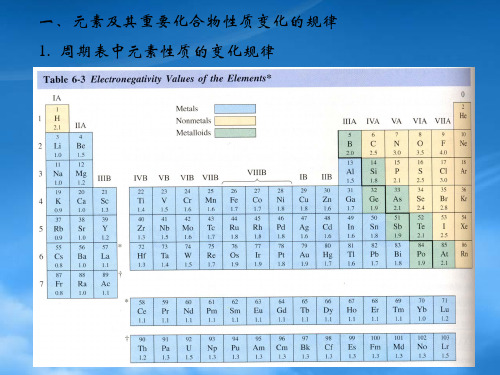
硼原子编号规则:
巢式和蛛网式结构的多面体总称为开 式。这两类结构的中性硼烷中硼原子的编 号规则如下:从开口面俯视,把整个结构 投影到一个平面上,选择一个处在12: 00位置的原子开始,从内圈到外圈按顺 时针方向进行编号。
硼烷的命名:
硼原子数少于10,用干支数表示硼 原子数。超过10,用中文数字词头来标 明,分子中氢原子数用阿拉伯数字加括 号直接写在化合物名称的后面。 例如:
1.硼烷(borane)的分类和结构
硼氢化合物统称为硼烷,按化学式基 本上分为BnHn+4和BnHn+6。20世纪50 年代和60年代又相继合成了一系列 硼烷 负离子BnHn2-和碳硼烷C2Bn-2Hn 。
对各类硼烷和碳硼烷进行X射线衍射发 现:它们的结构都是以三角面为单元的规则 多面体,并有三种结构类型:闭式,巢式和 蛛网式。以下先结合硼烷来讨论这三类结构 的特点和硼原子的编号规则。
P254
4.硼烷的电子结构和分子轨道处 理
硼烷电子结构的一个重要特点是“缺电子”。
所谓“缺电子”是指在这类化合物中没有足够的
价电子使所有相邻原子间的键用2中心2电子键(简称 为2c-2e)描述,也就是有m个原子,若它们形成m-1 个2c-2e键,则需要2(m-1)个电子来连接,而缺电子 化合物中的价电子数必定于2(m-1)。例如B2H6的价 电子数12(每个B提供3,H提供1),小于2(8-1)=14, 因此它是缺电子化合物。
因此还需要用分子轨道方法讨论。P257
高元硼烷W.N.Lipscomb的五种键
1. 端B-H键 2. 桥B-H-B键 3. B-B键
B-H
2c-2e 3c-2e
x s y
B-B
高中化学无机化学竞赛辅导课件.ppt
• d区元素的化合物
• 离子极化对ds区元素化合物性质的影响
•
颜色
•
溶解
•
HgF2 HgCl2 HgBr2 HgI2 水解性质
• Hg2+ 与卤素及拟卤离子形成的配合物 HgX42-
• HgNH2X
4) 常见配位化合物及配位数 Cu(I) Cu(NH3)2+ CuCl3- Cu(CN)43Cu(II) 配位数通常为4 CuCl42- Cu(NH3)42+ Cu(CN)42Ag(I) 配位数通常为2 Ag(NH3)2+ Ag(S2O3)23- Ag(CN)2Zn(II) 配位数为4和6 ZnCl42- Zn(NH3)42+ Zn(NH3)62+ Cd(II) 常见配位数为4 Hg(II) 配位数为4 与卤素和类卤离子
• 氢键
•
强弱次序:
F—H ···F > O—H ···O > O—H ···N &g ···Cl > O—H ···S
特点: 是特殊的分子间作用力
具有方向性和饱和性
晶体结构
1. 晶格和点阵、晶胞 晶系:立方 四方 正交 单斜 三斜 三方 六方
2. 金属晶体—堆积 非密置层的堆积:简单立方和体心立方 密堆积:立方密堆—面心立方 六方密堆—六方晶胞 空间利用率及配位数
• 离子晶体 • CsCl 负离子成简单立方堆积,正离子占据立方体间隙。
NaCl 负离子成面心立方堆积,正离子占据八面体体间隙。
ZnS 负离子成面心立方堆积,正离子占据四面体间隙。
• 分子晶体
• 共价晶体
•
金刚石和石墨的结构
• 离子极化 • 离子的极化能力 • 离子的变形性 • 离子极化对键型和晶型的影响
中级无机化学第五章PPT课件

第8页/共114页
3 (蛛)网式(arachno)- 硼烷
5. 1 硼烷化学
硼烷是硼氢化合物的总称。 硼能形成多种氢化物, 如B2H6、 B4H10、B5H9。 除中性硼氢化物 之外, 还有一系列的硼氢阴离子, 如BH4-、B3H8-、BnHn2-(n=6~ 12)等。
第1页/共114页
5.1.1 制备、性质和命名
5.1.1.1 硼烷的制备
1 硼氢化物的合成
B2O3 + 2Al + 3H2 压力, AlCl3 B2H6 + Al2O3
第2页/共114页
较高级的硼烷一般可通过热解乙硼烷来制备:
100℃, 10MPa 2B2H6
B4H10 + H2
5B2H6 180℃ 2B5H9 + 6H2
150℃, 二甲醚 2B2H6
B4H10 + H2
此外, 不少高级硼烷还可以用其他一些方法来制备, 如
第9页/共114页
4 敞网式(hypho)-硼烷
除上述三种 主要的硼烷以外, 还有一种硼烷, 其“口”开得更 大, 网敞得更开, 几乎成了一种平 面型的结构, 称 为敞网式硼烷, 这类化合物为数 较少, 现举二例 如右。
在蛛网式-硼烷中, 有三种结构不同的氢原子, 除外向端梢和
桥氢以外, 还有另一种端梢的氢原子, 后者和硼原子形成的B-H键,
指向假想的基础多面体或完整多面体外接球面的切线方向, 因此,
这种氢原子又称切向氢原子。他们和处于Байду номын сангаас完全的边或面上顶点
第6章硼烷及其衍生物和过渡金属簇合物

2.巢式(nido)
具有这种结构的硼烷通式BnHn+4。可看作是闭式结构的多面体 移去一个顶点(即BnHn2-再移去一个BH单位)的结构,他们是开口 的, 不完全的或缺顶的多面体。其形状如鸟巢,nido就是希腊文巢的 意思。
在巢式结构硼烷中有n个端氢,还有除此以外还有4个H, 每个氢 连接2个B, 称作桥氢
以B6 H 6 2-为例,共26 个价电子,它应形成6 个B-H 键, 3 个B-B双中心键和4 个BBB 三中心键,总共13 个成键轨道, 正好容纳26 个价电子。但对于更复杂的低对称化合物则不方便解释.
6.2 多面体骨架电子对理论
对于高对称的硼烷进行分子轨道处理获得了令人满意的结果,但 低对称性的结构计算比较困难,因此在发展定量的分子轨道方法的同时, 人们也在寻找硼烷及其衍生物的结构与电子数之间的关系。对硼烷和碳 硼烷的深入研究已经总结出有关他们的多面体形状与骨架电子数关系的 一些规则。
3.蛛网式(arachno)
4.网式硼烷 BnHn+8 的骨架健 对数等于 n+4
2.巢式(nido)
1976 年,Wade K 提出多面体骨架电子对理论(PSEPT),它只讨 论与骨架或键相关的电子数,解释它与骨架构型间的关系,而 不去具体探讨双中心键或三中心键。这是很明智的。对B6H62得出4 个三中心BBB 键,由图可见,
如Wade提出的规则,我国化学家唐敖庆提出的4n—F规则以及徐光宪
提出的nxc格式等,根据上述规则可预测硼烷、碳硼烷的结构,由于它
们都涉及多面体骨架电子对数的计算,故总称为多面体骨架电子对理论.
一.Wade 规则
硼烷和碳硼烷的结构都是以硼原子(和碳原子)为骨架组成
的三角多面体(或多面体碎片).
2024年化学竞赛无机化学绝密课件硼族元素-(含多场合)

化学竞赛无机化学绝密课件硼族元素-(含多场合)化学竞赛无机化学绝密课件硼族元素摘要:本文主要介绍了化学竞赛中无机化学部分的重要知识点——硼族元素。
通过对硼族元素的概述、性质、化合物以及应用等方面的详细讲解,旨在帮助参赛者更好地掌握这一部分内容,提高化学竞赛成绩。
一、硼族元素概述硼族元素位于元素周期表的第二族,包括硼(B)、铝(Al)、镓(Ga)、铟(In)和铍(Tl)等元素。
硼族元素在自然界中分布广泛,其中硼和铝是地壳中含量较多的元素。
硼族元素在化学性质上具有一定的相似性,但在物理性质和应用方面存在较大差异。
二、硼族元素的性质1.电子结构:硼族元素的原子结构中,最外层电子数为3个,因此它们在化学反应中容易失去3个电子,形成+3价离子。
2.金属性和非金属性:从上到下,硼族元素的金属性逐渐增强,非金属性逐渐减弱。
硼和铝具有较强的非金属性,而铟和铍的金属性较强。
3.离子半径:硼族元素的离子半径随着原子序数的增加而增大,这是因为原子核对最外层电子的吸引力逐渐减弱。
4.电负性:硼族元素的电负性随着原子序数的增加而减小,这是因为原子核对最外层电子的吸引力逐渐减弱。
三、硼族元素的化合物1.氧化物:硼族元素与氧元素形成的氧化物具有多种类型,如硼酸、氧化铝、氧化镓等。
这些氧化物在工业、医药等领域具有广泛的应用。
2.硼化物:硼族元素与金属元素形成的硼化物具有高熔点、高硬度和良好的导电性等特点,如碳化硼、氮化硼等。
3.氢化物:硼族元素与氢元素形成的氢化物在有机合成中具有重要应用,如硼氢化钠、硼氢化铝等。
4.硼酸盐:硼酸盐是一类重要的无机化合物,如硼砂、硼酸铝等。
它们在玻璃、陶瓷、洗涤剂等领域具有广泛应用。
四、硼族元素的应用1.金属铝:铝是硼族元素中应用最广泛的元素,广泛应用于建筑、交通、包装、电力等领域。
铝具有良好的导电性、导热性和轻质等特点,是国民经济的重要支柱产业。
2.硼化合物:硼化合物在农业、医药、化工等领域具有重要应用。
高中化学竞赛 中级无机化学 硼烷及其衍生物
HH
[L 2B H 2]+[B H 4]-
26
第一步,配体L进行亲核进攻,使B2H6中的一个氢桥键断裂:
H
H
H2B BH2 + L H
H2B BH3 L
第二步,取决于第二个配体的进攻位置:
H H2B BH3 + L
L
2BH3L
2019/10/17
H
H2B BH3 + L
[BH2L2]++[BH4]-
L 27
② 碱裂解反应
较大Lewis碱易对称裂解 叔胺、醚、膦、吡啶 B2H6+ 2NR3→2H3B :NR3 B4H10+ 2N(CH3)3→H3B :N(CH3)3 + B3H7 :N(CH3)3
较小Lewis碱易不对称裂解 氨、H2NCH3、OHB2H6+ 2NH3→[(H3N)2BH2]+[BH4]B4H10+ 2NH3→[(H3N)2BH2]+[B3H8]-
硼烷
3 M g B 2 + 3 M g + 1 2 H C l = B 6 H 1 0 + 6 M g C l 2 + 6 H 2
2.乙硼烷是由高级硼烷的热分解制备
n B 4 H 1 0 △B 2 H 6+ 较 高 级 硼 烷
3.在H2存在下,通过控制热解B2H6可以制的其他较
高级硼烷。热解的温度不同,产物不同.
2
德国化学家在1912-1934年的22年间一共合成和 鉴定了6个硼氢化物,他们分别属于多氢型BnHn+6和 少氢型 BnHn+4两类。
到目前为止,已有50多种硼烷分子和多种多面体硼 烷阴离子被合成和鉴定。
高中化学竞赛 无机化学第2章硼族元素(共26页PPT)(共26张PPT)
2. 硼酸
B:sp2杂化;存在分子间氢键; 层与层之间的分子作用力结合。
点击观看动画
H3BO3是路易斯酸,是一元酸
酸性很弱,Ka=5.8×10-10加入多羟基
化合物可增加酸性。
2
双烷氧基硼阴离子
H2SO4
H3BO3+3CH3OH== B(OCH3)3+3H2O
•燃烧绿色火焰 •鉴别硼酸及盐
3. 硼砂 (Na2B4O7·10H2O)
[B4O5(OH)4]2B: sp2杂化 sp3杂化
Na2B4O5(OH)4·8H2O
硼砂珠实验
冷却后为 蓝宝石色
硼砂珠实验:
△
Na2B4O7 ==B2O3+2NaBO2 +) CoO +B2O3 ==Co (BO2)2
Na2B4O7+CoO=2NaBO2·Co(BO2)
α-菱形硼
2 B + 3F2 == 2 BF3 4 B + 3O2 == 2 B2O3 2 B + N2 == 2 BN 2 B + 3 Cl2 == 2 BCl3 2 B + 3 S == B2S3 2 B + 6 H2O(g) == 2 B(OH)3 + 3 H2↑ B + 3 HNO3(浓) == B(OH)3 + 3 NO2↑ 2 B + 3 H2SO4 (浓) == 2 B(OH)3 + 3SO2↑
由于他的理论和实验研究的成功,利普斯科姆于1976年获 诺贝尔化学奖,并在后来的二十年期间给硼化学的发展带来了 重大的影响,从而开创了硼化学这一新领域。
2. AlCl3的成键特征 AlCl3中铝为sp3杂化
(GaCl3)2 (InCl3)2 (AlBr3)2 (AlI3)2 (GaBr3)2 除B的卤化物及ⅢA的氟化物以外,均为二聚形式。
2019教育高中化学竞赛 中级无机化学 硼烷及其衍生物(共46张PPT)精品英语

H+
RH
BR3
H2O2
ROH
CO
H2O2
[(R3C)BO]x
R3COH
2019/6/12
33
B H 3
CC
H 2 BH CC
H 2 B H CC
B H 2H CC
2019/6/12
34
1. 硼烷阴离子
最简单硼烷阴离子: BH4- 四面体 最常见盐:NaBH4
白色固体 提供H-离子:还原剂、配体
L 27
② 碱裂解反应 较大Lewis碱易对称裂解 叔胺、醚、膦、吡啶 B2H6+ 2NR3→2H3B :NR3 B4H10+ 2N(CH3)3→H3B :N(CH3)3 + B3H7 :N(CH3)3
较小Lewis碱易不对称裂解 氨、H2NCH3、OHB2H6+ 2NH3→[(H3N)2BH2]+[BH4]B4H10+ 2NH3→[(H3N)2BH2]+[B3H8]-
1,2-B10C2H12
2019/6/12
1,2-二碳代-闭式-十二硼烷(12)
40
①立体异构和异构重排 例:1,2-C2B10H12、1,7-C2B10H12、1,12-C2B10H12 稳定性: 邻位 < 间位 < 对位
2019/6/12
41
②碳上的反应 碳硼烷骨架具有强烈的吸电子能力 →C−H上的H呈弱酸性
5
1. 物理性质
常温下,大多数硼烷是液体或固体,少数是气体。 2. 化学性质 (1)大多数硼烷的一个非常重要的化学性质是它 们与O2的猛烈的反应,通常爆炸。
2019/6/12
6
(2)多氢型的BnHn+6热稳定性很低,少氢型 的BnHn+4热稳定性较高。
高中化学竞赛辅导全套课件(绝对精品)(共255张PPT)

2,离子型卤化物和共价型卤化物各有那些特征? 3,举例说明低氧化态卤化物 离子型
高氧化态卤化物 共价型
1.4.2 卤素互化物
卤素互化物有XX´ XX´3 XX´5 XX´7四种,卤素的种类不 超过2种
X2+X´2 XX´ XX´3 例:Cl2+F2=2ClF
1.3.1.3 卤化物的水解
PBr3+3H2O=H3PO3+3HBr PI3+3H2O=H3PO3+3HI 或 2P+6H2O+3Br2=2H3PO3+6HBr↑ 2P+6H2O+3I2=2H3PO3+6HI↑
1.3.1.4 烃的卤化
C2H6(g)+Cl2(g)=C2H5Cl(l)+HCl(g)
1.1 单质
存在 :卤素因其活泼性,不以单质存在 F:CaF2(莹石) Na3AlF6 (冰晶石) Ca5F(PO4)3
氟磷硅石 (磷灰石) Cl:NaCl 海水3% 约20g·L-1,岩盐、井盐、盐湖 Br:矿水 I:海带,海藻类,智利硝石其主要为NaNO3(NaIO3)
碘易升华,为什么?
质的只有HClO4 HIO3 HIO4 H5IO6
它们采取什么形式杂化,sp3 sp3d2
空间构型 Cl OH
O
O
Cl
O
OH
F
O
S
O
OH
1.5.2.1 次卤酸及其盐
氰化物的处理 Fe2++6CN-=[Fe(CN)6]4 CN¯+2OH¯+Cl2=OCN¯+2Cl¯+H2O 2OCN¯ +4OH¯+3Cl2=2CO2+N2+6Cl¯ +2H2O
第7章+1节+硼烷及其衍生物

4.高级硼烷的合成
• 常常以乙硼烷为原料, 通过热解获得。
B2H6(g) B2H6(g) + BH3(g) B3H7(g)+ BH3(g)
不能独立存在
2BH3(g) B3H7(g)+H2(g) B4H10(g)
5.硼阴离子[BnH4]2-的制备
• 主要有两种方法
(1)BH缩聚法。用乙硼烷或其他来源BH基团 处理低级硼烷,使BH基团有效添加到分子中。
(1)基本要点(续1)
• d.每一个B原子提供三个原子轨道AO给骨架,多 面体的对称性由这些AO产生的(M+1)个骨架成 键分子轨道MO所决定,M为多面体顶点数。
MO数 6 7 8
9
10 11 12 13
M数 5 6 7
8
9 10 11 12
硼烷结构,提出多中心多电子键)
(3)硼烷结构预测
• 拓扑方法。假设分子通式为BnHn+m
端基B-H键:2C-2e 个数:n+x
B-B键:2C-2e 个数:y
H
桥 B B 键:3C-2e 个数:s
B
开式 B B 键:3C-2e 个数:t
B
闭式 B B 键:3C-2e 个数:t
x ms t ns 2y s x 0 ynm
BnHn+6型 BnHn+4型 BnHn+6型 BnHn+4型 BnHn+6型 BnHn+2型
(3)对硼烷、及杂硼烷骨架编号
• (a)对闭式结构
•
选择垂直多面
体的一条最长轴为
对称轴,轴的顶点
为第一个编号原子,
然后从上向下绕轴
依顺时针方向个各
平面上的B原子编 号即可。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.乙硼烷是由高级硼烷的热分解制备 n B 4 H 1 0 △B 2 H 6+ 较 高 级 硼 烷
3.在H2存在下,通过控制热解B2H6可以制的其他较
高级硼烷。热解的温度不同,产物不同.
如果多面体顶点全部占据则为闭合型(闭式);缺
一个顶点为鸟巢型(巢式);缺两个顶点则为蛛网
型(网式);缺三个顶点则为敞网型(链式,敞网
式)。表明硼烷要么是多面体结构,要么是多面体
碎片
21.01.2021
-
16
BnHn+m
B6H62m=2
21.01.2021
– BH +4H
– BH +2H
B5H9 m=4
-
2
德国化学家在1912-1934年的22年间一共合成和 鉴定了6个硼氢化物,他们分别属于多氢型BnHn+6和 少氢型 BnHn+4两类。
到目前为止,已有50多种硼烷分子和多种多面体硼 烷阴离子被合成和鉴定。
硼烷及其衍生物也是原子簇化合物,它们只是非金 属原子簇而已。
21.01.2021
-
3
1.最初用HCl或H3PO4与MgB2反应,制备一系列的 硼烷
M=2n+4 b=n+2 巢式 M=2n+6 b=n+3 网式 M=2n+8 b=n+4 链式
21.01.2021
-
22
1 1 9 .2 p m 177pm 9 6 .5 0
1 3 2 .9 p m
B 2H 6
1 2 1 .8 0
B 4H 10
H
B 5H 9
B 5H 11
B H
桥式 H
B 6H 10
3.前缀表明结构类型:如闭式、巢式、网式、链式。
4.对于硼烷阴离子应在括号内标出所带电荷数。
B12H122闭式十二硼烷阴离子(2-)
21.01.2021
-
8
1. 硼烷的化学键
(1)乙硼烷的化学键分析 2个BH2基团位于xy同一平面内,在垂直于xy 平面内分布着2个B-H-B 的3c-2e键(氢桥键), B原子之间没有直接成键.
21.01.2021
-
9
H
H
H
B
B
H
H
H
H
H
H
B
B
H
H
H
(a)
(b)
图6-6 (a)B2 H6中的B-H-B3c-2e键 (b)B2 H6 的分子结构
21.01.2021
-
10
①2c-2e BB键 ②2c-2e BH键 ③3c-2e BHB键(氢桥键)
④3c-2e BBB键
⑤5c-6e 硼键
21.01.2021
架成键电子数。
21.01.2021
-
20
硼烷、硼烷阴离子、碳硼烷的结构通式
[(CH)a(BH)pHq]d-
a、p为骨架原子数,q为额外的H原子数,d为 离子电荷数
假设
CH BH
H
P
S
贡献电子 数
3e
2e
1e
3e
4e
21.01.2021
-
21
b表示骨架成键电子对数,n为骨架原子数 若 M=2n+2 b=n+1 闭式
B 10H 14
21.01.2021
-
23
1. 与Lewis碱的反应
①碱加成反应 ②碱裂解反应 ③ 去桥式质子的反应(酸碱中和反应)
-
11
半拓扑图(结构式),就是指保持化学键不断 裂的前提下将硼烷的立体图像平摊在一个二维平 面上所得的图像.
21.01.2021
H
B5H9
-
H
H
H
B HB
H
B
H
B
B
H
H
H
B5H9
12
用6种硼烷结构的成键要素画出各种硼烷的结构式
H B
H
H H
B H
H
B 2H 6
H
H
H
B HB
H BH
BB
HH
H
B 5H 9
= B 2H 6+6H 2O 2H 3B O 3+6H 2
(4)所有挥发性硼烷都有毒。
21.01.2021
-
7
1. 硼烷的命名类似于烷烃,B原子在10以下用甲、乙、 丙、丁······十个干支字表示B原子数,10以上用中文数 字字头十一、十二、十三······称某硼烷。
2.在词干后的圆括号()内标出氢原子数。
21.01.2021
-
4
B2H6 100℃.H2.10MPa B4H10+H2
5B2H6 200-250℃.H2 2B5H9+6H2
3B4H10
△
2B5H11 +B2H6 +H2
4.硼烷阴离子的合成:通过与乙硼烷或其他含BH3 基团的硼烷的作用,生成较高级的硼烷阴离子
21.01.2021
B 2 H 6 + N a B H 4 N a B 3 H 8 + H 2
21.01.2021
-
14
1 1 9 .2 p m 177pm 9 6 .5 0
1 3 2 .9 p m
B 2H 6
1 2 1 .8 0
B 4H 10
H
B 5H 9
B 5H 11
B H
桥式 H
B 6H 10
B 10H 14
21.01.2021
-
15
三种硼烷之间的关系
硼烷结构是以三角形面为结构单元的多面体,
-
B4H10 m=6
17
21.01.2021
斜线方向: –BH, +2H 水平方向: +2H 垂直方向: –BH
-
18
21.01.2021
n+1
-
n+2
n+3 (Wade 规则)19
3 Wade规则 英国化学家K.Wade提出了一个预言硼烷、硼烷
衍生物及原子簇化合物结构规则,叫Wade规则。 硼烷、碳硼烷及原子簇化合物的结构是决定与骨
-
5
1. 物理性质
常温下,大多数硼烷是液体或固体,少数是气体。 2. 化学性质 (1)大多数硼烷的一个非常重要的化学性质是它 们与O2的猛烈的反应,通常爆炸。
21.01.2021
-
6
(2)多氢型的BnHn+6热稳定性很低,少氢型 的BnHn+4热稳定性较高。
(3)几乎所有的硼烷对水不稳定,发生水解 反应
H
HBH H
H
B
B
H
H
HB H
H
B 4H 10
H
H
BB
H
H
H
B H
H
BB
B
H
H
H
B 6H 10
HH
HB H
HB
H B
H
H
H
B 3H 9
H
H B
H
H B
H
B
H
B HH
H
B HH
B 5H 11
21.01.2021
-
13
2.硼烷多面体结构类型
多面体结构复杂,形状各异,结构类型有:闭 合型(closo-)、鸟窝型(nido-)、蛛网型 (arachno-)、敞网型(nypho-)。又分别称 为闭式、巢式、网式、链式 .
§ 6-2 硼烷及其衍生物
21.01.2021
-
1
硼氢化物在历史上曾经叫做“缺电子化合物”。 20世纪40年代H.C.Longuet-Higgins提出一个三电 子=电子键(3c-2e键)的新概念。
硼能形成多种氢化物,硼氢化物通称硼烷。最简 单的硼烷是乙硼烷B2H6 ,而不是BH3 .
21.01.2021
