胶团形成的热力学与动力学.
第4章 热力学之凝胶网络及橡胶弹性解析

fe
Temperature
L0
L L0 L0
f L
f
橡胶的形变习惯上用拉伸比表示:
L 1 L0
1 室温下天然橡胶的能弹 性分数表明弹性力中熵 变部分总是占80-85%
0.75
fe/f
0.5
0.25
0 0.75
1
1.25
1.5
1.75
2
U S f T L T ,V L T ,V
交联密度的描述方法
(3)交联点密度(/V):单位体积中的交联点数
为交联点总数
网链数与交联点数的关系
N个网链有2N个链端
每个链端结合为一个交联点
故 = 2N/
热力学分析
dL
dL
f
L
f
f
f
恒温条件下将原长度为L0的橡胶带拉长dL
dL
f
f
体系的内能受三个因素影响: (1)拉伸功 (2)体积变化功 (3)热量变化
4.2 橡胶弹性
橡胶弹性的特征:
小应力下可逆大形变
橡胶弹性的本质:熵弹性
构成弹性体的三个要件:
(1) 必须由长链聚合物构成 (2) 聚合物链必须具有高度柔性
(3) 聚合物链必须为交联网络
橡胶弹性的条件一:分子链长
r
2 1/ 2 0
C nl 2
rmax r
2 1/ 2 0
rmax nl sin
U f f T L T ,V T V , L
U S f T L T ,V L T ,V
Flory 构图
固定伸长
以外力对 温度作图
f
SDBS胶束体系热力学性质的研究

SDBS胶束体系热力学性质的研究王琼,王栋,卜芳(大连理工大学环境与生命学院,大连116024)摘要:文章选用十二烷基苯磺酸钠为研究对象,在(25±0.02)℃下,用Na+选择性电极法测量不同浓度的电动势(EMF),求出其临界胶束浓度(cmc)及反离子结合度,得出反离子与胶束结合的经验平衡常数K ass。
在25~50℃范围内,每隔5℃电导率随温度的变化,求出对应温度下的cmc 及其相应的一系列热力学参数。
在实验温度范围内,吉布斯自由能均为负值,胶束化可以自发进行;焓变为正值,胶束化过程吸热,且属于熵驱动过程,有18.67%的T△mic S0增加对胶束稳定性增加有贡献,以上特征参数的确定,可为研究表面活性剂溶液的各种应用以及处理技术提供重要参考。
关键词:S DBS;EMF;临界胶束浓度;反离子结合度;电导率;胶束化热力学参数中图分类号:X124 文献标志码:A 文章编号:1003-6504(2009)09-0077-04Investigation of Thermodynamic Properties of SDBS Micellar SystemWANG Qiong,WANG Dong,PU Fang(School of Environmental & Biological Science & Technolog y,Dalian University of Technolog y,Dalian 116024,C hina)Abstract:Sodium dodecyl benzene sulphate (S DBS),a typical anion surfactant,is investigated in the lab regarding its micellar solutions. EMF values of the solutions with various concentrations are measured using Na+ selective electrode,based on which the critical micelle concentration(CMC) and counter ion association degree can be calculated,thus leading to K ass,the empirical equilibrium constant as well as the CMC values and the micellization thermodynamic parameters of SDBS at different temperatures. It is found that values of △mic G°are negative in general at the room temperature of the lab,suggesting that micellization process can take place spontaneously. It is concluded that about 18.67% of T△mic S°is contributive to stability of the micellar system.Key w ords:SDBS;EWF;CMC;counterion a ssociation d egree;conductivity;micellization t hermodynamic p arameters日常生活中所用的表面活性剂主要是阴离子型表面活性剂,大量使用后成为环境水体中普遍存在的污染物。
胶体答案1

胶体的动力学性质:布朗运动,扩散作用,沉降作用。
适宜于LB膜的物质分以下三类(1)各种两亲分子(2)高聚物(3)芳香族大环化合物铺展是润湿的最高标准,凡能铺展,必能浸润,更能粘附①散射光强度与入射光波长的四次方成反比胶团结构:胶核、吸附层、胶粒、扩散层、胶团1无论是物理吸附还是化学吸附,温度升高时吸附量减少.(压力增大,吸附量增加,吸附速率也随压力的增大而增大。
)3使溶胶聚沉的方法:1加电解质2电性不同的溶胶混合3微波处理4.大分子摩尔质量的表示方法?数均分子量,重均分子量。
Z均分子量,黏均分子量5对于处于平衡状态的液体,水平液面内部分子所受压力等于外部压力,凹液面内部分子所受压力小于外部压力6临界胶束浓度CMC在CMC前溶液的表面张力有显著的变化7斯特恩电动电势指溶胶粒子表面由于静电或分子间的相互作用而紧密吸附一层的总电势8DLVO理论中质点间的作用力有静电斥力和相互间的吸引力9多孔物质的外观体积V堆包括颗粒与颗粒之间的孔隙体积V隙颗粒内部的微孔体积V孔和多孔物本身骨架的体积V骨。
1矿石浮选法的原理是根据表面活性剂的增容作用×2布朗运动是胶体粒子特有的运动方式,可以把胶体和溶液,悬浊液区别开来×3高度分散的多相性和热力学不稳定性是胶体的主要特征。
4除去制备过程中过剩的电解质,以利于溶胶的稳定性。
1溶胶制备的一般条件:a分散相在介质中的溶解度必须极小b必须有稳定剂存在2胶体的制备方法:a凝聚法b分散法3丁道尔效应:以一束强光射入溶胶后,在入射光的垂直方向可以看到一道明亮的光带,被称为丁道尔效应4入射光波长越短,分散相与分散介质的折射率相差越大,散射作用越明显5质点对光的吸收主要取决于其化学结构9球形胶束;浓度为CMC或略大于CMC棒状胶束:在浓度为CMC的10倍或更大的浓度层状胶束:浓度更大,可形成巨大的层状胶束3对于同一溶胶,外加电解质的离子价越低,聚沉值越大,离子浓度相同时,离子价越高,聚沉值越小,聚沉值主要取决于胶粒带相反电荷的离子的价数乳状液的鉴别方法:稀释法、然设法、导电法。
明胶与卡拉胶共凝胶体的热力学特性及微观结构的研究

_ ne m r’ r 0dVna l 1 l n● 1 m ● 上r C h 0De ne , rJ S and 1● r t uc・ e 0● ● 1』 UC Os ■r V● ・ r t ur I ’
G ea i - a r g e a - es l t c r a e n n Co g l n
明胶 :广 东开平 :卡拉胶 :广东 阳江 。
1 方法 . 2
溃散温度几乎未发生该变 ( 1 ) 图 C ,而添加高百分比
的卡拉 胶 后 ,共凝 胶 体 的溃 散温 度 生 高到 4 ℃。 0 Mor 研 究凝胶体 的特 性时将 凝胶体划分 为以下几种 rs i 类型 ( ) 充凝 胶体 , 1填 在这种 凝胶体 中一种 大分子起 凝胶体形成剂 的作用 ,而其 它的大分子起填 充剂的作
水相介质 中交互作用 的机理 。 1 材料 与方 法 11 材料 .
21 明胶与 卡拉胶 共凝胶体 的热力学特性 .
由图 l A、图 l B、图 l C可知 ,单纯 5 %明胶胶体
其 G从 2 0℃开始 随温 度的升 高逐渐 下降,到温度约
为 3 .℃ 时,胶 体的 G 降为 0 2 5 几乎 ,说明此 时胶体的 结构完 全破坏 。在添 加低 百分 比的卡 拉胶后 ,凝胶体
摘要:本文通过对明胶与卡拉胶共凝胶体的热力学特性及微观结构的研究 ,得 出明胶与卡拉胶形成的凝胶体的热力学特性随两 种大分子的配比、体 系的 D H值、及盐浓度的不同而不 同。微硼. 的研究表明胶体的结构决定 了其宏观功能特性的表现,两种 大子 结构
在不同的条件下,其发 生作用的方式不同。 关键词 :明胶;卡拉胶;热力学;微观结构 中图分类号:T 2 1 ;文献标识码:A:文章篇号: 7.0 82 0)704 -4 S0. 7 1 39 7 (080 .6 90 6
胶体动力学

这种现象只有在cmc(临界胶束浓度)以上胶团大量生成后,才明显表现出来。
基本原理:由于胶团的特殊结构,从它的内核到水相提供了从非极性到极性环境 的全过渡。
(一) 加溶方式 ① 加溶于胶团内部,主要适用于非极性有机物的加溶。 ②加溶物分子与形成胶团的表面活性剂分子穿插排列,主要适用于具有两亲性的 难溶有机物 ③ 被“吸附于胶团表面”,某些既不溶于水又不溶于烃的有机物,如苯二甲酸 二 甲酯以及一些染料。 ④包含于胶团的极性基层,只是聚氧乙烯型表面活性剂胶团的一种特殊加溶方式。
这表明,胶团催化作用的大小决定于胶团的数量、加溶能力以及在胶团中与在溶 剂中进行的反应速率之差。
§4.18 液晶
液晶:把由溶剂加入到表面活性剂晶体中,使之体系的结构发生变化,从高度 有序的晶体形式变为较为无序的相称之为液晶(Liquid crystal)或介晶相 (mesophase). 特点:兼有某些晶体和流体的物理性质。 液晶的种类:① 热致热晶,其结构和性质取决于体系的温度。 ②溶致液晶,取决于溶质分子和溶剂分子间的相互作用。 在简单表面活性剂——水体系中不是理论上的18种不同的液晶,而只有层状相 和立方相三种。
§ 4.22 阳离子型与阴离子型表面活性剂混合物
在一定条件下,阴、阳离子表面活性剂混合体系具有很高的表面活性,显示出 极大的增效作用。 混合溶液中的cmc下降, γcmc降低。 应用Gibbs吸附公式自混合溶液表面张力数据可计算出表面总吸附量和各组分的吸 附量。下表列出了吸附数据。 浓度/(mol/L) 1×10-3 Г+ /(mol/cm-2 ) 2.4×10-10 Г- /(mol/cm-2 ) 2.5×10-10 ГT /(mol/cm-2 ) 4.9×10-10
• •
橡胶弹性热力学

橡胶弹性的原因三:适度交联
无交联的情况
拉伸
回缩
建立交联点
有交联的情况
构成橡胶弹性体的三个要件:
(1) 必须由长链聚合物构成 (2) 聚合物链必须具有高度柔性 (3) 聚合物链必须为交联网络
热力学分析
dL
dL
f
ff
f
L
恒温条件下将原长度为 L0的橡胶带拉长 dL
dL
f
f
体系的内能受三个因素影响: (1)拉伸功 (2)体积变化功 (3)热量变化
Mc=W/N
交联密度的描述方法
(3)交联密度(? /V):单位体积中的交联点数
? 为交联点总数
橡胶示例
天然橡胶
优点:1有较高的门尼粘度2加工性
能好,易与配合剂混合,且可与多数 合成橡胶并用。 缺点:1非极性橡胶,在非极性溶剂 中膨胀,故耐油、耐溶剂性差。2含
H
HH
- --
-C-C=C-C-
--
-
f ? ?? ?U ?? ? T ?? ?S ?? ? ?L ?T ,V ? ?L ?T ,V
f ? ?T ?? ?S ?? ? ?L ?T ,V
揭示了橡胶弹性的本质: 熵弹性
近期的研究表明,内能对聚合物高弹性也有一定的贡献,约占十分之一。
解释了形变的热效应
热
冷
W
热
冷
f ? ?T ?? ?S ?? ? ?L ?T ,V
异丁烯
丁基橡胶
气密性好,耐热、耐臭氧、耐化学药品。制 作各种轮胎的内胎、无内胎轮胎的气密层、 各种密封垫圈,在化学工业中作盛放腐蚀性 液体容器的衬里。
橡胶示例
H
H
C =C
CH 2
胶体与界面化学6

四、表征手段
π—Α曲线能反映液一气界面LB膜的状态及 某些变化,但还难以体现分子水平的微观情况。 例如,分子排列的有序性、取向性,以至分子内 原子基团与价链的变化,而这些微观参量及其 变化对于LB膜的特征至关重要。 此外,LB膜的原位表征也具有重要的意义。 通常使用的分析手段有:红外光谱、激光拉谱、 X射线光电子能谱(XPS)、X射线衍射、荧光光 谱、电子衍射、核磁共振、电子回旋共振谱 (ESR)及扫描电镜等。用来对膜的结构、完整性、 排列以及各种膜分子与固体间的相互作用进行 研究。
3.LB膜技术在医学研究中的应用
病理药理研究中的应用 应用LB膜技术研究了胆结石的形成与结构, 研究结果表明,胆红素在有序分子膜中的行为 与亚相的pH值有很大关系,人体环境的pH范 围正好处在胆红素构型和性质变化敏感的pH范 围内,这可能是人体胆结识容易形成的分子基 础。
临床诊断中应用 机体的组织器官是由细胞组成的,而细胞是 一个生物膜的系统,不同细胞膜间的相互作用在 多方面表现出极其重要的生物学功能。以LB膜表 征技术为借鉴,研究开发膜诊断技术及膜诊断设 备,利用膜诊断技术了解生物膜性质和结构的变 化,将可实现对许多疾病进行早期诊断,以便早 期治疗和防止疾病发展与恶化。
表面活性剂的 分子有序组合体
表面活性剂分 子两亲结构的 特点导致在不 同的环境中均 能定向排列, 形成各种分子 有序组合体, 例如:单分子 膜、胶束、反 胶束、微乳液、 囊泡、液晶等。
第四节 L-B技术与LB膜
LB 膜 的 研 究 起 始 于 20 世 纪 30 年 代 , 首 先 是 由 Langmuir 及其学生Blodgett在1920年和1935先后将 单分子膜转移到固体表面(又称基底)上,并可 以多层重叠,建立了一种单分子膜堆积技术,称 之为 L-B膜技术。 60 年代初期 ,H.Kuhn 首先用 L-B 膜技术通过单分子膜的组装来构造分子有序体系, 并首次把具有光活性的染料分子引入LB膜。到了 80年代,LB膜技术已经引起物理学、生物学、电子 学、光学、化学、材料学、摩擦学等领域国内外 学者的普遍关注,并在许多方面得到了应用,取得较 大的进展。
表面活性剂物理化学第四章
返回
2013-7-9
胶束形成的热力学
若不考虑溶剂,表面活性剂的胶束化应是熵减的过程。 因为胶束化是表面活性剂从无序到有序的过程。但这明 显与胶束化是一自发过程相矛盾。 实际上,从憎水效应的机理看,当憎水基聚集成胶束 内核时,冰山结构被破坏,水恢复为自由水分子。此过 程熵的增加应比表面活性剂的熵减少要大,因此,净结 果是总熵增加。可见,胶束的形成除水分子与烃之间的 斥力及憎水基间的范德华力外,更主要的是热力学因素。 即熵效应是胶束形成的主要推动力。
返回
2013-7-9
4.3 临界胶团浓度的测定及其影响因素 1、测定方法 (1)表面张力法(这是测定cmc的标准方法) 作γ-lnc曲线,从曲线的转折点可得CMC,此方法简单 、方便,可同时求得CMC和吸附量。
1 d RT d ln c
上一内容
下一内容
回主目录
返回
2013-7-9
临界胶团浓度的测定及其影响因素
(5)光散射法 胶团粒子的大小满足光散射的条件,因此,具有较强的丁择尔效 应(Tyndall effect).因此,可通过测定散射光强度随浓度的 变化以确定临界胶团浓度,此方法干扰少,具有普适性,是测定 CMC的好方法。
上一内容
下一内容
回主目录
返回
2013-7-9
上一内容 下一内容 回主目录
返回
2013-7-9
胶团的大小 胶团聚集数的大小与亲水基和憎水性的相对大小有关,与电解质
的存在与否、强度的高低有关,一般规律为:
(1)憎水基链长增加,胶团聚集数增加,半径增大,表面层面 积增大(对球形或椭球形)
(2)憎水基固定,聚氯乙烯链长增加,聚集数下降。半径不变
胶体科学导论1

压力
P1 *
第二章 胶体的形成和增长
溶液中的析晶情况
析晶方法:
ln
恒温蒸发 C' 亚稳区 C'' C B B' A B''
a 2σ Vs 1 = ao RT r
第二章 胶体的形成和增长
a为溶解度 恒温蒸发 溶解度(饱和浓度) C' 亚稳区 C'' C B 冷却 B' A B''
溶解度(饱和浓度)
1、恒温蒸发 2、冷却
胶体与高分子溶液的区别
它们的大小具有相同的数量级,也具有多分散 性及组成不确定性,以及由此所得到的许多共 同性质。 胶体是热力学上不稳定的多相物系。两相放在 不同点 一起不能自发地形成胶体。相反地,形成的胶 体有自发分相的倾向。高分子溶液是热力学上 稳定的均相物系,是真溶液。当溶质与溶剂混 合时会自发形成溶液。
Mn
胶体粒子。 凝聚法: 将原子、离子或分子聚结成胶体粒子。
*本章的方法为凝聚法
不变。
第二章 胶体的形成和增长
§2-2胶体形成过程的热力学基础
第二章 胶体的形成和增长
1 相图、平衡相和亚稳相
温度
亚稳区:在 理论上应发 生相转变而 在实际上又 不能发生相 转变的区域
亚稳区
凯尔文方程
A B
C TA TB TC
②按分散相(分散相)及分散介质的聚集态分类
分散介质: 液态。 分散相: 气态、固态、液态 →(液) 溶胶 分散介质: 固态。分散相: 气态、固态、液态 → 固溶胶 分散介质: 气态。分散相: 固态、液态 → 气溶胶
胶体与真溶液的区别
胶体 真溶液 4)没有确定的组成和结构,受 溶质分子都有固定组 外来添加物的影响很大,而且 成和结构,也不能再 可以分裂,在化学组成上仍保 分裂。 持原来的性质。 相同点
第四章 表面活性剂(一)

3. 硅化合物类:如下所示的聚硅氧烷链疏水性很突出
H3C
CH3 CH3
C Si
(O
CH3 CH3
CH3
Si )4
CH3
非极性基团:
1. 最常见的是8-18碳的直链烷烃,或环烃等
如 C17H35-,R-
等
2. 全氟表面活性剂:将上述碳氢链中的氢原子全部用 氟原子取代即可。其疏水作用强于碳氢链,其水溶液 表面张力可低至20mN/m以下
能溶解相当量的不溶(或不易溶)于水的有机物质。如果是 无机盐水溶液,一般由于“盐析”作用,浓度增加易使其溶 解有机物的能力减小,而表面活性剂电解质则相反,溶解有 机物的能力随浓度上升。
图4-7 (CH3)2N— —N=N—
图4-8 染料“AB黄”在表面活性剂 C12H25SO3H水溶液中的溶量 S(25℃)
第四章(Ⅰ) 表面活性剂
曲线1是表面张力随浓度增
加而稍有上升。(NaCl、
1
KNO3、HCl等)
曲线2是表面张力随浓度增
加而缓慢下降。(乙醇、丁
2
醇、醋酸等)
曲线3是表面张力在稀溶液
3
范围内随浓度的增加而积剧
下降,表面张力降至一定程
度后便下降很慢,或基本不
浓度
下降.(表面活性剂)
图4-1 水溶液浓度与表面张力的关系
这一概念上世纪初由McBain提出,1925年当McBain在 伦敦的一个学术会议上提出肥皂这类物质的溶液含有导电的 胶体电解质,并且是严格的热力学稳定体系时,当时的会议 主席竟然以“胡说”的无理言辞代替了讨论。当然科学的历 史证明了McBain的正确。
临界胶束浓度 ( CMC ) (Critical Micelle Concentration)
胶体化学

系统 真溶液 胶体系统 粗分散系统
分散系统的分类及特征(总结)
分散相粒子 直径 d
系统相态
热力学稳定性
实例
d < 1 nm
均相
各种分子、原子、离子溶液
稳定
多相不稳定, 如乙醇水溶液、NaCl 水溶液、
空气等
多相 1<d<1000nm
不稳定
为什么? 各种溶胶
二 胶体系统的动力学性质
解释胶粒能扩散、渗透以及因重力作用而不聚沉下来的原因。
以后发现,线度小于4000nm的粒子,在分散介质中都 有这种运动。(胶体尺度 1 ~ 1000nm)
这种现象产生的原因是,分 散介质分子处于不断的热运动中, 从四面八方不断的撞击分散相粒 子。对于大小在胶体尺度下的分 散相粒子,粒子受到撞击次数较 小,从各个方向受到的撞击力不能 完全互相抵消,在某一时刻,粒子 从某一方向得到的冲量即可发生 位移。此即布朗运动。
h1 h2
4.沉降速度与粒子半径的关系
阻力F为: F=4/3лr3dg-4/3 лr3dog
= 4/3лr3(d-do)g
根据斯托克斯公式: 4/3лr3(d-do)g=6 лŋru 因此: r=[9 ŋu/2(d-do)g]1/2
r-粒子半径; d-粒子密度; d0-分散介质密度;u-粒子沉降速度; ŋ-介质粘度
溶胶是一个高度分散的非均相系统。分散相粒子 与分散介质间有明显的相界面。实验发现,在外电场 下,固、液两相可发生相对运动;反之,若迫使固、 液两相作相对运动时,又可产生电势差。溶胶的这种 与电势差有关的相对运动称为电动现象,电泳和电渗 都属于电动现象
电动现象说明,溶胶粒子表面带有电荷。而溶胶粒 子带有电荷也正是它能长期稳定存在的原因。
(物理化学D(下))溶胶的胶团结构
2. 溶胶的聚沉
➢ 任何溶胶本质上都是不稳定,稳定只是暂时,总会聚沉。 聚沉:溶胶粒子互相聚结、长大,进而沉淀的现象。
(1) 电解质的聚沉作用 适量电解质作溶胶的稳定剂;但电解质加入过多反而聚沉。 电解质浓度或价数增加,压缩扩散层,扩散层变薄,斥力势
能降低,溶胶聚沉; 加入的反离子发生特性吸附,斯特恩层内反离子数量增加,
保护作用:
若在溶胶中加入较多的高分子化合物,许多个高分子化合 物的一端吸附在同一个分散相粒子的表面上,或许多高分子线 团环绕在胶粒周围形成水化外壳,将分散相粒子完全包围起来, 对溶胶则起到保护作用。
电势越高:胶粒带电越多,扩散层越厚
溶液中电解质浓度增加时,介质中 反离子的浓度加大,把更多的反离子挤
进滑动面内,中和固体表面电荷,使
电势降低,甚至改变符号。
电解质浓度足够大, = 0 ,为等电态:胶粒不带电,不发
生电动现象,极易聚沉。
➢ 斯特恩模型:
❖ 给出了 电势明确的物理意义;
❖ 解释了溶胶的电动现象; ❖ 定性地解释了电解质浓度对溶胶稳定性的影响。
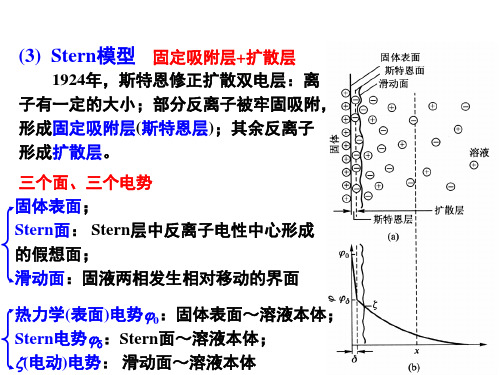
(3) Stern模型 固定吸附层+扩散层
1924年,斯特恩修正扩散双电层:离 子有一定的大小;部分反离子被牢固吸附, 形成固定吸附层(斯特恩层);其余反离子 形成扩散层。
三个面、三个电势 固体表面; Stern面: Stern层中反离子电性中心形成 的假想面; 滑动面:固液两相发生相对移动的界面
热力学(表面)电势0:固体表面~溶液本体; Stern电势:Stern面~溶液本体; (电动)电势: 滑动面~溶液本体
1、溶胶的经典稳定理论--DLVO理论 2、溶胶的聚沉
1. 溶胶的经典稳定理论DLVO理论
1941年杰里亚金(Derjaguin)和朗道(Landau)、1948年维韦 (Verwey)和奥弗比克(Overbeek)分别提出带电胶体粒子稳定理论 (DLVO理论),理论揭示溶胶稳定与聚沉的原因。
胶体颗粒自组装过程动力学特性解析

胶体颗粒自组装过程动力学特性解析胶体颗粒是一种尺寸在纳米尺度的微小颗粒,其尺寸介于分子和宏观物质之间。
自组装是指这些胶体颗粒在适当的条件下,根据一定的力学、热力学和几何原理,自发地组装成有序结构或者形成功能性材料的过程。
自组装过程中的动力学特性对于材料设计和应用具有重要意义。
在本文中,我们将探讨胶体颗粒自组装过程中的动力学特性,包括扩散、聚集和相变等方面的解析。
首先,让我们来分析胶体颗粒自组装过程中的扩散动力学特性。
扩散是指分子或颗粒在空间中由浓度高的区域向浓度低的区域移动的过程。
在胶体颗粒自组装中,扩散是粒子间相互作用的核心机制之一。
通过研究胶体颗粒的扩散行为,可以揭示其自组装过程中的动力学规律。
例如,一些研究发现,胶体颗粒在自组装过程中的扩散行为受到颗粒浓度、温度和溶剂等因素的影响。
此外,胶体颗粒的形状和表面性质也会对其扩散行为产生影响。
研究这些因素对胶体颗粒扩散动力学特性的影响,有助于我们理解胶体颗粒自组装过程中的动力学行为,并为材料设计和应用提供指导。
其次,我们来探讨胶体颗粒自组装过程中的聚集动力学特性。
聚集是指胶体颗粒在自组装过程中由于吸引力或排斥力的作用,聚集成更大的颗粒团块的过程。
聚集动力学特性的解析对于探讨胶体颗粒自组装过程中的结构发育和稳定性具有重要意义。
一些研究发现,胶体颗粒的聚集行为受到温度、添加剂浓度和流体性质等因素的影响。
此外,胶体颗粒的表面性质和形状也会对聚集过程产生影响。
研究这些因素对胶体颗粒聚集动力学特性的影响,有助于我们理解胶体颗粒自组装过程中的动力学规律,并为材料设计和应用提供参考。
最后,我们来讨论胶体颗粒自组装过程中的相变动力学特性。
相变是指物质在温度、压力等条件改变下从一种状态转变为另一种状态的过程。
在胶体颗粒自组装中,相变是指胶体颗粒在适当的条件下从无序状态转变为有序状态的过程。
研究胶体颗粒自组装过程中的相变动力学特性有助于我们理解胶体颗粒有序结构的形成机制。
硫酸钠滴加过量氯化钡形成硫酸钡溶胶的胶团结构

硫酸钠滴加过量氯化钡形成硫酸钡溶胶的胶团结构【硫酸钠滴加过量氯化钡形成硫酸钡溶胶的胶团结构】1. 背景介绍在化学实验室中,我们经常会遇到各种各样的化学反应。
其中一种非常有意思且具有实验价值的反应就是硫酸钠和氯化钡的反应。
当硫酸钠滴加到过量氯化钡溶液中时,会发生形成硫酸钡溶胶的胶团结构的有趣现象。
在本文中,我们将通过深度的探讨和分析,了解这一反应背后的化学原理及其胶团结构的形成机制。
2. 反应原理让我们简要回顾一下硫酸钠和氯化钡的化学性质。
硫酸钠是一种常见的无机盐,其化学式为Na2SO4,是一种白色的结晶性固体。
氯化钡则是一种无色晶体,其化学式为BaCl2,在水中溶解后能够分离出Ba2+和Cl-离子。
当硫酸钠滴加到过量的氯化钡溶液中时,会发生沉淀反应。
硫酸钠的Na+离子和氯化钡的Cl-离子会形成NaCl盐类,此时溶液中逐渐释放出大量的Cl-离子。
随后,Na+离子会与剩余的Ba2+离子结合,生成硫酸钡(BaSO4)沉淀。
这种沉淀的形成会导致溶液中浑浊的变化,同时在观察下还能看到固体胶团结构的形成。
3. 胶团结构的形成机制接下来,让我们深入分析硫酸钠滴加过量氯化钡形成硫酸钡溶胶的胶团结构的形成机制。
在这个过程中,硫酸钡溶胶的胶团结构是如何产生的呢?这一现象需要从化学动力学和热力学的角度进行分析。
我们需要了解硫酸钡溶胶的结构特点。
硫酸钡溶胶是由大量微小颗粒组成的,这些颗粒之间存在着一定的相互作用力。
在溶液中,随着硫酸钡沉淀的形成,颗粒之间由于离子的吸引和排斥作用形成了一定的空间排列结构。
这一结构会导致颗粒之间产生静电吸引力,从而形成了胶团结构。
热力学的因素也是影响硫酸钡溶胶胶团结构形成的重要因素之一。
在沉淀反应中,释放出的热量会导致溶液的温度升高。
通过热动力学的分析,可以得知在高温下,离子的活动能力会增强,从而使得颗粒间的相互作用力增强,形成较为稳定的胶团结构。
4. 个人观点和理解对于硫酸钠滴加过量氯化钡形成硫酸钡溶胶的胶团结构,我们应该如何进行深入理解呢?在我看来,这一反应提醒我们化学反应背后隐藏着丰富的化学原理。
胶团形成的热力学与动力学.

胶团热力学
• 质量作用模型的评价 合理性: 模型比相分离模型更接近实际体系的情况,用化学 平衡的方法解决问题,想法比较巧妙。 其表达的临界胶束浓度与反离子浓度的关系与从大 量实验中归纳出的相同,由此可见,质量作用模型 的预示性比较强。
局限性: 推导过程稍比相分离模型复杂。
胶团热力学
• 有了胶团标准自由能便可以方便计算出相应 的标准焓变和标准熵变。 • 在所有实验温度, △Gm0皆为负值,说明在 标准状态下此过程可以自动发生。 • 标准焓变的数值有正有负,所有的标准熵变 都是正值,所以-T△Sm0 为较大的负值。因 此胶团形成过程主要是熵驱动过程。
胶团热力学
• 相分离模型的评价 • 合理性: 在胶团溶液所具有的胶团聚集数很大的情况 下,单体到胶团的过渡是锐变过程,类似于 相分离。 • 局限性: 一般溶液的胶团聚集数并不大(30-200), 不适宜作为一相处理,因此相分离的描述不 确切
胶团热力学
• 质量作用模型 把胶团形成看作一种广义的化学反应——缔合 对于非离子型SAa, nS Sn 可以根据化学热力学的基本原理写出如下关系: △G0 = - RTlnK = RTlnCs – (1/n)lnCm 由于n>>1,在cmc以上的一段浓度范围内,可以忽 略第二项。 所以△Gm = △Gm0 – RTlnas 即:对于非离子型SAa,两种模型得出同样的结果
C11H23COOCH2CH2N(CH2)sNCH2CH2OOCC11H23 BrBr-
叶康,许虎君,王中才,包新颜,丁振军,刘晓亚,华东理工大学学报(自然科学版), 2006, 32(12), 1418
热力学
• 表面活性剂C16-MADS • 通过测量γ,得到cmc, 计算△Gm0 • 计算知△Hm0 <0 • 随着温度的上升,△Gm0 负值增大,说明△Sm0 >0 • 过程为熵驱动。
胶团反胶团萃取ppt

• 可以认为相对分子量20000左 右得蛋白质得高效分离就是 通过立体性相互作用来实现 得。
有机溶剂
反胶团:
表面活性剂得 极性头朝内,疏水 得尾部向外,中间 形成极性得“核”
极性 “头”
极性得“核”
非极性 “尾”
3、表面活性剂 表面活性剂得存在就是构成反胶团得必
要条件,有三类表面活性剂都可在非极性溶 剂中形成反胶团。 (1)阴离子型表面活性剂 (2)阳离子型表面活性剂 (3)非离子型表面活性剂
胶团反胶团萃取
目录
一、胶团与反胶团概述 二、反胶团得物理化学特性及制备 三、反胶团萃取机理 四、在分离工艺中得应用
一、胶团与反胶团概述
1、胶团得形成及特性 2、反胶团得形成及特性 3、表面活性剂 4、反胶团得分类
1、胶团得形成及特性
胶团或反胶团得形成均就是表面活性剂分子自
聚得结果,就是热力学稳定体系。 将表面活性剂溶于水中,当其浓度超过临界胶团
常用得表面活性剂及其相应得有机溶剂
表面活性剂
有机溶剂
表面活性剂 有机溶剂
AOT n-烃类(C6~C10)、异辛烷、 Brij60
辛烷
环己烷、四氯化碳、苯
CTAB 己醇/异辛烷,己醇/辛烷 TritonX 己醇/环己烷
三氯甲烷/辛烷 磷脂酰胆碱 苯、庚烷
TOMAC
环己烷
磷脂酰乙醇胺 苯、庚烷
在反胶团萃取蛋白质使用最多得就是阴离子 型表面活性剂AOT ,AOT容易获得,它具有双链,形成 反胶团时无需添加辅助表面活性剂且有较好得强度; 它得极性基团较小,所形成得反胶团空间较大,有利 于生物大分子进入。
胶束

Colloid & Interface Sci. Lab.胶束<<胶体与界面化学>>表面活性剂的溶液性质表面活性剂的浓度渗透压浊度溶解性磁共振表面张力当量电导自扩散各项性质的量值CMC•胶团化作用的特性:•自发过程;•胶团由溶质单体聚集形成聚集体;•胶团溶液是热力学平衡体系,胶团中溶质与溶液中的单体平衡,是热力学稳定性;•胶团内核为疏水微区,具有溶解油的能力。
内容提要•临界胶束浓度的测定•胶束的结构•胶束的形状•胶束的聚集数与大小•胶束形成的热力学•胶束形成的动力学临界胶束浓度的测定•表面张力法•电导法•染料法•浊度法•光散射法疏水内核极性基层•胶束基本结构:内核和外层与液态烃相似l c a 0va 0:头基所占的最小截面积;l c :疏水尾链的有效长度;v :疏水尾链所占的体积。
24micelle A R π=0n a =⋅343micelle V R π=n v=⋅013v a R =⋅•由n 个表面活性剂分子所形成疏水内核半径为R 的胶束,则c R l ≥013c v a l ≤⋅0cva l ⋅即为表面活性剂分子的临界堆积参数P c分子堆积参数a 0的求算疏水链为直链烷烃时l c 和v 的求算:(0.150.1265) c l N nm =+⋅33(27.426.9)10 v N nm−=+⋅×Example :十二烷基硫酸钠2030.63 1.7 0.35 c a nm l nm v nm===,0.350.330.63 1.7c P ==×球状胶束蠕虫状胶束胶束的结构J. Phys. Chem. 1994, 98, 5984J. AM. CHEM. SOC. 2007, 129, 1553Science1999, 283, 960J. AM. CHEM. SOC. 2006, 128, 5751•表面活性剂结构的影响•表面活性剂亲水性变弱,胶团的聚集数增加;反之则变小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
胶团热力学
• 对于离子型表面活性剂 nM+ + nASn 所以 △Gm0 = - RT/n * ln[am/(a+a-)n] (a+=a-) △Gm0 = 2RTlncmc
胶团热力学
• 相分离模型的评价 nS Sn K=Cm/Csn CT= cmc + nCm K=Cm/(CT - nCm)n 将上式对CT积分得: dCm/dCT =K1/n/[nK1/n +(1/n)Cm(1-n)/n] dCm/dCT可以用来表示相分离的程度。
胶团动力学
• 毫秒级慢过程 胶团形成和解体 nS Sn 胶团部分破坏和恢复 Sn Sn-a + Sa a为不大于n/2的整数 尺寸变更 S n + S n’ Sn-b + Sn’+b (n+1)Sn nSn+1
胶团动力学
• 影响因素 碳链加长使单体离开胶团的速度明显变慢 (分子的疏水性增强)
= RTlnCs + RTk/n * lnCb - RT/n * ln(FCm) 当聚集数较大且溶液浓度较小时, RT/n * ln(FCm) 一项可忽略。
胶团热力学
• 于是就有: △Gm0 = RTlncmc + (k/n) * RTlnCb 定义kg = k/n 为反离子结合度 当k=n时,反离子全部结合到胶团上,此时等式的 右边可以写成2RTlncmc,与相分离模型得到的结 果相同。 若k=0,则无反离子与胶团连接,则有 △Gm0=RTlncmc 恰好与非离子型的表达式相同。^_^
胶团动力学
• 胶团处于动态的平衡当中 • 胶团形成动力学的研究通常利用温度跃、压 力跃、超声吸收等方法使胶团溶液经受突变, 再监测它的弛豫过程。 • 两类速度过程:微秒级的快过程 毫秒级的慢过程
胶团动力学
• 微秒级的快过程 电离 Sn Bm SnB(m-1) +B; Sn代表n个单体形成的胶团,B代表反离子 单体转移 Sn-1 + S Sn 其中S代表活性剂单体
胶团热力学
• 相分离模型的评价 • 合理性: 在胶团溶液所具有的胶团聚集数很大的情况 下,单体到胶团的过渡是锐变过程,类似于 相分离。 • 局限性: 一般溶液的胶团聚集数并不大(30-200), 不适宜作为一相处理,因此相分离的描述不 确切
胶团热力学
• 质量作用模型 把胶团形成看作一种广义的化学反应——缔合 对于非离子型SAa, nS Sn 可以根据化学热力学的基本原理写出如下关系: △G0 = - RTlnK = RTlnCs – (1/n)lnCm 由于n>>1,在cmc以上的一段浓度范围内,可以忽 略第二项。 所以△Gm = △Gm0 – RTlnas 即:对于非离子型SAa,两种模型得出同样的结果
胶团热力学
• 质量作用模型的评价 合理性: 模型比相分离模型更接近实际体系的情况,用化学 平衡的方法解决问题,想法比较巧妙。 其表达的临界胶束浓度与反离子浓度的关系与从大 量实验中归纳出的相同,由此可见,质量作用模型 的预示性比较强。
局限性: 推导过程稍比相分离模型复杂。
胶团热力学
• 有了胶团标准自由能便可以方便计算出相应 的标准焓变和标准熵变。 • 在所有实验温度, △Gm0皆为负值,说明在 标准状态下此过程可以自动发生。 • 标准焓变的数值有正有负,所有的标准熵变 都是正值,所以-T△Sm0 为较大的负值。因 此胶团形成过程主要是熵驱动过程。
胶团热力学
• 对于离子型SAa(以正离子SAa为例) nS+ + kB- = (SnBk)(n-k)+ (其中,S为表面活性剂离子,B为反离子,(SnBk)为 胶束) 所以有K = am/(asn * abk) = F * Cm/(Csn*Cbk) 若溶液较稀,则F接近常数
△Gm0 = - RT/n * ln(F * Cm/(Csn * Cbk))
胶团形成的热力学与动力学
化学与分子工程学院05级 俞歌&于芳汀
The two of us!
于芳汀
俞歌
Outline
• 理论部分Leabharlann • 胶团热力学• 相分离模型 • 质量作用模型
• 胶团动力学
• 应用部分
• 胶团热力学 • 胶团动力学
Part one
理论部分
胶团热力学
• 胶团溶液 热力学平衡体系,研 究的关键是确定热力 学过程及其模型
单体进入胶团的速度随碳链的加长略有变慢 (扩散控制速度)
浓度增加使得速度过程变快
Part two
应用部分
热力学
• 热力学:由胶团形成标准自由能,可以计算出 相应的标准焓变和标准熵变。 • △Sm0 = -d△Gm0 /dT • △Hm0 = -T2d△Gm0 /dT • 热力学函数是胶团的性质之一;可以作为特定 胶团的表征手段。 • 在研究胶团的时候,可以根据形成热力学函数 的变化来研究胶团的行为。
热力学
• 通过测量γ,得到cmc,可以计算 热力学函数。然后通过函数的变 化趋势,得到SAa的性质。
热力学
• 一种Gemini SAa,其表面活性与连接基团的碳 链长度有关 • 通过测量γ,得到cmc,计算△Gm0 • 实验表明,s值大, △Gm0的负值小,因此胶团 更不稳定 • 与胶团表面分子排列有关
C11H23COOCH2CH2N(CH2)sNCH2CH2OOCC11H23 BrBr-
叶康,许虎君,王中才,包新颜,丁振军,刘晓亚,华东理工大学学报(自然科学版), 2006, 32(12), 1418
热力学
• 表面活性剂C16-MADS • 通过测量γ,得到cmc, 计算△Gm0 • 计算知△Hm0 <0 • 随着温度的上升,△Gm0 负值增大,说明△Sm0 >0 • 过程为熵驱动。
过程: 若干个表面活性分子 或离子结合成整体的 过程
图1胶团的结构
From 黄老师ppt
胶团热力学
• 相分离模型: 把胶团与溶液的平衡看作相平衡 对于非离子型的表面活性剂,胶团溶液中单体与聚 集体成平衡: nS Sn △Gm = △Gm0 – RTlnas (as是整个体系中SAa单体 的活度) △Gm0 = - RT/n * ln(amo/ason) 对于一组分胶团,其中表面活性剂分子活度为1,同 时假设溶液中单体浓度很低 所以有△Gm0 = RTlnCs = RTlncmc
