产甲烷菌的生态多样性
2022年锦州医科大学医疗学院食品科学与工程专业《微生物学》期末试卷B(有答案)

2022年锦州医科大学医疗学院食品科学与工程专业《微生物学》期末试卷B(有答案)一、填空题1、产甲烷细菌的细胞壁不含______,它属于______。
2、艾滋病全名为______,其病原体称为______,英文简写为______。
3、以一种______作氢供体,而以另一种______作氢受体而实现生物氧化产能的独特发酵类型,称为Stickland反应。
此反应的产能效率很______,每分子______仅产______ATP。
4、在配制异养微生物培养基时,常用的生长因子来源是______、______、______或______等。
5、真菌细胞壁的主要成分是______,另有少量的蛋白质和脂类。
低等真菌的细胞壁成分以______为主,酵母菌以______为主,而高等陆生真菌则以______为主。
6、在经典遗传学发展至分子遗传学过程中,有四种模式微生物发挥了重大作用,它们是① ______,② ______,③ ______,④ ______。
7、最常见的厌氧菌有① ______,② ______,③ ______,④ ______,⑤ ______,⑥ ______等。
8、根瘤菌的三种特性是指______、______和______。
9、线粒体的核糖体在大小上类似于原核生物的核糖体,线粒体与细菌之间的近缘关系,支持真核的细胞器(线粒体、叶绿体)是由______演化出来的假设。
10、决定传染结局的三大因素是______、______和______。
二、判断题11、固氮菌等的孢囊,除其形成方式与芽孢不同外,其功能(休眠、抗热性)与芽孢相同。
()12、病毒、类病毒和朊病毒因其是活细胞内寄生物,不能在人工培养基上培养,故属于难养菌。
()13、在肽聚糖的合成过程中,甲、乙两个肽尾间的交联是由转肽酶的转肽作用完成的。
()14、大肠杆菌噬菌体靠尾部的溶菌酶溶解寄主细胞壁后靠尾鞘收缩将DNA注入寄主细胞。
()15、真核微生物的“9+2”型鞭毛,指的是其鞭杆和基体的横切面都显示出外围有9个微管二联体,中央为2条中央微管。
基于mcrA基因的厌氧颗粒污泥产甲烷菌群分析_刘春

Analysis of Methanogenic Community of Anaerobic Granular Sludge Based on mcrA Gene
LIU Chun 1 ,LI Liang 1 ,MA Jun-ke 1 ,WU Gen 2 ,YANG Jing-liang 1
,而 且 多 数 研 究 都 是 基 于
16S rRNA 基因 . 有研究认为, 基 于 16S rRNA 基 因 的 PCR 引物对 产 甲 烷 菌 群 的 特 异 性 会 受 到 产 甲 烷 菌 群自身系统发育多样性的影响, 因而 mcrA 基因在产 甲烷菌群分析中逐渐受到关注
[ 14 , 15 ]
fish厌氧颗粒污泥是高效厌氧反应器稳定和高效运行的关键产甲烷菌群是厌氧颗粒污泥中的主要功能菌群uasb颗粒污泥中的产甲烷菌数量可达10目前现代分子生物学技术已经广泛应用于包括厌氧颗粒污泥在内的不同环境样品中的产甲烷16srrna基因
第 32 卷第 4 期 2011 年 4 月
环 境 科 学 ENVIRONMENTAL SCIENCE
厌氧颗粒污泥是高效厌氧反应器稳定和高效运 行的关键, 产甲烷菌 群 是 厌 氧 颗 粒 污 泥 中 的 主 要 功 UASB 颗 粒 污 泥 中 的 产 甲 烷 菌 数 量 可 达 能菌群, 10 9 / mL[1 ]. 目前, 现代分子生物学技术已经广泛应 用于包括厌氧颗粒污泥在内的不同环境样品中的产 甲烷 菌 群 分 析
.
本研究以阿维菌素废水处理工业化厌氧颗粒污 泥为研究对象, 以 mcrA 基因为 PCR 的 目 标 基 因, 利 用 变 性 梯 度 凝 胶 电 泳 ( denaturing gradient gel electrophoreses , DGGE ) 技 术, 对厌氧颗粒污泥中的 优势产 甲 烷 菌 群 的 系 统 发 育 进 行 了 分 析, 并基于 mcrA 基 因 利 用 荧 光 原 位 杂 交 ( fluorescence in situ hybridization , FISH ) 技 术 对 产 甲 烷 菌 群 进 行 了 原 位 分析 . 同 时, 对 基 于 mcrA 基 因 和 16S rRNA 基 因 的 PCR-DGGE 及 FISH 检测结果进行了比较分析 . 1 1. 1 材料与方法 污泥样品 本研究所用厌氧颗粒污泥样品取自河北石家庄 某阿维 菌 素 废 水 处 理 工 业 化 UASB 反 应 器 ( 500 m ), 其平均 VSS / SS 值为 0. 882. 1. 2 污泥样品总 DNA 提取 采用改进后的工业化废水处理反应器污泥样品 总 DNA 提取方法对厌氧颗粒污泥样品总 DNA 进行 提取
产甲烷菌

产甲烷菌胡俊英 222010328210116动医二班摘要:产甲烷菌(Methanogenus),是专性厌氧菌,属于古菌域,广域古菌界,宽广古生菌门。
1974年《伯杰氏细菌鉴定手册》(第八版)中将其归属于1科、3属、9种。
截至1992年已发展为3目、7科、19属、70种。
截至2009年已发展为4目、12科、31属。
1979年,Balch和Wolfe通过16S rRNA测序将产甲烷菌发展为3目(甲烷杆菌目、甲烷球菌目、甲烷微菌目)4科7属14种。
1993年,Boone将甲烷八叠球菌科上升为一个目,建立了火热产甲烷菌目,至此产甲烷菌发展为5目10科25属59种。
2001年,Bergey's Manual of Systematic Bacteriology将产甲烷菌放在宽广古生菌门(Euryarchaeota)中,至此产甲烷菌发展为3纲,5目,10科,26属,78种。
产甲烷菌属于古菌域(Archaea),广域古菌界(Euryarchaeon),宽广古生菌门(Euryarchaeota)。
关键词:产甲烷细菌,厌氧分离技术,产甲烷作用产甲烷菌(Methanogenus),是专性厌氧菌,属于古菌域,广域古菌界,宽广古生菌门。
1974年《伯杰氏细菌鉴定手册》(第八版)中将其归属于1科、3属、9种。
截至1992年已发展为3目、7科、19属、70种。
截至2009年已发展为4目、12科、31属。
1979年,Balch和Wolfe通过16S rRNA测序将产甲烷菌发展为3目(甲烷杆菌目、甲烷球菌目、甲烷微菌目)4科7属14种。
1993年,Boone将甲烷八叠球菌科上升为一个目,建立了火热产甲烷菌目,至此产甲烷菌发展为5目10科25属59种。
2001年,Bergey's Manual of Systematic Bacteriology将产甲烷菌放在宽广古生菌门(Euryarchaeota)中,至此产甲烷菌发展为3纲,5目,10科,26属,78种。
《微生物产甲烷原理》课件

pH值和温度
合适的pH值和温度能够维 持微生物活性,促进甲烷 发酵过程的稳定和高效。
微生物群落
微生物群落的构成和多样 性对甲烷生成有重要影响, 不同群落具有不同的代谢 能力和耐受性。
微生物产甲烷工艺的优缺点
1 优点
可将有机废弃物转化为有用能源,减少污染和碳排放,促进可持续发展。
2 缺点
工艺技术复杂,需要严格控制环境条件和微生物群落,成本较高且受限于底物类型。
微生物产甲烷应用与前景展望
生物气体生产
利用微生物产甲烷的原理,建 立生物气体生产系统,为能源 供应和替代燃料开辟新途径。
废弃物处理
将微生物产甲烷应用于废弃物 处理,实现废弃物资源化和减 少环境污染。
可持续发展
微生物产甲烷为可持续发展提 供了解决方案,减少了对传统 能源的依赖,推动绿色能源的 发展。
甲烷生成的生物反应
厌氧发酵
甲烷发酵
甲烷生成示意图
厌氧条件下,微生物通过发酵 过程产生甲烷,其中包括酸化、 乙酸生成和甲酸生成等重要生 物反应。
甲烷发酵是微生物利用有机废 弃物产生甲烷的过程,包括乙 酸、丙酸和氢气等底物的转化。
甲烷生成涉及多种微生物群落 和复杂反应路径,其中关键酶 的作用起着至关重要的作用。
微生物产甲烷原理
本课件介绍微生物产甲烷的原理,包括微生物概述、甲烷生成反应、厌氧消 化的工艺路线、甲烷发酵反应的控制因素、微生物产甲烷的优缺点以及应用 与前景展望。
微生物的分类和特点
分类
微生物包括细菌、真菌和病毒等多种类别,每种类别都在微观生物界有着不同的角色和功 能。
特点
微生物具有微小体积、高适应性、高繁殖率和广泛分布等特点,在自然界中起着重要的生 态作用。
2022年湖南农业大学东方科技学院食品科学与工程专业《微生物学》期末试卷A(有答案)

2022年湖南农业大学东方科技学院食品科学与工程专业《微生物学》期末试卷A(有答案)一、填空题1、细菌的鞭毛具有______功能,菌毛具有______功能,性菌毛具有______功能。
2、最大的病毒是直径为200nm的______;最小病毒之一是______,其直径仅为28nm。
3、硝酸盐在微生物生命活动中具有两种作用,其一是利用它作为氮源,这就是______;另一种是利用它作为呼吸链最终氢受体,这就是______,又称______或______。
这两个作用的共同点都需要一种含______的______酶将硝酸盐还原为亚硝酸盐。
4、放线菌为7.5~8.@5、酵母菌菌为3.8~6.@0、霉菌为4.0~5.@8、藻类为6.0~7.@0、原生动物为6.0~8.0。
@43、培养基按所含成分可分为______、______和______;按物理状态可分为______、______、______和______;按用途可分为______和______。
5、食用菌一般是指可食用的有大型______的高等真菌,分类上主要属于______,其次为______。
6、微生物学为现代生命科学提供的独特研究方法有:① ______,② ______,③ ______,④ ______,⑤ ______,⑥ ______,⑦ ______,⑧ ______和⑨ ______等。
7、利用加热和辐射的物理方法可以对______进行灭菌,______和______可用加热、辐射和过滤进行消毒和灭菌。
8、植物根际微生物对植物有害的方面有______和______等。
9、质粒通常以共价闭合环状的超螺旋双链DNA分子存在于细胞中,但从细胞中分离的质粒大多是3种构型,即______型、______型和______ 型。
10、当前已开发的新型疫苗有______、______、______、______、______和______等。
二、判断题11、菌落边缘细胞的菌龄比菌落中心的细胞菌龄长。
2022年江苏大学京江学院食品科学与工程专业《微生物学》期末试卷A(有答案)

2022年江苏大学京江学院食品科学与工程专业《微生物学》期末试卷A(有答案)一、填空题1、不同的放线菌有不同的典型形态,如______属的基内菌丝会断裂成大量的杆菌状体,______属等可在菌丝顶端形成少量孢子,______属具有孢囊并可产生孢囊孢子,而______属则具有孢囊,但产生的是游动孢子等。
2、植物病毒一般可引起宿主植物三类明显的症状:① ______;② ______;③ ______。
3、根据受氢体性质不同,可把生物氧化分为______、______和______ 三种类型。
4、碳源对微生物的功能是______和______,微生物可用的碳源物质主要有______、______、______、______、______和______等。
5、酵母菌的无性繁殖方式主要有______和______。
6、原生动物是______色、无______,能______运动的单细胞真核生物。
7、最常见的厌氧菌有① ______,② ______,③ ______,④ ______,⑤ ______,⑥ ______等。
8、一般来说,在土壤中,各种微生物含量按递减顺序排列如下:______、______、______、______、______和______。
9、Avery和他的合作者分别用降解DNA、RNA和蛋白质的酶作用于有毒的S型细胞抽提物,然后分别与______混合,结果发现,只有DNA被酶解而遭到破坏的抽提物无转化活性,说明DNA是转化所必须的转化因子。
10、外毒素的种类很多,常见的如______、______、______和______ 等。
二、判断题11、因支原体的细胞大小接近病毒,故具有滤过性。
()12、用分装器将培养基分装试管时,应谨防培养基沾染试管口。
()13、原核生物呼吸链的P/O比一般较真核生物高。
()14、在昆虫颗粒体病毒的每一个蛋白质包含体中,都包裹着数量很多的杆状病毒体。
反刍动物瘤胃甲烷生成相关研究进展

动物营养学报2020,32(11):5013⁃5022ChineseJournalofAnimalNutrition㊀doi:10.3969/j.issn.1006⁃267x.2020.11.005反刍动物瘤胃甲烷生成相关研究进展王㊀坤1㊀南雪梅1㊀熊本海1∗㊀蒋林树2(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京100193;2.北京农学院奶牛营养学北京市重点实验室,北京102206)摘㊀要:反刍动物能将人类不能直接利用的纤维性植物原料转化成肉和奶等优质的畜产品,然而反刍动物每年向环境中排放甲烷约1亿t,不但加剧全球温室效应,而且降低饲料利用率㊂本文详细综述了近年来瘤胃甲烷生成机制㊁瘤胃甲烷生成相关微生物㊁瘤胃甲烷测定方法及瘤胃甲烷排放调控措施等方面的相关研究进展,以期为调控反刍动物瘤胃甲烷排放研究提供参考㊂关键词:反刍动物;瘤胃;甲烷生成;产甲烷古菌中图分类号:S811.6㊀㊀㊀㊀文献标识码:A㊀㊀㊀㊀文章编号:1006⁃267X(2020)11⁃5013⁃10收稿日期:2020-03-30基金项目:国家 十三五 重大专项课题(2017YFD0701604)作者简介:王㊀坤(1990 ),男,山东烟台人,博士研究生,研究方向为反刍动物营养与饲料科学㊂E⁃mail:cang327@163.com∗通信作者:熊本海,研究员,博士生导师,E⁃mail:xiongbenhai@caas.cn㊀㊀反刍动物能将人类不能直接利用的纤维性植物原料转化成肉和奶等优质的畜产品,对人类社会发展具有重要意义㊂随着世界人口的增长以及居民生活水平的提高,人类社会对优质畜产品的需求越来越多,反刍动物生产的重要性也越来越大㊂然而,反刍动物在消化植物纤维的同时会向环境中排放甲烷等温室气体,反刍动物每年向环境中排放甲烷约1亿t,约占全球每年甲烷排放总量的20%[1]㊂甲烷的温室效应约为二氧化碳的25倍,反刍动物生产对环境的影响引起了越来越多的关注,各国科学家围绕反刍动物瘤胃甲烷排放展开了大量研究,通过适当的措施调控反刍动物瘤胃甲烷排放具有重要意义㊂1 甲烷生成机制㊀㊀甲烷生成通常被认为是产甲烷古菌在严格厌氧的条件下独有的生命现象㊂但有研究报道,除产甲烷古菌外,蓝藻细菌和真核生物也具有产生甲烷的能力,甚至可以在有氧的情况下产生甲烷[2-4]㊂产甲烷古菌是一种生态多样性的微生物,广泛存在于多种陆生及水生厌氧环境中,包括湿地㊁海洋沉积物㊁淡水沉积物以及动物胃肠道等㊂甲烷是产甲烷菌厌氧呼吸的终产物[5],作为主要的甲烷产生源头,大气中70%的甲烷是由产甲烷菌产生的[6]㊂㊀㊀甲烷生成是生物质厌氧降解的终端过程,通常发生在氧㊁硝酸盐㊁Fe3+及硫酸盐等末端电子受体不足或快速耗尽的环境中[5-6]㊂甲烷生成的底物主要有二氧化碳㊁乙酸盐和甲基化合物㊂根据反应底物的不同,甲烷生成可分为3条途径:二氧化碳还原途径㊁解乙酸途径和甲基营养途径㊂3条途径的最后1步反应均为甲基辅酶M被甲基辅酶M还原酶还原生成甲烷㊂氢气是二氧化碳还原途径的主要电子供体,因此该途径也被称为氢营养途径,此外,甲酸㊁甲醇及一氧化碳也可作为该途径的电子供体[5]㊂氢营养途径是最常见的甲烷生成途径,甲烷杆菌目(Methanobacteriales)㊁甲烷球菌目(Methanococcales)㊁甲烷微菌目(Methanomi⁃crobiales)㊁甲烷八叠球菌目(Methanosarcinales)㊁甲烷火菌目(Methanopyrales)及甲烷胞菌目(Methanocellales)的产甲烷菌均可通过该途径生成甲烷㊂在解乙酸途径中,乙酸裂解为羧基和甲基,羧基被氧化为二氧化碳,甲基被还原为甲烷㊂作为最不常见的途径,仅存在于Methanosarcina⁃㊀动㊀物㊀营㊀养㊀学㊀报32卷les,但由解乙酸途径生成的甲烷约占全球生物甲烷总量的2/3[5]㊂在甲基营养途径中,甲醇㊁甲胺及甲基硫化物等甲基化合物的甲基团传递给辅酶M,生成的甲基辅酶M最终被甲基辅酶M还原酶还原生成甲烷㊂对于常见的甲基营养型甲烷菌(主要来自Methanosarcinales),甲基还原所需的电子是通过额外的甲基被氧化成二氧化碳得到,但是Methanomicrococcusblatticola和Methanospha⁃era的甲基营养型甲烷菌以氢气作为电子供体[5-7]㊂最近研究发现,Methanomassiliicoccales的甲烷菌也以氢气作为电子供体,其甲烷生成途径属于氢气依赖型甲基营养途径[8]㊂甲基营养型甲烷菌主要存在于海洋沉积物中,以及动物胃肠道和一些极端环境中[5]㊂2㊀反刍动物瘤胃甲烷生成㊀㊀反刍动物瘤胃微生物发酵碳水化合物产生甲烷,不但加剧全球温室效应,而且降低饲料利用率㊂反刍动物以甲烷形式所损失的能量占饲料总能的2% 12%[9]㊂研究人员围绕甲烷生成及其调控措施展开了大量研究,然而瘤胃微生物发酵碳水化合物生成挥发性脂肪酸的过程部分依赖于可排出代谢氢的甲烷生成过程,因此单纯抑制瘤胃甲烷生成的调控措施往往不能起到长期调控的目的[10-11]㊂产乙酸作用和丙酸生成等一些瘤胃内可与甲烷生成途径竞争代谢氢的内在代谢过程,在瘤胃甲烷调控方面的潜在作用越来越多的引起了公众的关注[12-13]㊂一方面,这些代谢过程通过与甲烷生成途径竞争代谢氢来抑制甲烷生成,不会因为瘤胃中的氢无法被及时排出而影响发酵;另一方面,乙酸和作为瘤胃葡萄糖前体物的丙酸均为反刍动物的能量来源物质,通过增加乙酸和丙酸的产量来竞争性抑制瘤胃甲烷生成可提高饲料能量的利用率㊂㊀㊀碳水化合物是反刍动物主要的能量来源,纤维素㊁半纤维素和淀粉等多糖首先在瘤胃内水解为葡萄糖等单糖㊂各种单糖在瘤胃微生物的作用下进一步代谢为挥发性脂肪酸㊁二氧化碳及氢气㊂氢气是瘤胃发酵过程中重要的中间产物,在葡萄糖分解为丙酮酸以及丙酮酸氧化脱羧生成乙酰辅酶A的过程中产生(图1)㊂为了保证瘤胃发酵的正常进行,产生的氢气需要被及时从瘤胃排出[10]㊂甲烷生成是瘤胃主要的排出氢气的途径,细菌㊁原虫以及真菌产生的氢气被传递给产甲烷古菌通过氢营养途径还原二氧化碳生成甲烷㊂瘤胃产甲烷古菌在数量和多样性上不如瘤胃细菌丰富,且在全世界范围内的反刍动物中高度保守[14]㊂Hen⁃derson等[14]对来自35个国家的瘤胃和前肠样品(379头牛㊁106头绵羊㊁59头鹿㊁52头山羊和72头其他物种)的微生物群落组成进行了全面的全球普查㊂研究发现,尽管样品的来源千差万别,但主要的古菌群体却惊人地相似㊂Methanobrevi⁃bactergottschalkii和Methanobrevibacterruminanti⁃um出现在所有样品中,且占比高达74%㊂Metha⁃nosphaera和Methanomassiliicoccaceae的2个古菌群体占比也比较高,这5个主要的产甲烷古菌群体约占整个古菌群落的90%㊂瘤胃中大约78%的产甲烷古菌通过氢营养途径产生甲烷,22%的产甲烷古菌通过甲基营养途径产生甲烷,解乙酸途径在瘤胃中较为少见[15]㊂甲烷短杆菌(Methanobre⁃vibacter)是瘤胃中主要氢营养型甲烷菌[16],Meth⁃anosphaera㊁Methanimicrococcus和甲烷细菌属(Methanobacterium)也是瘤胃中重要氢营养型甲烷菌属[13]㊂瘤胃中的甲基营养型甲烷菌主要包括Methanosarcinales㊁Methanosphaera和Methanomas⁃siliicoccaceae[5]㊂㊀㊀除甲烷生成外,瘤胃中的丙酸生成过程以及由氢气和二氧化碳生成乙酸的过程都可消耗氢气㊂硝酸盐和硫酸盐等一些无机盐也可作为电子受体消耗氢气,但是这些物质在瘤胃中的含量通常不多[17-19],而且含量过多可能会增加反刍动物中毒的风险[20]㊂3㊀反刍动物瘤胃甲烷生成相关微生物㊀㊀瘤胃甲烷的生成是瘤胃内各种微生物共同作用的结果,产甲烷古菌是直接的甲烷产生微生物,而原虫㊁细菌及真菌等其他微生物也在瘤胃甲烷生成过程中发挥着重要作用㊂㊀㊀瘤胃原虫根据其结构和活性不同,主要有2种类型:Holotrich原虫,具有完全被纤毛覆盖的柔性表膜,主要消化可溶性底物;Entodiniomorphid原虫,具有坚硬的表膜,纤毛仅位于口部附近区域,能够消化微粒状物质[22]㊂尽管瘤胃原虫不能产生甲烷,但其可通过自身的氢化酶产生大量氢气供氢营养型产甲烷古菌使用,因此在瘤胃甲烷生成中发挥重要作用㊂此外,原虫的表面和体内附着410511期王㊀坤等:反刍动物瘤胃甲烷生成相关研究进展以及寄生有产甲烷古菌,这种共生关系也使原虫成为瘤胃甲烷生成重要的参与者[22]㊂Methano⁃brevibacter和Methanomicrobium被认为是最主要的2个与原虫具有共生关系的产甲烷古菌属[23-24]㊂尽管原虫在瘤胃中普遍存在,但原虫对于瘤胃并不重要,且驱除原虫可以降低9% 37%的甲烷排放[25-26]㊂然而,也有一些研究表明,驱除原虫对瘤胃甲烷产生的影响并不明显[27-28]㊂Newbold等[29]通过Meta分析研究发现,通过驱除原虫平均可降低11%的甲烷产量,然而产甲烷古菌的丰度并没有显著降低㊂图1 瘤胃发酵及甲烷生成途径Fig.1㊀Rumenfermentationandpathwaysofmethanogenesis[13,19,21]㊀㊀同原虫类似,真菌通过产生大量氢气参与瘤胃甲烷生成,此外真菌发酵也可产生二氧化碳㊁甲酸和乙酸等代谢终产物[30]㊂目前已知的瘤胃中的真菌属有6个,Neocallimastix㊁Caecomyces㊁Piromy⁃ces㊁Anaeromyces㊁Orpinomyces和Cyllamyces[31]㊂一些产甲烷古菌可能也与真菌有共生关系,然而这种关系并没有得到证实[32]㊂由于真菌能产生氢气,通常认为真菌的丰度可能与甲烷生成有关,但Kittelmann等[33]研究发现,绵羊瘤胃甲烷排放与真菌群落结构没有相关性㊂Newbold等[29]通过Meta分析研究发现,驱除原虫虽然对产甲烷古菌的丰度没有影响,但降低了真菌的丰度,而真菌丰度的降低是否与甲烷产量的降低有关尚不清楚㊂㊀㊀细菌是瘤胃内最多样化的微生物类群,能分解纤维㊁淀粉㊁蛋白质和糖等多种物质,瘤胃中最丰富的3个细菌门是厚壁菌门(Firmicutes)㊁拟杆菌门(Bacteroidetes)和变形菌门(Proteobacte⁃ria)[14]㊂属于Firmicutes的纤维分解菌瘤胃球菌属(Ruminococcus)和优杆菌属(Eubacterium)能够产生氢气,纤维杆菌属(Fibrobacter)不产生氢气,而Bacteroidetes是纯粹的氢气消耗菌[34]㊂Kittel⁃mann等[33]通过分析236份来自于118头不同甲烷排放量绵羊的瘤胃液样品,发现瘤胃微生物的群落结构与绵羊甲烷排放水平相关㊂一种类型的低甲烷排放量绵羊瘤胃中具有较高含量的丙酸生成菌Quinellaovalis;另一种类型的低甲烷排放量绵羊瘤胃中具有较高含量的乳酸和琥珀酸生成菌,包括Fibrobacterspp.㊁Kandleriavitulina㊁Olsenellaspp.㊁Prevotellabryantii和Sharpeaaza⁃buensis;高甲烷排放量绵羊的瘤胃中具有较高含量属于瘤胃球菌属(Ruminococcus)的一些菌种,以及瘤胃球菌科(Ruminococcaceae)㊁毛螺旋菌科(Lachnospiraceae)㊁Catabacteriaceae㊁粪球菌属(Coprococcus)和普雷沃菌属(Prevotella)等㊂Danielsson等[35]和Wallace等[36]均研究发现,高甲烷排放动物个体的瘤胃中Proteobacteria的含量较少㊂琥珀酸弧菌科(Succinivibrionaceae)是Pro⁃teobacteria的优势科,有研究发现肠道中较高含量5105㊀动㊀物㊀营㊀养㊀学㊀报32卷的Succinivibrionaceae是导致Tammar袋鼠相比反刍动物甲烷生成效率低的原因[37]㊂Prevotella是一种多功能的菌属,该属的部分菌种在高甲烷排放个体中含量较高,而部分菌种又在低甲烷排放个体中含量较高[16,35]㊂通常情况下,高甲烷排放的动物个体肠道中有更多的氢气产生菌,而低甲烷排放的动物个体肠道中有更多的氢气消耗菌㊂4㊀反刍动物瘤胃甲烷测定方法㊀㊀准确测定反刍动物甲烷排放量对于研究甲烷生成机制及其减排措施具有重要意义㊂呼吸舱法以其高的准确性及可重复性被认为是甲烷测定的 金标 方法,但由于其成本高㊁技术要求严格且对动物应激较大,因此限制了该方法的广泛使用[38]㊂六氟化硫示踪法相比于呼吸舱法,可直接在生产条件下对动物的甲烷排放进行测定,但该方法的准确性受当地天气变化影响较大且存在残留问题,因此该方法的广泛使用亦受到限制[39]㊂此外,直接测定法还包括头箱法㊁面罩法㊁便携式收集舱法㊁甲烷/二氧化碳比例法㊁GreenFeed体系法㊁嗅探器法㊁甲烷激光探测器等短期测定方法,以及适用于大群体测定的塑料大棚法和微气象法[40]㊂直接测定法虽然设备成本高㊁技术要求苛刻且操作难度大,但直接测定法是研究甲烷排放的基础方法,是其他方法参考和对比的标准㊂㊀㊀间接测定甲烷产量的方法主要有体外法和统计模型法㊂体外法通过模拟体内瘤胃环境来研究气体生成,故而其影响因素较多[41]㊂统计模型法通常根据营养物质或能量摄入量建立线性或非线性模型估测甲烷排放量,实用性强㊂国家水平以及全球水平甲烷排放量的测定均采用统计模型法估测[40]㊂随着技术水平的不断改进,模型法预测的准确性越来越高,并且发展了针对不同种类反刍动物的专用模型(表1)㊂此外,间接测定法还包括根据乳中特定脂肪酸的浓度预测甲烷产量的方法以及乳中红外光谱法[42]㊂统计模型法是一种非常有效的甲烷估测方法,但代表性强的统计模型需要以直接测定法为基础㊂表1㊀甲烷产量预测模型Table1㊀ModelsusedtopredictCH4production动物Animals方程式EquationRMSER2RMSPE/%绵羊Sheep[20]方程1Eq.1CH4(MJ/d)=0.208(ʃ0.040)+0.049(ʃ0.0039)ˑGEI(MJ/d)0.240.8622.7方程2Eq.2CH4(MJ/d)=0.550(ʃ0.172)+1.299(ʃ0.126)ˑDMI(kg/d)-0.266(ʃ0.053)ˑFL-0.00093(ʃ0.00042)ˑNDF(g/kg)0.220.9222.4方程3Eq.3CH4(MJ/d)=-0.784(ʃ0.269)+0.138(ʃ0.0084)ˑME(MJ/d)-0.378(ʃ0.062)ˑFL+0.00294(ʃ0.00046)ˑOMDm(g/kg)-1.943(ʃ0.381)ˑmetabolizability0.210.9424.5方程4Eq.4CH4(MJ/d)=5.699(ʃ1.94)-[5.699(ʃ1.94)-0.133(ʃ0.047)]ˑexp[-0.021(ʃ0.0071)ˑME(MJ/d)]0.140.9120.7山羊Goat[43]方程5Eq.5CH4(MJ/d)=0.242(ʃ0.073)+0.0511(ʃ0.0073)ˑDEI(MJ/d)0.310.8330.3方程6Eq.6CH4(MJ/d)=-1.042(ʃ0.271)+2.205(ʃ0.395)ˑNDFI(kg/d)-2.417(ʃ1.102)ˑEEI(kg/d)+1.456(ʃ0.323)ˑNFC(kg/d)+0.0208(ʃ0.0039)ˑOMDm(g/kg)-0.513(ʃ0.137)ˑFL0.140.8230.3方程7Eq.7CH4(MJ/d)=0.885(ʃ0.154)+0.809(ʃ0.0867)ˑDMI(kg/d)-0.397(ʃ0.0494)ˑFL+0.0198(ʃ0.0022)ˑOMDm(g/kg)+2.04(ʃ0.234)ˑADFI(kg/d)-8.54(ʃ0.548)ˑEEI(kg/d)0.240.8836.6方程8Eq.8CH4(MJ/d)=1.721(ʃ0.151)ˑ{1-exp[-0.0721(ʃ0.0092)ˑMEI(MJ/d)]}0.170.7938.0水牛Buffalo[44]方程9Eq.9CH4(MJ/d)=1.29(ʃ0.576)+0.788(ʃ0.099)ˑDMI(kg/d)0.8119.4610511期王㊀坤等:反刍动物瘤胃甲烷生成相关研究进展续表1动物Animals方程式EquationRMSER2RMSPE/%方程10Eq.10CH4(MJ/d)=-0.436(ʃ0.665)+0.678(ʃ0.184)ˑDMI(kg/d)+0.697(ʃ0.347)ˑNDFI(kg/d)0.8516.1方程11Eq.11CH4(MJ/d)=21.71(ʃ3.84)-[21.71(ʃ3.84)-0.732(ʃ0.637)]-exp[-0.0485(ʃ0.0094)ˑDMI(kg/d)]0.7921.2牛Cattle[45]方程12Eq.12CH4(MJ/d)=9.311(ʃ1.060)+0.042(ʃ0.001)ˑGEI(MJ/d)+0.094(ʃ0.014)ˑNDF(%)-0.381(ʃ0.092)ˑEE(%)+0.008(ʃ0.001)ˑBW(kg)+1.621(ʃ0.119)ˑMF(%)2.59 15.6方程13Eq.13CH4(MJ/d)=2.880(ʃ0.200)+0.053(ʃ0.001)ˑGEI(MJ/d)-0.190(ʃ0.049)ˑEE(%)1.29 14.4方程14Eq.14CH4(MJ/d)=1.487(ʃ0.318)+0.046(ʃ0.001)ˑGEI(MJ/d)+0.032(ʃ0.005)ˑNDF(%)+0.006(ʃ0.0007)ˑBW(kg)1.23 18.6方程15Eq.15CH4(MJ/d)=0.221(ʃ0.151)+0.048(ʃ0.001)ˑGEI(MJ/d)+0.005(ʃ0.0005)ˑBW(kg)0.9215.1热带牛Tropicalcattle[46]方程16Eq.16CH4(MJ/d)=1.29(ʃ0.906)+0.878(ʃ0.125)ˑDMI(kg/d)5.490.7031.0方程17Eq.17CH4(MJ/d)=0.910(ʃ0.746)+1.472(ʃ0.154)ˑDMI(kg/d)-1.388(ʃ0.451)ˑFL-0.669(ʃ0.338)ˑADFI(kg/d)4.220.8422.2方程18Eq.18CH4(MJ/d)=71.47(ʃ22.14)ˑ[1-exp(-0.0156(ʃ0.0051)ˑDMI(kg/d))]3.560.8330.3㊀㊀GEI:总能采食量grossenergyintake;DEI:消化能采食量digestibleenergyintake;DMI:干物质采食量drymatterintake;NDF(I):中性洗涤纤维含量或采食量neutraldetergentfibercontentorintake;FL:饲喂水平feedinglevel;ADFI:酸性洗涤纤维采食量aciddetergentfiberintake;MEI:代谢能采食量metabolizableenergyintake;EE(I):粗脂肪含量或采食量etherex⁃tractcontentorintake;NFCI:非纤维性碳水化合物采食量non⁃fibercarbohydrateintake;OMDm:采食维持水平有机物消化率organicmatterdigestibilityatmaintenanceleveloffeedintake;MF:乳脂肪含量milkfatcontent;BW:体重bodyweight;RMSE:均方根误差rootmeanssquareerror;RMSPE:均方根预测误差rootmeansquarepredictionerror㊂5 反刍动物瘤胃甲烷排放调控措施㊀㊀瘤胃甲烷产量受动物个体㊁饲粮组成㊁瘤胃发酵模式㊁瘤胃微生物组成及活性等多种因素影响㊂研究人员围绕反刍动物瘤胃甲烷调控展开了大量研究,主要的调控措施包括:调整饲粮结构,改变瘤胃发酵模式;使用甲烷抑制剂,抑制甲烷生成途径及甲烷生成相关微生物活性;增加其他电子受体,竞争性抑制甲烷产生㊂此外,提高动物的生长性能,优化畜群结构减少非生产动物的数量,以及选育低甲烷排放品种等也是调控瘤胃甲烷排放的有效措施(图2)㊂通常情况下,不同调控措施之间可相互影响,共同发挥调控作用㊂㊀㊀调整饲粮结构,改善瘤胃发酵模式和瘤胃微生物组成及活性进而调控瘤胃甲烷排放㊂饲粮组成对瘤胃甲烷生成具有重要影响㊂随饲粮精料比例的增加,瘤胃中乙酸比例降低,丙酸比例升高,瘤胃发酵模式以丙酸型发酵为主,而丙酸是瘤胃中仅次于甲烷的氢利用物质,可竞争性抑制瘤胃甲烷产生[10]㊂高精料饲粮会降低瘤胃pH,抑制产甲烷古菌及原虫活性进而降低甲烷产量[47]㊂然而,增加饲粮精料比例不但增加了饲养成本,而且易引起亚急性或急性瘤胃酸中毒㊁蹄叶炎等营养代谢病㊂Meale等[48]通过体外法研究发现,墨西哥丁香(Gliricidiasepium)和臂形草(Brachiariaruziziensis)具有降低甲烷排放的潜力㊂Machado等[49]通过体外法研究了多种海藻类植物发现,钥形毛藻(Asparagopsis)和鞘藻(Oedogonium)具有显著降低甲烷排放的作用㊂Wang等[12]研究发现,增加饲粮中非粗料来源纤维的含量,有降低体外甲烷产量的趋势,并增加了发酵液中丙酸的比例㊂因此,开发利用新型优质饲料比单纯增加饲粮精料水平更有应用前景㊂㊀㊀使用甲烷抑制剂,抑制甲烷生成途径及甲烷7105㊀动㊀物㊀营㊀养㊀学㊀报32卷生成相关微生物活性㊂甲烷抑制剂主要包括植物次级代谢物㊁脂类㊁卤代物㊁离子载体及硝基物等㊂单宁等植物次级代谢物一方面可抑制产甲烷古菌活性抑制甲烷生成,另一方面可减少原虫数量抑制甲烷生成[50]㊂脂类可通过抑制产甲烷古菌活性抑制甲烷生成,且不饱和脂肪酸还可通过生物氢化作用竞争性抑制甲烷生成[51]㊂卤代物和离子载体对甲烷的抑制作用主要是通过毒害产甲烷古菌直接降低甲烷产量[52-53]㊂离子载体还可刺激产琥珀酸菌和丙酸菌生长,通过增加丙酸产量从而竞争性抑制甲烷生成[40]㊂3-硝基丙醇可在不损害动物生产性能和健康的情况下持续降低甲烷产量并增加丙酸产量[54],被认为是目前最有潜力及应用价值的甲烷抑制剂㊂此外,科学家通过免疫法使用产甲烷古菌疫苗抑制瘤胃甲烷产生[55],但由于大部分瘤胃产甲烷菌无法纯培养,因而利用纯培养产甲烷古菌开发的疫苗可能导致瘤胃未培养产甲烷菌数量增加㊂甲烷抑制剂普遍存在成本高㊁毒副作用及生物残留等诸多弊端,且抑制剂可使产甲烷古菌产生抗性,因此甲烷抑制剂长期作用效果有待观察㊂图2㊀反刍动物瘤胃甲烷排放调控措施Fig.2㊀StrategiestomitigateCH4emissioninrumen[40]㊀㊀增加其他电子受体,竞争性抑制甲烷生成㊂硝酸盐在瘤胃中对氢的亲和力大于二氧化碳,可通过与产甲烷古菌竞争氢进而减少瘤胃甲烷生成[49],硝酸盐自身被还原为亚硝酸盐,进一步生成氨㊂Lee等[56]研究发现,饲粮中添加硝酸盐能降低肉牛12%的甲烷排放㊂VanZijderveld等[57]在奶牛饲粮中添加硝酸盐,降低了16%的甲烷排放㊂硝酸盐和亚硝酸盐具有一定的毒性,饲喂硝酸盐会增加其在组织和奶中的残留[58-59]㊂此外,饲粮中添加延胡索酸和苹果酸等丙酸前体物,可通过增加丙酸生成竞争性抑制甲烷生成[60]㊂6㊀小㊀结㊀㊀消耗氢气生成甲烷从而促进碳水化合物的降解吸收是反刍动物在物种进化过程中形成的正常生理机制,各种直接抑制甲烷生成的调控措施在瘤胃微生物复杂的自我调节下很难长期发挥作用㊂丙酸生成是瘤胃内可与甲烷生成途径竞争代谢氢的内在代谢过程,通过竞争性抑制甲烷产生从而增加丙酸产量,不会因为瘤胃中的氢无法被及时排出而影响发酵,同时作为瘤胃葡萄糖前体物的丙酸是反刍动物重要的能量来源物质㊂因此,竞争性抑制甲烷生成,在调控甲烷生成的同时提高饲料能量利用率是一种具有应用前景的甲烷调控模式㊂810511期王㊀坤等:反刍动物瘤胃甲烷生成相关研究进展参考文献:[1]㊀CONRADR.Theglobalmethanecycle:recentad⁃vancesinunderstandingthemicrobialprocessesin⁃volved[J].EnvironmentalMicrobiologyReports,2009,1(5):285-292.[2]㊀LENHARTK,BUNGEM,RATERINGS,etal.Evi⁃denceformethaneproductionbysaprotrophicfungi[J].NatureCommunications,2012,3:1046.[3]㊀LIUJG,CHENH,ZHUQA,etal.Anovelpathwayofdirectmethaneproductionandemissionbyeu⁃karyotesincludingplants,animalsandfungi:anover⁃view[J].AtmosphericEnvironment,2015,115:26-35.[4]㊀BIZ㊅ICᶄM,KLINTZSCHT,IONESCUD,etal.Cya⁃nobacteria,themostancientandabundantphotoau⁃totrophsonearthproducethegreenhousegasmethaneduringphotosynthesis[J].BioRxiv,2019:398958.[5]㊀LIUYC,WHITMANWB.Metabolic,phylogenetic,andecologicaldiversityofthemethanogenicarchaea[J].AnnalsoftheNewYorkAcademyofSciences,,2008,1125(1):171-189.[6]㊀LYUZ,SHAONN,AKINYEMIT,etal.Methano⁃genesis[J].CurrentBiology,2018,28(13):R727-R732.[7]㊀THAUERRK,KASTERAK,SEEDORFH,etal.Methanogenicarchaea:ecologicallyrelevantdiffer⁃encesinenergyconservation[J].NatureReviewsMi⁃crobiology,2008,6(8):579-591.[8]㊀SÖLLINGERA,URICHT.Methylotrophicmethano⁃genseverywhere⁃physiologyandecologyofnovelplayersinglobalmethanecycling[J].BiochemicalSo⁃cietyTransaction,2019,47(6):1895-1907.[9]㊀JOHNSONKA,JOHNSONDE.Methaneemissionsfromcattle[J].JournalofAnimalScience,1995,73(8):2483-2492.[10]㊀MCALLISTERTA,NEWBOLDCJ.Redirectingru⁃menfermentationtoreducemethanogenesis[J].Aus⁃tralianJournalofExperimentalAgriculture,2008,48(2):7-13.[11]㊀DENMANSE,FERNANDEZGM,SHINKAIT,etal.Metagenomicanalysisoftherumenmicrobialcom⁃munityfollowinginhibitionofmethaneformationbyahalogenatedmethaneanalog[J].FrontiersinMicrobi⁃ology,2015,6:1087.[12]㊀WANGK,NANXM,CHUKK,etal.Shiftsofhy⁃drogenmetabolismfrommethanogenesistopropionateproductioninresponsetoreplacementofforagefiberwithnon⁃foragefibersourcesindietsinvitro[J].FrontiersinMicrobiology,2018,9:2764.[13]㊀LANW,YANGCL.Ruminalmethaneproduction:associatedmicroorganismsandthepotentialofapply⁃inghydrogen⁃utilizingbacteriaformitigation[J].Sci⁃enceoftheTotalEnvironment,2019,654:1270-1283.[14]㊀HENDERSONG,COXF,GANESHS,etal.Rumenmicrobialcommunitycompositionvarieswithdietandhost,butacoremicrobiomeisfoundacrossawidege⁃ographicalrange[J].ScientificReports,2015,5:14567.[15]㊀SESHADRIR,LEAHYSC,ATTWOODGT,etal.CultivationandsequencingofrumenmicrobiomemembersfromtheHungate1000collection[J].NatureBiotechnology,2018,36(4):359-367.[16]㊀KITTELMANNS,SEEDORFH,WALTERSWA,etal.Simultaneousampliconsequencingtoexploreco⁃occurrencepatternsofbacterial,archaealandeukaryot⁃icmicroorganismsinrumenmicrobialcommunities[J].PLoSOne,2013,8(2):e47879.[17]㊀NEWBOLDCJ,LÓPEZS,NELSONN,etal.Propio⁃nateprecursorsandothermetabolicintermediatesaspossiblealternativeelectronacceptorstomethanogene⁃sisinruminalfermentationinvitro[J].BritishJournalofNutrition,2005,94(1):27-35.[18]㊀VANZIJDERVELDSM,GERRITSWJJ,APA⁃JALAHTIJA,etal.Nitrateandsulfate:effectivealter⁃nativehydrogensinksformitigationofruminalmeth⁃aneproductioninsheep[J].JournalofDairyScience,2010,93(12):5856-5866.[19]㊀BEAUCHEMINKA,UNGERFELDEM,ECKARDRJ,etal.Review:fiftyyearsofresearchonrumenmethanogenesis:lessonslearnedandfuturechallengesformitigation[J].Animal,2020,14(Suppl.1):S2-S16.[20]㊀PATRAAK.Predictionofentericmethaneemissionfrombuffaloesusingstatisticalmodels[J].Agricul⁃ture,Ecosystems&Environment,2014,195:139-148.[21]㊀SHIWB,MOONCD,LEAHYSC,etal.Methaneyieldphenotypeslinkedtodifferentialgeneexpressioninthesheeprumenmicrobiome[J].GenomeRe⁃search,2014,24(9):1517-1525.[22]㊀BELANCHEA,DELAFUENTEG,NEWBOLDCJ.Studyofmethanogencommunitiesassociatedwithdifferentrumenprotozoalpopulations[J].FEMSMi⁃9105㊀动㊀物㊀营㊀养㊀学㊀报32卷crobiologyEcology,2014,90(3):663-677.[23]㊀JANSSENPH,KIRSM.Structureofthearchaealcommunityoftherumen[J].AppliedandEnviron⁃mentalMicrobiology,2008,74(12):3619-3625.[24]㊀PATRAA,PARKT,KIMM,etal.Rumenmethano⁃gensandmitigationofmethaneemissionbyanti⁃meth⁃anogeniccompoundsandsubstances[J].JournalofAnimalScienceandBiotechnology,2017,8:13.[25]㊀HOOKSE,WRIGHTADG,MCBRIDEBW.Meth⁃anogens:methaneproducersoftherumenandmitiga⁃tionstrategies[J].Archaea,2010,2010:945785.[26]㊀MORGAVIDP,FORANOE,MARTINC,etal.Mi⁃crobialecosystemandmethanogenesisinruminants[J].Animal,2010,4(7):1024-1036.[27]㊀HEGARTYRS,BIRDSH,VANSELOWBA,etal.Effectsoftheabsenceofprotozoafrombirthorfromweaningonthegrowthandmethaneproductionoflambs[J].BritishJournalofNutrition,2008,100(6):1220-1227.[28]㊀BIRDSH,HEGARTYRS,WOODGATER.Persist⁃enceofdefaunationeffectsondigestionandmethaneproductioninewes[J].AustralianJournalofExperi⁃mentalAgriculture,2008,48(2):152-155.[29]㊀NEWBOLDCJ,DELAFUENTEG,BELANCHEA,etal.Theroleofciliateprotozoaintherumen[J].FrontiersinMicrobiology,2015,6:1313.[30]㊀GRUNINGERRJ,PUNIYAAK,CALLAGHANTM,etal.Anaerobicfungi(phylumNeocallimastigomy⁃cota):advancesinunderstandingtheirtaxonomy,lifecycle,ecology,roleandbiotechnologicalpotential[J].FEMSMicrobiologyEcology,2014,90(1):1-17.[31]㊀ISHAQSL,KIMCJ,REISD,etal.Fibrolyticbacte⁃riaisolatedfromtherumenofnorthamericanmoose(Alcesalces)andtheiruseasaprobioticinneonatallambs[J].PLoSOne,2015,10(12):e0144804.[32]㊀WEIYQ,LONGRJ,YANGH,etal.Fiberdegrada⁃tionpotentialofnaturalco⁃culturesofNeocallimastixfrontalisandMethanobrevibacterruminantiumisolatedfromyaks(Bosgrunniens)grazingontheQinghaiTibetanPlateau[J].Anaerobe,2016,39:158-164.[33]㊀KITTELMANNS,PINARES⁃PATINOCS,SEED⁃ORFH,etal.Twodifferentbacterialcommunitytypesarelinkedwiththelow⁃methaneemissiontraitinsheep[J].PLoSOne,2014,9(7):e103171.[34]㊀TAPIOI,SNELLINGTJ,STROZZIF,etal.Theru⁃minalmicrobiomeassociatedwithmethaneemissionsfromruminantlivestock[J].JournalofAnimalSci⁃enceandBiotechnology,2017,8:7.[35]㊀DANIELSSONR,DICKSVEDJ,SUNL,etal.Meth⁃aneproductionindairycowscorrelateswithrumenmethanogenicandbacterialcommunitystructure[J].FrontiersinMicrobiology,2017,8:226.[36]㊀WALLACERJ,ROOKEJA,MCKAINN,etal.Therumenmicrobialmetagenomeassociatedwithhighmethaneproductionincattle[J].BMCGenomics,2015,16:839.[37]㊀POPEPB,SMITHW,DENMANSE,etal.IsolationofSuccinivibrionaceaeimplicatedinlowmethanee⁃missionsfromtammarwallabies[J].Science,2011,333(6042):646-648.[38]㊀GRAINGERC,CLARKET,MCGINNSM,etal.Methaneemissionsfromdairycowsmeasuredusingthesulfurhexafluoride(SF6)tracerandchambertechniques[J].JournalofDairyScience,2007,90(6):2755-2766.[39]㊀WILLIAMSSRO,MOATEPJ,HANNAHMC,etal.BackgroundmatterswiththeSF6tracermethodforestimatingentericmethaneemissionsfromdairycows:acriticalevaluationoftheSF6procedure[J].AnimalFeedScienceandTechnology,2011,170(3/4):265-276.[40]㊀PATRAAK.RecentAdvancesinmeasurementanddietarymitigationofentericmethaneemissionsinru⁃minants[J].FrontiersinVeterinaryScience,2016,3:39.[41]㊀RYMERC,HUNTINGTONJA,WILLIAMSBA,etal.Invitrocumulativegasproductiontechniques:histo⁃ry,methodologicalconsiderationsandchallenges[J].AnimalFeedScienceandTechnology,2005,123-124:9-30.[42]㊀NEGUSSIEE,DEHAASY,DEHARENGF,etal.In⁃vitedreview:large⁃scaleindirectmeasurementsforen⁃tericmethaneemissionsindairycattle:areviewofproxiesandtheirpotentialforuseinmanagementandbreedingdecisions[J].JournalofDairyScience,2017,100(4):2433-2453.[43]㊀PATRAAK,LALHRIATPUIIM,DEBNATHBC.Predictingentericmethaneemissioninsheepusinglin⁃earandnon⁃linearstatisticalmodelsfromdietaryvari⁃ables[J].AnimalProductionScience,2016,56(2/3):574-584.[44]㊀PATRAAK,LALHRIATPUIIM.Developmentofstatisticalmodelsforpredictionofentericmethanee⁃missionfromgoatsusingnutrientcompositionandin⁃020511期王㊀坤等:反刍动物瘤胃甲烷生成相关研究进展takevariables[J].AgricultureEcosystems&Environ⁃ment,2016,215:89-99.[45]㊀MORAESLE,STRATHEAB,FADELJG,etal.Predictionofentericmethaneemissionsfromcattle[J].GlobalChangeBiology,2014,20(7):2140-2148.[46]㊀PATRAAK.Predictionofentericmethaneemissionfromcattleusinglinearandnon⁃linearstatisticalmod⁃elsintropicalproductionsystems[J].MitigationandAdaptationStrategiesforGlobalChange,2016:1-22.[47]㊀KUMARS,DAGARSS,PUNIYAAK,etal.Chan⁃gesinmethaneemission,rumenfermentationinre⁃sponsetodietandmicrobialinteractions[J].ResearchinVeterinaryScience,2013,94(2):263-268.[48]㊀MEALESJ,CHAVESAV,BAAHJ,etal.Methaneproductionofdifferentforagesininvitroruminalfer⁃mentation[J].Asian⁃AustralasianJournalofAnimalSciences,2011,25(1):86-91.[49]㊀MACHADOL,MAGNUSSONM,PAULNA,etal.Effectsofmarineandfreshwatermacroalgaeoninvitrototalgasandmethaneproduction[J].PLoSOne,2014,9(1):e85289.[50]㊀PATRAAK,SAXENAJ.Anewperspectiveontheuseofplantsecondarymetabolitestoinhibitmethano⁃genesisintherumen[J].Phytochemistry,2010,71(11/12):1198-1222.[51]㊀WILLIAMSSRO,MOATEPJ,DEIGHTONMH,etal.Methaneemissionsofdairycowscannotbepre⁃dictedbytheconcentrationsofC8ʒ0andtotalC18fat⁃tyacidsinmilk[J].AnimalProductionScience,2014,54(10):1757-1761.[52]㊀CHENM,WOLINMJ.Effectofmonensinandla⁃salocid⁃sodiumonthegrowthofmethanogenicandru⁃mensaccharolyticbacteria[J].AppliedandEnviron⁃mentalMicrobiology,1979,38(1):72-77.[53]㊀MARTINEZ⁃FERNANDEZG,DENMANSE,YANGCL,etal.Methaneinhibitionaltersthemicro⁃bialcommunity,hydrogenflow,andfermentationre⁃sponseintherumenofcattle[J].FrontiersinMicrobi⁃ology,2016,7:1122.[54]㊀HRISTOVAN,OHJ,GIALLONGOF,etal.Anin⁃hibitorpersistentlydecreasedentericmethaneemissionfromdairycowswithnonegativeeffectonmilkpro⁃duction[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2015,112(34):10663-10668.[55]㊀WRIGHTADG,KENNEDYP,O'NEILLCJ,etal.Reducingmethaneemissionsinsheepbyimmuniza⁃tionagainstrumenmethanogens[J].Vaccine,2004,22(29/30):3976-3985.[56]㊀LEEC,ARAUJORC,KOENIGKM,etal.Effectsofencapsulatednitrateongrowthperformance,nitratetoxicity,andentericmethaneemissionsinbeefsteers:backgroundingphase[J].JournalofAnimalScience,2017,95(8):3700-3711.[57]㊀VanZIJDERVELDSM,GERRITSWJJ,DIJK⁃STRAJ,etal.Persistencyofmethanemitigationbydi⁃etarynitratesupplementationindairycows[J].JournalofDairyScience,2011,94(8):4028-4038.[58]㊀GUYADERJ,DOREAUM,MORGAVIDP,etal.Long⁃termeffectoflinseedplusnitratefedtodairycowsonentericmethaneemissionandnitrateandni⁃triteresidualsinmilk[J].Animal,2016,10(7):1173-1181.[59]㊀DOREAUM,ARBREM,POPOVAM,etal.Linseedplusnitrateinthedietforfatteningbulls:effectsonmethaneemission,animalhealthandresiduesinoffal[J].Animal,2017,12(3):501-507.[60]㊀LIXZ,LONGRJ,YANCG,etal.Rumenmicrobialresponsesinfermentationcharacteristicsandproduc⁃tionofCLAandmethanetolinoleicacidinassociatedwithmalateorfumarate[J].AnimalFeedScienceandTechnology,2010,155(2/3/4):132-139.1205㊀动㊀物㊀营㊀养㊀学㊀报32卷∗Correspondingauthor,professor,E⁃mail:xiongbenhai@caas.cn(责任编辑㊀陈㊀鑫)ResearchAdvancesonRumenMethanogenesisinRuminantsWANGKun1㊀NANXuemei1㊀XIONGBenhai1∗㊀JIANGLinshu2(1.StateKeyLaboratoryofAnimalNutrition,InstituteofAnimalScience,ChineseAcademyofAgriculturalSciences,Beijing100193,China;2.BeijingKeyLaboratoryforDairyCowNutrition,BeijingUniversityofAgriculture,Beijing102206,China)Abstract:Ruminantscanconvertplantmaterialsthatpeoplecan tutilizedirectlyintomeatandmilkproducts.However,ruminantsemitabout100milliontonsofmethaneintotheenvironmenteveryyear,whichnotonlyexacerbatestheglobalgreenhouseeffects,butalsoreducesfeedutilization.Thisarticlereviewedtherecentre⁃searchprogressinmethanogenesisintherumen,rumenmicroorganismsassociatedwithmethaneemissions,measurementmethodsandstrategiesinmitigatingmethaneemissionsinordertoprovideareferenceforstudiesofruminantmethaneemissions.[ChineseJournalofAnimalNutrition,2020,32(11):5013⁃5022]Keywords:ruminants;rumen;methanogenesis;methanogens2205。
内蒙古工业大学给水排水工程《水处理微生物》考试考点

---"水处理生物学"的研究对象是什么?主要集中在与水中的污染物迁移、分解及转化过程密切相关的微生物、微型水生动物和水生/湿生植物,特别是应用于水处理工程实践的生物种类。
细菌等原核微生物在水处理工程中通常起着关键的作用,是水处理生物学研究的重点。
---微生物有哪些基本特征?个体微小、结构简单、进化地位低、种类多、分布广、繁殖快、易变异---微生物的双名法规定是什么?一种微生物的名称由两个拉丁文单词组成,第一个是属名,用拉丁文名词表示,词首字母大写,它描述微生物的主要特征;第二个是种名,用拉丁文形容词表示,词首字母不大写,它描述微生物的次要特征。
有时候在前面所述的两个单词之后还会有一个单词,这个单词往往是说明微生物的命名人。
---细菌的大小一般是用什么单位测量的?一般用μm测量。
---以形状来分,细菌可分为哪几类?可分为球状、杆状和螺旋状(弧菌及螺菌)3种,少数为其他形状,以杆菌最为常见,球菌次之,螺旋菌最少。
---细菌的细胞结构包括一般结构和特殊结构,简单说明这些结构及及其生理功能。
-细菌的一般结构包括细胞壁和原生质两部分。
原生质位于细胞壁内,包括细胞膜(细胞质膜)、细胞质、核质和内含物。
-细胞壁是包围在细菌细胞最外面的一层富有弹性的、厚实、坚韧的结构。
功能有:①保持细胞形状和提高细胞机械强度②为细胞的生长、分裂所必需③鞭毛的支点,实现鞭毛运动④阻拦大分子有害物质⑤赋予细胞特定的抗原性以及对抗生素和噬菌体的敏感性。
-细胞膜是一层紧贴着细胞壁而包围着细胞质的薄膜,其化学组成主要是蛋白质、脂类和少量糖类。
这种膜具有选择性吸收的半渗透性,膜上具有与物质渗透、吸收、转运和代谢等有关的许多蛋白质和酶类。
功能为:①选择性地控制细胞内外物质的运送和交换②维持细胞内正常渗透压③合成细胞壁组分和荚膜的场所④进行氧化磷酸化或光合磷酸化的产能基地⑤许多代谢酶和运输酶以及电子呼吸链组成的所在地⑥鞭毛的着生和生长点。
泸州古酿酒窖池中两株产甲烷杆菌比较研究

应用与环境生物学报 2010,16 ( 6 ): 840~844Chin J Appl Environ Biol=ISSN 1006-687X2010-12-25DOI: 10.3724/SP.J.1145.2010.00840泸州老窖古酿酒窖池群是全国重点文物保护单位,自公元1573年开始酿造浓香型曲酒一直延续至今. 浓香型曲酒的主体香成分——己酸乙酯由窖内多种微生物作用生成,其前体物则来源于窖泥中的己酸发酵. 北原觉雄研究巴氏梭菌除转变乙醇为己酸和少量丁酸外,还生成CH 4和H 2,以后发现该菌并非纯种,但因此认识到己酸发酵和甲烷发酵存在一定关系[1]. 泸州老窖古酿酒窖池中,多种厌氧细菌类群参与曲酒发酵生香,其中己酸菌具有特别重要的生产性能. 上世纪80年代首次从泸州老窖泥中分离出氢营养型的布氏甲烷杆菌CS 菌株,揭示了酿酒窖池是产甲烷古菌存在的又一生态系统[2]. 随后发现该菌和从老窖泥中分离的己酸菌——泸酒梭菌菌株存在“种间氢转移”互营共生关系,混合培养时可较大程度提高己酸产量. 以后将CS 菌株应用于酿酒工业,与己酸菌共同促进新窖老熟,有效提高酒质[3]. 因此,窖泥中栖息的产甲烷古菌既是生香功能菌,又是标志老窖生产性能的指示菌.最近我们在对泸州古酿酒窖池微生物研究中,观察到窖泥中的产甲烷古菌在形态特征、营养类群和生理特性上表现出多样性,并分离到部份菌株. 本文报道其中两株产甲烷杆菌0372-D1和0072-D2菌株的比较研究结果. 值得一提的泸州古酿酒窖池中两株产甲烷杆菌比较研究王俪鲆1, 4 张 良2 刘来雁3 张宿义2 许德富2 刘光烨1*(1中国科学院成都生物研究所 成都 610041)(2泸州老窖股份有限公司 泸州 646000)(3农业部沼气科学研究所,农业部能源微生物与利用重点开放实验室 成都 610041)(4中国科学院研究生院 北京 100049)Comparative Study of Two Methanobacterium Strains in the Ancient FermentationPits of LuzhouWANG Liping 1, 4, ZHANG Liang 2, LIU Laiyan 3, ZHANG Suyi 2, XU Defu 2 & LIU Guangye 1*(1Chengdu Institute of Biology, Chinese Academy of Sciences , Chengdu 610041, China)(2Luzhoulaojiao Co., Ltd., Luzhou 646000, Sichuan, China)(3Biogas Institute of Ministry of Agricultural, Key Laboratory of Energy Microbiology and Application, Ministry of Agriculture , Chengdu 610041, China)(4Graduate University of Chinese Academy of Sciences , Beijing 100049, China)Abstract Two strains of Methanobacterium , named as 0372-D1 and 0072-D2, were isolated from the ancient fermentation pits of Luzhoulaojiao by using the Hungate anaerobic techniques. The cells of 0372-D1 are long rod, slightly curved, both ends neatly and nonmotile, which may form long chains by some cells. However, they are dif fi cult to form colony in the solid medium. This strain utilizes only H 2+CO 2 to produce methane. Strain 0072-D2 is curved in rod-shape, light yellow and forms round colonies, and it utilizes formate or H 2+CO 2 as its sole carbon source for growth. The optimal growth temperature of two strains was found at 35 ℃. The optimal growth pH of strain 0372-D1 was 6.5~7.0 and its growth pH ranged from 5.0 to 8.0, and the optimal growth pH of strain 0072-D2 occurred at pH 7.5. The double time was 19 h for 0372-D1 and 8 h for 0072-D2 when cultured under the optimal conditions. The result from the analysis of their morphological and physicobiochemical characteristics and homology of the 16S rDNA gene sequences demonstrated that strain 0372-D1 would be a novel species of Methanobacterium , and strain 0072-D2 belonged to M. formicicum with the highest similarity of 99% in 16S rDNA gene sequence. Fig 6, Tab 1, Ref 16Keywords methanogen; Methanobacterium ; comparative study; new strain isolation; pit mud; 16S rDNA sequence;phylogenetic analysis; LuzhoulaojiaoCLC Q939.97 : TQ92摘 要 采用厌氧操作技术,从泸州老窖古酿酒窖池窖泥中分离到两株产甲烷杆菌0372-D1和0072-D2. 0372-D1菌体形态为长杆状,略弯,两端整齐,不运动,可由多个菌体形成长链;在固体培养基中难以长出菌落,只利用H 2+CO 2产生甲烷. 0072-D2菌体形态为弯曲杆状,淡黄色圆形菌落,利用H 2+CO 2或甲酸盐作为唯一碳源生长. 两株菌最适生长温度均为35 ℃、菌株0372-D1最适生长pH 为6.5~7.0,生长pH 范围5.0~8.0;菌株0072-D2最适生长pH 则为7.5. 在各自最适条件下培养,两株菌的最短增代时间分别为19 h 和8 h. 通过形态、生理生化特征和16S rDNA 序列的同源性分析,表明菌株0372-D1为产甲烷杆菌属的一个新种. 0072-D2则为甲酸甲烷杆菌(Methanobacterium formicicum )的新菌株,相似性为99%. 图6 表1 参16关键词 产甲烷菌;比较研究;新种分离;窖泥;16S rDNA 序列;系统发育分析;泸州老窖CLC Q939.97 : TQ92收稿日期:2010-03-02 接受日期:2010-04-29*通讯作者 Corresponding author (E-mail: liugy@)8416 期王俪鲆等:泸州古酿酒窖池中两株产甲烷杆菌比较研究是,菌株0372-D1具有耐酸的特性,对其进行的多相分类研究表明该菌可能为产甲烷杆菌属(Methanobacterium )的一个新种.1 材料与方法1.1 样 品窖泥样品采自泸州老窖明代古酿酒窖池,密封低温保存.1.2 富集、分离和纯化1.2.1 培养基 富集培养采用改良的MB [4]培养基(1 000 mL ):NaCl 6 g ,NH 4Cl 1 g ,MgCl 2·6H 2O 0.1 g ,K 2HPO 4·3H 2O 0.4 g ,KH 2PO 4 0.2 g ,HCOONa 2 g ,CH 3COONa 2 g ,酵母粉1 g ,胰酶解酪蛋白1 g ,微量元素液10 mL ,复合维生素液10 mL ,0.1%刃天青1 mL ,L -盐酸半胱氨酸0.5 g.分离纯化采用改良的Medium141(DSMZ )(http:www.dsmz.de/microorganisms/html/media/medium000141.html ). 固体培养基另加入1.8~2.0% (w/V )的琼脂粉.无机盐培养基(1 000 mL ):在改良的Medium141配方中去除HCOONa 、CH 3COONa 、酵母粉及胰酶解酪蛋白后即为无机盐培养基.1.2.2 操作方法 采用亨盖特厌氧操作改良技术[5~6]进行液体梯度稀释和固体滚管分离纯化. 25 mL 厌氧管或120 mL 血清瓶中加入无氧培养基,顶空为氮气,121 ℃,30 min 高压灭菌,接种后充入H 2+CO 2(V/V =4/1,约200 kPa )混合气,35 ℃培养.1.3 形态观察和生理生化实验1.3.1 检 测 镜检采用Nikon 80i 和Olympus BH-2荧光相差显微镜,甲烷含量的测定采用岛津GC-2010气相色谱仪. 1.3.2 生理实验 生长条件测定包括最适pH 值、最适生长温度和最适NaCl 浓度试验. 最适生长条件下选取生长对数期的甲烷产量作线性回归,计算得到产甲烷菌的倍增时间. 1.3.3 生化实验 底物实验、刺激因子实验、抗生素敏感性实验均采用改良的Medium141无机盐培养基.不同底物利用实验[7]:H 2/CO 2(V/V =4/1)、甲酸盐(50 mmol/L )、甲醇(50 mmol/L )、甲胺(50 mmol/L )、三甲胺(50 mmol/L )、乙酸盐(50 mmol/L )、乙醇(50 mmol/L )分别作为唯一碳源.不同刺激因子实验:酵母粉0.2%、胰酶解酪蛋白0.2%、复合维生素溶液1%(V/V )、微量元素溶液1%(V/V )、窖泥浸提液1%(V/V )、瘤胃浸提液1%(V/V )、污泥浸提液1%(V/V )、Na 2WO 4 0.02%、Na 2SeSO 4 0.02%、HS-CoM0.025%.不同抗生素抑制实验[8]:红霉素、卡那霉素、链霉素、氨苄青霉素、利福平、氯霉素,终浓度均为200 μg mL -1.1.4 16S rDNA 基因扩增与测序提取基因组D N A 作为模板,用产甲烷菌16S r D N A 特异性引物进行P C R 扩增. 正向引物M e t -86F :5’-GCTCAGTAACACGTGG-3’,反向引物Met-1340R :5’-CGG TGTGTGCAAGGAG-3’. PCR 反应条件:94 ℃预变性3 min ;94 ℃变性30 S ,58 ℃退火30 S ,72 ℃延伸1.5 min ,40个循环;72 ℃延伸10min [9~10]. 经切胶纯化的PCR 产物连接到PMD18-T 载体(TaKaRa )上,转化大肠杆菌感受态细胞(DH5α),检测到载体已连接到目的片段之后交由Invitrogen 公司(上海)完成测序.1.5 系统发育树的构建将菌株的16SrDNA 测序结果提交GenBank (/Genbank/index.html )核酸序列数据库进行BLAST ,使用Clustalx (1.83)软件将与之同源性较高的产甲烷菌的16SrDNA 序列进行比对,通过MEGA (4.1)软件采用邻位相邻法绘出系统发育树并进行Bootstape 稳定性检验(1 000次).2 结果与分析通过多次富集、添加抗生素梯度稀释纯化得到菌株0372-D1,滚管分离纯化得到菌株0072-D2.2.1 形态特征0372-D1菌体形态为长杆状,略弯,两端整齐,不运动,大小为(0.4~0.5)×(2~25) μm ,单个存在或由3~4个菌体形成长链,培养时间较长时可观察到长的菌体拧成绳状或大量的菌体相互缠绕形成菌丛,该菌在固体培养基上难以长出菌落. 0072-D2菌体形态为直或弯曲杆状,不运动,大小为(0.2~0.3)×(2~10) μm ,单个存在或形成弯曲长链,有时也聚集成团,在固体培养基上培养10 d 左右长出直径1~2 mm 淡黄色圆形菌落,边缘光滑. 见图1.2.2 生理特征菌株0372-D1和0072-D2均为中温产甲烷菌,最适生长温度35 ℃,生长温度范围15~50 ℃. 如图2-A 所示.0372-D1在不添加NaCl 的培养基中生长速度最快,在NaCl 浓度(w/V )为0.5%~2.5%时生长速度相当,而当NaCl 浓度高于4.5%时不生长;0072-D2则要求培养基具有一定的盐浓度,但NaCl 浓度高于5%时也不生长,最适生长NaCl 浓度在0.5%~1.0%之间. 见图2-B.如图2-C 所示,两株菌在对酸碱的耐受范围上表现出图1 菌株照片图Fig. 1 Micrograph of strainsA :菌株0372-D1紫外荧光显微照片;B :菌株0372-D1扫描电镜照片;C :菌株0072-D2紫外荧光显微照片;D :菌株0072-D2可见光相差显微照片A: UV fluorescence micrograph of strain 0372-D1; B: Scanning electron micrograph of strain 0372-D1; C: UV fluorescence micrograph of strain 0072-D2; D: Phase-contrast microscopy of strain 0072-D284216 卷应 用 与 环 境 生 物 学 报 Chin J Appl Environ Biol了较大的差异:菌株0372-D1生长最适pH 为6.5~7.0,其生长的pH 范围为5.0~8.0. 虽然该菌在pH 5.0和pH 8.0范围内生长停滞期较长,培养7 d 后才开始生产甲烷,但是培养20 d 后可以获得较高的菌浓度,并且在pH 5.0培养基中产生的甲烷量远高于pH 8.0,说明该菌耐酸的能力强于耐碱的能力. 菌株0072-D2生长最适pH 为7.5,略偏碱性,生长pH 范围6.0~9.0,并且在生长的后期,随着CO 2的消耗殆尽,培养基pH 略有升高,而此时菌体浓度高且荧光强烈,说明该菌对碱性环境有较强的适应性.2.3 最适生长曲线两株产甲烷杆菌分别在各自最适条件下培养(300 mL 体系),定时测定甲烷产量,并绘制生长曲线,在生长曲线的直线部分取点,求得菌株0372-D1和0072-D2的倍增时间分别为:19 h 和8 h. 见图3.2.4 生化特征分别以H 2+CO 2、甲酸钠、甲醇、甲胺、三甲胺、乙酸钠和乙醇作为唯一碳源,接种量10%,培养1 mo 监测这两株产甲烷菌的生长情况,结果表明菌株0372-D1只利用H 2+CO 2产生甲烷,0072-D2能够利用H 2+CO 2或甲酸钠作为唯一碳源生长;二者均不利用甲醇、甲胺、三甲胺、乙酸钠或乙醇. 见图4.图2 不同温度(A )、不同NaCl 浓度(B )和不同pH (C )下菌株0372-D1和0072-D2的甲烷生成比较Fig. 2 Comparison of methane production by strain 0372-D1 and 0072-D2 at various different temperatures (A), concentrations of NaCl (B) and pH values (C)图3 菌株0372-D1和0072-D2的最适生长曲线Fig. 3 The growth curves of strains 0372-D1and 0072-D2 underoptimum conditions图4 菌株0372-D1和0072-D2在不同底物中的生长情况Fig. 4 Methane production by strains 0372-D1 and 0072-D2 in various substrates图5 刺激因子对菌株0372-D1和0072-D2生长的影响Fig. 5 Effect of growth stimulators on the growth of strains 0372-D1 and 0072-D21PMF :窖泥浸提液;2SF :污泥浸提液;3RS :瘤胃浸提液;4TES :微量元素液;5VS :复合维生素液;6YP :酵母粉;7BBL :胰酶解酪蛋白;8VAX :Na 2WO 4/Na 2SeSO 4混合溶液;9CK :对照1PMF: Pit mud fl uid; 2SF: Sludge fl uid; 3RS:Rumen solution; 4TES: Trace elements solution; 5VS: Vitamin solution; 6YP: Yeast extract; 7BBL: Trypticase;8VAX: Na 2WO 4/Na 2SeSO 4 mixed solution; 9CK: Contrast8436 期王俪鲆等:泸州古酿酒窖池中两株产甲烷杆菌比较研究刺激因子实验结果表明,0372-D1能在无机盐培养基中生长良好,瘤胃浸提液对其的刺激作用最明显,其次是复合维生素液和酵母粉;而0072-D2在无机盐培养基中生长不良,污泥浸提液和酵母粉对其生长有较强的刺激作用. 见图5.抗生素抑制实验表明,0372-D1和0072-D2对氯霉素敏感,对红霉素、卡那霉素、链霉素、氨苄青霉素和利福平均有抗性.2.5 系统发育学分析0372-D1和0072-D2的16SrDNA 序列相似性为95%.将0372-D1和0072-D2的16SrDNA 序列在G e n Ba n k中分别进行B L A S T ,相似性最高的均为产甲烷杆菌属(M e t h a n o b a c t e r i u m )的菌株. 以此为根据选择10株M e t h a n o b a c t e r i u m 菌株,以1株产甲烷短杆菌模式株Methanobrevibacter smithii 作为外群种构建系统发育树,见图6.由系统发育树可以看出,菌株0372-D1与0072-D2与Methanobacterium 内的10株菌亲缘关系最密切,形成一个簇群. 其中,0372-D1与M. curvum 和M. congolense C 的16S rDNA图6 根据16S rDNA 序列同源性构建的产甲烷杆菌属的系统发育树Fig. 6 Dendragram of Methanobacterium based on 16S rDNA sequence homology表1 0372-D1,0072-D2与16SrDNA 序列同源性相近的几种产甲烷杆菌的特征比较Table 1 Comparison of phenotypic features of strains 0372-D1 and 0072-D2 with other species of Methanobacterium特征 Features123456789101112菌体大小Cell size (d /µm)0.4~0.5×2~250.2~0.3×2~100.4~0.8×2~150.4~0.5×2~100.3~0.4×2~200.5×2.5~50.1~0.15×0.6~1.20.3~0.4×3~100.4~0.5×3~50.7×5~180.5~1.0×10~150.8×3~22菌落大小Colony size (d /mm)ND1.0~2.0Up to 5.0Up to 1.0 1.0~1.5ND 1.0~2.0 1.0~2.00.5~1.0ND 1~50.5~1.0底物利用Substrates used H 2+CO 2H 2+CO 2甲酸盐Formate H 2+CO 2甲酸盐Formate H 2+CO 2H 2+CO 2H 2+CO 2甲酸盐Formate H 2+CO 2甲酸盐Formate H 2+CO 2甲酸盐Formate H 2+CO 2甲酸盐Formate H 2+CO 2H 2+CO 2H 2+CO 2最适温度Optimum temperature (θ/℃)353537~4537~423733~3720~4040374537~3935温度范围Temperature range(θ/℃)15~5015~50ND 25~5027~4520~45 3.6~4520~4225~505~48ND 15~50最适pH Optimum pH 6.5~7.07.5 6.6~7.87.2 6.5~7.57.07.8~8.87.07.27.5~8.0 6.9~7.2 5.6~6.2pH 范围pH range 5.0~8.0 6.0~9.0ND 5.9~8.2ND ND 6.5~9.2 6.0~8.5 6.5~8.0 5.0~9.0ND 4.6~7.0最适NaCl 浓度Optimum NaCl con. (w /%)00.2~0.5ND ND <0.5ND ND ND ND ND ND ND NaCl 浓度范围NaCl con. range(w /%)0~4.50~5.0NDNDND0~0.30.1~1.20~0.40~0.5NDNDND来源Source 窖泥Pit mud 窖泥Pit mud 厌氧消化器Anaerobic digester 厌氧消化器Anaerobic digester 厌氧消化器Anaerobic digester 泥炭沼泽Peat bog 深岩地下水Deep granitic groundwater 稻田Rice fi eld 厌氧消化器Anaerobic digester 海洋沉积物Marinesediment厌氧消化器Anaerobic digester污泥SludgeStrains: 1, 0372-D1; 2, 0072-D2; 3, M. formicicum DSM 1535T ; 4, M. congolense DSM 3387T ; 5, M. curvum Px1; 6, M. palustre DSM 3108T; 7, M. subterraneum DSM 11074T ; 8, M. oryzae DSM 11106T ; 9, M. beijingense 8-2T ; 10, M. aarhusense DSM 15219T ; 11, M. bryantii DSM 863T ; 12, M. espanolae OCM 178T ; ND: Not determined84416 卷应 用 与 环 境 生 物 学 报 Chin J Appl Environ Biol序列同源性最高,为96%;0072-D2与M. formicicum的同源性最高,为99%.菌株0372-D1和0072-D2与16SrDNA序列同源性最相近的产甲烷杆菌属几个种的特征比较见表1.3 讨 论根据国际细菌系统分类学产甲烷菌分类鉴定的基本标准[11],以及细菌分类学家普遍认为的当16S rDNA序列同源性在98%以上时,可认作同一个种;当序列同源性低于97%时,可认为是属内的不同种,低于93%~95%则可能为属外成员[12~13];通过系统发育分析得出0372-D1与产甲烷杆菌属中同源性最高的种M. curvum和M. congolense C的相似性为96%. 在生理特征上,菌株0372-D1与产甲烷杆菌属其它种最大的区别就在于生长pH范围的宽泛性和一定的耐酸能力,生化性质上也存在较大差异,因此0372-D1可能为产甲烷杆菌属的一个新种. 菌株0072-D2与M. formicicum的同源性最高,为99%,因此为甲酸甲烷杆菌的一个新菌株.古酿酒窖池为一酸性环境,老窖泥pH值在3.8~4.0之间,滴窖黄水的pH值则低达3.0左右,然而从窖泥富集的产甲烷古菌最适pH基本在中性附近. 这种情况和酸性泥炭沼泽相类似. 泥炭pH值一般在3.5~5.0之间,但从泥炭中分离出的绝大多数菌株仍是中性产甲烷菌. 这种在酸性环境中仍以中性产甲烷菌为优势种群的现象,值得进一步研究.产甲烷古菌作为古菌域中最大的一个类群,广泛存在于地球上各类厌氧环境中. 淡水和海洋沉积物、稻田、沼泽、动物瘤胃和肠道等大小厌氧生态环境均有产甲烷古菌存在. 产甲烷古菌能适应多种多样的温度环境,但大多数产甲烷古菌的适宜pH在相对狭窄的范围内(6.0~8.0). 至今已报道的产甲烷古菌中,仅有少数几个种为嗜酸或耐酸产甲烷古菌. 分离自污泥中的M. espanolae是嗜酸产甲烷菌,生长最适pH 为5.6~6.2,但若pH低于4.68则停止生长[14]. 2006年《Nature》报道的一株分离自泥炭沼泽的嗜酸产甲烷菌Methanoregula boonei,生长最适pH5.0,当pH低于4.0或高于5.8则不生长,为目前分离到的最耐酸的产甲烷古菌[15~16]. 本次从古酿酒窖池分离出的产甲烷杆菌0372-D1菌株虽然生长最适pH为6.5~7.0,但在pH 5.0时仍可生长,表现出一定的耐酸特性,因而具有较好的学术意义和应用价值.References1 北原觉雄. 细菌利用工业. 平安译. 北京: 中国轻工出版社, 1956.147~1562 Liu GY (刘光烨), Zhao YZ (赵一章), Wu YY (吴衍庸). Isolation andcharacterization of Methanobacterium bryantii of Luzhou-Liqure pit mud. Microbiology (微生物学通报), 1987, 14 (3): 156~1593 Wu YY (吴衍庸), Lu SH (卢世珩), Liu GY (刘光烨). A study ofenhancing the quality of Luzhou type Qujiu by using simulataneous fermentation of caproic acid bacteria and Methane bacteria. Food & Ferment Ind (食品与发酵工业), 1990, 6: 2~64 Romesser JA, Wolfe RS, Mayer F. Methanogenium, a new genus ofmarine methanogenic bacteria, and characterization of Methanogenium cariaci sp. nov. and Methanogenium marisnigri sp. nov. Arch Microbiol, 1979, 121 (2): 147~1535 Hungate RE. A roll-tube method for cultivation of strict anaerobes.Mthods Microbiol, 1969, 3B: 117~1326 Balch WE, Wolfe RS. New approach to the cultivation of methanogenicbacteria: 2- mercaptoethanesulfonic acid (HS-CoM)-dependent growth of Methanobacterium ruminantium in a preesureized atmosphere. Appl Environ Microbiol, 1976, 32 (6): 781~7917 Cuzin N, Ouattara AS, Labat M, Garcia JL. Methanobacteriumcongolense sp. nov., from a methanogenic fermentation of cassava peel.Intern J Syst & Evol Microbiol, 2001, 51 (2): 489~4938 Qiu TL (仇天雷), Cheng L (承磊), Luo H (罗辉), Zhang H (张辉),Wu XL (吴晓磊), Deng Y (邓宇). Isolation and characterization of Methanogens from sedinents in Jiaozhou Bay. China Biogas (中国沼气), 2006, 25 (2): 3~109 Skillman LC, Evans PN, Strömpl C, Joblin KN. 16SrDNA directed PCRprimers and detection of methanogens in the bovine rumen. Lett Appl Microbiol, 2006, 42: 222~22810 Wright A-DG, Williams AJ, Winder B, Christophersen CT, Rodgers SL,Smith KD. Molecular diversity of rumen methanogens from sheep in Western Australia. Appl Environ Microbiol, 2004, 70 (3): 1263~127011 农业部厌氧微生物重点开放实验室. 产甲烷菌及其研究方法. 成都:成都电子科技大学出版社, 1997. 14~1512 Sun Z (孙征), Zhou YG (周宇光), Dong XZ (东秀珠). Characterizationand phylogenetics of a new species of genus methanobacterium. Acta Microbiol Sin (微生物学报), 2001, 41 (3): 265~26913 Boone, DR, Whitman, WB. Proposal of minimal standards fordescribing new taxa of methanogenic bacteria. Int Syst Bacteriol, 1988, 38: 212~21914 Patel GB, Sprott GD, Fein JE. Isolation and characterization ofMethanobacterium espanolae sp. Nov., a mesophilic, moderately acidiphilic methanogen. Int J Syst Bacteriol, 1990, 40: 12~1815 Bräuer SL, Cadillo-Quiroz H, Yashiro E, Yavitt JB, Zinder SH. Isolationof a novel acidiphilic methanogen from an acidic peat bog. Nature, 2006, 442: 192~19416 Bräuer SL, Yashiro E, Ueno NG, Yavitt JB, Zinder SH. Characterizationof acid-tolerant H2/CO2-utilizing methanogenic enrichment cultures from and acidic peat bog in New York State. FEMS Microbiol Ecol, 2006, 57: 206~216。
论述生物能多样性概念与研究内容及其多样性指数

论述生物能多样性概念与研究内容及其多样性指数第一篇:论述生物能多样性概念与研究内容及其多样性指数论述生物能多样性概念与研究内容及其多样性指数1、生物多样性概念生物多样性是指生物中的多样化与变异性以及物种生境的生态复杂性,可以分成若干水平,即遗传多样性、物种多样性、生态系统多样性,还可以包括景观多样性。
分为基因、细胞、个体、种群、群落和生态系统等各个生命系统等级。
遗传多样性是指地球上所有生物或物种个体之间或群体内的基因或基因型的多样性。
世界上所有生命既能保持自己物种的繁衍,又能使每一个个体都表现出差别,这要归功于其体内基因表达的差别。
在组成生命的细胞中,DNA是遗传物质,由4种碱基在DNA长链上不同的排列组合,决定了基因及生命的多样性。
物种多样性是指生物物种的多样性或丰富度,一般以物种丰富度和均匀的为衡量指标。
地球上的生命是丰富多彩的:从非常小的一个病毒到重达150吨的大鲸鱼;从慢性子的蜗牛到每小时能奔跑90公里的猎豹;植物借助于风、水和动物的迁移把自己的后代送向远方;仅苔癣植物就有13000种之多......,大自然中每一样生命都是独特的,不可替代的。
生态系统多样性是指生物圈内生境、生物群落和生态过程的多样化以及生态系统内生境、生物群落和生态系统变化的惊人的多样性。
在地球的表面,到处都有生命在游荡。
为适应在不同环境下生存,各种植物、动物和菌类与环境又构成了不同的生态系统,这就是生命的家园。
在不同的生态系统中,各种生命通过一张极其复杂的食物网来获取和传递太阳的能量,同时完成物质的循环。
生态系统的结构、功能、平衡及调节机制千差万别是生物多样性的重要内容。
景观多样性是指不同类型的景观在空间结构,功能机制和时间动态方面的多样化和变异性.景观要素可分为斑块,廊道和基质.斑块是景观尺度上最小的均质单元,它的大小,数量,形态和起源等对景观多样性有重要意义.廊道成线状或带状,是联系斑块的纽带,不同景观有不同类型的廊道.基质是景观中面积较大,连续性高的部分,往往形成景观的背景.。
UASB反应器颗粒污泥培养技术实验结果的分析与讨论

UASB反应器颗粒污泥培养技术实验结果的分析与讨论目录一、颗粒污泥培养效果评估 (2)二、反应器性能优化效果验证 (4)三、实验数据统计分析 (7)四、异常现象与问题剖析 (10)五、实验误差与不确定性分析 (13)声明:本文内容来源于公开渠道或根据行业大模型生成,对文中内容的准确性不作任何保证。
本文内容仅供参考,不构成相关领域的建议和依据。
一、颗粒污泥培养效果评估(一)污泥形态与结构分析1、颗粒污泥外观特征在培养周期内,对UASB反应器中的颗粒污泥进行了定期取样观察。
通过显微镜及扫描电镜技术,发现颗粒污泥逐渐由初始的小而松散状态转变为较大且结构紧密的球形或椭球形。
这些颗粒污泥表面光滑,颜色由初期的浅灰色逐渐加深至深褐色,表明污泥逐渐成熟并富含微生物群落。
2、污泥内部结构变化利用切片技术和荧光原位杂交(FISH)技术,分析了颗粒污泥的内部结构。
结果显示,随着培养时间的延长,颗粒污泥内部形成了明显的分层结构,包括外层的好氧/兼氧区、中间层的厌氧区和内层的产甲烷区。
这种分层结构有助于不同微生物种群在各自适宜的环境条件下生长,提高了污泥的整体代谢效率和稳定性。
(二)污泥性能参数评估1、污泥沉降性能通过污泥沉降比(SV%)和污泥体积指数(SVI)的测定,评估了颗粒污泥的沉降性能。
实验结果显示,随着培养时间的增加,SV%逐渐降低,而SVI保持在较低水平,表明颗粒污泥具有良好的沉降性和紧密性,有利于减少反应器中污泥的流失和提高出水水质。
2、有机物去除效率分析了反应器进出水中的化学需氧量(COD)和生物需氧量(BOD5)的变化,以评估颗粒污泥对有机物的去除效率。
结果显示,随着颗粒污泥的成熟,反应器对COD和BOD5的去除率显著提高,最终达到90%以上,证明了颗粒污泥在有机物降解方面的优异性能。
3、甲烷产量与产气效率通过气体收集装置,定期测量了反应器的甲烷产量和产气效率。
实验数据表明,随着颗粒污泥的培养,甲烷产量逐渐增加,产气效率也随之提高。
低温沼气技术:低温产甲烷过程及嗜冷产甲烷菌

厌 氧 消化微 生物 可分 为产 甲烷 菌群与 不产 甲烷 菌群 。其 中不 产 甲烷 菌 群 有 水 解 细 菌 、发 酵 细 菌 、产 氢产 乙酸 菌 和 同 型 产 乙 酸 菌 等 J 。产 甲烷
一
】 1一
环 境科 学导刊
h t t p :/ /  ̄k x d k . y i e s . o r g . c n 第3 2卷
生 物质 甲烷 化技 术历 史悠 久 ,它 可 以产 生 甲烷
会被互 营微生物消耗 ;另一种低 温下更 易降解 的多糖
— —
以满足 人类 的能 源需 求 ,减轻 人们 对传 统能 源 的依
淀粉会被转化为乙酸和 丁酸等短链脂肪 酸 ,同时
赖 。研究者对厌氧消化进行了大量 的研究 ,但多集
中在 中温 和高温 范 围 ,对 低温 下生 物质 厌氧 消化 产 甲烷作 用还 不 甚 了解 。而 地 球 表 面 约 8 5 % 的 环 境 是 处 于永 久 性 低 温 状 态 的 … ,因此 ,对 低 温 发酵 生成 的挥发 性脂 肪酸和 乙醇 经过 酸化作 用 和脱氢 作 用生成 乙酸 和氢 气 。专 性产 氢产 乙酸 细菌 可 以直接将 长链脂 肪 酸转
有 机物 在厌 氧条 件下 ,经过水 解 、发 酵 、乙酸 化 、产 甲烷 等一 系列 复杂 的微 生物 代谢 过程 ,最 终
被降解为甲烷和 C O : 。其 中每一步都是由某些特定
种 群微 生物 有机 体来 实现 的。在一 个平 衡 的消 化系 统 中 ,各微 生物 群落 相互 依存 ,互 相 提供原 料 和能
化为产 甲烷作用最重要 的底物 乙酸 、氢气和 C O 。 同型产 乙酸菌把 各种 底物 转化 为 乙酸 ,这 是低 温下
饲粮中不同水平单宁对绵羊瘤胃细菌、产甲烷菌数量和古菌多样性的影响

动物营养学报2020,32(6):2722⁃2729ChineseJournalofAnimalNutrition㊀doi:10.3969/j.issn.1006⁃267x.2020.06.031饲粮中不同水平单宁对绵羊瘤胃细菌㊁产甲烷菌数量和古菌多样性的影响丽㊀丽㊀李大彪∗㊀王敬尧㊀解湧芳㊀李子南(内蒙古农业大学动物科学学院,内蒙古自治区高校动物营养与饲料科学重点实验室,呼和浩特010018)摘㊀要:本试验旨在研究饲粮中不同水平单宁对绵羊瘤胃细菌㊁产甲烷菌数量和古菌多样性的影响㊂试验选取45kg左右㊁体况良好的绵羊15只,随机分为3组,分别为Ⅰ组(对照组,不含单宁)㊁Ⅱ组(含2%单宁)和Ⅲ组(含4%单宁),每组5只羊㊂预试期14d,正试期60d㊂于正试期晨饲后6h使用瘤胃液口腔采样器采集瘤胃液,提取微生物DNA,用实时荧光定量检测瘤胃细菌和产甲烷菌数量,采用IlluminaMiseqPE300平台测定瘤胃古菌的多样性㊂结果表明:1)Ⅱ组和Ⅲ组总细菌㊁白色瘤胃球菌㊁溶纤维丁酸弧菌㊁产琥珀酸丝状杆菌数量显著低于Ⅰ组(P<0.05);Ⅱ组黄色瘤胃球菌数量显著低于Ⅰ组(P<0.05);Ⅲ组产甲烷菌和甲烷短杆菌数量显著低于Ⅰ组(P<0.05)㊂2)Ⅱ组和Ⅲ组Ace指数显著低于Ⅰ组(P<0.05);Ⅲ组香农指数显著低于Ⅰ组(P<0.05);Ⅲ组辛普森指数显著高于Ⅰ组和Ⅱ组(P<0.05),而Ⅱ组辛普森指数显著高于Ⅰ组(P<0.05)㊂综上得出,饲粮中含2%和4%的单宁降低了绵羊瘤胃中总细菌和产甲烷菌的数量,也降低了绵羊瘤胃古菌菌群丰度和多样性㊂关键词:单宁;绵羊;瘤胃;细菌;多样性中图分类号:S826㊀㊀㊀㊀文献标识码:A㊀㊀㊀㊀文章编号:1006⁃267X(2020)06⁃2722⁃08收稿日期:2019-12-31基金项目:国家自然科学基金项目(31660666)作者简介:丽㊀丽(1992 ),女,内蒙古通辽人,硕士研究生,研究方向为动物营养与饲料科学专业㊂E⁃mail:1134038654@qq.com∗通信作者:李大彪,教授,博士生导师,E⁃mail:da_biao1980@163.com㊀㊀内蒙古自治区是畜牧业大省,绵羊和山羊存栏数均居于全国前列㊂近年来由于过度放牧造成了严重的土地荒漠化㊂草食动物的饲养方式也由之前的放牧逐渐转变为舍饲或半舍饲,这使草食动物养殖对粗饲料的需求量逐渐增加㊂我国北方地区的灌木植被较丰富,有开发为粗饲料的潜力㊂柠条作为一种灌木类植物在内蒙古自治区分布广泛,且营养价值较高㊂营养期的柠条营养价值高于3级苜蓿草粉,其粗蛋白质㊁粗脂肪和矿物元素含量较丰富,而且氨基酸组成较为平衡,是优良的非常规饲料资源之一[1]㊂近年来,国内外研究人员对开发柠条作为新型饲料资源的可行性开展了相关的研究㊂柠条中富含单宁,单宁是植物饲料的抗营养因子,也是将柠条开发为饲料资源的限制性因素㊂单宁作为植物进化过程中由碳水化合物衍生出来的一种自我保护性物质,是植物与环境相互作用的产物[2]㊂单宁按结构可分为水解单宁和缩合单宁两大类[3]㊂单宁在瘤胃中与消化酶和蛋白质结合形成沉淀,极大地降低了粗蛋白质和纤维素在瘤胃中的降解率,减少了氮和甲烷的排放量,增加了过瘤胃蛋白质含量,从而提高了氮的利用效率[4]㊂前人研究指出,单宁会改变瘤胃发酵模式和微生物区系,也有减少反刍动物甲烷排放的作用[5-6]㊂周奕毅[7]研究指出,含单宁的茶皂素通过改变湖羊瘤胃产甲烷菌数量而显著降低甲烷产量㊂产甲烷菌是专性厌氧菌,属于古菌域,广域古菌界,宽广古生菌门,主要有氢营养型㊁甲基营养型和乙酸营养型3种营养类型㊂产甲烷菌6期丽㊀丽等:饲粮中不同水平单宁对绵羊瘤胃细菌㊁产甲烷菌数量和古菌多样性的影响可利用二氧化碳㊁甲酸㊁乙酸㊁甲胺和次甲胺等通过一系列复杂的化学过程合成甲烷[8]㊂甲烷的生成既加剧温室效应,又造成能量损失㊂一般来说,以甲烷气体形式损失的能量占饲料总能量的7% 10%,反刍动物消化过程中约有2%的可消化能转变成甲烷和热能被消耗[9]㊂王卫云[10]研究发现,体外培养条件下添加单宁会抑制瘤胃纤维降解细菌的生长,这种抑制作用随单宁浓度增加而增强㊂Zhou等[11]用16SrRNA高通量测序技术分析了单宁酸对肉牛瘤胃细菌多样性的影响,结果表明添加单宁酸对肉牛瘤胃细菌的相对丰度无显著影响,但增加了细菌群落的多样性㊂目前,国内外关于单宁对瘤胃微生物区系影响的研究多是在饲粮中添加单宁酸开展的,而不同来源的单宁其组成可能有较大差异,对瘤胃微生物区系的影响可能不尽相同㊂而细菌数量和古菌群落结构与反刍动物瘤胃内甲烷的生成密切相关㊂因此,本研究以柠条作为单宁来源研究饲粮中不同水平单宁对瘤胃细菌㊁产甲烷菌数量和古菌多样性的影响,旨在为柠条这一非常规饲料资源开发利用和减少反刍动物生产中温室气体的排放提供科学依据㊂1㊀材料与方法1.1㊀试验设计㊀㊀本试验采用单因素完全随机试验设计,试验动物按照维持需要的1.2倍饲养,按照‘动物营养参数与饲养标准“[12]配制饲粮,根据饲粮单宁水平分为3组,分别为Ⅰ组(对照组,不含单宁)㊁Ⅱ组(含2%单宁)和Ⅲ组(含4%单宁)㊂预试期14d,正试期60d㊂㊀㊀饲粮中的单宁由柠条提供,选用结荚期的柠条,根据实测的柠条中缩合单宁含量确定Ⅱ组和Ⅲ组饲粮中柠条的用量,3组饲粮按照等能等氮原则配制,加工成全混合颗粒㊂柠条的营养成分和缩合单宁含量见王敬尧[13]㊂试验饲粮组成及营养水平见表1㊂表1㊀试验饲粮组成及营养水平(干物质基础)Table1㊀Compositionandnutrientlevelsofexperimentaldiets(DMbasis)%项目Items组别GroupsⅠⅡⅢ原料Ingredients玉米Corn12.8521.3531.35小麦麸Wheatbran18.0013.00豆粕Soybeanmeal6.003.006.00羊草Chinesewildrye45.0015.004.00苜蓿Alfalfa15.0025.0016.00柠条Caragana20.0040.00石粉Limestone0.50磷酸氢钙CaHPO41.001.001.00食盐NaCl0.650.650.65预混料Premix1)1.001.001.00合计Total100.00100.00100.00营养水平Nutrientlevels2)代谢能ME/(MJ/kg)8.508.428.34粗蛋白质CP10.6710.7110.75中性洗涤纤维NDF40.3642.2744.05非结构性碳水化合物NSC46.8344.9742.62钙Ca0.790.840.78磷P0.530.470.56淀粉Starch2.582.232.46㊀㊀1)预混料为每千克饲粮提供Thepremixprovidedthefollowingperkgofdiets:Se0.30mg,Cu25.00mg,Fe55.00mg,I5.10mg,Mn25.00mg,S60.00mg,Zn116.00mg,VA18000IU,VD3000IU,VE576IU㊂㊀㊀2)代谢能为计算值,其余为实测值㊂MEwasacalculatedvalue,whiletheothersweremeasuredvalues.3272㊀动㊀物㊀营㊀养㊀学㊀报32卷1.2㊀试验动物及饲养管理㊀㊀选择体况良好㊁1 1.5周岁㊁体重45kg左右的杜蒙杂交羯羊15只,随机分为3组,每组5只㊂试验动物单笼饲养,自由饮水,统一驱虫㊂每天09:00和17:00各饲喂1次㊂1.3㊀样本采集㊀㊀在正式试验期的第1天晨饲后6h使用口腔采样器采集瘤胃液,经4层纱布过滤,分装于冻存管内液氮速冻后于-80ħ保存㊂1.4㊀瘤胃细菌和产甲烷菌数量的测定1.4.1㊀微生物基因组DNA的提取㊀㊀瘤胃液基因组总DNA的提取参照李子健[14]的十六烷基三甲基溴化铵(CTAB)法㊂1.5%的凝胶电泳检测DNA的完整性,使用酶标仪测定粗提DNA的浓度和纯度㊂1.4.2㊀目的基因的扩增㊀㊀引物委托北京六合华大基因科技有限公司合成,引物信息见表2㊂表2㊀瘤胃细菌和产甲烷菌PCR扩增引物Table2㊀PCRamplificationprimersofruminalbacteriaandMethanogens引物Primers引物序列Primerssequence(5ᶄ 3ᶄ)退火温度Annealingtemperature/ħ扩增长度Amplificationlength/bp总细菌GeneralbacteriaF:CGGCAACGAGCGCAACCCR:CCATTGTAGCACGTGTGTAGCC60130白色瘤胃球菌R.albusF:CCCTAAAAGCAGTCTTAGTTCGR:CCTCCTTGCGGTTAGAACA54175黄色瘤胃球菌R.flavefaciensF:ATTGTCCCAGTTCAGATTGCR:GGCGTCCTCATTGCTGTTAG57173产琥珀酸丝状杆菌F.succinogenesF:GTTCGGAATTACTGGGCGTAAAR:CGCCTGCCCCTGAACTATC56121溶纤维丁酸弧菌B.fibrisolvensF:GCCTCAGCGTCAGTAATCGR:GGAGCGTAGGCGGTTTTAC60121产甲烷菌MethanogensF:CCGGAGATGGAACCTGAGACR:CGGTCTTGCCCAGCTCTTATTC60129甲烷短杆菌MethaneobrevibacteriumF:CCTCCGCAATGTGAGAAATCGCR:TCWCCAGCAATTCCCACCAGTT60130㊀㊀PCR反应体系为25μL,分别为DNA模板2μL,上㊁下游引物各1μL,DNA连接酶12.5μL,无酶水8.5μL㊂反应参数:95ħ预变性5min,95ħ变性30s,退火温度根据菌种设定40s,72ħ延伸40s,40个循环,72ħ5min,4ħ保温㊂扩增产物用1.5%的琼脂糖凝胶检测,使用胶回收试剂盒回收目的片段㊂1.4.3㊀PCR产物的克隆㊀㊀培养基的制备㊁载体的连接㊁阳性质粒转化及蓝白斑筛选方法参见李子健[14],阳性菌落测序委托北京六合华大基因科技有限公司,测序结果在NCBI上进行比对,相似度均达到95%以上,质粒提取试剂盒提取质粒,制作标准曲线㊂提取的质粒用酶标仪测定浓度和纯度,利用下列公式计算拷贝数㊂质粒拷贝数浓度(copies/μL)={6.02ˑ1023(copies/mol)ˑDNA(ng/μL)ˑ10-9/DNAlength(bp)ˑ660[g/(mol㊃bp)]}㊂㊀㊀绝对定量前将样品浓度统一稀释到100ng/μL,每个反应体系中加入同PriemixTaq相同量的荧光染料SYBRGreenⅡ㊂将待测样品的Ct值代入相应的标准曲线得到拷贝数,计算公式如下:拷贝数=MQˑCˑVDSˑV㊂㊀㊀式中:MQ为根据标准曲线计算得到的拷贝数;C为样品基因组DNA浓度(ng/μL);VD为熔解基因组DNA时所用去离子水的体积(μL);S为RT⁃PCR反应中所用DNA的量(ng);V为提取样本基因组DNA时瘤胃液的用量(mL)㊂42726期丽㊀丽等:饲粮中不同水平单宁对绵羊瘤胃细菌㊁产甲烷菌数量和古菌多样性的影响1.5㊀瘤胃古菌多样性的测定1.5.1㊀DNA提取和PCR扩增㊀㊀DNA提取和PCR扩增方法同1.4,引物信息见表3㊂1.5.2㊀IlluminaMiseq平台测序㊀㊀测序工作委托上海美吉生物医药科技有限公司进行,利用Illumina公司的MiseqPE300平台进行测序㊂1.6㊀数据统计与分析㊀㊀数据经Excel2013整理,运用SAS9.0软件的ANOVA过程进行单因素方差分析,多重比较检验采用Duncan氏法,结果表示为平均值ʃ标准差㊂以P<0.05作为差异显著性判断标准㊂表3㊀测序分析采用的引物信息Table3㊀Informationofprimerforsequencinganalysis项目Item上游引物Forwardprimer(5ᶄ 3ᶄ)下游引物Downwardprimer(5ᶄ 3ᶄ)扩增长度Amplificationlength/bp退火温度Annealingtemperature/ħ古菌ArchaeaTGYCAGCCGCCGCGGTAAYCCGGCGTTGAVTCCAATT468552㊀结㊀果2.1㊀饲粮中不同水平单宁对绵羊瘤胃细菌和产甲烷菌数量的影响㊀㊀从表4可以看出,Ⅱ组和Ⅲ组的总细菌㊁白色瘤胃球菌㊁溶纤维丁酸弧菌㊁产琥珀酸丝状杆菌数量显著低于Ⅰ组(P<0.05),Ⅱ组和Ⅲ组间无显著差异(P>0.05)㊂Ⅱ组黄色瘤胃球菌数量显著低于Ⅰ组(P<0.05),Ⅰ组与Ⅲ组㊁Ⅱ组与Ⅲ组间无显著差异(P>0.05)㊂Ⅲ组产甲烷菌和甲烷短杆菌数量显著低于Ⅰ组(P<0.05),Ⅰ组与Ⅱ组㊁Ⅱ组与Ⅲ组间无显著差异(P>0.05)㊂表4㊀饲粮中不同水平单宁对绵羊瘤胃细菌和产甲烷菌数量的影响Table4㊀EffectsofdifferentlevelsoftanninindietsonnumberofrumenbacteriaandMethanogensinsheeplg16SrDNA拷贝数项目Items组别GroupsⅠⅡⅢP值P⁃value总细菌Generalbacteria13.12ʃ0.21a12.42ʃ0.34b12.00ʃ0.56b0.0048白色瘤胃球菌R.albus7.99ʃ0.20a7.39ʃ0.54b7.22ʃ0.19b0.0009黄色瘤胃球菌R.flavefaciens9.41ʃ0.49a8.80ʃ0.29b9.15ʃ0.49ab0.0033溶纤维丁酸弧菌B.fibrisolvens9.04ʃ0.17a8.61ʃ0.32b8.40ʃ0.31b0.0160产琥珀酸丝状杆菌F.succinogenes9.96ʃ0.30a9.11ʃ0.38b9.20ʃ0.47b0.0027产甲烷菌Methanogens8.52ʃ0.61a7.88ʃ0.18ab7.53ʃ0.44b0.0051甲烷短杆菌Methaneobrevibacterium8.91ʃ0.80a8.58ʃ0.35ab7.99ʃ0.27b0.0040㊀㊀同行数据肩标不同小写字母表示差异显著(P<0.05),相同或无字母表示差异不显著(P>0.05)㊂下表同㊂㊀㊀Inthesamerow,valueswithdifferentsmalllettersuperscriptsmeansignificantdifference(P<0.05),whilewiththesameornolettersuperscriptsmeannosignificantdifference(P>0.05).Thesameasbelow.2.2㊀饲粮中不同水平单宁对绵羊瘤胃古菌多样性的影响2.2.1㊀饲粮中不同水平单宁对绵羊瘤胃古菌α多样性的影响㊀㊀测序数据按最小样本序列进行抽平,经过质量控制后各组瘤胃古菌的多样性指数见表5㊂本试验各组测序覆盖度均达到了0.99,满足后续分析要求㊂从15个样本中共得到703996高质量的古菌16SrRNA基因序列,每个样本的平均cleanreads数目为46933,各组间无显著差异(P>0.05)㊂平均分类操作单元(OTU)数目为19,各组间无显著差异(P>0.05)㊂Ⅲ组香农指数显著低5272㊀动㊀物㊀营㊀养㊀学㊀报32卷于Ⅰ组(P<0.05),Ⅰ组与Ⅱ组㊁Ⅱ组与Ⅲ组间无显著差异(P>0.05)㊁Ⅰ组辛普森指数显著低于Ⅱ组和Ⅲ组(P<0.05),其中Ⅱ组又显著低于Ⅲ组(P<0.05)㊂Ⅱ组和Ⅲ组Ace指数显著低于Ⅰ组(P<0.05),Ⅱ组和Ⅲ组间无显著差异(P>0.05)㊂各组间Chao1指数无显著差异(P>0.05)㊂表5㊀瘤胃古菌高通量测序质量控制与样品多样性指数Table5㊀High⁃throughputsequencingqualitycontrolanddiversityindexesofruminalarcheae项目Items组别GroupsⅠⅡⅢP值P⁃valueCleanreads数目Cleanreadsnumber48109ʃ341347383ʃ293345308ʃ56060.9292分类操作单元数目OTUnumber20.80ʃ3.4319.40ʃ3.0919.40ʃ1.410.8678香农指数Shannonindex0.93ʃ0.13a0.83ʃ0.19ab0.61ʃ0.18b0.0130辛普森指数Simpsonindex0.45ʃ0.10c0.56ʃ0.11b0.71ʃ1.78a0.0152Ace指数Aceindex26.80ʃ1.93a20.17ʃ1.37b18.08ʃ1.53b0.0336Chao1指数Chao1index22.60ʃ4.6021.04ʃ4.4021.47ʃ4.100.9162覆盖度Coverage0.990.990.992.2.2㊀饲粮中不同水平单宁对绵羊瘤胃古菌β多样性的影响2.2.2.1㊀瘤胃古菌门㊁科㊁属水平上的物种组成分析㊀㊀各组间瘤胃古菌在门水平上的群落组成无显著差异(P>0.05)(表6),各组优势菌门均为广古菌门,其比例均在98%以上㊂在门水平上未分类的菌门丰度有随单宁水平的增加而下降的趋势㊂各组间瘤胃古菌在科水平上的组成无显著差异(P>0.05),各组的优势菌科均为甲烷杆菌科㊂在科水平上热变形菌科和未分类的菌科丰度均有随单宁水平的增加而下降的趋势㊂表6㊀瘤胃古菌在门㊁科水平上的物种比例(占总古菌比例大于1%)Table6㊀Proportionofruminalarcheaatphylumandfamilylevel(morethan1%oftotalarchea)%项目Items组别GroupsⅠⅡⅢP值P⁃value门Phylum广古菌门Euryarchaeota98.91ʃ3.2398.95ʃ3.5399.01ʃ3.330.5516未分类Unclassified1.09ʃ0.131.05ʃ0.350.89ʃ0.110.5126科Family甲烷杆菌科Methanobacteriaceae98.14ʃ3.1298.30ʃ3.5698.40ʃ3.260.6630热变形菌科Thermoplasmatales_Incertae_Sedis0.76ʃ0.150.65ʃ0.110.60ʃ0.110.5263未分类Unclassified1.09ʃ0.131.05ʃ0.160.09ʃ0.130.5126㊀㊀在属水平上各样本中均为甲烷短杆菌属所占比例最高(图1)㊂由图1可知,在属水平上各组中未分类的菌属所占比例较高,Ⅰ组和Ⅲ组甲烷杆菌在纲以下未进行分类的菌属所占比例比Ⅱ组高㊂2.2.2.2㊀瘤胃古菌菌群落组成主成分分析㊀㊀图2为样本的OTU水平偏最小二乘法判别分析(PLS⁃DA),样本点的空间距离代表样本间的距离㊂主成分COMP1和COMP2在样本差异性贡献率上分别为11.06%和12.05%㊂且各组均被COMP1和COMP2所分开,各组样本不具有相似性㊂3㊀讨㊀论3.1㊀单宁对绵羊瘤胃细菌数量和甲烷生成的影响㊀㊀反刍动物瘤胃微生物群落是一个复杂的整体,瘤胃中饲粮的降解是在细菌㊁真菌㊁古菌㊁原虫等微生物互相 协作 下完成的㊂饲粮中添加单宁会改变绵羊瘤胃中某些菌群数量㊂Tana等[15]研究表明,缩合单宁能够显著降低产甲烷菌数量㊂张梅梅[16]研究发现,饲粮中添加2%和6%的单宁降低了瘤胃总细菌㊁产琥珀酸丝状杆菌㊁黄色瘤胃球菌和产甲烷菌的数量㊂赵薇等[17]研究发现,在62726期丽㊀丽等:饲粮中不同水平单宁对绵羊瘤胃细菌㊁产甲烷菌数量和古菌多样性的影响延边黄牛基础饲粮中添加3%不同相对分子质量的缩合单宁,溶纤维丁酸弧菌和甲烷菌数量显著降低,细菌数量呈下降趋势㊂汪海峰[18]指出,缩合单宁可以改变微生物细胞形态结构㊂本研究得出,饲粮中添加2%和4%单宁显著降低了绵羊瘤胃中总细菌㊁白色瘤胃球菌㊁溶纤维丁酸弧菌㊁产琥珀酸丝状杆菌数量㊂饲粮中添加2%单宁显著降低了黄色瘤胃球菌数量,而添加4%单宁组黄色瘤胃球菌数量也有下降趋势㊂饲粮中添加4%单宁显著降低了绵羊瘤胃中产甲烷菌和甲烷短杆菌数量,而2%单宁组产甲烷菌和甲烷短杆菌数量也有下降趋势㊂本试验结果与上述研究结果一致,其原因可能是单宁改变了瘤胃细菌和产甲烷菌细胞的形态结构,使细胞壁塌陷㊁褶皱[10]㊂单宁对细菌细胞膜的破坏以及结合蛋白质的能力也是导致瘤胃细菌数量发生改变的主要因素之一㊂图1㊀瘤胃古菌属水平上的群落组成Fig.1㊀Communitycompositionofruminalarcheaatgenuslevel图2㊀瘤胃古菌OTU水平PLS⁃DAFig.2㊀PLS⁃DAofrumenarchaeaatOTUlevel㊀㊀古菌作为瘤胃微生物不可或缺的一部分,其作用不可忽视㊂产甲烷菌属于古菌,甲烷是产甲烷菌代谢的最终产物,瘤胃内的产甲烷菌通过共生㊁黏附和伴生模式,分别从原虫㊁细菌和真菌中摄取氢,保证氢营养型甲烷生成途径的顺利进行㊂抑杀原虫和产氢细菌㊁竞争性结合氢和阻断氢生成甲烷[19]㊂甲烷是重要的温室气体,也是新的清洁能源㊂反刍动物甲烷排放会导致能量的损失,也会加重温室效应㊂前人研究指出,反刍动物饲粮中添加缩合单宁会减少甲烷的排放[20]㊂Wag⁃horn等[21]研究表明,饲粮中添加含单宁的豆科牧草可以减少绵羊甲烷排放量㊂Animut等[22]研究表明,在山羊饲粮中添加含缩合单宁的胡枝子会减少甲烷的排放㊂本课题组前期研究表明,柠条来源的单宁可以降低绵羊甲烷排放[13]㊂本研究得出,饲粮中添加4%单宁可以显著降低产甲烷菌和甲烷短杆菌数量,饲粮中添加2%单宁也有降低产甲烷菌和甲烷短杆菌数量的趋势㊂这与上述研究结果相一致,其原因是因为单宁通过减少绵羊瘤胃中产甲烷菌数量而降低甲烷排放量㊂3.2㊀饲粮中不同水平单宁对绵羊瘤胃古菌多样性的影响㊀㊀瘤胃古菌作为瘤胃内微生物的一部分,对反刍动物能量代谢有着积极的作用㊂瘤胃古菌的多样性与反刍动物甲烷的排放量密切相关㊂辛普森指数和香农指数表征微生物群落多样性,群落多样性与辛普森指数呈负相关,与香农指数呈正相关㊂Ace指数和Chao1指数表征微生物群落丰度,群落丰度与Ace指数和Chao1指数均呈正相关㊂Franzolin等[23]研究了水牛瘤胃中甲烷菌多样性,得出甲烷短杆菌属为水牛瘤胃甲烷菌的优势菌属㊂St⁃Pierre等[24]发现反刍动物瘤胃甲烷菌以甲烷短杆菌属为主,其次是甲烷球菌属和热源体属㊂7272㊀动㊀物㊀营㊀养㊀学㊀报32卷Cheng等[25]对山羊瘤胃产甲烷菌进行了多样性分析,得出甲烷杆菌属为山羊瘤胃中主要的产甲烷菌㊂本研究得出,绵羊瘤胃古菌共分为6个属,各组中占比最高的均为甲烷短杆菌属,这与以上研究结果一致㊂林波等[26]研究指出,水牛瘤胃甲烷菌在属水平上的组成不会随着饲粮精粗比的变化而发生改变㊂Saminathan等[27]研究表明,缩合单宁分子量的增加会显著降低黑头黄源肉牛瘤胃产甲烷菌多样性㊂Zhao等[28]研究表明,外界环境和饲粮组成的变化并不会影响反刍动物瘤胃内甲烷菌各水平上的组成㊂本研究得出,饲粮中添加单宁提高了绵羊瘤胃古菌辛普森指数,降低了香农指数和Ace指数,表明单宁降低了瘤胃古菌的群落多样性和菌群丰度㊂这与本试验得出的2%和4%单宁组产甲烷菌菌群数量低于对照组的结果一致㊂结合本课题组前期研究发现的2%和4%单宁组绵羊单位干物质采食量甲烷的排放量低于对照组的结果[13],分析得出单宁可能通过改变瘤胃古菌的群落结构影响产甲烷菌代谢路径减少瘤胃发酵过程中甲烷的生成,其机制还有待进一步研究㊂4㊀结㊀论㊀㊀饲粮中含2%和4%柠条来源的单宁减少了绵羊瘤胃细菌和产甲烷菌数量,降低了瘤胃古菌多样性和菌群丰度㊂参考文献:[1]㊀王兴蕾,梁飘飘,赵敏杰,等.内蒙古阿拉善左旗六种常见沙生植物的营养成分与氨基酸组成分析[J].光谱学与光谱分析,2019,39(1):204-209.[2]㊀史志诚.单宁生物活化理论及其应用[J].江北农业大学学报,1987,17(1):2732.[3]㊀朱南山,张彬,李丽立.单宁的抗营养作用机理及处理措施[J].中国饲料,2006(17):26-29.[4]㊀郑会超,刘建新,吴跃明,等.单宁对反刍动物营养代谢的影响[J].黄牛杂志,2004,30(6):23-25,32.[5]㊀丁学智.单宁酸对瘤胃发酵特性及甲烷产量的影响[D].硕士学位论文.兰州:甘肃农业大学,2006.[6]㊀金龙.紫色达利菊提取缩合单宁对大肠杆菌和瘤胃氮代谢以及瘤胃微生物的影响[D].博士学位论文.哈尔滨:东北农业大学,2011.[7]㊀周奕毅.茶皂素抑制湖羊甲烷生成的微生物学机制研究[D].硕士学位论文.杭州:浙江大学,2009.[8]㊀刘云龙,王炳,刁其玉,等.绵羊甲烷排放规律及减排技术研究[J].饲料工业,2018,39(15):43-47.[9]㊀周怿,刁其玉.反刍动物瘤胃甲烷气体生成的调控[J].草食家畜,2008(4):21-24.[10]㊀王卫云.不同水平的单宁对瘤胃主要纤维降解细菌纤维降解特性和细胞形态结构的影响[D].硕士学位论文.呼和浩特:内蒙古农业大学,2017.[11]㊀ZHOUK,BAOY,ZHAOGY.Effectsofdietarycrudeproteinandtannicacidonrumenfermentation,rumenmicrobiotaandnutrientdigestioninbeefcattle[J].Ar⁃chivesofAnimalNutrition,2019,73(1):30-43.[12]㊀张宏福.动物营养参数与饲养标准[M].3版.北京:中国农业出版社,2010:361,456.[13]㊀王敬尧.单宁对绵羊瘤胃发酵参数㊁营养物质消化率和甲烷排放量的影响[D].硕士学位论文.呼和浩特:内蒙古农业大学,2019.[14]㊀李子健.不同生理阶段奶牛瘤胃细菌菌群数量与多样性的比较研究[D].硕士学位论文.呼和浩特:内蒙古农业大学,2018.[15]㊀TANAHY,SIEOCC,ABDULLAHN,etal.EffectsofcondensedtanninsfromLeucaenaonmethanepro⁃duction,rumenfermentationandpopulationsofmetha⁃nogensandprotozoainvitro[J].AnimalFeedScienceandTechnology,2011,169(3/4):185-193.[16]㊀张梅梅.日粮中添加单宁对绵羊和绒山羊瘤胃细菌数量和多样性影响[D].硕士学位论文.呼和浩特:内蒙古农业大学,2015.[17]㊀赵薇,沈寿东,李成云,等.不同相对分子质量缩合单宁对延边黄牛瘤胃总菌㊁溶纤维丁酸弧菌和产甲烷菌的影响[J].饲料研究,2014(17):53-57.[18]㊀汪海峰.缩合单宁对反刍动物的营养作用[J].中国饲料,2004(12):24-28.[19]㊀金舒文,王佳堃.瘤胃产甲烷菌与其他微生物间的氢传递及其调控研究进展[J].中国畜牧杂志,2019,55(2):1-6.[20]㊀ROTHS,STEINGASSH,DROCHNERW.Minde⁃rungvonmethaneemissionundoptimierungderN⁃versorgungbeiwiederkauerndurchdiebehand⁃lungvonfuttermittelnmitTanninen[M]//BOCKERR.HohenheimerUmwElttagung.Stuttgart:VerlagGunterHeimbach,2002:181-186.[21]㊀WAGHORNGC,TAVENDALEMH,WOOD⁃FIELDDR.Methanogenesisfromforagesfedtosheep[J].ProcessingofNewZealandGrasslandAssocia⁃tion,2002,64:167-171.[22]㊀ANIMUTG,PUCHALAR,GOETSCHAL,etal.Methaneemissionbygoatsconsumingdietswithdif⁃ferentlevelsofcondensedtanninsfromlespedeza[J].AnimalFeedScienceandTechnology,2008,144(3/4):212-227.[23]㊀FRANZOLINR,ST⁃PIERREB,NORTHWOODK,etal.Analysisofrumenmethanogendiversityinwaterbuffaloes(Bubalusbubalis)underthreedifferentdiets[J].MicrobialEcology,2012,64(1):131-139.[24]㊀ST⁃PIERREB,WRIGHTADG.Diversityofgut82726期丽㊀丽等:饲粮中不同水平单宁对绵羊瘤胃细菌㊁产甲烷菌数量和古菌多样性的影响methanogensinherbivorousanimals[J].Animal,2011,7(Suppl.1):49-56.[25]㊀CHENGYF,MAOSY,LIUJX,etal.Moleculardi⁃versityanalysisofrumenmethanogenicArchaeafromgoatineasternChinabyDGGEmethodsusingdiffer⁃entprimerpairs[J].LettersinAppliedMicrobiology,2009,48(5):585-592.[26]㊀林波,梁辛,李丽莉,等.饲粮精粗比对泌乳水牛瘤胃细菌和甲烷菌区系的影响[J].动物营养学报,2016,28(10):3101-3109.[27]㊀SAMINATHANM,SIEOCC,GANHM,etal.Effectsofcondensedtanninfractionsofdifferentmo⁃lecularweightsonpopulationanddiversityofbovinerumenmethanogenicarchaeainvitro,asdeterminedbyhigh⁃throughputsequencing[J].AnimalFeedSci⁃enceandTechnology,2016,216:146-160.[28]㊀ZHAOM,HÜNERBERGM,BEAUCHEMINK,etal.Individualityofruminalmethanogen/protozoapopula⁃tionsinbeefcattlefeddietscontainingdrieddistillers grainwithsolubles[J].ActaAgriculturaeScandinavica,SectionA:AnimalScience,2012,62(4):273-288.∗Correspondingauthor,professor,E⁃mail:da_biao1980@163.com(责任编辑㊀陈㊀鑫)EffectsofDifferentLevelsofTannininDietsonRumenBacteria,MethanogensNumberandRumenArchaeaDiversityinSheepLILi㊀LIDabiao∗㊀WANGJingyao㊀XIEYongfang㊀LIZinan(InnerMongoliaKeyLaboratoryofAnimalNutritionandFeedScience,CollegeofAnimalScience,InnerMongoliaAgriculturalUniversity,Hohhot010018,China)Abstract:Thisexperimentwasaimedtoinvestigatetheeffectsofdifferentlevelsoftanninindietsonruminalbacteriaandmethanogensnumber,aswellasruminalarchaeadiversityinsheep.Atotalof15healthysheepwithweightabout45kgwereselectedandrandomlydividedinto3groups:groupⅠ(controlgroup,withouttannin),groupⅡ(2%tannin)andgroupⅢ(4%tannin),with5sheepineachgroup.Thepre⁃trialperiodwas14daysandtheformaltrialperiodwas60days.At6haftermorningfeeding,rumenfluidwascollectedbyoralsampler,andthenmicrobialDNAwasextractedtomeasurethenumberofruminalbacteriaandmetha⁃nogensbyusingreal⁃timeqPCRandthediversityofruminalarchaeabyusingtheIlluminaMiseqPE300plat⁃form.Theresultsshowedasfollows:1)thenumberofgeneralbacteria,Ruminococcusalbus,ButyrivibriofibrisolvensandFibrobactersuccinogenesofgroupsⅡandⅢweresignificantlylowerthanthoseofgroupⅠ(P<0.05).ComparewithgroupⅠ,thenumberofRuminococcusflavefaciensofgroupⅡwassignificantlydecreased(P<0.05).ThenumberofmethanogensandMethaneobrevibacteriumofgroupⅢweresignificantlylowerthanthoseofgroupⅠ(P<0.05).2)TheAceindexofruminalarchaeaofgroupsⅡandⅢwassignif⁃icantlowerthanthatofgroupⅠ(P<0.05).TheShannonindexofruminalarchaeaofgroupⅢwassignifi⁃cantlylowerthanthatofgroupⅠ(P<0.05).Inaddition,theSimpsonindexofgroupⅢwassignificantlyhigherthanthatofgroupsⅠandⅡ(P<0.05),andSimpsonindexofgroupⅡwassignificantlyhigherthanthatofgroupⅠ(P<0.05).Inconclusion,2%and4%tanninindietscandecreasethenumberofruminalgeneralbacteriaandmethanogens;thecommunityrichnessanddiversityofruminalarchaeaarealsodecreased.[ChineseJournalofAnimalNutrition,2020,32(6):2722⁃2729]Keywords:tannin;sheep;rumen;bacteria;diversity9272。
原核生物多样性

原核生物多样性姓名:学号:专业班级:【摘要】微生物是一群以分解代谢为主的重要生物类群,其生物学多样性十分丰富。
但由于它们的微观性,尤其原核微生物不但形态简单、而且不存在有性生殖,也缺乏化石资料[29]而造成难以对其进行种群数目和数量的统计,因而对微生物的多样性研究远没有宏观生物那样深入和受到重视。
本文根据原核微生物的特性,从其形态结构、进化分支、生理代谢类群、遗传及应用等方面简述了它们的多样性及重要意义,意在引起科学界和全社会对这类生物资源的认识和保护的重视。
【关键词】原核微生物多样性应用原核生物包括细菌、放线菌、衣原体、支原体、立克次氏体和蓝细菌。
(一)、形态结构的多样性以细菌为代表说明原核生物形态结构的多样性:1、细胞壁原核生物经过革兰氏染色,可分为革兰氏阳性菌和革兰氏阴性菌。
革兰氏染色反映的是细胞壁结构的差异。
革兰氏阳性菌细胞壁主要由肽聚糖和磷壁酸组成,其中肽聚糖是细菌特有的成分,而磷壁酸则是革兰氏阳性菌所特有。
革兰氏阴性菌的细胞壁主要是由肽聚糖和脂多糖(LPS)组成。
其中脂多糖为革兰氏阴性菌特有。
2、细胞膜细菌细胞膜有如下功能:控制细胞内外物质交换和运输;壁多糖和荚膜等大分子物质合成场所;氧化磷酸化或光合磷酸化产能基地;鞭毛着生点并提供运动所需能量。
3、细胞质中的内含物细菌细胞质中的内含物主要包括:核糖体,是蛋白质合成的场所;载色体,质膜内陷形成囊状载色体,属内膜系统,是光合细菌光合作用的场所;羧化体,在化能自养细菌中常发现由膜内陷包裹形成的羧化体,是将CO2还原成糖的场所;气泡,水生,无鞭毛的光合细菌细胞内所含众多充满气体的小泡囊,由蛋白质膜包围而成。
4、细菌细胞的特殊结构[30]荚膜:某些细菌细胞壁外包裹的一层胶状结构,统称荚膜。
化学组成多是胞外多糖类,少量蛋白质,常呈粘稠状;鞭毛:某些细菌在体表长出的波曲的长丝状物,是细菌的运动器官;菌毛:是细菌表面的一种纤细、中空、外直、数量多的蛋白质附属物,功能是使菌体细胞粘连在宿主各器官表面。
产甲烷菌的生态多样性及工业应用

2 产甲烷菌的生态多样性
产甲烷菌属于原核生物中的古菌域,具 有其它细菌如好
4期
傅 霖等:产甲烷菌的生态多样性及工业应用
575
分类单元(目) Taxon (Order)
甲烷杆菌目 Methanobacteriales
表1 产甲烷菌系统分类的主要类群及其生理特性[3] Table 1 Properties of major taxa of methanogens [3]
Abstract Methanogens are important extremophiles, which play a key role in the global carbon cycle. Recently, the cultured methanogens are grouped into five orders based on their phylogeny and phenotypic properties. In addition, there are many different habitats in nature for methanogens, such as marine and freshwater sediments, rice-field soils, animal gastrointestinal tracts, mineral and geothermal environment. The ecology of methanogens indicates that the different ecological methanogenic communities have different distribution characteristics, and the metabolic functions of methanogens are affected by different environmental factors. In this paper, the current knowledge methanogens, such as their definition in taxonomy and ecological diversity is reviewed, and some suggestions related to further studies on the application of methanogens in anaerobic biotreatment and biomethanization are provided. Tab 1, Ref 38 Keywords methanogen; classification; ecological diversity; anaerobic biotreatment; biogasification CLC Q939.908
产甲烷菌毒理

产甲烷菌毒理
产甲烷菌是一类能够产生甲烷气体的微生物,通常包括在甲烷生成的生态系统中,如沼气池、湿地和某些动物的胃道中。
这些微生物对环境的甲烷循环具有重要作用。
在正常的环境条件下,产甲烷菌对人体并不具有明显的毒理效应。
然而,在特定情况下,甲烷气体可能对人体产生一些影响。
以下是一些与产甲烷菌及其产物甲烷气体相关的潜在毒理效应:
1.有毒气体释放:产甲烷菌通过代谢产生甲烷气体,而高浓度的甲烷气体在封闭空间内可能导致缺氧。
大量的甲烷气体在空气中积聚可能形成可燃混合物,增加火灾和爆炸的风险。
2.扰乱生态系统:在某些情况下,产甲烷菌的活动可能导致甲烷释放增加,对大气中温室气体的浓度产生影响,从而对气候产生潜在影响。
3.甲烷的生物学效应:高浓度的甲烷气体可能对人体产生麻醉作用,导致头晕、乏力、呼吸困难等症状。
然而,在正常的环境中,人们一般不会接触到高浓度的甲烷气体。
需要注意的是,正常情况下,产甲烷菌在自然界中的存在和活动通常是平衡和有益的。
在工业和生产过程中,如沼气发电、垃圾填埋场等,可以通过控制甲烷的释放来减轻与其相关的潜在风险。
此外,在封闭环境中,特别是需要注意防爆和通风的地方,应谨慎处理产甲烷菌可能导致的甲烷气体释放。
在工业和实验室设置中,相关的安全措施和规范应得到遵循,以确保人员和环境的安全。
2021年黑龙江生物科技职业学院生物制药技术专业《微生物学》期末试卷B(有答案)

2021年黑龙江生物科技职业学院生物制药技术专业《微生物学》期末试卷B(有答案)一、填空题1、在蓝细菌类囊体内存在的光合色素是______和______,在蓝细菌类囊体外表面有藻胆蛋白体,其中有______、______、______三种光合色素。
2、大多数DNA动物病毒的核酸在______复制,蛋白质在______合成,病毒粒子的组装在______完成。
3、细菌的二次生长现象是指当细菌在含有葡萄糖和乳糖的培养基中生长时,优先利用______,当其耗尽后,细菌经过一段停滞期,不久在______的诱导下开始合成______,细菌开始利用______。
该碳代谢阻遏机制包括______和______的相互作用。
4、在用曲法对微生物进行固体培养时,根据培养容器和规模的不同,可把它分为______、______、______、______、______和______等形式。
5、食用菌一般是指可食用的有大型______的高等真菌,分类上主要属于______,其次为______。
6、被誉为微生物学奠基人的是______世纪、______国的______;而细菌学的奠基人则为______国的______。
7、最常见的厌氧菌有① ______,② ______,③ ______,④ ______,⑤ ______,⑥ ______等。
8、细菌沥滤又称细菌冶金,主要分三阶段:______,______,______;其中后一步是关键,它由化能自养细菌______来完成的。
9、微生物菌种保藏的原理是在______、______、______、______和______等环境条件下,使其处于代谢不活泼状态。
10、当前已开发的新型疫苗有______、______、______、______、______和______等。
二、判断题11、形态通常有球状、杆状、螺旋状三类。
在自然界中杆菌最常见,球菌次之,螺旋菌最少。
()12、用白糖配制培养基能满足微生物对一般微量元素的需要。
mcr基因——精选推荐
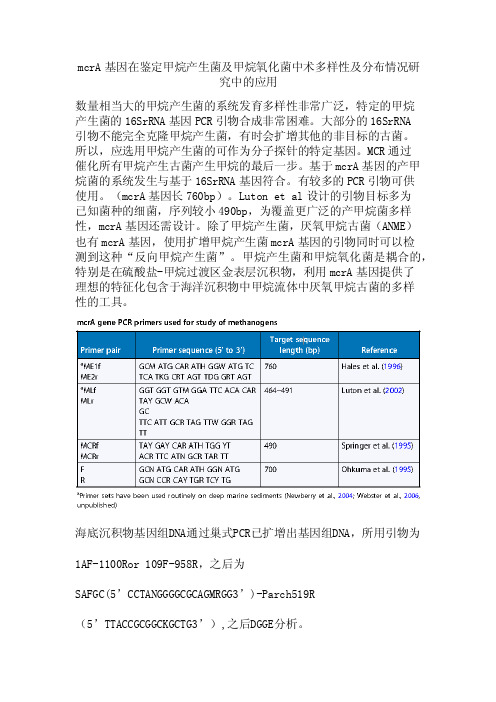
mcrA基因在鉴定甲烷产生菌及甲烷氧化菌中术多样性及分布情况研
究中的应用
数量相当大的甲烷产生菌的系统发育多样性非常广泛,特定的甲烷
产生菌的16SrRNA基因PCR引物合成非常困难。
大部分的16SrRNA
引物不能完全克隆甲烷产生菌,有时会扩增其他的非目标的古菌。
所以,应选用甲烷产生菌的可作为分子探针的特定基因。
MCR通过
催化所有甲烷产生古菌产生甲烷的最后一步。
基于mcrA基因的产甲烷菌的系统发生与基于16SrRNA基因符合。
有较多的PCR引物可供
使用。
(mcrA基因长760bp)。
Luton et al设计的引物目标多为
已知菌种的细菌,序列较小490bp,为覆盖更广泛的产甲烷菌多样性,mcrA基因还需设计。
除了甲烷产生菌,厌氧甲烷古菌(ANME)
也有mcrA基因,使用扩增甲烷产生菌mcrA基因的引物同时可以检
测到这种“反向甲烷产生菌”。
甲烷产生菌和甲烷氧化菌是耦合的,特别是在硫酸盐-甲烷过渡区金表层沉积物,利用mcrA基因提供了
理想的特征化包含于海洋沉积物中甲烷流体中厌氧甲烷古菌的多样
性的工具。
海底沉积物基因组DNA通过巢式PCR已扩增出基因组DNA,所用引物为
1AF-1100Ror 109F-958R,之后为
SAFGC(5’CCTANGGGGCGCAGMRGG3’)-Parch519R
(5’TTACCGCGGCKGCTG3’),之后DGGE分析。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《微生物学》课程论文论文题目:产甲烷杆菌的研究和其利用前景工艺学学院:生命与地理科学学院专业:生物科学班级:S10A学号:20101911131姓名:刘韬成绩:目录1 产甲烷菌的分类................................................................................................................................ -2 -2.产甲烷菌的生态多样性.................................................................................................................... - 2 - 3.生长繁殖特别缓慢.......................................................................................................................... - 3 -4.产甲烷菌代谢途径............................................................................................................................ - 3 -5.甲烷合成的途径................................................................................................................................ - 3 -6.沼气池中产甲烷杆菌和不产甲烷菌的关系.................................................................................... - 4 -6.1不产甲烷细菌为产甲烷菌提供生长基质和产甲烷所需的底物 ......................................... - 4 -6.2不产甲烷细菌为产甲烷菌创造适宜的厌氧环境................................................................. - 4 -6.3不产甲烷细菌为产甲烷菌清除有毒物质............................................................................. - 4 -6.4产甲烷菌为不产甲烷细菌生化反应解除反馈抑制............................................................. - 4 -6.5共同维持沼气发酵环境中的适宜pH值............................................................................... - 5 -6.6不产甲烷细菌构建了产甲烷菌的“古环境” ....................................................................... - 5 -7.产甲烷杆菌的应用前景.................................................................................................................... - 5 -7.1废水处理................................................................................................................................. - 5 -7.2酿酒工业上的应用................................................................................................................. - 5 -7.3产甲烷菌在煤层气开发中的应用......................................................................................... - 6 -8. 结语................................................................................................................................................ - 6 - 参考文献................................................................................................................................................ - 6 -产甲烷杆菌的研究和其利用前景10级生物科学 20101911131 刘韬摘要产甲烷菌是一类重要的极端环境微生物,在地球生物化学碳素循环过程中起着关键作用. 目前,根据产甲烷菌的系统发育和生理生化特性可将已培养的产甲烷菌分为5大目. 产甲烷菌广泛分布在海底及淡水沉积物、水稻田、动物胃肠道、地热及地矿等环境中,生态学研究表明,产甲烷菌在不同的生态环境里具有不同的群落分布特点,并且受不同环境因子的影响而显示出不同的生理代谢功能. 本文综述了国内外近年来产甲烷菌的分类及生态多样性研究进展,同时简述了产甲烷菌在厌氧生物处理和工业酿酒中广阔应用前景.关键词产甲烷菌;分类;生态多样性;废水处理;泸州老窖Methanobacterium research and its prospect Abstract methanogens is an important kind of extreme environmental microbial, in the biogeochemistry of carbon cycle plays a key role in the process. At present, according to the methanogenic bacteria phylogeny and physiological and biochemical characteristics can be cultured methanogens have been divided into 5heads. Methane producing bacteria widely distributed in marine and freshwater sediments rice, water, animal gastrointestinal tract, geothermal and geological environment, ecological studies have indicated, methanogenic bacteria in different ecological environment has different characteristics of community distribution, and affected by different environmental factors and show different physiological and metabolic function. This article reviews the domestic and abroad in recent years and the classification of methane producing bacteria biodiversity research progress, at the same time on the methanogenic bacteria in anaerobic biological treatment and broad application prospects in industrial saccharomyces.Key words methanogens; classification; biodiversity; wastewater treatment; Lu zhou产甲烷菌是一类严格厌氧的原核微生物,是有机物甲烷化作用中食物链的最后一组成员,其独特的厌氧代谢机制使其在自然界物质循环中起着重要作用. 一方面,产甲烷菌是产生温室气体的主要因素,全球甲烷的排放量每年大约是500 t,其中74%是由产甲烷菌代谢产生[1];另一方面,产甲烷菌在有机质的厌氧生物处理工业应用中发挥着关键的作用,如沼气发酵、煤层气开发等. 因此,对产甲烷菌的研究具有重要的理论和实践意义. 随着厌氧培养技术和微生物分子生态技术的发展,更多的实验室能对产甲烷菌进行多角度的研究. 这些研究揭示出产甲烷菌分类地位的多样性,展示出不同环境下产甲烷菌的生态及生理特性的差异性,同时也为产甲烷菌的实际工业应用指明了方向.1 产甲烷菌的分类1776年,Alessandro Volta首次发现了湖底的沉积物能产生甲烷,之后历经一个多世纪的研究,利用有机物产甲烷的厌氧微生物才大致被分为两类:一类是产氢、产乙酸菌,另一类就是产甲烷菌. W.E. Balch等在1979年报道了3个目、4个科、7个属和13个种的产甲烷微生物,他们的分类是建立在形态学、生理学等传统分类特征以及16S rRNA寡核苷酸序列等分子特征基础上的[2].随着厌氧培养技术和菌种鉴定技术的不断成熟,产甲烷菌的系统分类也在不断完善. 《伯杰系统细菌学手册》第9版将近年来的研究成果进行了总结和肯定,并建立了以系统发育为主的产甲烷菌最新分类系统. 产甲烷菌分可为5个大目,分别是:甲烷杆菌目(Methanobacteriales)、甲烷球菌目(Methanococcales)、甲烷微菌目(Methanomicrobiales)、甲烷八叠球菌目(Methanosarcinales)和甲烷火菌目(Methanopyrales) [3],上述5个目的产甲烷菌可继续分为10个科与31个属,它们的系统分类及主要代谢生理特性见表1.2.产甲烷菌的生态多样性产甲烷球菌发现于1982年,生活在260m深、200atm、94℃的海底火山口附近,属于原核生物中的古菌域,具有其它细菌如好氧菌、厌氧菌和兼性厌氧菌所不同的代谢特征. 产甲烷菌的甲烷生物合成途径主要是以乙酸、H2/CO2、甲基化合物为原料[4]. 产甲烷菌在自然界中分布极为广泛,在与氧气隔绝的环境几乎都有甲烷细菌生长,如海底沉积物、河湖淤泥、水稻田以及动物的消化道等. 在不同的生态环境下,产甲烷菌的群落组成有较大的差异性,并且其代谢方式也随着不同的微环境而体现出多样性.3.生长繁殖特别缓慢甲烷细菌生长很缓慢,在人工培养条件下需经过十几天甚至几十天才能长出菌落。
