高中有机化学--糖类
(2012)有机化学-第十四章--糖类

CHO H OH HO H HO H H OH
CH2OH
D-半乳糖
差向异构体:在含有多个手性碳的旋 光异构体中,只有一个手性碳原子的 构型不同,这些异构体之间互称为差 向异构体。
D-葡萄糖与D-甘露糖互为C2差向异构体; D-葡萄糖与D-半乳糖互为C4差向异构体。
(三)单糖的开链结构
D-系列醛糖见图14-1。 自然界常见的糖为D-型,其中D-葡萄糖最
常见,分部最广。几种表示方法见P.261。
*二、葡萄糖的环状结构和 变旋光现象
葡萄糖的的链状结构不能解释如下性质: 1.不能与亚硫酸氢钠加成; 2.存在变旋光现象:糖在水溶液中逐渐改
变其比旋光度,最后达到一个定值的现象。 3.1mol的葡萄糖在干HCl条件下与
HO
1
CH2OH
2C
HO 3C H 4C
OH
β-D-呋喃果糖
(直立氧环式)
1 CH2OH
2
CO
3
HO C H
H 4 C OH
5
H C OH
6
CH2OH
1
HOCH2 OH
2C
HO 3C H O
4
HC
OH
5
HC
6CH2OH
α-D-呋喃果糖 (直立氧环式)
HOH2C O OH HO CH2OH
CHO HO C H
CH2OH
L(-)-甘油醛
CHO H C OH
CH2OH
D(+)-甘油醛
1CHO
H 2 C OH
HO
3
C
H
H 4C OH
H 5C OH 6CH2OH
D-葡萄糖
高中化学选修五第四章糖类知识点

第二节糖类一、糖的组成和分类1、糖的组成:糖类是由C、H、O三种元素组成的一类有机化合物。
糖类的组成通常用通式Cm(H2O)n表示,因而又称为碳水化合物。
2、糖的分类根据糖能否水解及水解产物的多少,可分为:单糖:不能再水解成更简单的糖,如葡萄糖、果糖二糖:每摩尔二糖可水解成两摩尔单糖,如蔗糖、麦芽糖多糖:每摩尔多糖可水解成多摩尔单糖,如淀粉、纤维素【习题一】糖类与我们的日常生活息息相关.关于糖类物质的说法正确的是()A.糖类均有甜味B.淀粉和纤维素均不是糖类C.糖类均不可水解D.糖类都含有C、H和O元素【分析】A.糖类不一定有甜味;B.淀粉和纤维素属于多糖;C.二糖和多糖能水解;D.糖类含有C、H、O三种元素.【解答】解:A.糖类不一定有甜味如多糖,故A错误;B.淀粉和纤维素属于多糖,属于糖类,故B错误;C.二糖和多糖能水解,单糖不能水解,故C错误;D.糖类含有C、H、O三种元素,故D正确。
故选:D。
二、葡萄糖与果糖1、结构(1)葡萄糖分子式:C6H12O6结构简式:CH2OH(CHOH)4CHO实验式:CH2O官能团:醛基(—CHO)、羟基(—OH)葡萄糖是一种多羟基醛,属醛糖。
(2)果糖分子式:C6H12O6结构简式:CH2OH(CHOH)3COCH2OH官能团:酮基(CO)、羟基(—OH)果糖是一种多羟基酮,属酮糖。
总结:葡萄糖与果糖互为同分异构体。
2、化学性质(1)葡萄糖与氢气反应CH2OH(CHOH)4CHO+H2 → CH2OH(CHOH)4CH2OH(己六醇)。
(2)葡萄糖与银氨溶液反应CH2OH(CHOH)4CHO+2Ag(NH3)2OH →CH2OH(CHOH)4COONH4+2Ag↓+H2O+3NH3。
(3)葡萄糖与氢氧化铜悬浊液反应CH2OH(CHOH)4CHO+2Cu(OH)2 → CH2OH(CHOH)4COOH+Cu2O↓+2H2O【习题二】关于葡萄糖的叙述中正确的是()A.它是果糖的同系物B.葡萄糖水解为乙醇和二氧化碳C.葡萄糖既有还原性又有氧化性D.葡萄糖在人体内发生氧化反应,释放能量【分析】A.结构相似,在分子组成上相差一个或若干个H2原子团的物质互称为同系物.注意同系物中的“结构相似”是指物质种类相同,若含有官能团,官能团的种类与数目相同;B.葡萄糖分解为乙醇和二氧化碳;C.醛基既有氧化性又有还原性;D.葡萄糖发生缓慢氧化反应生成二氧化碳和水.【解答】解:A.葡萄糖的结构简式为CH2OH(CHOH)4CHO,果糖的结构简式为CH2OH(CHOH)3COCH2OH,二者结构不相似,故A错误;B.葡萄糖分解为乙醇和二氧化碳,与水不反应,故B错误;C.醛基能被氧化为羧基,能与氢气加成被还原为醇,故C正确;D葡萄糖发生缓慢氧化反应生成二氧化碳和水,释放能量,故D正确。
有机 5.1 糖类

天然高分子化合物,各自的 值不同 值不同, 天然高分子化合物,各自的n值不同 不是同分异构体,并且是混合物。 不是同分异构体,并且是混合物。
(1)淀粉 淀粉
物理性质
白色、无气味、无味道,粉末状物质。 白色、无气味、无味道,粉末状物质。 物质 不溶于冷水, 在热水中能膨胀, 不溶于冷水 在热水中能膨胀 部分溶于 热水, 部分糊化。 热水 部分糊化。 糊化
1、蔗糖/麦芽糖(半药匙)+3mL水→加入新制的氢氧化铜,加热。现象? 蔗糖/麦芽糖(半药匙)+3mL水 加入新制的氢氧化铜,加热。现象? )+3mL
麦芽糖
砖红色沉淀
蔗糖
无砖红色沉淀
说明:麦芽糖是还原性糖, 说明:麦芽糖是还原性糖,蔗糖是非还原性糖
2、蔗糖/麦芽糖(半药匙)+3mL水+3滴稀硫酸→水浴煮沸2min→取出1mL, 蔗糖/麦芽糖(半药匙)+3mL水 )+3mL 滴稀硫酸→水浴煮沸2min→取出1mL, 2min→取出1mL 以氢氧化钠溶液中和到碱性→加入新制的氢氧化铜,加热。现象? 以氢氧化钠溶液中和到碱性→加入新制的氢氧化铜,加热。现象?
12 2.64 × = 0.72 g ~ 0.06mol 44 m(H2O) →m(H), n(H) 2 1.08 × = 0.12 g ~ 0.12mol 18
结论 最简式: 最简式: CH2O 分子式: 分子式:C6H12O6
m(CO2) →m(C), n(C)
最简式
1.8 − (0.72 + 0.12) = 0.96 g ~ 0.06mol
2、与新制Cu(OH)2悬浊液反应 、与新制 医学上用于检验尿糖 3、酯化反应 、 4、加氢还原 、 5、氧化反应 生命活动所需能量的来源 、
果糖简介: 果糖简介:葡萄糖的同分异构体
化学高中糖类知识点

《高中化学糖类知识点全解析》糖类,作为生命活动中重要的有机化合物,在高中化学的学习中占据着重要的地位。
它不仅与我们的日常生活息息相关,更是在生物化学、有机化学等领域有着广泛的应用。
一、糖类的定义与分类糖类,又称为碳水化合物,是多羟基醛、多羟基酮以及它们的脱水缩合物。
根据糖类能否水解以及水解后的产物,可将糖类分为单糖、二糖和多糖。
1. 单糖单糖是不能再水解的糖,如葡萄糖、果糖等。
葡萄糖的分子式为 C₆H₁₂O₆,它是一种多羟基醛,具有还原性,能与银氨溶液发生银镜反应,也能与新制的氢氧化铜悬浊液反应生成砖红色沉淀。
果糖的分子式也为 C₆H₁₂O₆,它是一种多羟基酮,同样具有还原性。
2. 二糖二糖是能水解生成两分子单糖的糖,如蔗糖、麦芽糖等。
蔗糖的分子式为 C₁₂H₂₂O₁₁,它是由一分子葡萄糖和一分子果糖脱水缩合而成,无还原性。
麦芽糖的分子式也为 C₁₂H₂₂O₁₁,它是由两分子葡萄糖脱水缩合而成,具有还原性。
3. 多糖多糖是能水解生成多个分子单糖的糖,如淀粉、纤维素等。
淀粉的分子式为(C₆H₁₀O₅)ₙ,它是由多个葡萄糖分子脱水缩合而成,无还原性。
纤维素的分子式也为(C₆H₁₀O₅)ₙ,它也是由多个葡萄糖分子脱水缩合而成,但与淀粉不同的是,纤维素中的葡萄糖分子是以β-1,4-糖苷键连接的,而淀粉中的葡萄糖分子是以α-1,4-糖苷键连接的。
二、糖类的性质1. 物理性质糖类一般为白色晶体,有甜味,但甜度不同。
单糖和二糖易溶于水,多糖不溶于水,但在一定条件下可与水形成胶体。
2. 化学性质(1)氧化反应单糖中的葡萄糖和果糖具有还原性,能与银氨溶液、新制的氢氧化铜悬浊液等氧化剂发生氧化反应。
(2)水解反应二糖和多糖在一定条件下能发生水解反应。
蔗糖在稀硫酸的作用下,水解生成一分子葡萄糖和一分子果糖;麦芽糖在稀硫酸的作用下,水解生成两分子葡萄糖;淀粉和纤维素在稀硫酸的作用下,水解生成葡萄糖。
(3)酯化反应糖类中的羟基可以与酸发生酯化反应。
糖类-人教版选修5有机化学基础教案

糖类-人教版选修5 有机化学基础教案一、教学目标1.了解糖类的基本概念,分类和结构特征;2.掌握糖类的命名方法及反应类型;3.理解糖代谢的重要性及相关疾病的发生机制;4.能够掌握实验室中制备糖类的方法和分离纯化的技术。
二、教学内容1. 糖类的基本概念和分类•糖类的定义和概念;•糖类的分类及重要代表物种(单糖、双糖、多糖);•糖类的结构特征。
2. 糖类的命名和反应类型•糖类的命名方法(Fischer式、Haworth式);•糖类的光学异构体及演化规律;•糖类的氧化、还原反应和糖苷化反应。
3. 糖的代谢及相关疾病发生机制•糖的消化、吸收、代谢和运输;•糖尿病的发生机理及治疗方法;•糖的营养学价值和相关疾病预防。
4. 糖类的实验室制备和分离纯化•煮沸法制备葡萄糖、果糖、山梨醇等单糖;•化学合成法制备蔗糖、甘露糖等双糖;•生物法制备淀粉、纤维素等多糖;•离子交换法、凝胶过滤法等技术对糖类进行分离纯化。
三、教学方法1.理论教学与实践相结合的方式,通过讲解、示范和实验操作展示糖类的制备和分离纯化方法,让学生了解糖类的性质和应用。
2.发挥学生的主体作用,通过讲解和案例分析等方式激发学生兴趣,培养学生的分析、解决问题的能力。
3.分组讨论,让学生探究糖类的代谢和相关疾病的发生机制,逐步培养学生的科研能力和创新意识。
四、教学评价1.采取定期测试和参与度考核相结合的方式进行教学评价;2.针对学生的情况进行个性化辅导和指导,全面提升学生的学习能力和测评成绩;3.鼓励学生参加有关糖类相关的科研活动和学术会议,激励学生发挥自己的专业优势和个性特点,形成合作、探究和创新的良好氛围。
有机化学基础-糖类
1 有下列物质:①碘水;②银氨溶液;③NaOH 溶液;④稀硫酸;⑤浓硫酸。 在进行淀粉的水解实验(包括检验水解产物及水解是否完全)时,除淀粉外, 还需使用上述试剂或其中一部分,判断使用的试剂及其先后次序为( A.④①③② C.⑤①③② B.①④②③ D.①⑤②③ )。
解析:淀粉的水解需要稀酸溶液作催化剂,要判断水解程度及水解产物时,应 先检验淀粉是否存在,因为所加碘水溶液也呈酸性。然后将上述溶液用 NaOH 溶液中和,使溶液呈碱性,最后加入银氨溶液,若有 Ag 析出则证明水 解产物为葡萄糖。所以所加试剂的顺序为④①③②。 答案:A
C12 H22 O11 +H2O
麦芽糖
2C6 H12 O6 。
葡萄糖
四、淀粉和纤维素
1.淀粉 (1)组成。 通式为(C6H10O5)n,属于天然有机高分子化合物。
(2)性质。 ①不溶于冷水,在热水中形成胶状淀粉糊。 ②水解反应: (3)用途。 淀粉是食物的重要成分,同时还是重要的食品工业原料,葡萄糖转化为 酒精的化学方程式为 C6H12O6 2C2H5OH+2CO2↑。 。
第二节 糖类
你知道糖类在生命活动过程中起着什么作用?我们平常用的作业本中含有 什么? 1.认识糖类的组成和性质特点,能举例说明糖类在食品加工和生物质能源 开发上的应用。 2.通过单糖、二糖、多糖的探究实验,使学生进一步体验对化学物质探究 的过程,理解科学探究的意义,学习科学探究的基本方法,提高科学探究的能 力。
2 下列物质中不属于糖类物质的是( A.CH2OH—CHOH—CHO B.CH2OH—CHOH—CHOH—CH2—CHO C.CH2OH—CHO D.CH2OH—(CHOH)3CO—CH2OH 答案:C
)。
3 可以鉴别乙酸溶液、葡萄糖溶液、蔗糖溶液的试剂是( A.银氨溶液 C.石蕊试液 B.新制氢氧化铜悬浊液 D.碳酸钠溶液
《有机化学》-糖类

H HO H H
OH H OH OH OH
HO H HO H H
H OH H O OH CH 2OH
开链式葡萄糖
β-吡喃葡萄糖(63%)
19:46
α-葡萄糖和β-葡萄糖的哈沃斯式和球棍模型如下:
OH H HO H OH H OH H O OH H
OH H HO H OH H OH H OH OH
α-吡喃葡萄糖
2. 塞利凡诺夫反应
19:46
(四)成苷反应
由于单糖多以环状结构存在,其中环状结构的苷羟基比较活泼,能 够与另1分子糖或非糖中的羟基、氨基等脱水生成缩醛或缩酮。这种 化合物称为糖苷(简称苷)。 糖苷是由糖和非糖部分通过苷键连接而成的一类化合物。糖的部 分称为糖苷基,非糖部分称为配糖基,糖苷基和配糖基之间由氧原子 连接而成的键称为糖苷键(或苷键)。糖苷不具有还原性。
19:46
二、单 糖 的 性 质 (一)氧化反应 1. 银镜反应 2. 班氏试剂反应
CH2OH(CHOH)4CHO +Cu(OH)2 → (CH2OH(CHOH)4COO)2Cu + Cu2O↓ + 2H2O
水
浴
CH2OH(CHOH)4CHO + 2Ag(NH3)2OH CH2OH(CHOH)4COONH4 + 2Ag ↓+NH3↑+ H2O
“碳水化合物”的来源:大多数糖类化合物中氢、氧原子的个数比为2:1,恰如 水的组成。 属于糖类,不符合上述规律:鼠李糖C6H12O5、脱氧核糖C5H10O4 。 符合上述规律,不属于糖类:甲醛CH2O、乙酸C2H4O2 。
糖的本质结构:多羟基醛、酮。 分类:
单糖 葡萄糖、果糖 低聚糖( 2-10个单糖):蔗糖、麦芽糖 多聚糖 (> 10 个单糖):淀粉、纤维素
糖类知识点总结化学

糖类知识点总结化学一、糖的种类1. 单糖单糖是由3至7个碳原子连接在一起形成的分子,最常见的单糖有葡萄糖、果糖和半乳糖等。
单糖按照分子构造可以分为直链式单糖和环状单糖两类,其中环状单糖又可分为葡萄糖型和果糖型两类。
单糖还可以根据光学活性分为D-型和L-型两类。
2. 双糖双糖由两个单糖分子通过糖苷键连接在一起形成,常见的双糖有蔗糖、乳糖和麦芽糖等。
双糖的生成是通过两个单糖分子的缩合反应形成的。
3. 多糖多糖是由多个单糖分子经过缩合反应形成的大分子,常见的多糖有淀粉、纤维素和糖原等。
多糖的结构复杂,可以分为直链多糖和支链多糖两类。
多糖在生物体内有重要的生理作用,是植物细胞壁的主要组成部分,也是动物体内储存能量的主要形式。
二、糖的性质1. 化学性质糖类化合物是碳水化合物的一种,具有醇、醛或酮官能团。
单糖可以发生还原反应,产生醛糖和酮糖,而双糖和多糖则不具有还原性。
2. 物理性质糖类化合物大多为白色结晶性固体,溶解于水后呈甜味。
双糖和多糖在水溶液中能够产生旋光性,而单糖可以通过酶的作用将直链构象转变为环状构象。
三、糖的结构1. 单糖的结构单糖的一般式为(CH2O)n,n为3至7之间的整数。
单糖的结构中含有羟基和半乳糖基,不同的单糖之间在立体结构上存在差异,因此它们会呈现出不同的化学性质和生物作用。
2. 双糖和多糖的结构双糖和多糖是由多个单糖分子通过糖苷键连接在一起形成的大分子,它们的结构复杂,包括直链式和支链式两类。
双糖和多糖的结构决定了它们的生理功能和生物活性。
四、糖的生物作用糖类是生物体内的主要能量来源,通过代谢过程,葡萄糖可以被分解为丙酮酸和丙酸,产生大量的ATP分子,为细胞提供能量。
2. 糖原和淀粉的储存糖原是动物体内的主要能量储备物质,存储在肝脏和肌肉组织中,当体内需要能量时,糖原可以迅速被分解为葡萄糖进行能量代谢。
而淀粉是植物体内的能量储备物质,主要储存在种子、根茎和果实等部位。
3. 结构组成糖类是植物细胞壁的主要组成部分,纤维素是由葡萄糖分子通过β-1,4-糖苷键连接而成,它赋予植物细胞壁良好的稳定性和结构支撑。
高三有机化学复习《糖类、蛋白质》

高三有机化学复习§12 糖类一、糖类的结构和组成(1)糖类的结构:分子中含有多个羟基、醛基的多羟基醛,以及水解后能生成多羟基醛的由C、H、O组成的有机物.糖类根据其能否水解以及水解产物的多少,可分为单糖、二糖和多糖单糖:;低聚糖:;多糖:;(2)糖类的组成:糖类的通式为Cn(H2O)m,对此通式,要注意掌握以下两点:①该通式只能说明糖类是由C、H、O三种元素组成的,并不能反映糖类的结构;②少数属于糖类的物质不一定符合此通式,如鼠李糖的分子式为C6H12O5;反之,符合这一通式的有机物不一定属于糖类,如甲醛CH2O、乙酸C2H4O2等.(3)相互转化关系:(请用箭头表示相互转化关系)多糖————二糖———单糖二.单糖1、葡萄糖(1)自然界中的存在:葡萄和其他带甜味的水果中,以及蜂蜜和人的血液里.(2)结构:分子式为C6H12O6(与甲醛、乙酸、乙酸乙酯等的最简式相同,均为CH2O),其结构简式为:CH2OH-(CHOH)4-CHO,是一种多羟基醛.(3)化学性质:兼有醇和醛的化学性质.a.还原性:基的性质与新制的银氨溶液反应;与新制的氢氧化铜反应:b.加成反应:基的性质与氢气反应:c.酯化反应;基的性质与乙酸的反应:d.发酵反应:(制酒精)e.生理氧化:【用途】①是一种重要的营养物质,它在人体组织中进行氧化反应,放出热量,以供维持人体生命活动所需要的能量;②用于制镜业、糖果制造业;③用于医药工业.体弱多病和血糖过低的患者可通过静脉注射葡萄糖溶液的方式来迅速补充营养.2、果糖:①.分子式: ②结构简式:和结构特点:③.与葡萄糖的关系: ④.性质:四、多糖——淀粉和纤维素(1)多糖:由许多个单糖分子按照一定的方式,通过分子间脱水缩聚而成的高分子化合物.淀粉和纤维素是最重要的多糖.(2)高分子化合物;即相对分子质量很大的化合物.从结构上来说,高分子化合物通过加聚或缩聚而成.判断是否为高分子化合物的方法是看其化学式中是否有n值(叫做聚合度),如聚乙烯卡CH:一CH2头、淀粉(C6H10O5)n等都是高分子化合物.通过人工合成的高分子化合物属于合成高分子化合物,而淀粉、纤维素等则属于天然高分子化合物.说明在用稀H2SO4作催化剂使蔗糖、淀粉或纤维素水解而进行银镜反应实验前,必须加入适量的NaOH溶液中和稀H2SO4,使溶液呈碱性,才能再加入银氨溶液并水浴加热.【例题解析】【例1】为鉴别乙醇、乙酸、葡萄糖溶液,选用一种试剂,可为下列中的A.钠B.硝酸C.碘D.新制氢氧化铜【例2】将蔗糖溶于水,配成10%的溶液,分装在两个试管中,在第一支试管中加入银氨溶液,在水浴中加热,没有变化,原因是蔗糖分子中;在第二支试管中,加入几滴稀H2SO4,再在水浴中加热,加NaOH中和酸后也加入银氨溶液,现象是,原因是,稀硫酸的作用是。
《有机化学—— 糖类》PPT课件

Special lecture notes
从冷乙醇中得到的
葡萄糖晶体
水溶液
比旋光度+112°
葡萄糖 水溶液
比旋光度+52.7°
从热吡啶中得到的
葡萄糖晶体
水溶液
比旋光度+18.7°
旋光性化合物溶液的旋光度自行改变直至达到恒 定值的现象称为变旋光现象
(2)葡萄糖的环状结构
Special lecture notes
(四)成苷反应
Special lecture notes
环状结构单糖的苷羟基与另一分子化合物中的活
泼氢脱水,生成的化合物称为糖苷,这种反应称为成
苷反应
CH2OH
H
OH
H
OH H
OH
OH
H OH
CH2OH
+2 CH3OH 干 燥 H Cl
H
O OH
H
OH H
OH
H
H OH
D-葡萄糖
CH2OH
H
OH
生成脎是α-羟基醛或α-羟基酮的特有反应。单糖和过量的 苯肼一起加热即生成糖脎
C H O
C H =N -N H -C 6H 5
C H 2O H
HCO H
C =N -N H -C 6H 5
C = O
H O HC CH O HH 2N - N H - C 6H 5H H OC CH O H
H 2N - N H - C 6H 5H H OC CH O H
6CH2OH H 5 OH
H 4 OH H 1
OH
3
OH
2
H OH
哈 沃 斯 式
D-(+)-吡 喃 葡 萄 糖
高中有机化学--糖类.ppt

A、乙醇萄糖
合理膳食
健
经常运动
康 寄
保持身体健康
语
让爱你的人放心
一.糖类的概念及分类 1 .定义: 糖类是指 多__羟_基__醛 多__羟_基_酮_ 以 及能水解生成它们的物质。
说明:(1)糖类是绿色植物光合作用的产
物,糖类不都是甜的。我们食用的蔗糖是甜的, 它只是糖类中的一种。淀粉、纤维素均不甜,但 它们也属于糖类。有些有甜味的物质,如糖精, 不属于糖类。
(3) 葡萄糖的用途
1. 营养 物质
3. 制药 工业
2. 镀银 工业
4、 制酒 工业
【乐于关注】
糖尿病称为现代 疾病中仅次于癌症的 第二杀手,全世界糖 尿病患者约有1.25亿 人,我国的糖尿病患 者已超过4000万人。
防治糖尿病的关 键在哪里?
【善于思考】
合理膳食是防治糖尿 病的关键。
糖尿病人是否就不能 吃甜食了呢?
②此通式适用于大多数糖类化合物,而
对少数糖类物质不适合,如鼠李糖化学式为 ___C_6_H_1_2_O_5____,脱氧核糖化学式为_C__5_H___1_0_O___4_ 。 有些符合此通式的物质并不是糖类,如
__甲__醛___C__H_2_O__,,乙__酸___C_2_H__4O__2_,
___乳__酸___C_3_H__6O__3__等。
③
葡萄糖与新制氢氧化铜反应生 成绛蓝色溶液,加热产生砖红 色沉淀。
分子中含有一个醛 基,且有多个羟基
④ 在一定条件下,1. 80 g (0.01mol) 葡萄糖与0.05mol乙酸完全酯化。
每个分子中含 有5个羟基
⑤ 葡萄糖可以被还原为直链己六醇 6个碳排成直链
关于葡萄糖分子结构的结论:
糖类基础知识点总结

糖类基础知识点总结一、糖类的分类糖类是一类碳水化合物,主要包括单糖、双糖和多糖三大类。
单糖是由简单的碳水化合物分子组成的,例如葡萄糖、果糖、半乳糖等。
双糖是由两个单糖分子通过酶反应而形成的,例如蔗糖(由葡萄糖和果糖组成)、乳糖(由葡萄糖和半乳糖组成)等。
多糖是由多个单糖分子通过酶反应而形成的,例如淀粉(由α-葡萄糖分子组成)、纤维素(由β-葡萄糖分子组成)等。
二、糖类的结构糖类的分子结构包括碳、氧、氢三种元素,通常以化学式(CH2O)n 表示,其中 n 为一个整数。
单糖的分子结构主要由一个环状的六碳或五碳骨架构成,它们的结构不同主要取决于羟基的位置。
双糖和多糖则由多个单糖分子通过酶反应而形成,它们的分子结构通常比较复杂。
三、糖类的代谢糖类在人体内的代谢过程主要包括消化、吸收和利用三个过程。
在消化过程中,食物中的淀粉和糖类会被唾液和胃液中的酶分解为单糖,然后在小肠中被吸收进入血液循环。
在吸收过程中,单糖通过小肠黏膜上的细胞膜转运蛋白被吸收到血液中,然后在利用过程中,单糖在细胞内经过一系列酶反应被氧化分解,产生能量和二氧化碳。
四、糖类的应用糖类在食品工业、医药工业和生物工业中有着广泛的应用。
在食品工业中,糖类是一种重要的食品添加剂,可以增加食品的甜味、口感和保存时间,同时也被用于食品加工和饲料生产。
在医药工业中,葡萄糖和果糖等单糖被用于制备口服补液和输液等,而多糖则被用于制备口服补液和糖皮质激素等。
在生物工业中,糖类被用于生物发酵和细胞培养等,例如利用葡萄糖作为细胞培养基的碳源。
总之,糖类是一类重要的碳水化合物,它们在食品工业、医药工业和生物工业中都有着重要的应用。
通过对糖类的分类、结构、代谢和应用等方面的了解,可以更好地掌握糖类基础知识,为相关领域的研究和应用奠定基础。
有机化学-第13章 糖类

xCO 2 + yH 2 O
光
叶绿素
C x (H 2 O) y + xO 2
Cx(H2O)y + xO2
xCO2 + yH2O + 能量
C、H、O组成,通式Cm(H2O)n,
不符合碳水比例的糖:
鼠李糖 C5H12O5(甲基糖);脱氧核糖 C5H10O4
符合碳水比例的非糖:
甲醛(CH2O)、乙酸(C2H4O2)、乳酸(C3H6O3)
b-D-葡萄糖
甲基-b-D-葡萄糖苷 b-糖苷
CH2OH O O H OH H OH OH
OH
CH2OH O H H HO OH OC2H5 OH
水杨苷 b-糖苷 ROH + 糖
H+ H2 O
乙基--D-葡萄糖苷 -糖苷
-糖苷 麦芽糖酶
糖+ROH
b-糖苷
苦杏仁酶 糖+ROH
D-(+)-葡萄糖
D-吡喃葡萄糖
羰基碳原子变成手性碳原子
O HO H HO H H C H OH H OH O C H H OH H HO H OH H O H H2C OH H H HO H H C OH OH H OH O
H2C OH
H2C OH
63% [] =+19°
0.1% [] =+52°
第十三章
糖 类
Carbohydrates
一个羰基共多羟, 古误碳水今为糖。 单糖缩聚糖苷键, 植物动物贮能量。
本章学习要求
1. 了解糖的来源和糖的分类;
2. 掌握单糖、二糖及多糖的结构和性质,
3. 掌握单糖的开链式、氧环式和Haworth
式的画法.
有机化学大一糖类知识点

有机化学大一糖类知识点糖类是一类在生物界中广泛存在的有机化合物,它们是构成生物体的重要成分,也是能量的重要来源。
在大一有机化学的学习中,糖类作为一个重要的知识点,需要我们了解其结构、分类和一些重要的反应。
本文将介绍有机化学大一糖类知识点的主要内容。
一、糖类的结构糖类的结构非常多样化,但它们都由一个或多个单糖单元组成。
单糖是最简单的糖类,由3-7个碳原子和伴随的羟基组成。
常见的单糖包括三碳糖丙酮糖、五碳糖葡萄糖和六碳糖果糖等。
多糖是由许多单糖单元通过糖苷键连接而成,如葡聚糖和淀粉等。
二、糖类的分类根据单糖的化学性质,糖类可以分为单糖、双糖和多糖三个类别。
单糖是由一个单糖单元组成,双糖则由两个单糖单元通过糖苷键连接而成,多糖则由许多单糖单元组成。
三、糖类的重要反应1. 缩醛反应:糖类中的部分羟基在酸性条件下可以发生缩醛反应,生成醛酮官能团,这是糖类重要的识别反应之一。
2. 试剂检验:糖类可以通过加入试剂进行检验。
比如用硝酸银试剂检测存在于糖中的醛基,形成银镜反应,可以判断糖的还原性,如果糖和葡萄糖是还原糖。
3. 水解反应:多糖可以通过水解反应将多个单糖单元分解为单糖,如酶催化下的淀粉水解。
酶催化水解是生物体分解多糖的主要途径。
4. 光学活性:糖类中的单糖和双糖分子可以存在手性中心,因而具有旋光性质。
通过旋光仪可以测定旋光度,来判断糖类的旋光性质。
四、糖类在生物体中的作用糖类在生物体中具有重要的作用。
首先,糖类是生物体的主要能量来源,通过糖酵解和呼吸作用释放能量。
其次,糖类参与细胞膜的结构,并参与了生物粘附和识别过程。
此外,糖类还是核酸和脂肪的结构单位,为生物体提供了重要的物质基础。
总结:有机化学大一糖类知识点主要包括糖类的结构、分类和一些重要的反应。
糖类是生物体的重要成分之一,对于生命过程具有重要的作用。
通过学习糖类的知识,我们可以更好地理解生物体的结构和功能,为进一步研究生命科学奠定基础。
以上就是有机化学大一糖类知识点的主要内容。
有机化学基础知识点糖类的结构和性质

有机化学基础知识点糖类的结构和性质糖类是有机化合物中最常见的一类物质,广泛存在于自然界和生物体内。
它们不仅是重要的营养物质,也在生物体内担任着重要的功能角色。
本文将就糖类的结构和性质进行详细的讨论。
一、糖类的结构糖类的基本结构可以归纳为单糖、双糖和多糖三种类型。
单糖是最简单的糖类,包括三种常见的单糖:葡萄糖、果糖和半乳糖。
它们的分子式均为C6H12O6,但它们的结构却有所不同。
葡萄糖和果糖都是环状的结构,而半乳糖则是线性结构。
双糖是由两个单糖分子通过缩合反应形成的,比如蔗糖和乳糖。
多糖是由多个单糖分子缩合而成,常见的有淀粉和纤维素。
二、糖类的性质1. 溶解性: 糖类常用作食品中的添加剂,如砂糖和蜂蜜。
它们具有良好的溶解性,尤其是在水中能够迅速溶解。
这也是为什么糖类常被用于制作饮料、甜点等食品的原因。
2. 甜味: 糖类具有独特的甜味,是许多食物中不可或缺的调味品。
这是由于糖类分子中含有许多羟基,能够与味蕾上的受体相结合,从而引起甜味感觉。
3. 反应性: 糖类具有一定的反应性,可以与其他物质产生化学反应。
例如,糖类能够与氨基酸缩合形成糖基化合物,这在生物体内起着重要的作用。
此外,糖类还可以与氧化剂反应发生糖的焦糖化反应,生成焦糖色素。
4. 发酵性: 糖类可以被微生物发酵产生酒精和二氧化碳。
这也是为什么糖类常被用于酿造过程中的原因。
在酵母菌的作用下,糖类可以转化为乙醇和二氧化碳,并且在此过程中释放能量。
5. 构象异构性: 糖类分子的立体结构存在构象异构性。
例如,在溶液中,葡萄糖分子可以存在α型和β型两种构象。
这种构象异构性对于糖类的生物活性和化学性质都有一定的影响。
综上所述,糖类作为有机化合物的一类,其结构和性质的研究对于我们了解生物体内的基本过程和化学反应机制具有重要意义。
通过对糖类结构和性质的深入研究,我们可以更好地理解糖类在生物体内的作用,从而为相关领域的研究和应用提供基础支持。
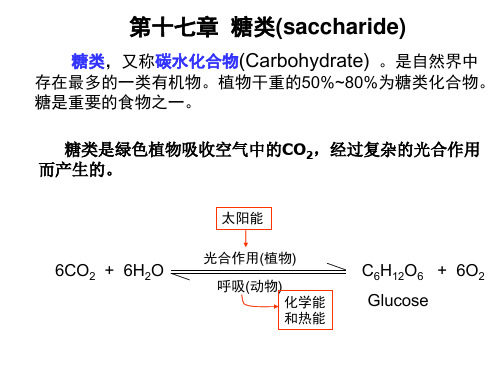
有机化学:第十七章 糖类(saccharide)
OH
O
O
糖类分子中既有C=O,又在g- 或 d-位存在—OH, 故可发生分子内羟醛缩合反应,形成环状半缩醛。
糖的环状半缩醛较稳定,通常为四碳一氧的五元 杂环(呋喃糖)或五碳一氧的六元杂环(吡喃糖)。羰基 碳变成手性中心,故有α、β两种异构体。这种仅端 基不同的异构体称端基异构体或异头物。
该环状结构式称为
在右——D-构型糖,在左——L-构型糖。
D-甘油醛
L-葡萄糖 D-葡萄糖
二. 单糖的环状结构及构象
单糖是多羟基醛(酮)的开链结构,得到了一些化学反 应的证实。但单糖的其它一些性质却是开链结构不能解释的。
(1) 单糖晶体IR谱无羰基的伸缩振动峰;醛糖PMR谱 无醛氢的特征峰。
谱图中1800~1600cm-1处无吸收峰,表明测不出羰基; 2700cm-1附近也无吸收峰,表明未测出醛基氢—CHO;
方法1:可以用R/S构型(复杂)。如两个葡萄糖:
1
2
1为:(2S,3R,4S,5S)-2,3,4,5,6-五羟基己醛 2为:(2R,3S,4R,5R)-2,3,4,5,6-五羟基己醛
方法2:同一对对映体之间,用D/L构型命名法加以区别。
(1) 醛糖或酮糖按严格的Fischer投影式书写,竖线 表示碳链,羰基具有最小编号。 (2) 以D-甘油醛为标准。编号最大的手性碳的-OH
C6H12O6 + 6O2 Glucose
绝大多数糖类分子由C、H、O三中元素组成,大多 数化合物具有通式Cn(H2O)m,但有些糖[鼠李糖 (C6H12O5)]并不符合这个通式。因此碳水化合物只 是沿用习惯的称呼。
定义:糖类是一类多羟基醛、酮以及通过
水解产生这些醛酮的物质。
如葡萄糖的结构为:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
___乳__酸___C_3_H__6O__3__等。
24
事实上,葡萄中还有一种糖。它比葡萄糖甜得多, 是天然存在的糖中最甜的一种。它的代谢不需要胰岛素 的调节,因此对糖尿病患者无害。
23
① 糖分子中的H、O原子并不是结合成
水分子形式存在,它只能说明糖类由__C__、 __H___、__O___三种元素组成。
②此通式适用于大多数糖类化合物,而 对少数糖类物质不适合,如鼠李糖化学式为 ___C_6_H_1_2_O_5____,脱氧核糖化学式为_C___5_H__1_0_O___4_ 。 有些符合此通式的物质并不是糖类,如
合理膳食是防治糖尿 病的关键。
糖尿病人是否就不能 吃甜食了呢?
行是知之始,知是行之成.——陶行知
17
练习
1. 关于葡萄糖的下列说法中,错误的
是
(D )
A. 葡萄糖具有醇羟基,能和酸发
生酯化反应
B. 葡萄糖能使溴水褪色
C. 葡萄糖能被硝酸氧化
D. 葡萄糖可被还原为1-己醇
18
2. 在一定的条件下,既可以发生氧
化反应,又可以发生还原反应,又
可以和酸发生酯化反应的是(D)
A、乙醇
B、乙醛
C、乙酸
D、葡萄糖
19
合理膳食 经常运动 保持身体健康
语健 康 寄
让爱你的人放心
20
21
22
一.糖类的概念及分类 1 .定义: 糖类是指 多__羟_基__醛 多__羟_基_酮_ 以 及能水解生成它们的物质。
说明:(1)糖类是绿色植物光合作用的产
醛基: ①与银氨溶液水浴加热反应,出现银镜
②与新制Cu(OH)2加热,产生红色沉淀
羧基: ①与Na2CO3或NaHCO3反应产生CO2 ②使紫色石蕊试剂变红或使用PH试纸检测 ③与新制Cu(OH)2悬浊液反应,溶解成蓝色 溶液
醇羟基: 与Na反应放出氢气
7
实验验证
2 ml10%氢 加入5~6滴5% 蓝色氢氧化 氧化钠溶液 的硫酸铜溶液 铜悬浊液
葡萄糖
H = -2804kJ/mol
15
(3) 葡萄糖的用途
1. 营养 物质
3. 制药 工业
2. 镀银 工业
4、 制酒 工业
16
【乐于关注】
糖尿病称为现代 疾病中仅次于癌症的 第二杀手,全世界糖 尿病患者约有1.25亿 人,我国的糖尿病患者 已超过4000万人。
防治糖尿病的关 键在哪里?
【善于思考】
③
葡萄糖与新制氢氧化铜反应生 成绛蓝色溶液,加热产生砖红 色沉淀。
分子中含有一个醛 基,且有多个羟基
④ 在一定条件下,1. 80 g (0.01mol)葡 萄糖与0.05mol乙酸完全酯化。
每个分子中含 有5个羟基
⑤ 葡萄糖可以被还原为直链己六醇 6个碳排成直链
关于葡萄糖分子结构的结论:
CH2—CH—CH—CH—CH—CHO
(水解得2mol单糖)
根据能否水解 多糖:淀粉、纤维素 (C6H10O5)n
及水解产物多
(水解得多mol单糖)
少
4
糖类的相互转化
(2~10)
低聚糖
缩合
缩合
水解
水解
单糖
缩聚
水解
多糖 ( >10)
5
研究过程 --葡萄糖的分子式
实验事实
结论
① 1.80g葡萄糖完全燃烧,只得到 0.06molCO2和0.06molH2O
振荡
绛蓝色溶液
加入1ml10% 的葡萄糖溶液
加
振荡
实验事实:多羟基化合物热与
新制 Cu(OH)2悬浊液反应 生成绛蓝色溶液
砖红色沉淀有醛基8ຫໍສະໝຸດ 实验事实结论①
1.80 g葡萄糖完全燃烧,只得到 0.06mol二氧化碳和0.06mol水。
实验式:CH2O
② 葡萄糖的相对分子质量为180。 分子式: C6H12O6
物,糖类不都是甜的。我们食用的蔗糖是甜的,
它只是糖类中的一种。淀粉、纤维素均不甜,但
它们也属于糖类。有些有甜味的物质,如糖精,
不属于糖类。
(2)糖类是由C、H、O三种元素组成的有
机化合物,大多数糖符合通式___C__m_(_H_2_O_)_n___。 所以糖类以前又称碳水化合物。实际上这种叫法
不科学,在学习中对通式的理解应注意:
与H2加成反应
11
1、写出葡萄糖与银氨溶液发生反应的化学方程式 CH2OH(CHOH)4CHO+2 Ag(NH3)2OH △
2Ag +CH2OH(CHOH)4COONH4+3NH3 +H2O
2、写出葡萄糖与新制Cu(OH)2溶液反应的化学 方程式
CH2OH(CHOH)4CHO+2Cu(OH)2 CH2OH(CHOH)4COOH+Cu2O +2H2O
实验式为CH2O
② 葡萄糖的相对分子质量为180 分子式:C6H12O6
葡萄糖分子式: C6H12O6
根据葡萄糖的分子式C6H12O6,从不饱和度和 含有氧元素两个角度,猜测葡萄糖可能的结构和
官能团,并说出检验官能团的方法?
6
可能结构:成环、碳碳双键 醛基、羰基、 羧基、酯基 羟基、醚键
碳碳双键: 使酸性高锰酸钾或溴水褪色
第二节 糖类
1
2
思考提问: 1、什么是糖?大自然中糖类的来源是什么? 2、以前糖类又称碳水化合物。这种叫法科学 吗? 3、是否所有糖都有甜味? 4、糖是怎样分类的?如何进行相互转化?
3
低聚糖:由2~10个单糖缩合而成,以蔗糖,麦芽糖等最普遍
分类
单糖:葡萄糖、果糖 C6H12O6
(不能水解)
二糖:蔗糖、麦芽糖 C12H22O11
OH OH OH OH OH
9
葡萄糖三维图 10
(1)葡萄糖的分子结构 分子式:C6H12O6
结构简式:
(2)葡萄糖的化学性质CH2OH(CHOH )4CHO
酯化反应
银镜反应
醇羟基的性质
与Na反应 消去反应
醛基的性质 与新制Cu(OH)2 悬浊液反应
—OH
分子间脱水
被氧化
与HX发生取代反应 被氧化
12
【走近生活】酒的酿造
情景一:有些家庭自家酿制葡萄酒,你知道
用葡萄酿酒的原理吗?
葡萄糖生物发酵产生乙醇:
酒化酶
C6H12O6 → 2C2H5OH+2CO2↑
葡萄糖
13
【走近生活】 无氧呼吸
情景二:长时间坐着写字会感到腰、肩酸
痛。很久没有运动,偶尔去登山,第二天
必定小腿酸胀得厉害。你能解释产生这些
现象的原因吗?
酶
C6H12O6
葡萄糖
2 CH3CHCOOH
OH
为了避免乳酸堆积,最好经常活动身体,促进血液与含有 充分营养和氧气的新鲜血液的交换。
14
【走近生活】 有氧呼吸
情景三:当人生病时,常常注射葡萄糖溶液起
什么作用?
C6H12O6(s) + 6O2(g) 酶 6CO2(g) + 6H2O(l)
