沉淀的形成和沉淀条件的选择培训资料
第5章 5.3沉淀的形成与沉淀条件
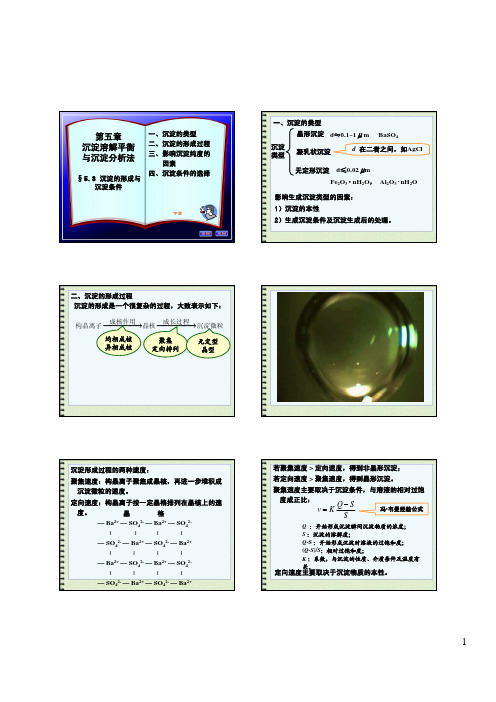
二、沉淀的形成过程 沉淀的形成是一个很复杂的过程,大致表示如下:
成核作用 成长过程 构晶离子 晶核 沉淀微粒
均相成核 异相成核
聚集 定向排列
无定型 晶型
沉淀形成过程的两种速度: 聚集速度:构晶离子聚集成晶核,再进一步堆积成 沉淀微粒的速度。 定向速度:构晶离子按一定晶格排列在晶核上的速 度。 晶 格 — Ba2+ — SO42- — Ba2+ — SO42| | | | — SO42- — Ba2+ — SO42- — Ba2+ | | | | — Ba2+ — SO42- — Ba2+ — SO42| | | | — SO42- — Ba2+ — SO42- — Ba2+
1
三、影响沉淀纯度的因素 1、 共沉淀 在操作条件下,某些物质本身不能单独析出沉 淀,当溶液中产生沉淀时,它便随同生成的沉淀 一起析出。 共沉淀的几种类型: 1)表面吸附 由于在沉淀表面上吸附了杂质而使沉淀玷污的 现象。 原因:处于沉淀表面的离子的电荷作用力未完电 层 — Ba2+ — SO42- — Ba2+ — SO42- …. Ba2+…. Cl| | | | — SO42- — Ba2+ — SO42- — Ba2+ | | | | — Ba2+ — SO42- — Ba2+ — SO42-…. Ba2+…. Cl| | | | — SO42- — Ba2+ — SO42- — Ba2+ 吸附层 扩散层
一、沉淀的类型
第五章 沉淀溶解平衡 与沉淀分析法
§5.3 沉淀的形成与
沉淀条件
一、沉淀的类型 二、沉淀的形成过程 三、影响沉淀纯度的 因素 四、沉淀条件的选择
《分析化学》知识点沉淀法概述

引言概述:分析化学是化学的一个重要分支,通过对物质的成分和结构进行分析和鉴定,从而了解物质的性质和变化规律。
其中,沉淀法作为一种基本的分析方法,被广泛应用于物质的分离与鉴定。
本文将围绕着《分析化学》中的知识点——沉淀法展开深入的探讨。
正文内容:1.沉淀法的基本原理1.1沉淀的形成沉淀的形成机制沉淀的条件与影响因素1.2沉淀物的鉴定及其性质沉淀物的形态与颜色沉淀物的溶解度沉淀物的化学性质与反应2.沉淀和驱动力2.1沉淀的原理溶液中沉淀的动力学沉淀的平衡条件2.2驱动力对沉淀的影响pH值对沉淀的影响温度对沉淀的影响沉淀速度与超饱和度的关系3.沉淀法的应用及实验操作3.1重金属离子的沉淀法分析镉离子的沉淀法铅离子的沉淀法3.2硫酸盐的沉淀法分析硫酸钡沉淀法硫酸钠沉淀法3.3沉淀法的实验操作技巧沉淀滤液的过滤与洗涤沉淀物的收集与干燥沉淀法实验中的注意事项4.沉淀法的优缺点及改进措施4.1沉淀法的优点简单易行成本较低可以分离不同化合物4.2沉淀法的缺点沉淀物的纯度较低有一定的选择性4.3改进措施应用配位复合物来提高沉淀物的纯度控制温度和pH值来提高选择性5.沉淀法与其他分析方法的比较和结合应用5.1与滴定法的比较原理的不同应用的领域差异5.2与光谱分析的结合应用红外光谱分析与沉淀法紫外可见光谱分析与沉淀法总结:通过对《分析化学》中的知识点——沉淀法的概述,我们了解了沉淀法的基本原理、沉淀和驱动力、应用及实验操作、优缺点与改进措施以及与其他分析方法的比较和结合应用。
沉淀法作为一种常用的分析方法,在实际应用中具有广泛的可行性和适用性。
我们深信通过对沉淀法的深入研究和实践应用,将更好地为化学分析提供有效的手段和方法。
高中化学沉淀

高中化学沉淀沉淀是化学实验中常见的现象,指的是溶液中某些物质由于化学反应或物理变化而生成的固体颗粒,被称为沉淀物。
在高中化学中,沉淀是一个非常重要的概念,涉及到诸如离子反应、酸碱中和、络合反应等多个方面。
本文将从沉淀的基本概念、沉淀的形成条件、沉淀的性质与鉴定方法以及沉淀在实际应用中的作用等几个方面进行介绍。
一、沉淀的基本概念沉淀是指在溶液中某些物质由于化学反应或物理变化而形成的固体颗粒。
沉淀是一种比较常见的现象,常常出现在化学实验中,如酸碱中和反应、离子反应、络合反应等。
在化学反应中,如果产生的产物是不溶于溶液中的固体物质,它们就会聚集在一起,逐渐形成沉淀。
沉淀物的颗粒大小、形状、颜色等特征与反应物的种类、浓度、温度、pH值等因素有关。
二、沉淀的形成条件沉淀的形成需要满足一定的条件,主要包括反应物的浓度、温度、pH值等因素。
1、反应物的浓度反应物的浓度是影响沉淀形成的重要因素之一。
一般来说,当反应物浓度越高时,产生的沉淀物也越多。
这是因为高浓度的反应物可以提高反应速率,促进反应进行,从而使得沉淀物的生成速率加快。
2、温度温度是另一个影响沉淀形成的因素。
在一定的反应物浓度下,温度越高,反应速率也越快,沉淀物的生成速率也会加快。
但是需要注意的是,温度过高会使得某些沉淀物溶解,从而影响实验结果。
3、pH值pH值也是影响沉淀形成的因素之一。
在一些酸碱反应中,当pH 值达到一定程度时,反应物会发生沉淀并生成固体物质。
例如,当氢氧化钠与硫酸铜反应时,当pH值达到12左右时,会生成蓝色的氢氧化铜沉淀物。
三、沉淀的性质与鉴定方法沉淀物的性质和鉴定方法是高中化学中需要掌握的重要内容。
下面将介绍几种常见的沉淀物的性质和鉴定方法。
1、氯化银沉淀物氯化银沉淀物是一种白色的固体,可以溶于氨水,并在光线照射下变黑。
鉴定方法可以使用氯化银试剂与待测物质反应,若出现白色沉淀,即可证明待测物质中含有氯离子。
2、碳酸钙沉淀物碳酸钙沉淀物是一种白色、无臭、无味的固体,可以溶于强酸和酒石酸。
沉淀溶解平衡与沉淀条件的选择

S0称为物质的分子溶解度或固有溶解度。 溶解达到平衡时,MA的溶解度S: S=S0+[M+]=S0+[A-]
各种难溶化合物的S0相差很大。 在计算溶解度时必须加以考虑。
许多沉淀的S0较小,计算溶解度时,一般可忽略
当难溶化合物的S0较大时(即MA(水)的离解度较小),
S0的影响。 S = [M+] = [A-]
【例】
纯水中BaSO4的溶解度为:
S=[Ba2+]=[SO42-]=Ksp1/2=1.0×10-5(mol· -1) L
加过量H2SO4,使沉淀后溶液[SO42-]=0.010 mol/L
,则溶解度为:
S=[Ba2+]=Ksp/[SO42-]=1.1×10-8(mol· -1) L
沉淀溶解度降低1000倍。
(五)必要时进行再沉淀。无定形沉淀一般含杂质的 量较多,如果准确度要求较高时,应当进行再沉 淀。
三、均匀沉淀法 消除局部过浓现象。 【方法】先控制一定条件,使沉淀剂不能立刻与 被测离子生成沉淀,然后通过一种化学反应,使 沉淀剂从溶液中缓慢均匀产生,使得沉淀在整个 溶液中缓慢、均匀析出。可获得颗粒较大、吸附 杂质少、易过滤洗涤的晶形沉淀。
Ksp = [M][A] = [M’]/M × [A’]/A
Ksp’=[M’][A’]= Ksp M A
Ksp’称为条件溶度积。因为副反应系数 M、 A 均大于1,故Ksp’ > Ksp。
S副反应
= [M’] = [A’] = Ksp’1/2 = (Ksp M A)1/2
S副反应 > S理论
沉淀条件的选择
一、 沉淀的类型:晶形沉淀、凝乳状沉淀和无定 形沉淀。主要区别是颗粒的大小。 无定形沉淀 二、沉淀的形成
沉淀的类型及沉淀条件的选择

沉淀的类型及沉淀条件的选择8.4.1沉淀的类型在分量分析法中,为了得到精确的分析结果,要求沉淀尽可能具有易于过滤和洗涤的结构。
按照沉淀的物理性质和结构,可粗略地分为以下三类。
1.晶形沉淀晶形沉淀体积小,颗粒大,其颗粒直径在0.1~1um,内部罗列较规章,结构紧密,比表面积较小,易于过滤和洗涤。
如用普通办法得到的SaSO4沉淀。
2.无定形沉淀无定形沉淀又称为胶状沉淀或非晶形沉淀,是由细小的胶体微粒凝结在一起组成的,体积浩大,颗粒小,胶体微粒直径普通在0.02um以下,无定形沉淀是杂乱疏松的,比表面积比晶形沉淀大得多,简单吸附杂质,难以过滤和洗涤。
X衍射法证实,普通状况下形成的无定形沉淀并不具有晶体的结构。
如Fe2O3·nH2O沉淀。
3.凝乳状沉淀凝乳状沉淀也是由胶体微粒凝结在一起组成的,胶体微粒直径在0.02~0.1um,微粒本身是结构紧密的极小晶体。
所以,从本质上讲,凝乳状沉淀也属晶形沉淀,但与无定形沉淀相像,凝乳状沉淀也是疏松的,比表面积较大,如AgCl沉淀。
生成的沉淀属于哪种类型,首先取决于沉淀的性质,同时也与形成沉淀时的条件以及沉淀的预处理疏远相关。
以上三类沉淀的最大差别是沉淀颗粒的大小不同,分量分析中最好能避开形成无定形沉淀。
由于它的颗粒罗列杂乱,其中还包含了大量的水分子,体积特殊浩大,形成疏松的絮状沉淀,所以在过滤时速度很慢,还会将滤纸的孔隙阻塞。
而且,因为比表面积特殊大,带有大量杂质,很难洗净。
相比之下,凝乳状沉淀在过滤时并不阻塞滤纸,过滤的速度还比较快,洗涤液可以通过孔隙将沉淀内部的表面也洗净。
在沉淀分量分析中,希翼得到的是晶形沉淀,有较大的颗粒,无定形沉淀要紧密,这样便于洗涤和过滤,沉淀的纯度要高。
所以了解沉淀的溶解度、纯度以及沉淀条件的挑选对沉淀分量分析是很重要的。
8.4.2沉淀条件的挑选在分量分析中,为了获得精确的分析结果,要求沉淀彻低、纯净、易于过滤和洗涤,并削减沉淀的溶解损失。
化学沉淀知识点总结归纳

化学沉淀知识点总结归纳一、化学沉淀的定义化学沉淀是指在化学反应中生成的一种难溶于溶剂的物质,在反应过程中沉积形成固体沉淀物的过程。
化学沉淀通常是由两种可溶性物质反应生成一种不溶性产物,这种产物在溶液中发生沉淀。
例如氯化银和硝酸钠反应生成氯化钠和硝酸银,硝酸银在水中不溶,因此会沉淀出来,这就是化学沉淀的典型例子。
二、化学沉淀的类型1. 交换反应生成的沉淀:当两种溶液中的阳离子和阴离子交换位置而生成的新物质溶解度减小时,就会发生沉淀。
例如氯化银和硝酸钠反应生成氯化钠和硝酸银的沉淀。
2. 酸碱反应生成的沉淀:当酸碱中的阴离子和阳离子发生反应生成不溶性物质时,就会发生沉淀。
例如氢氧化钙和盐酸反应生成氯化钙的沉淀。
3. 氧化还原反应生成的沉淀:当氧化还原反应中的金属阳离子和氧化物阴离子反应生成不溶性物质时,就会发生沉淀。
例如氧化铅和硫化氢反应生成硫化铅的沉淀。
三、化学沉淀的形成条件1. 反应物浓度:化学沉淀的生成与反应物浓度有关,一般来说,当两种溶液中反应物的浓度增加,会促进产物的生成和沉淀的形成。
2. 反应物溶解度:当反应物的溶解度较低时,会促进生成不溶性产物,从而形成化学沉淀。
3. 反应温度:一般来说,反应温度对化学沉淀的形成影响较小,但在某些特定反应中,温度过高或过低可能会影响产物的形成和沉淀的生成。
4. 反应时间:反应时间对化学沉淀的形成影响较小,但在一些反应中,反应时间过长或过短可能会影响产物的形成和沉淀的生成。
四、化学沉淀的影响因素1. 浓度:反应物的浓度直接影响化学反应速率和产物形成的速度,浓度越高,沉淀的生成速度越快。
2. 温度:温度影响反应热力学和动力学过程,一般来说,温度越高,化学反应速率越快,沉淀的生成速度也越快。
3. pH值:酸碱性对于一些反应的进行和产物的生成有重要影响,不同 pH 值下会影响产物的形成和沉淀的生成。
4. 溶剂:溶剂对反应过程中的生成物溶解度有影响,不同溶剂对产物溶解度的影响也会影响沉淀的生成。
化学沉淀的知识点总结

化学沉淀的知识点总结化学沉淀是一种重要的化学实验方法,广泛应用于化学、环境、生物等领域。
本文将从化学沉淀的原理、适用条件、常见沉淀反应和实验技术等方面进行总结。
一、化学沉淀的原理化学沉淀是利用溶液中物质的溶解度差异而实现的一种分离方法。
在溶液中,待沉淀物质和沉淀剂可以发生化学反应生成不溶的物质沉淀,从而达到分离的目的。
化学沉淀的原理主要包括以下几点:1. 溶解度差异:物质的溶解度与溶液中的温度、压力、浓度等因素有关。
某些物质在一定条件下会生成不溶的沉淀,利用这种溶解度差异可以实现化学沉淀分离。
2. 化学反应生成沉淀:待沉淀物质和沉淀剂在溶液中发生化学反应,生成不溶的沉淀物质。
通常沉淀剂选择适当,可以使待沉淀物质和沉淀剂之间发生反应生成不溶的物质。
3. 沉淀的形成条件:化学沉淀的形成需要具备适当的条件,包括溶液的浓度、温度、pH值等因素,只有在合适的条件下才能发生有效的化学沉淀反应。
综上所述,化学沉淀是利用物质的溶解度差异以及化学反应生成不溶物质的原理实现的一种分离方法。
二、化学沉淀的适用条件化学沉淀作为一种常见的实验方法,适用条件是其能否成功实现沉淀分离的关键。
化学沉淀的适用条件主要包括以下几点:1. 沉淀剂选择:沉淀剂的选择直接影响化学沉淀的效果。
通常选择具有较强沉淀作用的沉淀剂,使之与待沉淀物质发生反应生成不溶的沉淀物质。
2. 溶液的浓度:溶液的浓度对化学沉淀有重要影响。
通常情况下,当溶液浓度较高时,有利于沉淀物质的形成和分离,而浓度过低则难以实现有效的沉淀分离。
3. 温度和pH值:温度和pH值是影响化学沉淀的重要因素。
通常情况下,适宜的温度和pH值能够提高沉淀的形成和分离效果,而不利的条件则会影响沉淀的效果。
4. 混合和搅拌:待沉淀物质和沉淀剂的充分混合和搅拌是实现有效化学沉淀的重要条件,通过搅拌可以促进沉淀物质的形成和分离。
综上所述,化学沉淀的适用条件包括沉淀剂选择、溶液的浓度、温度和pH值以及混合搅拌等因素。
沉淀的类型和沉淀形成过程

三、沉淀的类型和沉淀形成过程(一)沉淀的类型沉淀可大致分为晶形沉淀和非晶形沉淀两大类。
非晶形沉淀又称为无定形沉淀或胶状沉淀。
BaSO4是典型的晶形沉淀,Fe2O3·nH2O是典型的无定形沉淀。
AgCl 是一种凝乳状沉淀,按其性质来说,介于两者之间。
晶形沉淀与非晶形沉淀之间虽无绝对界限,但仍有明显差异。
晶形沉淀颗粒大,直径约在0.1~ 1 μm之间,内部排列较规则,结构紧密,易于沉淀和过滤;非晶形沉淀颗粒很小,其直径一般小于0.02 μm,没有明显的晶格,排列杂乱,结构疏松,体积庞大,易吸附杂质,难以过滤和洗净。
凝乳状沉淀的颗粒大小介于两者之间。
在重量分析法中,最好能获得晶形沉淀。
(二)沉淀的形成过程沉淀的形成过程是一个非常复杂的过程,目前仍未有成熟的理论,一般认为在沉淀过程中,首先是构晶离子在过饱和溶液中形成晶核,然后进一步成长按一定晶格排列的晶形沉淀。
构晶离子→晶核→沉淀颗粒→晶形沉淀或无定形沉淀晶核的形成有两种情况:均相成核作用和异相成核作用1. Von Veimarn经验公式Von Veimarn(冯·韦曼)经验公式将沉淀生成的速度(用分散度表示)与溶液的相对过饱和度的关系描述为式中Q表示加入沉淀剂瞬间溶质的总浓度;s表示晶体的溶解度;Q-s为过饱和度;(Q-s)/s为相对过饱和度;K为常数,它与沉淀的性质、温度、介质等有关。
溶液的相对过饱和度越小,则晶核形成速度越慢,可望得到大颗粒沉淀。
2. 均相成核的临界(过饱和)比在均匀的液相中,过饱和的溶质自发的产生晶核的均相成核过程决定于体系的过饱和比SR(supersaturation ratio)。
当溶质的过饱和比很小时,只形成很少的晶核,成核过程以异相成核为主;若SR增大,当达到或超过临界过饱和比CSR(critical supersaturation ratio)时,就会自发地产生大量的晶粒,沉淀反应由异相成核作用转化为既有异相成核作用又有均相成核作用。
沉淀的类型及沉淀条件的选择

沉淀的类型及沉淀条件的选择沉淀的类型及沉淀条件的选择5.3 沉淀的类型及沉淀条件的选择5.3.1沉淀的类型按颗粒大小分的不同,可将沉淀粗略分为两大类:一类是晶形沉淀;另一类是无定形沉淀,或称非晶形沉淀或胶状沉淀。
晶形沉淀的颗粒直径约为0.1-1mm,构晶离子排列规则、结构紧密,例如BaSO4。
无定形沉淀颗粒直径小于0.02mm,沉淀颗粒无规则堆积,沉淀疏松含水多,体积大,例如Fe2O3·nH2O。
介于晶形沉淀与无定形沉淀之间的是凝乳状沉淀,它颗粒大小介于以上两者之间,例如AgCl。
沉淀属于何种类型,由沉淀性质决定,但沉淀条件也起很大的作用。
如沉淀的颗粒大小与进行沉淀反应时构晶离子的浓度有关。
5.3.2沉淀的形成过程沉淀过程中,首先是构晶离子在过饱和溶液中形成晶核,然后进一步成长为按一定晶格排列的晶形沉淀。
1. 晶核的形成晶核的形成有均相成核和异相成核两种情况。
(1)均相成核:是由构晶离子互相缔合而成的晶核。
如硫酸钡沉淀的晶核是Ba2+与SO42-缔合,形成BaSO4、(Ba2SO4)2+和[Ba(SO4)2]2+等等多聚体。
这些是结晶体的胚芽。
形成晶核的基本条件必须是溶液处于过饱和状态,即形成晶核时溶液的浓度Q要大于该物质的溶解度s。
(2) 异相成核:溶液中存在微细的其它颗粒,如尘埃、杂质等微粒,在沉淀过程中,它们起着晶核的作用,诱导沉淀形成。
2. 聚集与定向过程在形成晶核后,溶液的构晶离子不断向晶核表面扩散,并沉积在晶核表面,使晶核逐渐长大成为沉淀的微粒,沉淀微粒又可聚集为更大的聚集体,此过程称为聚集过程。
在聚集过程的同时,构晶离子按一定的晶格排列而形成晶体,此过程称为定向过程。
沉淀类型与聚集过程和定向过程的速度有关。
如果聚集速度大于定向速度,晶体未能定向排列,就堆聚在一起,因而得到的是无定形沉淀。
如果定向速度大于聚集速度,构晶离子得以定向排列,形成晶形沉淀。
聚集速度主要与溶液的相对过饱和度有关,定向速度主要与沉淀物质的性质有关,例如极性较强的盐类,一般具有较大的定向速度。
2.2.8.2沉淀条件的选择.

3. ↓的后处理
(外因)
构晶离子:构成↓的离子,如Ba2+、SO42晶种 无定形;V1>V2
构晶离子
成核作用 均相成核 异相成核
晶核
长大
沉淀颗粒
晶形;V1<V2
(离子对 )
成核作用:由构晶离子的静电 2 2 2 作用力而缔合起来 Ba Ba 2 SO 4 4 BaSO 4 均相成核
可挥发性沉淀剂过量50%~100%
非挥发性沉淀剂过量20%~30%
BaSO4沉淀重量法测Ba2Cl2·2H2O时其用量
为0.40~0.6g,则沉淀剂0.10mol/L H2SO4溶
液的用量为多少?
0.40 V ( H 2 SO 4 ) 1000 (1.5 ~ 2.0) 25 ~ 33(mL ) 244 .3 0.10
趋近于零呢?
沉淀形成过程为两个阶段:
构晶离子聚集形成晶核,其形成速度称
为聚集速度。
(Va)
构晶离子在晶核上沉积使晶核长大成为
沉淀颗粒,其速度称为定向速度。
(Vc)
沉淀的类型取决于Va与Vc的大小:
Va
〉Vc
Vc
形成晶形沉淀。
形成非晶形沉淀。 (无定形沉淀)
Va 〈
影响Vc的因素:
C(Na2SO4)/mol· L-1
0 0.001 0.01 0.02 0.04 0.100 0.200
S(PbSO4)/mol· L-1 0.15 0.024 0.016 0.014 0.013 0.016 0.023
同离子效应占优势 盐效应占 主导地位
14
※并非沉淀剂过量越多越好。
※多少合适呢?
2 S [ Ba2 ] [ SO4 ] K sp 1.11010 1.0 105 m ol L1 在200m L溶液中BaSO 4的损失量为: 5 1 1 1.0 10 m ol L 200m L 233.4 g m ol 0.5m g
昆工11无机及分析-第05章 沉淀-带答案

第5 章沉淀的形成与沉淀平衡一、是非题1、溶度积与其它化学平衡常数一样,与难溶电解质的本性和温度有关。
(√)2、比较难溶电解质溶解度的大小,只需比较难溶电解质溶度积的大小。
(×)3、沉淀形成的先决条件是Q C > K SP。
(√)4、当定向速率大于集聚速率时,得到的是晶型沉淀。
(√)5、无机沉淀若在水中的溶解度较大,通常采用加有机溶剂降低其溶解度。
(√)6、共沉淀是重量分析中最重要的误差来源之一。
(√)二、选择题1、影响沉淀溶解度的主要因素是 B D E。
A、水解效应B、酸效应C、盐效应D、配位效应E、同离子效应2、K SP (CaF2) = 2.7×10-11,若不考虑F-的水解,则CaF2在纯水中的溶解度为A mol·L-1。
A、1.9×10-4B、3.0×10-4C、2.0×10-4D、5.2×10-4E、2.6×10-43、晶型沉淀的沉淀条件是 B D。
A、沉淀作用宜在较浓溶液中进行B、应在不断搅拌中加入沉淀剂C、沉淀作用宜在冷溶液中进行D、应进行沉淀的陈化4、为获得纯净而易过滤、洗涤的晶型沉淀的的要求是 B D。
A、沉淀的V聚> V定B、沉淀的V聚< V定C、溶液的相对过饱和度量大D、溶液的相对过饱和度量小E、沉淀的溶解度很小5、如果被吸附的杂质和沉淀具有相同的晶格,这就形成D。
A、后沉淀B、机械吸留C、包藏D、混晶E、表面吸附6、当母液被包夹在沉淀中引起沉淀沾污时,有效减少其沾污的方法是 B CA、多次洗涤B、重结晶C、陈化D、改用其他沉淀剂7、BaSO4沉淀在0.10mol.L-1KNO3溶液中的溶解度较其在纯水中的溶解度为大,其合理的解释是BA、酸效应B、盐效应C、配位效应D、形成过饱和溶液8、沉淀滴定法中的莫尔法不适用于测定I- ,是因为 AA、生成的沉淀强烈吸附被测物B、没有适当的指示剂指示终点C、生成的沉淀溶解度太小D、滴定酸度无法控制9、在重量分析中对无定形沉淀洗涤时,洗涤液应选择 BA 、冷水B 、热的电解质稀溶液C 、沉淀剂稀溶液D 、有机溶剂10、用莫尔法测定Cl - 时,下列哪种离子存在会干扰测定 B CA 、SO 42-B 、 PO 43-C 、 Cu 2+D 、 Ca 2+三、填空题1、沉淀按物理性质不同可分为 晶 形 沉淀、 无 定 形 沉淀和凝 乳状沉淀。
沉淀反应和沉淀物的形成条件

沉淀反应和沉淀物的形成条件沉淀反应是化学反应中常见的一种类型,它涉及到溶液中的物质在特定条件下形成固态的沉淀物。
在化学实验室以及工业生产中,了解沉淀反应和沉淀物的形成条件非常重要。
本文将介绍沉淀反应的基本概念,并探讨影响沉淀物形成的条件。
一、沉淀反应的基本概念沉淀反应是指溶液中的离子或分子发生化学反应,生成难溶于溶液中的固体产物。
这些固体产物称为沉淀物。
在沉淀反应中,通常会有两种溶液中的离子发生结合,生成固态沉淀物。
沉淀反应的化学方程式通常以离子形式书写,并在方程式的末尾标出沉淀物。
例如,当氯化银和硝酸钠混合时,会发生沉淀反应:Ag+ + Cl- + Na+ + NO3- → AgCl↓ + Na+ + NO3-在这个反应中,氯化银和硝酸钠的离子在溶液中结合,生成难溶于溶液中的氯化银沉淀物。
二、影响沉淀物形成的条件1. 溶解度积沉淀反应的进行与溶解度积(Ksp)有关。
溶解度积是指离子在饱和溶液中的浓度乘积。
当溶液中的离子浓度乘积超过溶解度积时,沉淀反应发生。
溶解度积的大小取决于溶质在溶剂中的相对溶解度。
当Ksp的值很小时,说明产生固态沉淀物的倾向较小。
相反,当Ksp的值很大时,产生固态沉淀物的倾向较大。
2. 温度温度对沉淀物的形成有重要影响。
在某些沉淀反应中,随着温度的升高,沉淀物的溶解度会增加。
这是因为在高温下,溶剂分子的热运动增强,使离子更容易离开沉淀物表面。
然而,在其他沉淀反应中,随着温度的升高,沉淀物的溶解度会降低。
这是由于在高温下,化学反应的平衡位置发生变化,使生成沉淀物的反应向前进行。
3. 浓度沉淀反应的浓度也会影响沉淀物的形成。
通常情况下,当反应物离子浓度增加时,沉淀物的形成倾向也会增加。
这是因为离子浓度的增加增加了碰撞的概率,从而促进离子的结合和形成沉淀物。
4. pH值溶液的酸碱度对沉淀物形成也有一定的影响。
有些沉淀反应只在特定的pH值范围内发生。
这是因为pH值的变化可以改变离子的电荷,从而影响反应物之间的相互作用和结合。
沉淀条件

第四节沉淀条件为使沉淀完全并得到纯净的沉淀,对不同类型的沉淀,必须选择不同的沉淀条件。
一、晶形沉淀的沉淀条件在生成晶形沉淀时,为了得到便于过滤、洗涤和颗粒较大的晶形沉淀,必须减小聚集速度,增大定向速度。
减少晶核的形成,有助于晶体的长大。
一般应控制以下条件:控制相对过饱和度小,沉淀陈化。
1、稀:沉淀反应须在适当稀的溶液中进行。
减小相对过饱和度,减小共沉淀现象,减少杂质吸附量。
2、热:沉淀反应须在热溶液中进行。
增大沉淀溶解度,降低相对过饱和度,减少均相成核,增大定向速度,有利于沉淀长大。
3、慢:加入沉淀剂的速度要慢。
防止晶核的快速形成,有利于沉淀长大。
4、搅:加入沉淀剂时应不断搅拌。
防止局部过饱和度大而形成较多的晶核。
5、陈:即陈化。
减少包藏,使晶形完整化,沉淀易于过滤和洗涤。
二、无定形沉淀的沉淀条件无定形沉淀,溶解度一般较小,很难通过改变沉淀条件来改变沉淀的物理性质,但可以通过控制沉淀条件,设法破坏胶体、防止胶溶、加速沉淀微粒的凝聚,得到便于洗涤过滤又纯净的沉淀。
减少水合,使其聚集紧密,便于过滤;减少杂质吸附。
1、浓:沉淀反应需在较浓的溶液中进行,加入沉淀剂的速度也可适当快些。
目的是减少水合,沉淀完后,稀释搅拌,减少杂质吸附。
2、热:沉淀反应在热溶液中进行。
减少水合,减少杂质吸附,防止胶溶。
3、大量电解质:沉淀时加入大量电解质或某些能引起沉淀微粒凝聚的胶体。
利于沉淀凝聚、沉降。
4、快搅:沉淀时不断搅拌。
5、立即过滤:沉淀完毕后,趁热过滤,不陈化。
三、均相沉淀法1、定义:均相沉淀法是通过某一化学反应,在溶液内部逐渐地产生沉淀剂,使沉淀在整个溶液中缓慢均匀析出的方法。
2、特点:此法得到的沉淀颗粒粗大,结构紧密,纯净,易过滤和洗涤。
3、方法:(1)控制溶液pH值的均匀沉淀法沉淀CaC2O4:于酸性含Ca2+的试液中加入过量草酸,利用尿素水解产生NH3逐步提高溶液的pH,使CaC2O4均匀缓慢地形成。
CO(NH2)2 + H2O →2NH3 + CO2(2)有机沉淀剂(酯类或其它有机化合物水解),产生沉淀剂阴离子。
工业分析技术专业《沉淀重量法对沉淀形式和称量形式的要求教案4》

重铬酸钾法及应用教学要点:熟练掌握晶形沉淀和无定形沉淀的沉淀条件,熟练掌握沉淀过滤、洗涤和灼烧的原那么及方法。
第四节沉淀的条件和称量形的获得【学习要点】一、沉淀的条件在重量分析中,为了获得准确的分析结果,要求沉淀完全、纯洁、易于过滤和洗涤,并减小沉淀的溶解损失。
因此,对于不同类型的沉淀,应中选用不同的沉淀条件。
1.晶形沉淀为了形成颗粒较大的晶形沉淀,采取以下沉淀条件:〔1〕在适当稀、热溶液中进行在稀、热溶液中进行沉淀,可使溶液中相对过饱和度保持较低,以利于生成晶形沉淀。
同时也有利于得到纯洁的沉淀。
对于溶解度较大的沉淀,溶液不能太稀,否那么沉淀溶解损失较多,影响结果的准确度。
在沉淀完全后,应将溶液冷却后再进行过滤。
〔2〕快搅慢加在不断搅拌的同时缓慢滴加沉淀剂,可使沉淀剂迅速扩散,防止局部相对过饱和度过大而产生大量小晶粒。
〔3〕陈化陈化是指沉淀完全后,将沉淀连同母液放置一段时间,使小晶粒变为大晶粒,不纯洁的沉淀转变为纯洁沉淀的过程。
因为在同样条件下,小晶粒的溶解度比大晶粒大。
在同一溶液中,对大晶粒为饱和溶液时,对小晶粒那么为未饱和,小晶粒就要溶解。
这样,溶液中的构晶离子就在大晶粒上沉积,直至到达饱和。
这时,小晶粒又为未饱和,又要溶解。
如此反复进行,小晶粒逐渐消失,大晶粒不断长大。
陈化过程不仅能使晶粒变大,而且能使沉淀变的更纯洁。
加热和搅拌可以缩短陈化时间。
但是陈化作用对伴随有混晶共沉淀的沉淀,不一定能提高纯度,对伴随有继沉淀的沉淀,不仅不能提高纯度,有时反而会降低纯度。
2.无定形沉淀无定形沉淀的特点是结构疏松,比外表大,吸附杂质多,溶解度小,易形成胶体,不易过滤和洗涤。
对于这类沉淀关键问题是创造适宜的沉淀条件来改善沉淀的结构,使之不致形成胶体,并且有较紧密的结构,便于过滤和减小杂质吸附。
因此,无定形沉淀的沉淀条件是:〔1〕在较浓的溶液中进行沉淀在浓溶液中进行沉淀,离子水化程度小,结构较紧密,体积较小,容易过滤和洗涤。
沉淀生成和溶解的条件

沉淀生成和溶解的条件沉淀生成和溶解是化学反应中常见的现象,涉及到物质的相互转化。
本文将从化学反应条件的角度对沉淀生成和溶解进行探讨。
一、沉淀生成的条件1. 反应物浓度:沉淀生成的条件之一是反应物浓度的变化。
当溶液中的反应物浓度超过溶解度时,就会发生沉淀生成。
反之,如果溶解度高于反应物浓度,则不会形成沉淀。
2. 温度:温度也是影响沉淀生成的重要因素。
一般来说,温度升高会促使沉淀生成反应进行得更快。
这是因为温度升高会增加反应物的活动性,使反应物之间的碰撞频率增加,从而加速反应速率。
3. pH值:pH值是指溶液的酸碱性程度,也会影响沉淀生成的过程。
不同的物质在不同的pH值下具有不同的溶解度。
当溶液的pH值发生变化时,可能会导致物质的溶解度发生改变,进而影响沉淀生成的过程。
4. 反应时间:反应时间是指反应物发生化学反应所需要的时间。
有些沉淀生成反应是需要一定时间的,而有些反应则可以迅速生成沉淀。
反应时间的长短取决于反应物的性质以及反应条件。
二、溶解的条件1. 温度:与沉淀生成类似,溶解也受到温度的影响。
一般来说,溶解度随温度的升高而增加。
这是因为温度升高会增加溶质分子的平均动能,使其更容易克服吸引力而脱离溶剂分子,从而增加溶解度。
2. 压力:压力对溶解度的影响相对较小,但在某些情况下也是重要的。
例如,气体溶解在液体中时,压力的增加会使溶解度增加。
这是因为增加压力会增加气体分子与液体分子之间的碰撞频率,从而促进溶解过程。
3. 溶剂性质:溶解的条件还与溶剂的性质有关。
不同的溶剂对溶质的溶解度有不同的影响。
溶剂的极性、溶剂与溶质之间的相互作用力等因素都会影响溶解度。
4. 溶质的性质:溶质的性质也是影响溶解度的重要因素。
溶质的极性、分子大小、电荷等特性都会对溶解度产生影响。
溶质分子越小、极性越大,溶解度通常会越高。
沉淀生成和溶解是化学反应中常见的现象。
沉淀生成的条件包括反应物浓度、温度、pH值和反应时间;溶解的条件包括温度、压力、溶剂性质和溶质性质。
沉淀的形成和沉淀条件的选择

第五节沉淀的形成和沉淀条件的选择一、沉淀的类型沉淀按其物理性质不同,可粗略分成两类:晶形沉淀和无定形沉淀( 又称非晶形沉淀或胶状沉淀) 。
晶形沉淀如:BaSO4,MgNH4PO4,CaC2O4·2H2O ,PbSO4 其颗粒直径约0.1 ~ 1 μm 。
非晶形沉淀:Fe2O3·nH2O ,ZnS ,Al2O3·nH2O[Al(OH)3] 其颗粒直径一般<0.02 μm 。
晶形沉淀:内部排列较规则,结构紧密,整个沉淀所占体积较小,易沉降于容器底部。
无定形↓,由许多疏松聚集在一起的微小沉淀颗粒组成,排列杂乱无章,有时又包含大量数目的H 2 O ,所以是疏松的絮状沉淀。
介于晶形沉淀与无定形沉淀之间的为凝乳状沉淀,颗粒大小0.1>d>0.02 μm ,如AgCl 。
二、沉淀的形成沉淀的形成一般经过晶核形成和晶核长大两个过程。
将沉淀剂加入试液中,当形成沉淀的离子浓度乘积大于其K SP,离子通过静电引力结合成一定数目的离子群,即为晶核。
晶核形成后,构晶离子向晶核表面沉积,晶核就逐渐长大成微粒。
聚集速度V :由离子聚集成晶核,再进一步积集成沉淀颗粒的速度。
定向速度V ′:在聚集的同时,构晶离子又按一定晶格排列,这种定向排列速度。
若聚集速度V 大,而定向排列速度V ′小,即离子很快聚集来生成沉淀微粒,却来不及进行晶格排列,则得到的是非晶形沉淀。
若V 较小,而V ′较大,即离子较慢地聚集成沉淀,有足够时间进行晶格排列,则得到晶形↓。
V 由沉淀条件所决定。
式中:S 沉淀的溶解度。
Q 加入沉淀剂瞬间,生成沉淀物质的浓度。
Q -S 沉淀开始瞬间的过饱和度。
K 常数:与沉淀的性质、温度、共存物质等因素有关。
从上式可知:聚集速度主要由沉淀时的条件决定的。
定向速度,主要取决于沉淀物质的本性。
(1) 一般极性强的盐类:如MgNH4PO4,BaSO4,CaC2O4等。
有较大的定向速度,易形成晶形沉淀。
中考化学沉淀知识点总结

中考化学沉淀知识点总结一、沉淀的基本概念1. 沉淀的定义沉淀是指在溶液中发生的固体产物。
通常在两种溶液混合时,若生成的产物是不溶于水的固体,就会产生沉淀。
例如在溶液中,当两种溶质混合时,在反应的条件下会产生一种不溶于溶液的固体,这种固体即为沉淀。
2. 沉淀的特点沉淀的形成需要有适当的条件,包括溶液的浓度、温度等。
在化学实验中,通过溶液的混合可以观察到不同沉淀的颜色、形状等特点。
沉淀反应是化学实验中常见的一种实验手段,可以通过观察沉淀的形成,判断不同溶液中存在的物质。
二、沉淀的产生条件1. 溶液中产生的沉淀通常需要满足一定的条件,主要包括以下几个方面:2. 活动离子浓度和溶液的饱和度当两种溶液混合时,若其中一种溶质的活动离子浓度过高,或者溶液处于过饱和状态时,就会有沉淀的产生。
在化学实验中,可以通过定量试验测定活动离子的浓度,判断产生沉淀的条件。
3. 沉淀的形成条件还受到pH值、温度、压力等多种因素的影响。
例如,当溶液的pH值发生变化时,溶解度也会发生变化,从而影响沉淀的形成。
三、沉淀的实验方法1. 沉淀实验通常是化学实验中的一种典型实验方法。
通过观察沉淀的形成可以推测反应的进行情况,判断溶液中可能存在的物质。
2. 沉淀实验的基本步骤包括:(1)将两种溶液混合在一起,通常在离心管、试管等容器中进行。
(2)观察反应过程中是否产生固体沉淀,根据实验中的观察结果,可以推测反应中可能存在的物质。
3. 在实验中,通常还可以通过加热、搅拌等方法促进沉淀的形成,加快实验的进行速度。
在实验中,需要注意安全操作,避免因为化学物质的接触导致身体受伤。
四、沉淀的应用1. 沉淀作为一种产物,在化学生产、实验室分析等方面有着广泛的应用。
2. 在化工生产中,沉淀的分离、提纯等工艺通常也是化学工艺的重要环节。
例如,在矿石提取中,通过沉淀的分离和提纯工艺,可以制备出纯度较高的金属。
3. 在化学实验室中,沉淀反应通常是一种常见的实验手段。
沉淀的形成与处理

沉淀的形成与处理一、沉淀的成分沉淀是指沉积在阴极及内衬上的含有不溶氧化物电解质的堆积物。
其主要成分是氧化铝和冰晶石的混合物。
捞出的沉淀样品中内部黑色的颗粒是炭粒,其中夹带着一些铝珠。
正常的生产电解质中AL2O3的含量应该小于5%,而在沉淀物中发现AL2O3的含量达到了51%,这说明在沉淀物中含有大量的没有溶解的AL2O3晶体及电解质。
二、沉淀的形成沉淀的形成原因我们可分为人为操作不当、工艺技术条件控制不当、设备及原料因素三个方面。
1.人为操作不当人为操作不当有多种情形,主要原因是职工技能水平不高,对生产工艺不了解,对操作规程执行不到位,操作过程中破坏了电解槽生产的物料平衡。
具体可分为以下情形:①效应处理不当,人为手动下料过多。
②壳头包处理不当,打掉的包块被直接压入电解质后不能及时熔化而沉入炉底;③处理冒火时方法不对,部分物料进入槽内;④换极操作不当,不扒料,出极时大量物料进入槽内;⑤盖极上料不注意方法,添加料块时滑如槽内或覆盖料不合格添加保温料时滑料特别是添加AL2O3做保温料时;⑥下料器、打壳器维修或更换时,大量物料流入槽内;⑦盖极质量差,大面塌壳;⑧堵料处理违章不扒料;⑨添加物料(如电解质、清包料、废铝、脏料等)方法方式违规。
2.工艺技术条件控制不当众所周知,电解质对AL2O3的溶解能力是有限的。
温度越高,AL2O3溶解度越大,溶解速度越快,分子比较高,氧化铝溶解度越大,电解质量大,对AL2O3的溶解量越大,电解质流动性越好,AL2O3溶解速度越快。
当工艺控制不符合生产实际时,下列情况会使电解槽沉淀增多:①冷槽,电解质过热度小。
氧化铝融入电解质是吸热过程,当部分AL2O3溶解后,造成局部电解质温度低,AL2O3不能及时溶化并沾附电解质沉入炉底。
②NB设定与生产实际不匹配,AL2O3投入量大于电解反应消耗量。
③电解质水平低,下料量超出电解质的溶解能力。
④分子比过低,电解质对AL2O3溶解能力下降。
九年级化学中的沉淀知识点

九年级化学中的沉淀知识点化学是一门研究物质性质和变化的科学,而沉淀作为其中的一个重要概念,在九年级化学学习中具有很高的重要性。
本文将针对九年级化学中的沉淀知识点进行论述,帮助读者更好地理解和掌握相关概念和原理。
一、沉淀的定义和特征沉淀是指两种溶液中溶质发生化学反应,形成的不溶于水的产物。
沉淀通常以固体形式存在,能够在溶液中沉积下来。
沉淀的形成与溶质的溶解度以及反应条件等因素有关。
二、沉淀的条件1. 溶质的溶解度:溶质在溶剂中的溶解度越小,就越容易形成沉淀。
2. 反应物浓度:当反应物浓度增加时,产生沉淀的可能性也会增加。
3. 反应温度:一般来说,温度的升高会增加溶质的溶解度,降低形成沉淀的可能性。
三、沉淀的生成与判定实验1. 氯化物沉淀实验:将待检溶液中加入氯化银(AgCl)沉淀试剂,如果产生白色沉淀,则说明溶液中存在氯离子。
2. 硫酸根离子沉淀实验:通过加入硫酸钡(BaSO4)试剂,形成白色沉淀,判定溶液中是否存在硫酸根离子。
3. 碳酸盐沉淀实验:加入碳酸氢钠(NaHCO3)试剂,若产生白色沉淀,则说明溶液中含有碳酸盐。
四、沉淀反应的应用1. 沉淀反应的分离:通过控制反应条件,使溶液中的某些成分以沉淀的形式分离出来,实现物质的分离纯化。
2. 沉淀法制备纯品:利用沉淀反应的产物独特的沉淀性质,可以制备出纯度较高的某种化合物。
3. 沉淀反应的定性与定量分析:通过观察沉淀的形成与性质,可以判断和测定溶液中的特定离子或化合物。
五、常见沉淀反应案例1. 氯化银与氯化钠反应:Ag+ + Cl- → AgCl↓2. 硫酸铜与氢氧化钠反应:Cu2+ + 2OH- → Cu(OH)2↓3. 硫酸钡与硫酸镁反应:Ba2+ + SO42- → BaSO4↓六、沉淀知识点的注意事项1. 注意安全:在进行沉淀反应实验时,应佩戴防护眼镜、手套等个人防护装备,避免实验品误入眼睛或皮肤接触。
2. 谨慎选择试剂:选择恰当的试剂和适当的反应条件,以保证实验结果的准确性。
沉淀法的原理和操作指南

沉淀法的原理和操作指南沉淀法是一种常用的分离和纯化技术,广泛应用于实验室和工业中。
它利用溶液中的化学反应,通过形成沉淀而将目标物质从混合物中分离出来。
本文将介绍沉淀法的原理和操作指南,帮助读者更好地理解和运用这一技术。
一、原理沉淀法的原理基于物质在溶液中的溶解度差异。
当两种或更多物质溶解在同一溶液中时,存在一种溶解度的平衡。
当反应条件改变,溶解度可能受到影响,导致其中一种物质溶解度下降并生成沉淀。
沉淀的形成可以通过不同的方式实现。
最常见的方法是添加沉淀剂,它与目标物质发生化学反应,生成难溶的化合物。
难溶化合物的生成使得该物质从溶液中析出,从而分离出来。
此外,改变溶液的温度、pH值、离子强度等条件也可以影响反应平衡,促进沉淀的形成。
例如,某些物质在高温下溶解度较高,而在低温下溶解度较低,因此可以通过降低温度来诱导沉淀形成。
二、操作指南在进行沉淀实验时,有一些关键步骤需要注意。
以下是一些常见的操作指南,供读者参考。
1. 选择适当的沉淀剂:根据目标物质的性质,选择合适的沉淀剂。
沉淀剂应与目标物质发生反应,生成难溶沉淀,且与其他组分无或极少反应。
2. 调节溶液条件:根据目标物质和沉淀剂的特性,调节溶液的温度、pH值和离子强度等条件。
这些参数的变化可以通过实验预先确定,或者在实验过程中逐步调整以达到最佳效果。
3. 慢慢添加沉淀剂:为了获得较大颗粒的沉淀物,应该慢慢添加沉淀剂,以免过量的剂量导致溶液中小颗粒的形成。
4. 充分搅拌和沉淀时间:在添加沉淀剂后,应充分搅拌溶液,以促进反应和沉淀的形成。
此外,待沉淀物形成后,留出足够的时间使其充分沉淀下来。
5. 过滤和洗涤沉淀:在沉淀物形成后,通过过滤将其分离出来。
过滤时要选择适当的滤纸或其他滤材,以防止沉淀渗透或滤液损失。
同时,要进行适当的洗涤,以去除溶液中的杂质。
6. 干燥和收集沉淀:将洗净的沉淀在适当的条件下干燥并收集。
干燥方法可根据沉淀物性质选择空气干燥、真空干燥或加热干燥等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第五节沉淀的形成和沉淀条件的选择
一、沉淀的类型
沉淀按其物理性质不同,可粗略分成两类:晶形沉淀和无定形沉淀( 又称非晶形沉淀或胶状沉淀) 。
晶形沉淀如:BaSO4,MgNH4PO4,CaC2O4·2H2O ,PbSO4 其颗粒直径约0.1 ~ 1 μm 。
非晶形沉淀:Fe2O3·nH2O ,ZnS ,Al2O3·nH2O[Al(OH)3] 其颗粒直径一般<0.02 μm 。
晶形沉淀:内部排列较规则,结构紧密,整个沉淀所占体积较小,易沉降于容器底部。
无定形↓,由许多疏松聚集在一起的微小沉淀颗粒组成,排列杂乱无章,有时又包含大量数目的H 2 O ,所以是疏松的絮状沉淀。
介于晶形沉淀与无定形沉淀之间的为凝乳状沉淀,颗粒大小0.1>d>0.02 μm ,如AgCl 。
二、沉淀的形成
沉淀的形成一般经过晶核形成和晶核长大两个过程。
将沉淀剂加入试液中,当形成沉淀的离子浓度乘积大于其K SP,离子通过静电引力结合成一定数目的离子群,即为晶核。
晶核形成后,构晶离子向晶核表面沉积,晶核就逐渐长大成微粒。
聚集速度V :由离子聚集成晶核,再进一步积集成沉淀颗粒的速度。
定向速度V ′:在聚集的同时,构晶离子又按一定晶格排列,这种定向排列速度。
若聚集速度V 大,而定向排列速度V ′小,即离子很快聚集来生成沉淀微粒,却来不及进行晶格排列,则得到的是非晶形沉淀。
若V 较小,而V ′较大,即离子较慢地聚集成沉淀,有足够时间进行晶格排列,则得到晶形↓。
V 由沉淀条件所决定。
式中:S 沉淀的溶解度。
Q 加入沉淀剂瞬间,生成沉淀物质的浓度。
Q -S 沉淀开始瞬间的过饱和度。
K 常数:与沉淀的性质、温度、共存物质等因素有关。
从上式可知:聚集速度主要由沉淀时的条件决定的。
定向速度,主要取决于沉淀物质的本性。
(1) 一般极性强的盐类:如MgNH4PO4,BaSO4,CaC2O4等。
有较大的定向速度,易形成晶形沉淀。
(2) 而氢氧化物,特别是高价氢氧化物和多数硫化物如Fe(OH)3,Al(OH)3等,定向速度
V ′较小,一般是非晶形沉淀。
解度较小,大多数是非晶形↓。
有时改变沉淀条件,可以改变沉淀的类型:
如BaSO4在浓溶液中析出时,可以得到非晶形沉淀;Ca(OH)2 、Mg(OH)2 从很稀的热溶液中,经过放置也可得到晶形↓。
相对过饱和度对BaSO 4 颗粒的影响
175000 胶状沉淀
25000 凝乳状沉淀
125细结晶状沉淀
25 大颗粒晶形沉淀
由此可见:沉淀的类型,不仅决定于沉淀的本质,也取决于沉淀的条件。
三、沉淀条件的选择:
V 和V ′的相对大小直接影响↓的类型。
其中V 主要由沉淀条件决定。
因此,要获得较好的晶形↓要求有较小的V ,这就应适当选择沉淀条件
1.晶形沉淀的沉淀条件
同时晶粒大,共沉淀现象也相应减小,有利于得到净沉淀。
(2) 慢、搅:在不断搅拌下,慢慢加入沉淀剂。
以避免“局部过浓”。
(3) 热:应在热溶液中进行沉淀。
(4) 陈,即陈化,就是在沉淀定量完成后,让母液与沉淀一起放置一段时间。
在陈化过程中:小颗粒逐渐溶解,大颗粒逐渐长大,也就是说小颗粒转化为大颗粒,而且还可以使不完整的晶体转化为完整晶粒,亚稳态转化为稳定态↓;同时陈化可减小沉淀对杂质的吸附,因为颗粒大了,吸附量就小了,再则,原来吸附、吸留或夹杂杂质亦将重新进入溶液中,因而可提高沉淀的纯度。
但对伴随有混晶的共沉淀,不一定能提高纯度,对有后沉淀的沉淀,反而会降低其纯度。
四、均相沉淀:
加入到溶液中的试剂,通过化学反应,逐步而均匀地在溶液中产生沉淀剂,从而使沉淀在整个溶液中
均匀地缓缓析出。
这样可得到大颗粒↓。
