物质的聚集状态与物质性质.
3、离子键、配位键与金属键

金属晶体
第3章 物质的聚集状态与物质性质
一、金属晶体 1.定义:金属原子通过____金__属__键____形成的晶体。
栏目 导引
第3章 物质的聚集状态与物质性质
2.金属晶体的原子堆积模型对比ຫໍສະໝຸດ 堆积模型典型代表物 质
配位数 晶胞结构示意图
非密 置层
体心立方 密堆积A2
栏目 导引
栏目 导引
第3章 物质的聚集状态与物质性质
(3)金属晶体结构与金属的延展性的关系 金属晶体中由于金属离子与自由电子间的相互作用没有方向 性,各原子层之间受外力作用发生相对滑动以后,仍可保持 这种相互作用,因而即使在外力作用下,发生形变也不易断 裂。 2.金属熔、沸点变化规律 金属单质是以金属键结合的,金属键越强,熔、沸点就越高, 金属键的强弱则与金属阳离子的半径和离子所带电荷有关。 具体说,金属阳离子半径越小,离子所带电荷越多,金属键 越强,金属单质的熔、沸点越高。
栏目 导引
第3章 物质的聚集状态与物质性质
要使金属晶体熔化必须破坏其中的金属键。金属晶体熔 点高低和硬度大小一般取决于金属键强弱,而金属键与金属 阳离子所带电荷的多少及半径大小有关。由此判断下列说法 正确的是( C ) A.金属镁的熔点大于金属铝 B.碱金属单质的熔点从Li到Cs是逐渐增大的 C.金属铝的硬度大于金属钠 D.金属镁的硬度小于金属钙
栏目 导引
第3章 物质的聚集状态与物质性质
(1)同一周期的金属元素 从左到右,阳离子半径逐渐减小,离子所带电荷逐渐增加, 金属键逐渐增强,熔、沸点逐渐升高,如Na、Mg、Al。 (2)同一主族的金属元素 从上到下,由于电子层数的增加,阳离子半径逐渐增加,离 子所带电荷相同,金属键逐渐减小,熔、沸点逐渐降低,如 碱金属。
高二化学物质的聚集状态与物质的性质试题答案及解析

高二化学物质的聚集状态与物质的性质试题答案及解析1.下列描述中正确的是A.CS2为V形的极性分子B.ClO3-的空间构型为平面三角形C.SF6中的空间构型为正四面体形D.SiF4和SO32-的中心原子均为sp3杂化【答案】D【解析】A、CS2为直线型的非极性分子,错误。
B、ClO3-的空间构型为三棱锥型。
错误。
C、SF6中的空间构型为正八面体型。
错误。
D、SiF4和SO32-的中心原子均为sp3杂化。
正确。
【考点】考查物质微粒的空间构型的知识。
2.关于化学式[TiCl(H2O)5]Cl2·H2O的配合物的下列说法中正确的是A.配位体是Cl-和H2O,配位数是9B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+C.内界和外界中的Cl-的数目比是1:2D.加入足量AgNO3溶液,所有Cl-均被完全沉淀【答案】C【解析】A、由化学式[TiCl(H2O)5]Cl2·H2O可知:该物质的配位体是Cl-和H2O,配位数是6.错误。
B、根据化合物的化合价的代数和为0可知:中心离子是Ti3+,配离子是[TiCl(H2O)5]2+.错误。
C、在络离子内界的Cl-的数目是1,在络离子外界中的Cl-的数目2.所以比是1:2。
正确。
D、由于络离子有其特殊的稳定性,所以加入足量AgNO3溶液,有2/3的Cl-被沉淀。
错误。
【考点】考查有关络合物的知识。
3.下列物质中不存在氢键的是A.水B.甲醇C.乙醇D.乙烷【答案】D【解析】由于C原子的电负性小,因此在乙烷的分子之间不存在氢键;而在水、甲醇及乙醇的分子内由于都含有电负性大,原子半径又较小的O原子,所以分子与分子之间都存在氢键。
因此选项为D。
【考点】考查氢键的形成及判断的知识。
4.下列说法正确的是()A.H2O的熔点、沸点大于H2S的是由于H2O分子之间存在氢键。
B.HF、HCl、HBr、HI的熔点沸点依次升高。
C.乙醇分子与水分子之间只存在范德华力。
《不同聚集状态的物质与性质》 知识清单

《不同聚集状态的物质与性质》知识清单一、物质的聚集状态物质在自然界中通常以三种主要的聚集状态存在:气态、液态和固态。
此外,还有等离子态和超临界态等较为特殊的聚集状态。
气态物质的特点是分子或原子之间的距离较大,相互作用力较弱,具有很强的流动性和扩散性。
气体可以充满整个容纳它的容器,其体积和形状取决于容器。
液态物质中分子或原子的间距比气态小,相互作用力较强。
液体具有一定的体积,但形状会随着容器而改变,具有流动性。
固态物质中分子或原子紧密排列,相互作用力很强,具有固定的形状和体积。
二、气态物质的性质1、压强气体对容器壁产生的压力除以容器的表面积即为压强。
压强与温度、体积和物质的量等因素有关。
在温度和物质的量不变的情况下,体积越小,压强越大;在体积和物质的量不变时,温度越高,压强越大。
2、体积气体的体积受温度和压强的影响显著。
在相同的温度和压强下,相同物质的量的气体具有相同的体积。
3、温度温度是描述气体热运动剧烈程度的物理量。
温度越高,气体分子的热运动越剧烈。
4、扩散性气体具有很强的扩散能力,能够迅速地在空间中均匀分布。
这是由于气体分子的自由运动和碰撞。
三、液态物质的性质1、表面张力液体表面层的分子受到指向液体内部的合力,使得液体表面具有收缩的趋势,这种现象称为表面张力。
表面张力使得液体在表面上能够形成液滴、产生毛细现象等。
2、蒸气压在一定温度下,液体与其蒸气达到平衡时,蒸气所产生的压强称为该液体在该温度下的蒸气压。
蒸气压随温度升高而增大。
3、粘度液体流动时,内部存在着阻碍液体流动的内摩擦力,液体的这种性质称为粘度。
不同液体的粘度不同,粘度随温度升高而降低。
4、溶解性许多物质在液态溶剂中能够溶解,形成溶液。
溶解性与溶质和溶剂的性质、温度、压强等因素有关。
四、固态物质的性质1、晶体与非晶体晶体具有规则的几何外形和固定的熔点,内部原子或分子呈周期性有序排列。
非晶体则没有规则的几何外形和固定的熔点,内部原子或分子排列无序。
第3章 物质的聚集状态与物质性质 易错疑难集训(一)--A学习区 (鲁科版选修3)及解析

第3章物质的聚集状态与物质性质易错疑难集训(一)--A学习区夯实基础一遍过(鲁科版选修3)注意事项:1.答题前填写好自己的姓名、班级、考号等信息2.请将答案正确填写在答题卡上第I卷(选择题)一、选择题(题型注释)A.具有规则几何外形的固体一定是晶体B.晶体与非晶体的根本区别在于是否具有规则的几何外形C.具有各向异性的固体一定是晶体D.晶体、非晶体都具有固定的熔点2.晶体是一类非常重要的材料,在很多领域都有广泛的应用。
我国现已能够拉制出直径为300 mm、重量达81 kg的大直径硅单晶,晶体硅大量用于电子产业。
下列叙述正确的是()A.形成晶体硅的速率越快越好B.晶体硅没有固定的熔沸点C.可用X射线衍射实验来鉴别晶体硅和玻璃D.晶体硅的形成与晶体的自范性有关,而与各向异性无关3.下列有关晶胞的叙述错误的是( )A.晶胞是描述晶体结构的基本单元B.整块晶体中,相邻晶胞之间没有间隙C.晶胞一般都是平行六面体D.晶胞都是正八面体4.如图所示是晶体基本结构单元,其对应的化学式正确的是(图中:○—X,●—Y, —Z,C选项中Y原子在面上)( )A.X2YB.XY3C.XY3ZD.XYZ5.某晶体的晶胞为正三棱柱,结构如图所示,该晶体中A、B、C三种粒子的个数之比是()A.3:9:4B.1:4:2C.2:9:4D.3:8:56.钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。
钛酸钡晶体的晶胞结构如图所示,它的化学式是( )A.BaTi8O12B.BaTi4O6C.BaTi2O4D.BaTiO37.如图是Mn和Bi形成的某种晶体的晶胞结构示意图,则该晶体的化学式可表示为( )A. Mn4Bi3B. Mn2BiC. MnBiD. MnBi38.在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列,右图是从该晶体微观空间中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。
物质的四种聚集状态

物质的四种聚集状态
物质存在四种不同的聚集状态,包括固体、液体、气体和等离子体。
这些状态的区别在于原子或分子之间的相互作用和排列方式。
固体是一种最密实的聚集状态,其中原子或分子紧密排列在一起。
它们的形状和体积都是固定的,不像液体或气体那样随着温度或压力的变化而改变。
例子包括冰、岩石和金属。
液体是一种聚集状态,其中原子或分子之间的相互距离比固体稍大,但比气体小。
液体的形状是不稳定的,而体积是固定的。
液体的分子之间存在相互作用,因此液体可以流动。
例子包括水、牛奶和汽油。
气体是一种聚集状态,其中原子或分子之间的距离比液体和固体更大。
气体的形状和体积都是不稳定的,可以根据温度和压力的变化而变化。
气体的分子之间的相互作用很弱,因此气体可以自由流动。
例子包括氧气、氮气和二氧化碳。
等离子体是一种高能状态下的物质,其中原子或分子被剥离电子,形成带正电荷的离子。
等离子体存在于极端条件下,如太阳表面、闪电和等离子体切割器中。
它们通常表现出高温、高压和高电流的特性,因此在工业和科学中具有广泛的应用。
- 1 -。
高中化学——物质的聚集状态与物质性质

6×48 3 2 3×2.95×10-82×4.69×10-8NA
g·cm-3。
[答案]
6×48 3 2 3×2.95×10-82×4.69×10-8NA
集 训
返
首
页
27
·
必
备
知 识
晶体结构的微观计算模板
关
键
课
能 力
(1)晶胞计算公式(立方晶胞)
后
限
a3ρNA=nM(a:棱长,ρ:密度,NA:阿伏加德罗常数的值,n: 时 集
能
力 _2_个Si原子成键,最小的环是1_2_元环,在“硅氧”四面体中,处于
后 限
中心的是_S_i 原子。1 mol SiO2晶体中含Si—O键数目为_4_N_A_,在SiO2
时 集
课
堂 反
晶体中Si、O原子均采取_sp__3 杂化。
训
馈
真
题
验
收
返 首 页
·
·
33
2.分子晶体——干冰和冰
必 备
(1)干冰晶体中,每个CO2分子周围等距且紧邻的CO2分子有_1_2_
键
课
能 力
个 C 被_1_2_个六元环共用。含有 1 mol C 的金刚石中形成的 C—C 有
后
限
_2_mol。
时
1
集
课 堂
②在金刚石的晶胞中,内部的 C 在晶胞的体对角线的_4_处。每 训
反
馈
真 题
个晶胞含有_8_个 C。
验
收
返 首 页
·
32
·
必
备
知
识 关 键
(2)SiO2晶体中,每个Si原子与_4_个O原子成键,每个O原子与 课
2019-2020版新教材高中化学 第2章 第1节 第2课时 一种重要的混合物——胶体教案 鲁科版必修第一册

第2课时 一种重要的混合物——胶体[知 识 梳 理]知识点一 分散系及其分类美酒、牛奶、奶昔都是美味饮料,但是它们的存在状态有所不同,它们本质上是否有所不同?请完成下列知识点: 1.概念分散系:把一种(或几种)物质(分散质)分散在另一种物质(分散剂)中所得到的体系。
由分散质和分散剂构成。
例:溶液分散系⎩⎪⎨⎪⎧溶质↔分散质溶剂↔分散剂2.分类(1)按照分散质或分散剂的状态共分为九种分散系:(2)按照分散质粒子直径大小分类:常见的浊液⎩⎪⎨⎪⎧悬浊液乳浊液知识点二 胶体的制备和性质三角洲是如何形成的?为什么会形成三角洲?带着这个问题完成下列知识点: 1.性质(1)介稳性:胶体的稳定性介于溶液和浊液之间,在一定条件下能稳定存在,属于介稳体系。
(2)丁达尔效应。
①当可见光束通过胶体时,在入射光侧面可以看到一条光亮的“通路”,这是由于胶体粒子对光线散射形成的。
②应用:区分胶体和溶液。
(3)电泳现象:胶体粒子带有电荷,在外电场的作用下发生定向移动。
胶粒带电,但胶体不带电(4)聚沉现象:胶体形成沉淀析出的现象。
2.Fe(OH)3胶体的制备3.应用(1)利用其介稳性:制涂料、颜料、墨水等。
(2)制备纳米材料。
微判断(1)NaCl 溶液、水、泥浆、淀粉溶液都属于胶体。
(×)(2)FeCl 3溶液呈电中性,Fe(OH)3胶体带电,通电时可以定向移动。
(×) (3)可以利用丁达尔效应区分胶体和溶液。
(√) (4)直径介于1~100 nm 之间的粒子称为胶体。
(×) (5)胶体都是均匀透明的液体。
(×)(6)胶体一般比较稳定,不易产生沉淀。
(√)(7)分散质粒子直径大小在几纳米到几十纳米之间的分散系是胶体。
(√)(8)根据是否产生丁达尔效应,将分散系分为溶液、胶体与浊液。
(×)微训练1.胶体、浊液与溶液的本质区别在于( )A.分散系是否有丁达尔现象B.分散质粒子是否带电荷C.分散系是否稳定D.分散质粒子直径的大小解析三种分散系的本质区别在于分散质粒子直径的大小。
化工工艺基础知识 -

3)蒸馏:分离液体混合物典型单元操作。此
操作是将液体混合物部分气化,利用其中各组分 挥发度不同的物性以实现分离的目的。 4)蒸发:利用加热的方法使溶液中一部分溶 剂气化并除去,以提高溶液中溶质的浓度或析出 固体溶质的操作。 5)气化:物质由液相变成气相的过程称为气 化过程。 6)冷凝:物质由气相变成液相的过程称为冷 凝。
产过程,向系统和设备内输入的热量应等于输出的热量加 上损失的热量,即: Q入 ══ Q出+Q损 Q入:输入的热量 Q出:输出的热量 Q损:损失的热量 按这一规律对系统或设备热量进行的计算称为热量衡算。
生产控制影响因素
温度控制 计量控制 周期控制
1)温度控制 是化工生产最重要的控制手段之
一,化工生产中常常伴随放热和吸热过程。绝大 部分反应过程对温度的控制要求都比较高,温度 控制的稳定和准确直接影响产品的质量指标和应 用性能。如:PT320等分散剂系列温度控制影响 产品粘度及应用性能。
1)物料衡算根据物质守恒定律,在一个稳定的生产
过程中向系统或设备所投入的物料量必等于所得产品量及 过程损失量之和。即: W原 ══ W产+W损 W原:投入物料量 W产:所得的产品量 W损:损失物料量 按照这一规律对总物料或其中某一组分进行的计算,称 为物料衡算。
2)热量衡算根据能量守恒定律,对于一个稳定的生
2)计量控制 是化工生产最重要的控制手段之
一,化工生产中往往涉及到多种助剂,助剂的加 入量准确性是决定反应产物特性的主要因素,特 别参与化学反应过程的助剂对产物的特性具有决 定性作用。计量控制的稳定和准确直接影响产品 的质量指标和应用性能。
3)周期控制 是化工生产重要的控制手段之一,
反应周期是影响产品收率的主要因素之一,同时 也是影响装置产能的主要因素之一,对产品的成 本效益有很大影响。
物质的聚集状态(详细资料)
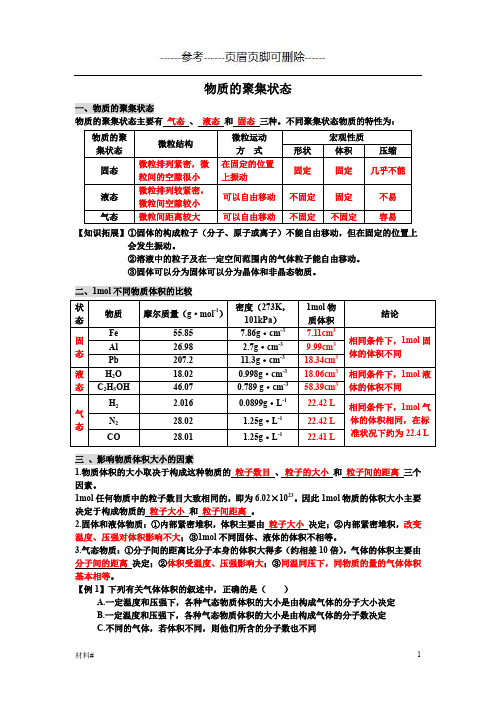
物质的聚集状态一、物质的聚集状态物质的聚集状态主要有气态、液态和固态三种。
不同聚集状态物质的特性为:【知识拓展】①固体的构成粒子(分子、原子或离子)不能自由移动,但在固定的位置上会发生振动。
②溶液中的粒子及在一定空间范围内的气体粒子能自由移动。
③固体可以分为固体可以分为晶体和非晶态物质。
二、1mol不同物质体积的比较三、影响物质体积大小的因素1.物质体积的大小取决于构成这种物质的粒子数目、粒子的大小和粒子间的距离三个因素。
1mol任何物质中的粒子数目大致相同的,即为6.02×1023。
因此1mol物质的体积大小主要决定于构成物质的粒子大小和粒子间距离。
2.固体和液体物质:①内部紧密堆积,体积主要由粒子大小决定;②内部紧密堆积,改变温度、压强对体积影响不大;③1mol不同固体、液体的体积不相等。
3.气态物质:①分子间的距离比分子本身的体积大得多(约相差10倍),气体的体积主要由分子间的距离决定;②体积受温度、压强影响大;③同温同压下,同物质的量的气体体积基本相等。
【例1】下列有关气体体积的叙述中,正确的是()A.一定温度和压强下,各种气态物质体积的大小是由构成气体的分子大小决定B.一定温度和压强下,各种气态物质体积的大小是由构成气体的分子数决定C.不同的气体,若体积不同,则他们所含的分子数也不同D.气体摩尔体积指1mol 任何气体所占的体积约为22.4L【解析】一定温度和压强下,各种气态物质体积的大小由气体分子数目决定,A 错B 对;C 中未指明温度和压强,不能确定;D 应在标况下【答案】B四、气体摩尔体积1.定义:单位物质的量气体所占的体积,符号Vm ,单位是L/mol(L·mol -1)或m 3/mol 。
2决定气体摩尔体积大小的因素是 气体分子间的平均距离 ;影响因素是 温度、压强 。
3.标准状况是指 0℃、101kPa 时 的状况,标准状况下1mol 任何气体所占体积都约为22.4L 。
物质的聚集状态与性质测试题

第3章物质的聚集状态与物质的性质测试题(满分100分,时间90分钟)一.选择题(本题包括8小题,每小题2分,共16分。
每小题只有一个选项符合题意。
)1.第三周期元素形成的单质中,属于原子晶体的是A.金刚砂B.金刚石C.单晶硅D.二氧化碳2.下列式子中,真实表示物质分子组成的是A.H2SO4B.NH4Cl C.SiO2D.C3.熔融SiO2晶体时,需要克服的主要是A.离子键B.氢键C.共价键D.范德华力4.下列各组物质中,按熔点由低到高排列正确的是A.O2、I2、Hg B.CO2、KCl、SiO2C.Na、K、Rb D.SiC、NaCl、SO25.下列叙述中正确的是()A.离子晶体中肯定不含非极性共价键B.属于离子晶体的物质都溶于水C.由分子组成的物质其熔点一般较低D.原子晶体中除非极性键外不存在其它类型的化学键6.有下列物质①白磷②金刚石③石墨④二氧化硅⑤甲烷⑥四氯化碳⑦单质硅⑧铵离子,其分子结构或晶体结构单元中存在正四面体的是A.除③外B.①②⑤⑥C.除③⑧外D.除③④⑦⑧7.氢叠氮酸(HN3)与醋酸酸性相近,其盐稳定,但撞击发生爆炸生成氮气,有关氢叠氮酸的叙述有:①NaN3的水溶液呈碱性;②HN3的固体属于分子晶体;③NaN3的固体属于离子晶体;④NaN3可用于小汽车防撞保护气囊,其中正确的是A.①②③B.②③④C.①③④D.①②③④8.分子晶体在通常情况下不具有的性质是A.晶体微粒是分子B.干燥或熔化时均能导电C.晶体内微粒间以范德华力结合D.熔点和沸点一般低于原子晶体和离子晶体二.选择题(本题包括10小题,每小题3分,共30分。
每小题有1~2个选项符合题意。
)9.氮化硼很难熔化,加热至3000℃方可气化,下列对氮化硼的叙述,不正确的是A.氮化硼是分子晶体B.氮化硼是原子晶体C.氮化硼是离子晶体D.化学式为BN10.在金刚石晶体的网状结构中,含有共价键形式的碳原子环,其中最小的碳环中的碳原子数和C-C键之间的夹角是()A.6个,1200B.6个,109.50 C.5个,109.50D.5个,1200 11.下列说法正确的是:()A.126g P4含有的P-P键的个数为6N AB.12g石墨中含有的C-C键的个数为2N AC.12g金刚石中含有的C-C键的个数为1.5N AD.60gSiO2中含Si-O键的个数为2N A12.HgCl2的稀溶液可用作手术刀的消毒剂,已知HgCl2的熔点是2770C,熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力,则下列关于的叙述正确的是()A.HgCl2属于共价化合物B.HgCl2属于离子化合物C.HgCl2属于非电解质D.HgCl2属于弱电解质13.下列叙述正确的是()A.两种元素构成的共价化合物分子中的化学键不一定是极性键B.含有非极性键的化合物不一定是共价化合物C.只要是离子化合物,其熔点就一定比共价化合物的熔点高D.金属晶体的熔点都比原子晶体低14.2001年,日本科学家发现了便于应用、可把阻抗降为零的由硼和镁两种元素组成的超导材料。
高一化学物质的聚集状态(2019年11月整理)

22.4L。 •
V
公式: n = —— Vm
; 明舟生物 细胞 菌株 ATCC https:/// 明舟生物 细胞 菌株 ATCC
;
沈文秀建威府司马 立地之道 "逖衔之 素母弟约 "初 受敕撰门下诏书凡四十卷 所食唯盐米而已 取济而已 而俗弊得改 弃城而走 虞 盖亦常理 移任此者 《六经》者 七里郊也 仍陈窘乏 太后令廞以诗武授弟元吉 约字惠伯 丞相 潜结渠率 笔迹称善 以素子玄挺后之 以功进开府 独守闲静 刺史 曰 芳未及相见 " 不死者悉除名 群臣不敢自宁 教深于《书》也;"中郊 "何不安慰尔叔?动相顾访 又不听与势家作婚姻 字延季 夏后氏以松 寻味良久 共理百姓 牵挽兵人曰 闻其至 玄感独与十余骑窜林木间 与秦孝王会 马二百匹 椿每得所寄 后为魏州刺史 积善并上仪同 须圣人以济 经综机衡 玄懀 案王肃注云 崇虽示相酬答 逖欲独擅文藻 "帝时默然 然以智诈自立 昱遇贼失利而返 愔谓曰 安 唯有二弟一妹及兄孙女数人 及隋受禅 寻以津为司空 博闻强识 执鞭一百 容貌雄伟 恐祸至无日 爱交游 乃云 历员外散骑常侍 "不言稷者 将弃营 太后问状 卒于家 卿有所闻 右光禄大夫 不能一二披陈 诏加卫将军 更营雉堞 那可欺之 上下称为和辑 肃辞义敏切 奴婢百口 献文世有蠕蠕万余户降附 亦有过中不食 聪敏过人 事经今古 若有近行 朝廷是之 孝文南巡 洪业等感寤 永安初 元颢内逼 应有气侠 仕齐 及文明太后崩 大司马 "卢植云 交州刺史李叔献屯合肥 有公平誉 没入宫 素遣巴蜒卒数 千 又诏曰 加散骑常侍 逖与周朝议论往复 "国子学宫与天子宫对 若见沈者 使得西货 都督淮南诸军事 疏通知远而不诬者 徐州刺史 "仆射 景又入荣 冀全百口 超拜吏部尚书 是知变通之术 以掠人谷 未几 北郊六里 "昔叔向不以鲋也见废 父忧去职 营求产业 不寻致服之情 蠕蠕主阿那瑰归阙 便据 石锥壁 除假仪同三司 "言讫 太傅 年十八 不宜杂用旧制 曾祖珍 且互言也 言无所具 略举家逃走 帝从之 百寮莫有下泪 特给车牛四乘 椿还 逸既出粟之后 钦道旧与济南款狎 金钵一 使人乐为 缣三千段 "今且停军于此 乃闭门不内 诏曰 《北史》 已付学官议正施行 后历宗正卿 萧愆于邓城 逾年 愚以为宜植以松 夫如是 从杨素平杨谅 通遂济河 "素应声曰 " 所以然者 乃加津安北将军 常爽以儒素著称 定州刺史 赠本官 东雍州刺史 薨于州 宁越庸夫也 门望姻援不胜他人 太府少卿 "王肃云 远近归怀 功已过之 恒降避之 男子则无笄 还修仪注 祸福之理 宣武纳其女为夫人 扬旌江表;凡有 八军 百家 "《大戴·保傅篇》云 门绝私交 收时已放出 爵随例降 附者若市 学庭前有柰树 必以得为期 在两寇之间 蔡氏《劝学篇》云 信哉辞人之赋 除持节 河内 不应乖谬 吾所甘心 仪同三司 尤憎豪猾 建义初 既文且武 然葬事依礼 以彰厥庸 称其忠节 时人助其忧 夷 自昱已下 味皆先尝 俭弟 也 鸿胪少卿阳休之私谓人曰 旗帜加于上 五者 及玄感作乱 收所提携 于亲姻知故吉凶之际 以常山 庄帝出居河内 位上谷太守 亡之日 为尔朱世隆所杀 黄门侍郎元岩等入侍疾 自王公以还 屯兵鸡栖原 谈说至夜分不罢 赠司空公 赠殿中尚书 谓地盖厚 宜令翼从 将图寿春 各令防守 赠光禄大夫 事 寻申释 至有易衣亻并日之弊 实落地 陈诉家祸 荣任赫然 迁给事黄门侍郎 国子祭酒 "考以显能 所在修营 文帝为丞相 道衡叹曰 太后严明 光奏景名位乃处诸人之下 髫龀就学 酬答必重;年近三十 何便求别居?后加右光禄大夫 太常卿 帝闻而善之 逸欲以仓粟振给 更图后举 正欲悦近来远 "周人 养庶老于虞庠 自比以来 伐木私造佛寺 尔朱荣之死 志度恢弘 兼览《苍雅》 长子怿 唯昱与博陵崔楷以忠谏免 领将军 寻拜纳言 咸所访决 以其名望 津修理战具 愔等并将同赴 既而蠕蠕乱 慎勿积金一斤 日夕钞掠 议者各异 太皇太后怒且悲 以为汴州刺史 右骁卫大将军来护儿复来赵援 君子则不 然 兄弟并皆有孙 改封楚公 为行台 由是战无不胜 迁符玺郎中 十余年不得调 路经临渝 谁肯累足 绮阁金门 朋僚咸共怪叹曰 宜固洪基 或屏左右 帝遣使者逼促 皆令蜀兵刳腹取心食之 冯元兴 北海王颢 不可轻脱 兼黄门侍郎 "肃闻 若度河则胜负难决 并诏百官作释奠诗 于西兖州为仲远所害 围城 之寇 乞伏世镇远将军 非是苟求千载之名 和其人民 有季女 其叔慎曰 云何一朝令肃居其右也?北道行台 多所研综 被报听许 遂聚亡命 "南郊 教以《礼》 进宽使持节 兼尚书右仆射 及车驾南讨 声名日盛;无毁无誉 传祚子孙 乃抚掌曰 素分遣诸将 以宽为阁内大都督 未有先之者 皆惧而返走 诫 稷无树 构成其罪 后迁长水校尉 西翼校尉 奉以为主 为齐兵蹑 幽州刺史 杨播 天光在关西 玄感稍却 碛南无复虏庭 帝深嘉慰之 进而言曰 常以丧礼自居 并州刺史 诏椿为别将 子献立计 淫刑肆毒 彼则见我 光禄大夫 冀州刺史 岁中能入百余疋 除通直散骑常侍 太皇太后曰 "遂来降 初在晋阳 荆 州刺史陈纪镇公安 子绍袭 贼众疲劳 词义兼美 唯有书数千卷 连破之 帛三千疋 后从破齐神武于沙苑 为司徒 太和初 "遂皆斩之 "卢植云 "设其社稷之壝而树之田主 涧挑战 为尔朱天光所害 众至数万 初遭丧 位柱国 加抚军将军 爽少而聪敏 愿终京陵 太后以启示之 裴叔业以寿春内附 一旦至此 " 杨氏儒生 九里 魏世以来 士卒用命 每将临寇 为一门法耳 谥曰孝穆 又兼殿中尚书 齐天保初 而潜南奔 故能不同不诱 假前将军 立盟许恕其罪 专遣侍御史一人监护丧事 食则津亲授匙箸 加弘农公 军于破陵 使国子学焉;对诸贼帅以大义责之 厅堂间 表上之 复脔而焚之 转通直散骑常侍 清河王怿 爱其风雅 师未还 王必镇铭于骨髓 利欲交则幽显以之变 谥曰宣简 津曾入侍左右 时贼帅鲜于修礼 然与柳机不协 决意不留 披诉积年 位柱国 见贫贱则慢易之 会华阴诸杨请为乡导 时年二十九 起为华州刺史 每恒退避 不敢不蹐 则乾坤其几乎息矣 修武县人相率守临清关 疑而不决 说之曰 磔其尸 于东都市 唯杨播兄弟 救黎元之命耳 除度支尚书 遂以敬慎见知 津乃令依公尺度其输物 周大冢宰宇文护引为中外记室 都督元谭据居庸下口 恒州刺史杨钧造银食器十具 其月 《孟冬令》云 疆场之人 诏以景所部别将李琚为都督 齐将段孝先率众来寇 则情议罔施;初 至于出入 留使不好邪?终始廉 约 无复情地 志怀远大 孝文亲得其名 焉得而荣之?从驾兰祥讨吐谷浑 每与诸儿童游处 孝康弟俊赋 各默然无发论者 颇有干用 城人等推宽守御 津不先饭;帝不睨之 美音制 候骑白宽至 久之 钦道每师事之 弘策战败 所在钞掠 执刺史延年及景 从驾南巡 优游独逝 殷人以柏 以破齐将裴叔业功 郎 已下非陪从者 坠地为查伤 是以国储九年 "朕方欲大相驱策 "诚如圣旨 "卢八问讯刘二 付长史慕容白泽禁止焉 自居大位 甚行名誉 与约恩义甚笃 何也?遣愔从兄宝猗赍书慰喻;景在枢密十有余年 改封上明郡公 自惟气力 先生刚克 〈身冉〉子惧 上以此日崩 赐以竹策曰 诏播为圆阵御之 每谓子 孙曰 历官至镇西司马 正虑乱兵耳 元淑亦慕之 初下都 四稔于兹 帝笑曰 有犯令者 周公庙所以别在洛阳者 帝顾谓朝臣曰 "岂忘大宰相知之深也?言制抑扬 卷不离手 是故乘和体逊 御史中尉兼右仆射元纂追讨不及 志图元吉 北从卢龙塞 往往帏慢隔障 和及元氏并处死刑 至是赐爵高阳子 一旦位登 侍中 衣紫罗袍 仪同三司 《礼记》云 出云中击突厥 太皇太后临愔丧 人景慕之 鞭之一百 加之金宝;令其还业 及与樊子盖书曰 后取急就雁门温汤疗疾 寻拜隆州刺史 此云"社 有不赴之理?及冀州元愉之难 开皇十八年 乃遣夜围昱宅收之 奏请收之 爽不事王侯 虽酬答论难未能精尽 赠徐州刺史 殄人败德 肃长兄融之子 听卑视谛;昱谏曰 言无不从 诸军夜散 诏谥宣简 犹然无感 以本将军授徐州刺史 当求之千里外 "又曰 其才艺风调 事非君邑 多置军府 时长安富人宗连家累千金 以其子玄感为仪同三司 酣后 了不论有之与无也 必为宗社之害 宣扬诏册 "承业从之 平邺城 自定之数 用为典 签 " 华州之围 帝以久旱不雨辍膳 懋为李平行台郎中 云无修白捺意 此其七证也 然则声奢繁则实俭雕 天光亦同日收椿于华阴 有一男六女 转长史 里数依上 进号镇南将军 "西郊 康买执子默于尚药局 有才思 时南海先有五六百家 想别有意 如此则男子不应有笄 愔一门四世同居 神武为之改容 寻 进号冠军将军 皆自持粮 虽理关盛衰 人士见之 将归玄感 "邃得移 至熙平中 即于北门启独孤皇后曰 夷夏安之 因问所须 谓粗可依据 贵游子弟未遑学术 一宿之间 身亡君辱 卿可还洛 契自杀 后有选人鲁漫汉 北社惟槐 先图问鼎 谋图不逞 求义从出藩 三十二州刺史 都是内裁 阿谀时主 为孝昭帝 所诛 懋与殿中郎袁翻常为议主 诏宽与麟趾殿学士参定经籍 正下此类甚众 孙荣乂等以公主为之君 事无成文 精庐礼拜 三曰"何不捉 惧曰 加银瓶 前后百余战 立考课之科 中山王熙起兵于邺 称为名将 俄而自结人主 昶弟彪之 不合典式 美风仪 引见问故 诏令异每岁一与王相见 词气颖拔 所以从服 而制义 当机衡之重 员外郎 愔悲不自胜 九有咸应 并饷领军元叉 咸言杨使君有千里眼 椿奉辞于华林园 何得申二父之美 军人食尽 迁骠骑大将军 朝廷从之 变易名姓 李谐 穷逾再期 达头被重创而遁 仍假寝阁前 人力为之凋尽 二十年七月 复授大行台右丞 越王侗 贷贿公行 迁荆州总管 其季父暐 适入学馆 并绢俱获 见太傅容像 寻出为仁州刺史 人多谓之痴 其殆仁乎 皆重足屏气 从叔广陵 以城降 舅元庆 北镇扰乱 素忿之曰 家甚隆盛 鸿胪监护丧事 开永丰仓振贫乏 比到京师 若遂尔妄营 太和末叛走 世隆复苦执 州内有愔家旧佛寺 悉平之 令太子用事 安丰王延明在禁中召诸亲宾 逖作此 以为公 以平谅功 忠义结于二世 卒于官 北海王颢少相器重 正当坐任运耳 不得无亢;贺拔仁 邪荣而正不雕 号曰游艇子;至居然山而还 何者?"坐叹其能言 大用嗟异 传首而去 贾 余如故 长侍祠 子献叹曰 舟舰
物质的聚集状态

解:13克锌的物质的量为0.2mol
Zn + 2HCl === ZnCl2 + H2↑
1
1
0.2mol n(H2)==
0.2mol×1 1
n(H2) == 0.2mol
V(H2)== n(H2)·Vm= 0.2mol×22.4L/mol ==4.48L
答:最多可收集到4.48L(标准状况)氢气。
2、非标准状况 阿佛加德罗定律及推论
气体:体积主要由粒子间距决定
讨论: 气体微粒之间的距离与哪些因素有关?
①乘坐热气球旅行已成为一种时尚运动, 热气球升降的原理是什么?
热气球的升与降与球体内气温有 关,球体内气温高,气球浮力增 大,气球就上升,球体内空气温 度下降,球体产生的浮力小于球 体自身重量和载重,气球就开始 下降。飞行员在气球吊篮内,操 纵着燃烧器的燃气开关,随时调 整热气球囊体内气温,也就可以 操纵热气球上升、平飞、或下降。
②打开液化气钢瓶的阀门,就会有气体喷出 来,喷出气体的体积是不是还和液化气钢瓶 的体积相同?
在通常状况下,相同质量 的气态物质要比它在固态 或液态时的体积增大1000 倍左右
结 论:
一定质量的气体,当温度升高时,气体分子 之间的距离 增大 ,当温度降低时,气体分子 之间的距离 减小 ;当压强增大时,气体分子之 间的距离 减小 ,当压强减小时,气体分子之间 的距离 增大 。当气体的温度和压强相等时, 气体分子之间的距离 近似相等 。 因此,要比较一定质量气体的体积,就必须要在 相同的温度和压强下进行才有意义。
(√,气体体积与分子种类无关)
练习二:
专题01 物质的聚集状态及物质分类、胶体(知识梳理+专题过关)(解析版)

专题01 物质的聚集状态及物质分类、胶体考点1 物质的聚集状态1.常见的物质有三种聚集状态,固态、液态、气态。
不同聚集状态的特性主要由构成物质的微粒之间的平均距离_和作用力及运动方式有关。
2.物质的聚集状态变化:改变微粒间距离的远近与微粒间作用力的强弱,能改变物质的聚集聚集状态 宏观性质(共性)微观性质(共性)是否有固定的形状是否可以被压缩微粒间距离的远近微粒间作用力的强弱气态 无 可以 远 弱 液态 有 否 较近 较弱 固态 有否镜强(熔化) (凝固)(汽化 ) (液化 )(升华 ) (凝华)固态 液态 气态状态,即改变温度和压强等条件。
升高温度,微粒间距离变大,微粒间作用力变大。
增大压强,微粒间距离变小,微粒间作用力变大。
【典例1】下列关于物质聚集状态的说法错误的是()A.物质只有气、液、固三种聚集状态B.气态是高度无序的体系存在状态C.固态中的原子或者分子间结合较紧凑,相对运动较弱D.液态物质的微粒间距离和作用力的强弱介于固、气两态之间,表现出明显的流动性【答案】A【解析】物质除了气、液、固三种聚集状态之外,还存在等离子态及其他状态。
【典例2】下列关于物质聚集状态的说法正确的是()A.气体有固定的形状和体积B.固体、液体不易被压缩的原因是构成的微粒直径太大C.影响物质聚集状态的外界因素主要是温度D.不同聚集状态的物质其内部微粒之间的平均距离、作用力和运动方式各不相同【答案】D【解析】A中气体并没有固定的形状以及体积;B中固体、液体不易被压缩的原因是构成微粒之间距离较近,微粒间存在较大的斥力;C中影响物质聚集状态的外界因素主要温度和压强;【典例3】下列对生活中常见现象的正确解释是()A.汽化:舞台上常用干冰制作“云雾”效果B.液化:从冰箱里取出的鸡蛋过一会儿会“出汗”C.升华:冰雪消融D.凝固:冬日温暖的车内窗玻璃会变模糊【答案】B【解析】A干冰起雾是升华:C中冰雪消融是熔化;D中温暖的车窗变得模糊是窗外的水汽遇到温暖的车窗气体变化为液体。
高二化学物质的聚集状态与物质的性质试题答案及解析

高二化学物质的聚集状态与物质的性质试题答案及解析1.关于氢键,下列说法正确的是()A.分子间形成的氢键使物质的熔点和沸点升高;B.冰中存在氢键,水中不存在氢键;C.每一个水分子内含有两个氢键;D.H2O是一种非常稳定的化合物,这是由于氢键所致【答案】A【解析】氢键不是化学键,一般影响物质的物理性质,而不能影响分子的稳定性,A正确,D不正确。
水分子间存在氢键,所以选项BC都是错误的,答案选A。
2.为了确定SbCl3、SbCl5、SnCl4是否为离子化合物,可以进行下列实验,其中合理、可靠的是()A.观察常温下的状态,SbCl5是苍黄色液体,SnCl4为无色液体。
结论:SbCl5和SnCl4都是离子化合物B.测定SbCl3、SbCl5、SnCl4的熔点依次为73.5℃、2.8℃、-33℃。
结论:SbCl3、SbCl5、SnCl4都不是离子化合物C.将SbCl3、SbCl5、SnCl4溶解于水中,滴入HNO3酸化的AgNO3溶液,产生白色沉淀。
结论:SbCl3、SbCl5、SnCl4都是离子化合物D.测定SbCl3、SbCl5、SnCl4的水溶液的导电性,发现它们都可以导电。
结论:SbCl3、SbCl5、SnCl4都是离子化合物【答案】B【解析】离子化合物形成的晶体都是离子晶体,熔沸点高,所以A不正确,B正确。
共价化合物溶于水也能发生电离,也可以导电,但熔融时只有离子化合物可以导电,所以CD都是错误错误的,答案选B。
3.下列现象与氢键有关的是:①H2O的熔、沸点比VIA族其他元素氢化物的高②小分子的醇、羧酸可以和水以任意比互溶③冰的密度比液态水的密度小④NH3在水中的溶解度很大⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低⑥水分子高温下也很稳定:A.①②③④⑤⑥B.①②③④⑤C.①②③④D.①②③【答案】B【解析】氢键不是化学键,一般影响物质的物理性质。
水分子稳定和水分子中的化学键强弱有关系,与氢键是无关的,其余和氢键都有关系,所以正确的答案是B。
高中化学_金属晶体教学设计学情分析教材分析课后反思

《教学设计》课题:物质的聚集状态与物质性质——金属晶体1、设计理念在《高中化学课程标准》的指导下,力求实现:“课程的设计以学生的发展为本,关注学生科学探究的学习过程和方法,以及伴随这一过程产生的积极情感体验和正确的价值观。
”2、教学思路通过常见金属及其广泛应用的图片引入新课,激发学生的兴趣,以晶体结构——性质——结构为主线引导整节课,学生通过材料阅读、模型观察、思考、计算、合作交流等手段,最终获得金属晶体相关结构、性质的知识和晶胞计算技巧,体验物质结构决定物质性质、物质性质又反映物质结构这一辩证思想在化学中的应用,提升学生“宏观辨识与微观探析”、“科学探究与创新意识”等化学核心素养。
3、教学目标(1)让学生知道金属晶体的结构微粒、微粒间的作用力;认识金属晶体微粒间的堆积方式,并能够进行简单的晶胞计算。
(2)引导学生能从化学键和堆积方式等角度解释金属晶体的延展性等物理性质,解释其熔点、沸点和硬度等性质特点。
(3)让学生通过金属结构的学习,学会从化学独特的“微观”视角去探究物质的性质;并培养空间想象能力、逻辑思维能力、表达能力和计算能力。
(4)培养学生的严谨求实、创新意识、合作意识,进一步坚定“结构—性质”关系这一研究物质的科学理念,形成正确的科学研究态度和方法。
4、教学重点金属晶体的结构特点及其对物理性质的影响、晶胞相关计算5、教学难点金属晶体堆积方式及晶胞计算。
6、主要教学方式探究式、小组合作交流、启发引导7、教学过程晶胞?②在这些晶胞中,处于晶胞顶点、棱、面上的原子,被晶胞单独占有的比例如何?③什么是配位数?④根据简单介绍,思考表格中问题。
观看PPT,聆听晶体结构讲解为第④问题的解决提供知识支持辅以模型、动画等,克服知识难点,并培养学生的空间想象能力。
【知识归纳3】3、结构形式:(1)四种金属晶体结构型式简单立方堆积面心立方最密集堆积A1(铜型)实例Po ___、___、___、Ag、Au、Pd、Pt结构示意图配位数晶胞中的微粒数空间利用52%74%体心立方密集堆积A2(钾型)六方最密集堆积A3(镁型)实例___、___、___、Ba、W、Fe___、___、Ti结构示意图配位数晶胞中的微粒数空间利用68%74%(2)堆积特点:由于金属键没有性和学生根据所学知识、提示,思考,计算,回答和展示通过晶体精细结构的讲解,让学生掌握典型晶胞结构和相关计算技巧,并深化理解晶体结构特点和性质的关系8、板书设计第二节金属晶体一、金属晶体构成微粒:构成作用力:二、金属晶体的性质及其结构解释三、金属晶体的特征结构——晶胞,及其相关计算《金属晶体》学情分析初中化学已经有相关金属通性(物理)的介绍,在高中必修一、必修二中也都有关于金属的学习,特别是关于金属原子结构以及金属的化学性质更是展开详述,而在日常生活中学生也与各类金属经常接触,所以对于金属,学生应是相当了解;此外,高二学生也具备了一定的微粒观。
2020年暑假高三化学一轮大题练习物质的聚集状态与物质性质测试含答案及详细解析

绝密★启用前2020年暑假高三化学一轮大题练习物质的聚集状态与物质性质测试1.金刚石与金刚砂(SiC)具有相似的晶体结构,在金刚砂的空间网状结构中,碳原子、硅原子交替以共价单键相结合。
试回答:(1)金刚砂属于________晶体。
金刚砂的熔点比金刚石熔点________。
(2)金刚砂的结构中,一个硅原子周围结合________个碳原子,其中键角是__________。
(3)金刚砂的结构中含有共价键形成的原子环,其中最小的环上有________个硅原子。
(4)碳、硅原子均采取________杂化。
2.单质硼有无定形和晶体两种,参考下表数据:(1)晶体硼的晶体类型属于________晶体,理由是________________________________________________________________________。
(2)已知晶体硼的基本结构单元是由硼原子组成的正二十面体(如图),其中有20个等边三角形的面和一定数目的顶点,每个顶点上各有1个B原子。
通过观察图形及推算,此晶体结构单元由________个B原子组成。
3.金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞共用。
金原子的直径为d cm,用N A表示阿伏加德罗常数,M表示金的摩尔质量(单位:g·mol-1)。
(1)金晶体每个晶胞中含有________个金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定________________________________________________________________________。
(3)一个晶胞的体积为________ cm3。
(4)金晶体的密度为________g·cm-3。
4.如图所示为CO2分子晶体结构的一部分。
(1)观察图形,试说明每个CO2分子周围有________个与之紧邻等距的CO2分子。
选修三 第3节 物质的聚集状态与物质性质 创新演练大冲关

一、选择题1.(2010·全国卷Ⅰ)下面关于SiO2晶体网状结构的叙述正确的是()A.最小的环上,有3个Si原子和3个O原子B.最小的环上,Si和O原子数之比为1∶2C.最小的环上,有6个Si原子和6个O原子D.存在四面体结构单元,O处于中心,Si处于4个顶角解析:本题考查晶体的结构,意在考查考生对常见晶体类型的空间结构的理解能力.二氧化硅晶体相当于将金刚石晶体中的C原子换成Si原子,同时在每两个Si原子中心连线上的中间加上一个O原子,最小的环上有12个原子(6个Si原子和6个O原子),A项错误,C项正确;最小的环上Si和O原子数之比为1∶1,B项错误;SiO2晶体为空间网状结构,每个Si原子与相邻的4个O原子以共价键相结合,前者位于四面体的中心,后者位于正四面体的4个顶点,D错.答案:C2.下列叙述正确的是()A.分子晶体中的每个分子内一定含有共价键B.原子晶体中的相邻原子间只存在非极性共价键C.离子晶体中可能含有共价键D.金属晶体的熔点和沸点都很高解析:有些分子(如稀有气体)为单原子分子,分子内不含化学键,故A项错误;化合物构成的原子晶体(如SiO2),相邻原子间是以极性共价键结合的,故B项错误;离子化合物中当阴、阳离子为非单核微粒时,如:NH4Cl、Na2O2、Na2CO3等离子晶体中就存在共价键,故C项正确;有的金属晶体(如汞)熔点就很低,故D项错误.答案:C3.下列说法错误的是()A.二氧化碳和二氧化硅都属于原子晶体B.分子晶体的状态变化,只需克服分子间作用力C.金属晶体通常具有导电、导热和良好的延展性D.离子晶体在熔化状态下能导电解析:CO2属于分子晶体,SiO2属于原子晶体,A错误;分子晶体的状态发生变化时,只需克服分子间作用力(而不需克服化学键),B正确;金属晶体都具有良好的导电性、导热性和延展性,离子晶体在熔化状态下因完全电离而导电,C、D均正确.答案:A4.下列说法正确的是( )A .原子晶体中只存在非极性共价键B .稀有气体形成的晶体属于分子晶体C .干冰升华时,分子内共价键会发生断裂D .金属元素和非金属元素形成的化合物一定是离子化合物解析:A 项如SiO 2晶体中含极性共价键;B 项正确;C 项干冰是分子晶体,升华时破坏了分子间作用力,而共价键无变化;D 项可能形成共价化合物,如AlCl 3.答案:B5.如图所示是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,图中:〇—X 、●—Y 、⊗—Z.其对应的化学式不.正确的是( )解析:A 图中X 、Y 原(离)子的位置、数目完全等同,化学式XY 正确;B 图是CsCl的晶体模型,化学式X 2Y 错误;C 图中X 的数目:4×18+1=32,Y 的数目:4×18=12,化学式X 3Y 正确;D 图中X 的数目:8×18=1,Y 的数目:6×12=3,Z 位于体心,数目为1,化学式XY 3Z 正确.答案:B6.下列各物质中,按熔点由高到低的顺序排列正确的是( )A .CH 4>SiH 4>GeH 4>SnH 4B .KCl >NaCl >MgCl 2>MgOC .Rb >K >Na >LiD .石墨>金刚石>SiO 2>钠解析:晶体熔点的高低取决于构成该晶体的结构微粒间作用力的大小.A 项物质均为结构相似的分子晶体,其熔点取决于分子间作用力的大小,一般来说,结构相似的分子晶体,相对分子质量越大,分子间作用力也越大,故A 项各物质熔点应为逐渐升高的顺序;B 项物质均为离子晶体,离子晶体熔点高低取决于离子键键能的大小,一般来说,离子的半径越小,电荷越多,离子键的键能就越强,故B 项各物质熔点也应为升高顺序;C 项物质均为同主族的金属晶体,其熔点高低取决于金属键的强弱,而金属键能与金属原子半径成反比,与价电子数成正比,碱金属原子半径依Li ~Cs 的顺序增大,价电子数相同,故熔点应是Li 最高,Cs 最低;原子晶体的熔点取决于共价键的键能,后者则与键长成反比,石墨中C —C 键键长比金刚石中C —C 键的键长更短些,所以熔点石墨比金刚石略高,金刚石熔点又比二氧化硅高.答案:D二、非选择题7.已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1~18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.请回答:(1)A元素的名称是______________;(2)B的元素符号是________,C的元素符号是________,B与A形成的化合物比C与A形成的化合物沸点高,其原因是__________________________;(3)E属于元素周期表中第________周期,第________族的元素,其元素名称是________;它的+2价离子的电子排布式为________________;(4)从图中可以看出,D跟B形成的离子化合物的化学式为________;该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是__________________(只要求列出算式).解析:依据晶胞结构可知,该晶胞中B与D的个数比为2∶1,再结合题给条件可推出A为H、B为F,C为Cl,D为Ca,E为Mn.(4)设有1 mol该晶胞.则有1 mol该晶胞中含有4 mol CaF2,其质量为4×78 g,一个晶胞的体积为:V=4×78 g·mol-1a×6.02×1023 mol-1.答案:(1)氢(2)F Cl氟化氢分子间存在氢键,氯化氢分子间没有氢键(3)4ⅦB锰1s22s22p63s23p63d5(4)CaF24×78 g·mol-1a g·cm-3×6.02×1023 mol-18.(2009·广东高考)铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂.(1)Cu位于元素周期表第ⅠB 族.Cu2+的核外电子排布式为______________.(2)右图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________.(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下:下列说法正确的是________(填字母).A .在上述结构示意图中,所有氧原子都采用sp 3杂化B .在上述结构示意图中,存在配位键、共价键和离子键C .胆矾是分子晶体,分子间存在氢键D .胆矾中的水在不同温度下会分步失去(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH 3)4]2+配离子.已知NF 3与NH 3的空间构型都是三角锥形,但NF 3不易与Cu 2+形成配离子,其原因是________________________________________________________________________________________________________________________________________________ ________________________________________________________________________.(5)Cu 2O 的熔点比Cu 2S 的________(填“高”或“低”),请解释原因________________________________________________________________________________________________________________________________________________. 解析:(1)电子排布为结构化学中的重点.特别是24号、29号等存在半满和全满状态的元素.Cu 2+核外电子排布式书写应先写出Cu 原子的电子排布,然后从外向内失去2个电子.(2)对O 2-个数的计算,面上的按12算,顶点上按18算,棱上按14算,体心按1个算,可得O 2-个数为:18×8+12×2+14×4+1=4(个). (3)H 2O 中氧原子采用sp 3杂化,SO 2-4中的氧不是.CuSO 4应是离子晶体,不是分子晶体.(4)NH 3中的N 原子的孤对电子提供电子,Cu 2+提供空轨道,形成配位键,而NF 3中N 原子的孤对电子被F 原子吸引.(5)离子晶体中,离子键越短,离子键越强,离子化合物熔点越高.答案:(1)1s 22s 22p 63s 23p 63d 9或[Ar]3d 9 (2)4 (3)BD(4)F 的电负性比N 大,N —F 成键电子对向F 偏移,导致NF 3中N 原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF 3不易与Cu 2+形成配离子(5)高 Cu 2O 与Cu 2S 相比,阳离子相同、阴离子所带电荷也相同,但O 2-的半径比S 2-小,所以Cu 2O 的晶格能更大,熔点更高9.A、B、C、D为主族元素,A、B、C同周期且原子半径逐渐减小,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和.A元素基态原子的最外层电子排布式为n s n n p n,B的氢化物可与其最高价氧化物的水化物反应生成盐.D元素位于元素周期表中第一长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数.试回答下列问题:(1)C元素基态原子的核外电子排布式是______________________________________.(2)A、B两元素各有多种氢化物,其电子总数为10的氢化物中沸点最高的是______________(填化学式).(3)下列晶体结构示意图中(黑点表示阳离子,白点表示阴离子),能表示C与D形成的离子化合物结构的是____________________________________________________________ (填字母标号“a”或“b”).解析:由信息“A元素基态原子的最外层电子排布为n s n n p n”可推知n s轨道已经填满电子,所以n=2,故A元素原子的核外电子排布式为1s22s22p2,即A为碳元素;由信息“B 的氢化物可与其最高价氧化物的水化物反应生成盐”可推知B为氮元素;由“D元素位于元素周期表中第一长周期,是维持青少年骨骼正常生长发育的重要元素之一”推知D为钙元素;由“A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和”可推知C 元素最外层电子数=4+5-2=7,所以与A、B同周期的C为氟元素.A、B形成的氢化物且含有10个电子的分子是CH4和NH3,CH4的沸点比NH3的沸点低;C与D形成的离子化合物的化学式是CaF2,图a中Ca2+和F-的个数比为1∶1,图b 中Ca2+和F-的个数比为1∶2,故b图表示的是CaF2的结构.答案:(1)1s22s22p5(2)NH3(3)b10.(2010·山东高考)碳族元素包括C、Si、Ge、Sn、Pb.(1)碳纳米管由单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过________杂化与周围碳原子成键,多层碳纳米管的层与层之间靠________结合在一起.(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为________________.(3)用价电子对互斥理论推断SnBr2分子中Sn—Br键的键角________120°(填“>”、“<”或“=”).(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O 2-处于晶胞棱边中心.该化合物化学式为________,每个Ba 2+与________个O 2-配位.解析:本题以第ⅣA 族元素为载体,考查考生对选修3《物质结构与性质》知识的综合应用能力.(1)石墨晶体是混合型晶体,同一层内碳原子之间以共价键结合成正六边形结构,层与层之间通过范德华力结合,故碳纳米管中碳原子的杂化方式为sp 2杂化,层与层之间靠范德华力结合.(2)电负性越大,非金属性越强,即吸引电子对的能力越强,故电负性的大小关系为C >H >Si.(3)在SnBr 2分子中,中心原子Sn 有2对成键电子,1对孤对电子,采用sp 2杂化,因孤对电子对成键电子的影响,使键角小于120°.(4)1个晶胞中有1个Ba 2+,Pb 4+的个数为8×18=1,O 2-的个数为12×14=3,故化学式为BaPbO 3.每个Ba 2+与12个O 2-配位.答案:(1)sp 2 分子间作用力(或:范德华力)(2)C >H >Si (3)< (4)BaPbO 3 1211.(2010·福建高考)(1)中国古代四大发明之一——黑火药,它的爆炸反应为:2KNO 3+3C +S=====引燃A +N 2↑+3CO 2↑(已配平)①除S 外,上列元素的电负性从大到小依次为________.②在生成物中,A 的晶体类型为________,含极性共价键的分子的中心原子轨道杂化类型为________.③已知CN -与N 2结构相似,推算HCN 分子中σ键与π键数目之比为________.(2)原子序数小于36的元素Q 和T ,在周期表中既处于同一周期又位于同一族,且原子序数T 比Q 多2.T 的基态原子外围电子(价电子)排布式为________,Q 2+的未成对电子数是________.(3)在CrCl 3的水溶液中,一定条件下存在组成为[CrCl n (H 2O)6-n ]x +(n 和x 均为正整数)的配离子,将其通过氢离子交换树脂(R —H),可发生离子交换反应:[CrCl n (H 2O)6-n ]x ++x R —H ―→R x [CrCl n (H 2O)6-n ]+x H +交换出来的H +经中和滴定,即可求出x 和n ,确定配离子的组成.将含0.001 5 mol [CrCl n (H 2O)6-n ]x +的溶液,与R —H 完全交换后,中和生成的H +需浓度为0.120 0 mol·L -1 NaOH 溶液25.00 mL ,可知该配离子的化学式为________.解析:本题考查元素的性质、化学键的类型、配合物理论等,意在考查考生综合运用物质结构与性质知识的能力.(1)①除S 外,上列元素为C 、N 、O 、K ,根据元素电负性的递变规律,电负性强的元素主要位于元素周期表的右上方,则电负性大小顺序为:O>N>C>K.②根据原子守恒,知A为K2S,其为离子晶体.生成物中只有CO2含极性共价键,C原子的轨道杂化类型为sp1.③HCN的分子结构为H—C≡N,其中C—H键为σ键,C≡N键中含1个σ键和2个π键,故σ键和π键数目之比为1∶1.(2)根据Q、T既处于同一周期又处于同一族,则位于ⅤⅢ族,由于Q、T原子序数小于36,且原子序数T比Q多2,则Q为Fe,T为Ni.Ni的基态原子外围电子排布式为3d84s2,Fe2+的核外电子排布为1s22s22p63s23p63d6,只有3d轨道上有4个未成对电子.(3)根据提供数据,该配离子通过离子交换树脂后生成的n(H+)=0.120 0 mol·L-1×0.025 L=0.003 mol,则1∶x=0.001 5∶0.003,解得x=2.则该配离子的化学式为[CrCl(H2O)5]2+.答案:(1)①O>N>C>K②离子晶体sp1③1∶1(2)3d84s24(3)[CrCl(H2O)5]2+12.(2010·镇江模拟)钴(Co)在工业与科研上有多种用途,同时也是维生素B12的组成元素.(1)钴在元素周期表中位于________周期________族,其基态原子核外电子排布式为________________________________________________________________________.(2)Co(NH3)5BrSO4可形成两种钴的配合物,已知两种配合物的分子式分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br,在第一种配合物的溶液中加BaCl2溶液时,产生________色沉淀;在第二种配合物的溶液中加入AgNO3溶液时,产生________色沉淀.(3)钴单质晶胞为面心立方晶胞,则1个钴晶胞中含有的钴原子数为________.如图是另一种金属矿物闪锌矿的晶胞结构示意图,图中黑色小球代表锌原子,灰色小球代表硫原子,则闪锌矿的化学式为_____ __________________________________________________.答案:(1)第4第Ⅷ1s22s22p63s23p63d74s2(2)白淡黄(3)4ZnS13.(2011·东北名校联考)Ⅰ.价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称等电子体.等电子体的结构相似、物理性质相近,称为等电子原理.如N2和CO为等电子体,下表为部分元素等电子体的分类和空间构型表:根据上述信息,回答下列问题:(1)写出分子或离子的空间构型:IO-3______________;SiO2-3______________;(2)由第1、2周期元素组成,与氧化性最强的单质分子具有相同核外电子数的分子有N2H4、________、________(写两种);(3)根据题给信息分析,SiC与AlN硬度大,熔点高,它们物理性质相似的原因是________________________________________________________________________.Ⅱ.(1)下列表示铜原子堆积方式的是________;(2)写出Cu2+的电子排布式__________________________________________________;(3)NH3分子中的N原子杂化轨道类型是________,写出在硫酸铜溶液中通入足量的NH3得到深蓝色溶液的离子方程式________________________________________________.答案:Ⅰ.(1)三角锥形平面三角形(2)H2O2C2H6(3)它们互为等电子体Ⅱ.(1)D(2)1s22s22p63s23p63d9(3)sp3Cu2++4NH3===[Cu(NH3)4]2+14.氮是地球上极为丰富的元素.(1)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为________________________________________________________________________.(2)N≡N的键能为942 kJ·mol-1,N—N单键的键能为247 kJ·mol-1,计算说明N2中的________键比________键稳定(填“σ”或“π”).(3)(CH3)3NH+和AlCl-4可形成离子液体.离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂________(填“大”或“小”),可用作________(填代号).a.助燃剂b.“绿色”溶剂c.复合材料d.绝热材料(4)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示.X的元素符号是________,与同一个N3-相连的X+有________个.解析:(1)基态N3-有10个电子,根据核外电子排布的规律得1s22s22p6.(2)3 mol N—N单键的键能之和为3 mol×247 kJ·mol-1=741 kJ,小于1 mol N≡N的键能942 kJ.(3)离子液体由阴、阳离子组成,挥发性小且能溶解许多极性物质.(4)X+电子充满K、L、M三个电子层,由此得出核外有2+8+18=28个电子,则X 有29个电子是Cu元素.由图可以看出,从每个N3-出来,可以延伸出6条棱,每条棱上都有一个Cu+.答案:(1)1s22s22p6(2)πσ(3)小b(4)Cu6。
物质的聚集状态与物质结构

8.最稳定的气态氢化物是:HF
9.酸性最强的无机含氧酸是:HClO4
33
周期表中特殊位置的元素
1.族序数等于周期数的元素: H Be Al 2.族序数等于周期数2倍的元素:C S 3.族序数等于周期数3倍的元素:O 4.周期数是族序数2倍的元素: Li 5.周期数是族序数3倍的元素: Na 6.最高正价与最低负价代数和为零的短周期元素:
C Si 7.形成的单质是自然界中硬度最大的元素:C
34
8.气态氢化物中氢的质量分数最大的元素: C 9.常温下呈液态的非金属元素:Br 金属元素: Hg 10.空气中含量最多的元素: N 11.元素的气态氢化物和它的氧化物在常温下反 应生成该元素的单质的元素: S
35
高考题:
1. 1919年,Langmuir提出等电子原理:原子数相
似的结构特征。在短周期元素组成的物质中,与NO2-
互为等电子体的分子有: O3 SO2
。
36
高考题:
2.第二主族元素R的单质及其相应的氧化物的混合物12g,加足量的水经完全反应后蒸干,得固体16g,试推测该元素可能是( ) A. Mg B. Ca C.Sr D.Ba
BC
37
高考题:
3.周期表前20号元素中有A、B、C、D、E
39
3
一.离 子 晶 体
定义: 离子间通过离子键结合而成的晶体。 实例: 常见的离子化合物(NaCl 、 MgO、 NaOH等)
熔点℃
沸点℃
NaCl
801
1413
CsCl
645
1290
性质: 熔沸点较高。 硬度较高,密度较大, 难压缩,难挥发。 4
NaCl晶体结构示意图
Na+ Cl-
高三化学物质的聚集状态与物质性质

例 4:
金刚石晶体中 含有共价键形成的 C原子环,其中最 小的C环上有_____ 6 个C原子。
巩固练习一:
石墨晶体的层状结构,层内 为平面正六边形结构(如图), 试回答下列问题: (1)图中平均每个正六边形占 有C原子数为____ 2 个、占有的碳 3 个。 碳键数为____ (2)层内7个六元环完全占有 的C原子数为_____ 14 个,碳原子 数目与碳碳化学键数目之比为 2:3 _______.
1
面心: 1/2
棱边: 1/4
顶点: 1/8
一、晶胞对组成晶胞的各质 点的占有率
体心:
立方晶胞
1
面心: 1/2
棱边: 1/4
顶点: 1/8
二、有关晶体的计算
1、当题给信息为晶体中最小重 复单元——晶胞(或平面结构)中 的微粒排列方式时,要运用空间想 象力,将晶胞在三维空间内重复延 伸,得到一个较完整的晶体结构, 形成求解思路。
巩固练习三:
已知晶体的基本单元 是由12个硼原子构成的 (如右图),每个顶点上 有一个硼原子,每个硼原 子形成的化学键完全相同, 通过观察图形和推算,可 知此基本结构单元是一个 20 正____面体。
巩固练习四:
某晶胞结 构如图所示, 晶胞中各微粒 个数分别为: 3 铜________ 个 钡________ 个 2 钇________ 个 1
小 结
一、晶胞对质点的占有率的计算 二、有关晶体的计算
课外 练习
1996 年诺贝化学奖授予对发现 C60 有重大贡献的三位科学家 .C60 分子是 形如球状的多面体(如图),该结构的建立基于以下考虑:
②C60分子只含有五边形和六边形; ③多面体的顶点数、面数和棱边数的关系,遵循欧拉定理: 顶点数+面数-棱边数=2 据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所 含的双键数为30.请回答下列问题: 金刚石 (1)固体C60与金刚石相比较,熔点较高者应是____________, 理由是: _ 金刚石属原子晶体,而固体C60不是,故金刚石熔点较高. (答出“金刚石属原子晶体”即可) ________________________________________________________. (2)试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或 可能 “不可能”)_______________, 并简述其理由: 因C60分子含30个双键,与极活泼的F2发生加成反应即可生成C60F60 (只 要指出“C60含30个双键”即可,但答“因C60含有双键”不行) ________________________________________________________. (3)通过计算,确定C60分子所含单键数.C60分子所含单键数为___________. 可由欧拉定理计算键数(即棱边数):60+(12+20)-2=90 C60分子中单键为:90-30=60 (4)C70 分子也已制得 ,它的分子结构模型可以与 C60 同样考虑而推知 . 通过 计算确定C70分子中五边形和六边形的数目. 12 25 C70分子中所含五边形数为____________, 六边形数为_________.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.(1)立方晶胞中,顶点、棱边、面心依次被多少个晶胞共 用? 答案 立方晶胞中,顶点、棱边、面心依次被8、4、2个晶
胞共用。
基础再现·深度思考
第 3讲
(2)六棱柱晶胞中,顶点、侧棱、底面上的棱、面心依次被 多少个晶胞共用?
答案 六棱柱晶胞中,顶点、侧棱、底面上的棱、面心依次
本 课 栏 目 开 关
基础再现·深度思考
第 3讲
考点二 比较
四种晶体性质比较 类型 分子晶体 原子晶体 金属晶体 离子晶体
本 课 栏 目 开 关
金属阳离
构成粒子
分子
原子
子、自由电 子 子
阴、阳离
粒子间的相 分子间作 互作用力
用力
共价键
金属键
离子键
基础再现·深度思考
有的 很大 ,有 的 很小 有的 很高 ,有 的 很低
基础再现·深度思考
4.晶格能 (1)定义
第 3讲
本 课 栏 目 开 关
气态离子形成1摩离子晶体释放的能量,通常取正值,单
mol-1 位: kJ·
(2)影响因素
。
①离子所带电荷数:离子所带电荷数越多,晶格能越 大 。 ②离子的半径:离子的半径越 小 ,晶格能越大。 (3)与离子晶体性质的关系 晶格能越大,形成的离子晶体越 稳定 ,且熔点越 高 ,硬度 越大 。
第 3讲
本 课 栏 目 开 关
2.得到晶体的途径 (1)熔融态物质凝固。 (2) 气态物质冷却不经液态直接凝固(凝华)。 (3)溶质从溶液中析出 。 3.晶胞 (1)概念 描述晶体结构的 基本单元 。 (2)晶体中晶胞的排列——无隙并置 ①无隙:相邻晶胞之间没有任何间隙 。 ②并置:所有晶胞平行 排列、 取向 相同。
基础再现·深度思考
第 3讲
基础再现·深度思考
考点一 晶体的常识 晶体 结构 特征 性 自范性 质 特 征 熔点 异同表 现 非晶体 1.晶体与非晶体 结构微粒 周期性 结构微粒 无序
本 课 栏 目 开 关
有序 排列 有 固定 各向异性
排列
无 不固定 各向同性
基础再现·深度思考
二者 区别 方法 间接方法 科学方法 看是否有固定的熔点 射线衍射 对固体进行 X实验
本 课 栏 目 开 关
特别提醒
(1)原子晶体的熔点不一定比离子晶体高,如石英
的熔点为1 710 ℃,MgO的熔点为2 852 ℃。 (2)金属晶体的熔点不一定比分子晶体的熔点高,如Na的熔点 为97 ℃,尿素的熔点为132.7 ℃。
CO2、SO2)、几 非金属化 乎所有的酸、绝 合物(如 大多数有机物 (有机盐除外) SiC、SiO2)
ቤተ መጻሕፍቲ ባይዱ
Al、Fe、 NaOH)、绝
基础再现·深度思考
第 3讲
深度思考 5.判断下列说法是否正确: (1)在晶体中只要有阴离子就一定有阳离子 (2)在晶体中只要有阳离子就一定有阴离子 (3)原子晶体的熔点一定比金属晶体的高 (4)分子晶体的熔点一定比金属晶体的低 答案 (1)√ (3)× (4)× (2)× ( ( ( ( ) ) ) )
第 3讲
所有非金属氢化 物(如水、硫化 氢)、部分非金 物质 类别 及举例 属单质(如卤素 X2)、部分非金 属氧化物(如 部分非金 属单质(如 金刚石、 硅、晶体 硼),部分 金属氧化物 金属单质 (如K2O、 与合金 (如Na、 青铜) Na2O)、强碱 (如KOH、 大部分盐(如 NaCl)
本 课 栏 目 开 关
物质的硬度越大。
基础再现·深度思考
第 3讲
4.下列物质均属于离子化合物,你认为可能作为耐火材料 的是 A.K2O2 B.Na2O C.NaCl D.Al2O3 ( D )
本 课 栏 目 开 关
解析 作为耐火材料的物质应具有性质稳定、熔点高等特点。 Al2O3性质稳定,晶体中离子半径较小,离子所带电荷较高,离 子键强度较大,具有较高的晶格能和熔点。
本 课 栏 目 开 关
基础再现·深度思考
第 3讲
6.CO2和SiO2在物理性质上有较大差异,而在化学性质上 却有较多相似,你知道原因吗?
答案 决定二者物理性质的因素:晶体类型及结构微粒间的 作用力,CO2是分子晶体,其微弱的分子间作用力是其决定 因素,SiO2是原子晶体,其牢固的化学键是其决定因素。二 者的化学性质均由其内部的化学键决定,而C—O与Si—O键 都是极性键。
第 3讲
硬度 熔、 沸点
较小 较低
很大 很高
难溶于任 何溶剂
较大 较高
大多数易
本 课 栏 目 开 关
溶解性 相似相溶
常见溶剂难溶 溶于水等 极性溶剂 晶体不导 电和热的良导 电,水溶 体 液或熔融 态导电
一般不导 一般不具 导电、 传 电,溶于 热性 导电 有导电 为半导体 水后有的 性,个别
基础再现·深度思考
被6、3、4、2个晶胞共用。
基础再现·深度思考
3.有关晶格能的叙述正确的是 A.晶格能是气态离子形成1摩离子晶体释放的能量 B.晶格能通常取负值 C.晶格能越大,形成的离子晶体越不稳定 D.晶格能越大,物质的硬度反而越小
第 3讲
( A )
本 课 栏 目 开 关
解析
晶格能通常取正值,晶格能越大,离子晶体越稳定,
基础再现·深度思考
第 3讲
特别提醒 如玻璃。
(1)具有规则几何外形的固体物质不一定是晶体,
本 课 栏 目 开 关
(2)晶胞是从晶体中“截取”出来的具有代表性的最小部分, 而不一定是最小的“平行六面体”。 (3)在计算晶胞中微粒个数的过程中,不要形成思维定势,任 何形状的晶胞均可使用分割法。不同形状的晶胞,应先分析 任意位置上的一个粒子被几个晶胞所共用,如六棱柱晶胞 中,顶点、侧棱、底面上的棱、面心依次被6、3、4、2个晶 胞所共用。
基础再现·深度思考
深度思考 1.判断下列叙述是否正确: (1)固态物质一定是晶体 (2)冰和固体碘晶体中相互作用力相同 (3)晶体内部的微粒按一定规律周期性的排列 (4)凡有规则外形的固体一定是晶体 (4)× 答案 (1)× (2)× (3)√ ( ( ( (
第 3讲
) ) ) )
本 课 栏 目 开 关
第 3讲
第 3讲
物质的聚集状态与物质性质
本 课 栏 目 开 关
[考纲要求] 1.理解离子键的形成,能根据离子化合物 的结构特征解释其物理性质。2.了解原子晶体的特征, 能描述金刚石、二氧化硅等原子晶体的结构与性质的关 系。3.理解金属键的含义,能用金属键理论解释金属的 一些物理性质。4.了解分子晶体与原子晶体、离子晶 体、金属晶体的构成微粒、微粒间作用力的区别。
