06化工原理第六章习题答案
化工原理 第六章 传热2

第六章传热一、填空题1. 冷热水通过间壁换热器换热,热水进口温度为90 ℃,出口温度为50 ℃,冷水进口温度为15 ℃,出口温度为53 ℃,冷热水的流量相同,且假定冷热水的物性相同,则热损失占传热量的 ________。
2. 100℃的热水在一钢管内流过,钢管暴露在大气中,大气温度为20℃,则钢管壁的温度大约是℃,产生上述答案的理由说明如下:。
3. 圆筒壁总传热系数K与间壁两侧对流传热系数α1,α2以及间壁导热系数λ的关系为_________。
当间壁管规格为φ108×4,导热系数为45W·m-1·K-1时,管内外两侧的对流传热系数分别为8 000 W·m-2·K-1和1200 W·m-2·K-1时,总传热系数K1=_____ W·m-2·K-1,总传热系数K2=_______ W·m-2·K-1。
4.用常压蒸馏塔的塔底重油加热原油。
重油的初始温度为300℃,最终温度为220℃;原油的初始温度为25℃,最终温度为180℃;若采用并流操作,其平均温差为____,若采用逆流操作,其平均温差为_____。
由上述结果可知:当热交换双方流体无相变,且进出口温度不变时,采用___操作的传热平均温差比___操作的传热平均温差大,对热交换有利。
二、选择题1. 有一套管换热器,在内管中空气从20℃被加热到50℃,环隙内有120℃的水蒸气冷凝,则内管壁的温度接近℃。
(A) 35 (B) 77.5 (C) 120 (D) 1002. 冷热流体在换热器中进行无相变逆流传热,换热器用久后形成垢层,在同样的操作条件下,与无垢层相比,结垢后的换热器的K ,t 。
mA. 变大B. 变小C. 不变D. 不确定3. 在蒸气—空气间壁换热过程中,为强化传热,下列方案中的_____工程上可行。
A. 提高蒸气流速B. 提高空气流速C. 采用过热蒸气以提高蒸气温度D. 在蒸气一侧管壁加装翅片,增加冷凝面积三、计算题1. 某列管式冷凝器的列管规格为Φ25 mm×2.5 mm。
南工大化工原理第六章习题解答
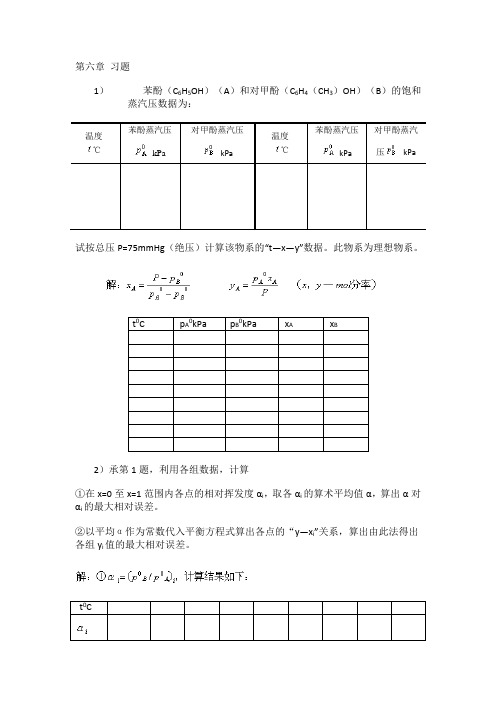
第六章习题1)苯酚(C6H5OH)(A)和对甲酚(C6H4(CH3)OH)(B)的饱和蒸汽压数据为:温度℃苯酚蒸汽压kPa对甲酚蒸汽压kPa温度℃苯酚蒸汽压kPa对甲酚蒸汽压 kPa试按总压P=75mmHg(绝压)计算该物系的“t—x—y”数据。
此物系为理想物系。
t0C p A0kPa p B0kPa x A x B2)承第1题,利用各组数据,计算①在x=0至x=1范围内各点的相对挥发度αi,取各αi的算术平均值α,算出α对αi的最大相对误差。
②以平均α作为常数代入平衡方程式算出各点的“y—x i”关系,算出由此法得出各组y i值的最大相对误差。
t0Ct0Cx i0y i0最大误差=3)已知乙苯(A)与苯乙烯(B)的饱和蒸汽压与温度的关系可按下式算得:式中p0的单位是mmHg,T的单位是K。
问:总压为60mmHg(绝压)时,A与B的沸点各为多少℃在上述总压和65℃时,该物系可视为理想物系。
此物系的平衡汽、液相浓度各为多少摩尔分率4)苯(A)和甲苯(B)混合液可作为理想溶液,其各纯组分的蒸汽压计算式为式中p0的单位是mmHg,t的单位是℃。
试计算总压为850mmHg(绝压)下含苯25%(摩尔百分率)的该物系混合液的泡点。
5)试计算总压为760mmHg(绝压)下,含苯、甲苯(摩尔分率)的混合蒸汽的露点。
若令该二元物系降温至露点以下3℃,求平衡的汽、液相摩尔之比。
6)有一苯(A)、甲苯(B)、空气(C)的混合气体,其中空气占2%,苯与甲苯浓度相等(均指摩尔百分数),气体压强为760mmHg(绝压)。
若维持压强不变,令此三元物系降温至95℃,求所得平衡汽相的组成。
A、B组分均服从拉乌尔定律。
已知95℃时,。
设X A算得的X‘A7)常压下将含苯(A)60%,甲苯(B)40%(均指摩尔百分数)的混合液闪蒸(即平衡蒸馏),得平衡汽、液相,汽相摩尔数占总摩尔数的分率——汽化率(1-q)为。
物系相对挥发度α=,试求:闪蒸所得平衡汽、液相的浓度。
化工原理第六章吸收习题答案解析

由于 y*A yA ,所以将发生吸收过程。推动力为
示意图见题 6-3 图。
y 0.03 0.0189 0.0111
题 6-3 图
分析 体会通过改变温度和总压来实现气液之间传质方向的改变 ,即吸收和解 吸。
6-4 氨-空气混合气中含氨(摩尔分数),在常压和 25℃下用水吸收,过程中不 断移走热量以使吸收在等温下进行。进气量为 1000 m3 ,出口气体中含氨(摩尔 分数)。试求被吸收的氨量(kg)和出口气体的体积(m3) 。
①
p* CO2
cCO2 H CO2
0.01 3.347 104
29.9kPa
推动力
p 20.1kPa(吸收)
②
p* CO2
cCO2 H CO2
0.05 3.347 104
149.4kPa
推动力
p 99.4kPa(解吸)
或者 , 用摩尔分数差表示时
①
由
xCO2
0.01 1000
1.8104
NA
DP RTZ
pA1 pA2 ln pB2 pB1 pB2 pB1
查教材附录水的物理性质得,20℃时水的蒸汽压为。已知条件为:
pA1 101.3kPa, pA2 0kPa, pB2 101.3kPa, pB1 101.3 2.3346 98.97kPa, P pA2 pB2 101.3kPa,
试求这两种情况下 CO2 的传质方向与推动力。 解: 由亨利定律得到
pCO2 50kPa ExC*O2 根据《 化工原理》 教材中表 8-1 查出
ECO2 25℃ 1.66105 kPa
所以可以得到
又因为
x* CO2
3.01104
HCO2 25℃
化工原理第六章吸收习题答案解析

等于水扩散出管口的量,即
N A Ad
M
AdZ
则 dZ N AM 5.03 10 6 18 9.054 10 8 m / s
d
1000
在 0, Z 0 到 0, Z 2103m 之间积分,得
2 10-3 9.054 10-8
2.21104 s
6-6 含组分 A 为的混合气,用含 A 为(均为摩尔分数)的液体吸收其中的 A。
解
根据定义式 N A KG
pA p*A
K L c*A cA
和
p
* A
c*A H
,可知
KL
1 H
KG
所以只要求出 KG 即可。又
1 KG
1 kG
1 Hk L
1 5.67 10-5
1
1.98 10-3 0.075
17637
6734
24371
所以
KG 4.110-5 kmol / m2 • h • Pa
3.347104 kmol/
kPa• m3
所以得
c* CO2
HCO2
pCO2
3.347104 50 0.0167kmol/ m3
于是:(1)为吸收过程, c 0.0067kmol/ m3 。
(2)为解吸过程, c 0.0333kmol/ m3 。
分析 (1)推动力的表示方法可以有很多种,比如,用压力差表示时:
1000 kg / m3 )
解:(1)根据已知条件
定义
p* NH3
987Pa
cNH 3
1/17 101/1000
0.5824kmol/ m3
p* NH 3
cNH3
H NH3
HNH3 cNH3 pNH3 5.9104 kmol/ m3 • Pa
化工原理刘伟主编第六章蒸馏答案
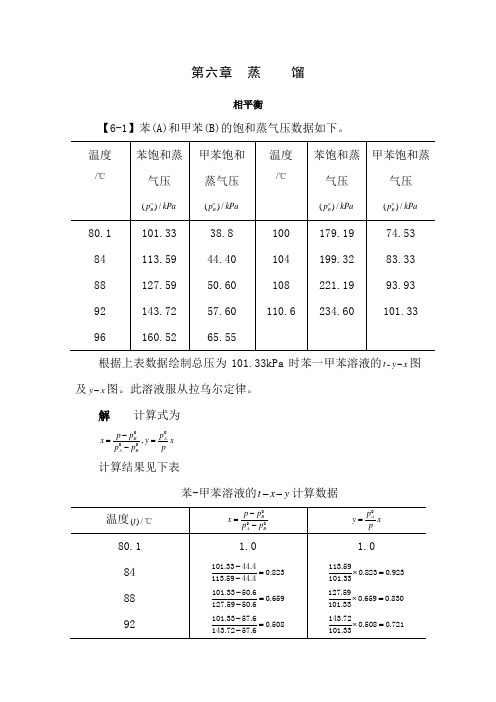
第六章 蒸 馏相平衡【6-1】苯(A)和甲苯(B)的饱和蒸气压数据如下。
B B B B 根据上表数据绘制总压为101.33kPa 时苯一甲苯溶液的-t y x -图及y x -图。
此溶液服从拉乌尔定律。
解 计算式为,0000B AA Bp p p x y x p p p -==- 计算结果见下表苯-甲苯溶液的t x y --计算数据苯-甲苯溶液的t y x --图及y x -图,如习题6-1附图1与习题6-1附图2所示。
习题6-1附图1 苯-甲苯t-y-x 图习题6-1附图2 苯-甲苯y-x 图【6-2】在总压.101325kPa 下,正庚烷-正辛烷的汽液平衡数据如下。
试求:(1)在总压.101325kPa 下,溶液中正庚烷为0.35(摩尔分数)时的泡点及平衡汽相的瞬间组成;(2)在总压.101325kPa 下,组成.035x =的溶液,加热到117℃,处于什么状态?溶液加热到什么温度,全部汽化为饱和蒸气?解 用汽液相平衡数据绘制t y x --图。
(1) 从t y x --图上可知,.035x =时的泡点为113.8℃,平衡汽相的瞬间组成.053y =。
(2) .035x =的溶液,加热到117℃时为气液混合物,液相组成.024x =,汽相组成.040y =。
.035x =的溶液加热到118℃时,全部汽化为饱和蒸气。
习题6-2附图 正庚烷-正辛烷t-y-x 图【6-3】 甲醇(A)-丙醇(B)物系的汽液平衡服从拉乌尔定律。
(1) 试求温度80℃t =、液相组成.05x =(摩尔分数)时的汽相平衡组成与总压。
(2) 试求总压为.10133kPa 、液相组成.04x =(摩尔分数)时的汽液相平衡温度与汽相组成。
(3) 试求液相组成.06x =、汽相组成.084y =时的平衡温度与总压。
组成均为摩尔分数。
用Antoine 方程计算饱和蒸气压(kPa) 甲醇 .lg ..15749971973623886A p t =-+丙醇 .lg .137514674414193B p t =-+ 式中t 为温度,℃。
化工原理习题答案-第六章-第九章
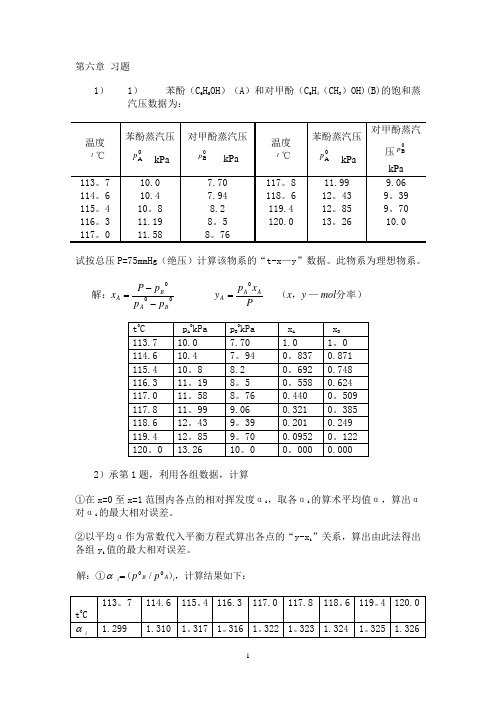
第六章 习题1)1) 苯酚(C 6H 5OH )(A )和对甲酚(C 6H 4(CH 3)OH)(B)的饱和蒸汽压数据为:试按总压P=75mmHg (绝压)计算该物系的“t-x —y ”数据。
此物系为理想物系。
分率)—,(解:mol y x P xp y p p p P x AA A BA BA 00=--=2)承第1题,利用各组数据,计算①在x=0至x=1范围内各点的相对挥发度αi ,取各αi 的算术平均值α,算出α对αi 的最大相对误差。
②以平均α作为常数代入平衡方程式算出各点的“y-x i ”关系,算出由此法得出各组y i 值的最大相对误差。
,计算结果如下:)(解:①i A B i p p 00/=α%46.1299.1299.1318.1318.1=-===∑最大误差niαα计,结果如下:按)()318.1112αααiii x x y -+=t 0C113。
7 114.6 115。
4 116.3 117。
0 117.8 118。
6 119。
4 120。
0 x i 1。
0 0。
837 0.692 0.558 0。
440 0。
321 0。
201 0。
0952y i1.0 0。
871 0.748 0。
625 0。
509 0.384 0.249 0.122 0最大误差=31060.2385.0385.0384.0-⨯-=-3)已知乙苯(A )与苯乙烯(B )的饱和蒸汽压与温度的关系可按下式算得:式中p 0的单位是mmHg,T 的单位是K.问:总压为60mmHg (绝压)时,A 与B 的沸点各为多少℃?在上述总压和65℃时,该物系可视为理想物系。
此物系的平衡汽、液相浓度各为多少摩尔分率?CK T T Ln B t p p CK T T Ln A t p p B B A A 00007.6985.34272.63/57.33280193.16608.6195.33495.59/47.32790195.1660)1==∴--====∴--==)(的沸点为,算得的令)(的沸点为算得的,令解:mmHgp Lnp KC t mmHg p A A 81.6895.5915.338/47.32790195.1615.33865602000=∴--====)(,)639.060557.081.68557.092.4881.6892.486092.4872.6315.338/57.33280193.1600=⨯==--==∴--=A A B B y x mmHgp Lnp )(4)苯(A)和甲苯(B)混合液可作为理想溶液,其各纯组分的蒸汽压计算式为式中p 0的单位是mmHg ,t 的单位是℃。
化工原理复习必看第6章_蒸馏习题

1.蒸馏是分离的一种方法,其分离依据是混合物中各组分的,分离的条件是。
答案:均相液体混合物,挥发性差异, 造成气液两相系统(每空1分,共3分)2.在t-x—y图中的气液共存区内,气液两相温度,但气相组成液相组成,而两相的量可根据来确定。
答案: 相等,大于,杠杆规则(每空1分,共3分)3.当气液两相组成相同时,则气相露点温度液相泡点温度。
答案:大于(每空1分)4.双组分溶液的相对挥发度α是溶液中的挥发度对的挥发度之比,若α=1表示。
物系的α值愈大,在x—y图中的平衡曲线愈对角线。
答案:易挥发组分,难挥发组分,不能用普通蒸馏方法分离远离(每空1分,共4分)5.工业生产中在精馏塔内将过程和过程有机结合起来而实现操作的.而是精馏与普通精馏的本质区别。
答案:多次部分气化,多次部分冷凝,回流(每空1分,共3分)6.精馏塔的作用是。
答案:提供气液接触进行传热和传质的场所。
(2分)7.在连续精馏塔内,加料板以上的塔段称为,其作用是 ;加料板以下的塔段(包括加料板)称为________,其作用是。
答案:精馏段(1分)提浓上升蒸汽中易挥发组分(2分)提馏段提浓下降液体中难挥发组分(2分)(共6分)8.离开理论板时,气液两相达到状态,即两相相等,____互成平衡。
答案: 平衡 温度 组成 (每空1分,共3分)9. 精馏塔的塔顶温度总是低于塔底温度,其原因有(1) 和(2) 。
答案: 塔顶易挥发组分含量高 塔底压力高于塔顶(每空2分,共4分)10. 精馏过程回流比R 的定义式为 ;对于一定的分离任务来说,当R= 时,所需理论板数为最少,此种操作称为 ;而R= 时,所需理论板数为∞。
答案:R=DL∞ 全回流 R min (每空1分,共4分) 11. 精馏塔有 进料热状况,其中以 进料q 值最大,进料温度____泡点温度。
答案: 五种 冷液体 小于(每空1分,共3分)12. 某连续精馏塔中,若精馏段操作线方程的截距等于零,则回流比等于____,馏出液流量等于 ,操作线方程为 .答案: ∞ 零 y n+1=x n (每空1分,共3分)13. 在操作的精馏塔中,第一板及第二板气液两相组成分别为y 1,x 1及y 2,x 2;则它们的大小顺序为 最大, 第二, 第三,而 最小. 答案: y 1 y 2 x 1 x 2 (每空1分,共4分)14. 对于不同的进料热状况,x q 、y q 与x F 的关系为(1)冷液进料:x q x F ,y q x F ; (2)饱和液体进料:x q x F ,y q x F ; (3)气液混合物进料:x q x F ,y q x F f ; (4)饱和蒸汽进料:x q x F ,y q x F ; (5)过热蒸汽进料:x q x F ,y q x F ;答案:大于 大于(1分)等于 大于(1分)小于 大于(1分)小于 等于(1分)小于 小于(1分)(共5分)15. 精馏操作时,增大回流比R ,其他操作条件不变,则精馏段液气比VL( ),馏出液组成x D ( ),釜残液组成x W ( ).A 增加B 不变C 不确定D 减小答案: A A D(每空1分,共3分)精馏塔的设计中,若进料热状况由原来的饱和蒸气进料改为饱和液体进料,其他条件维持不变,则所需的理论塔板数N T ( ),提馏段下降液体流量L /( )。
化工原理习题答案第六章

RT n 8.314 10 3 700 0.45 m 3 0.45 kmol ) kw ( ) 0.0535 0.333( ) p 0 .1 kmol kg h
4. 在等温下进行液相反应 A+B→C+D,在该条件下的反应速率方程为:
0.5 rA 0.8c1.5 A cB mol/(L min )
所以,反应器出口气体组成为: 组分 CH3OH HCHO H2O CO2 O2 N2 摩尔数(mol) 7.672 18.96 38.3 0.7672 0.8788 43.28 摩尔分率% 6.983 17.26 34.87 0.6983 0.7999 39.39
2. 在一体积为 4L 的恒容反应器中进行 A 的水解反应,反应前 A 的含量为 12.23%(重量) , 混合物的密度为 1g/mL,反应物 A 的分子量为 88。在等温常压下不断取样分析,测的组分 A 的浓度随时间变化的数据如下: 反应时间(h) cA(mol/L) 1.0 0.9 2.0 0.61 3.0 0.42 4.0 0.28 5.0 0.17 6.0 0.12 7.0 0.08 8.0 0.045 9.0 0.03
(4)以摩尔浓度表示反应物系组成时的速率常数 kC。 解: (1) k v b k w 1.13 103 0.0535 60.64kmol/(m 3 h )
b b kw k w 1.78 10 6 kmol/(m 2 h ) av b 3 103 1 1 kmol (3) k p ( ) n k w ( ) 0.45 0.0535 0.1508 p 0.1013 kg h (Mpa ) 0.45
(3)求平衡温度 Te
新版化工原理习题答案(06)第六章 蒸发

第六章 蒸发1.采用标准蒸发器将10%的NaOH 水溶液浓缩至25%(质量分数)。
蒸发室的操作压力为50 kPa ,试求操作条件下溶液的沸点升高及沸点。
解:溶液的沸点升高及沸点均按完成液来计算。
查得水的有关数据为压力p /kPa 温度t /℃ 汽化热r /(kJ ∙kg -1)101.3 10050 81.2 2304.5在101.3 kPa 时,25%NaOH 溶液的沸点为113.07 ℃。
常压下溶液的沸点升高为Δ a =(113.07–100)℃=13.07℃50 kPa 时,溶液的沸点升高可用两种方法计算。
(1)用杜林规则在杜林线图的横标81.2 ℃作垂直线交组成为25%的杜林线,再由该点查得纵标的温度为93 ℃,此即50kPa 下溶液的沸点t A 。
∆'=(93–81.2)℃=11.8 ℃(2)用式6-17经验公式估算a f '∆=∆=2(81.2273)0.016213.072304.5+⎡⎤⨯⨯⎢⎥⎣⎦℃=11.5 ℃ 则溶液的沸点升高为11.8 ℃,50kPa 下的沸点为93 ℃。
两种方法计算结果相差不大。
2.用连续操作的真空蒸发器将固体质量分数为4.0%的番茄汁浓缩至30%,加热管内液柱的深度为2.0 m ,冷凝器的操作压力为8 kPa ,溶液的平均密度为1 160 kg/m 3,常压下溶质存在引起的沸点升高a ∆'=1 ℃,试求溶液的沸点t B 。
解:8 kPa 压力下对应二次蒸汽温度为41.3 ℃,水的汽化热为2497 kJ/kg 。
取冷凝器到蒸发室的温差损失∆'''=1.5℃。
溶质引起的沸点升高取常压下数据,即∆'=1℃。
则溶液的沸点为B 41.341.31 1.543.8t ''''=+∆=+++∆=+∆∆''的计算如下:m 2Lg p p ρ'=+与43.8 ℃相对应的压力p '=9.25 kPa则 m 1160 2.09.819.2510002p ⨯⨯⎡⎤=+⎢⎥⨯⎣⎦kPa=20.63 kPa 与p m 对应的溶液沸点为60.7 ℃,即t B =60.7 ℃3.在一连续操作的单效蒸发器中将NaOH 水溶液从10%浓缩至45%(质量分数),原料液流量为1 000 kg/h 。
南工大化工原理第六章习题解答

第六章习题1)苯酚(C6H5OH)(A)和对甲酚(C6H4(CH3)OH)(B)的饱和蒸汽压数据为:温度℃苯酚蒸汽压 kPa对甲酚蒸汽压 kPa温度℃苯酚蒸汽压 kPa对甲酚蒸汽压 kPa113.710.07.70117.811.999.06 114.610.47.94118.612.439.39 115.410.88.2119.412.859.70 116.311.198.5120.013.2610.0 117.011.588.76试按总压P=75mmHg(绝压)计算该物系的“t—x—y”数据。
此物系为理想物系。
t0C pA 0kPa pB0kPa xAxB113.7 10.0 7.70 1.0 1.0 114.6 10.4 7.94 0.837 0.871 115.4 10.8 8.2 0.692 0.748 116.3 11.19 8.5 0.558 0.624 117.0 11.58 8.76 0.440 0.509 117.8 11.99 9.06 0.321 0.385 118.6 12.43 9.39 0.201 0.249 119.4 12.85 9.70 0.0952 0.122 120.0 13.26 10.0 0.000 0.0002)承第1题,利用各组数据,计算①在x=0至x=1围各点的相对挥发度αi ,取各αi的算术平均值α,算出α对αi的最大相对误差。
②以平均α作为常数代入平衡方程式算出各点的“y—xi”关系,算出由此法得出各组yi值的最大相对误差。
t0C 113.7 114.6 115.4 116.3 117.0 117.8 118.6 119.4 120.01.299 1.310 1.317 1.316 1.322 1.323 1.324 1.325 1.326t0C 113.7 114.6 115.4 116.3 117.0 117.8 118.6 119.4 120.01.0 0.837 0.692 0.558 0.440 0.321 0.201 0.0952 0xi1.0 0.871 0.748 0.625 0.509 0.384 0.249 0.122 0yi最大误差=3)已知乙苯(A)与苯乙烯(B)的饱和蒸汽压与温度的关系可按下式算得:式中p0的单位是mmHg,T的单位是K。
南工大化工原理第六章 习题解答
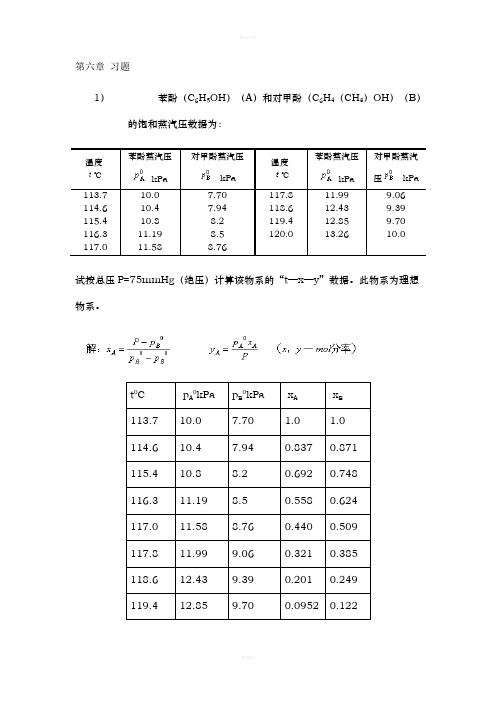
第六章习题1)苯酚(C6H5OH)(A)和对甲酚(C6H4(CH3)OH)(B)的饱和蒸汽压数据为:温度℃苯酚蒸汽压kPa对甲酚蒸汽压kPa温度℃苯酚蒸汽压kPa对甲酚蒸汽压 kPa 113.710.07.70117.811.999.06 114.610.47.94118.612.439.39 115.410.88.2119.412.859.70 116.311.198.5120.013.2610.0 117.011.588.76试按总压P=75mmHg(绝压)计算该物系的“t—x—y”数据。
此物系为理想物系。
t0C p A0kPa p B0kPa x A x B113.710.07.70 1.0 1.0114.610.47.940.8370.871115.410.88.20.6920.748116.311.198.50.5580.624117.011.588.760.4400.509117.811.999.060.3210.385118.612.439.390.2010.249119.412.859.700.09520.122120.013.2610.00.0000.0002)承第1题,利用各组数据,计算①在x=0至x=1范围内各点的相对挥发度αi,取各αi的算术平均值α,算出α对αi的最大相对误差。
②以平均α作为常数代入平衡方程式算出各点的“y—x i”关系,算出由此法得出各组y i值的最大相对误差。
t0C 113.7114.6115.4116.3117.0117.8118.6119.4120.01.299 1.310 1.317 1.316 1.322 1.323 1.324 1.325 1.326t0C113.7114.6115.4116.3117.0117.8118.6119.4120.0x i 1.00.8370.6920.5580.4400.3210.2010.09520y i 1.00.8710.7480.6250.5090.3840.2490.1220最大误差=3)已知乙苯(A)与苯乙烯(B)的饱和蒸汽压与温度的关系可按下式算得:式中p0的单位是mmHg,T的单位是K。
化工原理答案

第六章 蒸 馏11、在连续精馏操作中,已知精馏段操作线方程及q 线方程分别为y =0.8x +0.19;y = -0.5x +0.675,试求:(1)进料热状况参数q 及原料液组成x F ;(2)精馏段和提馏段两操作线交点坐标。
解:由q 线方程 y = -0.5x +0.675知5.01-=-q q 故q =1/3 又675.01=--q x F 故x F =0.675(1-q )=0.675×(1 -1/3)=0.45 因为精馏段操作线与提馏段操作线交点也是精馏段操作线与q 线的交点,所以y q = -0.5x q +0.675y q =0.8x q +0.18 联立求解 x q =0.373 y q =0.48912、用逐板计算习题10中泡点进料时精馏段所需理论板层数。
在该组成范围内平衡关系可近似表达为y =0.46x +0.545解:由习题10知 x F =0.4 、x D =0.95 、R =2.6设塔顶为全凝器,故y 1=x D =0.95由平衡关系 y 1=0.46x 1+0.545=0.95 得 x 1=0.88由精馏段操作线方程26.072.06.395.06.36.2111+=+=+++=+n n D n n x x R x x R R y 得 y 2=0.72×0.88+0.26=0.89又 0.46x 2+0.545=0.89 得 x 2=0.75同理 y 3=0.72×0.75+0.26=0.80又 0.46x 3+0.545=0.80得 x 3=0.55y 3=0.72×0.55+0.26=0.66又 0.46x 4+0.545=0.66得 x 4=0.25<x F∴ 精馏段理论板层数为3层,第四层为进料板。
13、在常压连续精馏塔中分离苯-甲苯混合液。
若原料为饱和液体,其中含苯0.5(摩尔分数,下同),塔顶馏出液组成为0.95,釜液组成为0.06,操作回流比为2.6。
化工原理第6章课后习题答案

第五章 习题解答1)1)总压100,温度25℃的空气与水长时间接触,水中的的浓度为多少?分别用摩尔浓度和摩尔分率表示。
空气中 的体积百分率为0.79。
解:将空气看作理想气体:y=0.79 p*=yp=79kPa查表得 E=8.76×510kPa610/*-==E p xH=)./(10342.6)181076.8/(1000)/(65m kN kmoL EMS -⨯=⨯⨯=ρ C=p*.H=79×6.342×10-5=5.01×10-4kmol/m 32)2)已知常压、25℃下某体系的平衡关系符合亨利定律,亨利系数E 为大气压,溶质A 的分压为0.54大气压的混合气体分别与三种溶液接触:①溶质A 浓度为 的水溶液;②溶质A 浓度为的水溶液;③溶质A 浓度为 的水溶液。
试求上述三种情况下溶质A 在二相间的转移方向。
解: E=0.15×104atm ,p=0.054atm ,P=1atm ,y=p/P=0.054① m EP ==⨯015104. x 135002110183610=⨯=⨯-..∴y mx 110054*.== ∴∆y y y =-=10* ∴平衡 ② x 2350001110181810=⨯=⨯-.. ∴y mx 220027*.== ∴∆y y y =-20* ∴气相转移至液相 ③x 3350003110185410=⨯=⨯-..∴y mx 330081*.== ∴∆y y y =-30*∴液相转移至气相 ④ P=3atm y=0.054 E=0.15×104atm ∴m=E/P=0.05×104 x 4=x 3=5.4×10-5∴y mx 440027*.== ∴∆y y y =-40* ∴气相转移至液相3)3)某气、液逆流的吸收塔,以清水吸收空气~硫化氢混合气中的硫化氢。
总压为1大气压。
已知塔底气相中含1.5%(摩尔分率),水中含的浓度为 (摩尔分率)。
化工基础学习知识原理习题集解答(第六章)

第6章 蒸馏6-1.尔定律。
解:00BA BA P P P P x --=;A A A x PPy 0=x (y )t/0C0.00.20.40.60.81.00.00.20.40.60.81.0yx6-2.利用习题6-1的数据 (1)计算相对挥发度α。
(2)写出平衡方程式。
(3)算出x y -的一系列平衡数据与习题1作比较。
(答:(1) 44.2=α, (2)xxy 44.1144.2+=)解:⑴0A P P =α,44.22==α⑵()xxx x y 44.1144.211+=-+=αα⑶由α计算所得的一系列y 、x 值与习题6-1之值很接近。
6-3.将含%24(摩尔分数,下同)易挥发组分的某液体混合物送入一连续精馏塔中。
要求馏出液含%95易挥发组分,釜液含%3易挥发组分。
送至冷凝器的蒸气量为1h kmol 850-⋅,流入精馏塔的回流液量为1h kmol 670-⋅。
试求:(1)每小时能获得多少kmol 的馏出液?多少kmol 的釜液?(2)回流比DLR = 为多少?(答:1h kmol 180-⋅=D , 1h kmol 6.608-⋅=W ;72.3=R ) 解:D L V +=,1h kmol 180670850-⋅=-=-=L V D ,72.3180670===D L R , W W D F +=+=180,W D F Wx Dx Fx +=即()03.018018095.024.0⨯-+⨯=F F ,解得:1h kmol 6.788-⋅=F ,1h kmol 6.6081806.788-⋅=-=-=D F W 。
6-4.有1hkg 10000-⋅含物质A (摩尔质量为1kmol8kg 7-⋅ )3.0(质量分数,下同)和含物质B (摩尔质量为1kmol 0kg 9-⋅ )7.0的混合蒸气自一连续精馏塔底送入。
若要求塔顶产品中物质A 的组成为95.0,釜液中物质A 的组成为01.0。
化工原理学习指导 第6章 蒸馏 计算题答案.

化工原理学习指导 第6章 蒸馏 计算题答案6-31 某二元混合物蒸汽,其中轻、重组分的摩尔分数分别为0.75和0.25,在总压为300kPa 条件下被冷凝至40℃,所得的汽、液两相达到平衡。
求其汽相摩尔数和液相摩尔数之比。
已知轻、重组分在40℃时的蒸汽压分别为370kPa 和120kPa 。
解:两相中,720.01203701203000B0A 0B =--=--=p p p p x 888.0300720.03700A A =⨯===x p p p p y设汽相摩尔量为V ,液相摩尔量为L ,总量为F ,则L V F +=Lx Vy Fx F +=由以上两式可得:217.075.0888.072.075.0F F =--=--=x y x x L V 事实上,汽液平衡体系中,两相的摩尔量比值服从杆杠定律。
6-32 苯和甲苯组成的理想溶液送入精馏塔中进行分离,进料状态为汽液共存,其两相组成分别如下:5077.0F =x ,7201.0F =y 。
用于计算苯和甲苯的蒸汽压方程如下:8.2201211031.6lg 0A +-=t p5.2191345080.6lg 0B +-=t p其中压强的单位为Pa ,温度的单位为℃。
试求:(1)该进料中两组份的相对挥发度为多少?(2)进料的压强和温度各是多少?(提示:设进料温度为92℃) 解:(1)混合物中两组分的相对挥发度:49.25077.015077.07201.017201.011F F F F=--=--=x x y y α (2)设进料温度为92℃,则16.28.220921211031.6lg 0A =+-=pkPa 38.1440A =p 762.15.219921345080.6lg 0B =+-=pkPa 83.570B =p由此求得体系的相对挥发度为:496.283.5738.144'0B0A ===p p α 其值与(1)中所求相对挥发度足够接近,故可认为进料温度为92℃。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2)回流比 R = L 为多少? D
(答: D = 180kmol ⋅ h −1 , W = 608.6kmol ⋅ h −1 ; R = 3.72 )
解:V = L + D ,
D = V − L = 850 − 670 = 180kmol ⋅ h −1 ,
=
0.77 ,
精馏段操作线方程为:
y = R x + xD = 3 x + 0.77 = 0.75x + 0.1925 , R +1 R +1 3+1 3+1
即 y = 0.75x + 0.1925,
提馏段操作线方程为:
y = L′ x − WxW = 125.625 x − 8.125 × 0.04 , L′ − W L′ − W 125.625 − 8.125 125.625 − 8.125
r甲苯 = 32200kJ ⋅ kmol−1,
⇒ r = 0.4r苯 + 0.6r甲苯 = 31609.7kJ ⋅ kmol−1 ,
平均温度: 25 + 95 = 60°C , 2
查得 60°C 苯的比热为 cp = 143.5kJ ⋅ kmol−1 ⋅ K −1 ,
甲苯的比热为 cp = 169.3kJ ⋅ kmol−1 ⋅ K −1 ,
和含物质 B(摩尔质量为 90kg ⋅ kmol−1 ) 0.7 的混合蒸气自一连续精馏塔底送入。若要求
塔顶产品中物质 A 的组成为 0.95 ,釜液中物质 A 的组成为 0.01 。试求:(1)进入冷凝器底 蒸气流量为多少?以摩尔流量表示。(2)回流比 R 为多少?
(答:(1)V = 116kmol ⋅ h −1 ; (2) R = 1.96 ) 解: F = D + W ,
含 0.95 苯的馏出液和 0.04 苯(以上均为摩尔分数)的釜液。回流比为 3 ,泡点进料,进料
量为100kmol ⋅ h −1 。求从冷凝器回流入塔顶的: L = 118.68kmol ⋅ h −1 ;V = 158.24kmol ⋅ h −1 )
解:由 F = D + W 、 FxF = DxD + WxW ,
在平衡线与操作线间作梯级,塔内理论板数为八块,加料板为第六块。(图略)
6-8.用一连续精馏塔分离苯-甲苯混合液,原料中含苯 0.4 ,要求塔顶馏出液中含苯 0.97 ,釜液中含苯 0.02 (以上均为摩尔分数),若原料液温度为 250 C ,求进料热状态参
数 q 为多少?若原料为气液混合物,气液比为 3 / 4 , q 值为多少?
t / 0C
α
xA
80.2
2.53
1.0
84.1
2.56
0.823
88.0
2.52
0.659
92.0
2.50
0.508
96.0
2.44
0.376
100
2.40
0.256
104
2.39
0.155
108
2.36
0.058
110.4
2.30
0
yA
1 0.919 0.825 0.716 0.595 0.456 0.309 0.131
⇒ c p = 0.4 ×143.5 + 0.6 ×169.5 = 159.1kJ ⋅ kmol−1 ⋅ K −1 ,
q = 31609.7 + 159.1(95 − 25) = 1.35 ; 31609.7
气液混合物:
q = 汽化率 = 4 = 0.57 。 7
6-9.某液体混合物含易挥发组分 0.65 (摩尔分数,下同),以饱和蒸汽加入连续精馏 塔中,加料量为 50kmol ⋅ h −1 ,残液组成为 0.04 ,塔顶产品的回收率为 99%,回流比为 3 ,
6-7.在连续精馏塔中将甲醇 30%(摩尔分数,下同)的水溶液进行分离,以便得到含
甲醇 95% 的馏出液及 3% 的釜液。操作压力为常压,回流比为1.0 ,进料为泡点液体,试求
理论板数及加料位置。常压下甲醇和水的平衡数据如下:
t /0 C
液相中甲醇的摩尔分数
/%
气相中甲醇的摩尔分数
/%
100
0.0
96.4
(答: NT = 8; 6 块板进料 ) 解: x = xD , y = xD 在 y − x 图上得 a 点,
精馏段截距 xD = 0.95 = 0.475 , R +1 1+1
在 y − x 图上得 c 点,连接 ac 得精馏段操作线,
过 x = xF 做垂直线与精馏段操作线的交点 d , 当 x = xW 时,提馏段操作线 y = xW 对角线上 b 点,
⑵根据回流比的定义 R = L / D 有:
L = RD = 3 × 41.875 = 125.625kmol ⋅ h −1 ,
又∵ V = L + D = (R + 1)D = (3 + 1) × 41.875 = 167.5kmol ⋅ h −1 ,
因为进料为饱和蒸气 q = 0 ,所以提馏段上升蒸气和下降的液流量如下:
解:⑴根据回收率的定义有:η = DxD , FxF
又∵ FxF = DxD + WxW ,
∴ WxW = 1 −η , FxF
则W = FxF (1 −η) = 50 × 0.65 × (1 − 0.99) = 8.125kmol ⋅ h −1,
xW
0.04
∴ D = F −W = 50 − 8.125 = 41.875kmol ⋅ h −1 ;
试求:(1)塔顶、塔底的产品流量;(2)精馏段和提馏段内上升蒸汽及下降液体的流量;(3) 写出精馏段和提馏段的操作线方程。
(D = 41.875 , W = 8.125 , V = 167.5 , L = 125.625 , V ′ = 117.5
L′ = 125.625 以上单位均为kmol ⋅ h −1, y = 0.75x + 0.1925, y = 1.07x − 0.03)
199.32
83.33
108
221.19
93.93
110.4
233.05
101.33
根据上表数据作101.33kPa 下苯和甲苯溶液的 t − y − x 图及 y − x 图。此溶液服从拉乌
尔定律。
解: xA
=
P − PB 0 PA0 − PB 0
; yA
=
PA 0 P
xA
t / 0C
80.2 84.1 88.0 92.0 96.0 100 104 108 110.4
FxF = DxD + WxW , ⇒ D = 3085.1kg ⋅ h −1 ,
xD
=
0.95 / 78 0.95 0.05
=
0.956 ,
+
78 90
0.3 / 78
xF = 0.3
= 0.33 , 0.7
+
78 90
M D = 0.956 × 78 + 0.044 × 90 = 78.53 , M F = 0.33 × 78 + 0.67 × 90 = 86.11, V = 10000 = 116kmol ⋅ h −1 ,
86.11
D = 3085.1 = 39.28kmol ⋅ h −1 , 78.53
V = (R + 1)D ⇒ R = V −1 = 116 −1 = 1.96 。 D 39.28
6-5.某连续精馏塔,泡点加料,已知操作线方程如下:
精馏段
y = 0.8x + 0.172
提馏段
y = 1.3x − 0.018
V ′ = V − (1 − q)F = 167.5 − (1 − 0) × 50 = 117.5kmol ⋅ h −1 ,
L′ = L + qF = 125.625 + 0 × 50 = 125.625kmol ⋅ h −1 ;
⑶由回收率定义得:
xD
=
FxFη D
=
50 × 0.65× 0.99 41.875
2.0
93.5
4.0
91.2
6.0
89.3
8.0
87.7
10.0
84.4
15.0
81.7
20.0
78.0
30.0
75.3
40.0
73.1
50.0
71.2
60.0
69.3
70.0
67.6
80.0
66.0
90.0
65.0
95.0
64.5
100.0
0.0 13.4 23.4 30.4 36.5 41.8 51.7 57.9 66.5 72.9 77.9 82.5 87.0 91.5 95.8 97.9 100.0
xA
1.0 0.823 0.659 0.508 0.376 0.256 0.155 0.058
0
yA
1.0 0.925 0.83 0.72 0.596 0.453 0.304 0.123
0
1.0
x(y)
0.8
0.6
0.4
0.2
0.0
80
85
90
95
100
105
110
t/0C
1.0
0.8
y
0.6
0.4
( 答: q = 1.35 ; q = 0.57 )
解: xF
=
αA /MA
αA /MA +αB
