CO2二氧化碳物性特性参数
二氧化碳理化性质及危险特性表

二氧化碳理化性质及危险特性表物质名称:二氧化碳英文名称:carbon dioxide危险性类别:第2.2类不燃气体物化特性熔点(℃)-56.6(527kPa)沸点(℃)-78.5(升华)溶解性溶于水、烃类等多数有机溶剂。
危险货物编号:UN编号:1013相对密度(空气=1)1.53 相对密度(水=1)火灾爆炸危险数据闪点(℃)临界温度(℃)灭火方法危险特性健康危害数据侵入途径急性毒性无意义31饱和蒸气压1013.25(-39燃烧热(kPa)℃)无色无臭气体。
偶然义1.56(-79℃)外观与气味爆炸极限(%)临界压力(MPa)上限无意义下限无意义引燃温度(℃)无意义7.39燃烧性本品不燃。
本品不燃。
尽可能将从火场移至空旷处。
喷水保持火场冷却,直至灭火结束。
若遇高热,内压增大,有开裂和爆炸的危险。
皮肤接触、眼睛接触、吸入LD50无资料LC50无资料安康危害在低浓度时,对呼吸中枢呈兴奋作用,高浓度时则产生按捺甚至麻痹作用。
中毒机制中还兼有缺氧的身分。
急性中毒:人进入高浓度二氧化碳情况,在几秒钟内迅速昏迷倒下,反射消逝、瞳孔扩大或缩小、大小便失禁、呕吐等,更严重者出现呼吸截止及休克,甚至死亡。
固态(干冰)和液态二氧化碳在常压下迅速汽化,能造成-80~-43℃高温,引发皮肤和眼睛严重的冻伤。
慢性影响:经常接触较高浓度的二氧化碳者,可有头晕、头痛、失眠、易兴奋、无力等神经功用紊乱等。
但在生产中是否存在慢性中毒国内外均未见病例报道。
泄露紧急处理迅速撤离泄漏污染区人员至上风处,并进行隔离,严格限制出入。
建议应急处理人员戴自给正压式呼吸器,穿一般作业工作服。
尽可能切断泄漏源。
合理通风,加速扩散。
漏气要妥善处理,修复、检验后再用。
运输注意事项:采用刚瓶运输时必须戴好钢瓶上的安全帽。
钢瓶一般平放,并应将瓶口朝同一方向,不可交叉;高度不得超过车辆的防护栏板,并用三角木垫卡牢,防止滚动。
严禁与易燃物或可燃物等混装混运。
夏季应早晚运输,防止日光曝晒。
二氧化碳的性质与用途

二氧化碳的性质与用途二氧化碳是一种无色、无臭的气体,化学式为CO2、它是地球大气中最重要的温室气体之一,并在许多行业和领域中具有广泛的应用。
现在我们将详细介绍二氧化碳的性质和用途。
1.性质1.1物理性质:二氧化碳是一种相对较重的气体,在常温下为无色、无臭的气体。
它比空气重约1.5倍,凝固点为-78.5℃,沸点为-56.6℃。
此外,二氧化碳具有较高的溶解度,可以溶解于许多溶剂中。
1.2化学性质:二氧化碳是一种稳定的分子,不容易发生化学反应。
它不易燃烧,不支持燃烧。
但在高温和高压条件下,二氧化碳还是可以和一些物质发生反应。
2.用途2.1工业用途:二氧化碳在工业中拥有广泛的用途。
一方面,在食品饮料行业中,二氧化碳被用作充气剂,为饮料增加气泡和口感。
此外,它还用于制作碳酸饮料、啤酒等。
二氧化碳还可作为冷却剂和气雾剂在一些喷涂和清洁过程中使用。
另一方面,二氧化碳还是钢铁、煤矿和水泥等工业中的还原剂。
2.2医疗应用:二氧化碳在医疗领域中也有着重要的用途。
利用其特性,二氧化碳可以用作治疗呼吸道疾病的气体。
例如,在肺功能测试中,患者需要吸入含有二氧化碳的气体来评估肺功能。
此外,二氧化碳还被用于一些医疗手术,例如腹腔镜手术,可以通过将二氧化碳充入腹腔来创造一个操作空间。
2.3温室气体:二氧化碳是地球大气中最重要的温室气体之一、在大气中,二氧化碳可以吸收和辐射地球表面的热能,通过这种方式,二氧化碳的存在会影响地球的气候。
然而,由于人类活动的增加,二氧化碳的排放量大大增加,导致地球温室效应加剧,引发了全球变暖的问题。
2.4消防灭火:二氧化碳具有窒息作用,可用于灭火。
在火灾发生时,将二氧化碳注入火源中,由于二氧化碳的密度较大,它能从下往上覆盖火焰,减少火焰周围氧气浓度,以达到灭火的效果。
因此,二氧化碳广泛应用于电气设备、机械设备和航空航天等领域的灭火系统中。
2.5聚合物加工:二氧化碳还可作为聚合物加工中的膨胀剂使用。
例如,在注塑过程中,通过向聚合物中注入二氧化碳,可以在聚合物内产生气泡,这样可以降低聚合物的密度,减少材料的成本。
二氧化碳的物理性质和化学性质

二氧化碳的物理性质和化学性质二氧化碳在生活无处不在,只是它难以发现而已。
那么二氧化碳的物理性质和化学性质各位同学知道吗?为了普及知识,下面是由小编小编为大家整理的“二氧化碳的物理性质和化学性质”,仅供参考,欢迎大家阅读。
二氧化碳的物理性质:1、常温常压下是一种无色无味或无色无嗅(嗅不出味道)而略有酸味的气体;2、溶于水和烃类等多数有机溶剂;3、密度比空气大;4、熔点为-56.6℃,沸点为-78.5℃。
二氧化碳的化学式为CO2,是一种碳氧化合物,常温常压下是一种无色无味的气体,也是一种常见的温室气体,是空气的组分之一。
二氧化碳的化学性质不活泼,热稳定性很高,不能燃烧,通常也不支持燃烧。
属于酸性氧化物,具有酸性氧化物的通性,因与水反应生成的是碳酸,所以是碳酸的酸酐。
1、高纯二氧化碳主要用于电子工业,医学研究及临床诊断、二氧化碳激光器、检测仪器的校正气及配制其它特种混台气,在聚乙烯聚合反应中则用作调节剂。
2、固态的二氧化碳可以用来冷藏奶制品、肉类、冷冻食品和其他转运途中容易腐败的食品。
3、气态的二氧化碳可以用来碳化软饮料,便于食品保存等。
4、液体二氧化碳可以用作灭火剂。
化学性质:“三不二水”二氧化碳不能燃烧,不能助燃,也不能供呼吸.二氧化碳能与水反应生成使紫色石蕊试液变红的碳酸:CO2 + H2O = H2CO3.但碳酸不稳定,受热易分H2CO3=△= CO2 ↑+ H2O .二氧化碳通入澄清的石灰水,能使石灰水变浑浊 ,这也是检验二氧化碳的方法.Ca(OH)2+CO2 = CaCO3↓ + H2O另外,二氧化碳还是光合反应的原料:6CO2 + 6H2O =叶绿体、光照=C6H12O6 + 6O2会的,干冰在气化的时候会大量吸热,会造成局部低温,灭火是喷出的二氧化碳有降温和隔绝空气的作用,灭火器是靠灭火剂来区分的,使用时先拔出保险销,一只手按住把柄,另一只手紧握压把,切记不能用手直接抓住金属连接管,防止手被冻伤。
二氧化碳的理化性质及危险特性

二氧化碳的理化性质及危险特性理化性质二氧化碳(CO2)是一种无色、无味的气体,其化学式由一个碳原子和两个氧原子组成。
以下是二氧化碳的一些重要理化性质:1. 密度:二氧化碳的密度较大,约为空气的1.98倍。
这使得二氧化碳能够在低处聚集,并形成所谓的"二氧化碳下沉"现象。
2. 熔点和沸点:二氧化碳在标准大气压下,熔点为-56.6℃,沸点为-78.5℃。
这意味着二氧化碳在常温下呈固态(干冰),需要较低的温度才能转变为气体。
3. 可溶性:二氧化碳在水中能够溶解,形成碳酸。
这使得二氧化碳可以在自然界中参与碳循环,并影响生物系统的平衡。
4. 不燃性:二氧化碳本身是不可燃的,但能够支持燃烧过程,促进火势扩大。
危险特性尽管二氧化碳对人体相对无害,并且在自然界中广泛存在,但在某些情况下,它可能会具备一些危险特性。
以下是一些重要的危险特性:1. 窒息风险:二氧化碳是一种窒息性气体。
当高浓度的二氧化碳存在于空间中时,它可以排挤氧气导致缺氧,可能对人体造成窒息和死亡的危险。
2. 灭火风险:二氧化碳可以作为灭火剂使用。
然而,在使用二氧化碳灭火系统时,必须注意避免高浓度的二氧化碳对人体的窒息作用。
3. 温室气体:二氧化碳被认为是主要的温室气体之一,对地球的气候变化产生重要影响。
由于二氧化碳的浓度增加,可能导致地球温度上升,引发极端天气和海平面上升等问题。
需要特别注意的是,在处理和使用二氧化碳时,必须遵守相关的安全规定和操作指南,以确保安全性和减少潜在的危险。
参考文献- Smith, L.A. (2009). Carbon Dioxide: Properties and Applications. CRC Press.- IPCC (2013). Climate Change 2013: The Physical Science Basis. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge University Press.- National Fire Protection Association (NFPA). (2020). NFPA 12: Standard on Carbon Dioxide Extinguishing Systems.。
二氧化碳规格

二氧化碳(CO2)是一种无色、无味、无毒的气体,化学式为CO2。
以下是二氧化碳的一些常见规格:
- 分子式:CO2
- 分子量:44.01 g/mol
- 摩尔体积:22.32 L/mol(标准大气压下)
- 密度:1.977 g/L(0 °C,标准大气压下)
- 沸点:-78.5 °C
- 融点:-56.6 °C
二氧化碳广泛应用于工业、农业、医疗等领域。
在工业方面,二氧化碳被用作化学品生产、焊接、冷冻和清洗的原料。
在农业方面,二氧化碳被用来增加温室气体浓度以促进植物生长。
在医疗领域,二氧化碳被用于制作麻醉剂和医疗设备的消毒。
需要注意的是,二氧化碳是一种温室气体,在过量排放或积累的情况下可能对环境产生负面影响。
因此,在使用和处理二氧化碳时,需要严格遵守相关的环境保护和安全规定。
二氧化碳的物理性质简介

二氧化碳的物理性质简介1二氧化碳的物理性质二氧化碳在常温常压下为无色无味气体,溶于水和烃类等多数有机溶剂。
二氧化碳一般可由高温煅烧石灰石或由石灰石和稀盐酸反应制得,主要应用于冷藏易腐败的食品(固态)、作致冷剂(液态)、制造碳化软饮料(气态)和作均相反应的溶剂(超临界状态)等。
关于其毒性,研究表明:低浓度的二氧化碳没有毒性,高浓度的二氧化碳则会使动物中毒。
2二氧化碳的化学性质二氧化碳是碳氧化合物之一,是一种无机物,不可燃,通常不支持燃烧,低浓度时无毒性。
它也是碳酸的酸酐,属于酸性氧化物,具有酸性氧化物的通性,其中碳元素的化合价为+4价,处于碳元素的最高价态,故二氧化碳具有氧化性而无还原性,但氧化性不强。
3二氧化碳产生途径二氧化碳气体是大气组成的一部分(占大气总体积的0.03%-0.04%),在自然界中含量丰富,其产生途径主要有以下几种:①有机物(包括动植物)在分解、发酵、腐烂、变质的过程中都可释放出二氧化碳。
②石油、石腊、煤炭、天然气燃烧过程中,也要释放出二氧化碳。
③石油、煤炭在生产化工产品过程中,也会释放出二氧化碳。
④所有粪便、腐植酸在发酵,熟化的过程中也能释放出二氧化碳。
⑤所有动物在呼吸过程中,都要吸氧气吐出二氧化碳会中毒吗吸入浓度过高的二氧化碳会中毒,主要是指长期处在低氧和高二氧化碳的环境中,或者突然进入高浓度的二氧化碳环境中,都会引起中毒,一般会引起恶心、呕吐、头晕、头痛,会出现注意力不集中,引起记忆力减退。
比较严重的情况下还会引起昏迷,出现呼吸中枢的麻痹,而影响患者的生命。
如果怀疑二氧化碳中毒,需要立刻离开这种环境,需要及时吸氧或者吸新鲜的空气,症状比较严重的需要把患者及时送去医院,接受检查和救治。
一般需要抽血化验做血气分析,还需要做X线检查,症状比较严重的需要用高压氧舱治疗。
人二氧化碳的中毒怎么办?1、一氧化碳中毒人一氧化碳中毒时会最初感觉为头痛、头昏、恶心、呕吐、软弱无力,当他意识到中毒时,常挣扎下床开门、开窗,但一般仅有少数人能打开门,大部分病人迅速发生抽痉、昏迷,两颊、前胸皮肤及口唇呈樱桃红色,如救治不及时,可很快呼吸抑制而死亡。
二氧化碳的性质及应用

二氧化碳的性质及应用二氧化碳是一种由碳原子和两个氧原子组成的化学物质,化学式为CO2。
它是地球上最常见的气体之一,也是温室气体的一种。
在常温下,二氧化碳是无色、无味、无臭的气体,密度比空气大约1.5倍。
下面将从物理性质、化学性质以及应用方面来详细论述二氧化碳。
首先,二氧化碳具有一些比较明显的物理性质。
它的熔点为-56.6摄氏度,沸点为-78.5摄氏度,对大气压下会直接从固态转变为气态,这一现象被称为“升华”。
此外,二氧化碳是在常温下不可燃的气体,不支持燃烧的过程。
在饱和蒸气压下,它可以形成固态的干冰而不会形成液体。
其次,从化学性质来看,二氧化碳相对稳定,与多数物质反应较不活泼。
但在高温和高压下,它与某些物质可以发生激烈的反应。
例如,二氧化碳可以与碱金属反应生成碱式碳酸盐、与酸反应形成碳酸等,这些反应在化学工业中有一定的应用。
在应用方面,二氧化碳有着广泛的用途。
首先,二氧化碳是饮料和气泡饮料中常见的一种气体。
它可以通过在液体中通入二氧化碳气体的方式制造出起泡效果。
此外,二氧化碳还是一种广泛应用于气体焊接和激光切割等工艺中的媒介气体。
在激光切割过程中,高能量的激光束通过与金属反应生成熔融或蒸发产物来实现材料的切割。
其次,二氧化碳还在消防和灭火领域有重要应用。
二氧化碳灭火系统是一种常用的灭火装置,广泛应用于电子设备、计算机机房、图书馆、博物馆以及航空航天等关键设施领域。
二氧化碳在灭火过程中可以吸收燃烧区域的热量,降低氧气浓度,从而消除燃烧过程中需要的三要素,即燃料、氧气和可燃物温度。
此外,二氧化碳还在一些工业过程中被用作溶剂和中间体。
例如,二氧化碳可用作化学反应中的溶剂或催化剂,与一些有机物反应可以产生酯、酸和酮等有机化合物。
它也可以被用作超临界流体在高温高压条件下的处理介质,例如用于咖啡因的提取、聚合物的合成和材料表面的改性等。
最后,二氧化碳还在农业和食品工业中有广泛应用。
例如,二氧化碳可以作为食品保鲜剂,用于延长食品的保质期。
CO2二氧化碳物性特性参数

CO2二氧化碳物性特性参数二氧化碳(CO2)是一种由碳原子和氧原子组成的无色、无味的化合物。
在常温常压下,CO2以气体形式存在。
下面将详细介绍CO2的物性特性参数。
1. 摩尔质量:CO2的摩尔质量为44.01 g/mol。
2.熔点和沸点:CO2在常温下的熔点为-78.5°C,在常温常压下的沸点为-57°C。
3. 密度:CO2的密度受到温度和压力的影响。
在常温常压下,CO2的密度约为1.98 kg/m³。
在液化的状态下,CO2的密度可显著增加。
4. 相态:CO2在常温常压下是一种气体,但可以通过增加压力将其转化为液体或固体。
在洛斯查特压力(臨界點為73.8 atm)以下,CO2存在为气体;在洛斯查特压力以上,CO2存在为液体或固体。
5.溶解性:CO2是一种高度溶解于水的气体。
在常温常压下,CO2与水反应形成碳酸,在水中可呈现酸性。
因此,CO2在自然界中的大气、地球表面水体和植物体内均广泛存在。
6.热力学属性:CO2是一种非常稳定的化合物,具有较高的化学惰性。
它不易燃烧,也不支持燃烧过程。
7.等温压缩系数和温度扩散系数:CO2的等温压缩系数表示了单位温度变化时CO2体积的变化。
温度扩散系数表示了CO2分子在气体中扩散的速率。
8.热导率:CO2是一种热绝缘体,具有较低的热导率。
这使得CO2成为一种常用的绝热材料。
9.可燃性:CO2本身不是易燃物质,但可以参与其他物质的氧化反应,促进燃烧。
10.环境影响:CO2是一种温室气体,对地球的气候变化产生重要影响。
它的排放和累积与全球气候变暖和海平面上升等问题相关。
以上是CO2的一些物性特性参数。
了解和研究CO2的物性特性对于环境保护、能源开发和气候变化应对具有重要意义。
二氧化碳理化特性表

二氧化碳理化特性表
简介
本文档旨在提供关于二氧化碳的理化特性的相关信息。
二氧化碳是一种常见的气体,在许多领域都有广泛的应用。
了解其理化特性对于工业生产和环境保护具有重要意义。
理化特性
以下是二氧化碳的一些重要理化特性:
分子结构
- 分子式:CO2
- 分子量:44.01 g/mol
物理性质
- 相态:在常温常压下,二氧化碳为无色无味的气体。
- 沸点:-78.5 °C
- 融点:-56.6 °C
- 密度:1.98 kg/m³(液态二氧化碳)
- 溶解度:二氧化碳可溶于水和一些有机溶剂。
化学性质
- 反应性:二氧化碳不易燃烧,但可作为氧化剂参与许多化学反应。
- 酸碱性:二氧化碳溶于水形成碳酸,具有酸性。
- 腐蚀性:二氧化碳不具有直接腐蚀性。
环境影响
- 温室效应:二氧化碳是主要的温室气体之一,对地球气候变化有重要影响。
- 碳循环:二氧化碳参与了地球上的碳循环,对生物和地球系统起着重要作用。
应用领域
- 工业制造:二氧化碳广泛应用于化工、制药、食品加工等工业生产过程中。
- 饮料制造:二氧化碳可用于制造碳酸饮料和啤酒等饮料。
- 消防灭火:二氧化碳是常用的灭火剂之一,具有无毒、高效的特点。
- 医疗应用:二氧化碳可用于医疗设备中,如呼吸机和麻醉机等。
结论
二氧化碳是一种常见而重要的化合物,具有多种理化特性。
了解二氧化碳的性质对于相关领域的研究和应用具有重要意义。
二氧化碳的理化性质及危险特性

二氧化碳的理化性质及危险特性中文名称:二氧化碳;碳酸酐分子式:CO2 分量44.01标英文名称:carbon dioxide UN 编号:1013识含量≥99.9% 有害成分:二氧化碳CAS 号:124-38-9 危险货物编号:22019 外观与性状无色无臭气体。
熔点(℃):-56.6(527kpa) 饱和蒸气压1013.25 (-39℃)沸点(℃):-78.5(升华)引燃温度无意义相对密度:(水=1)1.56(-79℃) (空气=1): 1.53理化爆炸上限(%)无意义临界压力(Mpa) 无意义特征爆炸下限(%)无意义临界温度(℃)31溶解性:溶于水、烃类等多数有机溶剂。
用于制糖工业、制碱工业、制铅白等,也用于冷饮、灭火及有主要用途:机合成。
皮肤接触:若有冻伤,就医治疗。
急救眼睛接触:若有冻伤,就医治疗。
措施吸入:迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。
就医。
食入:危险特性:若遇高热,容器内压增大,有开裂和爆炸的危险。
消防措施灭火方法:本品不燃。
尽可能将容器从火场移至空旷处。
喷水保持火场容器冷却,直至灭火结束。
危险性类别:第2.2 类不燃气体侵入途径:吸入。
环境危害:对大气可造成污染。
在低浓度时,对呼吸中枢呈兴奋作用,高浓度时则产生抑制甚至麻痹作用。
中毒机制中还兼有缺氧的因素。
急性中毒:人进危入高浓度二氧化碳环境,在几秒钟内迅速昏迷倒下,反射消失、险性瞳孔扩大或缩小、大小便失禁呕吐等,更严重者出现呼吸停止概健康危害:及休克,甚至死亡。
固态(干冰)和液态二氧化碳在常压下迅述速汽化,能造成-80~-43℃低温,引起皮肤和眼睛严重的冻伤。
慢性影响:经常接触较高浓度的二氧化碳者,可有头晕、头痛、失眠、易兴奋、无力等神经功能紊乱等。
但在生产中是否存在慢性中毒国内外均未见病例报道。
燃爆危险:本品不燃。
操密闭操作。
提供良好的自然通风条件。
操作人员必须经过专门作处置操作处置注意事项:培训,严格遵守操作规程。
二氧化碳物理性质化学性质

二氧化碳物理性质化学性质
二氧化碳(CO2)是现代学科中极其重要的物质。
它根据其物理性质和化学性
质分别被称为一种气体和一种无机化合物。
物理性质上,二氧化碳实际上是透明的,具有从结晶到气态之间的温度变化,
只有在煤和汽油燃烧时才显示出它的存在。
它的沸点为-78.5摄氏度,它的比重也
比其他气体小,可以支撑地球上的大气层。
它能轻易溶解在液态水中。
二氧化碳可产生多余的压力,以增加液体的形状,这也是它如此重要的原因之一。
化学性质上,二氧化碳是一种无机化合物,其分子组成结构为CO2。
它在标准
温度下不易溶于水,但是在常温下可以被吸收。
它是一种稳定的化合物,可以在许多不同的物质中转化,例如果碳与一氧化碳一起存在,它们可以非常容易地反应,产生二氧化碳及其他特殊的成分。
它因拥有极佳的化学反应性,而成為生物体及工业生产中再也不可或缺的物质。
二氧化碳是个充满神奇的物质,其重要性不言而喻。
而学习和研究关于它的物
理性质和化学性质,也让现代学科更上一层楼。
它是现代科学发展不可或缺的,在高校和大学教育中,二氧化碳的相关知识必须通过课程系统被传播,进而形成梁桥,连接科技及未来。
二氧化碳的物理性质和化学性质

二氧化碳的物理性质和化学性质二氧化碳在生活无处不在,只是它难以发现而已。
那么二氧化碳的物理性质和化学性质各位同学知道吗?为了普及知识,下面是由小编为大家整理的“二氧化碳的物理性质和化学性质”,仅供参考,欢迎大家阅读。
二氧化碳的物理性质二氧化碳的物理性质:1、常温常压下是一种无色无味或无色无嗅(嗅不出味道)而略有酸味的气体;2、溶于水和烃类等多数有机溶剂;3、密度比空气大;4、熔点为-56.6℃,沸点为-78.5℃。
二氧化碳简介二氧化碳的化学式为CO2,是一种碳氧化合物,常温常压下是一种无色无味的气体,也是一种常见的温室气体,是空气的组分之一。
二氧化碳的化学性质不活泼,热稳定性很高,不能燃烧,通常也不支持燃烧。
属于酸性氧化物,具有酸性氧化物的通性,因与水反应生成的是碳酸,所以是碳酸的酸酐。
二氧化碳的应用1、高纯二氧化碳主要用于电子工业,医学研究及临床诊断、二氧化碳激光器、检测仪器的校正气及配制其它特种混台气,在聚乙烯聚合反应中则用作调节剂。
2、固态的二氧化碳可以用来冷藏奶制品、肉类、冷冻食品和其他转运途中容易腐败的食品。
3、气态的二氧化碳可以用来碳化软饮料,便于食品保存等。
4、液体二氧化碳可以用作灭火剂。
二氧化碳的化学性质化学性质:“三不二水”二氧化碳不能燃烧,不能助燃,也不能供呼吸.二氧化碳能与水反应生成使紫色石蕊试液变红的碳酸:CO2 + H2O = H2CO3.但碳酸不稳定,受热易分H2CO3=△= CO2 ↑+ H2O .二氧化碳通入澄清的石灰水,能使石灰水变浑浊 ,这也是检验二氧化碳的方法.Ca(OH)2+CO2 = CaCO3↓ + H2O另外,二氧化碳还是光合反应的原料:6CO2 + 6H2O =叶绿体、光照=C6H12O6 + 6O2会的,干冰在气化的时候会大量吸热,会造成局部低温,灭火是喷出的二氧化碳有降温和隔绝空气的作用,灭火器是靠灭火剂来区分的,使用时先拔出保险销,一只手按住把柄,另一只手紧握压把,切记不能用手直接抓住金属连接管,防止手被冻伤。
二氧化碳物质特性与危害识别表
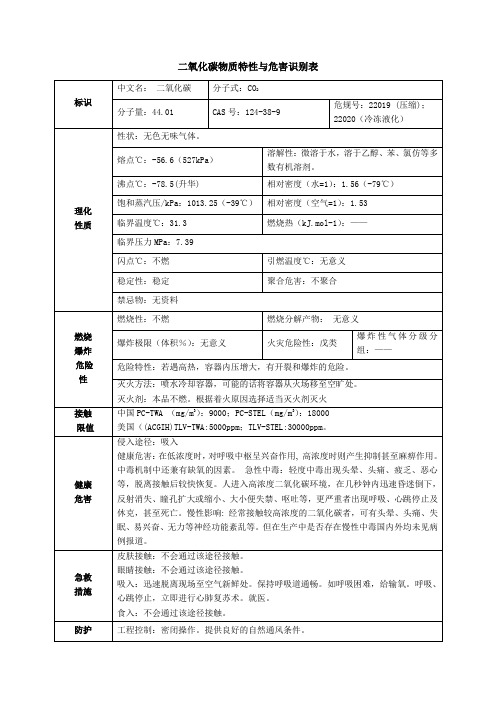
[身体防护]:穿一般作业工作服。
[手防护]:戴一般作业防护手套。
[其他防护]:避免高浓度吸入。进入限制性空间或其它高浓度区作业,须有人监护。
应急
泄漏
处理
大量泄漏:根据气体扩散的影响区域划定警戒区,无关人员从侧风、上风向撤离至安全区,建议应急处理人员戴正压自给式呼吸器,穿一般作业工作服,尽可能切断泄漏源。漏出气允许排入大气中,泄漏场所保持通风。
健康
危害
侵入途径:吸入
健康危害:在低浓度时,对呼吸中枢呈兴奋作用,高浓度时则产生抑制甚至麻痹作用。中毒机制中还兼有缺氧的因素。急性中毒:轻度中毒出现头晕、头痛、疲乏、恶心等,脱离接触后较快恢复。人进入高浓度二氧化碳环境,在几秒钟内迅速昏迷倒下,反射消失、瞳孔扩大或缩小、大小便失禁、呕吐等,更严重者出现呼吸、心跳停止及休克,甚至死亡。慢性影响:经常接触较高浓度的二氧化碳者,可有头晕、头痛、失眠、易兴奋、无力等神经功能紊乱等。但在生产中是否存在慢性中毒国内外均未见病例报道。
二氧化碳物质特性与危害识别表
标识
中文名:二氧化碳
分子式:CO2
分子量:44.01
CAS号:124-38-9
危规号:22019 (压缩);
22020(冷冻液化)
理化
性质
性状:无色无味气体。
熔点℃:-56.6(ቤተ መጻሕፍቲ ባይዱ27kPa)
溶解性:微溶于水,溶于乙醇、苯、氯仿等多数有机溶剂。
沸点℃:-78.5(升华)
相对密度(水=1):1.56(-79℃)
运输注意事项:采用钢瓶运输时必须戴好钢瓶上的安全帽。钢瓶一般平放,并应将瓶口朝同一方向,不可交叉;高度不得超过车辆的防护栏板,并用三角木垫卡牢,防止滚动。严禁与易燃物或可燃物等混装混运。夏季应早晚运输,防止日光曝晒。铁路运输时要禁止溜放。
二氧化碳物性特性参数

二氧化碳物性特性参数二氧化碳(CO2)是一种无色、无味、无臭的气体。
在常温常压下,它是一种无毒、无燃性的气体。
二氧化碳具有以下物性特性参数:1. 密度:二氧化碳是一种相对较轻的气体,其密度为1.98 kg/m³,比空气稍重。
这使得二氧化碳在空气中往往向下沉积,形成“下沉”特性。
2.熔点和沸点:二氧化碳的熔点为-78.5°C,沸点为-56.6°C。
因此,在常温常压下,二氧化碳处于气体状态。
当温度降低到熔点以下时,二氧化碳会凝固成为固体,通常称为干冰。
3.溶解性:二氧化碳在水中具有一定的溶解度,形成碳酸溶液。
在常温下,二氧化碳可溶解约1千克二氧化碳溶解于1千克水中。
这种溶解性使得二氧化碳能够在水中形成碳酸,从而对生物和环境产生一定的影响。
4.导热性:二氧化碳的导热系数较低,约为0.014W/(m·K)。
这意味着二氧化碳的热传导能力较差,不如空气等其他气体传导热量效果好。
5.气味:虽然二氧化碳本身是无味无臭的,但在高浓度下,其可影响人类呼吸系统,导致呼吸困难和窒息。
6.光学特性:二氧化碳对红外线辐射具有吸收能力,在特定波长范围内具有较高的吸收率。
这使得二氧化碳具有较好的光学特性,被广泛应用于激光等领域。
7.化学反应:二氧化碳是一种稳定的化合物,不易与其他物质发生反应。
但在一些特殊条件下,例如高温高压下,二氧化碳可以与金属反应形成碳酸盐。
总结:二氧化碳是一种常见的化学物质,具有一系列特性参数,包括密度、熔点和沸点、溶解性、导热性、气味、光学特性和化学反应等。
这些特性参数使得二氧化碳在许多工业和科学领域得以广泛应用。
二氧化碳的特性

二氧化碳的特性
二氧化碳,一种碳氧化合物,化学式为CO2,化学式量为44.0095,常温常压下是一种无色无味或无色无臭而其水溶液略有酸味的气体,也是一种常见的温室气体,还是空气的组分之一。
在化学性质方面,二氧化碳的化学性质不活泼,热稳定性很高(2000℃时仅有1.8%分解),不能燃烧,通常也不支持燃烧,属于酸性氧化物,具有酸性氧化物的通性,因与水反应生成的是碳酸,所以是碳酸的酸酐。
二氧化碳是碳氧化合物之一,是一种无机物,不可燃,通常也不
支持燃烧,低浓度时无毒性。
它也是碳酸的酸酐,属于酸性氧化物,具有酸性氧化物的通性,其中碳元素的化合价为+4价,处于碳元素
的最高价态,故二氧化碳具有氧化性而无还原性,但氧化性不强。
在物理性质方面,二氧化碳的熔点为-56.6℃(527kPa),沸点为-78.5℃,密度比空气密度大(标准条件下),溶于水。
二氧化碳一般可由高温煅烧石灰石或由石灰石和稀盐酸反应制得,主要应用于冷藏易腐败的食品(固态)、作致冷剂(液态)、制造碳化软饮料(气态)和作均相反应的溶剂(超临界状态)等。
关于其毒性,研究表明:低浓度的二氧化碳没有毒性,高浓度的二氧化碳则会使动物中毒。
二氧化碳宏观表征

二氧化碳宏观表征
二氧化碳是一种无色无味的气体,在常温常压下为普通气体,分子式
为CO2。
下面从分子结构、化学性质、物理性质和应用等方面进行宏
观表征。
一、分子结构
二氧化碳分子由一个碳原子和两个氧原子组成,中心原子为碳原子,
氧原子与碳原子的键为双键。
分子结构呈线性排列,键角为180度,
结构简单明了。
二、化学性质
二氧化碳的化学性质稳定,不易被化学反应作用,不起化学反应作用,易于保存。
它具有酸性,可以在水中溶解,形成碳酸,能与碱反应生
成盐。
三、物理性质
1、密度:二氧化碳密度比空气大约1.5倍,浓度高于空气。
2、熔点:二氧化碳熔点为-56.6℃。
3、沸点:二氧化碳沸点为-78.5℃,在此温度下蒸发变为气体。
4、相对分子质量:44。
5、导电性:二氧化碳为非导体。
四、应用
1、饮料工业:二氧化碳是制造碳酸饮料的主要原料。
2、消防器材:二氧化碳被广泛用作灭火剂,因为它不会损伤电器设备。
3、气象学:气象实验室需要二氧化碳作为标准气体,用于研究天气预
报方面的研究。
4、切割、焊接:二氧化碳激光是现代金属加工工业的重要工具,可以
高效地将金属材料切割和焊接。
总之,二氧化碳是一种重要的气体,有着广泛的应用。
在生活和工业中,它发挥着不平凡的作用,为人们创造了更加便利的生产和生活环境。
