Seahorse海马代谢仪使用说明
海瑞思 HC 系列流量检测仪说明书

流量检测仪说明书手册修订前言亲爱的客户:感谢您信赖我们的品牌,购买海瑞思流量检测仪,此仪器被设计的尽可能实用和稳定,我们深信它在多年的使用期间,能够带给您非常满意的体验。
为了更好的操作仪器,请仔细阅读说明书。
本说明书介绍的是海瑞思HC系列流量检测仪的安装、设置、产品功能、操作方法、保养、维修和操作注意事项等。
使用前请仔细阅读本说明书,并妥善保管。
安全注意事项本说明书记录了如何正确安全的使用流量检测仪的方法,并阐述了防止对操作者本人和他人造成危害及财产损失的内容。
不可进行本操作说明书记载以外的操作。
[标识说明]目录第一章、准备和安装 (1)1.开箱 (1)1.1准备工作 (1)1.2附件 (1)2.仪器组成 (1)2.1仪器正面构成 (1)2.2仪器背面构成 (2)3.仪器安装与连接 (2)3.1流量检测仪安装环境 (2)3.2仪器气源/电源连接 (2)3.3工装夹具与仪器的连接 (2)3.4控制接口的说明 (3)第二章、仪器界面操作说明 (6)1.总览 (6)1.1开机界面说明 (6)2.用户登录 (6)2.1如何进行用户登录? (6)2.2如何修改密码? (8)2.3如何注销用户? (9)2.4新建用户 (9)3.测前设置 (9)3.1显示方式 (10)3.2启动方式 (11)3.3语言选择 (12)3.4单位选择 (12)3.5精度选择 (13)3.6当前压力 (14)3.7仪表回零 (14)3.8正压 (14)3.9负压 (14)4.程序参数 (14)4.1测试类型选择 (15)4.2测试方法选择 (16)4.3附加功能 (16)4.4测试时间参数 (17)4.5测试压力参数 (17)4.6外部输出状态 (18)4.7上方按钮说明 (18)4.8下方按钮说明 (20)5.系统设置 (21)5.1如何进入系统设置? (21)5.2输出 (22)5.3条码扫描参数 (22)5.4其他参数设置 (22)5.5通信状态 (22)5.6高级 (22)6.测试界面 (25)6.1测试界面 (25)7.历史记录 (26)7.条码扫描 (28)8.远程控制 (29)8.1 485modbus站号 (29)8.2 232modbus站号 (29)8.3结果上传 (29)8.4通信485串口/通信方式网口 (29)8.5 MES控制无效/MES控制有效 (29)8.6 IP地址 (30)9.工厂模式 (30)第三章、维护和保养 (31)1关于仪器保养 (31)1.1每天进行检测项目 (31)2.1 测试中NG多发时 (33)2.2 历史记录无法导出 (34)2.3仪器测试结果与实际泡水实验结果不对应 (34)第一章、准备和安装1.开箱1.1准备工作a)稳定且清洁的压缩气体,气压0.4Mpa-0.8Mpa;b)平稳并足够可靠的工作台;c)稳定且无泄漏的工装夹具;d)电源要求AC 220V(±15%)、50HZ;e)插好仪器的电源线,进出气气管、仪器与工装通讯的25PIN排线;连接方式见图1-3;1.2附件2.仪器组成2.1仪器正面构成图1-1 防滑脚垫X4橡胶提手停止按钮/NG指示灯蜂鸣器开始按钮/OK指示灯操作屏幕2.2仪器背面构成2.2.1背面构成A图1-23.仪器安装与连接3.1流量检测仪安装环境a) 仪器工作环境温度,尽量保持在26C °±1°;b) 仪器摆放避开门口、通风口、空调口等;c) 仪器摆放桌面要稳定可靠,仪器周边不得摆放杂物;3.2仪器气源/电源连接a) 如图1-4所示,首先将仪器摆放到平整且稳定的桌面,将电源线一端插进仪器电源接口,另一端插入220V/50HZ 单相电源插座上;b) 将φ8的气管一端接到仪器进气接口,另一端接到工厂气源上; c) 将测试接口的气管接到工件或者模具上; d) 打开电源开关,等待2-3秒,仪器启动完成;3.3工装夹具与仪器的连接进气接口 电源接口电源开关 仪器锁RS232/485接口 25PIN I/O 接口测试口B测试口A 铭牌网络接口 USB 接口图1-3图1-4工装与仪器连接步骤:a) 如图1-4,经过过滤后的工厂气源,分为两路,一路供给工装,一路供给仪器; b) 工装和仪器都是采用φ8的气管连接;c) 将仪器上φ4的出气管,连接到模具进气口; d) 用工装上25P 的排线连接到仪器上; e) 工装与仪器连接完成;3.4控制接口的说明a) 以太网接口:用于连接电脑(选配);接φ8的进气管 φ4测试管,连接模具 25PINO I/O 连接线 φ4测试气管 φ8进气管 电源线b)USB接口:用于导出历史数据或者安装扫码枪;c)RS485接口:标准通信接口,可连接电脑,需要通讯协议,请联系销售工程师;d)25PIN I/O接口:海瑞思专用控制数据接口;外部输出:默认是24V直流输出,输出电流最大0.5A。
seahorse能量代谢实验步骤

seahorse能量代谢实验步骤Seahorse能量代谢实验步骤引言:Seahorse能量代谢实验是一种常用的方法,用于研究细胞的能量代谢过程。
该实验通过测量细胞的氧耗和酸化速率,可以得到细胞的能量代谢状态、线粒体功能以及细胞对不同药物的敏感性等信息。
本文将详细介绍Seahorse能量代谢实验的步骤。
实验步骤:一、细胞处理1. 培养细胞:首先,需要培养所需的细胞系。
将细胞种植在含有适宜培养基的培养皿中,并在恒温恒湿的培养箱中培养细胞至达到所需的细胞数目。
2. 细胞收获:当细胞生长至适当密度时,用胰酶等方法将细胞从培养皿中收获下来,并转移到含有适宜培养基的离心管中。
3. 细胞计数:使用细胞计数仪或显微镜等设备,对收获的细胞进行计数,以确定细胞的浓度。
二、Seahorse载体处理1. 准备Seahorse载体:将Seahorse载体放入预先恢复的培养基中,并在无菌条件下进行孵育。
2. 加载细胞:将细胞悬液与Seahorse载体混合,并将混合液转移到Seahorse载体板中的各孔中。
三、实验参数设置1. 选取适当的实验条件:根据实验要求,设置Seahorse仪器的参数,如预运行时间、采样间隔、时间点数等。
2. 添加药物:根据需要,可以在实验过程中添加不同的药物,以研究细胞对药物的反应和影响。
四、Seahorse能量代谢测量1. 氧耗测量:将Seahorse载体板放入Seahorse仪器中,并进行氧耗测量。
Seahorse仪器会通过微量注射将氧浓度计和酸碱浓度计等传感器插入到载体孔中,测量细胞的氧耗情况。
2. 酸化速率测量:在氧耗测量结束后,继续进行酸化速率测量。
Seahorse仪器会通过微量注射将酸碱浓度计插入到载体孔中,测量细胞的酸化速率。
五、数据分析与结果解读1. 数据处理:将Seahorse仪器得到的原始数据导入数据处理软件中,进行数据清洗、校正和归一化等处理,以得到可靠的结果。
2. 结果解读:根据处理后的数据,分析细胞的能量代谢状态、线粒体功能以及细胞对药物的敏感性等信息,并进行结果解读。
海馬生物能量測定儀 XF24 實驗手冊

可以注意到,設定畫面中分為數個獨立的子頁 面,每個頁面分別用於紀錄實驗中各類參數的細 節,這些資訊用意在協助研究人員追蹤實驗的流 程,除了protocol此項之外其餘的內容均不會直 接影響實驗的結果,不過強烈建議使用者確實的 紀錄實驗的細節,以便後續的追蹤。
已編寫的流程一覽,執行指令時會由上向下執行,每當使用者新增指令 的時候,指令會新增在圖中藍色光棒的上方。
OCR (pmol/min) 25-50 50-100 100-200 200-400 400-800 800+
Mix Time 2 min. 2 min. 3 min. 4 min. 5 min. 5 min.
Wait 2 2 2 2 2 2 min. min. min. min. min. min.
探針校正
樣本分析
Day 2
結果輸出 最佳解決方案
實驗第一天 準備實驗分析所需要的細胞
XF生物能量測定儀專用培養盤 XF測定儀所使用的細胞培養盤與一般所使用的二 十四孔培養盤略有不同,原則上同樣具有4乘6的 格式,但是每個孔都具有類似漏斗的構造,底部 平坦的部分才是實際用於細胞培養的區域,其面 積與一般常用的九十六孔盤底面積相當。
預祝各位研究工作順利
David Li
尚博生物科技
海馬生物能量測定儀中文手冊
海馬生物能量測定儀實驗流程 貼附型細胞
Cell
Day 1
XF Analyzer
開機
訂定細胞數
分析培養基
背景校正設定 製備培養基 暖機
探針組
兩段式細胞培養 更換培養基 37 C無CO2 培養一小時
o
調整pH值
實驗流程設計
sea horse

Sea horse多功能生物能量代谢监测仪创新点:侦测技术的核心是将可以即时侦测培养环境中氧分子以及氢离子浓度变化的光学侦测器整合在可以活动的探针上。
在观测的过程中将探针贴近细胞,seahorse XF能量侦测仪可以及时观测细胞与周边培养环境交换分子的情况以了解代谢系统的变化,侦测完成之后探针会再离开细胞。
完全满足新世纪代谢侦测四不一没有的要求:不用额外的试剂、不会接触细胞,不破坏细胞结构,,易操控。
多功能生物能量代谢监测仪简介:1 世界上唯一一款无损伤实时同步侦测细胞糖酵解与线粒体功能的独步全球技术系统2 固态探针侦测技术:将可以即时侦测培养环境中之氧分子以及氢离子浓度变化的光学侦测器整合在可以活动的探针上。
在观测的过程中将探针贴近细胞,海马XF能量侦测仪可以及时观测细胞与周边培养环境交换分子的情况以了解代谢系统的变化,侦测完成之后探针会再离开细胞。
完全满足新世纪代谢侦测四不一没有的要求:不用额外的试剂、不会接触细胞,不破坏细胞结构,且没有学习门槛。
3 固态光纤传感技术:***灯激发,使用寿命长,独立24根光纤探针,便于单根探针损坏时更换,仪器维护成本低4荧光功能:高效LED光源,参考型光电二极管检测器及发射光电二极管探测器,减少光散射,提高检测数据的准确度5 检测方式:细胞种于专用24孔细胞培养板,细胞均一的贴在培养板的底部,检测过程自动形成7ul的半封闭环境,检测快速灵敏。
6 样品种类:悬浮细胞、贴附细胞、组织、分离的细胞器等7 质量保证:实时动态侦测,内设对照,真实反应细胞的生理状态,保证了实验的真实性。
8 仪器设计:整合式集成控制设计,全程触摸式操作,无杂乱的链接线,节省空间;人性化操作界面,易学易懂;与探针整合的4道自动加药槽,满足不同实验及不同领域的研究需求。
多功能生物能量代谢监测仪主要功能应用:1、Extracellular Acidification Rate (产酸率)糖酵解作用所产生的丙酮酸(pyruvate)经过乳酸脱氢酶(lactate dehydrogenase)反应产生乳酸(lactate),允许细胞在不消耗氧气的情况下快速产生ATP以满足能量需求,测量乳酸的氢离子可以说明无氧代谢的变化。
海马细胞能量代谢仪检测指标

海马细胞能量代谢仪检测指标海马细胞能量代谢仪是一种用于研究细胞代谢能力的仪器,可以测量细胞内氧气消耗和酸性代谢产物产生情况,从而评价细胞的代谢情况。
在癌症、心血管、神经系统等疾病的研究中,海马细胞能量代谢仪已被广泛应用。
下面将介绍几个主要的检测指标。
1. 氧耗率(OCR)氧耗率是海马细胞能量代谢仪中最基本的指标之一,反映的是细胞内线粒体呼吸链的功能状况。
当线粒体的功能受损时,氧耗率通常会下降。
而在一些代谢异常的疾病中,如2型糖尿病、肥胖症等,氧耗率会升高。
因此,氧耗率的测量可以提供许多疾病的相关信息。
2. 酸性代谢产物产生率(ECAR)酸性代谢产物产生率是海马细胞能量代谢仪另一个基本的指标。
它反映的是细胞的糖酵解过程中,由于乳酸的产生而导致的酸化程度。
ECAR和OCR是两个相互独立的指标,但在代谢通路受到调节时,ECAR和OCR相互影响。
例如,当细胞从呼吸状态转变为糖酵解状态时,ECAR会升高,而OCR则会下降。
因此,ECAR对研究细胞代谢的调节机制有着重要的意义。
3. 细胞质色素c释放细胞质色素c是线粒体呼吸链中的一个分子,其在线粒体不足以提供足够的ATP时会释放到细胞质内,参与细胞凋亡的过程。
因此,测量细胞质色素c释放的水平可以判断细胞的凋亡状态。
海马细胞能量代谢仪可以测量细胞质色素c释放的水平,从而用作判断细胞凋亡的一个指标。
4. 能量变化量(ATP)ATP是细胞内能量的主要来源,海马细胞能量代谢仪可以测量细胞的ATP水平。
ATP水平常常被用来评价药物对细胞的影响。
例如,在心血管疾病的研究中,海马细胞能量代谢仪可以评估药物对心肌细胞ATP水平的影响,从而更好地评价药效。
综上所述,海马细胞能量代谢仪可以提供细胞代谢情况的多种指标,这些指标可以用于评估药物治疗的效果,探究代谢异常所涉及的分子机制,并在疾病诊断和治疗中发挥重要作用。
海马(Sea horse)去甲肾上腺素(NE)-NEWA

本试剂盒只能用于科学研究,不得用于医学诊断海马(Sea horse)去甲肾上腺素(NE)ELISA检测试剂盒使用说明书检测原理试剂盒采用双抗体一步夹心法酶联免疫吸附试验(ELISA)。
往预先包被去甲肾上腺素(NE)抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。
用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的去甲肾上腺素(NE)呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD 值),计算样品浓度。
样品收集、处理及保存方法1. 血清:使用不含热原和内毒素的试管,操作过程中避免任何细胞刺激,收集血液后,3000转离心10分钟将血清和红细胞迅速小心地分离。
2. 血浆:EDTA、柠檬酸盐或肝素抗凝。
3000转离心30分钟取上清。
3. 细胞上清液:3000转离心10分钟去除颗粒和聚合物。
4. 组织匀浆:将组织加入适量生理盐水捣碎。
3000转离心10分钟取上清。
5. 保存:如果样本收集后不及时检测,请按一次用量分装,冻存于-20℃,避免反复冻融,在室温下解冻并确保样品均匀地充分解冻。
自备物品1.酶标仪(450nm)2.高精度加样器及枪头:0.5-10uL、2-20uL、20-200uL、200-1000uL3.37℃恒温箱操作注意事项1. 试剂盒保存在2-8℃,使用前室温平衡20分钟。
从冰箱取出的浓缩洗涤液会有结晶,这属于正常现象,水浴加热使结晶完全溶解后再使用。
2. 实验中不用的板条应立即放回自封袋中,密封(低温干燥)保存。
3. 浓度为0的S0号标准品即可视为阴性对照或者空白;按照说明书操作时样本已经稀释5倍,最终结果乘以5才是样本实际浓度。
4. 严格按照说明书中标明的时间、加液量及顺序进行温育操作。
5. 所有液体组分使用前充分摇匀。
试剂盒组成名称96孔配置48孔配置备注微孔酶标板12孔×8条12孔×4条无标准品0.3mL*6管0.3mL*6管无样本稀释液6mL 3mL 无检测抗体-HRP 10mL 5mL 无20×洗涤缓冲液25mL 15mL 按说明书进行稀释底物A 6mL 3mL 无底物B 6mL 3mL 无终止液6mL 3mL 无封板膜2张2张无说明书1份1份无自封袋1个1个无注:标准品(S0-S5)浓度依次为:0、7.5、15、30、60、120 ng/mL试剂的准备20×洗涤缓冲液的稀释:蒸馏水按1:20稀释,即1份的20×洗涤缓冲液加19份的蒸馏水。
赛多利斯快速水份测定仪MA35水质分析仪操作手册
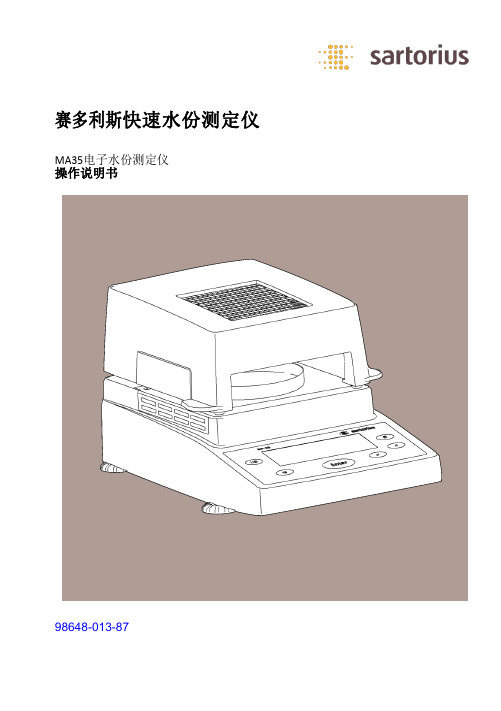
赛多利斯快速水份测定仪MA35电子水份测定仪操作说明书98648-013-87用途MA35快速水份测定仪是使用热重法来快速、可靠测定液体、粉末和固体物质的水份含量。
符号以下为该操作手册中所用符号含义:表示必须执行的步骤表示在特定环境下需要执行的步骤执行某一步骤后显示的内容表示目录中某一项内容表示危险目录2用途3注意事项和安全信息6开机6设备组件一览7提供的部件9连接电源11水平调节12开机;打开/关闭上盖13操作单元13按键14显示屏15设置参数15设置设备参数17设置加热参数21操作21举例:指定加热时间的测定操作23校准23加热单元的校准23称量系统的校准24用符合厂方要求的外校砝码进行校准和调整26接口27引脚分配表28错误代码29保养和维护31安全检查32技术规格一览表32技术参数33附件(选件)34一致性声明2注意事项和安全信息该水份仪的制造遵循了有关电器设备操作、电磁兼容性以及安全要求的欧洲委员会指令和国际条例与标准。
但是不适当的使用和操作会导致仪器损坏和(或)人员伤害。
为避免对设备造成损坏,请在使用水份仪前仔细阅读操作说明书。
把操作说明书放在安全的地方。
遵循以下说明以确保安全、无故障地操作水份仪:该水份仪仅用于测定样品的水份。
任何不适当的使用和操作会导致仪器损坏和(或)人员伤害。
不要在危险区域使用该水份仪,只能在本说明书规定的环境下使用该仪器。
如果用户在要求更高安全标准的设施和环境条件下使用电气设备,必须遵守本国有关设施适用条例中的规定。
必须由熟悉被测样品性质的专业人员操作该仪器。
确保当地电压与电源变压器上标明的额定电压一致(参看“开机”一章“连接电源”一节)。
该水份仪必须插在接地的电源插座上。
使电源完全断开的唯一办法是拔下电源变压器。
不要使电源线与水份仪的任何加热部位接触。
只能使用符合应用标准、并有接地保护的延长线。
严禁取消接地保护。
只连接赛多利斯公司生产的附件和选件,因为这些附件和选件都是为了与用户购买的赛多利斯水份仪达到最佳使用效果而设计的。
seahorse实验原理

seahorse实验原理Seahorse(海马仪器)是一种流式细胞代谢分析系统,用于评估细胞的呼吸和酸碱平衡。
它可以通过测量氧气消耗和酸碱转化的动力学来确定细胞的能量代谢状态和功能。
Seahorse仪器的工作原理包括以下几个步骤:细胞预处理、装载、测量和分析。
首先,细胞预处理。
细胞在培养基中孵育,通过调整培养条件来激活或抑制细胞代谢途径。
例如,将细胞孵育在低糖或高糖培养基中,以模拟缺氧或高糖环境。
在处理前,细胞需要进行准备,包括洗涤和预处理。
其次,装载。
经过预处理的细胞被装载到Seahorse培养底片的微孔中,通常每个孔有数千个细胞。
装载时要确保细胞均匀分布,以使测量结果准确。
接下来,测量。
Seahorse系统通过将循环的介质通过底片的微小泵浦系统,将细胞与测量区分离。
细胞所在的区域中有传感器,可以测量介质中的氧气和酸碱变化。
在测量期间,根据预设的实验方案,底板内的介质会逐渐变化。
例如,可以通过控制气体组成来调节氧气浓度,并在短时间内迅速改变实验环境。
最后,分析。
Seahorse系统通过测量介质中的氧气和酸碱变化来计算各种细胞代谢参数。
氧气消耗速率(OCR)是一个关键指标,它反映了细胞的呼吸活性。
酸化速率(ECAR)是另一个关键指标,它反映了细胞的酸碱代谢状态。
通过分析OCR和ECAR之间的关系,可以评估细胞的能量代谢状态和功能。
需要注意的是,Seahorse系统只能提供相关的代谢数据,对于潜在的生物学机制的解释需要进一步的研究和分析。
总结起来,Seahorse(海马仪器)通过测量细胞的呼吸和酸碱平衡来评估细胞的能量代谢状态和功能。
它的工作原理包括细胞预处理、装载、测量和分析。
通过分析氧气消耗速率(OCR)和酸化速率(ECAR)之间的关系,可以评估细胞的能量代谢状态和功能。
Seahorse系统为细胞研究提供了一个有力的工具,可以深入了解细胞代谢的机制。
利用SeahorseXF-96探讨不同细胞浓度和血清对线粒体功能的影响

doi:10.11659/jjssx.08E021135·基础研究·利用SeahorseXF 96探讨不同细胞浓度和血清对线粒体功能的影响李晓栩1,崔 宇1,阳一栋1,周晓英1,矫 力1,王辰元1,杨诚忠1,史 诗2,黄 缄1 (1.陆军军医大学高原军事医学系/高原生理学与病理学教研室/极端环境医学教育部重点实验室/全军高原医学重点实验室,重庆400038;2.重庆医药高等专科学校生理教研室,重庆401331)[摘 要] 目的 利用SeahorseXF 96探讨不同细胞浓度和血清对HUVEC细胞和U87细胞线粒体功能的影响。
方法 利用细胞线粒体应激试剂盒,在不同浓度的HUVEC细胞和U87细胞中加入抑制剂(寡霉素、解偶联剂、鱼藤酮和抗霉素A),根据细胞浓度分为2000组、4000组、6000组和8000组,根据有无血清和不同的解偶联剂浓度分为血清+低解偶联剂组、血清+高解偶联剂组、无血清+低解偶联剂组和无血清+高解偶联剂组。
在SeahorseXF 96中测定线粒体的耗氧率(OCR)和细胞外酸化率(ECAR),并比较HUVEC细胞和U87细胞各组线粒体的基础氧耗、质子漏、最大呼吸能力、非线粒体的氧耗、储备的呼吸能力、三磷酸腺苷(ATP)生成能力、线粒体呼吸潜力和偶联效率;比较HUVEC细胞和U87细胞之间上述指标的差异;观察血清和解偶联剂浓度对HUVEC细胞线粒体功能的影响。
结果 在HUVEC细胞和U87细胞中,2000组OCR显著低于4000组、6000组和8000组(P<0.01);2000组的ECAR显著低于4000组(P<0.01),4000组显著低于6000组和8000组(P<0.01)。
在HUVEC细胞中,与2000组比较,6000组和8000组的基础氧耗、储备的呼吸能力、ATP生成能力和最大呼吸能力增强(P<0.05),8000组非线粒体的氧耗和质子漏增强(P<0.05);在U87细胞中,与2000组比较,6000组和8000组的基础氧耗、非线粒体的氧耗和最大呼吸能力增强(P<0.05),8000组ATP生成能力、储备的呼吸能力和质子漏增强(P<0.05);HUVEC细胞和U87细胞各组间线粒体的偶联效率和线粒体呼吸潜力比较差异均无统计学意义(P>0.05)。
海马能量代谢测试流程

海马能量代谢测试流程英文回答:The process of conducting a seahorse energy metabolism test involves several steps. First, the seahorse is placed in a specially designed respirometry chamber, which is a closed system that allows for the measurement of oxygen consumption. The chamber is equipped with sensors to monitor the oxygen levels inside.Once the seahorse is settled in the chamber, the next step is to establish a baseline oxygen consumption rate. This is done by measuring the oxygen levels for a certain period of time while the seahorse is at rest. This baseline measurement provides a reference point for comparison during subsequent stages of the test.After establishing the baseline, the seahorse is then subjected to physical activity, such as swimming or hunting for food. The oxygen consumption is continuously monitoredduring this active phase. This allows researchers to determine the metabolic rate of the seahorse during different levels of activity.The final step of the test involves analyzing the data collected during the rest and active phases. By comparing the oxygen consumption rates during these two phases, researchers can gain insights into the energy expenditure and metabolic efficiency of the seahorse. This information can be used to study the impact of various factors, such as temperature or diet, on the seahorse's energy metabolism.In conclusion, the process of conducting a seahorse energy metabolism test involves placing the seahorse in a respirometry chamber, establishing a baseline oxygen consumption rate, subjecting the seahorse to physical activity, and analyzing the data collected. This test provides valuable information about the seahorse's energy expenditure and metabolic efficiency.中文回答:海马能量代谢测试的流程包括几个步骤。
S220_中文

46
4 目录
1 序言
感谢您购买梅特勒-托利多公司的仪表。SevenCompact 系列是新一代的台式仪表,操作更 简单,界面更友好,以下卓越特性令测量结果更可靠并确保更佳的数据安全性: ● 新的 ISM® (智能电极管理) 技术:仪表可自动识别电极,并将最近一组校准数据从
电极芯片传输到仪表。最近的五条校准数据以及出厂数据也将存储在电极芯片上。可 查看、传输和打印这些数据。ISM® 技术使数据更安全,减少错误。 ● 4.3 英寸大屏幕上的多国语言图形用户界面,显示直观的菜单向导,使操作更加便 捷。 ● GLP 和常规模式满足各类操作人员的需求:在常规模式中,可防止删除数据,也可防 止更改某些设置 (如测量设置) 而影响测量结果的可靠性。这为常规的日常工作提供 了额外的安全保障。建议技术熟练的操作人员采用 GLP 模式,充分利用仪表完整强 大的功能。 该仪表支持支持现代实验室数据采集和归档过程所有阶段的工作流程: ● 电极支架可单手操作,垂直上下移动,将电极置于理想位置,以获得最佳的测量性 能。这使得测量更快速,减少翻倒样品容器和/或损坏电极测量端的危险! ● 只需单次按键即可操作:按 READ 键启动测量,按 CAL 启动校准。简单快捷! ● 在标准视图和超级视图之间轻松切换。标准视图中,显示屏上显示所有测量参数和 ID,为您提供即时完整的概览。在超级视图中,仅以大数字显示最重要的信息,例如 测量值和温度等。这让您能够将注意力完全放在测量上,不会被无关信息分心。 ● 在测量前或测量期间使用模式软按键轻松切换各种测量参数。 ● 多种数据归档选择:打印数据、导出数据到 U 盘或使用 LabX direct 软件将数据传输 至电脑! ● 多种数据输入过程:直接在仪表上输入样品/用户和电极 ID,或者使用条形码扫描仪 或 USB 键盘高效率输入。 梅特勒-托利多公司致力于为您提供最高品质的仪表,我们尽我们所能为您提供支持,最 大可能地延长仪表的使用寿命。 ● IP54 防护等级 – 防水防尘保护:根据设计,我们仪表在其外壳上和连接处能够防止 水滴的渗漏。这不仅提供额外的保护,还允许用湿布方便地对仪表进行清洁。 ● 橡胶密封盖和保护罩提供额外的防尘和防水保护。在不使用时,把橡胶密封盖安装到 仪表接口上并使用透明保护罩盖住仪表即可。 我们的 SevenCompact 系列 pH/离子浓度测量仪和电导率仪表使您的测试充满乐趣,而且 数据可靠!
海马用户指南说明书

目錄XF Assay Roadmap (3)1.確認海馬的使用機型 (4)2.購買正確的海馬耗材 (5)3.選擇您的加藥試驗 (6)a.Mito Stress Testb.Glycolysis Stress Testc.Fatty Acid Oxidationplex protein Activity & Substrate Utilization4.準備上樣用的細胞 (10)5.準備上樣用的培養基 (16)6.活化螢光探針組 (19)Day Before AssayDay of Assay7.更換上機用培養基 (20)8.準備上機用的藥物 (22)9.將藥物放置在注藥槽內 (25)10.上機與軟體操作 (27)1.確認您使用的海馬機型XFe24XFe96XFp2. 購買正確的海馬耗材FluxPak Series :內含細胞培養盤,螢光探針 & 校正液XF24:XF24 FluxPak XF96:XF96 FluxPak XFe24:XFe24 FluxPakXFe96:XFe96 FluxPakXFp :XFp FluxPakXFp FluxPaksXFpXF FluxPaksXF24 Islet FluxPak 適用XF24 & XFe24 only 分析活體組織與小型生物樣本 XFe96 Spheroid FluxPak適用XFe96 only 分析單一sphere 樣本3.選擇您的加藥試驗A.Mito Stress Test:完整評估粒線體功能的加藥測試Basal Respiration:粒線體於基礎狀態時的耗氧效率ATP Production:評估粒線體有多少氧氣參與產生ATPProton Leak:反應粒線體雙層膜的完整性,類似傳統的MMPMaximal Respiration:評估粒線體的極限運作效率Spare Capacity:評估粒線體所保留的潛力,也就是遇到變化可調整的彈性Non-Mito Respiration:粒線體以外的耗氧,若細胞內有許多ROS其值會增加對應藥物組:XF cell mito stress test kit適用XF24, XF96, XFe24 & XFe96XFp cell mito stress test kit適用XFp only皆內含Oligomycin, FCCP(須測試最佳濃度),Rotenone/Antimycin A(依使用方式, 可進行6~10盤實驗)B.Glycolysis Stress Test:評估糖解作用的極限運作能力Glycolysis:評估樣本從no glucose到瞬間glucose濃度飽和時的運作效率Glycolytic Capacity:評估當糖解作用為樣本唯一ATP來源時的運作效率Glycolytic Reserve:反應糖解作用代償粒線體能量缺口的狀況Non-glycolytic Acidification:分析糖解作用以外的產酸背景值對應藥物組:XF glycolysis stress test kit適用XF24, XF96, XFe24 & XFe96XFp glycolysis stress test kit適用XFp only皆內含glucose, oligomcycin & 2-DG(可進行6盤實驗)C.Fatty Acid Oxidation:評估脂肪代謝能力此實驗以Mito Stress Test為基礎,配合BSA-conjugated Palmitate和抑制劑etomoxir來評估細胞內源性脂肪代謝的比例, 以及可承受外來脂肪的代謝極限的程度是多少。
安捷伦 Seahorse XF 底物氧化压力测试试剂盒说明书

一种通过底物氧化来评估线粒体代谢的创新方法安捷伦 Seahorse 提供了一套强大的新分析方法,通过评估活细胞中耗氧率 (OCR) 的变化来测定细胞底物氧化。
这些快速的非破坏性方法可以研究细胞如何氧化 3 种主要的线粒体底物:长链脂肪酸 (LCFA)、葡萄糖/丙酮酸和/或谷氨酰胺,从而揭示通路的特异性信息。
这些分析方法提供了直观的功能参数,这些参数建立在广受认可的 Seahorse XF 细胞线粒体压力测试基础上,无论是在基础条件下还是在响应升高的底物需求时,都非常适用于评估细胞的底物需求。
利用标准化的分析方案、经验证的试剂和基于云的 Seahorse Analytics ,您可以开始进行测试,并快速获得条理清晰的出色结果。
深入揭示影响细胞命运、功能和适应性的因素LCFA 、葡萄糖/丙酮酸和谷氨酰胺是线粒体代谢的 3 种主要底物。
许多领域(如癌症、免疫学、干细胞生物学)的研究人员已经证明了这些底物的氧化如何对细胞命运、功能和适应性产生深远影响。
许多发现不仅提供了新的生物学见解,而且揭示了用于干预和开发成功疗法的新方法。
Seahorse 底物氧化压力测试试剂盒能够快速评估活细胞中的底物氧化,有助于研究细胞如何改变或转变特定底物的氧化来执行激活、增殖和分化等重要的细胞功能,细胞在微环境中的生存,以及对遗传或药物干预的响应。
了解更多信息:/chem/discoverXF安捷伦 Seahorse XF 底物氧化压力测试– 揭示细胞对线粒体底物(LCFA 、葡萄糖/丙酮酸和/或谷氨酰胺)的依赖性– 了解哪些底物与特定的细胞功能和/或表型相关– 借助用于测定后分析的集成数据处理工具轻松实现测定– 经优化的一次性试剂可简化工作流程并降低分析复杂性了解更多信息/chem/discoverXF 全球技术支持********************************安捷伦客户服务中心免费专线:800-820-3278400-820-3278(手机用户)仅限研究使用。
能量代谢车操作流程SOP

在启动Express的电源之前,确保所有电缆线路都接通,电源线正确插入电源插座。找出位于仪器背面,电源接口上方的系统电源开关,并打开。
2.建立受试者信息
Expres显示界面科通过针形尖笔或鼠标、键盘来进行运作。(请参看图2-1)
图2-1 主界面
3.设备预热30分钟以上。
4.呼吸校准
该校准界面提供了校准指南以确保流量结果的变化程度。校准界面图标可控制校准功能和打印校准报告来保存详细的系统历史记录。(请参看图4-1)
4.6校准结果以界面顶部的数据表格展现出来。(请参看图4-3)
图4-3 校准结果
5.自动气体校准
自动气体校准能测量信号和自动调整获得并抵消容纳信号数值,从而校准分析器。
自动气体校准并不要求校准气体。
黄色对话框(见图5-1下方)提示当下测试的数据。
界面允许手动进入气体校准较早前的变量操作。
图 5-1
图5-2
6.受试者连接
6.1测试前60min内受试者处于静息状态。
6.2患者线路包括:直接连接呼吸测定器和呼吸脐带式管线。(请参看图6-1)5.3A中间部位有个孔和B部件脐带管连接。锥底有一个蜂窝圆孔面向病人,在阻止preVentpneumotach有一个标签突出外向或缩进缺口(A),该标贴的脐带管夹子选项应向外凸出(B).当两件部件连接,标签缺口A调整与脐带管夹同一侧.连接两个部件后,preVentpneumotach和脐带管平齐调整到金属探针孔.使这二个部件紧密配合扣在一起.
图4-1 校准界面
4.1把流量传感器直接连接安装到夹子上。(请参看图4-2)
4.2把以上提到的流量传感配置插入圆形转接器的橡胶耦合器中,将其与注射器连接起来
4.3在工具菜单中按下注射器的图标 ,启动流量校准操作。
Seahorse海马代谢仪使用说明

3.放入无CO2的培养箱,37℃过夜(使校准液能浸没在sensors 中;保证培养箱湿度,防止干燥)
培养细胞
1.100ul 培 养 液 收 集 细 胞 , 按 最 佳 细 胞 密度重悬细胞(10,000 - 80,000个细胞/ 孔)。 2.每孔接种100 μL细胞悬液,背景校正 孔(A1, B4, C3, D6)不接种细胞。将 细胞板室温静置在超净台上1 h。
Thank you
此课件下载可自行编辑修改,供参考! 感谢您的支持,我们努力做得更好!
特点:通过特殊的细胞培养微孔板设计,在测量时临时形成 的约2ul微环境中,利用无创的专利光学传感器同步地实时探 测溶解氧(OCR)和细胞外酸化率(ECAR)变化,从而快速 了解细胞内两大能量转换途径(线粒体的有氧代谢和糖酵解) 的能量代谢状态。
仪器外观
Hydro Booster
Sensor Cartridge
Cartridge Lid
耗材
自动药物注射端口 启用实时功能分析
Cell Mito Stress Test Assay Kits
实验前一天
水化探针
1.在Utility Plate每孔中加入1ml校准液
(Seahorse XF 校准液用于溶解和校准 XF 小柱,并包含 FluxPak)
2.将Hydro Booster放在Utility Plate上,Sensor Cartridge放在最上面
2.按以下表格,用检测液将FCCP稀释为不同的浓度
3.取300 μL 50 μM rotenone/antimycin A母 液至2700 μL检测液中。
加药
从无CO2培养箱中取出已水化的测试板。按以下说明, 将药物分别加到每个加药孔里。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
配制XF细胞线粒体压力测试盒中药物 母液
检测液体积 Oligomycin FCCP Rotenone/Ant imycin A 630 μL 720 μL 540 μL
终浓度 100 μM 100 μM 50 μM
将药物稀释为10×浓度,用于加到加药孔中
1.按左边表格,用3 mL 检测液将 oligomycin稀释为所需浓度(或使 用大多数细胞都适用的1 μM)。
3.放入无CO2的培养箱,37℃过夜(使校准液能浸没在sensors 中;保证培养箱湿度,防止干燥)
培养细胞
1.100ul 培养液收集细胞,按最佳细胞 密度重悬细胞(10,000 - 80,000个细胞/ 孔)。 2.每孔接种100 μL细胞悬液,背景校正 孔(A1, B4, C3, D6)不接种细胞。将 细胞板室温静置在超净台上1 h。
实验当天 准备XF检测液
一个培养板 手动加液需100ml,仪器加液需 200ml
1.使用NaOH调节pH值至7.35±0.05 2.检测液中所需要添加的底物及浓度取决于细 胞类型和实验设计,或者与生长培养基保持一 致。 3.37℃放置备用。
NO sodium bicarbonate Low phenol red (3 mg/L)
Review Run-----Plate Information-----Well Volume-----Plate by----Start Run,放入测试板。当软件出现校准完成提示时,将Utility板 换为细胞培养板。点击Continue。仪器完成OCR值测定,数据分析。
寡霉素:ATP合酶抑制剂; FCCP:解偶联剂 ; 抗霉素A/鱼藤酮:呼吸链抑制剂;
How do I know whether the cell density is good?
• Basal OCR range: 20-160 pmol/min • Maximum recommended OCR: 400 pmol/min • ECAR: 5-100 mpH/min
优势特点:
Cartridge Lid
耗材
自动药物注射端口 启用实时功能分析
实验前一天
水化探针
1.Байду номын сангаасUtility Plate每孔中加入1ml校准液
(Seahorse XF 校准液用于溶解和校准 XF 小柱,并包含 FluxPak)
2.将Hydro Booster放在Utility Plate上,Sensor Cartridge放在最上面
3.将细胞板放置在细胞培养箱中让细胞 贴壁(快1h;慢5-6h),在显微镜下观 察细胞是否贴壁。
4.细胞贴壁后,每孔加入150 μL生长培 养液,总体积为250 μL。加液时,沿壁 轻轻加入,避免吹起刚贴壁的细胞。 5.将细胞放置在细胞培养箱中过夜培养。 在显微镜下观察细胞的生长状态。
预热仪器
打开Seahorse仪器和电脑,并打开软件,使仪器升温至37 ℃,过夜预热。
处理细胞
1.将细胞培养板从CO2培养箱中取出,并记录时间。 2.在显微镜下观察细胞(无污染,细胞均匀状态好,贴壁 未脱落,背景矫正孔无细胞。) 3.用XF细胞线粒体压力测试检测液洗细胞: a.吸去生长培养液至每孔剩余50 μL。 b.用1 mL XF检测液洗细胞两次。 c.每孔加入检测液至终体积为500 μL/孔。 4.在显微镜下观察细胞,确认细胞在换液过程中没有脱落。 5.将细胞板置于37°C无CO2培养箱中1 h。
采用超敏感的生物传感器和非接触式设计,真正实现检
测细胞零损伤; 实时检测细胞有氧呼吸、糖酵解的能量代谢情况,即时 反应细胞生理状态; 同步检测细胞的耗氧量和产酸率(pH值变化),数据结 果更加全面; 实现同步检测96/24个细胞样品,通量高,速度快; 自动化检测流程、自动化控制添加多达四种药物,操作 方便高效。
填写相关信息:Name ,Cell Type, Seeding density(Cell Type2,3, 4 同样),之后点击“Generate Group”查看
“Plate Map”设置颜色
默认的 Mix-Wait-Measure时间为3 min-2 min-3 min。通常在 加药前测量3次基础值;每次加药后再进行3次测量。 “Injection”多少种药点多少次
汇报人: 学号:
背景
生物能量学(Bioenergetic)
老化 各类药 物毒理 机制 神经退 化性疾 病
探讨的是生物将氧份 转为能量并借此推动生 命的过程。不同的细胞 依据其生理特性及健康 状况,能量供需系统亦 有所不同。
癌症
能量 代谢
糖尿病
心血管 疾病
肥胖
简介
美国海马生物科学利用细胞外流量(Extracellular Flux, XF)检测专利技术,发明了业界第一款海马细胞能量代谢 实 时 测 定 仪 / 生 物 能 量 代 谢 测 定 仪 ( Seahorse XF Extracellular Flux Analyzers),是进行细胞代谢分析、氧 呼吸测定、药物代谢分析、线粒体有氧代谢和糖酵解等功 能的最佳分析工具。
特点:通过特殊的细胞培养微孔板设计,在测量时临时形
成的约2ul微环境中,利用无创的专利光学传感器同步地实 时探测溶解氧(OCR)和细胞外酸化率(ECAR)变化,从 而快速了解细胞内两大能量转换途径(线粒体的有氧代谢 和糖酵解)的能量代谢状态。
仪器外观
Hydro Booster
Sensor Cartridge
选择模板(提前预热)
Injection strategies--add---strategy 1----A---add----mito stress test1
B C同样
Pretreatment----add-----不用做修改
Assay Media-----Mito Stress test medium
2.按以下表格,用检测液将FCCP稀释为不同的浓度
3.取300 μL 50 μM rotenone/antimycin A母 液至2700 μL检测液中。
加药
从无CO2培养箱中取出已水化的测试板。按以下说明,
将药物分别加到每个加药孔里。 加药孔A:细胞孔内oligomycin终浓度为1 μM。每个A 孔加入56 μL 10×药物。 加药孔B:测定浓度的FCCP。将62 μL 10×的不同浓 度药物加入到B孔里。 加药孔C:细胞孔内Rot/AA终浓度为0.5 μM。每个C孔 加入69 μL 10×药物。
