2018年中国化学奥林匹克福建省赛区预赛试题及评分标准
中国化学奥林匹克福建省赛区预赛试卷

20XX年中国化学奥林匹克福建省赛区预赛试卷(20XX年4月24日8:30-11:30共计3小时)●竞赛时间为3小时,迟到超过半小时者不能进考场,开始考试1小时不得离场●试卷装订成册,不得拆散。
所有解答必须卸载答题框内,使用铅笔书写的解答无效。
草稿纸在最后3页,不得携带其它任何纸张入场●姓名、性别、学校、年级、准考证号等必修填写在卷首左侧指定的位置,否则视同废卷。
●允许使用非编程计算器和直尺等文具。
第1题(10分)G是由X、YB两种元素形成的XY2型化合物1-1 若高温下将G与焦炭发生反应,则可以得到一种半导体型材料,请写出G的化学式1-2 取少许G容易置于试管中,滴入KSCN溶液,无明显现象。
另取等量的G溶液于另一试管,先加入足量的氯水,再加入适量的CCl4,振荡,静置,下层溶液呈紫红色。
往上层溶液中加入KSCN溶液呈红色。
请写出G溶液中所含的金属阳离子及G与足量的氯水反应的离子反应方程式。
1-3若G是离子化合物,其阴阳离子均含有18电子,且阴、阳离子个数之比为1:1。
请写出该阴离子的电子式,若1molG与足量的水充分反应,则转移电子的物质的量为多少mol?1-4若X、Y是同主族元素,G溶解于水形成一种二元弱酸1-4-1则Y在元素周期表的位置为:1-4-2如果常温下G为气体,所形成的弱酸溶液中含X元素的某微粒的物质的量分数与溶液PH值的关系如右图所示,请写出该微粒的化学式。
1-4-3该二元弱酸的一级电离常数为,则P的值是多少?1-4-4如果X元素的周期序数为Y的两倍,请写出G的水溶液被H2O2氧化的化学反应方程式。
1-4-3第2题(10分)化合物M(分子式为C11H21BrO2)是有机合成的中间体,实验室制备的方法如下:10-十一碳烯酸溶于己烷,加入少量的过氧化二苯甲酰,通入干燥的溴化氢直至饱和并有大量HBr从己烷中溢出即可以停止反应,冰浴冷却后抽滤即得化合物M。
反应所用的HBr可由液溴和四氢化萘在少量的铁粉催化下制取。
高中化学竞赛试题-2018年福建省高中学生化学竞赛(预)试题及答案 最新

2018年福建省高中学生化学竞赛(预赛)试题答案(2018年18月28日8:00-11:00共计3小时)一、10 分(1)于酸性溶液中混合等物质的量的KBrO3和KI,生成哪些氧化还原产物,它们的物质量的比是多少?(2)用漂白粉漂白物料时,常采用以下步骤:将物料浸入漂白粉溶液,然后暴露在空气中;将物料浸在稀盐酸中;将物料浸在大苏打溶液中,最后取出放在空气中干燥;试说明每二、(8分)设计以银币(约含50%Cu)为原料制备硝酸银和胆矾的简单步骤并写出有关三、(12分)氮、磷、铋都是V A族元素,它们都可以形成氯化物,例如:NCl3、PCl3、PCl5和BiCl3。
试问:(1) 为什么不存在NCl5及BiCl5而有PCl5?(2) 请写出NCl3、PCl3、BiCl3水解反应反应方程式。
(3)热电材料Bi2Te(3-x) 的性质在x由正值变负值时会发生急剧的变化,欲使x由+0.01变到-0.01,应在5.000 g Bi2Te(3-x) 中加碲多少克?四、(10分)水中Ca2+、Mg2+能形成“水垢”使水质变得不适于家庭和工业使用,回答下列问题:(1)石灰-苏打法被用来大规模软化生活用水,写出配平的离子反应方程式。
(2)另一种软化硬水的方法是离子交换法,交换过程是在装有离子交换树脂的交换柱或交换床中完成的。
A.用方程式表示离子交换过程B.如何对树脂进行再生?C.离子交换水可作为饮用水吗?为什么?(3)工业上常用格氏盐(某种磷酸盐)作为锅炉用水的软化剂,为什么?画出格氏盐的结构示意图以及格氏盐与钙离子结合后形成化合物的结构示意图。
C. 离子交换法软化硬水虽然解决了Ca 2+、Mg 2+等离子带来的问题, 但却不是理想的饮用水。
(1分) 由于水中Na +离子浓度升高, 因而特别不适于患高血压病的人群饮用。
(1分)(3) 格氏盐能同Ca 2+、Mg 2+等离子配位生成可溶性配合物,(1分)阻止水垢形成机理是晶体表面被吸附的多阴离子遮盖,使晶体生长变得缓慢,晶体严重变形,而难以聚结成为水垢,因此它可作为锅炉用水的软化剂。
第18届中国化学奥林匹克(初赛)试题及答案

中国化学会2004年全国高中学生化学竞赛(省级赛区)试题答案(2004年9月12日 9:00 - 12:00共计3小时) 题 号1 2 3 4 5678910111213总 满分 4 4 6 15 769868999 100 得分评卷人z 竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
z 试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
z 姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
z 允许使用非编程计算器以及直尺等文具。
第1题(4分) 2004年2月2日,俄国杜布纳实验室宣布用核反应得到了两种新元素X 和Y 。
X 是用高能48Ca 撞击靶得到的。
经过100微秒,X 发生α-衰变,得到Y 。
然后Y 连续发生4次α-衰变,转变为质量数为268的第105号元素Db 的同位素。
以X 和Y 的原子序数为新元素的代号(左上角标注该核素的质量数),写出上述合成新元素X 和Y 的核反应方程式。
Am 24395答案: +Ca = Am 243954820288115+3n (2分)不写3n 不得分。
答291115不得分。
288115 = 284113 + 4He (2分) 质量数错误不得分。
4He 也可用符号α。
(答下式不计分:284113-44He = 268105或268105Db )(蓝色为答案,红色为注释,注释语不计分,下同)第2题(4分)2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮, 这种高聚氮的N-N 键的键能为160 kJ/mol (N 2的键能为942 kJ/mol),晶体结构如图所示。
在这种晶体中,每个氮原子的配位数为 ;按键型分类时,属于 晶体。
这种固体的可能潜在应用是 ,这是因为: 。
答案: 3 原子晶体炸药(或高能材料)高聚氮分解成N2释放大量能量。
福建省泉州市南安第一中学2017-2018学年高一上学期化学竞赛试题 Word版含答案

2017-2018学年高一化学竞赛相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 Mn-55 Fe-56 Cu-64 I-127一、选择题(本大题共16小题,每小题3分,共48分。
每小题只有1个选项符合题意) 1.下列化学用语书写正确的是 ( )A .中子数为10的氧原子:108O 错误!未找到引用源。
B .亚硫酸铵的化学式:(NH 3) 2SO 3C .碳酸钾的电离方程式:K 2+1 3-2 D .硫离子的结构示意图为:2.质量相同的两种气体A 、B ,在同温、同压下,A 的分子数比B 多。
下列说法不正确...的( ) A .A 占的体积比B 大 B .A 的物质的量比B 大 C .A 的密度比B 小 D .A 的摩尔质量比B 大 3.下列有关海带中提取碘实验的说法,错误的是( )A.海带提碘的过程,大体可划分为灼烧、氧化、分离、纯化等步骤B.海带提碘各过程均发生氧化还原反应C.检验获得的碘可选用淀粉溶液D.碘的纯化是利用碘的物理性质4.由一种阳离子与两种酸根离子组成的盐称为混盐。
混盐CaOCl 2在酸性溶液中可以发生反应产生Cl 2,下列关于混盐CaOCl 2的有关判断不正确的是(N A 为阿伏加德罗常数) ( ) A .该混盐在酸性溶液中产生1mol Cl 2时转移的电子数为N A B .该混盐的水溶液具有漂白性C .该混盐中氯元素的化合价为+1和-1价D .该混盐具有较强的还原性 5.下列说法正确的是( )A.实验室用MnO 2与稀盐酸,在加热的条件下反应制取氯气B.实验室通常是用电解饱和食盐水的方法制取少量的氯气C.氯气是一种黄绿色的气体,有毒,尾气可用NaOH溶液来吸收D.实验室收集氯气可用向下排空气法收集6.只用一种试剂就能区别NaCl、NaBr、NaI 3种溶液,该试剂可用( )①AgNO3溶液②氯水③溴水④碘水A.①②B.①③C.②③D.②④7.将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。
第二十八届中国化学奥林匹克福建赛区竞赛
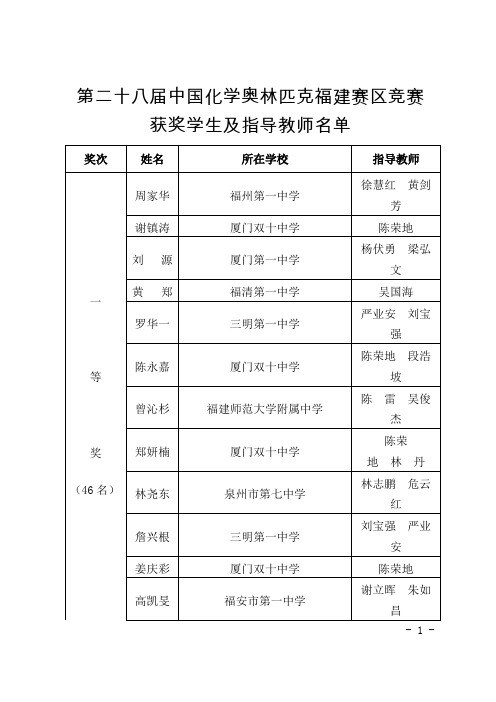
厦门双十中学
陈荣地林丹
林尧东
泉州市第七中学
林志鹏危云红
詹兴根
三明第一中学
刘宝强严业安
姜庆彩
厦门双十中学
陈荣地
高凯旻
福安市第一中学
谢立晖朱如昌
李嘉豪
福建师范大学附属中学
陈雷吴俊杰
吴泽宏
安溪第一中学
林建雄陈海芳
卢薏
武平县第一中学
饶永祥
徐浩义
厦门双十中学
阙锦南冯岩
王泽杰
厦门双十中学
陈荣地
吕向
厦门双十中学
黄冠群
上杭县第一中学
赖增荣
三
等
奖
(60名)
陈涛
永安市第一中学
陈志勇尤华生
陈潇扬
福建师范大学附属中学
陈雷吴俊杰
赵新湧
福州第三中学
卢晓平
洪润辰
同安第一中学
罗德炳李婷婷
郑家锋
仙游县私立第一中学
陈国良
邓洲
三明第一中学
严业安刘宝强
谢国全
南平第一中学
吴长才朱四妹
倪玮铭
福州第三中学
卢晓平
冯锐
厦门第一中学
赖德贵
谢泽阳
吕尚普
林欣颖
安溪第一中学
黄福恭唐炳坤
杨元鑫
泉州市第七中学
林志鹏危云红
康韶宇
龙海第一中学
洪耀辉
杨钧麟
厦门第一中学
杨伏勇梁弘文
蒋扬天
厦门第一中学
杨伏勇朱磊
许祺航
龙海第一中学
洪耀辉
陈演鹏
厦门双十中学
陈荣地
刘启明
厦门外国语学校
朱加贤盛景云
第中国化学奥林匹克初赛试题及评分标准

第 32 届中国化学奥林匹克(初赛)试题(2018 年 9 月 2 日 9:00 ~ 12:00)·把试卷(背面朝上)放在桌面上,立即起立撤离考场。
·试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
·姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
·允许使用非编程计算器以及直尺等文具。
第 1 题(8 分)根据所给条件按照要求书写化学反应方程式(要求系数为最简整数比)。
42-1 195 K,三氧化二磷在二氯甲烷中与臭氧反应得到P4O18。
画出P4O18分子的结构示意图。
2-2 CH2SF4是一种极性溶剂,其分子几何构型符合价层电子对互斥(VSEPR)模型。
画出属三元共聚物,由乙烯、丙烯及第三单体经溶液共聚而成。
2-3-1 EPDM 具有优良的耐紫外光、耐臭氧、耐腐蚀等性能。
写出下列分子中不可用于制备EPDM 的第三单体(可能多选,答案中含错误选项不得分)。
2-3-2 合成高分子主要分为塑料、纤维和橡胶三大类,下列高分子中与 EPDM 同为橡胶的是:为纪念门捷列夫发现元素周期律 150 周年,国际纯粹和应用化学联合会将 2019 年设为“国际化学元素周期表年”。
门捷列夫预言了多种当时未知的元素,A 即为其中之一。
将含元素A 的硫化物矿在N2气氛中800℃处理,分解产物中有A 的硫化物B;随后升温至825℃并向体系中通入氨气,得到红色化合物C,C 溶于发烟硝酸得白色沉淀D。
经过滤洗涤,D 在 600℃与 COCl2反应,产物冷却后得液体 E,E 遇水生成 D,在E的 6mol·L-1盐酸溶液中通入 H2S 得沉淀 B;将D溶于NaOH 溶液,用硝酸调 H+浓度至约为 0.3 mol·L-1,加入钼酸铵溶液,常温下反应产生橙黄色沉淀F,F 与十二钼磷酸结构等同;将 D 加入H3PO2和H3PO3的混合溶液可得黄绿色的亚磷酸盐沉淀G,G 在碱性溶液中转化为黄色沉淀H,H放置时脱水变为 I, I 也可由D和A 的单质在高温下反应产生, D 变为 I 失重 15.3%。
2018年中国化学奥林匹克(初赛)试题解析

A. Ge B. GeS2 C. GeS
D. GeO2
G. GeHPO3 H. Ge(OH)2
选 CE
解析:C 和 E 中有共轭双键存在,由于共轭 π 键的反应活性较高,且易受到紫外辐射使得电子 跃迁至 π*轨道,所以 C 和 E 都是不耐臭氧,不耐紫外光的。
2-3-2 合成高分子主要材料分为塑料、纤维和橡胶三大类,下列高分子中与 EPDM 同为橡胶的 是:
F 聚乙烯
Hale Waihona Puke G 聚丙烯氰H 反式聚异戊二烯
I 聚异丁烯
选 H、I
解析:对于高中基础高分子化学常识的考察
第 3 题(12 分)
为纪念门捷列夫发现元素周期表 150 周年,国际纯粹和应用化学联合会将 2019 年设为“国 际化学元素周期表年”。门捷列夫预言了多种当时未知的元素,A 即为其中一种。
将含元素 A 的硫化物矿在 N2 气氛中 800oC 处理,分解产物中有 A 的硫化物 B;随后升温 至 825oC 并向体系中同入氨气,得到红色化合物 C,C 溶于发烟硝酸得到白色沉淀 D。经过滤 洗涤,D 在 600oC 与 CoCl2 反应,产物冷却后得到液体 E,E 遇水生成 D,在 E 的 6 mol·L-1 盐 酸溶液中通入 H2S 得到沉淀 B;将 D 溶于 NaOH 溶液,用硝酸调节 H+浓度至约 0.3 mol·L-1,
2018年第32届中国化学奥林匹克(初赛)试题及答案

2018年第32届中国化学奥林匹克(初赛)试题答案与解析 第1题(8分)根据所给条件按照要求书写化学反应方程式(要求系数为最简整数比。
1-1 氮化硅可用作 LED 的基质材料,它可通过等离子法用 SiH 4 与氨气反应制得。
1-2 将擦亮的铜片投入装有足量的浓硫酸的大试管中,微热片刻,有固体析出但无气体产生, 固体为 Cu 2S 和另一种白色物质的混合物。
1-3 在 50o C 水溶液中,单质碲与过量 NaBH 4 反应制备碲氢化钠,反应过程中析出硼砂[Na 2B 4O 5(OH)4·8H 2O] 1-4 天然气的无机成因十分诱人。
据称,地幔主成分之一的橄榄石与水和二氧化碳反应,可生成甲烷。
橄榄石以 Mg 2SiO 4 和 Fe 2SiO 4 表示,反应后变成蛇纹石[Mg 3Si 2O 5(OH)4]和磁铁矿。
第2题(8分)2-1 195K ,三氧化二磷在二氯甲烷中与臭氧反应生成 P 4O 18,画出 P 4O 18 分子的结构示意图。
2-2 CH 2SF 4 是一种极性溶剂,其分子几何构型符合价层电子对互斥理论(VSEPR)模型。
画出CH 2SF 4 的分子结构示意图(体现合理的成键及角度关系)。
2-3 2018 年足球世界比赛用球使用了生物基元三元乙丙橡胶(EPDM)产品 Keltan Eco 。
EPDM 属三元共聚物,由乙烯、丙烯、及第三单体经溶液共聚而成。
2-3-1 EPDM 具有优良的耐紫外光、耐臭氧、耐腐蚀等性能。
写出下列分子中不可用于制备 EPDM 的第三单体(可能多选,答案中含错误选项不得分) 2-3-2 合成高分子主要材料分为塑料、纤维和橡胶三大类,下列高分子中与 EPDM 同为橡胶的是: F 聚乙烯 G 聚丙烯氰 H 反式聚异戊二烯 I 聚异丁烯 第3题(12分)为纪念门捷列夫发现元素周期表 150 周年,国际纯粹和应用化学联合会将 2019 年设为“国际化学元素周期表年”。
2018年高中化学奥林匹克预赛(福建)试题、参考答案、评分标准
2018年中国化学奥林匹克福建省赛区预赛试题(2018年4月22日8:30-11:30共计3小时)题号 1 2 3 4 5 6 7 8 9 1011 12 总分满分值 10 1010 10 10101010101010 10 120 得分评卷人◆竞赛时间3小时,迟到超过半小时者不能进考场,开始考试后1小时内不得离场。
试卷装订成册,不得拆散。
所有解答必须写在答题框内,使用铅笔书写的解答无效,草稿纸◆在最后2页,不得携带任何其他纸张入场。
◆姓名、性别、学校、年级、准考证号等必须填写在首页左侧指定位置,否则视同废卷。
◆允许使用非编程计算器和直尺等文具。
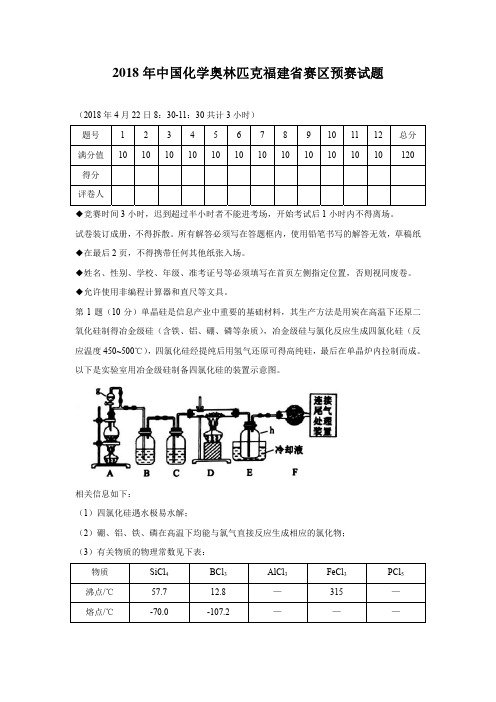
第1题(10分)单晶硅是信息产业中重要的基础材料,其生产方法是用炭在高温下还原二氧化硅制得冶金级硅(含铁、铝、硼、磷等杂质),冶金级硅与氯化反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅,最后在单晶炉内拉制而成。
以下是实验室用冶金级硅制备四氯化硅的装置示意图。
相关信息如下:(1)四氯化硅遇水极易水解;(2)硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;(3)有关物质的物理常数见下表:物质 SiCl4 BCl3 AlCl3 FeCl3 PCl5沸点/℃ 57.7 12.8 — 315 —熔点/℃ -70.0 -107.2 ———升华温度/℃ — — 180 300 1621-1写出装置A 中发生反应的离子方程式。
1-11-2写出装置A 中仪器g 的名称及装置C 中的试剂名称。
1-3装置E 中h 瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有什么杂质元素?(填写元素符号) 1-2仪器g 的名称: C 中的试剂名称:1-3(填写元素符号)1-4为分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe 2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是: 5Fe 2++MnO 4-+8H +=5Fe 3++Mn 2++4H 2O称取5.000g 残留物,经预处理后在容量瓶中配制成100mL 溶液,移取25.00mL 试样溶液,用1.000×10-2mol/L KMnO 4标准溶液滴定,达到滴定终点时,消耗标准溶液20.00mL 。
最新-2018年福州市高中化学竞赛试卷 精品

2018年福州市高中化学竞赛试卷考试限时:180分钟试卷满分:100分考试要求:(1)允许使用非编程计算器以及直尺等文具。
(2)竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
(3)试卷分考室装订成册,不得拆散。
所有解答必须写在指定的括号中、试题后及横线上,不得用铅笔填写。
使用统一发放的草稿纸。
不得持有任何其他纸张。
(4)姓名、年级和所属学校等必须写在首页左侧指定位置,写在其他地方者按废卷论。
相对原子质量:H-1、C-12、O-16、S-32、Cl-35.5、Cs-133、Al-27、Fe-56、Cu-64一、(15分)选择题(每小题均只有一个正确答案。
)1.亚碘酸钠的化学式为A NaIB NaIOC NaIO2D NaIO32.下列气体中,直接排放到大气而不会产生污染的是A NOB O3C CH4D CO23.属于同系物的一组物质是A 甲醇、乙二醇、丙三醇B -OH、-CH2OH、-CH2CH2OHC CH4、CH3CH(CH3)2、(CH3)3CCH2CH3D 一氯甲烷、二氯甲烷、三氯甲烷4.同时含有这组物质,却是纯净物的是A 35Cl2、37Cl2、35Cl-37ClB 白磷、红磷C 正丁烷、异丁烷D HCOOH、CH3COOH、CH3CH2COOH5.“绿色化学”是当今社会提出的一个新概念。
在“绿色化学工艺”中,理想状态是反应原子全部转化为欲制得的产物,即原子利用率为100%。
用甲烷合成乙酸乙酯,欲使原子利用率达到最高,还需要消耗的其他的反应物有A COB CO2和H2OC H2O和O2D CH3OH6.反物质颇为科学家所关注,早在1997年就有科研机构称制成了反氢原子。
你认为反氢原子的组成应该为A 由1 个带正电荷的质子与一个带负电荷的电子构成B 由1 个带负电荷的质子与一个带正电荷的电子构成C 由1 个不带电的中子与一个带负电荷的电子构成D 由1 个带负电荷的质子与一个带负电荷的电子构成7.将铝粉放入烧碱溶液中,若反应过程中有0.5mol电子转移,则反应中被还原的水的质量为A 9克B 18克C 3克D 6克8.已知49%(溶质的质量分数)硫酸溶液的物质的量浓度为amol/L,试判断98%硫酸溶液的物质的量浓度为A 大于2amol/LB 等于2amol/LC 小于2amol/LD 无法判断9.将来若发现位于元素周期表第七横行、第十七纵列元素的一种原子,该原子的质量数为280,则该原子核内中子数为A 162B 163C 164D 16510.1995年,美国教授Lagow称他已制得了碳的第四种同素异形体链式炔碳:…-C≡C-C≡C-C≡C…该物质的一个分子中含300-500个碳原子,性质很活跃。
福建省泉州市2018年泉州高二化学竞赛试题答案

泉州市2018年高二化学竞赛试卷参考答案11.(15分)(1)(1分)(2)①不合理,因为若产物为CO和SO2,则反应中C和S元素的化合价均降低,不符合氧化还原反应的电子守恒(或直接指明浓硫酸作催化剂、脱水剂)(2分)H2C2O4 CO↑+CO2↑+H2O(2分)②吸收CO2 (1分)③防止CO与装置内空气混合在加热时发生爆炸(1分)(3)① Cu、Cu2O、CuO或Cu、CuO 或Cu2O、CuO(2分,以上三种组合均得分)② 13.79g (2分)③ Ca(OH)2微溶于水,饱和溶液浓度也很低,过量的CO2 使Ca(OH)2转化为可溶的Ca(HCO3)2(2分)(4)d(2分)12.(12分)(1)①6Fe2++ Cr2O72- +14H+=6Fe3++ 2Cr3++ 7H2O (2分)②1.575×107 (2分)③ 2Ba2+ + Cr2O72- + H2O =2BaCrO4↓ +2H+ (2分)(2) ①4Fe+10HNO3=4 Fe(NO3)2+NH4NO3+3 H2O (2分)②d (1分)③不合理,因为温度较高,硝酸易分解、易挥发(或还原产物含有NO、NO2的有毒气体,甚至不生成NH4NO3)(2分)合理(1分)13.(13分)(1)①5s25p6(1分)② +1 +5(2分)③离子正八面体(2分)④ O2PtF6(1分)⑤ C(2分)(2)①CuO NH3 (2分)②CuO +H2 Cu +H2O (1分)4NH3+3O2 2N2+6H2O (2分)14.(1)MnCl2(H2O)2·[(CH2)6N4]2或MnCl2(H2O)2(C6N4H12)2(2分)(注:中心原子、配体化学式及配位数书写正确得2分)(2)顺磁性(2分)(3) 或(2分) (4)(2分)(4)密度为1.57×103kg/m 3, (2分)15.(1)(1)假设原料气乙苯1mol3256CH CH HC 256CH CH H C =+2H起始物质的量(mol) 1 0 0平衡物质的量(mol): α-1 α αα+=1总n%4.7749.11100100111111222222==-=⨯-=⋅-=⋅+-⋅+⨯⋅+=⋅=αααααααααααααθθθθθθθ解得总总总总乙苯苯乙烯氢气kPa kPa p p p p p p p p p p p p pp K p(2) 答案:假设原料气乙苯1mol ,水蒸气10mol3256CH CH H C 256CH CH H C =+2H O H 2 起始物质的量(mol) 1 0 0 10平衡物质的量(mol): α-1 α α 10 α+=11总n1分1分1分2分%9.9449.1)1)(11(100100)1)(11()1)(11(1111111222==-+=⨯-+=⋅-+=⋅+-⋅+⨯⋅+=⋅=ααααααααααααααααθθθθθθθ解得总总总总乙苯苯乙烯氢气kPa kPa p p pp p p p p p p p p pp K p过程合理,答案正确得满分16.(1)结构基元:1个A 或 A (1分) 点阵形式:底心正交(1分)(2)图略,合理即可 (1分) 3个-42Sb (1分)(3)①BaTi 2As 2O (2分) ②简单四方(2分)③ 共顶点连接(或共用Ti 为顶点)(2分) 17.(10分)(1)X:OCl, AlCl 3Y. Zn-Hg,HCl(或①N 2H 4②NaOH 溶液,Δ)(2) sp 2 有,存在碳环共平面10电子结构(或满足4n+2结构) (每空1分)1分1分1分2分。
最新-2018年福州市高中生化学竞赛试题卷 精品

2018年福州市高中生化学竞赛试题卷考试限时:150分钟 试卷满分:100分考试要求:⑴.允许使用非编程计算器以及直尺等文具。
⑵.竞赛时间2.5小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把答题卷(背面朝上)放在桌面上,立即起立撤离考场。
监考教师负责收集答题卷,并按准考号顺序叠放装袋。
试题卷归考生所有。
⑶.所有解答必须写在答题卷指定的位置,不得用铅笔填写;⑷.姓名、年级等必须写在答题卷指定的位置,写在其他地方者按废卷论。
相对原子质量:H-1、C-12、N-14、O-16、Na-23、Mg-24、S-32、Cl-35.5、Al-27、Fe-56、Cu-64、Zn-65、Ba-137一、(共25分)选择题(每小题均只有一个..正确答案。
) 1.下列产品的使用不会对环境造成明显污染的是A.含磷洗衣粉B.氢氧燃烧电池C.氟利昂D.含汞电池2.从烹调香料八角(俗称大料)中提取到的莽草酸是制取抗禽流感药物Tamiflu (商品名:达菲)的基本原料。
莽草酸的结构式如下。
下列对莽草酸说法正确的是 A.分子式:C 7H 10O 5 B.莽草酸是芳香族化合物C.莽草酸可以遇到氯化铁溶液变紫色D.1mol 莽草酸与足量钠反应可以产生4mol 氢气3同温同压下,1体积空气和1体积二氧化碳混合后缓慢通过灼热且足量的焦炭,充分反应后的气体中N 2和CO 的体积分数分别为a 和b ,则a ∶b 约为 A.1∶3 B.2∶3 C.4∶7 D.4∶11 4.下列有关pH 变化的判断中,正确的是A.随着温度的升高,碳酸钠溶液的pH 减小B.随着温度的升高,纯水的pH 增大C.新制氯水经光照一段时间后,pH 减小D.氢氧化钠溶液久置于空气中,pH 增大 5.已知2KClO 3+I 2 2KIO 3+Cl 2↑,下列对此反应的说法正确的是 A.氧化产物与还原产物的物质的量之比为1∶2 B.I 2的还原性强于Cl 2 C.标准状况下产生11.2 L Cl 2,转移电子为1 mol D.Cl 2和I 2都是氧化剂 6.中国锅炉燃煤采用沸腾炉逐渐增多,采用沸腾炉好处在于 A .增大煤炭燃烧时的燃烧热并形成清洁能源 B .减少炉中杂质气体(如SO 2等)的形成 C.可使生成的SO 2用于生产硫酸D.使得燃料燃烧充分,从而提高燃料的利用率且减少CO 的排放7.已知H +(aq )+OH -(aq )=H 2O (l );ΔH = -57.3 kJ /mol 。
福建省南安第一中学2018学年高一上学期奥赛选拔化学试

2016年南安一中高中化学奥赛选拔试卷2016.9试题说明:1.本试卷满分100分。
2.可能用到的相对原子质量:H —1 C —12 N —14 O —16 Na —23 Mg —24 Al —27 Si —28 S —32 C1—35.5 Ca —40 Cu —64 Ag —108 Ba —137Fe —56 Zn —653.考试时间:90分钟第Ⅰ卷(选择题 共54分)一、(本题包括18个题,每题3分,共54分。
每题只有一个....选项符合题意) 1. 物质的性质决定用途,下列物质的用途与物质化学性质无关的是( ) A .用铜丝做导线 B .稀硫酸除铁锈 C .稀有气体做金属焊接保护气 D .用生石灰做食品干燥剂 2.下列各图所示装置的气密性检查中,漏气的是( )A. B. C. D.3.航天员专用的小分子团水具有饮用量少、在人体内储留时间长、排放量少等特点。
航天员一次饮用125mL 小分子团水,可维持人体6小时正常需水量。
下列关于小分子团水的说法中正确的是( )A.水分子的化学性质被改变了 B .小分子团水中水分子间没有间隙 C .小分子团水中水分子停止了运动 D .小分子团水的部分物理性质与普通水有所不同 4.工业酒精中常含有甲醇,甲醇有剧毒,不能食用,其分子结构可能如图所示的模型表示。
下列有关甲醇的叙述中,错误的是( )A.甲醇的化学式为CH4OB.甲醇的相对分子质量为32C.甲醇中C 、H 、O 三种元素的质量比为1:4:1D.甲醇中氧元素的质量分数为50%5.下列符号中,既能表示一个原子,又能表示一种元素,还能表示一种物质的是( ),A、H2B、OC、C60D、Cu6.碳纳米管是在1991年被发现的。
碳纳米管是由石墨中的碳原子层卷曲而成的管状的材料,管的直径一般为几纳米到几十纳米,管的厚度仅为几纳米。
碳纳米管由于其独有的结构和奇特的物理、化学特性以及潜在的应用前景而受到人们的关注。
下列有关碳纳米管的说法中正确的是()A.碳纳米管是一种新型的高分子化合物B.碳纳米管的化学性质常温时很稳定C.碳纳米管导电属于化学变化D.碳纳米管的结构和性质与金刚石均相同7.产生下列现象,只与空气中的水蒸气有关的是()A.固体烧碱要密封存放B.浓硫酸露置于空气中会增重、变稀C.浓盐酸露置于空气中会变轻、变稀D.铜制品长期放在空气中会产生“铜锈”[又称“铜绿”,化学式为Cu2(OH)2CO3]8.如图,将两支燃着的蜡烛罩上茶杯,一会儿后高的蜡烛先熄灭,低的蜡烛后熄灭,同时还观察到茶杯内壁变黑。
最新-2018年福建省高中学生化学竞赛(复赛)试题及参考答案 精品
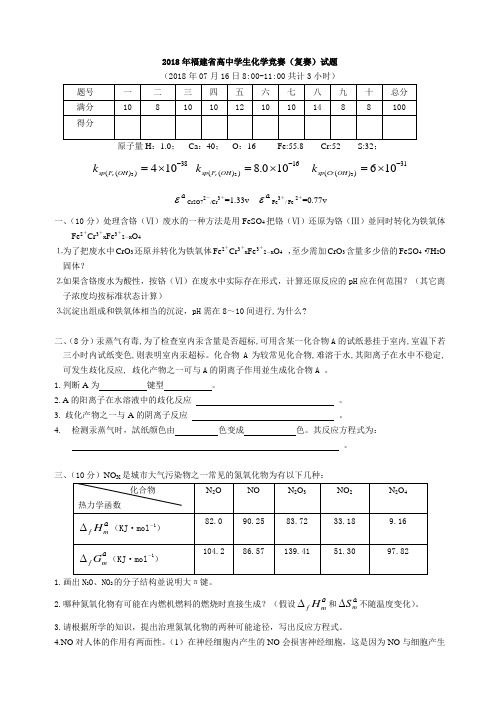
2018年福建省高中学生化学竞赛(复赛)试题 (2018年07月16日8:00-11:00共计3小时)原子量H :1.0; Ca :40; O :16 Fe:55.8 Cr:52 S:32;38))((1043-⨯=OH F sp e k 16))((100.82-⨯=OH F sp e k 31))((1063-⨯=OH Cr sp kοεCr2O72-/Cr3+=1.33vοεFe 3+/ Fe2+=0.77v一、(10分)处理含铬(Ⅵ)废水的一种方法是用FeSO 4把铬(Ⅵ)还原为铬(Ⅲ)並同时转化为铁氧体Fe 2+Cr 3+x Fe 3+2-x O 4⒈为了把废水中CrO 3还原并转化为铁氧体Fe 2+Cr 3+x Fe 3+2-x O 4 ,至少需加CrO 3含量多少倍的FeSO 4·7H 2O 固体?⒉如果含铬废水为酸性,按铬(Ⅵ)在废水中实际存在形式,计算还原反应的pH 应在何范围?(其它离子浓度均按标准状态计算)⒊沉淀出组成和铁氧体相当的沉淀,pH 需在8~10间进行,为什么?二、(8分)汞蒸气有毒,为了检查室内汞含量是否超标,可用含某一化合物A 的试纸悬挂于室内,室温下若三小时内试纸变色,则表明室内汞超标。
化合物A 为较常见化合物,难溶于水,其阳离子在水中不稳定,可发生歧化反应, 歧化产物之一可与A 的阴离子作用並生成化合物A 。
1.判断A 为 键型 。
2. A 的阳离子在水溶液中的歧化反应 。
3. 歧化产物之一与A 的阴离子反应 。
4. 检测汞蒸气时,試纸颜色由 色变成 色。
其反应方程式为:。
三、(10分)NO X 是城市大气污染物之一常见的氮氧化物为有以下几种:1.画出N 2O 、NO 2的分子结构並说明大π键。
2.哪种氮氧化物有可能在内燃机燃料的燃烧时直接生成?(假设οmfH ∆和οm S ∆不随温度变化)。
3.请根据所学的知识,提出治理氮氧化物的两种可能途径,写出反应方程式。
2018年全国化学竞赛初赛试题答案与解析

题目:化学反应速率与化学计量数的关联
解析:化学反应速率与化学计量数呈正相关,即反应速率随着反应物浓度的增加而增加,随 着反应物浓度的减小而减小。
题目:化学平衡常数的计算
解析:化学平衡常数是描述化学反应平衡状态的重要参数,可以通过平衡时各组分的浓度计 算得出。
简述化学反应速率的影响因素。
解释酸碱指示剂的作用原理。
XX,aies
汇报人:XX
CONTENTS
PART ONE
PART TWO
考试时间:2018年5月19 日(星期六)上午9:0012:00
考试地点:各省市级重点中 学
考试形式:闭卷、笔试 试卷结构:单选题、填空题、简答题、计算题等题型 分值分布:各题型分值分布情况 考试时间:总时长及各部分用时
考试科目:化学 考试形式:笔试 考试时间:3小时 试题难度:中等
PART THREE
考查知识点:化学基础知识
注意事项:注意题目中的陷阱和易 错点,避免因疏忽而选错答案。
添加标题
添加标题
添加标题
添加标题
解题思路:根据题目给出的选项, 逐一分析每个选项的正确性或错误 性,并给出相应的解释。
示例:针对题目“下列哪个选项是正 确的?”给出四个选项,分别对每个 选项进行分析和解释,最终给出正确 答案。
答案:$17/22.4$
题目:在标准状况下,$11.2LCO_{2}$所含分子数为____个。 答案:$3.01 \times 10^{23}$
答案:$3.01 \times 10^{23}$
题目:在标准状况下,$11.2LSO_{2}$的质量是____$g$。 答案:$34$
答案:$34$
简答题1答案: B
提高解题速度,通过大量练习 来提高解题效率和准确性。
第35届中国化学奥林匹克竞赛初赛试题(福建卷)

第 35 届中国化学奥林匹克(初赛)试题福建卷第 1 题(23 分)氟及化合物1-1德国人斯瓦恩哈德是从事玻璃加工的一名工人。
1670 年,他无意中将萤石与浓硫酸 1 : 1 混合在一起,结果产生了一种具有刺激性气味的烟雾,他发现这种气体能腐蚀玻璃,从而研究出一种不用金刚石或其他磨料也可以在玻璃上刻蚀图案的方法。
利用这种方法,斯瓦恩哈德制成了许多玻璃艺术品,成为有名的玻璃雕刻艺术家。
写出上述化学反应方程式。
1-2单质氟的制备是化学史上一段悲壮的历史,有多位化学家中毒,甚至付出生命,但是化学家们不畏艰难、前仆后继。
终于,1886 年法国化学家莫瓦桑在总结前人经验与教训的基础上,在低温下电解熔融的氟化氢钾制得单质氟,这距离氢氟酸的发现已经过去一百多年之久。
写出电解制备单质氟的反应方程式。
1-3又过了整整一百年,化学方法制取 F2 获得成功。
其步骤如下:在 HF、KF 存在下,用KMnO4 氧化 H2O2;SbCl5 和 HF 反应;K2MnF6 和 SbF5 反应。
写出各步的化学反应方程式。
1-4氟单质的反应性非常强,可与稀有气体氙发生反应。
已知:Xe(g) + 2F2(g) = XeF4(g) K p = 1.07 × 108(523 K),K p = 1.98 × 103(673 K)Xe(g) + 3F2(g) = XeF6(g) K p = 1.01 × 108(523 K),K p = 36.0(673 K)XeF6 的立方晶型中有四聚体单元,Xe 与其中 5 个 F 的键长为 184 pm,与第 6 个 F 的键长为223 pm。
1-4-1在满足反应速率的前题下,应如何控制温度才有利于 XeF6 的生成。
1-4-2若在523 K 下以Xe 和F2 制取XeF6,并使产物中 XeF6/XeF4 > 10,计算说明 F2 的平衡分压至少应保持在标准压力的多少倍(精确到小数点后第一位)?1-4-3指出XeF6 气体的分子构型。
2019年高中化学奥林匹克预赛(福建)参考答案、评分标准

属给予电子,另一方面中心金属离子可向 P 的空 d 轨道反馈电子,形成了 d - d 反馈
键,从而加强了配合物的稳定性。
(2 分)
4-4(3 分)
第一步,取三种固体分别溶于水中,并用稀硫酸酸化,再加 KI 溶液,产生 I2 的是
Na2HAsO4。(I2 用淀粉试纸试验) H3AsO4 + 2I + 2H+ = H3AsO3 + I2 + H2O
1-5 (1分) 操作II的名称:分液(0.5分); 副产物A的主要成分:NH4Cl(0.5分) 1-6(3分) 系列操作步骤:蒸发浓缩、冷却结晶、过滤、洗涤、干燥(每个0.5分,共2.5分)
可直接循环利用的物质:有机萃取剂(0.5分)
第 2 题(10 分) 2-1 (1.5 分)
Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O(0.5 分); 增大气体与溶液接触面,增大气体吸收率(0.5 分); NaOH溶液(或酸性高锰酸钾溶液)(0.5分)
4-2 (5 分)
sp3d
(1 分)
2PCl5 PCl5
[PCl4]+ + [PCl6][PCl4]+ + [Cl]-
(1 分) (1 分)
PCl5 浓度较高时,第一个平衡占优势;较低时,后一平衡占优势。
PCl5 + H2O = POCl3+2HCl
(1 分)
(1 分)
4-3(2 分)
P 有孤对电子和可以利用的 3d 轨道。在与过渡金属形成配合物时,一方面 P 向中心金
2019 年中国化学奥林匹克福建省赛区预赛试题答案及评分标准 (第1页,共 8 页)
2018年福建省高中数学联赛(福建省赛区)预赛试题参考答案

r1 r2 16 ,结合 r1 r2 4 ,得 r1 10 , r2 6 。
2
由此得到, F1P ∴
F1F2
2
F2 P
2
。因此, PF2 F1 F2 。
△F1 PF2 的外接圆半径 R
1 F1 P 5 。 2
4
8.最近网络上有一篇文章很火。源于一道常见题目: (见图) ,这貌似易解的题目,里面 竟然蕴藏了深奥的大道理。 (本题不作为本次考试的试题,本次试题如下) 设 a , b 2 , 3, 4, 5, 6, 7, 8 ,则 最大值为 【答案】
∴ ∴
c 2 10 , c 10 。
cos C a 2 b 2 c 2 4 9 10 1 。 2ab 2 2 3 4
。 ( i 为虚数单位, z 为复
3.设复数 z 满足 z i 2 ,则 z z 的最大值为 数 z 的共轭复数) 【答案】
6
【解答】设 z x yi ( x , y R ) , 则 z x yi , z z ( x yi ) ( x yi ) 2 yi , z z 2 y 。 由 z i 2 ,知 ( x yi ) i 2 , x 2 ( y 1)2 4 。 ∴ ∴ ∴ ( y 1)2 4 , 1 y 3 。 z z 2 y 6 ,当且仅当 y 3 ,即 z 3i 时,等号成立。 z z 的最大值为 6 。
1
4. 已知定义在 R 上的奇函数 f ( x ) 的图像关于直线 x 2 对称, 当 0 x 2 时,f ( x ) x 1 , 则 f (100) f (101) 【答案】
2
。
