芬苯达唑质量标准
芬苯达唑混悬剂的制备与含量测定方法的建立

芬苯达唑混悬剂的制备与含量测定方法的建立张粉丽;党丽梅;杨小怀;张要齐;孙雪峰;童光年;贾维彬;杨小凡;李引乾【摘要】以芬苯达唑为主药,选择合适的助悬剂、润湿剂等辅料制备混悬剂,并建立该混悬剂中芬苯达唑含量测定方法.采用紫外-可见分光光度法,以217 nm为测定波长,测定芬苯达唑混悬剂中芬苯达唑的含量.在1.08μg/mL~10.80 μg/mL浓度范围内,标准曲线y=0.099 2x-0.033 6,线性回归相关性好(R2 =0.995 3,n=5).芬苯达唑的平均回收率为98.60%,变异系数为0.48%,日内和日间精密度RSD均小于5%,表明该方法专属性好,测定结果稳定可靠.此方法可以用于芬苯达唑混悬剂有效成分的含量测定.【期刊名称】《动物医学进展》【年(卷),期】2015(036)009【总页数】4页(P76-79)【关键词】芬苯达唑;混悬液;紫外-可见分光光度法;含量测定【作者】张粉丽;党丽梅;杨小怀;张要齐;孙雪峰;童光年;贾维彬;杨小凡;李引乾【作者单位】西北农林科技大学动物医学院,陕西杨凌712100;陕西蓝牧生物科技有限公司,陕西西安710000;西北农林科技大学动物医学院,陕西杨凌712100;岐山县蔡家坡镇畜牧兽医工作站,陕西岐山722450;河南惠通天下生物工程有限公司,河南郑州451162;河南惠通天下生物工程有限公司,河南郑州451162;西北农林科技大学动物医学院,陕西杨凌712100;西北农林科技大学动物医学院,陕西杨凌712100;西北农林科技大学动物医学院,陕西杨凌712100;西北农林科技大学动物医学院,陕西杨凌712100【正文语种】中文【中图分类】S859.53芬苯达唑(fenbendazole,FBZ)又名硫苯咪唑,为白色或类白色粉末,无臭,无味,不溶于水,可溶于二甲亚矾和冰醋酸[1-3],在国内外已经得到了广泛的应用[4]。
芬苯达唑与虫体的微管蛋白结合,阻止微管的聚合,从而导致幼虫或成虫的表皮层与肠细胞质的微管损伤,降低虫体的消化和营养吸收的速率[5-6]。
中国与美国、日本、欧盟和国际食品法典委员会关于禽类产品中兽药最大残留限量标准的对比
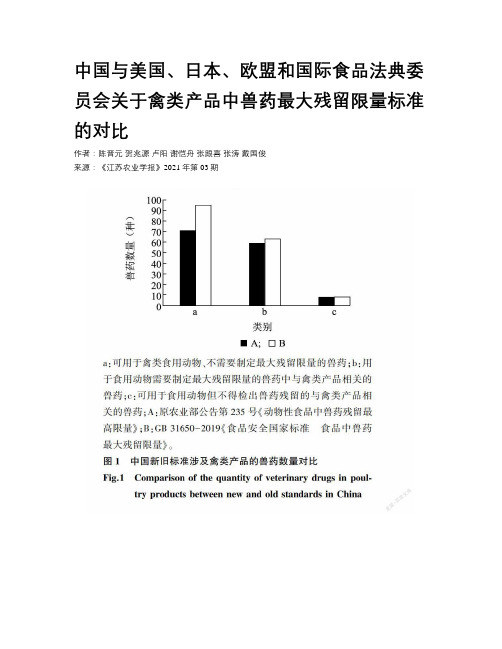
中国与美国、日本、欧盟和国际食品法典委员会关于禽类产品中兽药最大残留限量标准的对比作者:陈晋元贺兆源卢阳谢恺舟张跟喜张涛戴国俊来源:《江苏农业学报》2021年第03期摘要:旨在對中国关于禽类产品中兽药最大残留限量的新旧标准进行对比并将新标准与美国、日本等发达国家以及国际组织关于禽类产品中兽药最大残留限量标准进行对比。
结果表明,中国禽类产品中兽药的最大残留限量新标准与旧标准相比,内容上已经更为完善,与国外的差距逐渐缩小。
通过对比研究发现了中国标准的不足之处,并提出相关建议,以期为进一步完善中国禽类产品中兽药的最大残留限量标准提供参考。
关键词:兽药;最大残留限量标准;禽类产品中图分类号: S859.84 文献标识码: A 文章编号: 1000-4440(2021)03-0754-09Comparison of the standards about the maximum residue limit of veterinary drugs in poultry products between China and USA, Japan, European Union and Codex Alimentarius CommissionCHEN Jin-yuan1,2, HE Zhao-yuan1,2, LU Yang1,2, XIE Kai-zhou1,2, ZHANG Gen-xi1,2, ZHANG Tao1,2,DAI Guo-jun1,2(1.College of Animal Science and Technology, Yangzhou University, Yangzhou 225009,China;2.Joint International Research Laboratory of Agriculture & Agri-Product Safety, Ministry of Education, Yangzhou 225009, China)Abstract: The aim of this study is to compare the old and new domestic standards about the maximum residue limit of veterinary drugs in poultry products, and to compare the maximum veterinary drug residue limit in poultry products between the new standard and the standards of the United States, Japan and other developed countries and international organizations. The results showed that, the content of the Chinese new standard about the maximum residue limit of veterinary drugs in poultry products was improved compared with the old standard, and the gap between Chinese new standard and foreign standards gradually narrowed. Deficiencies of the domestic standard were found through comparative study, and relevant suggestions were proposed to providereference for further improvement of the domestic standard about the maximum residue limit of veterinary drugs in poultry products.Key words: veterinary drug;maximum residue limits (MRLs) standard;poultry products兽药的使用会使畜禽产品中存在兽药原形及其代谢产物的残留,而食用含有残留兽药的畜禽产品会产生许多不良影响,危害人们的身体健康[1-4],如引起体内菌群失调、胃肠道感染[5]、过敏反应和变态反应等[6-8],并能产生致癌、致畸、致突变等作用[9-14]。
芬苯达唑-甲基-β-环糊精包合物的制备及物相鉴定

中国畜牧兽医 2024,51(4):1729-1736C h i n aA n i m a lH u s b a n d r y &V e t e r i n a r y Me d ic i n e 芬苯达唑-甲基-β-环糊精包合物的制备及物相鉴定张志远,徐淑凤,聂结华,马艳芝,廖洁丹(佛山科学技术学院生命科学与工程学院,佛山528225)摘 要:ʌ目的ɔ提高难溶性兽药芬苯达唑(f e n b e n d a z o l e ,F B Z )的水溶性和溶出度,提高药物在临床应用中的治疗效果㊂ʌ方法ɔ采用恒温磁力搅拌法,配合冷冻干燥技术,制备芬苯达唑-甲基-β-环糊精包合物(F B Z -M e -β-C D )㊂通过设计单因素正交试验,以包合物的包合率和产率为指标,研究包合物的最佳制备工艺;通过相溶解度试验,根据5种不同环糊精对药物的增溶效果,确定最佳包合材料;使用高效液相色谱法(H P L C )对包合物的溶解度㊁包合率及体外溶出度进行检测;最后,使用差示扫描量热法(D S C )和扫描电镜(S E M )对包合物的物相结构进行表征㊂ʌ结果ɔ包合物的最佳制备工艺为:搅拌时间3h ㊁转速600r /m i n ㊁主客摩尔比1ʒ3,温度50ħ,最佳包合材料为甲基-β-环糊精㊂包合物在水中的溶解度为12.02m g /m L ,是芬苯达唑原药(0.3μg /m L )的4万倍㊂包合物的体外溶出度是芬苯达唑原药的7倍㊂包合物的平均产率㊁包合率分别为89.50%和29.20%,经扫描电镜和差示扫描量热法分析鉴定,芬苯达唑和环糊精处于非晶体结构的包合状态㊂ʌ结论ɔ本研究通过制备芬苯达唑环糊精包合物,提高了难溶性药物芬苯达唑的溶解度和体外溶出度,且制备方法简单易行,有利于芬苯达唑的进一步研究㊂关键词:芬苯达唑;包合物;环糊精;水溶性中图分类号:S 859.1文献标识码:AD o i :10.16431/j .c n k i .1671-7236.2024.04.040 开放科学(资源服务)标识码(O S I D ):收稿日期:2023-10-20基金项目:广东省南方现代草牧业(羊)产业技术体系(2019K J 127);2022年佛山市自筹经费类科技计划项目(2220001005797);2023年佛山科学技术学院大学生创新创业项目;2022年广东省研究生教育创新计划项目(2022J G XM 129㊁2022J G X M 128)联系方式:张志远,E -m a i l :J e r r y z h a n g 0707@o u t l o o k .c o m ㊂通信作者廖洁丹,E -m a i l :l i a o ji e d a n @163.c o m P r e p a r a t i o na n d I m a g e I d e n t i f i c a t i o no f F e n b e n d a z o l e -m e t h y l -β-c y c l o d e x t r i n Z H A N GZ h i y u a n ,X US h u f e n g,N I EJ i e h u a ,MA Y a n z h i ,L I A OJ i e d a n (S c h o o l o f L i f eS c i e n c e a n dE n g i n e e r i n g ,F o s h a nU n i v e r s i t y ,F o s h a n 528225,C h i n a )A b s t r a c t :ʌO b j e c t i v e ɔT h i s s t u d y w a s a i m e d t o i m p r o v e t h ew a t e r s o l u b i l i t y a n dd i s s o l u t i o nr a t e o f t h e i n s o l u b l ev e t e r i n a r y d r u g f e n b e n d a z o l e (F B Z )a n di m p r o v et h et h e r a p e u t i ce f f e c to f t h e d r u g i n c l i n i c a l a p p l i c a t i o n .ʌM e t h o d ɔF b e n d a z o l e -m e t h y l -β-c y c l o d e x t r i n i n c l u s i o nc o m p l e x (F B Z -M e -β-C D )w a s p r e p a r e d b y c o n s t a n tt e m p e r a t u r e m a g n e t i cs t i r r i n g m e t h o da n df r e e z e -d r y i n g t e c h n i q u e .T h r o u g h t h e d e s i g n o f s i n g l e f a c t o r o r t h o g o n a lt e s t ,t h e o p t i m u m p r e pa r a t i o n t e c h n o l o g y o f i n c l u s i o nc o m p l e x w a ss t u d i e d w i t ht h ei n c l u s i o nr a t ea n dr e c o v e r y ra t ea st h e i n d e x .A c c o r d i n g t ot h es o l ub i l i z a t i o n e f f ec to f5d i f fe r e n tc y c l o d e x t r i n s o n d r u g s ,t h e b e s t i n c l u s i o n m a t e r i a l w a s d e t e r m i n e d b y p h a s e s o l u b i l i t y t e s t .H i g h p e rf o r m a n c e l i qu i d c h r o m a t o g r a p h y (H P L C )w a s u s e d t od e t e c t t h e s o l u b i l i t y ,i n c l u s i o n r a t e a n d i n v i t r o d i s s o l u t i o n r a t eo ft h ei n c l u s i o n c o m p l e x .F i n a l l y ,t h e p h a s e s t r u c t u r e o ft h ei n c l u s i o n c o m pl e x w a s c h a r a c t e r i z e d b y d i f f e r e n t i a ls c a n n i n g c a l o r i m e t r y (D S C )a n d s c a n n i n g e l e c t r o n m i c r o s c o p y(S E M ).ʌR e s u l t ɔT h e o p t i m u m p r e p a r a t i o n p r o c e s s o f i n c l u s i o nc o m p l e xw a s a s f o l l o w s :S t i r r i n gt i m ew a s3h ,r o t a t i o n a ls p e e d w a s600r /m i n ,m o l a rr a t i o o fs u b j e c tt o g u e s t w a s1ʒ3,t e m p e r a t u r ew a s 50ħ.T h eb e s t i n c l u s i o n m a t e r i a lw a sm e t h y l -β-c y c l o d e x t r i n .T h es o l u b i l i t y o f t h e i n c l u s i o n c o m p l e x i nw a t e rw a s 12.02m g/m L ,w h i c hw a s 40000t i m e s t h a to f f e n b e n d a z o l e中国畜牧兽医51卷(0.3μg/m L).T h e d i s s o l u t i o n r a t e o ft h ei n c l u s i o n c o m p l e x i nv i t r o w a s7t i m e st h a to ff e n b e n d a z o l e.T h e a v e r ag e r e c o v e r y a n d i n c l u s i o nr a t eo f th ei n c l u s i o nc o m p o u n d sw e r e89.50% a n d29.20%,r e s p e c t i v e l y.B y s c a n n i n g e l e c t r o nm i c r o s c o p y a n dd i f f e r e n t i a l s c a n n i n g c a l o r i m e t r y, f e n b e n d a z o l e a n d c y c l o d e x t r i nw e r e i d e n t i f i e d a s a m o r p h o u s i n c l u s i o n s t a t e s.ʌC o n c l u s i o nɔI n t h i s s t u d y,t h es o l u b i l i t y a n dd i s s o l u t i o nr a t eo f t h e i n s o l u b l ed r u g f e n b e n d a z o l e w e r e i m p r o v e db y p r e p a r i n g t h ec y c l o d e x t r i ni n c l u s i o nc o m p l e xo f f e n b e n d a z o l e,a n dt h e p r e p a r a t i o n m e t h o d w a s s i m p l e a n d e a s y,w h i c hw a s c o n d u c i v e t o t h e f u r t h e r s t u d y o f f e n b e n d a z o l e.K e y w o r d s:f e n b e n d a z o l e;i n c l u s i o nc o m p l e x;c y c l o d e x t r i n;w a t e r s o l u b i l i t y动物寄生虫病的防治是当今养殖业面临的重要问题,动物感染寄生虫造成的消瘦㊁食欲不振甚至死亡等,给养殖业造成重大的经济损失[1]㊂芬苯达唑(f e n b e n d a z o l e,F B Z)是一种人兽共用的苯并咪唑类药物,具有高效㊁广谱的驱虫活性,对牛㊁绵羊㊁山羊和马的胃肠道线虫㊁肺线虫和绦虫有效,也能有效地驱除犬㊁猫和多种动物园动物的寄生蠕虫[2],研究发现,芬苯达唑在体外和体内对乳腺肿瘤细胞具有显著的活性,是一种潜在的抗癌药物[3]㊂然而芬苯达唑的水溶性差,在胃肠道中生物利用度低,常规剂量往往无法达到理想的驱虫效果[4]㊂过量服用芬苯达唑会造成较大的副作用,如厌食㊁呕吐甚至死亡等[5]㊂因此,提高芬苯达唑的水溶性是该药研发的关键㊂传统方法包括将芬苯达唑制成微晶体[6]㊁混悬剂[7]及固体分散体[8]等,这些方法往往需要在药物中添加较多的高分子材料,生产成本高,制备工艺相对复杂,甚至造成环境污染㊂环糊精是一种立体结构略呈上宽下窄环状低聚糖,其分子空腔具有内疏水外亲水的特性,能容纳客体药物分子,从而提高药物的水溶性,是一种绿色无污染的纳米材料[9]㊂甲基-β-环糊精是经过修饰后得到的环糊精衍生物[10],具有较好的水溶性和生物活性,其味道香甜可口,被广泛应用到食品㊁药品㊁化妆品等工业当中[11]㊂本研究以甲基-β-环糊精作为载体制备芬苯达唑包合物,来提高其水溶性和药物的适口性,掩盖不良气味,减少饲喂过程中的浪费,降低养殖成本,以期为芬苯达唑的进一步开发奠定基础㊂1材料与方法1.1材料1.1.1主要试剂芬苯达唑(含量98%)购自上海阿拉丁生化科技有限公司;甲基-β-环糊精(含量99%)㊁β-环糊精(含量99%)㊁羟丙基-β-环糊精(含量99%)㊁γ-环糊精(含量99%)㊁羟丙基-γ-环糊精(含量99%)均购自上海麦克林生化科技有限公司;其他试剂均为分析纯㊂1.1.2主要仪器 H J-6A旋转蒸发仪购自I K A 公司;恒温磁力搅拌器购自江苏金怡仪器科技有限公司;C18-E c o s i l色谱柱(250m mˑ4.6m m,5μm)购自广州绿百草科学仪器有限公司;1260i n f i n i t y 分析型高效液相色谱仪购自安捷伦科技有限公司;C T F D-10P真空冷冻干燥机购自郑州华辰仪器有限公司;S i g m a300扫描电镜购自德国蔡司公司;D S C204F1差示扫描量热仪购自梅特勒-托利多有限公司㊂1.2方法1.2.1高效液相检测条件采用1260i n f i n i t y高效液相仪及C18-E c o s i l色谱柱进行分析㊂流动相组成为乙腈ʒ水=7ʒ3,流速设定为1m L/m i n,柱温控制在25ħ㊂检测波长选定为296n m,每次进样量为10μL㊂1.2.2高效液相标准曲线的绘制为建立准确的分析方法,配制浓度为0.01㊁0.02㊁0.04㊁0.06㊁0.08和0.10m g/m L的芬苯达唑标准品溶液㊂使用高效液相检测仪器在296n m处测定峰面积㊂以芬苯达唑浓度作为横坐标,峰面积作为纵坐标,建立标准曲线,以定量分析样品中的芬苯达唑含量㊂1.2.3相溶解度试验研究芬苯达唑在不同环糊精水溶液中的相溶解度,制备β-环糊精㊁甲基-β-环糊精㊁羟丙基-β-环糊精㊁γ-环糊精及羟丙基-γ-环糊精水溶液,每种溶液均设5㊁10㊁15㊁20㊁25和30m m o l/m L6个浓度㊂在溶液中加入过量的芬苯达唑,并在室温下搅拌48h㊂过滤后,使用高效液相检测仪器测定溶液中芬苯达唑的含量㊂将所得数据用于绘制芬苯达唑与不同环糊精的相溶解度曲线㊂1.2.4包合物制备方法将芬苯达唑原药溶解于甲酸中,同时将环糊精溶解于超纯水中㊂两种溶液混合并静置10m i n㊂采用搅拌法制备芬苯达唑环糊精包合物,设置磁力搅拌器温度为50ħ,在转速为500r/m i n的条件下,搅拌6h㊂将得到的溶液03714期张志远等:芬苯达唑-甲基-β-环糊精包合物的制备及物相鉴定在4ħ冰箱中静置12h,然后通过旋转蒸发去除有机溶剂㊂最后,将所得产物溶于纯水中,通过过滤和减压冷冻干燥,获得包合物的固体粉末㊂1.2.5物理混合物的制备通过称取适量的芬苯达唑和甲基-β-环糊精,按照1ʒ1的摩尔比混合,并进行均匀的研磨㊂1.2.6单因素正交试验保持其他变量恒定,仅改变制备条件,通过磁力搅拌法制备包合物,研究温度(A)㊁转速(B)㊁时间(C)对包合率的影响㊂在实际工业生产当中,过多的环糊精用量,会大大增加药物的生产成本㊂因此,基于单因素试验结果,根据实际生产需要及摩尔比变化对药物的增溶趋势,选择环糊精和药物的使用摩尔比为1ʒ3㊂在此基础上,设计L9(33)正交试验,筛选出芬苯达唑环糊精包合物最佳制备工艺,试验设计详见表1㊂表1正交试验设计表T a b l e1O r t h o g o n a l t e s t d e s i g n t a b l e水平L e v e l温度T e m p e r a t u r e/ħ转速R o t a t i o n a ls p e e d/(r/m i n)时间T i m e/h1404003 2505004 3606005 1.2.7包合率与产率的测定取100m g芬苯达唑-甲基-β-环糊精包合物,溶解在10m L超纯水中,涡旋摇匀后经微孔针式过滤器过滤后,进行高效液相检测㊂将得到的峰面积代入标准曲线后,得到包合物药物的质量㊂按照以下公式计算得到包合物包合率;称量冻干后得到的包合物粉末,按照以下公式计算包合物的包合率和产率㊂包合率(%)=包合物中药物的质量投入药物的含量ˑ100%产率(%)=包合物的质量投入环糊精的质量+投入药物的质量ˑ100% 1.2.8平衡溶解度测定称取过量芬苯达唑-甲基-β-环糊精包合物,溶于10m L超纯水中㊂在37ħ下超声㊁振荡2h,形成饱和水溶液,离心取上清液过滤,使用高效液相色谱法分析,测定样品的峰面积,带入标准溶液方程,计算出对应浓度㊂1.2.9体外溶出度试验按照2015年版‘中华人民共和国兽药典“[12]第一部附录160中方法执行药物的体外溶出度测试㊂准备适量的芬苯达唑包合物㊁芬苯达唑原料药㊁甲基-β-环糊精及物理混合物(P M),其中各组芬苯达唑有效含量均为100m g㊂在仪器内加入900m L超纯水,超声脱气处理15m i n,水浴温度控制在37ħʃ0.3ħ㊂将药物分别投入反应容器中,搅拌速度设定为100r/m i n㊂分别在2㊁5㊁10㊁15㊁20㊁30㊁45和60m i n采集3m L样品,通过0.22μm微孔针式过滤器过滤,同时向反应容器内加入同温溶出介质3m L㊂对各个时间点的样品进行高效液相色谱检测,记录峰面积,并根据回归曲线计算累积溶出度㊂1.3包合物的物相鉴定1.3.1差示扫描量热样品包括芬苯达唑包合物㊁芬苯达唑原料药㊁甲基-β-环糊精及物理混合物,每个样品量为5~10m g㊂使用差示扫描量热仪,以空铝坩埚为参考池,另一空铝坩埚为样品池㊂扫描条件设置为10ħ/m i n的扫描速度,扫描范围为50~300ħ,在氮气中进行,气流速度为20m L/m i n㊂1.3.2扫描电镜采用S i g m a300扫描电子显微镜,电压设置为5k V,观察芬苯达唑包合物㊁芬苯达唑原料药㊁甲基-β-环糊精及物理混合物样品㊂样品固定在铜板上,并使用导电胶带固定,然后进行金喷射处理㊂1.4数据统计分析试验数据采用G r a p h P a dP r i s m9.0软件作图并对数据进行方差分析㊂试验结果以平均值ʃ标准差表示㊂2结果2.1高效液相色谱标准曲线绘制由图1可知,在芬苯达唑浓度为0.01~ 0.10m g/m L范围内,峰面积和浓度的线性回归方程为y=54641x-95.1,R2=0.9990,表明芬苯达唑在此浓度范围内线性关系良好㊂2.2相溶解度试验由图2可知,β-环糊精与芬苯达唑的增溶曲线呈先上升后下降的趋势,表明当环糊精溶液达到一定浓度后,对药物不再有增溶效果㊂与γ-环糊精㊁羟丙基-γ-环糊精形成的溶解曲线无上升趋势,表明这两种环糊精对于芬苯达唑无增溶效果㊂芬苯达唑与甲基-β-环糊精显示出了较好的增溶效果,药物在水中的浓度随着环糊精的浓度增加而增加,因此,选用甲基-β-环糊精作为包合材料进行后续试验㊂1371中国畜牧兽医51卷图1芬苯达唑高效液相色谱标准曲线F i g.1H i g h p e r f o r m a n c el i q u i dc h r o m a t o g r a p h y s t a n d a r dc u r v e o f f e n b e nd a z o l e2.3单因素正交试验通过单因素试验,筛选出影响包合物性能的关键因素,结果见图3㊂由图3可知,单因素条件下,不同的包合摩尔比㊁温度㊁转速及时间对包合物的包合率都有较大的影响,制备温度在50ħ左右,保持了相对稳定的结果;而摩尔比在1ʒ3时,包合率达到顶峰;搅拌时间在2h时为最佳,搅拌时间越长,包合率反而降低;转速在500~600r/m i n时有较好的包合效果,而在800r/m i n以上时,包合率严重下降㊂图2芬苯达唑相溶解度曲线F i g.2P h a s e s o l u b i l i t y c u r v e s o f f e n b e n d a z o le图3单因素试验结果F i g.3R e s u l t o f s i n g l e f a c t o r e x p e r i m e n t23714期张志远等:芬苯达唑-甲基-β-环糊精包合物的制备及物相鉴定 对正交试验结果数据处理分析显示,得到最佳制备工艺为A 2B 3C 1,即温度为50ħ,转速为600r /m i n,搅拌时间为3h (表3)㊂按照正交试验所得到的最佳制备工艺制备3份包合物进行产率和包合率测试,取平均值㊂得到芬苯达唑包合率平均值为29.20%,平均产率为89.50%㊂表3 正交试验结果T a b l e 3 R e s u l t s o f o r t h o g o n a l t e s t 编号N u m b e r A B C 包合率I n c l u s i o n r a t e/%产率R e c o v e r y /%综合评分C o m pr e h e n s i v e s c o r e /%111110.2282.2724.63212212.4374.3824.82313324.2479.9135.37421223.6082.1835.32522321.1785.6234.06623129.2089.5041.26731316.1279.3228.76832121.2388.1734.62933215.7282.6529.11K 1/%28.2729.5733.50K 2/%36.8831.1729.75K 3/%30.8335.2532.73R/%3.612.391.62综合评分=包合率ˑ0.8+产率ˑ0.2C o m p r e h e n s i v e s c o r e =i n c l u s i o n r a t e ˑ0.8+r e c o v e r y ra t e ˑ0.22.4 平衡溶解度检测高效液相色谱检测结果显示,芬苯达唑包合物在水中的溶解度为12.02m g /m L ,所得包合物的水溶性较芬苯达唑原药有大幅度提升㊂2.5 体外溶出度试验芬苯达唑原药㊁芬苯达唑-甲基-β-环糊精包合物㊁芬苯达唑和甲基-β-环糊精物理混合物的体外溶出曲线见图4㊂由图4可知,芬苯达唑包合物在体外迅速释放,10m i n 内即可溶解70%以上,是芬苯达唑原药的7倍㊂图4 芬苯达唑原药㊁包合物及物理混合物溶出度曲线图F i g .4 D i s s o l u t i o n r a t e c u r v e s o f f e n b e n d a z o l e ,c o m p l e x e s a n d p h ys i c a lm i x t u r e 2.6 差示扫描量热检测结果由图5可知,芬苯达唑的热吸收峰出现在260ħ左右,而环糊精的热吸收峰出现在80ħ左右,物理混合物中观察到了这两种物质的吸收峰,这表明混合物只是两种原料的简单混合,包合物在65和125ħ左右出现了两个微弱的吸收峰,这是因为形成包合物后,环糊精较高的熔点使芬苯达唑的热流状态发生了改变㊂图5 芬苯达唑原药㊁包合物㊁物理混合物㊁甲基-β-环糊精的差示扫描量热图F i g.5 X R D d i f f r a c t i o n p a t t e r n o ff e n b e n d a z o l e ,i n c l u s i o n c o m p l e x ,p h y s i c a lm i x t u r e a n dM e -β-C D 3371中 国 畜 牧 兽 医51卷2.7 扫描电镜观察结果扫描电镜下可以观察到芬苯达唑原药呈碎屑状(图6A ),环糊精则呈大小不一的球型(图6B ),物理混合物中可看到球状与原药碎片的简单混合(图6C ),而包合物中没有观察到球状的环糊精及碎屑状的芬苯达唑(图6D ),证明环糊精和芬苯达唑形成了新的物相结构㊂图6 芬苯达唑原药(A )㊁甲基-β-环糊精(B )㊁物理混合物(C )㊁包合物(D )扫描电镜图F i g .6 S E Mo f f e n b e n d a z o l e (A ),M e -β-C D (B ),p h y s i c a lm i x t u r e (C )a n d i n c l u s i o n c o m p l e x (D )3 讨 论苯并咪唑类药物是临床最常用的抗寄生虫药物之一,对癌乳腺上皮细胞也具有靶向杀伤作用[13-14]㊂本研究将芬苯达唑的水溶性提升至12.02m g/m L ,相较于R o d r i gu e s 等[15]使用聚乙烯吡咯烷酮辅助制备的芬苯达唑-羟丙基-β-环糊精包合物水溶性更高,且无需添加高分子材料,更适用于工业生产㊂与顾丽佳等[16]制备的芬苯达唑-β-环糊精包合物相比,本研究所得的包合物水溶性更好,其原因可能是甲基-β-环糊精比未经修饰的β-环糊精具有更好的水溶性,因此所得的包合物水溶性更好㊂相溶解度试验结果显示,β-环糊精与芬苯达唑的增溶曲线呈A N 型,线性有负偏差,可解释为环糊精或包合物的自结合或聚集,降低了药物的溶解度㊂与γ-环糊精㊁羟丙基-γ-环糊精形成的溶解曲线呈B 型,这表明形成的包合物溶解度有限㊂芬苯达唑与甲基-β-环糊精显示出了较好的增溶效果,药物在水中的浓度随着环糊精浓度的增加而增加,且溶解曲线呈A L 型[17-18],这说明甲基-β-环糊精与芬苯达唑之间更易形成易溶于水的包合物㊂甲基-β-环糊精是在天然的β-环糊精上进行修饰所得,因此具有更高的水溶性㊂通过分子之间微弱的氢键和范德华力,难溶性的药物可进入环糊精的空腔,从而提高其溶解度[19]㊂因此,在制备过程中,过于剧烈的搅拌或超声运行,往往会将已被包合的药物和环糊精分解,无法达到理想的效果㊂因此,通过单因素正交试验摸索出最佳的制备方法和条件是必不可少的一环㊂在传统的包合物制备工艺中,通常认为摩尔比的控制是药物能否被包合的关键㊂在实际生产当中,过高或过低的摩尔比都无法真正满足工业生产的需求㊂过高的摩尔比导致生产成本过高,无法产生实际价值;而过低的摩尔比无法将全部的药物进行有效包合,包合率也就不足,无法达到提高水溶性㊁掩盖药物不良气味㊁改善适口性的特点㊂因此在试验中,将主客摩尔比设置为1ʒ3较为合适㊂43714期张志远等:芬苯达唑-甲基-β-环糊精包合物的制备及物相鉴定差示扫描量热法是在程序控制温度下,测量输给物质和参比物的功率差与温度关系的一种技术[20]㊂冻干降低了相变温度和焓,使观察到的峰的宽度变宽,这种现象可能是由于包合物的冻干样品在冻干过程中已经部分脱水[21]㊂此外,药物熔化峰的完全消失可能与结晶化合物向非晶化合物的转化直接相关,这可能是真正包合物形成的结果[22]㊂药物被环糊精包合后,其分子形态的改变导致产生了不同的热流曲线㊂而扫描电镜更能够直观地观察到包合物特殊的非晶体形态[23]㊂结合药物溶解度的大幅度提升,充分证实了包合物的形成㊂4结论本试验成功制备了芬苯达唑-甲基-β-环糊精包合物,将芬苯达唑的水溶性提升至12.02m g/m L,体外溶出速率提升了7倍㊂本试验所得包合物包合率及产率较高,方法适用于工业生产㊂包合物的制备为芬苯达唑的研究开发奠定了基础,也给兽药制剂的研发创新提供了思路㊂参考文献(R e f e r e n c e s):[1]王宏磊,刘义明,徐飞,等.芬苯达唑的药理作用及其在动物生产中应用的研究进展[J].中国兽药杂志,2019,53(5):67-73.WA N G H L,L I U Y M,X U F,e t a l.R e s e a r c hp r o g r e s so n p h a r m a c o l o g i c a la c t i o n o ff e n b e n d a z o l ea n di t sa p p l i c a t i o ni na n i m a l p r o d u c t i o n[J].C h i n e s eJ o u r n a l o f V e t e r i n a r y D r u g,2019,53(5):67-73.(i nC h i n e s e)[2]张建平.抗寄生虫药芬苯达唑在家畜驱虫中的应用[J].饲料博览,2018,5:78.Z HA N G J P.A p p l i c a t i o n o f f e n b e n d a z o l e i nd e w o r m i n g o f l i v e s t o c k[J].F e e dR e v i e w,2018,5:78.(i nC h i n e s e)[3] D U A N Q,L I U Y,R O C KW E L LS.F e n b e n d a z o l e a sap o t e n t i a la n t i c a n c e r d r u g[J].A n t i c a n c e r R e s e a r c h,2013,33(2):355-362.[4]那璐,齐六卫.芬苯达唑采用纳米晶固体分散体技术在猪体内驱虫中的应用[J].今日养猪业,2023,4:68-69.N A L,Q I L W.A p p l i c a t i o n o ff e n b e n d a z o l e a s an a n o c r y s t a l l i n e s o l i d d i s p e r s i o n t e c h n i q u ei ni n s e c tr e p e l l e n t o f p i g s[J].P i g sT o d a y,2023,4:68-69.(i nC h i n e s e)[5]夏维福,郭冬生,洪冬胜.藏獒用芬苯达唑驱虫发生副反应的诊治[J].畜牧与兽医,2013,45(7):115.X I A W F,G U O D S,H O N G D S.D i a g n o s i sa n dt r e a t m e n t o f s i d e e f f e c t s o f f e n b e n d a z o l e d e w o r m i n g i nT i b e t a nm a s t i f f[J].A n i m a lH u s b a n d r y&V e t e r i n a r yM e d i c i n e,2013,45(7):115.(i nC h i n e s e) [6]吴海港,叶兆伟,李华,等.芬苯达唑微晶体在猪体内的药物动力学试验[J].中国兽医杂志,2016,52(3):110-112.WU H G,Y EZ W,L IH,e t a l.P h a r m a c o k i n e t i c so ff e n b e n d a z o l e n a n o c r y s t a l s i n p ig s[J].Chi n e s e J o u r n a lo f V e t e r i n a r y M e d i c i n e,2016,52(3):110-112.(i nC h i n e s e)[7]张粉丽,党丽梅,杨小怀,等.芬苯达唑混悬剂的制备与含量测定方法的建立[J].动物医学进展,2015,36(9):76-79.Z HA N G F L,D A N G L M,Y A N G X H,e t a l.D e t e r m i n a t i o no f g a l l i ca c i dc o n t e n t i ns u p p o s i t o r y o fC h i n e s e v e t e r i n a r y m e d i c i n e b y h i g h-p e r f o r m a n c el i q u i d c h r o m a t o g r a p h y[J].P r o g r e s si n V e t e r i n a r yM e d i c i n e,2015,36(9):76-79.(i nC h i n e s e) [8]杨彩梅,曾新福.不同工艺处理芬苯达唑的驱虫促生长研究[J].饲料研究,2007,5:62-64.Y A N GC M,Z E N GXF.S t u d y o n i n s e c t r e p e l l e n t a n dg r o w t h p r o m o t i o n o f f e n b e n d a z o l e b y d i f f e r e n tp r o c e s s e s[J].F e e d R e s e a r c h,2007,5:62-64.(i nC h i n e s e)[9]姜兴粲,李冰,张继瑜.沙拉沙星环糊精包合物的制备与体外释放度研究[J].动物医学进展,2021,42(5):67-72.J I A N G X C,L I B,Z H A N G J Y.P r e p a r a t i o nc h a r a c t e r i z a t i o na nd i n v i t r o d r u g re l e a s eof s a r a f l o x a c i ni n c l u s i o n c o m p l e x[J].P r o g r e s s i nV e t e r i n a r y M e d i c i n e,2021,42(5):67-72.(i nC h i n e s e)[10]杨玉帅,李泽,金天明,等.烯丙孕素-β-环糊精水溶性衍生物包合物的制备及表征[J].中国畜牧兽医,2021,48(11):4094-4104.Y A N G Y S,L IZ,J I N T M,e t a l.P r e p a r a t i o na n dc h a r a c t e r i z a t i o n o fa l t r e n o g e s t-β-c y c l ode x t r i n w a t e r-s o l u b l e d e r i v a t i v e i n c l u s i o n c o m p l e x[J].C h i n aA n i m a l H u s b a n d r y&V e t e r i n a r y M e d i c i n e,2021,48(11):4094-4104.(i nC h i n e s e)[11] M C G U I N N K P,MA H O N E Y M G.L i p i dr a f t sa n dd e t e r g e n t-r e s i s t a n t m e m b r a n e s i n e p i t h e l i a lk e r a t i n o c y t e s[J].M e t h o d s i n M o l e c u l a r B i o l o g y,2014,1195:133-144.[12]中国兽药典委员会.中华人民共和国兽药典.一部[S].北京:中国农业出版社,2015.C H I N E S E V E T E R I N A R Y P HA R MA C O P O E I AC OMM I T T E E.C h i n e s e V e t e r i n a r y P h a r m a c o p o e i a.5371中国畜牧兽医51卷P a r tⅠ[S].B e i j i n g:C h i n a A g r i c u l t u r eP r e s s,2015.(i nC h i n e s e)[13] S E MK O V A S,N I K O L O V A B,T S O N E V A I,e t a l.R e d o x-m e d i a t e d a n t i c a n c e r a c t i v i t y o f a n t i-p a r a s i t i cd r u g fe n b e n d a z o l e i n t r i p l e-n e g a t i v e b r e a s t c a n c e rc e l l s[J].A n t i c a n c e r R e s e a r c h,2023,43(3):1207-1212.[14] V L A C H O U I,P A R S O N I D I S P,MAMA G K A K IA,e t a l.T e a c h i n g a no l d d o g n e w t r i c k s:T h ec a s eo ff e n b e n d a z o l e[J].C a n c e r T r e a t m e n t a n d R e s e a r c hC o m m u n i c a t i o n s,2022,32:100601.[15] R O D R I G U E S L N C,T A V A R E S A C M,F E R R E I R A B T,e t a l.I n c l u s i o nc o m p l e x e sa n ds e l f-a s s e mb l e dc y c l ode x t r i na g g r e g a t e sf o r i n c r e a s i ng th es o l u b i l i t y o f b e n z i m i d a z o l e s[J].B r a z i l i a nJ o u r n a l o fP h a r m a c e u t i c a lS c i e n c e s,2019,55:e17776. [16]顾佳丽,赵恒,刘璐,等.芬苯达唑与β-环糊精包合物的制备及表征[J].化学研究与应用,2020,32(5):808-812.G U J L,Z HA O H,L I U L,e t a l.P r e p a r a t i o n a n dc h a r a c t e r i z a t i o n o f t h e f e n b e nd a z o l e-β-c y c l o de x t r i ni n c l u s i o n[J].C h e m i c a lR e s e a r c h a n d A p p l i c a t i o n,2020,32(5):808-812.(i nC h i n e s e)[17] H A I MH O F F E RÁ,R U S Z N YÁKÁ,RÉT I-N A G Y K,e t a l.C y c l o d e x t r i n s i nd r u g d e l i v e r y s y s t e m s a n d t h e i re f f e c t s o n b i o l o g i c a l b a r r i e r s[J].S c i e n t i aP h a r m a c e u t i c a,2019,87(4):33.[18] S A O K HAM P,MU A N K A E W C,J A N S O O K P,e t a l.S o l u b i l i t y of c y c l o d e x t r i n s a n dd r u g/c y c l o d e x t r i nc o m p l e x e s[J].M o l e c u l e s(B a s e l,S w i t z e r l a n d),2018,23(5):1161.[19]杨云汉,赵雪秋,杜瑶,等.长春胺与羟丙基-β-环糊精包合物的制备㊁表征及理论研究[J].中草药,2019,50(2):352-363.Y A N G Y H,Z HA O X Q,D U Y,e t a l.P r e p a r a t i o n,s p e c t r o s c o p y a n d m o l e c u l a r m o d e l l i n g s t u d i e s o fi n c l u s i o n c o m p l e x o f v i n c a m i n ew i t hh y d r o x y p r o p y l-β-c y c l ode x t r i n[J].C h i n e s e T r a d i t i o n a l a n d H e r b a lD r u g s,2019,50(2):352-363.(i nC h i n e s e)[20] P A L L I V,L E O N I S G,Z O U P A N O U N,e t a l.L o s a r t a n i n t e r a c t i o n sw i t h2-h y d r o x y p r o p y l-β-C D[J].M o l e c u l e s,2022,27(8):2421.[21] MU R A P.A n a l y t i c a lt e c h n i q u e sf o rc h a r a c t e r i z a t i o no f c y c l o d e x t r i n c o m p l e x e s i n t h e s o l i d s t a t e:Ar e v i e w[J].J o u r n a l o f P h a r m a c e u t i c a l a n dB i o m e d i c a lA n a l y s i s,2015,113:226-238.[22] K I M H Y,MA R T I NJH,M C L A C H L A N AJ,e t a l.P r e c i s i o n d o s i n g o f t a r g e t e d a n t i c a n c e r d r u g sC h a l l e n g e s i n t h e r e a lw o r l d[J].T r a n s l a t i o n a l C a n c e rR e s e a r c h,2017,6(S u p p l10):s1500-s1511. [23] R O S A S M D,P I Q U E R A S C M,P I V A G K,e t a l.S i m u l t a n e o u s f o r m a t i o n o f i n c l u s i o n c o m p l e x a n dm i c r o p a r t i c l e s c o n t a i n i n g a l b e n d a z o l e a n dβ-c y c l ode x t r i n b y s u p e r c r i t i c a l a n t i s o l v e n t c o-p r e c i p i t a t i o n[J].J o u r n a l o f C O2U t i l i z a t i o n,2021,47:101505.(责任编辑董晓云)6371。
猪用广谱驱虫产品(芬苯哒唑粉4%)说明书

广东省总经销代理:广州沃斯众生物科技有限公司维克康保(芬苯哒唑粉4%)——最经济实用的猪用广谱驱虫产品!维克康保4%(Fencare 4%)【仅限兽用】兽药名称:芬苯哒唑粉4%通用名:芬苯哒唑粉4%英文名:Fenbendazole Powder汉语拼音名:Fenbendazuofen 4%主要成分芬苯哒唑性状浅褐色粉末[药理作用]本品的抗虫谱与阿苯达唑相似,作用略强。
用于怀孕动物认为是安全的。
芬苯哒唑内服给药后,只有少量被吸收。
反刍动物吸收缓慢,单胃动物稍快。
犬内服后血药达峰时间为24小时,绵羊为2-3日。
吸收后的芬苯哒唑代谢为亚砜(具有活性的奥芬哒唑)和砜。
在牛、绵羊和猪,44%-50%的芬苯哒唑以原形从粪便中排泄,不到1%的在尿中排泄。
[适应症]预防和治疗猪和禽类肠道内、呼吸道和肾导管内的线虫感染。
[用法与用量]与日常饲料混合或喷洒在饲料之上。
一次性给药:猪:每100千克体重使用本品12.5g(5mg芬苯哒唑每千克体重)禽类:15-30mg芬苯哒唑每千克体重连续给药,与饲料混合:猪:每50公斤体重使用1.05g本品,连续使用6天。
如6天连续使用,平均每吨饲料添加500g本品。
禽类: 用于预防蛔虫和绦虫: 每吨饲料添加30ppm或750g本品,连续使用6天。
用于治疗蛔虫和绦虫:每吨饲料添加60ppm或1.5kg本品,连续使用3天。
用于治疗严重的绦虫感染:每吨饲料添加60ppm或1.5kg本品,连续使用6天。
[不良反应]无[注意事项]请勿与“溴胺杀”杀吸虫剂一起使用。
不能将药品抛弃于池塘或河流等水源处。
[停药期]肉猪:14天禽类(肉鸡和蛋鸡):7天[规格]芬苯哒唑40mg/g [包装]12.5g/小袋或1kg/塑料盒或5kg/塑料袋[贮藏]室温储存,温度低于30℃[有效期]3年[进口兽药登记许可证号](2008)外兽药证字21号[生产日期]见外包装[生产批号]见外包装[生产企业]法国维克有限公司-06516 卡洛斯-法国[销售企业] 广州沃斯众生物科技有限公司。
芬苯达唑的作用与功效

芬苯达唑的作用与功效芬苯达唑(Fenbendazole)是一种广谱抗寄生虫药物,主要被用于治疗和预防多种寄生虫感染,包括各种寄生虫导致的肠道感染、肺部寄生虫感染和肝脏寄生虫感染等。
该药物适用于多种动物,包括家畜、家禽和宠物等。
本文将详细介绍芬苯达唑的作用机制、临床应用、副作用和注意事项等内容。
一、芬苯达唑的作用机制芬苯达唑属于苯并咪唑类化合物,通过影响寄生虫的能量代谢和蛋白质合成来达到杀灭寄生虫的效果。
具体来说,芬苯达唑能够作用于寄生虫的线粒体微管系统,干扰线粒体分裂和复制,导致寄生虫死亡。
此外,芬苯达唑还能抑制寄生虫对葡萄糖的吸收和利用,从而降低对寄生虫产生的能量供应,最终导致寄生虫死亡。
二、芬苯达唑的临床应用芬苯达唑广泛应用于动物的寄生虫感染防治。
以下是一些常见的临床应用情况:1. 大型家畜:芬苯达唑可用于治疗或预防家畜(如牛、马、猪和羊等)的肠道寄生虫感染,如回肠蚴、细粒棘球蚴和蛇状肾蚴等。
通常以口服给药的形式给予动物,剂量根据动物种类和体重而定。
2. 家禽:芬苯达唑可用于治疗或预防家禽(如鸡、鸭和鹅等)的肠道寄生虫感染。
常见的肠道寄生虫包括绦虫、蛔虫和异尖线虫等。
可将芬苯达唑加入食物或水中,以确保动物摄入足够的药物。
3. 宠物:芬苯达唑也可用于宠物(如狗、猫和兔子等)的寄生虫感染治疗。
常见的寄生虫感染包括绦虫、蛔虫和蚯蚓等。
一般建议与兽医咨询后,按照指导剂量和给药方式进行用药。
4. 其他动物:芬苯达唑还可用于其他动物的寄生虫感染的治疗和预防,如鱼类、爬行动物和鸟类等纲目。
值得注意的是,对于不同动物种类和不同寄生虫感染,芬苯达唑的剂量和给药方式可能略有差异。
因此,在使用芬苯达唑之前,建议与兽医咨询或按照药物使用说明进行操作。
三、芬苯达唑的副作用芬苯达唑在正常剂量下通常是安全的,但在个别情况下,可能会出现一些副作用。
以下是一些常见的副作用:1. 消化系统反应:芬苯达唑可能导致食欲不振、恶心、呕吐、腹泻或便秘等消化系统反应。
成品检验操作规程

成品检验操作规程目录1 安乃近注射液成品检验操作规程 B.ZL.JY.C.00.0012 盐酸利多卡因注射液成品检验操作规程 B.ZL.JY.C.00.0023 芬苯达唑粉成品检验操作规程 B.ZL.JY.C.00.0034 烟酸诺氟沙星可溶性粉成品检验操作规程 B.ZL.JY.C.00.0045 三子散成品检验操作规程 B.ZL.JY.C.00.0056 健胃散成品检验操作规程 B.ZL.JY.C.00.0067 海南霉素钠预混剂成品检验操作规程 B.ZL.JY.C.00.0078 磷酸泰乐菌素-磺胺二甲嘧啶预混剂成品检验操作规程 B.ZL.JY.C.00.0089 氟苯尼考溶液成品检验操作规程 B.ZL.JY.C.00.00910 地克珠利溶液成品检验操作规程 B.ZL.JY.C.00.01011 稀戊二醛溶液成品检验操作规程 B.ZL.JY.C.00.01112 苯扎溴铵溶液成品检验操作规程 B.ZL.JY.C.00.012北京生安药业有限公司GMP 管理文件一、目 的:为规范芬苯达唑粉的测定方法和操作要求,特制定本操作规程。
二、标准依据:芬苯达唑粉质量标准。
三、适用范围:适用于本品的检验操作。
四、责 任 者:质控部经理、检验员。
五、正 文:本品为芬苯达唑与碳酸钙配制而成。
含芬苯达唑(C 15H 13N 3O 2S)应为标示量的93.0%~107.0%。
【鉴别】 1、仪器:752型紫外可见分光光度计 2、试剂与试液: 甲醇3、操作方法:取本品,加甲醇制成每1毫升中含芬苯达唑约15微克的溶液,滤过;取滤液,按《紫外分光光度法操作规程》进行测定。
4、判断标准:在218+2nm 与294+2nm 的波长处有最大吸收。
【检查】 干燥失重:1、仪器:101-1A 型干燥箱、电子天平(感量0.1mg )、干燥器(普通)、扁形称量瓶。
2、操作方法:取本品,按《干燥失重测定法操作规程》在105℃干燥至恒重。
芬苯达唑可作为中度微管去稳定剂,通过调节多种细胞途径导致癌细胞死亡

芬苯达唑可作为中度微管去稳定剂,通过调节多种细胞途径导致癌细胞死亡已经临床批准或经过实验测试的癌症以外的病症但被发现具有以前未被认识的对恶性细胞的细胞毒性的药物可以作为适合的抗癌候选物。
N-(6-苯基硫烷基-1H-苯并咪唑-2-基)氨基甲酸甲酯[Fenbendazole,FZ],苯并咪唑化合物,是一种安全且廉价的驱虫药,具有有效的抗增殖活性。
在我们早期的工作中,我们报道了FZ的有效生长抑制活性,部分是由蛋白酶体功能的损害引起的。
在这里,我们显示FZ表现出对哺乳动物微管蛋白的中等亲和力,并且在微摩尔浓度下对人癌细胞发挥细胞毒性。
同时,它引起p53的线粒体易位并有效抑制葡萄糖摄取,GLUT转运蛋白以及己糖激酶(HK II)的表达- 己糖酶(HK II)- 大多数癌细胞茁壮成长的关键糖酵解酶。
当小鼠口服给药时,它阻断了nu / nu小鼠模型中人异种移植物的生长。
结果与我们早期的数据一起表明,FZ是一种新的微管干扰剂,具有抗肿瘤活性,可以作为潜在的治疗剂进行评估,因为它对多种细胞途径有效,可有效消除癌细胞。
微管在细胞分裂,运动,细胞内运输中的重要性以及它们根据环境调节细胞形状的作用使其成为抗癌治疗最成功的靶标之一。
扰乱微管动力学的药物已被广泛用于癌症治疗1,2,3,4。
考虑到有丝分裂剂在癌症治疗中的相对成功,微管可被称为迄今为止鉴定的最佳癌症靶标之一5。
微管靶向剂可大致分为两大类。
第一类由微管去稳定剂组成,其抑制微管聚合。
这类抗有丝分裂药物包括几种化合物,例如长春花生物碱(长春碱,长春新碱,长春瑞滨,长春地辛,长春氟宁),雌莫司汀,秋水仙碱和combretastatin,它们在临床上使用或正在进行癌症治疗的临床研究。
第二类由微管稳定剂组成。
这些药物包括紫杉醇,多西紫杉醇,埃坡霉素和discodermolide6。
在分裂细胞中用这两类药物破坏微管蛋白和微管动力学的结果是中期停滞和诱导细胞凋亡。
芬苯达唑(N-(6-苯基硫烷基-1H-苯并咪唑-2-基)氨基甲酸甲酯)是广谱苯并咪唑驱虫剂,被批准用于许多动物物种7。
芬苯达唑粉(驱虫药)

芬苯达唑粉(驱虫药)
【兽药名称】芬苯达唑粉
【主要成分】芬苯达唑
【适应症】用于畜禽线虫病和绦虫病,可驱杀各种体内外寄生虫,并能提高饲料报酬,促进生长;主要驱杀:
1、牛、羊、猪蛔虫、红色圆线虫、蓝氏类圆线虫、畜毛首线虫、后圆线虫、食道口线虫、有齿冠尾线虫成虫及幼虫、对肠道内旋毛虫、畜血虱和疥螨也有良好的驱杀作用。
2、牛羊肝片吸血虫血矛线虫、奥斯特线虫、古柏线虫、毛圆线虫、圆形线虫、仰口线虫、细颈线虫、毛首线虫、食道口线虫、网尾线虫及夏伯特线虫成虫和幼虫、对节肢动物如蝇蛆(牛皮蝇、蚊皮蝇、羊狂蝇)、螨(牛疥螨、羊疥螨)和虱(牛腭虱、牛血虱和绵羊腭虱)等很有效,对被粪便中繁殖的蝇也极有效。
各种绦虫、吸虫,须连续用药5天以上。
3、对家禽线虫如鸡蛔虫和封闭毛细线虫以及家禽寄生的节肢动物如膝螨等均有高效驱杀作用。
4、本品对肾虫引起的母畜不发情、屡配不孕、尿液呈白色浑浊伴有线状分泌物有特效。
【用法用量】
1、内服使用:每公斤体重服用本品马、牛、羊、0.05~0.075克,禽0.1~0.5克。
2、牛羊大群:本品100g用于1000kg体重牛羊,连用3~5天,预
防量减半使用。
【使用对象】牛、羊等畜。
【包装规格】500克*20袋/件
【有效时间】2年
【贮藏方法】密闭、在阴凉、干燥处保存。
【郑重承诺】九鼎农牧集团兽药官网所售兽药全部执行国家兽药标准,每包(瓶)均进入国家兽药二维码可追溯系统,如果发现九鼎农牧集团官网有假兽药销售,厂家将以10倍金额进行赔偿,请广大客户放心购买使用。
阿苯达唑片质量标准

阿苯达唑片质量标准阿苯达唑片是一种常用的药物,用于治疗消化道溃疡和胃食管反流病。
作为一种重要的药物,其质量标准对于药品的安全性和疗效起着至关重要的作用。
本文将对阿苯达唑片的质量标准进行详细介绍,以期为相关行业提供参考。
一、外观和性状。
阿苯达唑片应为白色或类白色结晶性粉末,无明显气味,味微苦。
在外观上应无异物,无明显不均匀现象。
二、含量测定。
阿苯达唑片的含量应符合国家药典规定,一般来说,含量应在98%至102%之间。
含量测定是保证药物疗效的重要指标,对于药品的稳定性和疗效具有重要意义。
三、溶出度。
阿苯达唑片的溶出度是指在一定时间内,药物溶出的百分比。
溶出度合格范围应在75%至90%之间。
溶出度的合格与否直接关系到药物的释放速度和生物利用度,是药物质量的重要评价指标。
四、纯度。
阿苯达唑片的纯度应符合国家药典规定,杂质含量应在规定范围内。
纯度是药物质量的重要保证,直接关系到药物的安全性和稳定性。
五、微生物限度。
阿苯达唑片的微生物限度应符合国家药典规定,微生物总数、大肠埃希氏菌、金黄色葡萄球菌等指标应符合规定范围。
微生物限度是保证药物无菌的重要指标,对于药品的安全性具有重要意义。
六、贮存。
阿苯达唑片在贮存过程中,应避光、密封、干燥,贮存温度不得超过25摄氏度。
贮存条件的合理与否直接关系到药物的稳定性和有效期,对于药品的质量具有重要影响。
七、包装。
阿苯达唑片的包装应符合国家药典规定,应具有防潮、防污染、防光等功能。
合格的包装能够有效保护药物,延长其有效期,对于药品的质量具有重要作用。
总结:阿苯达唑片作为一种重要的药物,其质量标准对于药品的安全性和疗效具有重要的意义。
各项质量指标的合格与否直接关系到药品的质量和疗效,因此在生产和质量控制过程中,应严格按照国家药典的规定进行质量标准的执行和监控,确保阿苯达唑片的质量符合国家标准,为患者的用药安全提供保障。
中国与美国、日本、欧盟和国际食品法典委员会关于禽类产品中兽药最大残留限量标准的对比

江苏农业学报(JiangsuJ.ofAgr.Sci.)ꎬ2021ꎬ37(3):754 ̄762http://jsnyxb.jaas.ac.cn陈晋元ꎬ贺兆源ꎬ卢㊀阳ꎬ等.中国与美国㊁日本㊁欧盟和国际食品法典委员会关于禽类产品中兽药最大残留限量标准的对比[J].江苏农业学报ꎬ2021ꎬ37(3):754 ̄762.doi:10.3969/j.issn.1000 ̄4440.2021.03.027中国与美国㊁日本㊁欧盟和国际食品法典委员会关于禽类产品中兽药最大残留限量标准的对比陈晋元1ꎬ2ꎬ㊀贺兆源1ꎬ2ꎬ㊀卢㊀阳1ꎬ2ꎬ㊀谢恺舟1ꎬ2ꎬ㊀张跟喜1ꎬ2ꎬ㊀张㊀涛1ꎬ2ꎬ㊀戴国俊1ꎬ2(1.扬州大学动物科学与技术学院ꎬ江苏扬州225009ꎻ2.教育部农业与农产品安全国际合作联合实验室ꎬ江苏扬州225009)收稿日期:2020 ̄09 ̄07基金项目:国家现代农业产业技术体系专项(CARS ̄41 ̄G23)ꎻ江苏高校优势学科建设工程资助项目(PAPD)ꎻ扬州大学高端人才支持计划项目(201801)作者简介:陈晋元(1997-)ꎬ男ꎬ江苏淮安人ꎬ硕士研究生ꎬ主要从事畜产品品质与安全研究ꎮ(E ̄mail)1427550688@qq.com通讯作者:谢恺舟ꎬ(E ̄mail)yzxkz168@163.com㊀㊀摘要:㊀旨在对中国关于禽类产品中兽药最大残留限量的新旧标准进行对比并将新标准与美国㊁日本等发达国家以及国际组织关于禽类产品中兽药最大残留限量标准进行对比ꎮ结果表明ꎬ中国禽类产品中兽药的最大残留限量新标准与旧标准相比ꎬ内容上已经更为完善ꎬ与国外的差距逐渐缩小ꎮ通过对比研究发现了中国标准的不足之处ꎬ并提出相关建议ꎬ以期为进一步完善中国禽类产品中兽药的最大残留限量标准提供参考ꎮ关键词:㊀兽药ꎻ最大残留限量标准ꎻ禽类产品中图分类号:㊀S859.84㊀㊀㊀文献标识码:㊀A㊀㊀㊀文章编号:㊀1000 ̄4440(2021)03 ̄0754 ̄09Comparisonofthestandardsaboutthemaximumresiduelimitofveterina ̄rydrugsinpoultryproductsbetweenChinaandUSAꎬJapanꎬEuropeanUnionandCodexAlimentariusCommissionCHENJin ̄yuan1ꎬ2ꎬ㊀HEZhao ̄yuan1ꎬ2ꎬ㊀LUYang1ꎬ2ꎬ㊀XIEKai ̄zhou1ꎬ2ꎬ㊀ZHANGGen ̄xi1ꎬ2ꎬ㊀ZHANGTao1ꎬ2ꎬDAIGuo ̄jun1ꎬ2(1.CollegeofAnimalScienceandTechnologyꎬYangzhouUniversityꎬYangzhou225009ꎬChinaꎻ2.JointInternationalResearchLaboratoryofAgriculture&Agri ̄ProductSafetyꎬMinistryofEducationꎬYangzhou225009ꎬChina)㊀㊀Abstract:㊀Theaimofthisstudyistocomparetheoldandnewdomesticstandardsaboutthemaximumresiduelimitofveterinarydrugsinpoultryproductsꎬandtocomparethemaximumveterinarydrugresiduelimitinpoultryproductsbe ̄tweenthenewstandardandthestandardsoftheUnitedStatesꎬJapanandotherdevelopedcountriesandinternationalorgan ̄izations.TheresultsshowedthatꎬthecontentoftheChinesenewstandardaboutthemaximumresiduelimitofveterinarydrugsinpoultryproductswasimprovedcomparedwiththeoldstandardꎬandthegapbetweenChinesenewstandardandfor ̄eignstandardsgraduallynarrowed.Deficienciesofthedomesticstandardwerefoundthroughcomparativestudyꎬandrele ̄vantsuggestionswereproposedtoprovidereferenceforfurtherimprovementofthedomesticstandardaboutthemaximumresiduelimitofveterinarydrugsinpoultryproducts.Keywords:㊀veterinarydrugꎻmaximumresiduelimits(MRLs)standardꎻpoultryproducts㊀㊀兽药的使用会使畜禽产品中存在兽药原形及其代谢产物的残留ꎬ而食用含有残留兽药的畜禽产品会产生许多不良影响ꎬ危害人们的身体健康[1 ̄4]ꎬ如引起体内菌群失调㊁胃肠道感染[5]㊁过敏反应和变态反应等[6 ̄8]ꎬ并能产生致癌㊁致畸㊁致突变等作用[9 ̄14]ꎮ因此ꎬ制定兽药最大残留限量(Maximumresiduelimitsꎬ457MRLs)标准ꎬ并对动物性产品进行兽药残留量的检测是必不可少的流程ꎮ2019年9月6日发布的GB31650-2019«食品安全国家标准㊀食品中兽药最大残留限量»[15]自2020年4月1日开始实施ꎬ此标准将替代原农业部公告第235号«动物性食品中兽药残留最高限量»中的相关部分[16]ꎮ美国的兽药最大残留限量标准由美国食品药品监督管理局(FDA)管理并制定[17]ꎬ发布于美国联邦法规(CFR)第21卷第556部分[18]ꎮ日本的兽药最大残留限量标准由日本肯定列表及日本食品化学研究会制定ꎬ限量标准多且较严格[19]ꎮ欧盟在其发布的委员会法规(EU)No37㊁2010«关于动物源食品中药理学活性物质的最高残留限量及其分类»中规定了欧盟的兽药最大残留限量[20]ꎮ国际食品法典委员会(CodexAlimentariusCommis ̄sionꎬCAC)是由联合国粮食及农业组织(FAO)和世界卫生组织(WHO)共同建立ꎬ以保障消费者健康和确保食品贸易公平为宗旨的一个制定国际食品标准的政府间组织ꎬ其法典标准CX/MRL2-2018«食品中兽药残留的最大残留限量和风险管理建议»规定了禽类兽药最大残留限量[21]ꎮ本研究将中国的新标准(GB31650-2019«食品安全国家标准㊀食品中兽药最大残留限量»)[15]与美国㊁日本㊁欧盟和CAC等国家或国际组织关于禽类产品中兽药最大残留限量的标准进行对比ꎬ找出其中的区别及差距ꎬ以期为完善中国禽类产品中兽药最大残留限量标准和提高禽类产品质量安全及确保进出口贸易的正常进行提供参考数据ꎮ1㊀GB31650-2019中涉及禽类产品的兽药最大残留限量与原农业部公告第235号的对比㊀㊀原农业部于2002年发布的第235号公告中规定ꎬ可用于禽类食用动物且不需要标注最大残留限量的兽药共有71种ꎻ用于食用动物的兽药需要制定最大残留限量ꎬ其中与禽类产品相关的共有59种ꎻ根据质量标准㊁产品使用说明书规定可以用于食用动物ꎬ但不得检出兽药残留且与禽类相关的兽药共有8种[22]ꎮGB31650-2019«食品安全国家标准㊀食品中兽药最大残留限量»中规定ꎬ可用于禽类食用动物且不需要制定最大残留限量的兽药共有95种ꎻ用于食用动物ꎬ需要制定最大残留限量的兽药中与禽类产品相关的共有63种ꎻ可用于治疗食用动物ꎬ但不得在动物性食品中检出ꎬ且与禽类产品相关的兽药有8种ꎮ如图1所示ꎬ与原农业部公告第235号«动物性食品中兽药残留最高限量»相比ꎬGB31650-2019«食品安全国家标准㊀食品中兽药最大残留限量»中涉及禽类产品且有最大残留限量标准的兽药数量共增加了28种ꎬ说明中国对禽类产品的要求越来越严格ꎬ标准更加详细ꎮa:可用于禽类食用动物㊁不需要制定最大残留限量的兽药ꎻb:用于食用动物需要制定最大残留限量的兽药中与禽类产品相关的兽药ꎻc:可用于食用动物但不得检出兽药残留的与禽类产品相关的兽药ꎻA:原农业部公告第235号«动物性食品中兽药残留最高限量»ꎻB:GB31650-2019«食品安全国家标准㊀食品中兽药最大残留限量»ꎮ图1㊀中国新旧标准涉及禽类产品的兽药数量对比Fig.1㊀Comparisonofthequantityofveterinarydrugsinpoul ̄tryproductsbetweennewandoldstandardsinChina2㊀中国与美国关于禽类产品中兽药最大残留限量标准的对比㊀㊀通过对比发现ꎬ中国新国标中有最大残留限量的兽药种类与美国有最大残留限量的兽药种类存在差异ꎮ中国允许用于食用动物且规定了最大残留限量的兽药有104种ꎬ而美国有102种ꎬ说明中国与美国关于禽类产品中兽药最大残留限量的标准在兽药数量上已基本接轨ꎮGB31650-2019«食品安全国家标准㊀食品中兽药最大残留限量»中涉及禽类产品中最大残留限量的兽药共有63种ꎬ占所涉及兽药种类总数的60 6%ꎻ美国FDA标准中涉及禽类产品中最大残留限量的兽药共有44种ꎬ占有最大残留限量兽药种类总数的43.1%ꎮ中美均有最大限量规定的兽药有24种ꎬ其中中国与美国禽类产品中最大残留限量标准规定基本一致的兽药共有11种(表1)ꎻ中国禽类产品中最大残留限量标准严于美国的兽药有8种ꎬ557陈晋元等:中国与美国㊁日本㊁欧盟和国际食品法典委员会关于禽类产品中兽药最大残留限量标准的对比分别为尼卡巴嗪㊁新霉素㊁奥芬达唑/芬苯达唑㊁土霉素/四环素/金霉素㊁泰乐菌素㊁黏菌素㊁甲基盐霉素和盐霉素(表2)ꎻ中国禽类产品中最大残留限量标准宽松于美国的兽药有4种(表3)ꎬ分别为红霉素㊁大观霉素㊁链霉素和马度米星铵ꎮ表1㊀中美禽类产品中最大残留限量标准基本一致的兽药Table1㊀VeterinarydrugswithbasicallythesamemaximumresiduelimitstandardsforpoultryproductsinChinaandtheUnitedStates兽药名称㊀㊀中国家禽种类最大残留限量(MRLs)(mg/kg)美国家禽种类㊀最大残留限量(MRLs)(mg/kg)氨丙啉鸡㊁火鸡肌肉:0.50ꎻ肝脏㊁肾脏:1.00ꎻ鸡蛋:4.00鸡㊁火鸡㊁野鸡肌肉:0.50ꎻ肝脏㊁肾脏:1.00ꎻ全蛋:4.00ꎻ蛋黄:8.00杆菌肽禽可食用组织㊁蛋:0.50鸡肌肉:0.50地克珠利家禽肌肉:0.50ꎻ肝脏:3.00ꎻ肾脏:2.00鸡肌肉:0.50ꎻ肝脏:3.00ꎻ皮脂:1.00庆大霉素鸡㊁火鸡可食用组织:0.10鸡㊁火鸡可食用组织(鸡蛋除外):0.10拉沙洛西鸡㊁火鸡肝脏㊁火鸡皮脂:0.40ꎻ鸡皮脂:1.20鸡㊁火鸡肝脏㊁火鸡皮脂:0.40ꎻ鸡皮脂:1.20磺胺二甲嘧啶家禽肌肉㊁脂肪㊁肝脏㊁肾脏:0.10鸡㊁火鸡可食用组织(不含鸡蛋):0.10癸氧喹酯鸡肌肉:1.00ꎻ可食用组织:2.00鸡肌肉:1.00ꎻ其他可食用组织(不含鸡蛋):2.00氯羟吡啶鸡㊁火鸡肌肉:5.00ꎻ肝脏㊁肾脏:15.00鸡㊁火鸡肌肉:5.00ꎻ肝脏㊁肾脏:15.00赛杜霉素鸡肌肉:0.13ꎻ肝脏:0.40鸡肌肉:0.13ꎻ肝脏:0.40氯苯胍鸡皮脂:0.20ꎻ其他可食用组织(不含鸡蛋):0.10鸡皮脂:0.20ꎻ其他可食用组织(不含鸡蛋):0.10乙氧酰胺苯甲酯鸡肌肉:0.50ꎻ肝脏㊁肾脏:1.50鸡肌肉:0.50ꎻ肝脏㊁肾脏:1.50表2㊀中国禽类产品中最大残留限量标准严于美国的兽药Table2㊀VeterinarydrugswithstrictermaximumresiduelimitstandardsforpoultryproductsinChinathanthoseintheUnitedStates兽药名称㊀㊀㊀㊀中国家禽种类㊀㊀最大残留限量(MRLs)(mg/kg)美国家禽种类㊀㊀最大残留限量(MRLs)(mg/kg)尼卡巴嗪鸡肌肉㊁肝脏㊁肾脏㊁皮脂:0.20鸡肝脏:52.00新霉素鸡肌肉㊁脂肪:0.50ꎻ肝脏:5.50ꎻ肾脏:9.00鸡可食用组织:1.00火鸡皮脂:7.20ꎻ肝脏:3.60ꎻ肌肉:1.20奥芬达唑/芬苯达唑家禽肌肉㊁皮脂㊁肾脏:0.05ꎻ肝脏:0.50ꎻ蛋:1.30鸡肝脏:5.20ꎻ蛋:1.80土霉素/四环素/金霉素家禽肌肉:0.20ꎻ肝脏:0.60ꎻ肾脏:1.20ꎻ蛋:0.40鸡㊁火鸡肌肉:2.00ꎻ肝脏:6.00ꎻ肾脏:12.00ꎻ鸡蛋:0.40(金霉素)泰乐菌素鸡㊁火鸡肌肉㊁脂肪㊁肝脏㊁肾脏:0.10鸡肌肉:0.20火鸡肝脏㊁肾脏㊁脂肪:0.20黏菌素鸡㊁火鸡肌肉㊁皮脂㊁肝脏:0.15ꎻ肾脏:0.20ꎻ蛋:0.30鸡未规定甲基盐霉素鸡肌肉㊁肾脏:0.015ꎻ皮脂㊁肝脏:0.05鸡皮脂:0.48盐霉素鸡肌肉:0.60ꎻ皮脂:1.20ꎻ肝脏:1.80鸡可食用组织(不含鸡蛋):未规定表3㊀中国禽类产品中最大残留限量标准宽松于美国的兽药Table3㊀VeterinarydrugswithloosermaximumresiduelimitstandardsforpoultryproductsinChinathanthoseintheUnitedStates兽药名称㊀㊀中国家禽种类㊀㊀最大残留限量(MRLs)(mg/kg)美国家禽种类㊀㊀㊀最大残留限量(MRLs)(mg/kg)红霉素鸡㊁火鸡肌肉㊁脂肪㊁肝脏㊁肾脏:0.10ꎻ鸡蛋:0.05鸡肌肉:0.125ꎻ蛋:0.025大观霉素鸡肌肉:0.50ꎻ脂肪㊁肝脏㊁蛋:2.00ꎻ肾脏:5.00鸡㊁火鸡可食用组织(不含鸡蛋):0.10链霉素鸡肌肉㊁脂肪㊁肝脏:0.60ꎻ肾脏:1.00鸡肾脏:2.00ꎻ可食用组织(不含鸡蛋):0.50马度米星铵鸡肌肉:0.24ꎻ皮㊁脂肪:0.48ꎻ肝脏:0.72鸡脂肪:0.38657江苏农业学报㊀2021年第37卷第3期3㊀中国与日本关于禽类产品中兽药最大残留限量标准的对比㊀㊀日本肯定列表制度及日本食品化学研究会规定了日本动物性食品中兽药的最大残留限量ꎬ研究发现ꎬ中国和日本均有的㊁涉及禽类产品中兽药最大残留限量标准的兽药有30种ꎬ其中中国与日本最大残留限量基本一致的兽药有11种ꎬ分别为氯唑西林㊁地克珠利㊁二氟沙星㊁苯唑西林㊁氯苯胍㊁大观霉素㊁泰妙菌素㊁甲氧苄啶㊁杆菌肽㊁新霉素和哌嗪(表4)ꎻ中国标准严于日本标准的兽药有7种ꎬ分别为阿维拉霉素㊁达氟沙星㊁尼卡巴嗪㊁沙拉沙星㊁红霉素㊁林可霉素和托曲珠利(表5)ꎻ日本标准严于中国标准的兽药有12种ꎬ分别为阿莫西林㊁氨苄西林㊁氨丙啉㊁癸氧喹酯㊁二硝托胺㊁盐霉素㊁赛杜霉素㊁螺旋霉素㊁甲砜霉素㊁替米考星㊁乙氧酰胺苯甲酯和泰乐菌素(表6)ꎮ在上述兽药中ꎬ中国标准规定在家禽产蛋期禁用的兽药有氯唑西林㊁二氟沙星㊁苯唑西林㊁甲氧苄啶㊁阿维拉霉素㊁达氟沙星㊁沙拉沙星和托曲珠利ꎬ但是日本肯定列表制度中并没有明确说明在产蛋期禁用的兽药ꎮ表4㊀中日禽类产品中最大残留限量标准基本一致的兽药Table4㊀VeterinarydrugswithbasicallythesamemaximumresiduelimitstandardsforpoultryproductsbetweenChinaandJapan兽药名称㊀中国家禽种类最大残留限量(MRLs)(mg/kg)㊀㊀日本家禽种类最大残留限量(MRLs)(mg/kg)㊀㊀氯唑西林家禽(产蛋期禁用)肌肉㊁脂肪㊁肝脏㊁肾脏:0.30家禽肌肉㊁脂肪㊁肝脏㊁肾脏:0.30地克珠利家禽肌肉:0.50ꎻ肝脏:3.00ꎻ肾脏:2.00家禽(鸭和火鸡除外)肌肉:0.50ꎻ脂肪:1.00ꎻ肝脏:3.00ꎻ肾脏:2.00二氟沙星家禽(产蛋期禁用)肌肉:0.30ꎻ皮脂:0.40ꎻ肝脏:1.90ꎻ肾脏:0.60家禽肌肉:0.30ꎻ脂肪:0.40ꎻ肝脏:2.00ꎻ肾脏:0.60苯唑西林家禽(产蛋期禁用)肌肉㊁脂肪㊁肝脏㊁肾脏:0.30家禽肌肉㊁脂肪㊁肝脏㊁肾脏:0.30氯苯胍鸡皮脂:0.20ꎻ其他可食用组织(不含鸡蛋):0.10鸡肌肉:0.10大观霉素鸡肌肉:0.50ꎻ脂肪㊁肝脏㊁蛋:2.00ꎻ肾脏:5.00家禽肌肉:0.50ꎻ肾脏㊁蛋:2.00ꎻ脂肪:0.30ꎻ肝脏:0.70泰妙菌素鸡肌肉㊁皮脂:0.10ꎻ肝脏㊁蛋:1.00家禽肌肉㊁脂肪㊁肾脏:0.10ꎻ蛋:1.00ꎻ肝脏:0.60火鸡肌肉㊁皮脂:0.10ꎻ肝脏:0.30甲氧苄啶家禽(产蛋期禁用)肌肉㊁皮脂㊁肝脏㊁肾脏:0.05家禽肌肉㊁脂肪㊁肝脏㊁肾脏:0.05杆菌肽家禽可食组织㊁蛋:0.50家禽肌肉㊁脂肪㊁肝脏㊁肾脏㊁蛋:0.50新霉素家禽肌肉㊁脂肪㊁蛋:0.50ꎻ肝脏:5.50ꎻ肾脏:9.00家禽(鸭㊁火鸡除外)肌肉㊁脂肪㊁肝脏㊁蛋:0.50ꎻ肾脏:8.00哌嗪鸡蛋:2.00家禽肌肉㊁脂肪㊁肝脏㊁肾脏:0.10ꎻ鸡蛋:2.00表5㊀中国禽类产品中最大残留限量标准严于日本的兽药Table5㊀VeterinarydrugswithstrictermaximumresiduelimitstandardsforpoultryproductsinChinathanthoseinJapan兽药名称㊀㊀中国家禽种类㊀㊀最大残留限量(MRLs)(mg/kg)㊀㊀日本家禽种类㊀㊀最大残留限量(MRLs)(mg/kg)㊀㊀阿维拉霉素鸡㊁火鸡(产蛋期禁用)肌肉㊁皮㊁脂㊁肾脏:0.20ꎻ肝脏:0.30鸡肌肉㊁脂肪㊁肝脏㊁肾脏:0.03其他家禽肌肉㊁脂肪㊁肝脏㊁肾脏:0.05达氟沙星家禽(产蛋期禁用)肌肉:0.20ꎻ脂肪:0.10ꎻ肝脏㊁肾脏:0.40家禽肌肉:0.20ꎻ脂肪:0.10ꎻ肝脏㊁肾脏:0.40尼卡巴嗪鸡肌肉㊁肝脏㊁肾脏㊁皮脂:0.20家禽肌肉㊁脂肪㊁肝脏㊁肾脏:0.50沙拉沙星鸡㊁火鸡(产蛋期禁用)肌肉:0.01ꎻ脂肪:0.02ꎻ肝脏㊁肾脏:0.08鸡㊁火鸡可食用内脏:0.08红霉素鸡㊁火鸡肌肉㊁脂肪㊁肝脏㊁肾脏:0.10ꎻ鸡蛋:0.05鸡肌肉㊁脂肪㊁肝脏㊁肾脏:0.05ꎻ蛋:0.09其他家禽肌肉㊁脂肪㊁肝脏㊁肾脏:0.20林可霉素家禽肝脏㊁肾脏:0.50ꎻ肌肉:0.20ꎻ脂肪:0.10鸡肌肉:0.20ꎻ脂肪:0.30ꎻ肝脏㊁肾脏:0.50ꎻ蛋:0.10其他家禽肌肉:0.10ꎻ脂肪:0.05ꎻ肝脏:0.30ꎻ肾脏:0.80托曲珠利家禽(产蛋期禁用)肌肉:0.10ꎻ皮脂:0.20ꎻ肝脏:0.60ꎻ肾脏:0.40鸡肌肉:0.90ꎻ脂肪:0.20ꎻ肝脏㊁肾脏:2.00ꎻ蛋:0.05其他家禽肌肉:0.30ꎻ脂肪:0.20ꎻ肝脏:0.80ꎻ肾脏:0.70757陈晋元等:中国与美国㊁日本㊁欧盟和国际食品法典委员会关于禽类产品中兽药最大残留限量标准的对比表6㊀中国禽类产品中最大残留限量标准宽松于日本的兽药Table6㊀VeterinarydrugswithloosermaximumresiduelimitstandardsforpoultryproductsinChinathanthoseinJapan兽药名称㊀㊀中国家禽种类㊀㊀最大残留限量(MRLs)(mg/kg)㊀㊀日本家禽种类㊀㊀最大残留限量(MRLs)(mg/kg)㊀㊀阿莫西林家禽肌肉㊁脂肪㊁肝脏㊁肾脏:0.05鸡肌肉㊁脂肪㊁肝脏㊁肾脏:0.02其他家禽肌肉㊁肝脏㊁肾脏:0.40ꎻ脂肪:0.05氨苄西林家禽肌肉㊁脂肪㊁肝脏㊁肾脏:0.05鸡肌肉㊁脂肪㊁肾脏:0.02ꎻ肝脏:0.03ꎻ蛋:0.01其他家禽肌肉㊁脂肪㊁肝脏㊁肾脏:0.05氨丙啉鸡㊁火鸡肌肉:0.50ꎻ肝脏㊁肾脏:1.00ꎻ蛋:4.00鸡肌肉㊁脂肪㊁肾脏㊁肝脏:0.03ꎻ蛋:5.00其他家禽肌肉㊁脂肪:0.05ꎻ肝脏㊁肾脏:1.00癸氧喹酯鸡肌肉:1.00ꎻ其他可食用组织:2.00鸡肌肉㊁肝脏㊁肾脏:0.10ꎻ脂肪:2.00二硝托胺鸡肌肉:3.00ꎻ脂肪:2.00鸡肌肉㊁肝脏:0.10ꎻ脂肪:2.00ꎻ肾脏:6.00火鸡肝脏㊁肾脏:6.00ꎻ肌肉:3.00其他家禽肌肉㊁脂肪:3.00ꎻ肝脏:4.00ꎻ肾脏:6.00盐霉素鸡肌肉:0.60ꎻ皮脂:1.20ꎻ肝脏:1.80鸡肌肉:0.10ꎻ脂肪:0.50ꎻ肝脏㊁肾脏:0.30其他家禽肌肉㊁脂肪:0.10ꎻ肝脏㊁肾脏:0.30赛杜霉素鸡肌肉:0.13ꎻ肝脏:0.40家禽肌肉:0.09ꎻ脂肪㊁肝脏:0.50ꎻ鸡肾脏:0.20螺旋霉素鸡肌肉:0.20ꎻ脂肪:0.30ꎻ肝脏:0.60ꎻ肾脏:0.80家禽肌肉㊁脂肪:0.10ꎻ肝脏㊁肾脏:1.00甲砜霉素家禽肌肉㊁肝脏㊁肾脏㊁皮脂:0.05鸡肌肉㊁肾脏:0.02ꎻ脂肪:0.04ꎻ肝脏:0.05替米考星鸡肌肉:0.15ꎻ皮脂:0.25ꎻ肝脏:2.40ꎻ肾脏:0.60家禽肌肉㊁脂肪:0.08ꎻ肝脏:1.00ꎻ肾脏:0.30火鸡肌肉:0.10ꎻ皮脂:0.25ꎻ肝脏:1.40ꎻ肾脏:1.20乙氧酰胺苯甲酯鸡肌肉:0.50ꎻ肝脏㊁肾脏:1.50鸡肌肉㊁脂肪㊁肝脏㊁肾脏:0.04泰乐菌素鸡㊁火鸡肌肉㊁脂肪㊁肝脏㊁肾脏:0.10ꎻ鸡蛋:0.30鸡肌肉㊁脂肪㊁肝脏㊁肾脏:0.04ꎻ蛋:0.204㊀中国与欧盟关于禽类产品中兽药最大残留限量标准的对比㊀㊀中国与欧盟涉及禽类产品中兽药最大残留限量规定基本一致的兽药有23种ꎬ分别为泰乐菌素㊁阿莫西林㊁氨苄西林㊁哌嗪㊁泰妙菌素㊁黏菌素㊁氯唑西林㊁青霉素㊁达氟沙星㊁多西环素(强力霉素)㊁氟苯尼考㊁卡那霉素㊁左旋咪唑㊁苯唑西林㊁口恶喹酸㊁螺旋霉素㊁磺胺类㊁甲砜霉素㊁托曲珠利㊁甲氧苄啶㊁泰万菌素㊁二氟沙星和恩诺沙星(表7)ꎻ中国标准严于欧盟标准的兽药有2种ꎬ分别为红霉素和沙拉沙星(表8)ꎻ中国标准宽松于欧盟标准的兽药有9种ꎬ分别为维吉尼亚霉素㊁土霉素/金霉素/四环素㊁林可霉素㊁氟苯达唑㊁氟甲喹㊁大观霉素㊁拉沙洛西(拉沙里菌素)㊁新霉素和替米考星(表9)ꎮ在上述兽药中ꎬ中国规定在家禽产蛋期禁用的有阿莫西林㊁氨苄西林㊁青霉素㊁达氟沙星㊁多西环素㊁氟苯尼考㊁卡那霉素㊁左旋咪唑㊁苯唑西林㊁口恶喹酸㊁磺胺类㊁甲砜霉素㊁托曲珠利㊁甲氧苄啶㊁二氟沙星㊁恩诺沙星㊁沙拉沙星㊁氟甲喹和替米考星等ꎬ但欧盟并无在家禽产蛋期禁用兽药的规定ꎮ5㊀中国与国际食品法典委员会(CAC)关于禽类产品中最大兽药残留限量标准的对比㊀㊀CAC标准是以科学为基础ꎬ在获得所有成员国一致同意的基础上制定出来的ꎮCAC成员国参照和遵循这些标准ꎬ既可以避免重复性工作ꎬ又可以节省大量人力和财力ꎬ而且有效地减少了国际食品贸易摩擦ꎬ促进了贸易的公平和公正ꎮCAC标准中涉及禽类产品中最大残留限量的兽药有25种ꎬ其中与中国一致的兽药有23种ꎬ分别为阿苯达唑㊁卑霉素(阿维拉霉素)㊁普鲁卡因青霉素㊁金霉素/土霉素/四环素㊁黏菌素㊁达氟沙星㊁溴氰菊酯㊁地克珠利㊁链霉素㊁红霉素㊁氟苯达唑㊁氟甲喹㊁左旋咪唑㊁林可霉素㊁莫能菌素㊁甲基盐霉素㊁尼卡巴嗪㊁沙拉沙星㊁大观霉素㊁螺旋霉素㊁磺胺二甲嘧啶㊁替米考星㊁泰乐菌素(表10)ꎮ由此看出ꎬ中国标准与CAC标准关于857江苏农业学报㊀2021年第37卷第3期禽类产品中有最大限量的兽药数量基本一致ꎬ差距在缩小ꎮCAC标准与中国标准有2种兽药存在差异ꎬ分别为拉沙洛西(钠)和新霉素(表11)ꎬ关于这2种兽药最大残留限量对应的家禽种类及食用组织数量ꎬCAC的规定均多于中国ꎮ在上述兽药中ꎬ中国规定家禽产蛋期禁用的兽药有卑霉素㊁普鲁卡因青霉素㊁达氟沙星㊁地克珠利㊁氟甲喹㊁左旋咪唑㊁沙拉沙星㊁磺胺二甲嘧啶和替米考星等ꎬ但CAC的标准中没有明确规定在家禽产蛋期禁止使用的兽药ꎮ表7㊀中国与欧盟关于禽类产品中最大残留限量标准基本一致的兽药Table7㊀VeterinarydrugswithbasicallythesamemaximumresiduelimitstandardsforpoultryproductsbetweenChinaandtheEuropeanU ̄nion兽药名称㊀㊀㊀中国家禽种类㊀㊀最大残留限量(MRLs)(mg/kg)㊀㊀欧盟家禽种类最大残留限量(MRLs)(mg/kg)㊀㊀泰乐菌素鸡㊁火鸡肌肉㊁脂肪㊁肝脏㊁肾脏:0.10ꎻ鸡蛋:0.30家禽肌肉㊁脂肪㊁肝脏㊁肾脏:0.10ꎻ鸡蛋:0.20阿莫西林家禽(产蛋期禁用)肌肉㊁脂肪㊁肝脏㊁肾脏:0.05家禽肌肉㊁脂肪㊁肝脏㊁肾脏:0.05氨苄西林家禽(产蛋期禁用)肌肉㊁脂肪㊁肝脏㊁肾脏:0.05家禽肌肉㊁脂肪㊁肝脏㊁肾脏:0.05哌嗪鸡蛋:2.00家禽鸡蛋:2.00泰妙菌素鸡肌肉㊁皮脂:0.10ꎻ肝脏㊁蛋:1.00鸡肌肉㊁皮脂:0.10ꎻ肝脏㊁蛋:1.00火鸡肌肉㊁皮脂:0.10ꎻ肝脏:0.30火鸡肌肉㊁皮脂:0.10ꎻ肝脏:0.30黏菌素鸡㊁火鸡肌肉㊁皮脂㊁肝脏:0.15ꎻ肾脏:0.20ꎻ鸡蛋:0.30家禽肌肉㊁脂肪㊁肝脏:0.15ꎻ肾脏:0.20ꎻ蛋:0.30氯唑西林家禽肌肉㊁脂肪㊁肝脏㊁肾脏:0.30家禽肌肉㊁脂肪㊁肝脏㊁肾脏:0.30青霉素家禽(产蛋期禁用)肌肉㊁肝脏㊁肾脏:0.05家禽肌肉㊁脂肪㊁肝脏㊁肾脏:0.05达氟沙星家禽(产蛋期禁用)肌肉:0.20ꎻ脂肪:0.10ꎻ肝脏㊁肾脏:0.40家禽肌肉:0.20ꎻ脂肪:0.10ꎻ肝脏㊁肾脏:0.40多西环素(强力霉素)家禽(产蛋期禁用)肌肉:0.10ꎻ皮脂㊁肝脏:0.30ꎻ肾脏:0.60家禽肌肉:0.10ꎻ皮脂㊁肝脏:0.30ꎻ肾脏:0.60氟苯尼考家禽(产蛋期禁用)肌肉:0.10ꎻ皮脂:0.20ꎻ肝脏:2.50ꎻ肾脏:0.75家禽肌肉:0.10ꎻ皮脂:0.20ꎻ肝脏:2.50ꎻ肾脏:0.75卡那霉素家禽(产蛋期禁用)肌肉㊁皮脂:0.10ꎻ肝脏:0.60ꎻ肾脏:2.50家禽肌肉㊁脂肪:0.10ꎻ肝脏:0.60ꎻ肾脏:2.50左旋咪唑家禽(产蛋期禁用)肌肉㊁脂肪㊁肾脏:0.01ꎻ肝脏:0.10家禽肌肉㊁脂肪㊁肾脏:0.01ꎻ肝脏:0.10苯唑西林家禽(产蛋期禁用)肌肉㊁脂肪㊁肝脏㊁肾脏:0.30家禽肌肉㊁脂肪㊁肝脏㊁肾脏:0.30口恶喹酸鸡(产蛋期禁用)肌肉:0.10ꎻ脂肪:0.05ꎻ肝脏㊁肾脏:0.15家禽肌肉:0.10ꎻ脂肪:0.05ꎻ肝脏㊁肾脏:0.15螺旋霉素鸡肌肉:0.20ꎻ脂肪:0.30ꎻ肝脏:0.60ꎻ肾脏:0.80鸡肌肉:0.20ꎻ皮脂:0.30ꎻ肝脏:0.40磺胺类家禽(产蛋期禁用)肌肉㊁脂肪㊁肝脏㊁肾脏:0.10家禽肌肉㊁脂肪㊁肝脏㊁肾脏:0.10甲砜霉素家禽(产蛋期禁用)肌肉㊁皮脂㊁肝脏㊁肾脏:0.05家禽肌肉㊁脂肪㊁肝脏㊁肾脏:0.05托曲珠利家禽(产蛋期禁用)肌肉:0.10ꎻ皮脂:0.20ꎻ肝脏:0.60ꎻ肾脏:0.40家禽肌肉:0.10ꎻ皮脂:0.20ꎻ肝脏:0.60ꎻ肾脏:0.40甲氧苄啶家禽(产蛋期禁用)肌肉㊁皮脂㊁肝脏㊁肾脏:0.05家禽肌肉㊁脂肪㊁肝脏㊁肾脏:0.05泰万菌素家禽皮脂㊁肝脏:0.05ꎻ鸡蛋:0.20家禽皮脂㊁肝脏:0.05二氟沙星家禽(产蛋期禁用)肌肉:0.30ꎻ皮脂:0.40ꎻ肝脏:1.90ꎻ肾脏:0.60家禽肌肉:0.30ꎻ皮脂:0.40ꎻ肝脏:1.90ꎻ肾脏:0.60恩诺沙星家禽(产蛋期禁用)肌肉㊁皮脂:0.10ꎻ肝脏:0.20ꎻ肾脏:0.30家禽肌肉㊁皮脂:0.10ꎻ肝脏:0.20ꎻ肾脏:0.30表8㊀中国禽类产品中最大残留限量标准严于欧盟的兽药Table8㊀VeterinarydrugswithstrictermaximumresiduelimitstandardsforpoultryproductsinChinathanthoseintheEuropeanUnion兽药名称中国家禽种类㊀㊀最大残留限量(MRLs)(mg/kg)㊀㊀欧盟家禽种类最大残留限量(MRLs)(mg/kg)㊀㊀红霉素鸡㊁火鸡肌肉㊁脂肪㊁肝脏㊁肾脏:0.10家禽肌肉㊁脂肪㊁肝脏㊁肾脏:0.20ꎻ蛋:0.15鸡蛋:0.05沙拉沙星鸡㊁火鸡(产蛋期禁用)肌肉:0.01ꎻ脂肪:0.02ꎻ肝脏㊁肾脏:0.08家禽皮脂:0.01ꎻ肝脏:0.10957陈晋元等:中国与美国㊁日本㊁欧盟和国际食品法典委员会关于禽类产品中兽药最大残留限量标准的对比表9㊀中国禽类产品中最大残留限量标准宽松于欧盟的兽药Table9㊀VeterinarydrugswithloosermaximumresiduelimitstandardsforpoultryproductsinChinathanthoseintheEuropeanUnion兽药名称㊀㊀㊀㊀中国家禽种类㊀㊀最大残留限量(MRLs)(mg/kg)㊀㊀欧盟家禽种类最大残留限量(MRLs)(mg/kg)㊀㊀维吉尼亚霉素家禽肌肉:0.10ꎻ皮脂㊁肾脏:0.40ꎻ肝脏:0.30家禽肌肉㊁肝脏:0.01ꎻ皮脂:0.03ꎻ肾脏:0.06土霉素/金霉素/四环素家禽肌肉:0.20ꎻ肝脏:0.60ꎻ肾脏:1.20ꎻ蛋:0.40家禽肌肉:0.10ꎻ肝脏:0.30ꎻ肾脏:0.60ꎻ蛋:0.20林可霉素家禽肌肉:0.20ꎻ脂肪:0.10ꎻ肝脏㊁肾脏:0.50家禽肌肉:0.10ꎻ脂肪㊁蛋:0.05ꎻ肝脏:0.50ꎻ肾脏:1.50氟苯达唑家禽肌肉:0.20ꎻ肝脏:0.50ꎻ蛋:0.40家禽肌肉㊁皮脂:0.05ꎻ肝脏㊁鸡蛋:0.40ꎻ肾脏:0.30氟甲喹鸡(产蛋期禁用)肌肉㊁肝脏:0.50ꎻ脂肪:1.00ꎻ肾脏:3.00家禽肌肉:0.40ꎻ皮脂:0.25ꎻ肝脏:0.80ꎻ肾脏:1.00大观霉素鸡肌肉:0.50ꎻ脂肪:2.00ꎻ肝脏:2.00ꎻ肾脏:5.00家禽肌肉:0.30ꎻ脂肪:0.50ꎻ肝脏:1.00ꎻ肾脏:5.00拉沙里菌素/拉沙洛西鸡皮脂:1.20ꎻ肝脏:0.40家禽皮脂㊁肝脏:0.10ꎻ肾脏:0.05ꎻ蛋:0.15ꎻ肌肉:0.02火鸡皮脂㊁肝脏:0.40新霉素家禽肌肉㊁脂肪㊁蛋:0.50ꎻ肝脏:5.50ꎻ肾脏:9.00家禽肌肉㊁脂肪㊁肝脏㊁蛋:0.50ꎻ肾脏:5.00替米考星鸡(产蛋期禁用)肌肉:0.15ꎻ皮脂:0.25ꎻ肝脏2.40家禽肌肉㊁皮脂:0.075ꎻ肾脏:0.25ꎻ肝脏:1.00火鸡肾脏:0.60ꎻ肌肉:0.10ꎻ皮脂:0.25ꎻ肝脏:1 40ꎻ肾脏:1.20表10㊀中国禽类产品中最大残留限量标准与国际食品法典委员会(CAC)基本一致的兽药Table10㊀VeterinarydrugswithbasicallythesamemaximumresiduelimitstandardsforpoultryproductsbetweenChinaandCodexAlimen ̄tariusCommission(CAC)兽药名称㊀㊀中国家禽种类㊀㊀最大残留限量(MRLs)(mg/kg)㊀㊀国际食品法典委员会家禽种类㊀㊀最大残留限量(MRLs)(mg/kg)㊀㊀阿苯达唑家禽肌肉㊁脂肪:0.10ꎻ肝脏㊁肾脏:5.00家禽肌肉㊁脂肪:0.10ꎻ肝脏㊁肾脏:5.00卑霉素(阿维拉霉素)鸡㊁火鸡(产蛋期禁用)肌肉㊁皮脂㊁肾脏:0.20ꎻ肝脏:0.30鸡㊁火鸡肌肉㊁皮脂㊁肾脏:0.20ꎻ肝脏:0.30普鲁卡因青霉素家禽(产蛋期禁用)肌肉㊁肝脏㊁肾脏:0.05鸡肌肉㊁肝脏㊁肾脏:0.05金霉素/土霉素/四环素家禽肌肉:0.20ꎻ肝脏:0.60ꎻ肾脏:1.20ꎻ蛋:0.40家禽肌肉:0.20ꎻ肝脏:0.60ꎻ肾脏:1.20ꎻ蛋:0.40黏菌素鸡㊁火鸡肌肉㊁皮脂㊁肝脏:0.15ꎻ肾脏:0.20鸡㊁火鸡肌肉㊁肝脏㊁脂肪:0.15ꎻ肾脏:0.20鸡蛋:0.30达氟沙星家禽(产蛋期禁用)肌肉:0.20ꎻ脂肪:0.10ꎻ肝脏㊁肾脏:0.40鸡肌肉:0.20ꎻ脂肪:0.10ꎻ肝脏㊁肾脏:0.40溴氰菊酯鸡肌肉㊁蛋:0.03ꎻ肝脏㊁肾脏:0.05ꎻ皮脂:0.50鸡肌肉㊁蛋:0.03ꎻ肝脏㊁肾脏:0.05ꎻ脂肪:0.50地克珠利家禽(产蛋期禁用)肌肉:0.50ꎻ皮脂:1.00ꎻ肝脏:3.00ꎻ肾脏:2.00家禽肌肉:0.50ꎻ皮脂:1.00ꎻ肝脏:3.00ꎻ肾脏:2.00链霉素鸡肌肉㊁脂肪㊁肝脏:0.60ꎻ肾脏:1.00鸡肌肉㊁肝脏㊁脂肪:0.60ꎻ肾脏:1.00红霉素鸡㊁火鸡肌肉㊁脂肪㊁肝脏㊁肾脏:0.10ꎻ蛋:0.05鸡肌肉㊁肝脏㊁肾脏㊁脂肪:0.10ꎻ蛋:0.05氟苯达唑家禽肌肉:0.20ꎻ肝脏:0.50ꎻ蛋:0.40家禽肌肉:0.20ꎻ肝脏:0.50ꎻ蛋:0.40氟甲喹鸡(产蛋期禁用)肌肉㊁肝脏:0.50ꎻ皮脂:1.00ꎻ肾脏:3.00鸡肌肉㊁肝脏:0.50ꎻ脂肪:1.00ꎻ肾脏:3.00左旋咪唑家禽(产蛋期禁用)肌肉㊁脂肪㊁肾脏:0.01ꎻ肝脏:0.10家禽肌肉㊁肾脏㊁脂肪:0.01ꎻ肝脏:0.10林可霉素家禽肝脏㊁肾脏:0.50ꎻ肌肉:0.20ꎻ脂肪:0.10鸡肌肉:0.20ꎻ肝脏㊁肾脏:0.50ꎻ脂肪:0.10莫能菌素鸡㊁火鸡㊁鹌鹑肌肉㊁肝脏㊁肾脏:0.01ꎻ脂肪:0.10鸡㊁火鸡㊁鹌鹑肌肉㊁肝脏㊁肾脏:0.01ꎻ脂肪:0.10甲基盐霉素鸡肌肉㊁肾脏:0.015ꎻ皮脂㊁肝脏:0.05鸡肌肉㊁肾脏:0.015ꎻ肝脏㊁脂肪:0.05尼卡巴嗪鸡肌肉㊁肝脏㊁肾脏㊁皮脂:0.20鸡肌肉㊁肝脏㊁肾脏㊁皮脂:0.20沙拉沙星鸡㊁火鸡(产蛋期禁用)肌肉:0.01ꎻ脂肪:0.02ꎻ肝脏㊁肾脏:0.08鸡㊁火鸡肌肉:0.01ꎻ肝脏㊁肾脏:0.08ꎻ脂肪:0.02大观霉素鸡肌肉:0.50ꎻ脂肪㊁肝脏㊁蛋:2.00ꎻ肾脏:5.00鸡肌肉:0.50ꎻ肝脏㊁脂肪㊁蛋:2.00ꎻ肾脏:5.00螺旋霉素鸡肌肉:0.20ꎻ脂肪:0.30ꎻ肝脏:0.60ꎻ肾脏:0.80鸡肌肉:0.20ꎻ肝脏:0.60ꎻ肾脏:0.80ꎻ脂肪:0.30磺胺二甲嘧啶鸡(产蛋期禁用)肌肉㊁肝脏㊁肾脏㊁脂肪:0.10家禽肌肉㊁肝脏㊁肾脏㊁脂肪:0.10替米考星鸡(产蛋期禁用)肌肉:0.15ꎻ皮脂:0.25ꎻ肝脏:2.40ꎻ肾脏:0.60鸡肌肉:0.15ꎻ肝脏:2.40ꎻ肾脏:0.60ꎻ皮脂:0.25火鸡肌肉:0.10ꎻ皮脂:0.25ꎻ肝脏:1.40ꎻ肾脏:1.20火鸡肌肉:0.10ꎻ肾脏:1.20ꎻ肝脏:1.40ꎻ皮脂:0.25泰乐菌素鸡㊁火鸡肌肉㊁脂肪㊁肝脏㊁肾脏:0.10鸡肌肉㊁肝脏㊁肾脏㊁皮脂:0.10ꎻ蛋:0.30067江苏农业学报㊀2021年第37卷第3期表11㊀中国禽类产品中最大残留限量标准与国际食品法典委员会(CAC)标准存在差异的兽药Table11㊀VeterinarydrugswithdifferentmaximumresiduelimitsforpoultryproductsbetweenChinesestandardandCodexAlimentariusCommission(CAC)standard兽药名称㊀㊀中国家禽种类最大残留限量(MRLs)(mg/kg)㊀㊀国际食品法典家禽种类㊀㊀最大残留限量(MRLs)(mg/kg)㊀㊀拉沙洛西(钠)鸡㊁火鸡肝脏㊁火鸡皮脂:0.40ꎻ鸡皮脂:1.20鸡㊁火鸡㊁鹌鹑㊁野鸡肌肉:0.40ꎻ肝脏:1.20ꎻ肾脏㊁皮脂:0.60新霉素鸡肌肉㊁脂肪:0.50ꎻ肝脏:5.50ꎻ肾脏:9.00鸡㊁鸭㊁火鸡肌肉㊁肝脏㊁脂肪㊁鸡蛋:0.50ꎻ肾脏:10.006㊀中国与美国㊁日本㊁欧盟㊁国际食品法典委员会禁用兽药的对比㊀㊀农业农村部公告第250号中规定ꎬ在食用动物中禁止使用的兽药共有19种[23]ꎮ美国FDA规定ꎬ在食用动物中禁止使用的兽药有11种ꎬ分别为氯霉素㊁二甲硝咪唑㊁异丙硝唑㊁其他硝基咪唑㊁呋喃唑酮㊁呋喃西林㊁磺胺类㊁氟喹诺酮类㊁糖肽类㊁保泰松㊁头孢菌素ꎮ其中禁用的磺胺类兽药中不包括磺胺二甲氧嘧啶㊁磺胺溴甲嘧啶和磺胺乙氧基哒嗪ꎬ禁用的头孢菌素中不包括头孢氨苄ꎮ日本肯定列表制度规定ꎬ在食用动物中禁用的兽药有17种ꎬ分别为2ꎬ4ꎬ5 ̄T㊁喹乙醇㊁呋喃它酮㊁蝇毒磷㊁氯霉素㊁氯丙嗪㊁呋喃西林㊁孔雀石绿㊁呋喃妥因㊁呋喃唑酮㊁甲硝唑㊁洛硝达唑㊁敌菌丹㊁二甲硝咪唑㊁丁酰肼㊁苯胺灵㊁卡巴氧ꎮ欧盟«食品中兽药活性物质最大残留限量»中规定ꎬ在食用动物中禁止使用的兽药有9种ꎬ分别为罗硝唑(洛硝达唑)㊁硝基呋喃类(包括呋喃唑酮)㊁甲硝哒(咪)唑㊁二甲硝咪唑(迪美唑)㊁氨苯砜㊁秋水仙素㊁氯丙嗪㊁氯霉素㊁马兜铃及其制剂ꎮCAC规定ꎬ在食用动物中禁用的兽药有13种ꎬ分别为卡巴氧㊁氯霉素㊁氯丙嗪㊁地美硝唑㊁呋喃唑酮㊁甲紫㊁异丙硝唑㊁孔雀石绿㊁甲硝唑㊁呋喃西林㊁喹乙醇㊁洛硝达唑㊁二苯乙烯ꎮ通过比较发现ꎬ中国和日本禁用的兽药数量较为一致ꎬ多于美国㊁欧盟和CACꎮ7㊀结论与展望民以食为天ꎬ随着社会的不断发展与科技的进步ꎬ人们的生活品质不断提高ꎬ人们越来越重视食品安全问题ꎬ禽肉在中国作为仅次于猪肉的第二大肉类消费品ꎬ在畜牧业中占有重要地位ꎬ但是在养殖过程中ꎬ由于对兽药的使用缺乏科学的认识ꎬ同时缺少先进的兽药监测手段ꎬ家禽养殖业存在滥用兽药的现象ꎬ这些原因共同导致中国禽肉产品的兽药残留问题[24]ꎮ中国在2019年9月6日发布ꎬ自2020年4月1日正式实施的GB31650-2019«食品安全国家标准㊀食品中兽药最大残留限量»ꎬ完善了中国现行的兽药使用规范和标准ꎬ但是本研究通过与美国㊁日本㊁欧盟等发达国家或国际组织的食品安全标准及中国于2002年发布的原农业部第235号公告对比发现ꎬ中国涉及禽类产品的兽药最大残留限量指标与美国㊁日本基本一致的各有11种ꎬ与欧盟㊁CAC基本一致的各有23种ꎬ说明中国禽类产品的兽药最大残留限量标准与美国㊁日本相比还有待提高ꎮ新国标的制定弥补了旧国标的不足ꎬ更加适合中国国情ꎬ建议新国标紧跟国际标准的变化及时进行修订和完善ꎬ以缩小与发达国家的差距ꎬ达到乃至超越发达国家的标准ꎬ确保禽产品满足进出口要求ꎮ参考文献:[1]㊀SHAIKHB.Analyticalmethodsforthedeterminationofveterinarydrugresiduesinfoodproductsofanimalorigin[J].JournalofAOACInternationalꎬ2011ꎬ94(2):359.[2]㊀WISER.Antimicrobialresistance:prioritiesforaction[J].TheJournalofAntimicrobialChemotherapyꎬ2002ꎬ49(4):585 ̄586. [3]㊀CHARUAUDLꎬJARDEEꎬJAFFREZICAꎬetal.Veterinaryphar ̄maceuticalresiduesfromnaturalwatertotapwater:salesꎬoccur ̄renceandfate[J].JournalofHazardousMaterialsꎬ2019ꎬ361:169 ̄186.[4]㊀DELATOURTꎬRACAULTLꎬBESSAIRETꎬetal.ScreeningofveterinarydrugresiduesinfoodbyLC ̄MS/MSbackgroundandchallenges[J].FoodAdditives&Contaminantsꎬ2018ꎬ35(4):633 ̄646.[5]㊀彭椒华.畜产品中常用兽药残留危害及检测方法[J].畜牧兽医科技信息ꎬ2019(12):175.[6]㊀LOPESRPꎬROCÍOCRꎬROBERTORGꎬetal.Developmentandvalidationofamulticlassmethodforthedeterminationofveter ̄inarydrugresiduesinchickenbyultrahighperformanceliquidchromatography ̄tandemmassspectrometry[J].Talantaꎬ2012ꎬ89:201 ̄208.167陈晋元等:中国与美国㊁日本㊁欧盟和国际食品法典委员会关于禽类产品中兽药最大残留限量标准的对比。
2017年版《兽药质量标准》休药期表格
同上
牛、羊35日。1、泌乳期禁用。2、阿维菌素对鱼、虾及其他水生生物有剧毒,残留药物的包装切勿污染水源。3、使用本品后,牛和羊的排泄物中因含阿维菌素,对降解厩类的有益昆虫有潜在损害作用。
环丙氨嗪预混剂(1%)
同上
鸡3日。本品药料浓度达25mg/kg时,可使饲料消耗量增加,达500mg/kg以上可使饲料消耗量减少,1000mg/kg以上长期喂养可能因摄食过少而死亡。
甲磺酸达氟沙星注射液
同上
猪25日。1、勿与含铁制剂在同一日内使用。2、孕畜及泌乳母畜禁用。
甲磺酸达氟沙星粉
同上
鸡5日。蛋鸡产蛋期禁用。
四环素片
同上
牛2日、猪10日鸡4日。1、成年反刍兽、马属动物和兔不宜内服。2、产蛋期和泌乳期禁用。
头孢氨苄注射液
同上
猪28日。1、本品应振摇均匀后使用。2、对头孢菌素、青霉素过敏动物慎用。
兽药名称
执行标准
停药期
过氧乙酸溶液
《兽药质量标准》2017年版
无。1、使用前将A、B液混合反应10小时后生成过氧乙酸消毒液。2、本品腐蚀性强,操作时戴上防护手套,避免药液灼伤皮肤,稀释时避免使用金属器具。3、当室温低于15℃时,A液会结冰,用温水融化后即可使用。
伊维菌素氧阿苯达唑粉
同上
羊35日。1、泌乳期禁用。2、母畜妊娠前期45日内慎用。
阿苯达唑颗粒
同上
牛14日,羊4日,猪7日,禽4日,弃奶期60日。1、泌乳期禁用。2、绵羊、兔等动物妊娠早期使用阿苯达唑,可能伴有至畸和胚胎毒性的作用。3、犬按50mg/kg每日2次用药,会逐渐产生厌食症。
阿苯达唑阿维菌素片
同上
牛、羊35日。1、泌乳期禁用。2、阿维菌素的毒性较伊维菌素稍强,敏感动物慎用。3、阿维菌素对光敏感,易被迅速氧化灭活,应避光保存。
进口兽药质量标准——2006版

目录土霉素注射液 (1)牛至油预混剂 (3)过硫酸氢钾复合物粉 (4)托曲珠利 (6)多拉菌素注射液 (8)伊维菌素注射液 (10)苄星氯唑西林乳房注入剂 (12)阿维拉霉素预混剂..............................................................................14,阿莫西林注射剂 (16)阿莫西林、克拉维酸钾注射液 (18)芬苯达唑粉 (20)非波罗尼喷剂 (21)非波罗尼滴剂 (23)非班太尔 (25)非班太尔片 (27)非班大尔颗粒 (28)苯扎氯铵溶液 (29)苯硫苯咪唑粉 (30)拉沙洛西钠预混剂 (32)林可霉素—新霉素乳房注入剂(泌乳期) (34)注射用头孢噻呋钠 (36)复方戊二醛溶液 (38)复方甲醛溶液 (40)复方阿莫西林乳房注入剂(泌乳期) (42)氟苯尼考 (45)氟苯尼考溶液 (47)氟苯尼考注射液 (49)氟苯尼考预混剂 (50)浓辛硫磷溶液 (51)癸氧喹酯 (53)癸氧喹酯预混剂 (55)氨基丁三醇前列腺素F2a注射液 (57)氨苄西林、苄星氯唑西林乳房注入剂(干乳期) (59)氨苄西林、苄星氯唑西林乳房注入剂(泌乳期) (61)恩诺沙星 (63)恩诺沙星溶液(0.5%) (66)莫能菌素预混剂 (68)泰妙菌素注射液附件 (70)盐酸头孢噻呋注射液 (72)黄体酮阴道缓试剂 (75)黄霉素预混剂 (78)酒石酸泰乐菌素可溶性粉 (80)酒石酸乙酰异戊酰泰乐菌素预混剂 (81)酒石酸乙酰异戊酰泰乐菌素可溶性粉 (84)酒石酸乙酰异戊酰泰乐菌素粉 (86)氯前列醇钠注射液 (88)硫酸新霉素预混剂 (90)碘酸混合溶液(15%) (91)赛拉菌素溶液 (92)磷酸泰乐菌素预混剂 (94)磷酸替米考星预混剂 (96)土霉素注射液Tumeisu zhusheyeOxytetracycline Injection本品为土霉素与α-吡咯烷酮等制成的灭菌水溶液。
芬苯达唑片对犬猫安全性影响

初始均重(kg/只)
2.52±0.71
2.74±0.50
结束均重(kg/只)
2.54±0.71
2.76±0.52
采食量和体重无影响遥 试验期间袁 试验犬猫精神状态及日常行为均与试验前后一
致袁 并未表现出腹泻尧 瘙痒尧 呕吐尧 便秘等现象遥 3 讨论
安全尧 高效尧 抗虫广谱等优点使芬苯达唑作为常见驱虫药 在动物驱虫中广泛受用遥 最新研究表明袁 300ppm 剂量连续饲 喂孔雀 21d袁 并未对其采食量尧 饲料转化率产生显著影响 [3]遥 此外袁 在狐尾稚研究上发现袁 100耀500ppm 芬苯达唑连续饲喂 21d袁 并不影响其采食量和饲料转化率袁 且在连续高浓度不间 断饲喂芬苯达唑情况下袁 芬苯达唑及其代谢物在组织中浓度相 对较低袁 不会对动物机体产生负面影响 [4]遥 另有报道表明袁 芬 苯达唑在体内溶解度不足 50%袁 摄入后大部分通过排便以原形 排除袁 并在 3耀7d 内可排净袁 因而袁 芬苯达唑对常见动物不会 产生安全性隐患 遥 [5,6] 4 小结
寄生虫不仅易导致动物营养不良袁 更易触发传染性疾病袁 药物驱虫因其便捷性成为畜禽及宠物驱虫的常用手段遥 作为常 见驱虫药袁 芬苯达唑具有抗虫性能广谱尧 高效低毒等优点袁 对 动物常见的线虫尧 绦虫及幼虫均有较好效果 [1]遥 研究表明袁 芬 苯达唑可在 3d 内将粪便寄生虫出现僵直尧 虫体内部结构消失 等明显效果 [2]遥 本公司前期研发出一种有效成分为芬苯达唑的 驱虫药 野贝乐芬冶袁 芬苯达唑有效含量为 100mg/片遥 前期试验 表明袁 在推荐量 25耀50mg/kgBW 范围内对犬猫有较好的驱虫效 果袁 有一定推广应用价值袁 但尚未开展 50mg/kgBW 安全性评 估袁 为确保宠物主放心使用袁 50mg/kgBW 使用量安全性评价成 为本研究主要目的遥 1 材料与方法 1.1 试验药物
芬苯达唑粉等兽药产品说明书和标签

附件2(略)附件3芬苯达唑粉等兽药产品说明书和标签一、芬苯达唑粉说明书和标签(一)芬苯达唑粉说明书兽用【兽药名称】通用名:芬苯达唑粉商品名:胖可求(Panacur)英文名:Fenbendazole Powder汉语拼音名:Fenbendazuo Fen【主要成分】芬苯达唑【性状】本品为白色或类白色粉末。
【药理作用】抗蠕虫药。
芬苯达唑具有广谱抗蠕虫作用。
在治疗剂量下,芬苯达唑对90%~100%未成熟和成熟寄生虫有效,对动物排出的虫卵具有杀灭作用。
对猪蛔虫的作用机理为干扰其能量代谢,同时也具有神经毒性作用。
芬苯达唑经内服给药后只有少量被消化道吸收,主要由粪便排出,尿中有少量。
【适应症】主要用于驱除或杀灭猪胃肠道线虫和绦虫。
【用法与用量】以芬苯达唑计。
内服:一次量,每1kg 体重,猪5mg。
【不良反应】按推荐剂量使用,未见不良反应。
【注意事项】禁与抗肝片吸虫药溴沙兰(Bromsalan)合用。
【休药期】猪3日。
【规格】100g :4g【包装】【贮藏】遮光,密闭保存。
【有效期】5 年【进口兽药注册证号】【生产企业】英特威国际有限公司法国生产厂(Intervet Production SA)(二)芬苯达唑粉标签样稿兽用【兽药名称】通用名:芬苯达唑粉商品名:胖可求(Panacur)英文名:Fenbendazole Powder汉语拼音名:Fenbendazuo Fen【主要成分】芬苯达唑【适应症】主要用于驱除或杀灭猪胃肠道线虫和绦虫。
【用法和用量】以芬苯达唑计。
内服:一次量,每1kg体重,猪5mg。
【休药期】猪3日。
【规格】100g;4g【包装】【生产日期】【生产批号】【有效期至】【贮藏】遮光、密闭保存。
【进口兽药注册证号】【生产企业】英特威国际有限公司法国生产厂(Intervet Production SA)二、氨基丁三醇前列腺素F2α注射液说明书和标签(一)氨基丁三醇前列腺素F2α注射液说明书兽用【兽药名称】通用名:氨基丁三醇前列腺素F2α注射液商品名:律胎素®注射液(LUTAL YSE® Sterile Solution)英文名:Prostaglandin F2α Tromethamine Injection汉语拼音:Anjidingsanchun qianliexiansu F2α zhushey e【主要成分】氨基丁三醇前列腺素F2α。
芬苯达唑-混悬液

芬苯达唑——混悬液(适用于小型犬,幼猫,以及怀孕犬猫)产品介绍本品主要为芬苯达唑白色口服驱虫混悬液,专为家庭成年和幼年犬猫设计,1ml含100mg芬苯达唑。
使用本品属广谱驱虫药适用于家庭犬猫胃肠道和呼吸道寄生虫幼虫和成虫阶段的感染。
成年犬猫:作用于成年犬猫胃肠道线虫和绦虫的感染:蛔虫(犬弓首蛔虫,猫弓首蛔虫,狮首弓蛔虫);钩口线虫;鞭虫;线虫;带绦虫。
幼犬幼猫:作用于幼年犬猫胃肠线虫感染和幼犬原生物引起的感染(贾第虫)。
怀孕母犬:适用于怀孕母犬,以减少出生幼犬经由母乳感染犬弓首蛔虫和钩口线虫的几率。
其他:亦能治疗成犬肺蠕虫(奥氏奥斯勒丝虫)或贾第虫和猫圆线虫感染。
犬猫常规治疗1ml/kg口服单次用量(=100mg芬苯达唑/公斤体重)使用剂量本品可混入食物或喂食后直接口服。
常规驱虫每年2-4次,如需反复驱虫(如犬舍),每次投药请间隔6至8周。
成年犬猫:一次口服1ml/kg(=100mg芬苯达唑/公斤体重)幼年犬猫(2周龄~6月龄):每天0.5ml/kg,连续用3天(=50mg芬苯达唑/公斤体重,连用3天)怀孕母犬:每天0.25ml/kg (=25mg芬苯达唑/公斤体重),从怀孕第40天开始使用,至产前2天停药(用药期约25天)怀孕母猫:一次口服1ml/kg(=100mg芬苯达唑/公斤体重)特殊寄生虫感染可加大剂量:常见寄生虫感染,或犬贾第虫感染,0.5ml/kg每天,连用3天。
犬肺蠕虫(奥氏奥斯勒丝虫)感染:0.5ml/kg每天,连用7天。
猫圆线虫:0.5ml/kg每天,连用3天苯并咪唑适用范围广且安全,即使超剂量使用也不太会引起副作用。
注意事项用后请即刻洗手。
请按准确的体重用药。
仅供动物使用,请放在儿童无法接触的地方。
无需冷藏保存,用前先摇匀。
使用时最好带上橡胶手套。
可与生活垃圾同样处理。
芬苯达唑片生产工艺规程

芬苯达唑片生产工艺规程目录1 产品概述2 处方依据3 工艺流程图4 制剂工艺过程及工艺条件5 原辅材料质量标准和检查方法6 中间产品质量标准和检查方法7 成品质量标准和检查方法8 包装规格、包装材料质量标准9说明书、产品文字说明和标志10 工艺要求11 设备一览表和重要设备生产能力12 技术安全与劳动保护13 劳动组织14 原辅料消耗定额15 包装材料消耗定额16 动力消耗定额17 综合利用与环境保护目的:制定本标准的目的是规范芬苯达唑片生产过程,对一定数量的成品所需的起始原辅料和包装材料,以及工艺、加工说明、技术参数、注意事项等进一步标准化。
适用范围:适用于芬苯达唑片生产全过程。
责任人:质量部部长、生产部部长、车间主任。
内容:1 产品概述1.1产品特点:1.1.1性状:本品为白色或类白色的片。
1.1.2作用与用途:用于兽禽线虫病和绦虫病。
1.1.3用法用量:内服:一次量,每1kg体重,马、牛、羊、猪5~7.5mg;犬、猫2550;禽10~50mg。
1.1.4 停药期:牛、羊21日,猪3日,弃奶期7日。
1.1.5 贮藏:避光,密闭,在干燥处保存。
1.1.6 有效期:二年。
1.2 处方来源:2 处方和依据2.1 处方芬苯达唑20Kg(折纯)糊精 10.0Kg淀粉浆(10%)适量(约用20Kg左右)硬脂酸镁5Kg 淀粉加至100Kg2.2 处方依据:2.3 批量:批量为处方量的整数倍。
说明:根据生产计划及混合设备生产能力确定批量,每批批量为处方量的整数倍。
3工艺流程图4、制剂操作过程及工艺条件4.1 领料备料4.1.1 各物料必须经质管部检验合格后方可使用。
原辅料生产商的变更应通过小样试验,必要时须通过验证。
4.1.2、根据生产指令单和领料单,从仓库领取原、辅料。
4.1.3、领料到生产线后,原辅料、内包装材料经拆外包装后通过传递窗进入相应的暂存室,外包装材料进入外包材贮存室,芬苯达唑等原辅料通过传递窗进入暂存室,并核对品名、规格、数量、批号,检查外观符合要求,填写领料记录。
芬苯达唑结构范文

芬苯达唑结构范文芬苯达唑(Fenbendazole)是一种广谱抗寄生虫药物,属于苯醌类抗寄生虫剂。
它可以用于家畜、家禽和宠物的寄生虫感染治疗,特别是对于线虫感染非常有效。
芬苯达唑的化学结构如下所示:结构式为:C15H13N3O2S芬苯达唑的分子式为C15H13N3O2S,相对分子质量为: 299.35 g/mol。
它是白色或类白色结晶性粉末,无臭,微溶于水,可溶于氯仿、甲醇、乙醇、醚类溶剂等有机溶剂。
芬苯达唑的化学结构包含苯环、吡唑环和咚核。
苯环是一种含有6个碳原子的芳香环,它的化学性质稳定。
吡唑环是由氮原子和碳原子组成的五元杂环,其能够与生物体内的酶或其他分子结合,从而干扰寄生虫的生物活性。
咚核是由氮原子和硫原子组成的五元杂环,具有去氢的苄环结构。
咚核能够与寄生虫体内的酶结合,从而抑制其生长和繁殖。
芬苯达唑通过影响寄生虫的能量代谢和DNA合成来发挥其抗寄生虫作用。
它能够干扰线虫寄生虫体内的微管功能,从而阻碍其细胞分裂和繁殖。
更重要的是,芬苯达唑能够通过抑制寄生虫体内线粒体呼吸链的功能来干扰能量代谢,从而导致寄生虫的死亡。
这使得芬苯达唑在治疗多种线虫感染中表现出优异的疗效。
值得一提的是,芬苯达唑在人体内的代谢和排泄过程较为迅速,通常不会引起明显的副作用。
然而,长期大剂量的使用可能会对肝脏和肾脏产生一定的毒性,并且在一些敏感物种中可能导致过敏反应。
因此,在使用芬苯达唑时,需要遵循医生或兽医的建议,按照正确的剂量和使用方法进行使用。
总结起来,芬苯达唑是一种广谱抗寄生虫药物,具有苯环、吡唑环和咚核的化学结构。
它通过阻碍寄生虫的细胞分裂、繁殖和能量代谢来发挥其抗寄生虫作用。
适当使用芬苯达唑可以有效治疗多种线虫感染,但需要注意正确用药剂量和使用方法,避免出现副作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一目的:建立芬苯达唑质量标准,采购及仓库人员按此标准采购、验收,保证产品质量。
二适用范围:适用芬苯达唑检验。
三职责:质保部对本标准执行负责。
四正文:
芬苯达唑
Fenbendazuo
Fenbendazole
C15H13N3O2S 299.35本品为〔5-﹙苯硫基﹚-1H-苯并咪唑-2-基〕氨基甲酸甲酯。
按干燥品计算,含C15H13N3O2S不得少于99.0%。
【性状】本品为白色或类白色粉末;无臭,无味。
本品在二甲基亚砜中溶解,在二甲基甲酰胺中略溶,在甲醇中微溶,在水中不溶;在冰醋酸中溶解。
吸收系数取本品,精密称定,在甲醇溶解并定量稀释制成每1ml中约含7ug的溶液,照
)紫外-可见分光光度法(附录26页),在295nm的波长处测定吸光度,吸收系数(E1%
1cm 应为475~505。
【鉴别】(1)取本品,加甲醇溶解并定量稀释制成每1ml中约含7ug的溶液,照紫外-可见分光光度法(附录26页)测定,在270~350nm的波长范围内测定,在295nm的波长处有最大吸收。
(2)本品的红外吸收图谱应与对照的图谱一致。
【检查】有关物质照高效液相色谱法(附录36页)测定。
色谱条件与系统适用性实验用十八烷基硅烷键合硅胶为填充剂;以甲醇-水-冰醋酸(30:70:1)为流动相A,以甲醇-水-冰醋酸(70:30:1)为流动相B;检测波长为280nm。
理论板数按芬苯达唑峰计算不低于2000,按下表进行线性梯度洗脱。
时间(分钟)流动相A(%)流动相B(%)
0 100 0
10 0 100
40 0 100
50 100 0
测定法取芬苯达唑50mg,置10ml量瓶中,加盐酸甲醇溶液(1→100)溶解并稀释至刻度;量取10ul注入液相色谱仪,记录色谱图;按峰面积归一化法计算,单个杂质不得过0.5%,各杂质的和不得过1.0%。
干燥失重取本品,在105℃干燥3小时,减失重量不得过1.0%(附录78页)。
炽灼残渣不得过0.1%(附录80页)。
重金属取炽灼残渣项下遗留的残渣,依法检查(附录75页第二法),含重金属不得过百万分之二十。
【含量测定】取本品约0.2g,精密称定,加冰醋酸20ml,微温使溶解,放冷,加结晶紫指示液1滴,用高氯酸滴定液(0.1mol/L)滴定至溶液显绿色,并将滴定结果用空白试验校正。
每1ml高氯酸滴定液(0.1mol/L)相当于29.94mg的C15H13N3O2S。
【类别】抗蠕虫药。
【贮藏】密闭保存。
【制剂】(1)芬苯达唑片(2)芬苯达唑粉
【依据】《中华人民共和国兽药典》2010年版一部第99页。
