高中化学方程式填空训练1~6
高中化学方程式大全(默写训练版)

高考总复习之高中化学方程式总结 化学 第一册第一章 卤素第一节 氯气1、NaCl 2Cl Na 22−−→−+点燃2、22CuCl Cl Cu −−→−+点燃 3、32FeCl 2Cl 3Fe 2−−→−+点燃 4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃6、523PCl Cl PCl →+7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()( 9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)(10、O H NaCl NaClO Cl NaOH 222++→+ 11、↑++−→−+∆2222Cl O H 2MnCl MnO HCl 4 12、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓) 13、2O HCl 2HClO 2+−−→−见光第二节 氯化氢 14、↑+→+HCl NaHSO SO H NaCl 442(浓) 15、↑+−→−+∆HCl SO Na NaCl NaHSO 424 16、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓)(14、15结合) 17、33HNO AgCl AgNO HCl +↓→+化学 第一册第一章 卤素第一节 氯气1、−−→−+点燃2Cl Na 2、−−→−+点燃2Cl Cu 3、−−→−+点燃2Cl Fe 4、−−−−→−+点燃(光照)22Cl H 5、−−→−+点燃2Cl P 6、→+23Cl PCl7、→+O H Cl 228、→+22Cl OH Ca )(9、→++O H CO ClO Ca 222)(10、→+2Cl NaOH 11、−→−+∆2MnO HCl 12、→+(浓)HCl KMnO 4 13、−−→−见光HClO 第二节 氯化氢 14、→+(浓)42SO H NaCl 15、−→−+∆NaCl NaHSO 4 16、−→−+∆(浓)42SO H NaCl (14、15结合) 17、→+3AgNO HCl18、33NaNO AgCl AgNO NaCl +↓→+19、33KNO AgCl AgNO KCl +↓→+20、↑++→+2223CO O H CaCl CaCO HCl 2第三节 氧化还原反应21、O H Cu H CuO 22+−→−+∆22、O H 2NO 4CO HNO 4C 2223+↑+↑→+ 23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++−→−+∆)((极稀)24、4243324SO H 15PO H 6P Cu 5O H 24CuSO 15P 11++→++25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓) 26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++−→−+∆)((极稀) 27、O H 31SO K SO Fe 9SO Cr SO H 31O Fe 6O Cr K 2423423424243722+++→++)()(28、↑+↑+→++2223CO 3N S K S C 3KNO 2第四节 卤族元素29、HF 2F H 22→+30、HBr 2Br H 22→+31、HI 2I H 22→+32、22Br NaCl 2Cl NaBr 2+→+33、22I KCl 2Cl KI 2+→+34、22I KBr 2Br KI 2+→+35、33NaNO AgBr AgNO NaBr +↓→+36、33KNO AgI AgNO KI +↓→+37、2Br Ag 2AgBr 2+−−→−光照第二章 摩尔 反应热第一节 摩尔18、→+3AgNO NaCl19、→+3AgNO KCl20、→+3CaCO HCl第三节 氧化还原反应21、−→−+∆2H CuO 22、→+3HNO C 23、−→−+∆(极稀)3HNO Zn 24、→++O H CuSO P 24 25、→+(浓)HCl KClO 3 26、−→−+∆(极稀)3HNO Mg 27、→++4243722SO H O Fe O Cr K28、→++S C KNO 3第四节 卤族元素29、→+22F H30、→+22Br H31、→+22I H32、→+2Cl NaBr33、→+2Cl KI34、→+2Br KI35、→+3AgNO NaBr36、→+3AgNO KI 37、−−→−光照AgBr 第二章 摩尔 反应热第一节 摩尔38、22CO O C →+39、↑+→+22H MgCl HCl 2Mg第二节 气体摩尔体积40、22H ZnCl HCl 2Zn +→+第三节 物质的量浓度41、O H 2SO Na SO H NaOH 224242+→+第四节 反应热42、kJ 5.393CO O C 22+−−→−+(气)(气)(固)点燃43、kJ 6.483O H 2O H 2222+→+(气)(气)(气) 44、kJ 6.571O H 2O H 2222+→+(液)(气)(气) 45、kJ 3.131H CO O H C 22-+−→−+∆(气)(气)(气)(固) 第三章 硫 硫酸第一节 硫46、S Cu S Cu 22−→−+∆47、FeS S Fe −→−+∆ 48、S H H S 22−→−+∆49、2CS C S −−→−+高温 50、22SO O S −−→−+点燃 51、O H 3SO K S K 2KOH 6S 32422++−→−+∆第二节 硫的氢化物和氧化物 52、↓+−→−∆S H S H 22 53、2222SO 2O H 2(O 3S H 2+−−→−+点燃足)54、↓+−−→−+S 2O H 2(O S H 2222点燃不足) 55、↓+−−→−+S 3O H 2SO S H 2222点燃 56、HBr 2S Br S H 22+↓→+38、→+2O C39、→+HCl Mg第二节 气体摩尔体积40、→+HCl Zn第三节 物质的量浓度41、→+42SO H NaOH第四节 反应热42、−−→−+点燃(气)(固)2O C 43、→+(气)(气)22O H 44、→+(气)(气)22O H 45、−→−+∆(气)(固)O H C 2 第三章 硫 硫酸第一节 硫46、−→−+∆S Cu 47、−→−+∆S Fe 48、−→−+∆2H S 49、−−→−+高温C S 50、−−→−+点燃2O S 51、−→−+∆KOH S 第二节 硫的氢化物和氧化物 52、−→−∆S H 2 53、−−→−+点燃足)(22O S H 54、−−→−+点燃不足)(22O S H 55、−−→−+点燃22SO S H 56、→+22Br S H57、↑+→+S H FeCl HCl 2FeS 2258、4224SO H CuS S H CuSO +↓→+59、HAc 2PbS S H PbAc 22+↓→+60、O H NaHS NaOH S H 22+→+61、O H S Na NaOH NaHS 22+→+62、O H 2S Na NaOH 2S H 222+→+(60、61结合) 63、HCl 2FeCl 2S FeCl 2S H 232++↓→+64、↑+→+S H FeSO FeS SO H 2442(稀) 65、3222SO H O H SO ⇔+66、3OV 22SO 2O SO 252∆−−→←+ 67、4223SO H O H SO →+68、↑++→+22424232SO O H SO Na SO H SO Na 69、O H SO Na NaOH 2SO 2322+→+70、32CaSO CaO SO →+71、O H CaSO OH Ca 2SO 2322+↓→+)(72、23232HSO Ca O H CaSO SO )(→++73、O H 2S 3S H 2SO 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++ 75、42222SO H HBr 2O H 2Br SO +→++ 76、42424422SO H 2SO K MnSO KMnO 2O H 2SO 5++→++第三节 硫酸的工业制法77、↑+−−→−+23222SO 8O Fe 2O 11FeS 4高温78、3OV 22SO 2O SO 252∆−−→←+ 57、→+HCl FeS58、→+S H CuSO 2459、→+S H PbAc 2260、→+NaOH S H 261、→+NaOH NaHS62、→+NaOH S H 2(60、61结合) 63、→+32FeCl S H64、→+FeS SO H (稀)42 65、⇔+O H SO 2266、∆−−→←+5222OV O SO 67、→+O H SO 2368、→+4232SO H SO Na69、→+NaOH SO 270、→+CaO SO 271、→+22)(OH Ca SO72、→++O H CaSO SO 23273、→+S H SO 2274、→++O H Cl SO 22275、→++O H Br SO 22276、→++422KMnO O H SO第三节 硫酸的工业制法77、−−→−+高温22O FeS 78、∆−−→←+5222OV O SO 79、4232SO H SO O H →+80、O H 2SO 2CO SO H 2C 22242+↑+↑−→−+∆(浓) 81、O H 2SO 3SO H 2S 2242+↑−→−+∆(浓) 82、O H 2SO PO H SO H P 224342+↑+−→−+∆(浓) 83、O H 2SO S SO H S H 22422++−→−+∆(浓) 84、O H 2SO CuSO SO H 2Cu 22442+↑+−→−+∆(浓) 85、HCl 2BaSO SO H BaCl 4422+↓→+ 86、NaCl 2BaSO SO Na BaCl 4422+↓→+ 87、NaCl 2BaCO CO Na BaCl 3322+↓→+ 88、↑++→+2223CO O H BaCl HCl 2BaCO 89、↑++→+222333CO O H NO Ba HNO 2BaCO )(90、↑++→+2223232CO O H S Na SO H CO Na 91、42232SO H 2O SO H 2→+92、42232SO Na 2O SO Na 2→+ 93、423CaSO 2O CaSO 2→+94、O H 6SO 3SO Fe SO H 6Fe 22234242+↑+−→−+∆)((浓) 95、O H SO Na SO Br SO H 2NaBr 22422242++↑+−→−+∆(浓) 96、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓) 97、O H 11C 12O H C 2SOH 11221142+−−−→−浓 第四章 碱金属第一节 钠98、O Na 2O Na 422→+99、222O Na O Na 2→+79、→+32SO O H80、−→−+∆(浓)42SO H C 81、−→−+∆(浓)42SO H S 82、−→−+∆(浓)42SO H P 83、−→−+∆(浓)422SO H S H 84、−→−+∆(浓)42SO H Cu 85、→+422SO H BaCl 86、→+422SO Na BaCl 87、→+322CO Na BaCl 88、→+HCl BaCO 3 89、→+33HNO BaCO 90、→+3232SO H CO Na 91、→+232O SO H 92、→+232O SO Na 93、→+23O CaSO 94、−→−+∆(浓)42SO H Fe 95、−→−+∆(浓)42SO H NaBr 96、−→−+∆(浓)42SO H NaCl 97、−−−→−42112211SOH O H C 浓 第四章 碱金属第一节 钠98、→+2O Na 99、→+2O Na100、NaCl 2Cl Na 22−−→−+点燃101、S Na S Na 22−−→−+研磨102、↑+→+22H NaOH 2O H 2Na 2103、↑++→++242242H SO Na OH Cu CuSO O H 2Na 2)(第二节 钠的氧化物104、NaOH 2O H O Na 22→+105、↑+→+2222O NaOH 4O H 2O Na 2106、3222CO Na CO O Na →+107、232222O CO Na 2CO 2O Na 2+→+108、O H NaCl 2HCl 2O Na 22+→+109、↑++→+2222O O H 2NaCl 4HCl 4O Na110、O H CO NaCl 2HCl 2CO Na 2232+↑+→+ 111、O H CO NaCl HCl NaHCO 223+↑+→+ 112、O H CO CO Na NaHCO 222323+↑+−→−∆113、O H CO Na NaOH NaHCO 2323+−→−+∆ 114、O H 2CO Na CaCO OH Ca NaHCO 2232323++↓→+(少量))( 115、O H NaOH CaCO OH Ca NaHCO 2323++↓→+(足量))( 116、NaCl 2BaCO BaCl CO Na 3232+↓→+117、NaCl 2CaCO CaCl CO Na 3232+↓→+ 118、O H 2CO 2CaCl HCl 2HCO Ca 22223+↑+→+)(119、O H 2CO Na CaCO NaOH 2HCO Ca 232323++↓→+)(120、O H SO NaCl HCl NaHSO 223+↑+→+第三节 碱金属元素100、−−→−+点燃2Cl Na101、−−→−+研磨S Na 102、→+O H Na 2103、→++42CuSO O H Na第二节 钠的氧化物104、→+O H O Na 22105、→+O H O Na 222106、→+22CO O Na107、→+222CO O Na108、→+HCl O Na 2109、→+HCl O Na 22110、→+HCl CO Na 32111、→+HCl NaHCO 3 112、−→−∆3NaHCO 113、−→−+∆NaOH NaHCO 3 114、→+(少量))(23OH Ca NaHCO 115、→+(足量))(23OH Ca NaHCO 116、→+232BaCl CO Na117、→+232CaCl CO Na118、→+HCl HCO Ca 23)(119、→+NaOH HCO Ca 23)(120、HCl NaHSO +3第三节 碱金属元素121、O Li 2O Li 422−−→−+点燃122、22KO O K −−→−+点燃123、MX 2X M 22→+(M 表示氧族元素,X 代表卤族元素) 124、MH 2H M 22→+125、↑+→+22H MOH 2O H 2M 2 第五章 物质结构 元素周期律本章内容、性质特殊,所有化学反应方程式均融在其他章节中。
(完整版)高中化学方程式书写练习

1. 碳酸氢铵受热分解2. 氯气与水反应3. 将二氧化氮和氧气的混合气体通入水中4. 硅与氢氧化钠溶液反应5. 硫与铜反应6. 二氧化硅与氢氟酸反应7. 硫酸氢钠在水中电离8. 乙烯与溴化氢反应9. 苯的硝化反应10. 实验室制甲烷高中化学方程式书写练习(二)1. 硫化氢气体与氯化铁溶液反应2. 氧化铝与烧碱溶液反应3. 二氧化硫与硫化氢反应4. 氯气与铜反应5. 硫与浓硫酸反应6. 过氧化钠与水反应7. 红磷与白磷的相互转化8. 苯与液溴反应9. 乙醇的消去反应10. 乙酸甲酯的水解高中化学方程式书写练习(三)1. 铝与烧碱溶液反应2. 氮气与镁反应3. 氨气与氯化氢反应4. 氧气与臭氧的转化5. 氧化钠与盐酸反应6. 溴化银分解7. 二氧化硅与碳反应8. 实验室制乙炔9. 苯的燃烧10. 由甲苯制取TNT1. 实验室制氯气2. 浓硝酸分解3. 磷与少量氯气反应4. 二氧化硅与碳酸钙反应5. 氟气与水反应6. 过氧化钠与二氧化碳反应7. 往氯化铝溶液中滴入过量的烧碱溶液8. 乙烯与水反应9. 制取聚氯乙烯10.苯酚钠溶液与二氧化碳反应高中化学方程式书写练习(五)1. 铁与稀硝酸反应2. 硫化氢与浓硫酸反应3. 二氧化氮与水反应4. 镁与二氧化碳反应5. 往偏铝酸钠溶液中滴入少量盐酸6. 二氧化硅与氢氧化钠反应7. 铜与氯化铁溶液反应8. 乙烯与氢气反应9. 苯酚与氢氧化钠反应10. 乙醛的银镜反应高中化学方程式书写练习(六)1. 将过量的二氧化碳通入偏铝酸钠溶液中2. 黄铁矿与氧气反应3. 硅与氢氟酸反应4. 过氧化钠与盐酸反应5. 一氧化氮与氧气反应6. 电解饱和食盐水7. 铝与氧化铁反应8. 溴乙烷与氢氧化钠溶液反应9. 乙醛与氢气反应10. 淀粉的水解1. 二氧化硫与氧气反应2. 工业上制漂白粉3. 将过量盐酸滴入偏铝酸钠溶液中4. 氨的催化氧化5. 电解熔融氯化钠6. 将氯气和二氧化硫的混合气体通入水中7. 氢氧化亚铁在空气中被氧化8. 乙炔与氯化氢反应9. 麦芽糖的水解10. 苯酚与浓溴水反应高中化学方程式书写练习(八)1. 碳酸氢钠与少量氢氧化钙反应2. 工业上制氨气3. 明矾净水原因4. 铁与氯化铁溶液反应5. 氯化铝与氨水反应6. 镁与热水反应7. 胆矾受热分解8. 实验室制乙烯9. 苯与氢气反应10. 乙醇与钠反应高中化学方程式书写练习(九)1. 氮气与氧气反应2. 往次氯酸钙溶液中通入少量二氧化碳3. 铜与浓硝酸反应4. 往溴化亚铁溶液中通入足量氯气5. 钠与硫酸反应6. 碳酸氢钠与氢氧化钠反应7. 硫化氢与少量氧气反应8. 制聚乙烯9. 甲烷与氯气反应10. 乙炔与溴水反应1. 硫化氢与硫酸铜溶液反应2. 氯化铝与碳酸氢钠溶液反应3. 将一氧化氮和二氧化氮的混合气体通入烧碱溶液中4. 双氧水分解5. 实验室制氨气6. 铁与碘反应7. 氯气与热的氢氧化钾溶液反应8. 乙醛与新制氢氧化铜反应9. 乙醇的催化氧化10. 苯的磺化反应高中化学方程式书写练习(十一)1. 二氧化硫与过氧化钠反应2. 木炭与浓硝酸反应3. 实验室制氯化氢4. 磁铁矿与一氧化碳反应5. 二氧化碳与硅酸钠溶液反应6. 氨水与氢硫酸反应7. 铁与水蒸气反应8. 乙烯与溴水反应9. 钠与苯酚反应10. 乙醇分子间脱水高中化学方程式书写练习(十二)1. 硫酸铜与氢氧化钡溶液反应2. 二氧化硅与生石灰反应3. 将氨气与二氧化碳的混合气体通入食盐水中4. 钾在氧气中燃烧5. 水煤气的制取6. 氧化银与氨水反应7. 铜与浓硫酸反应8. 苯酚电离9. 溴乙烷的消去反应10. 制取乙酸乙酯。
高中化学方程式专项训练高三复习

高中化学方程式专题训练1、钠镁铝铁铜, 碳氢硫磷在空气中燃烧(10):2、一氧化碳、硫化氢、甲烷、氨气、乙烯、乙醇在氧气中燃烧(6):3、碳酸氢铵、碱式碳酸铜、氧化汞、氯酸钾、高锰酸钾、过氧化氢、碳酸钙、水分解(8):4、一氧化碳、氢气、碳、铝等还原氧化铜、氧化铁、四氧化三铁等、氧化钨、二氧化锰、三氧化二铬(12):5、锌铁镁铝和稀硫酸、稀盐酸反应(8):反应(8):7.氧化铁、氧化铜、氧化锌和稀盐酸、稀硫酸反应(6):8、盐酸、硫酸、硝酸与烧碱、氢氧化钙、氢氧化铝、氢氧化钡、氢氧化铜、氢氧化锌、氢氧化镁起反应(21):9、盐酸、硫酸、硝酸与碳酸钠、碳酸钙、碳酸氢钠、碱式碳酸铜反应(12):11、判别二氧化碳:12、八种基础气体试验室制取1)、氧气:用氯酸钾: 用高锰酸钾:氧化汞:过氧化氢:2)、氨气试验室制法:3)、氯气试验室制法和工业制法:4)、氢气试验室制法:5)、二氧化碳试验室制法:6)、二氧化硫试验室制法:7)、 NO2试验室制法:9)、硫化氢试验室制法:10)、工业制水煤气:13、钠镁铝铁与水反应(4):14、氧化钠与水、二氧化碳、盐酸反应:15、过氧化钠作为生氧剂与水反应:16、过氧化钠与CO2、 SO2反应化学方程式:17、氢氧化钠与硅、铝、二氧化碳、二氧化硫、二氧化硅、三氧化硫、硫化氢、氧化铝等反应:18、氢氧化钠溶液和碳酸氢钠溶液反应:19、碳酸钠与稀盐酸反应:20、碳酸钠与氢氧化钙、氢氧化钡反应:21、碳酸钠与氯化钡、氯化钙反应:22、碳酸钠与二氧化硅反应:23、碳酸氢钠与盐酸溶液反应离子方程式:24、碳酸氢钠与氢氧化钠反应:25、碳酸氢钠与氢氧化钡、氢氧化钙反应:27、碳酸氢钠与氯化铁反应:28、碳酸氢钙溶液与氢氧化钠反应:29、碳酸氢钙溶液与氢氧化钡反应:30、碳酸氢铵与盐酸反应:31、碳酸氢铵与氢氧化钠反应:32、碳酸氢铵与氢氧化钡反应:33、生石灰溶于水:34、生石灰与二氧化碳、二氧化硫反应、二氧化硅反应:35、生石灰与盐酸反应:36、消石灰吸收二氧化硫、二氧化碳、 :37、氯气与氢气、硅、磷反应:38、氯气与甲烷、乙烯反应:39、氯气与水反应离子方程式:40、氯气与氯化亚铁溶液反应:41、氯气与亚硫酸钠溶液反应:42、氯气与潮湿二氧化硫反应:43、氯气与硫化氢反应:44、氯气入石灰乳中制漂白粉化学方程式: ,用NaOH进行氯气尾气吸收):漂白粉漂白原理:45、试验室制氯气(浓盐酸与二氧化锰、高锰酸钾反应,工业制氯气):46、氯化钠与浓硫酸反应:47、电解氯化钠溶液:48、电解氯化镁(制金属镁):49、电解氯化铜溶液:50、电解硫酸铜、硝酸银溶液:51、电解氢氧化钠溶液:52、镁与水反应:53、镁与氯化铵溶液反应:54、镁与氯化铁溶液反应:55、氧化镁与盐酸反应:56、氧化镁与氯化铵溶液反应:57、氧化镁与氯化铁溶液反应:58、氢氧化镁与盐酸、硫酸、硝酸反应:59、氢氧化镁与氯化铵溶液反应:60、氢氧化镁与氯化铁溶液反应:61、碳酸镁与盐酸、硫酸、硝酸反应:62、碳酸镁与氯化铵溶液反应:63、碳酸镁与氯化铁溶液反应:64、铝与热水反应:65、铝与氢氧化钠溶液反应:66、铝与硫酸铜、硝酸银溶液反应:67、氧化铝与盐酸、硫酸、硝酸反应68、氧化铝与氢氧化钠溶液反应:69、氢氧化铝与盐酸、硫酸、硝酸反应70、氢氧化铝与氢氧化钠溶液反应:71、硫酸铝与氨水反应(氢氧化铝制备):72、硫酸铝与碳酸钠溶液反应:73、硫酸铝与碳酸氢钠溶液反应(泡沫灭火器原理):74、明矾与氢氧化钠溶液反应(过量或不足):75、明矾与氢氧化钡溶液反应(过量或不足):76、氢氧化铝酸式电离和碱式电离:77、偏铝酸钠与盐酸、硫酸、硝酸反应(过量或不足)78、偏铝酸钠溶液与二氧化碳反应(过量或不足)79、偏铝酸钠溶液与氯化铝溶液反应:80、偏铝酸钠与氯化铁溶液反应:81、铁与硫反应:82、铁与氯气反应:83、铁与盐酸、硫酸、硝酸溶液反应:84、铁与水蒸气反应:85、铁与硫酸铜、硝酸银溶液反应:87、氧化亚铁与氧气反应:88、氧化亚铁与盐酸、硫酸、硝酸溶液反应:89、氧化亚铁、氧化铁、四氧化三铁与铝反应90、氯化亚铁与氢氧化钠溶液在空气中反应:91、氯化铁与氢氧化钠溶液反应:92、硫酸铁与氢氧化钡溶液反应:93、三价铁离子检验:94、二价铁离子检验:95、三价铁离子与二价铁离子相互转化: (任意写两个)96、氯化铁与铜反应:97、氯化铁与亚硫酸钠溶液反应:98、氯化铁与硫化钠溶液反应:99、氯化铁与碘化钾溶液反应:100、氢氧化铁胶体制备:101、铜与浓硫酸反应:102、铜与硝酸反应(浓、稀硝酸):103、氧化亚铜与盐酸、硫酸、硝酸溶液反应:104、氧化亚铜在空气中加热:105、氢氧化铜与盐酸、硫酸、硝酸溶液反应:106、铜绿与醋酸反应107、氧化铜与盐酸、硫酸、硝酸溶液反应:108、碳与氧化钙反应:109、碳与二氧化硅反应:110、碳与浓硫酸反应:111、碳酸钙与二氧化硅反应:112、二氧化碳与镁反应113、碳与水蒸气反应: 114、氮气与氧气、氢气反应:115、氮气与镁反应:116、氨气与氧气反应(工业制硝酸):117、氨气与氯气反应:118、氨气与氯化氢反应:119、氨气与氧化铜反应:120、氯化铵与氢氧化钙反应(试验室制氨气):121、碳酸氢铵热分解:122、氯化铵热分解:123、硝酸铵热分解:124、氨气与水反应:125、一氧化氮与氧气反应:126、二氧化氮与水反应:128、二氧化氮与氨气反应:129、一氧化氮与一氧化碳反应:130、二氧化氮与硫化氢反应:131、二氧化氮与碘化钾溶液反应:132、浓硝酸保留在棕色瓶中原因, 用化学方程式解释133、 C与浓硝酸反应方程式134、硝酸与铜、银反应:135、二氧化硫与碳酸钙反应136、二氧化硫与氯气在水中反应:137、二氧化硫与硫化氢反应:138、二氧化硫与碳酸钠溶液反应:140、表现二氧化硫氧化性化学方程式141、 C与浓硫酸化学方程式142、硫酸钠和氯化钡:143、粗硅提纯:144、氢氧化钠不用玻璃瓶保留原因, 化学方程式145、碳酸钠与二氧化硅反应:146、硅酸钠与盐酸反应:147、硅酸钠溶液与二氧化碳反应:148、硅酸与氢氧化钠反应:149、醋酸与氨水反应150、将AlCl3溶液逐滴加入到NaOH溶液中151、将少许NaOH溶液逐滴加入到AlCl3溶液中152、将CO2通入Na[Al(OH)4](NaAlO2-)溶液中153、离子检验(1)SO42-离子检验:(2)NH4+离子检验:(3)Fe2+离子检验:(4)SO2检验:(5)Fe3+离子检验154、硅与氢氟酸反应:155、二氧化硅与氢氟酸反应:156、制造玻璃关键反应:157、硫化氢与硫酸铜、硝酸银溶液反应: 158、硫化钠与硫酸铜、硝酸银溶液反应:159、硫化亚铁与稀硫酸反应:160、氢化钠与水反应:161、氢化钙与水反应:162、氢化钙与盐酸反应:163、氢氟酸与氯化钙溶液反应:164、氨气与钠反应:165、氯气与氢氧化钠热溶液反应:166、硫与氢氧化钠溶液反应:167、磷与硫酸铜溶液反应:168、钠、镁与四氯化钛反应:169、侯氏制碱法:170、二氧化氮与氢氧化钠溶液反应:171、四氧化三铁与盐酸反应:172、锌与硝酸反应(浓、稀)173、亚硫酸钠与氧气反应:174、硝酸与硝酸亚铁反应:175、浓硫酸与硫化钠反应176、浓硫酸与氟化钙反应:177、氯化铝与氨水反应:178、硫化钠与硫酸铝溶液反应:179、氯化铁溶液与铁反应:180、氯酸钾与盐酸反应:181、在碘化亚铁溶液中通入氯气182、 FeSO4酸性溶液中加过量双氧水183、 Na与CuSO4溶液反应184、 Fe(NO3)3与NaHCO3溶液反应185、氨水与醋酸反应186、碳酸钠溶液与醋酸溶液反应187、新制氯水注入盛溴化钠溶液试管中188、新制氯水注入盛碘化钾溶液试管中189、氢氧化钡与氯化铵反应190、氧气与硫化亚铜反应:191、 F2通入水中192、 SO2通入FeCl3溶液中193、试验室可用湿润淀粉碘化钾试纸检验氯气194、为何久置氯水酸性增强?195、钠投入硫酸铜溶液中196、用食醋除水垢197、偏二甲肼(C2H8N2)与四氧化二氮反应:198、石灰法脱硫:199、 NO和CO反应:200、钠与四氯化钛反应201、电解熔融氯化镁202、电解熔融氧化铝203、高温灼烧氢氧化铝204、新制氯水与氯化亚铁溶液反应205、用氢气还原四氯化硅206、氢氧化钙与碳酸钠:207、向胆矾晶体滴入浓硫酸208、以硫铁矿为原料工业生产硫酸反应原理相关方程式209、甲烷与氯气发生替换反应211、乙烯与HBr发生加成反应212、乙烯与H2O发生加成反应213、乙烯加聚反应214、试验室制取乙烯215、由乙炔制取聚氯乙烯216、试验室制取乙炔217、苯溴代反应218、苯硝化反应219、甲苯制TNT220、乙醇与金属钠反应221、 2-丙醇与浓硫酸混合加热222、乙醇在铜催化氧化反应223、乙醇、乙酸和浓硫酸混合加热225、乙醛与银氨溶液反应226、乙醛与新制氢氧化铜悬浊液227、乙酸电离方程式228、乙酸与碳酸钠溶液反应229、乙酸乙酯与稀硫酸混合加热230、乙酸乙酯与氢氧化钠溶液混合加热:231、草酸与酸性高锰酸钾反应:232、硫代硫酸钠与硫酸反应:233、重铬酸钾(K2Cr2O7)水解:234、电解氯化铜溶液:235、电解饱和食盐水:236、电解硫酸铜溶液:237、电解氢氧化钠溶液:238、电解硫酸钠溶液:239、铜锌原电池电极反应式:240、一般锌锰干电池电极反应式(锌、氯化铵、二氧化锰):241、碱性锌锰干电池电极反应式(锌、氢氧化钾、二氧化锰)242、银锌电池电极反应式(锌、氧化银、氢氧化钾):243、锂电池电极反应式(锂):244、铅蓄电池电极反应式:放电电极反应式充电电极反应式:245、燃料电池电极反应式:氢氧燃料电池(电解质为酸性或碱性): 246、甲烷燃料电池(电解质为酸性或碱性): 247、甲醇燃料电池:248、消石灰放在空气中变质:249、氯气与钠、镁、铝、铁、铜:。
高中化学方程式配平100题

高中化学方程式配平100题在高中化学学习过程中,化学方程式的配平是一个基础且重要的环节。
正确配平方程式可以帮助我们理解化学反应的过程,掌握化学方程式的规律性。
下面就为大家提供100道高中化学方程式配平的练习题,希望对大家的学习有所帮助。
1. H₂ + O₂ → H₂O2. Na + Cl₂ → NaCl3. Fe + O₂ → Fe₂O₃4. Al + O₂ → Al₂O₃5. Ca + H₂O → Ca(OH)₂ + H₂6. Mg + HCl → MgCl₂ + H₂7. H₂SO₄+ NaOH → Na₂SO₄ + H₂O8. HCl + NaOH → NaCl + H₂O9. S + O₂ → SO₂10. N₂ + H₂ → NH₃11. CO + O₂ → CO₂12. C₃H₈ + O₂ → CO₂ + H₂O13. CH₄ + O₂ → CO₂ + H₂O14. NH₄NO₃ → N₂O + O₂ + H₂O15. FeCl₃ + NaOH → Fe(OH)₃ + NaCl16. Pb(NO₃)₂ + KI → PbI₂ + KNO₃17. AgNO₃+ NaCl → AgCl + NaNO₃18. CuCl₂ + NaOH → Cu(OH)₂ + NaCl19. H₂O₂ → H₂O + O₂20. Fe(NO₃)₃ + NaOH → Fe(OH)₃ + NaNO₃21. Na₂CO₃ + HCl → NaCl + H₂O + CO₂22. H₂SO₄ + Na₂CO₃ → Na₂SO₄ + H₂O + CO₂23. Pb(NO₃)₂ + Na₂SO₄ → PbSO₄ + NaNO₃24. FeCl₃ + NaOH → Fe(OH)₃ + NaCl25. Zn + H₂SO₄ → ZnSO₄ + H₂26. Al + Fe₂O₃ → Al₂O₃ + Fe27. H₂ + N₂ → NH₃28. K + H₂O → KOH + H₂29. BaCl₂ + Na₂SO₄ → BaSO₄ + NaCl30. Mg + Br₂ → MgBr₂31. Fe + CuSO₄ → FeSO₄ + Cu32. Ca(OH)₂ + H₃PO₄ → Ca₃(PO₄)₂ + H₂O33. H₂ + F₂ → HF34. KOH + H₂SO₄→ K₂SO₄ + H₂O35. Al + HCl → AlCl₃ + H₂36. HNO₃ + NaOH → NaNO₃ + H₂O37. Pb(NO₃)₂ + KCl → PbCl₂ + KNO₃38. Zn + HCl → ZnCl₂ + H₂39. H₂O + C → CO + H₂40. CH₄ + Cl₂ → CCl₄ + HCl41. H₃PO₄ + NaOH → Na₃PO₄ + H₂O42. H₂O₂ + HCl → H₂O + Cl₂43. Al + FeCl₃ → AlCl₃ + Fe44. Na + H₂O → NaOH + H₂45. H₂O₂ + KI → KOH + I₂ + H₂O46. Ca + O₂ → CaO47. Na₂CO₃ + HCl → NaCl + H₂O + CO₂48. Na + Br₂ → NaBr49. Ca + HCl → CaCl₂ + H₂50. H₂ + Cl₂ → HCl51. H₂O₂ + KMnO₄ → K₂MnO₄ + O₂ + H₂O52. Mg + Cl₂ → MgCl₂53. C₄H₁₀ + O₂ → CO₂ + H₂O54. NH₄Cl + KOH → NH₃ + KCl + H₂O55. FeSO₄ + NaOH → Fe(OH)₂ + Na₂SO₄56. NH₄NO₃ → N₂O + H₂O57. Al + H₂SO₄ → Al₂(SO₄)₃ + H₂58. Fe + HCl → FeCl₃ + H₂59. O₂ + C₆H₁₂O₆ → CO₂ + H₂O60. NaCl + F₂ → NaF + Cl₂61. Ba + H₂O → Ba(OH)₂ + H₂62. HCl + Ca(OH)₂ → CaCl₂ + H₂O63. Mg + H₂O → MgO + H₂64. Na + Cl₂ → NaCl65. FeCl₃ + NaOH → Fe(OH)₃ + NaCl66. Na₂CO₃ + H₃PO₄ → Na₃PO₄ + H₂CO₃67. H₂O + Na → NaOH + H₂68. Zn + HNO₃ → Zn(NO₃)₂ + N₂O + H₂O69. CuO + H₂ → Cu + H₂O70. Mg + HCl → MgCl₂ + H₂71. Cu + HNO₃ → Cu(NO₃)₂ + NO₂ + H₂O72. NaCl + H₂O₂ → NaClO + HCl + H₂O73. Fe + H₂SO₄ → FeSO₄ + H₂74. H₂ + O₂ → H₂O75. Na + Cl₂ → NaCl76. Fe + O₂ → Fe₂O₃77. Al + O₂ → Al₂O₃78. Ca + H₂O → Ca(OH)₂ + H₂79. Mg + HCl → MgCl₂ + H₂80. H₂SO₄ + NaOH → Na₂SO₄ + H₂O81. HCl + NaOH → NaCl + H₂O82. S + O₂ → SO₂83. N₂ + H₂ → NH₃84. CO + O₂ → CO₂85. C₃H₈ + O₂ → CO₂ + H₂O86. CH₄ + O₂ → CO₂ + H₂O87. NH₄NO₃ → N₂O + O₂ + H₂O88. FeCl₃ + NaOH → Fe(OH)₃ + NaCl89. Pb(NO₃)₂ + KI → PbI₂ + KNO₃90. AgNO₃ + NaCl → AgCl + NaNO₃91. CuCl₂ + NaOH → Cu(OH)₂ + NaCl92. H₂O₂ → H₂O + O₂93. Fe(NO₃)₃ + NaOH → Fe(OH)₃ + NaNO₃94. Na₂CO₃ + HCl → NaCl + H₂O + CO₂95. H₂SO₄ + Na₂CO₃ → Na₂SO₄ + H₂O + CO₂96. Pb(NO₃)₂ + Na₂SO₄ → PbSO₄ + NaNO₃97. FeCl₃ + NaOH → Fe(OH)₃ + NaCl98. Zn + H₂SO₄ → ZnSO₄ + H₂99. Al + Fe₂O₃ → Al₂O₃ + Fe100. H₂ + N₂ → NH₃希望通过这100道方程式配平练习题,大家可以熟练掌握化学方程式配平的方法和技巧,提升自己的化学学习水平。
(完整版)化学方程式配平练习题(含答案)

化学方程式配平1、化学方程式配平常用方法:最小公倍数法、奇数配偶法(先配奇数大):(1) P + O2 P2O5 (2) C + O2CO(3) Al + O2Al2O3 (4)Fe + O2Fe3O4(5) Mg + O2MgO (6) H2O2MnO2 H2O + O2↑(7) H2O H2↑+ O2↑(8) H2+ O2H2O1观察法:先金属后原子团(1)CuSO4 +NaOH —Na2SO4 + Cu(OH)2(2)Mg + HCl —MgCl2+ H2↑(3)Fe2O3 + H2SO4Fe2(SO4)3+ H2O(4)Al + H2SO4 —Al2(SO4)3+ H2↑(5)Fe(OH)3 + H2SO4Fe2(SO4)3+ H2O(6)Al2(SO4)3 +NaOH —Na2SO4 + Al(OH)33配平下列的各个化学反应的方程式:(1)KMnO4—K2MnO4+ MnO2+ O2↑(2)Al + CuSO4 —Al2(SO4)3 + Cu(3)Zn + HCl —ZnCl2 + H2↑(4)Al2O3 + H2SO4Al2(SO4)3 + H2O(5)Fe2(SO4)3+NaOH —Na2SO4+ Fe(OH)3(6)Fe(OH)3+ H2SO4Fe2(SO4)3+ H2O(7)CH4+ O2点燃CO2 + H2O(8) C + CO2高温CO(9)NH3+ O2催化剂NO + H2O(10) CO + Fe2O3高温Fe + CO2二练习1 在X + 2O2===CO2 + 2H2O的反应中,根据质量守恒定律可判断出X的化学式为:()A COB CH4C CH3OHD C2H42某纯净物X在空气中完全燃烧,反应式为:X + 3 O2=== 2CO2 + 3 H2O,根据质量守恒定律可判断出X的化学式为:()A C2H4B C2H4OC C2H6D C2H6O3在4Cu + 10HNO3 = 4Cu(NO3)3 + X + 5H2O反应方程式中,X的化学式为:()A NOB NO2C N2OD N2O34物质X和B2能发生下列反应:2X + B2 = 2 AB3,则X的化学式是:()A AB2B A2B2C AB3D A2B35某化合物R在空气燃烧后生成二氧化碳和水,下列关于R化学式叙述正确的是:()A R一定含有碳,氢,氧三种元素B R一定含有碳和氢元素,不含有氧元素C R一定含有碳和氢元素,可能含有氧元素D R不一定含有碳和氢元素,但一定不含有氧元素6物质W在氧气中燃烧后,生成了4.4克CO2和3.6克的水,消耗的氧气为6.4克,则W中所含有的元素是:()A 一定含有C H元素,不含O元素B 一定含有C H 元素,可能有O元素C 一定含有C H O三种元素D 条件不足,不能判断7氢气与氧气反应生成水的反应过程中,氢气与氧气的质量之比是:()A 1 :1B 2 :1C 2 :32D 4 :328对于质量守恒定律的解释不正确的是:()A 化学反应前后,分子的数目不变B 化学反应前后,原子的种类不变。
高中化学方程式配平练习题(含答案)

配平方程式1.下列化学方程式配平正确的是A 2KMnO 4+11H 2S +5H 2SO 4=K 2SO 4+2MnSO 4+13S ↓+16H 2OB 2KMnO 4+8H 2S +4H 2SO 4=K 2SO 4+2MnSO 4+9S ↓+12H 2OC 2KMnO 4+5H 2S +3H 2SO 4=K 2SO 4+2MnSO 4+S ↓+4H 2OD 2KMnO 4+5H 2S +3H 2SO 4=K 2SO 4+2MnSO 4+5S ↓+8H 2O 2.配平下列以KMnO 4为氧化剂的氧化-还原反应(1)KMnO 4+SO 2+H 2O -MnSO 4+K 2SO 4+H 2SO 4(2)KMnO 4+K 2SO 3+H 2O -MnO 2+K 2SO 4+KOH (3)KMnO 4+KNO 2+-MnSO 4+K 2SO 4+KNO 3+H 2O (4)KMnO 4+H 2S +H 2SO 4-K 2SO 4+MnSO 4+S ↓+H 2O(5)KMnO 4+H 2O 2+H 2SO 4-K 2SO 4+MnSO 4+O 2↑+H 2O(6)KMnO 4+HCl -MnCl 2+Cl 2+KCl +H 2O (7)KMnO 4+NaOH +PH 3-K 2MnO 4+Na 2MnO 4+Na 3PO 4+H 2O (8)KMnO 4+FeCl 2+H 2SO 4-K 2SO 4+MnSO 4+Fe 2(SO 4)3+Cl 2+H 2O3.配平下列以Cr (Ⅵ)为氧化剂的氧化-还原反应(1)K 2Cr 2O 7+C +H 2SO 4-K 2SO 4+Cr 2(SO 4)3+CO 2+H 2O(2)KI +K 2CrO 4+HCl -CrCl 3+KCl +I 2+H 2O (3)K 2Cr 2O 7+Fe 3O 4+H 2SO 4-Cr 2(SO 4)3+Fe 2(SO 4)3+K 2SO 4+H 2O (4)K 2Cr 2O 7+KI +-CrPO 4+K 3PO 4+I 2+H 2O 4.配平下列以HNO 3为氧化剂的氧化-还原反应(1)Cu +HNO 3-Cu(NO 3)2+NO +H 2O (2)FeSO 4+HNO 3+H 2SO 4-Fe 2(SO 4)3+NO +H 2O (3)Zn +HNO 3-Zn(NO 3)2+NH 4NO 3+H 2O (4)As 2S 3+HNO 3-H 3AsO 4+S +NO 2+H 2O (5)P +HNO 3+H 2O -H 3PO 4+NO (6)P +HNO 3-H 3PO 4+NO 2+H 2O (7)AsH 3+HNO 3-H 3AsO 4+NO 2+H 2O (8)As 2O 3+HNO 3+H 2O -H 3AsO 4+NO (9)Cu 2S +HNO 3-S +NO +Cu(NO 3)2+H 2O (10)Cu 2S +HNO 3-H 2SO 4+NO +Cu(NO 3)2+H 2O (11)FeS 2+HNO 3=Fe(NO 3)3+SO 2+NO +H 2O(12)Fe 3P +HNO 3-Fe(NO 3)3+NO +H 3PO 4+H 2O (13)Fe 3C +HNO 3-CO 2+NO +Fe(NO 3)3+H 2O 5.配平下列氧化-还原反应(1)KNO 2-K 2O +NO +O 2(2)P +KOH +H 2O -PH 3+KH 2PO 2(3)FeS 2+CuSO 4+H 2O -FeSO 4+Cu 2S +H 2SO 4(4)P +CuSO 4+H 2O -Cu +H 3PO 4+H 2SO 4(5)P +CuSO 4+H 2O -Cu 3P +H 3PO 4+H 2SO 4(6)HClO 3+P 4+H 2O -HCl +H 3PO 4(7)Fe(OH)3+NaOH +Cl 2-Na 2FeO 4+NaCl +H 2O (8)KI +H 2SO 4-I 2+H 2S +KHSO 4+H 2O (9)PbO 2+H 2SO 4-PbSO 4+O 2+H 2O (10)AsH 3+AgNO 3+H 2O -As 2O 3+Ag +HNO 3(11)NH 4ClO 4-N 2↑+HCl ↑+O 2↑+H 2O (12)NH 4NO 3-N 2+NO 2+H 2O (13)NH 4NO 3-N 2+HNO 3+H 2O (14)S +KOH -K 2S +K 2SO 3+H 2O (15)NO 2+NaOH -NaNO 2+NaNO 3+H 2O (16)F 2+NH 3-NH 4F +N 2(17)FeS 2+O 2-Fe 2O 3+SO 2(18)Cu(IO 3)2+KI +H 2SO 4-CuI ↓+I 2+K 2SO 4+H 2O6.配平下列含x 的氧化-还原反应(1)S +Ca(OH)2-CaS 2O 3+CaS ·S x +H 2O (2)Na 2S x +NaClO +NaOH -Na 2SO 4+NaCl +H 2O (3)NO x +NH 3-N 2+H 2O 7.配平下列离子氧化-还原反应--(1)A n +B x -A y +B m ---(2)Cl m +OH -ClO n +Cl +H 2O -+++-(3)BiO 3+Mn 2+H -Bi 3+MnO 4+H 2O +++(4)VO 2+H 2C 2O 4·2H 2O +H -VO 2+CO 2↑+H 2O 8.配平下列氧化还原方程式(1)F 2+NH 3-NH 4F +N 2+++(2)VO 2+H 2C 2O 4·2H 2O +H -VO 2+CO 2↑+H 2O (3)P 4+CuSO 4+H 2O -Cu 3P +H 3PO 4+H 2SO 49.已知铁溶于一定浓度的硝酸溶液中反应的离子方程式为(系数a ~k 均为正整数):-+++aFe +bNO 3+cH dFe 2+fFe 3+gNO ↑+hN 2O ↑+kH 2O 。
(word完整版)化学方程式配平练习含答案,推荐文档

1.配平下列氧化还原反应方程式:(1 Mn(NO3 2+PbO2+HNO3 —HMnO4+Pb(NO3 2+H2O(2 Ag3AsO 4+Zn+H2SO 4 —Ag+ZnSO4+AsH3+H2O(3 Fe(OH3+NaOH+Cl2 —Na2FeO 4+NaCl+H2O(4 KMnO4 +NaOH+PH3 —Na2MnO 4+K2MnO 4+Na3PO 4+H2O(5 (NH4 2 PtCI6 —Pt+ NH4CI + HCI + N2T2.配平下列氧化还原反应方程式:(1 Na2O 2+ C02= Na2CO 3+ 02(2 Fe(N03 2+ HN03 = Fe(N03 3+ N0+ H20(3 Mn (N0 32 + Pb02+ HN03 = HMn04 + Pb(N0 32+ H20(4 Ag3As0 4+ Zn + H2S0 4= Ag J+ Zn S04+ AsH3 + H20(5 KMn04 + NaOH+ PH3= K2Mn0 4 + NaMn04+ Na3P0 4(6 K2Cr 20 7+ Fe30 4+ H2S0 4= Cr2(S0 43+ Fe(S0 433.Cu +在酸性条件下发生自身氧化还原反应,生成Cu 和Cu 2+。
白色的亚铜化合物[Cu(NH4S0 3]难溶于水,若与足量的10 moI /L 的硫酸溶液混合并微热,生成铜、二氧化硫和溶液。
回答下列问题:(1 完成并配平下列化学方程式:Cu(NH4S0 3+__ H2S0 4_Cu+ __ S02+ _____________ + ____________ + __ H2O(2按上述反应,生成单质铜的最高产率为 ____________ 。
4. Fe 3P与稀HNO 3 反应生成Fe(N03 3、NO、H 3P0 4和H 20。
(1写出反应的化学方程式并配平:(2上述反应中,当生成1.8 mol Fe 3+时,放出NO的体积(标准状况下是_________ L,消耗的HNO 3是___________ mol;(3上述反应中,当有21 mol电子发生转移时,生成H 3PO 4是_________ mol, 被还原的HNO 3是____________ g=5.多硫化物离子S x 2-在碱性溶液里被BrO 3-氧化为SO 42-,BrO 3-被还原为Br ―,在反应中消耗BrO 3-和OH —的物质的量之比为2 : 3,则x的值为 ___________ 其反应的离子方程式为:6 .由硫可制得多硫化钠Na 2S x,x值一般为2—6。
化学方程式配平练习题(含答案)

化学方程式配平1、化学方程式配平常用方法:最小公倍数法、奇数配偶法(先配奇数大):(1) P + O2 点燃P2O5 (2) C + O2点燃CO(3) Al + O2Al2O3 (4)Fe + O2Fe3O4(5) Mg + O2点燃MgO (6) H2O2MnO2 H2O + O2↑(7) H2O 通电H2↑+ O2↑(8) H2+ O2点燃H2O1观察法:先金属后原子团(1)CuSO4 +NaOH —Na2SO4 + Cu(OH)2(2)Mg + HCl —MgCl2+ H2↑(3)Fe2O3 + H2SO4Fe2(SO4)3+ H2O(4)Al + H2SO4 —Al2(SO4)3+ H2↑(5)Fe(OH)3 + H2SO4Fe2(SO4)3+ H2O(6)Al2(SO4)3 +NaOH —Na2SO4 + Al(OH)33配平下列的各个化学反应的方程式:(1)KMnO4—K2MnO4+ MnO2+ O2↑(2)Al + CuSO4 —Al2(SO4)3 + Cu(3)Zn + HCl —ZnCl2 + H2↑(4)Al2O3 + H2SO4Al2(SO4)3 + H2O(5)Fe2(SO4)3+NaOH —Na2SO4+ Fe(OH)3(6)Fe(OH)3+ H2SO4Fe2(SO4)3+ H2O(7)CH4+ O2点燃CO2 + H2O(8) C + CO2高温CO(9)NH3+ O2催化剂NO + H2O(10) CO + Fe2O3高温Fe + CO2二练习1 在X + 2O2===CO2 + 2H2O的反应中,根据质量守恒定律可判断出X的化学式为:()A COB CH4C CH3OHD C2H42某纯净物X在空气中完全燃烧,反应式为:X + 3 O2=== 2CO2 + 3 H2O,根据质量守恒定律可判断出X的化学式为:()A C2H4B C2H4OC C2H6D C2H6O3在4Cu + 10HNO3 = 4Cu(NO3)3 + X + 5H2O反应方程式中,X的化学式为:()A NOB NO2C N2OD N2O34物质X和B2能发生下列反应:2X + B2 = 2 AB3,则X的化学式是:()A AB2B A2B2C AB3D A2B35某化合物R在空气燃烧后生成二氧化碳和水,下列关于R化学式叙述正确的是:()A R一定含有碳,氢,氧三种元素B R一定含有碳和氢元素,不含有氧元素C R一定含有碳和氢元素,可能含有氧元素D R不一定含有碳和氢元素,但一定不含有氧元素6物质W在氧气中燃烧后,生成了4.4克CO2和3.6克的水,消耗的氧气为6.4克,则W中所含有的元素是:()A 一定含有C H元素,不含O元素B 一定含有C H 元素,可能有O元素C 一定含有C H O三种元素D 条件不足,不能判断7氢气与氧气反应生成水的反应过程中,氢气与氧气的质量之比是:()A 1 :1B 2 :1C 2 :32D 4 :328对于质量守恒定律的解释不正确的是:()A 化学反应前后,分子的数目不变B 化学反应前后,原子的种类不变。
高考有机化学方程式训练过关
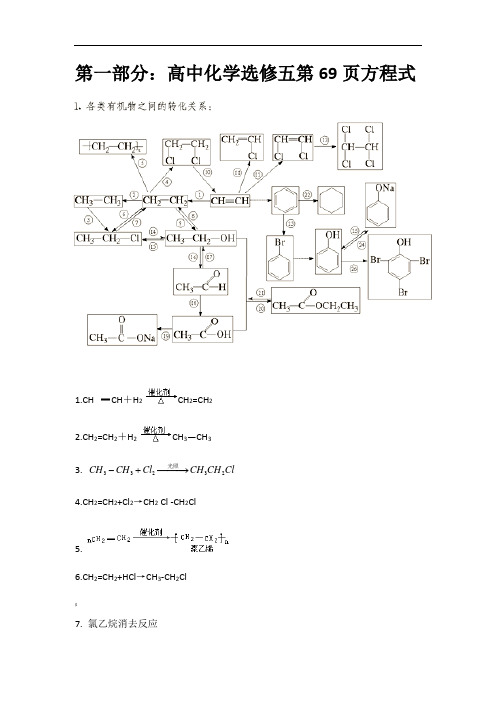
第一部分:高中化学选修五第69页方程式1.CH CH +H 2 CH 2=CH 22.CH 2=CH 2+H 2 CH 3—CH 33. 33232CH CH Cl CH CH Cl -+−−−→光照 4.CH 2=CH 2+Cl 2→CH 2 Cl -CH 2Cl5.6.CH 2=CH 2+HCl →CH 3-CH 2Cl$7. 氯乙烷消去反应CH3CH2 Cl +NaOH CH2=CH2↑+ Na Cl + H2O 8.9.CH2CH2+H—OH CH3CH2OH11. HC CH十HCl CH2=CHCl12.2CH CH Cl CHCl CHCl≡+→=[13.222CHCl CHCl Cl CHCl CHCl=+→-14.氯乙烷水解CH3CH2Cl+ NaOH CH3CH2OH + NaBr15.16. 乙醇催化氧化2CH3CH2OH + O2Cu∆−−→2CH3CHO + 2H2O》17.18.. 乙醛制乙酸2CH3CHO + O2催化剂△2CH3COOH19. CH3COOH+ NaOH→CH3COONa+ H2O20. 乙酸乙酯制取(用饱和碳酸钠溶液收集)CH3COOH + CH3CH2OH CH3COOC2H5+ H2O21.水解反应浓硫酸$H2O△醇△CH3COOC2H5+H2O CH3COOH+C2H5OH22.加成反应(环己烷)23. 取代反应+ Br2−−→−3FeBr+ HBr24. 苯酚与氢氧化钠溶液反应+ NaOH + H2O25. 苯酚钠溶液中通入二氧化碳!+ CO2+ H2O + NaHCO326.苯酚的取代反应(鉴别苯酚)1、将对应反应类型写到方程式后。
取代反应、加成反应、消去反应、聚合反应~氧化反应、还原反应、水解反应、酸碱反应2、观察以上26个转化及方程式,可知有如下常见的反应条件,试举例能发生什么反应。
(1)浓硫酸,加热。
—OH —ONa—ONa—OH(2)稀硫酸,加热(3)NaOH水溶液,加热(4)NaOH醇溶液,加热(5)Cu或Ag催化剂,加热(6)光照(7),(8)Fe或FeX3催化(9)溴水(10)浓溴水(11)银氨溶液Ag(NH3)2OH或 新制氢氧化铜悬浊液(12)酸性高锰酸钾溶液KMnO4(H+)(13)不需要条件即可转化3、官能团的引入或转化总结(1)产物中引入羟基-OH—(2)引入卤素原子-X[(3)引入碳碳双键?第二部分:高中有机化学方程式基础篇一、烃/1.乙烯乙烯的制取:(1)氧化反应高温乙烯的燃烧:H2C=CH2+3O22CO2+2H2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
高中化学填空试题及答案

高中化学填空试题及答案1. 根据题目所给的化学方程式,写出下列反应的化学方程式。
(1)铁与稀硫酸反应生成硫酸亚铁和氢气。
(2)氢气在氧气中燃烧生成水。
(3)碳酸钙在高温下分解生成氧化钙和二氧化碳。
2. 写出下列物质的化学式。
(1)水(2)二氧化碳(3)氧化铁3. 根据题目所给的化学方程式,计算下列反应中生成物的质量。
(1)锌与稀硫酸反应生成硫酸锌和氢气,若锌的质量为65g,求生成硫酸锌的质量。
(2)氢气在氧气中燃烧生成水,若氢气的质量为4g,求生成水的质量。
4. 根据题目所给的化学方程式,判断下列反应中哪种物质是氧化剂,哪种物质是还原剂。
(1)铜与硝酸银反应生成硝酸铜和银。
(2)氢气与氧化铜反应生成铜和水。
5. 根据题目所给的化学方程式,写出下列反应的离子方程式。
(1)硫酸铜与氢氧化钠反应生成氢氧化铜沉淀和硫酸钠。
(2)碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳。
6. 根据题目所给的化学方程式,写出下列反应的平衡常数表达式。
(1)氮气与氢气反应生成氨气。
(2)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳。
答案:1.(1)Fe + H2SO4 → FeSO4 + H2↑(2)2H2 + O2 → 2H2O(3)CaCO3 → CaO + CO2↑2.(1)H2O(2)CO2(3)Fe2O33.(1)生成硫酸锌的质量为161g。
(2)生成水的质量为36g。
4.(1)氧化剂是硝酸银,还原剂是铜。
(2)氧化剂是氧化铜,还原剂是氢气。
5.(1)CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4(2)NaHCO3 + HCl → NaCl + H2O + CO2↑6.(1)K = [NH3]/[N2][H2]^3(2)K = [CaCl2][CO2]/[CaCO3][HCl]。
高中常见化学方程式填空练习试题

钾和硫酸的反应
47
钾和硫酸铜的反应
48
锂在氮气中燃烧
镁、铝及其化合物有关的化学方程式
序号
反应条件
化学反应方程式或离子方程式
1
镁在氧气中燃烧
2
镁在氮气中燃烧
3
镁在二氧化碳中燃烧
4
镁在氯气中燃烧
5
镁与硫粉共热
6
镁与硫酸反应
7
镁与氯化亚铁反应
8
工业制备镁
9
铝在氧气中燃烧
10
铝在氯气中燃烧
11
铝与硫粉共热
12
铝与稀硫酸反应
13
铝与氢氧化钠反应
14
铝与硫酸铜溶液反应
15
铝与氧化铁反应(铝热反应)
铝与二氧化锰反应
铝与五氧化二钒反应
铝与三氧化二铬反应
16
工业制备铝
17
氧化铝与盐酸反应
18
氧化铝与氢氧化钠反应
19
氢氧化铝受热分解
20
氢氧化铝酸式电离
21
氢氧化铝碱式电离
22
氢氧化铝与硫酸反应
23
氢氧化铝与氢氧化钠反应
10
氯气通入氢氧化钠溶液
11
氯气通入热的氢氧化钠溶液
12
向次氯酸钙溶液通入少量二氧化碳
52
铜生锈原理
53
铜与浓硫酸共热
54
铜与浓硝酸反应
55
铜与稀硝酸反应
56
铜与硝酸银溶液反应
57
氧化铁与稀硫酸反应
58
氧化铜与氢气加热
59
氧化亚铜与稀硫酸(歧化反应)
60
氧化亚铜与氢气共热
61
氧化亚铜与稀硝酸反应
完整)高中化学方程式配平练习题

完整)高中化学方程式配平练习题1.此题无格式错误和明显有问题的段落。
2.下面是每个反应的配平结果:1) 2KMnO4 + 3SO2 + 2H2O → 2MnSO4 + 2KHSO4 +3H2SO42) 2KMnO4 + K2SO3 + 2H2O → 2MnO2 + K2SO4 + 2KOH3) 2KMnO4 + 2KNO2 + H2O → 2MnSO4 + K2SO4 +2KNO34) 2KMnO4 + 3H2S + 4H2SO4 → K2SO4 + 2MnSO4 + 3S↓ + 8H2O5) 2KMnO4 + 3H2O2 + 3H2SO4 → K2SO4 + 2MnSO4 +O2↑ + 5H2O6) 2KMnO4 + 16HCl → 2MnCl2 + 5Cl2 + 2KCl + 8H2O7) 2KMnO4 + 3NaOH + H3PO3 → K2MnO4 + Na2MnO4 + Na3PO4 + H2O8) 2KMnO4 + 3FeCl2 + 2H2SO4 → K2SO4 + 2MnSO4 + Fe2(SO4)3 + 3Cl2 + 2H2O3.下面是每个反应的改写:1) 在酸性条件下,二氧化锰氧化亚硫二氧化硫,生成硫酸和锰(II)离子。
2) 在碱性条件下,二氧化锰氧化亚硫酸钾,生成氧化锰(IV)、硫酸钾和氢氧化钾。
3) 在酸性条件下,二氧化锰氧化氧化铁(III),生成硫酸铬(III)、硫酸亚铁、硫酸钾和水。
4) 在酸性条件下,二氧化锰氧化硫化氢和硫酸,生成硫酸钾、硫酸锰(II)、硫和水。
5) 在酸性条件下,二氧化锰氧化过氧化氢和硫酸,生成硫酸钾、硫酸锰(II)、氧气和水。
6) 在酸性条件下,二氧化锰和盐酸反应,生成氯气、氯化锰(II)、氯化钾和水。
7) 在碱性条件下,二氧化锰氧化亚磷酸钠,生成高锰酸钾、高锰酸钠、磷酸三钠和水。
8) 在酸性条件下,二氧化锰氧化氯化亚铁和硫酸,生成硫酸钾、硫酸锰(II)、氯气、硫酸亚铁和水。
高中化学每日方程训练大集锦

每日方程式训练11、过氧化钠可作为潜水艇生氧剂。
写出产生氧气的两个主要化学方程式:_____________、_________________________________________2、侯氏制碱法原理(化学方程式)_________________________________________3、氯碱工业(电解饱和食盐水)原理(化学方程式)________________________________________4、向Na[Al(OH)4]溶液中通入过量CO2气体,写出离子方程式___________________________________________________________ __5、NaAlH4是重要的还原剂,试写出NaAlH4与H2O发生氧化还原反应的化学方程式:。
每日方程式训练26、PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为:。
7、将AlCl3溶液与NaHCO3溶液混合(泡沫灭火器原理),写出离子方程式_________________________________________8、Al2O3和NaOH溶液的反应,写出离子方程式_________________________________________9、Fe和过量稀HNO3的反应_________________________________________10、Fe高温下和水蒸气的反应_________________________________________11、FeCl3溶液腐蚀金属铜_________________________________________每日方程式训练312、FeBr 2溶液和等物质的量的Cl 2反应2Fe 2++2Br -+2Cl 2=2Fe 3++Br 2+4Cl -13、铜在空气中生成铜绿:必修一P120 14、SiO 2和C 的反应_:必修一P108 15、向Na 2SiO 3溶液中通入过量CO 2气体_: SiO 32-+2CO 2+2H 2O= H 2SiO 3↓+2HCO 3-16、把H 2S 气体通入CuSO 4溶液中,写出离子方程式:H 2S+Cu 2+=CuS ↓+2H +17、SO 2通入溴水中,使溴水退色,写出离子方程式 SO 2+Br 2+2H 2O= 4H ++SO 42-+2Br -每日方程式训练418、实验室制备SO 2原理(化学方程式)Na 2SO 3+H 2SO 4(浓)=Na 2SO 4+SO 2 +H 2O19、人工合成氨原理(化学方程式)N 2 + 3H 2 高温、高压催化剂2NH 3 (可逆号)20、实验室利用NH 4Cl 固体、Ca(OH)2固体混合加热制备NH 32NH 4Cl+ Ca(OH)2=====△2NH 3↑+2H 2O+ CaCl 221、C 和浓HNO 3的反应2H 2SO 4(浓) + C =====△CO 2↑+ 2H 2O + 2SO 2↑ 22、NH 4HCO 3溶液中加入过量稀NaOH 溶液,写出离子方程式HCO 3-+2OH -+ NH 4+=== CO 2-3+H 2O+ NH 3·H 2O 23、SO 2气体通入到NaClO 和NaOH 的混合溶液中:SO 2+ClO -++2OH -= SO 42-+Cl -+ H 2O每日方程式训练524、天然气中的H 2S 杂质常用氨水吸收,产物为NH 4HS 。
高中化学方程式填空训练1~6

高中化学方程式填空训练一一、碱金属元素及相关物质1、钠和氧气的反应i. 常温下: ii . 加热时:2、钠和硫的反应:(现象:)3、钠和水的反应:4、过氧化钠和水的反应:(此反应分两步: i.ii. )5、过氧化钠和二氧化碳的反应:(此反应也分两步: i.ii. )6、氧化钠分别和水、二氧化碳、盐酸的反应7、碳酸钠与盐酸的反应: i. 稀盐酸逐滴加入到碳酸钠溶液中直至过量:ii. 碳酸钠逐滴加入到稀盐酸中:8、碳酸氢钠与盐酸的反应:9、碳酸钠和碳酸氢钠的相互转化:碳酸钠与二氧化碳及水的反应:;碳酸氢钠与氢氧化钠的反应。
过量硫化氢与氢氧化钠溶液的反应:高中化学方程式填空训练二常见的金属及其化合物(.是.离.子.反.应.的.还.要.写.出.离.子.方.程.式.).1、铝和氧气的反应:2、铝和盐酸的反应:3、铝和氢氧化钠溶液的反应:4、氧化铝与盐酸的反应:5、氧化铝氢氧化钠溶液的反应:6、氢氧化铝和盐酸的反应:7、氢氧化铝和氢氧化钠溶液的反应:8、氯化铝溶液和一水合氨的反应: 9、在氯化铝溶液中逐滴加入氢氧化钠溶液直至过量时的反应:10、向偏铝酸钠溶液中通入少量二氧化碳气体:11、向偏铝酸钠溶液中通入过量二氧化碳气体:12、向偏铝酸钠溶液中滴入少量盐酸: 13、向偏铝酸钠溶液中逐滴滴入盐酸直至过量:14、向偏铝酸钠溶液中加入碳酸氢钠溶液:15、氯化铝溶液和碳酸氢钠溶液的反应:16、铝和氧化铁的反应:铝和三氧化二铬的反应:铝和二氧化锰的反应:17、铁在氧气中的燃烧:18、铁和水蒸气的反应:19、铁和硫的反应:20、铁和硫酸铜溶液的反应:21、铁和三氯化铁溶液的反应:22、三氯化铁溶液和铜的反应:23、三氯化铁溶液和硫化氢的反应:24、三氯化铁溶液和二氧化硫的反应:25、三氯化铁溶液和碘化钠溶液的反应:26、氯化亚铁溶液中通入氯气:27、氢氧化亚铁在溶液中被氧气氧化:28、氧化铁和焦炭的反应: 29、氧化铁和硫酸的反应:30、镁和二氧化碳的反应:31、氢氧化铁胶体的制取:32、三氯化铁溶液和氢氧化钠溶液的反应:补充和总结:高中化学方程式填空训练三卤族元素(是.离.子.反.应.的.还.要.写.出.离.子.方.程.式.)1、氯气和铜的反应:2、氯气和铁的反应:3、氯气和钠的反应:4、氯气和氢气的反应:5、氯气和磷的反应:6、氯气和水的反应:7、常温下氯气和氢氧化钠溶液的反应:加热时氯气和氢氧化钠溶液的反应:8、氯气和氢氧化钙的反应:9、氯气和氯化亚铁溶液的反应:10、次氯酸钙(漂白粉)溶液中通入少量的二氧化碳:11、次氯酸钙(漂白粉)溶液中通入过量的二氧化碳:12、次.氯.酸.钙.钠.溶.液.中.通.入.少.量.的.二.氧.化.碳.:.13、次.氯.酸.钙.钠.溶.液.中.通.入.过.量.的.二.氧.化.碳.:.14、次氯酸钙(漂白粉)溶液中通加入稀盐酸:15、次氯酸钙(漂白粉)溶液中通加入浓盐酸:16、次氯酸见光分解:17、氟气和水的反应:18、氯气和溴化钠溶液的反应:19、向淀粉碘化钾溶液中通入氯气直至过量的反应:20、氯气的实验室制法:21、溴化银见光分解:22、卤素离子的检验方法:23、氯气和二氧化硫气体混合后通入水中:24、向亚硫酸钠溶液中通入氯气:25、向硫化钠溶液中通入氯气直至过量:高中化学方程式填空训练四氧族元素(是.离.子.反.应.的.还.要.写.出.离.子.方.程.式.)1、硫与氢气的化合:2、硫与铁的化合:3、硫与铜的化合:4、硫与氧气的化合:5、氧气与臭氧的相互转化:6、过氧化氢的分解反应:7、硫化氢的分解反应:8、硫化氢与二氧化硫的反应:9、硫化氢的不完全燃烧:10、硫化氢的完全燃烧:11、硫化氢气体通入硫酸铜溶液中:12、二氧化硫通入硫化钠溶液中直至过量:13二氧化硫与水化合:14、少量二氧化硫通入氢氧化钠溶液中:15、二氧化硫通入亚硫酸钠溶液中:16、二氧化硫通入氢氧化钙溶液中:17、二氧化硫与氧气的化合:18、二氧化硫与溴水的反应:19、二氧化硫与碘水的反应:20、硫化氢与溴水的反应:21、硫化氢与碘水的反应:22、三氧化硫与水的化合:23、浓硫酸与铜的反应:24、浓硫酸与碳的反应:25、浓硫酸与硫化氢的反应:26、浓硫酸钝化铁、铝的反应:27、亚硫酸钠被氧气氧化的反应:28、二氧化硫的工业制取方法(硫铁矿的煅烧):29、二氧化硫的实验室制取方法:30、硫化亚铁分别和硫酸、盐酸的反应:31、硫酸工业上二氧化硫的尾气吸收方法(氨水吸收法):;32、氯气通入亚硫酸钠溶液中:补充和总结:高中化学方程式填空训练五氮族元素(注明条件,是.离.子.反.应.的.还.要.写.出.离.子.方.程.式.)1、氨气溶于水时的反应:2、氨气催化氧化反应:3、氨气的实验室制法:4、氨气的工业制法:5、氮气和镁的化合:6、氮气和氧气的化合:7、一氧化氮和氧气的反应:8、二氧化氮与水的反应:9、一氧化氮与氧气和水的反应:10、二氧化氮与氧气和水的反应:11、硝酸的分解:12、铜和稀硝酸的反应:13、铜和浓硝酸的反应:14、碳和浓硝酸的反应:15、硫和浓硝酸的反应:16、氯化铵的合成与分解:;17、少量的铁稀硝酸的反应:18、过量的铁稀硝酸的反应:19、碳酸氢铵的分解:20、硝酸铵的分解:在不同的条件下分解的产物不同1.2.3.21、铵根离子的检验方法:22、五氧化二磷与水的化合: 1. 加热时:2.不加热时:23、硝酸盐的分解:按金属的活泼性不同,对应的硝酸盐的分解产物也不同、Ca、Na的硝酸盐:~Cu的硝酸盐:以后的硝酸盐:4.硝酸亚铁的分解反应:碳族元素1、碳的完全燃烧和不完全燃烧:2、水煤气的制取方法:3、铁的冶炼原理:4、碳和二氧化碳的化合:5、单质硅的制取:6、粗硅的提纯过程:7、硅和氢氧化钠溶液的反应:8、硅和氟气的化合:9、硅和氢氟酸的反应:10、二氧化硅和氢氧化钠溶液的反应:11、二氧化硅和氢氟酸的反应:12、二氧化硅和氧化钙的反应:13、二氧化硅和碳酸钠的反应:14、二氧化硅和碳酸钙的反应:15、二氧化碳通入硅酸钠溶液时的反应:16、硅酸钠溶液和盐酸的反应:高中化学方程式填空训练六定量的化学方程式及其离子方程式的书写1、向 L 的 FeBr2 溶液中通入标况下:向 L的 FeBr2溶液中通入标况下:向 L的 FeBr2溶液中通入标况下:2、向 L 的 NaOH溶液中通入标况下:向 L 的 NaOH溶液中通入标况下:向 L 的 NaOH溶液中通入标况下:3、向明矾溶液中加入氢氧化钡溶液直至沉淀的质量最大时:向明矾溶液中加入氢氧化钡溶液直至沉淀的物质的量最大时:4、向 L 的 HNO3 溶液中加入粉末,充分反应:向 L 的 HNO3 溶液中加入粉末,充分反应:向 L 的 HNO3溶液中加入 14gFe 粉末,充分反应:5、碳酸氢钠溶液与足量的氢氧化钡反应:氢氧化钡溶液与足量的碳酸氢钠反应:6、碳酸氢钙溶液与氢氧化钙的反应:7、碳酸氢钙溶液与少量氢氧化钠溶液的反应:碳酸氢钙溶液与足量氢氧化钠溶液的反应:8、漂白粉溶液中通入少量 SO2 气体:漂白粉溶液中通入过量 SO2 气体:9、向 L的 AlCl 3溶液中加入 L的 NaOH溶液10、向 L的 NaAlO2溶液中加入 L的 HCl溶液11、标况下和混合:标况下和混合:标况下和混合:原电池反应的书写表示方法: X—Y(电解质溶液)或 X ‖电解质溶液‖Y(1)不可逆电池伏打电池(最早、最简单的原电池): Zn— Cu(H2SO4)- 2+Zn 极(-) Zn – 2e-==Zn2+(氧化反应)Cu 极(+) 2H ++2e-==H2↑ (还原反应)+ 2+离子方程式 Zn+2H +==H2↑ +Zn2+化学方程式 Zn+H 2SO4=ZnSO4+H2↑铁碳电池(钢铁的析氢腐蚀):Fe— C(H2CO3)- 2+Fe 极(-) Fe – 2e- ==Fe2+(氧化反应)C极(+) 2H ++2e-==H2↑ (还原反应)离子方程式 Fe+2H +==H2↑+Fe2+(析氢腐蚀)铁碳电池(钢铁的吸氧腐蚀):Fe— C (H2O、O2)- 2+Fe 极(-) 2Fe –4e ==2Fe (氧化反应)C极(+) O 2+2H2O+4e==4OH (还原反应)化学方程式 2Fe+O 2+2H2O==2Fe(OH)2 (吸氧腐蚀)4Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3==Fe2O3·nH2O+(3-n)H 2O (铁锈的生成过程)铝镍电池: Al —Ni(NaCl 溶液、 O2)Al 极(-) 4Al –12e-==4Al3+(氧化反应)Ni 极(+)3O 2+6H2O+12e ==12 OH (还原反应)化学方程式 4Al+3O 2+6H2O==4Al(OH)3 (海洋灯标电池)干电池: Zn—MnO2(NH4Cl 糊状物) NH 4Cl+H2 O==NH3· H2O+HCl- 2+Zn 极(-) Zn – 2e- ==Zn2+(氧化反应)Cu极(+) 2MnO 2+2H++2e-==Mn2O3+H2O (还原反应)化学方程式 Zn+2NH 4Cl+2MnO2=ZnCl 2+Mn2O3+2NH3↑(2)可逆电池铅蓄电池: Pb—PbO2(浓硫酸)放电Pb 极(-) Pb+H 2SO4–2e-==PbSO4+2H+(氧化反应)PbO2极(+)PbO 2+H2SO4+2H++2e-==PbSO4+2H2O (还原反应)化学方程式 Pb+PbO 2+2H2SO4==2PbSO4+2H2OPb —PbO2(浓硫酸)充电Pb 极(-) PbSO 4+2H+–2e-== Pb+H2SO4 (还原反应)PbO2极(+)PbSO 4+2H2O+2e-==PbO2+H2SO4+2H+(氧化反应)化学方程式 2PbSO 4+2H2O==Pb+PbO2+2H2SO4锂电池: Li — LiMnO2(固体介质)(-) Li –e- ==Li +(氧化反应)(+) MnO 2+Li ++e-==LiMnO2+H2O (还原反应)化学方程式 Li+MnO2==LiMnO2银锌电池: Zn—Ag2O(NaOH)Zn 极(-) Zn+2OH ––2e-==ZnO+H2O (氧化反应)Cu极(+) Ag 2O+H2O+2e- ==2Ag+2OH (还原反应)化学方程式 Zn+Ag 2O ==ZnO+2Ag(3) 高能燃料电池:H 2—O 2(NaOH)Pt 极 (-) 2H 2+4OH – 4e -==4H 2OPt 极(+) O 2+2H 2O+4e - ==4 OH化学方程式 2H 2+O 2==2H 2O CH 4—O 2(NaOH)Pt 极(-) CH 4+10 OH –8e -==CO 32 +7H 2OPt 极(+) 2O 2+4H 2O+8e -==8OH化学方程式 CH 4+2O 2+2NaOH==N 2aCO 3+3H 2O ( 氧化反应 ) ( 还原反应 )( 氧化反应 )电离方程式的书写1、酸的电离 (H 2SO 4、HNO 3、HCl 、HBr 、HI 、 H 3PO 4、HF 、H 2SO 3、CH 3COO 、H H 2CO 3、H 2S 、HNO2、C 6H 5OH 、HCN 、HClO)+ 2- H 2SO 4+2H 2O==2H 3O ++SO 42-H 2S H ++HS HS H ++S 2 HNO 2 H ++NO 2 HCN H ++CN HClO H+ClO H 2O H+OH 2H 2O H 3O+OH2、碱的电离 (NaOH 、 KOH 、 Ba(OH)2、Mg(OH)2、Al(OH)3、NH 3·H 2O) NaOH==N +a+OH KOH==K ++OH Ba(OH)2==Ba 2++2OHMg(OH)2 Mg 2++2OH Ca(OH) 2 Ca 2++2OH ( 石灰悬浊液 )碱式电离: Al(OH) 3 Al 3++3OH 酸式电离: Al(OH) 3 H ++ AlO 2+H 2O NH 3·H 2O NH 4 +2OH Ca(OH) 2==Ca 2++2OH ( 澄清石灰水 )3、盐的电离 (NaCl 、Na 2SO4、NaHSO 4、Na 2SO 3、NaHSO 3、MgSO 4、CaSO 4、Al 2(SO 4) 3、CuSO 4、AlCl 3、AgNO 3、CH 3COON 、aNH 4NO 3 、FeCl 3、 Na 2CO 3、 NaHCO 3、Na 2S 、NaHS 、NaH 2PO 4、Na 2HPO 4、Na 3PO 4、KI 、NaBr 、 NaClO 、AgCl 、 CaCO 3)NaCl==Na ++Cl Na 2SO 4==2Na ++SO 24 NaHSO 4==H ++Na ++SO 24 Na 2SO 3==2Na ++SO 24NaHSO 3==Na ++HSO 3- ( 错误书写: NaHSO 3==Na ++H ++SO 32-)MgSO 4==Mg 2++SO 24 Al 2(SO 4) 3==2Al 3++3SO 24CuSO 4==Cu 2++SO 24 AlCl 3==Al 3++3ClAgNO 3==Ag ++NO 3 CH 3COONa==C 3CHOO +Na + H 2SO 4==2H ++SO 42- 或:+- HNO 3==H ++NO 3或: +-HNO 3+H 2O==H 3O ++NO 3- 以下雷同 )+ HCl==H ++C + HBr==H +HI==H ++H 3PO 4 H ++H 2PO 4 H 2PO 4 H ++HPO 24 HPO 24 H ++PO 34HF H ++F 2SO 3 H ++HSO 3 HSO 3 H ++SO 32+ CH 3COOH H ++CH 3COO + H 2CO 3 H ++HCO 3 HCO 3 H ++CO 32+ - 3+NH4NO3==NH4++NO3- FeCl 3==Fe3++3ClNaHS==Na ++HS ( 错误书写:NaHS==N +a+H+S 2 ) +NaH 2PO 4==Na ++H 2PO 4Na 2HPO 4==2Na ++HPO 24 ( 错误书写: Na 2HPO 4==2Na ++H ++PO 43 ) Na 3PO 4==3Na ++PO 34AgCl Ag ++ Cl( 难溶、微溶物质在水中发生微弱电离 )CaCO 3 Ca 2++CO 32( 错误书写: CaCO 3==Ca 2++CO 32 ) CaSO 4 Ca 2++SO 42( 错误书写: CaSO 4==Ca 2++SO24 ) 3、熔融电离NaCl Na ++ ClMgCl 2 Mg 2++2Cl Na 2O 2Na ++O 2― Al 2O 3 2Al 3++3O 2― + Na 2S==2Na ++ S 2+KI==K +++ NaBr==Na + NaClO==Na ++Cl。
方程式配平练习

配平化学方程式练习1.C + Fe2O3—— Fe + CO22. C + Fe3O4—— Fe + CO23.H2 + Fe3O4— Fe + H2O4.H2 + WO3—— W + H2O5.CO + O2—— CO26. Fe + H2O—— H2+ Fe3O47. Al(OH)3+HCl —AlCl3 + H2O 8. Al+ O2—— Al2O39.Al + Fe3O4—Fe +Al2O3 10.Fe + O2—— Fe3O411.N2 + H2—— NH3 12. Al + H2SO4— Al2(SO4)3 + H213. H2 + Fe2O3——Fe + H2O 14. Al(OH)3 + HCl——AlCl3 + H2O 15.FeS2 + O2—— Fe2O3 + SO2 16. C2H2 + O2—— CO2+ H2O17.MnO2 + HCl—— MnCl2 + Cl2 + H2O 18. C2H6 + O2——CO2 + H2O19.C6H6 + O2——CO2 + H2O 20. C3H8 + O2 ------ CO2 + H2O21.NH3 + Cl2——NH4Cl + N2 22.NaOH + H2SO4——Na2SO4 + H2O23.Mg +HCl——H2 + MgCl2 24. CaCO3 + HCl——CaCl2 + CO2 + H2O 25.C2H2 + O2—— CO2 + H2O 26.C6H6 + O2—— CO2 + H2O27.C22H46 + O2—— CO2 + H2O 28. NH3 + Cl2—— NH4Cl + N229.CO + Fe3O4—— Fe + CO2 30. CO + Fe2O3 ------ Fe + CO231.C2H5OH + O2 --- CO2 + H2O 32. CH3OH + O2--- CO2 + H2O33. CH4 + O2--- CO2 + H2O 34. C2H2+ O2--- CO2 + H2O35. C2H4 + O2--- CO2 + H2O 36.C2H6 + O2 ------ CO2 + H2O37.Cl2 + Ca(OH)2—— CaCl2 + Ca(ClO)2 + H2O1-5单元必会化学方程式1、照相使用的镁光灯的原理(照明弹的使用):2、铁丝在氧气中燃烧 :3、铜在空气中受热:4、铝在空气中燃烧:5、氢气可作为高能燃料的反应原理:9、实验室制氧气 (1)(2)(3)10、电解水的反应原理:11、氢氧化钠溶液与硫酸铜溶液的反应:12、向碳酸钠粉末中加入稀盐酸(泡沫灭火器的反应原理):13、铁与硫酸铜溶液的反应(古代湿法炼铜原理):14、氧化铜和氢气在加热的条件下反应:。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学方程式填空训练一一、碱金属元素及相关物质1、钠和氧气的反应i.常温下:ii.加热时:2、钠和硫的反应:(现象:)3、钠和水的反应:4、过氧化钠和水的反应:(此反应分两步:i. ii. )5、过氧化钠和二氧化碳的反应:(此反应也分两步:i. ii. )6、氧化钠分别和水、二氧化碳、盐酸的反应:;;。
7、碳酸钠与盐酸的反应:i.稀盐酸逐滴加入到碳酸钠溶液中直至过量:;ii. 碳酸钠逐滴加入到稀盐酸中:8、碳酸氢钠与盐酸的反应:9、碳酸钠和碳酸氢钠的相互转化:碳酸钠与二氧化碳及水的反应:;碳酸氢钠与氢氧化钠的反应。
碳酸氢钠受热分解:。
10、锂和氧气的反应:。
11、少量二氧化碳与氢氧化钠溶液的反应:。
过量二氧化碳与氢氧化钠溶液的反应:。
12、少量二氧化硫与氢氧化钠溶液的反应:。
过量二氧化硫与氢氧化钠溶液的反应:。
13、少量硫化氢与氢氧化钠溶液的反应:。
过量硫化氢与氢氧化钠溶液的反应:。
14、氢氧化钠与氢氧化铝溶液的反应:。
15、碳酸钙高温分解:。
碳酸镁受热分解:。
氢氧化铁受热分解:。
氢氧化铜受热分解:。
氢氧化铝受热分解:。
氢氧化镁受热分解:。
16、碳酸钙与水和二氧化碳的反应:。
17、农药波尔多液的制取方法:。
18、氯化铁溶液和氢氧化钠的反应:。
氯化铁溶液和一水合氨的反应:。
高中化学方程式填空训练二常见的金属及其化合物(是离子反应的还要写出离子方程式).................1、铝和氧气的反应:2、铝和盐酸的反应:3、铝和氢氧化钠溶液的反应:4、氧化铝与盐酸的反应:5、氧化铝氢氧化钠溶液的反应:6、氢氧化铝和盐酸的反应:7、氢氧化铝和氢氧化钠溶液的反应:8、氯化铝溶液和一水合氨的反应:9、在氯化铝溶液中逐滴加入氢氧化钠溶液直至过量时的反应:;10、向偏铝酸钠溶液入少量二氧化碳气体:11、向偏铝酸钠溶液入过量二氧化碳气体:12、向偏铝酸钠溶液中滴入少量盐酸:13、向偏铝酸钠溶液中逐滴滴入盐酸直至过量:;14、向偏铝酸钠溶液中加入碳酸氢钠溶液:15、氯化铝溶液和碳酸氢钠溶液的反应:16、铝和氧化铁的反应:铝和三氧化二铬的反应:铝和二氧化锰的反应:17、铁在氧气中的燃烧:18、铁和水蒸气的反应:19、铁和硫的反应:20、铁和硫酸铜溶液的反应:21、铁和三氯化铁溶液的反应:22、三氯化铁溶液和铜的反应:23、三氯化铁溶液和硫化氢的反应:24、三氯化铁溶液和二氧化硫的反应:25、三氯化铁溶液和碘化钠溶液的反应:26、氯化亚铁溶液入氯气:27、氢氧化亚铁在溶液中被氧气氧化:28、氧化铁和焦炭的反应:29、氧化铁和硫酸的反应:30、镁和二氧化碳的反应:31、氢氧化铁胶体的制取:32、三氯化铁溶液和氢氧化钠溶液的反应:补充和总结:高中化学方程式填空训练三卤族元素(是离子反应的还要写出离子方程式...............)1、氯气和铜的反应:2、氯气和铁的反应:3、氯气和钠的反应:4、氯气和氢气的反应:5、氯气和磷的反应:6、氯气和水的反应:7、常温下氯气和氢氧化钠溶液的反应:加热时氯气和氢氧化钠溶液的反应:8、氯气和氢氧化钙的反应:9、氯气和氯化亚铁溶液的反应:10、次氯酸钙(漂白粉)溶液入少量的二氧化碳:11、次氯酸钙(漂白粉)溶液入过量的二氧化碳:12、次氯酸钙钠溶液入少量的二氧化碳:................13、次氯酸钙钠溶液入过量的二氧化碳:................14、次氯酸钙(漂白粉)溶液加入稀盐酸:15、次氯酸钙(漂白粉)溶液加入浓盐酸:16、次氯酸见光分解:17、氟气和水的反应:18、氯气和溴化钠溶液的反应:19、向淀粉碘化钾溶液入氯气直至过量的反应:20、氯气的实验室制法:21、溴化银见光分解:22、卤素离子的检验方法:23、氯气和二氧化硫气体混合后通入水中:24、向亚硫酸钠溶液入氯气:25、向硫化钠溶液入氯气直至过量:高中化学方程式填空训练四氧族元素(是离子反应的还要写出离子方程式...............)1、硫与氢气的化合:2、硫与铁的化合:3、硫与铜的化合:4、硫与氧气的化合:5、氧气与臭氧的相互转化:6、过氧化氢的分解反应:7、硫化氢的分解反应:8、硫化氢与二氧化硫的反应:9、硫化氢的不完全燃烧:10、硫化氢的完全燃烧:11、硫化氢气体通入硫酸铜溶液中:12、二氧化硫通入硫化钠溶液中直至过量:13、二氧化硫与水化合:14、少量二氧化硫通入氢氧化钠溶液中:15、二氧化硫通入亚硫酸钠溶液中:16、二氧化硫通入氢氧化钙溶液中:17、二氧化硫与氧气的化合:18、二氧化硫与溴水的反应:19、二氧化硫与碘水的反应:20、硫化氢与溴水的反应:21、硫化氢与碘水的反应:22、三氧化硫与水的化合:23、浓硫酸与铜的反应:24、浓硫酸与碳的反应:25、浓硫酸与硫化氢的反应:26、浓硫酸钝化铁、铝的反应:27、亚硫酸钠被氧气氧化的反应:28、二氧化硫的工业制取方法(硫铁矿的煅烧):29、二氧化硫的实验室制取方法:30、硫化亚铁分别和硫酸、盐酸的反应:31、硫酸工业上二氧化硫的尾气吸收方法(氨水吸收法):;32、氯气通入亚硫酸钠溶液中:补充和总结:高中化学方程式填空训练五氮族元素(注明条件,是离子反应的还要写出离子方程式...............)1、氨气溶于水时的反应:2、氨气催化氧化反应:3、氨气的实验室制法:4、氨气的工业制法:5、氮气和镁的化合:6、氮气和氧气的化合:7、一氧化氮和氧气的反应:8、二氧化氮与水的反应:9、一氧化氮与氧气和水的反应:10、二氧化氮与氧气和水的反应:11、硝酸的分解:12、铜和稀硝酸的反应:13、铜和浓硝酸的反应:14、碳和浓硝酸的反应:15、硫和浓硝酸的反应:16、氯化铵的合成与分解:;17、少量的铁稀硝酸的反应:18、过量的铁稀硝酸的反应:19、碳酸氢铵的分解:20、硝酸铵的分解:在不同的条件下分解的产物不同1.2.3.21、铵根离子的检验方法:22、五氧化二磷与水的化合:1.加热时:2.不加热时:23、硝酸盐的分解:按金属的活泼性不同,对应的硝酸盐的分解产物也不同1.K、Ca、Na的硝酸盐:2.Mg~Cu的硝酸盐:3.Ag以后的硝酸盐:4.硝酸亚铁的分解反应:碳族元素1、碳的完全燃烧和不完全燃烧:2、水煤气的制取方法:3、铁的冶炼原理:4、碳和二氧化碳的化合:5、单质硅的制取:6、粗硅的提纯过程:7、硅和氢氧化钠溶液的反应:8、硅和氟气的化合:9、硅和氢氟酸的反应:10、二氧化硅和氢氧化钠溶液的反应:11、二氧化硅和氢氟酸的反应:12、二氧化硅和氧化钙的反应:13、二氧化硅和碳酸钠的反应:14、二氧化硅和碳酸钙的反应:15、二氧化碳通入硅酸钠溶液时的反应:16、硅酸钠溶液和盐酸的反应:高中化学方程式填空训练六定量的化学方程式及其离子方程式的书写1、向1L0.5mol/L的FeBr2溶液入标况下11.2LCl2:向1L0.5mol/L的FeBr2溶液入标况下5.6LCl2:向1L0.5mol/L的FeBr2溶液入标况下22.4LCl2:2、向1L1.5mol/L的NaOH溶液入标况下22.4LCO2:向1L1.5mol/L的NaOH溶液入标况下11.2LCO2:向1L1.5mol/L的NaOH溶液入标况下33.6LCO2:3、向明矾溶液中加入氢氧化钡溶液直至沉淀的质量最大时:向明矾溶液中加入氢氧化钡溶液直至沉淀的物质的量最大时:4、向1L0.8mol/L的HNO3溶液中加入16.8gFe粉末,充分反应:向1L0.8mol/L的HNO3溶液中加入11.2gFe粉末,充分反应:向1L0.8mol/L的HNO3溶液中加入14gFe粉末,充分反应:5、碳酸氢钠溶液与足量的氢氧化钡反应:氢氧化钡溶液与足量的碳酸氢钠反应:6、碳酸氢钙溶液与氢氧化钙的反应:7、碳酸氢钙溶液与少量氢氧化钠溶液的反应:碳酸氢钙溶液与足量氢氧化钠溶液的反应:8、漂白粉溶液入少量SO2气体:漂白粉溶液入过量SO2气体:9、向1L0.5mol/L的AlCl3溶液中加入1L1.75mol/L的NaOH溶液10、向1L0.5mol/L的NaAlO2溶液中加入1L1.75mol/L的HCl溶液11、标况下33.6LCl2和22.4LNH3混合:标况下6.72LCl2和17.92LNH3混合:标况下11.2LCl2和22.4LNH3混合:原电池反应的书写表示方法:X—Y(电解质溶液) 或X‖电解质溶液‖Y(1)不可逆电池伏打电池(最早、最简单的原电池):Zn—Cu(H2SO4)Zn极(-) Zn–2e-==Zn2+(氧化反应)Cu极(+) 2H++2e-==H2↑(还原反应)离子方程式Zn+2H+==H2↑+Zn2+化学方程式Zn+H2SO4=ZnSO4+H2↑铁碳电池(钢铁的析氢腐蚀):Fe—C(H2CO3)Fe极(-) Fe–2e-==Fe2+(氧化反应)C极(+) 2H++2e-==H2↑(还原反应)离子方程式Fe+2H+==H2↑+Fe2+ (析氢腐蚀)铁碳电池(钢铁的吸氧腐蚀):Fe—C(H2O、O2)Fe极(-) 2Fe–4e-==2Fe2+(氧化反应)C极(+) O2+2H2O+4e-==4-OH(还原反应)化学方程式2Fe+O2+2H2O==2Fe(OH)2 (吸氧腐蚀)4Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3==Fe2O3·nH2O+(3-n)H2O (铁锈的生成过程) 铝镍电池:Al—Ni(NaCl溶液、O2)Al极(-) 4Al–12e-==4Al3+(氧化反应)Ni极(+)3O2+6H2O+12e-==12-OH(还原反应) 化学方程式4Al+3O2+6H2O==4Al(OH)3 (海洋灯标电池)干电池:Zn—MnO2(NH4Cl糊状物) NH4Cl+H2O==NH3·H2O+HClZn极(-) Zn–2e-==Zn2+(氧化反应)Cu极(+) 2MnO2+2H++2e-==Mn2O3+H2O (还原反应) 化学方程式Zn+2NH4Cl+2MnO2=ZnCl2+Mn2O3+2NH3↑(2)可逆电池铅蓄电池:Pb—PbO2(浓硫酸)放电Pb极(-) Pb+H2SO4–2e-==PbSO4+2H+(氧化反应)PbO2极(+)PbO2+H2SO4+2H++2e-==PbSO4+2H2O (还原反应) 化学方程式Pb+PbO2+2H2SO4==2PbSO4+2H2OPb—PbO2(浓硫酸)充电Pb极(-) PbSO4+2H+–2e-== Pb+H2SO4(还原反应)PbO2极(+)PbSO4+2H2O+2e-==PbO2+H2SO4+2H+(氧化反应) 化学方程式2PbSO4+2H2O==Pb+PbO2+2H2SO4锂电池:Li—LiMnO2(固体介质)(-) Li–e-==Li+(氧化反应)(+) MnO2+Li++e-==LiMnO2+H2O (还原反应) 化学方程式Li+MnO2==LiMnO2银锌电池:Zn—Ag2O(NaOH)Zn极(-) Zn+2OH––2e-==ZnO+H2O (氧化反应)Cu极(+) Ag2O+H2O+2e-==2Ag+2-OH (还原反应) 化学方程式Zn+Ag2O ==ZnO+2Ag(3)高能燃料电池:H2—O2(NaOH)Pt极(-) 2H2+4-OH–4e-==4H2O (氧化反应)Pt极(+) O2+2H2O+4e-==4-OH(还原反应) 化学方程式2H2+O2==2H2OCH4—O2(NaOH)Pt极(-) CH4+10-OH–8e-==-2CO+7H2O (氧化反应)3Pt极(+) 2O2+4H2O+8e-==8-OH(还原反应) 化学方程式CH4+2O2+2NaOH==Na2CO3+3H2O电离方程式的书写1、酸的电离(H 2SO 4、HNO 3、HCl 、HBr 、HI 、H 3PO 4、HF 、H 2SO 3、CH 3COOH 、H 2CO 3、H 2S 、HNO2、C 6H 5OH 、HCN 、HClO)H 2SO 4==2H ++SO 42- 或:H 2SO 4+2H 2O==2H 3O ++SO 42-HNO 3==H ++NO 3- 或:HNO 3+H 2O==H 3O ++NO 3- (以下雷同) HCl==H ++Cl -HBr==H ++Br -HI==H ++I -H 3PO 4H ++H 2PO -4 H 2PO -4H ++HPO -24 HPO -24H ++PO -34HFH ++F -H 2SO 3H ++HSO -3 HSO -3H ++SO -23CH 3COOH H ++CH 3COO -H 2CO 3H ++-3HCO -3HCO H ++-23COH 2S H ++-HS -HS H ++-2S HNO 2H ++NO -2 HCNH ++CN -HClOH ++ClO -H 2OH ++OH -2H 2OH 3O ++OH -2、碱的电离(NaOH 、KOH 、Ba(OH)2、Mg(OH)2、Al(OH)3、NH 3·H 2O) NaOH==Na ++OH -KOH==K ++OH -Ba(OH)2==Ba 2++2OH -Mg(OH)2Mg 2++2OH -Ca(OH)2Ca 2++2OH -(石灰悬浊液)碱式电离:Al(OH)3Al 3++3OH -酸式电离:Al(OH)3H ++-2AlO +H 2O NH 3·H 2O+4NH +2OH -Ca(OH)2==Ca 2++2OH -(澄清石灰水) 3、盐的电离(NaCl 、Na 2SO 4、NaHSO 4、Na 2SO 3、NaHSO 3、MgSO 4、CaSO 4、Al 2(SO 4)3、CuSO 4、AlCl 3、AgNO 3、CH 3COONa 、NH 4NO 3、FeCl 3、Na 2CO 3、NaHCO 3、Na 2S 、NaHS 、NaH 2PO 4、Na 2HPO 4、Na 3PO 4、KI 、NaBr 、NaClO 、AgCl 、CaCO 3)NaCl==Na ++Cl -Na 2SO 4==2Na ++-24SO NaHSO 4==H ++Na ++-24SO Na 2SO 3==2Na ++-24SO NaHSO 3==Na ++HSO 3- (错误书写:NaHSO 3==Na ++H ++SO 32-)MgSO 4==Mg 2++-24SO Al 2(SO 4)3==2Al 3++3-24SO CuSO 4==Cu 2++-24SO AlCl 3==Al 3++3Cl -AgNO 3==Ag ++NO 3 CH 3COONa==CH 3COO -+Na + NH 4NO 3==NH 4++NO 3- FeCl 3==Fe 3++3Cl -Na 2CO 3==2Na ++-23CO NaHCO 3==Na ++-3HCO (错误书写:NaHCO 3==Na ++H ++-23CO )Na 2S==2Na ++-2S NaHS==Na ++HS -(错误书写:NaHS==Na ++H+-2S ) NaH 2PO 4==Na ++H 2PO -4Na 2HPO 4==2Na ++HPO -24 (错误书写:Na 2HPO 4==2Na ++H ++PO -34) Na 3PO 4==3Na ++PO -34 KI==K ++I ―NaBr==Na ++Br ― NaClO==Na ++ClO ―AgCl Ag ++-Cl (难溶、微溶物质在水中发生微弱电离)CaCO 3Ca 2++-23CO (错误书写:CaCO 3==Ca 2++CO -23)CaSO 4Ca 2++SO -24(错误书写:CaSO 4==Ca 2++SO -24)3、熔融电离 NaCl Na ++-ClMgCl 2Mg 2++2-Cl Na 2O 2Na ++O 2―Al 2O 32Al 3++3O 2―。
