化学常用单位、元素分子量和常用物质分子量
化学常用单位元素分子量和常用物质分子量

化学常用单位元素分子量和常用物质分子量化学是一门重要的自然科学,研究的是物质的组成、性质、结构、变化及其规律。
在化学研究中,常常使用各种单位来表示物质的数量、质量和容积等。
同时,元素分子量和常用物质分子量也是化学中常用的概念。
下面将详细介绍化学常用单位、元素分子量和常用物质分子量。
一、化学常用单位1.原子量和摩尔质量原子是构成物质的最基本单元,每种元素的原子都具有一定的质量,这个质量被称为原子量。
对于不同元素来说,原子量是不同的。
元素的原子量单位是原子质量单位(u),常用符号是u或Da。
原子量的基准是碳-12同位素的原子量,被定义为12u。
其他元素的原子量则是相对于碳-12的质量比例。
例如,氢的原子量是1.008u,氧的原子量是15.999u。
若其中一种物质的摩尔质量为M,它就是占据摩尔(mol)的体积,因此,摩尔质量的单位是克/摩尔(g/mol)。
摩尔质量可以通过化学式中各元素的原子量相加而得到。
2.摩尔和物质的量摩尔(mol)是表示物质的量的单位,表示一定数量的物质。
摩尔的数量记作N。
一个摩尔的物质的质量就是该摩尔物质的摩尔质量。
例如,碳的摩尔质量是12g/mol,氧的摩尔质量是16g/mol。
3.分子量和离子量分子是由两个或多个原子结合而成的,具有一定的质量,被称为分子量。
对于涉及到摩尔的计算,往往需要知道分子量。
和分子不同,离子是带正电荷或负电荷的原子或原子团。
离子的质量称为离子质量或离子量。
例如,氧气分子(O2)的分子量是32g/mol,但是氧离子(O2-)的离子质量仍然是16g/mol。
4.体积和容量化学反应和实验中,通常需要使用体积或容量单位来表示反应物或产物的量。
体积是物质占用的空间的量度,常用单位有升(L)和立方厘米(cm^3)等。
1L等于1000cm^3容量是容器能够容纳的量度,是容器的体积。
例如,1000mL的烧杯可以测量1000mL的液体。
1.元素分子量元素的分子量可以通过计算该元素一个摩尔的原子量获得。
高一化学必修一物质的量知识点总结

高一化学必修一物质的量知识点总结高一化学必修一物质的量知识点总结高一的学生在学习必修一的化学课本时,会碰见很多理论性的知识概念,你知道物质的量是什么吗?关于物质的量这个内容我们需要掌握哪些知识点呢?下面是店铺为大家整理的高一化学必修一知识点,希望对大家有用!高一化学必修一物质的量知识点总结1一、物质的量的单位——摩尔1.物质的量(n)是表示含有一定数目粒子的集体的物理量。
2.摩尔(mol): 把含有6.02 ×1023个粒子的任何粒子集体计量为1摩尔。
3.阿伏加德罗常数:把6.02 X1023mol-1叫作阿伏加德罗常数。
4.物质的量 = 物质所含微粒数目/阿伏加德罗常数 n =N/NA5.摩尔质量(M)(1)定义:单位物质的量的物质所具有的质量叫摩尔质量.(2)单位:g/mol 或 g..mol-1(3)数值:等于该粒子的相对原子质量或相对分子质量.6.物质的量=物质的质量/摩尔质量 ( n = m/M )二、气体摩尔体积1.气体摩尔体积(Vm)(1)定义:单位物质的量的气体所占的体积叫做气体摩尔体积.(2)单位:L/mol2.物质的量=气体的体积/气体摩尔体积n=V/Vm3.标准状况下, Vm = 22.4 L/mol三、物质的量在化学实验中的应用1.物质的量浓度.(1)定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的浓度。
(2)单位:mol/L(3)物质的量浓度 = 溶质的物质的量/溶液的体积 CB = nB/V2.一定物质的量浓度的配制(1)基本原理:根据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的方法,求出所需溶质的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,就得欲配制得溶液.(2)主要操作a.检验是否漏水.b.配制溶液1计算.2称量.3溶解.4转移.5洗涤.6定容.7摇匀8贮存溶液.(3)注意事项A 选用与欲配制溶液体积相同的容量瓶.B 使用前必须检查是否漏水.C 不能在容量瓶内直接溶解.D 溶解完的溶液等冷却至室温时再转移.E 定容时,当液面离刻度线1―2cm时改用滴管,以平视法观察加水至液面最低处与刻度相切为止.3.溶液稀释:C(浓溶液)/V(浓溶液) =C(稀溶液)/V(稀溶液)高一化学必修一物质的量知识点总结2胶体1、胶体的定义:分散质粒子直径大小在10-9~10-7m之间的分散系。
化学用语及常用量

化学用语及常用量好的开始是成功的一半【高考考点】一、熟记并正确书写常见元素的名称、符号、离子符号。
二、熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。
三、掌握电子式、原子结构示意图、分子式、结构式和结构简式的表示方法。
四、理解质量守恒定律的涵义。
能正确书写化学方程式、热化学方程式、离子方程式、电离方程式、电极反应式。
五、了解相对原子量、相对分子量的涵义。
六、了解物质的量的单位——摩尔(mol),摩尔质量、气体摩尔体积(相应单位为g·mol-1、L·mol -1)的涵义。
理解物质的量浓度(mol·L-1)、阿伏加德罗常数的涵义。
掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系。
一、化学用语1.表示粒子的用语:元素名称、元素符号、离子符号、核素、同位素2.描述粒子特征的用语化合价:一种元素一定数目的原子,与其它元素一定数目的原子化合的性质。
实质是成键原子得失电子的数目或共用电子对偏移的数目。
离子电荷:原子或原子团得多少电子,带多少单位的负电荷,失多少电子,带多少单位的正电荷;形成共用电子对时,有多少对共用电子对偏向,带多少单位的负电荷,有多少对共用电子对偏离,带多少单位的正电荷。
3.描述粒子结构的用语原子组成表示式:AX ——A表示X原子的质量数,Z表示X原子的质子数Z原子结构示意图:用圆圈和其内的正数字表示核电荷数,圆圈外的弧线和弧线上的数字表示核外不同电子层上排布的电子数的式子。
电子式:用―•‖或―×‖表示原子或离子最外层电子的式子,叫做电子式。
化学式:用元素符号表示物质组成的式子,若物质是由分子构成的,该化学式也叫分子式。
结构式:用短线表示分子内共用电子对的式子。
如甲烷分子的结构式:结构式并不能反映分子的真实结构。
结构简式:将结构式中的部分短线省略形成的式子。
如乙烷的结构简式:CH3—CH34.化学反应表示式化学方程式:用反应物和生成物的化学式表示化学反应的式子。
常用原子量分子量

学好化学金钥匙:
学好化学需要打好基础,首先要下功夫记背基础,然后再理解应用。
其实没什么,多用几次就记住了,如:元素符号、化合价、化学式和化学反应方程式都可在应用中融会贯通,还有几个相对原子、分子质量必须记熟,有助计算。
“无他,唯手熟尔!”
一、常用相对原子量
氢H 1 碳 C 12 氮N 14 氧O 16 铁Fe 56 锌Zn 65 钠Na 23 镁Mg 24 铝Al 27 铜Cu 64 银Ag 108 钡Ba 137 硫S 32 氯Cl 35.5 钾K 39 钙Ca 40 锰Mn 55 碘I 127 磷P 31
二、常用相对分子量
氢气2 氧气32 水18 一氧化碳28 二氧化碳44
盐酸36.5 硫酸98 氢氧化钠40 碳酸钙:100
氯化银143.5 硫酸钡233 双氧水34 二氧化硫64
氧化钙56 氢氧化钙74 碳酸钠106 氯化钠58.5 氯化钙111 氧化铜80 氧化铁160 氢氧化铜98。
分子量的单位是什么

分子量的单位是什么在化学领域中,分子量是一个非常重要的概念。
它用于描述物质中分子的质量,是化学计量和计算的基础之一。
分子量的单位是原子质量单位,通常用原子质量单位(amu)或相对分子质量(molar mass)来表示。
本文将介绍分子量的定义、计算方法以及在化学中的应用。
首先,我们先来看看分子量的定义。
在化学中,分子量被定义为物质中分子的总质量。
它是由组成物质的原子质量按照相对比例进行加和得到的。
分子量也可以被看作是相对分子质量的一种表达方式。
不同物质的分子量可以通过实验测量或者计算得到。
要计算一个分子的分子量,我们需要知道该分子中各个原子的质量。
在化学中,每种元素都有一个标准的相对原子质量。
这些相对原子质量是根据碳-12同位素的质量进行比较确定的。
相对原子质量的单位是原子质量单位(amu),也被称为道尔顿(Da)。
为了计算一个分子的分子量,我们需要知道各个原子在分子中的相对数量。
这可以通过分子式来确定。
分子式描述了分子中各个元素的种类和数量。
通过查找元素周期表上对应元素的相对原子质量,我们可以计算出每个原子的质量,并按照相对数量进行求和,从而得到分子的分子量。
举个例子,让我们来计算一下水分子(H2O)的分子量。
根据元素周期表,氢原子的相对原子质量为1.008 amu,氧原子的相对原子质量为16.00 amu。
因此,水分子的分子量可以计算为:分子量= 2 × 1.008 amu + 16.00 amu = 18.02 amu需要注意的是,分子量是一个相对概念,它和物质中分子的实际质量有关,但不同物质之间的分子量无法直接比较。
例如,水和二氧化碳(CO2)的分子量分别为18.02 amu和44.01 amu,尽管二氧化碳的分子量大于水的分子量,但这并不意味着二氧化碳的分子比水的分子重。
分子量只能用于比较同一种物质的不同分子或者不同物质中相同组成分子的质量。
在化学中,分子量的计算对于许多方面都非常重要。
分子数和分子量

分子数和分子量分子数和分子量是化学中常用的概念,它们在化学计算和实验中起着重要的作用。
本文将详细介绍分子数和分子量的概念、计算方法以及其在化学中的应用。
一、分子数的概念和计算方法分子数是指一个物质中含有的分子的数量,通常用符号N表示。
分子数与物质的量(摩尔数)之间有一定的关系,可以通过物质的量来计算分子数。
物质的量用符号n表示,单位是摩尔(mol)。
根据阿伏伽德罗定律,1摩尔的任何物质都包含6.022×10^23个分子,这个常数被称为阿伏伽德罗常数,用符号NA表示。
分子数N与物质的量n之间的关系可以用以下公式表示:N = n × NA其中,N表示分子数,n表示物质的量,NA表示阿伏伽德罗常数。
例如,如果有0.5摩尔的氧气分子,那么它的分子数可以通过以下计算得到:N = 0.5 × 6.022×10^23 = 3.011×10^23二、分子量的概念和计算方法分子量是指一个分子中所有原子质量的总和,通常用符号M 表示。
分子量可以用来表示一个物质分子的质量大小。
分子量的计算方法是将一个分子中各个原子的相对原子质量相加得到。
相对原子质量是指一个原子质量与碳-12原子质量之比,相对原子质量的单位是无单位的。
例如,水分子(H2O)中含有2个氢原子和1个氧原子,它的分子量可以通过以下计算得到:M = 2 ×相对原子质量(氢) + 1 ×相对原子质量(氧)根据元素周期表中氢和氧的相对原子质量可以得到:M = 2 × 1.008 + 1 × 16.00 = 18.016所以水分子的分子量为18.016。
三、分子数和分子量在化学中的应用1. 化学计算:在化学计算中,常常需要根据物质的量和分子数来计算其他相关物理量。
例如,在配制溶液时,可以根据所需物质的摩尔数和溶液的体积来计算所需物质的质量。
2. 反应计算:在化学反应中,根据反应物的物质的量和反应方程式可以计算产物的物质的量和分子数。
大分子和小分子分子量区分

大分子和小分子分子量区分
大分子和小分子在化学上是根据其分子量来区分的。
分子量是
指化学物质中分子的质量,通常以原子单位(u)或克/摩尔(g/mol)来表示。
大分子通常指的是分子量较大的化合物,例如蛋白质、多糖、聚合物等,它们的分子量往往在千到百万之间。
这些大分子由
许多小分子单元通过化学键连接而成,具有复杂的结构和功能。
相
比之下,小分子的分子量通常在几百之内,例如水(H2O)、氧气
(O2)、甲烷(CH4)等。
它们通常由相对较少的原子组成,结构较
简单。
从化学和物理性质上来看,大分子和小分子也有很多区别。
大
分子通常具有较高的熔点和沸点,因为它们之间的分子间作用力较强,需要较大的能量才能使其分子间距离增大。
另外,大分子的溶
解度通常较小分子要低,因为大分子的分子结构复杂,与溶剂的相
互作用较弱。
而小分子由于分子量较小,通常具有较高的溶解度和
较低的熔点、沸点。
此外,大分子和小分子在生物学和工业上的应用也有所不同。
大分子常用于生物医药领域,例如药物、基因工程药物等;工业上
用于制备高分子材料、涂料、胶粘剂等。
而小分子则广泛应用于化
工、医药、食品等领域,例如溶剂、药物中的活性成分等。
总的来说,大分子和小分子在化学上主要是根据其分子量、化学结构、物理性质以及应用领域等方面来进行区分的。
这种区分有助于我们更好地理解和应用不同类型的化学物质。
化学 分子量 表示

化学分子量表示
在化学中,分子量是一种非常重要的概念。
它是指一个分子中
所有原子的相对原子质量总和。
分子量的概念对于化学反应的计算
和理解非常重要,它可以帮助化学家确定化合物的组成和性质。
分子量通常用原子单位(amu)或克/摩尔(g/mol)来表示。
原
子单位是相对于碳-12同位素的质量,而克/摩尔则是指1摩尔物质
的质量。
通过测量原子的相对原子质量,并将其相加,我们就可以
得到化合物的分子量。
化学分子量的计算可以通过化学式来完成。
例如,对于水(H2O)这个分子,我们可以通过查找氢和氧的相对原子质量,并将它们相
加来得到分子量。
氢的相对原子质量是1,氧的相对原子质量是16,所以水的分子量就是1+1+16=18。
这意味着1摩尔的水分子的质量
为18克。
分子量的概念对于化学反应的计算非常重要。
它可以帮助化学
家确定反应物和生成物的量之间的关系,从而帮助他们设计和优化
化学反应过程。
此外,分子量还可以帮助我们理解化合物的物理性质,例如密度、沸点和熔点等。
总之,化学分子量是化学中一个非常重要的概念,它可以帮助我们理解和计算化合物的组成和性质。
通过对分子量的理解,我们可以更好地理解化学反应,并为化学研究和工业生产提供重要的指导。
化学化合物的分子量

化学化合物的分子量化学化合物的分子量是指该化合物分子中所有原子的相对原子质量之和。
分子量是化学计量的重要概念,用于计算化学反应中的物质转化和质量变化。
一、分子量的概念在化学中,原子是物质的最基本单位,每种元素的原子都具有一定的相对原子质量。
化合物由不同元素的原子组成,分子量就是每种原子的相对原子质量之和。
分子量的计算方式可以通过化学式或者结构式来确定。
二、分子量的计算方法1. 计算分子量的关键是确定每种元素的相对原子质量。
根据元素周期表的数据,可以确定不同元素的相对原子质量。
2. 将每个元素的相对原子质量与其在化学式中的个数相乘,并将所有元素的结果相加,即可得到化学化合物的分子量。
例如,对于H2O这个化学式,可以通过查找元素周期表得到氢的相对原子质量为1,氧的相对原子质量为16。
因此,H2O的分子量为1 *2 + 16 = 18。
三、分子量的应用1. 用于计算化学反应的物质转化和质量变化。
在化学反应中,根据化学方程式可以确定反应物和生成物的摩尔比例关系。
通过分子量的计算,可以推算出物质的质量变化情况。
2. 用于确定化学物质的摩尔质量。
摩尔质量是指一个物质一摩尔的质量,可以通过分子量的计算确定。
3. 用于确定化学物质的浓度。
浓度表示单位体积或单位质量中所含化学物质的数量,可以通过摩尔浓度或质量浓度来表示。
分子量在计算浓度时往往被用作换算因子。
四、示例计算1. 计算氧化铁(Fe2O3)的分子量:Fe的相对原子质量为56,O的相对原子质量为16。
根据化学式,Fe2O3中有2个Fe原子和3个O原子,因此分子量为56 * 2 + 16 * 3 = 160。
2. 计算二氧化碳(CO2)的分子量:C的相对原子质量为12,O的相对原子质量为16。
根据化学式,CO2中有1个C原子和2个O原子,因此分子量为12 * 1 + 16 * 2 = 44。
五、结语化学化合物的分子量是计算和理解化学反应中物质转化和质量变化的重要指标。
化学物质的分子量

化学物质的分子量化学物质的分子量是指化学物质中所有原子的相对质量之和。
分子量的计算对于化学实验、药学研究以及化学工业等领域都具有重要意义。
在本文中,我们将介绍如何准确计算化学物质的分子量,以及一些常见化学物质的分子量。
一、分子量的概念分子量是化学物质中所有原子的质量之和,通常以原子质量单位(u)表示。
原子质量单位是以碳-12同位素为基准,被定义为碳-12同位素的质量的1/12。
分子量的计算可以通过元素的原子质量和其在分子中的相对比例来进行。
二、计算分子量的方法要计算化学物质的分子量,我们需要知道该物质的化学式。
化学式中包含了物质中各个元素的种类和相对比例。
下面以水(H₂O)为例,介绍计算分子量的方法。
1. 查找元素的原子质量首先,我们需要查找每个元素的原子质量。
原子质量可以在元素周期表中找到,通常以u为单位。
H(氢)的原子质量为1uO(氧)的原子质量为16u2. 计算分子量根据化学式中各元素的原子质量和比例,我们可以计算出分子量。
H₂O中,氢的原子质量为1u,氧的原子质量为16u。
根据化学式中的比例关系,我们可以计算出分子量:分子量 = 2×H的原子质量 + 1×O的原子质量= 2×1u + 1×16u= 2u + 16u= 18u因此,水(H₂O)的分子量为18u。
三、常见下面列举一些常见化学物质的分子量,供参考:1. 甲烷(CH₄)的分子量为16u2. 乙醇(C₂H₅OH)的分子量为46u3. 醋酸(CH₃COOH)的分子量为60u4. 苯(C₆H₆)的分子量为78u5. 氯化钠(NaCl)的分子量为58.5u以上只是一些常见化学物质的分子量,实际上化学物质的分子量非常广泛。
在进行实验或研究时,需要根据具体的化学式计算分子量。
总结:化学物质的分子量是化学研究和实验中重要的概念之一。
通过查找元素的原子质量,并根据化学式中的比例关系,可以准确计算化学物质的分子量。
化学分子量是什么意思

化学分子量是什么意思化学分子量是一种表示化学物质分子的质量的物理量。
它描述的是化学物质中所含有的原子的数量和种类,用来计量化学反应中的物质转化以及计算化学物质在溶液中的浓度等。
化学分子量的计算是化学分析和化学研究中非常重要的一部分。
化学分子量的单位通常使用摩尔/克(mol/g),它表示每摩尔化学物质所具有的质量。
化学分子量的计算方法相对简单,只需要将化学物质的相对原子质量(相对分子质量)求和即可。
相对原子质量是指元素相对于碳-12同位素的摩尔质量,而相对分子质量则是化学物质分子中所有原子相对原子质量的总和。
化学分子量在许多方面都有重要的应用。
首先,它用于计算化学反应中物质的转化。
通过知道反应物和生成物的分子量,可以确定反应物与生成物之间的化学计量关系,从而计算出反应的化学计量比。
这对于制定化学反应方程式、确定反应的偶联和反应的产率非常重要。
其次,化学分子量还用于计算溶液中溶质的浓度。
溶液中溶质的摩尔浓度可以通过将溶质的质量与溶液的总体积相除得到。
当我们知道溶质的分子量时,我们可以通过化学分子量和质量的关系推导出其摩尔量。
这对于溶液的准确配制以及溶液中溶质的实际浓度的计算至关重要。
此外,化学分子量还在理论化学中起着重要的作用。
化学分子量可以用于计算化学物质的平均摩尔质量,从而进一步推导出摩尔体积等重要的物理性质。
这对于理解化学反应的速率、平衡和热力学性质非常有帮助。
化学分子量的概念可以追溯到19世纪末,当时德国化学家Fri edrich Wöhler将原子量和分子量的概念引入了化学研究中。
他的研究奠定了化学分析和化学研究中分析化学的基础。
总结而言,化学分子量是一种描述化学物质分子质量的重要物理量。
它在化学反应计量、溶液浓度计算和理论化学研究中应用广泛。
通过化学分子量,我们可以计算化学反应的化学计量比,确定溶液中溶质的浓度,并推导出化学物质的物理性质。
正因为化学分子量的重要性,它成为了化学分析和化学研究中不可或缺的一部分。
化学常用单位、元素分子量和常用物质分子量
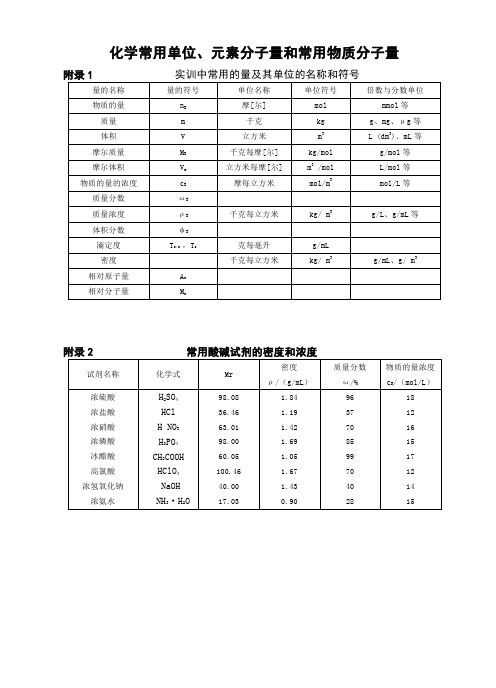
化学常用单位、元素分子量和常用物质分子量附录2 常用酸碱试剂的密度和浓度附录3 一些化合物的相对分子量附录4 相对原子质量表(1993年)附录5常用缓冲溶液的配制参考文献1.刘珍主编.1998.化验员读本(第3版).北京.化学工业出版社。
2.张济新等编. 1997.分析化学实验(第1版).上海.华东理工大学出版社。
3.张英主编. 2004.食品理化与微生物检测实验.北京.中国轻工业出版社。
4.张英主编. 2004.生物与化学基本技能实训指导.广州.广东科技出版社。
5.胡伟光,张文英主编. 2004.定量化学分析实验.北京.化学工业出版社。
6.无锡轻工业学院等编. 1995.微生物学(适用于工业发酵专业).北京.中国轻工出版社。
7.方富禄主编. 2001.有机化学实验.北京.高等教育出版社。
8.孙守田主编. 1980.化验员基本知识(第1版).北京.化学工业出版社。
9.吕春绪诸松渊主编. 1994.化验室工作手册.南京.江苏科学技术出版社。
10.宋清,张德聪编. 1996.实验设计与数据评价.广州.华南理工大学出版社。
11.周惠琳等.1993年.无机化学实验.广州.暨南大学出版社。
12.武汉大学化学系无机化学教研室编. 1997.无机化学实验.武昌.武汉大学出版社。
13.高职高专化学教材编写组编. 2002.无机化学实验.北京.高等教育出版社。
14.奚关根,赵长宏,高建宝编.1999.有机化学实验.上海.华东理工大学出版社。
15.诸葛健,王正祥. 1994.工业微生物实验技术手册.北京.中国轻工出版社。
湿法泥Pb(207.2)Zn(65.39)SiO2(60.08)Fe(55.85)CaO(56.08)In(114.82) Sn(118.7) Ag(107.86)自产水焠渣Pb(207.2) Zn(65.39)SiO2(60.08)Fe(55.85) CaO(56.08)(Ag注:几天化一次)自产铜渣Pb(207.2)Cu(63.55)自产返炉烟尘灰Pb(207.2)Zn(65.39)SiO2(60.08)Fe(55.85)CaO(56.08)外卖烟尘灰Pb(207.2)In(114.82)Ag(107.86)熔炼渣Fe(55.85)CaO(56.08)SiO2(60.08)Cu(63.55)Ag(107.87) Au(196.97) 送化验室样品如有增加元素在化验袋上注明。
分析化学中常用的量和单位

分析化学中常用的量和单位法定的量和单位应废除的量和单位量的名称量的符号单位名称单位符号量的名称量的符号单位名称单位符号长度L 米厘米毫米纳米mcmmmnm 公尺公分毫微米英寸,Mmμmin面积A(S)平方米平方厘米平方毫米m2cm2mm2 平方英寸in2 体积,容积V 立方米立方分米,升立方厘米,毫升立方毫米,微升m3dm3,Lcm3mL,mlmm3,μLμL立升,公升西西cc,c·c 时间T 秒分[小]时天(日)sminhdsec,(”)(’)hr 质量M 千克克毫克微克纳克原子质量单位kggmgμgngu毫微克磅γmμgib相对原子质量相对分子质量ArMr 无量纲无量纲原子量分子量当量式量AMEF 无量纲无量纲无量纲无量纲物质的量nB 摩[尔]毫摩微摩molmmolμmol克分子数(摩尔数)克原子数克当量数克式量数克离子数克分子克原子克当量克式量克离子M 摩尔质量M 千克每摩[尔]克每摩kg/molg/mol 克分子[量]克原子[量]克当量克式量EF 克克克克gggg 摩尔体积Vm 立方米每摩[尔]升每摩m3/molL/mol 密度相对密度ρd千克每立方米克(每立方厘米)(克每毫升)无量纲kg/m3g/cm3(g/ml)比重物质B 的质量浓度ρB千克每升克每升(毫克每毫升)kg/Lg/L(mg/ml)质量—体积浓度克每毫升g/ml 物质B 的质量分数ωB无量纲(即含量)物质B 的物质的量浓度cB 摩每立方米摩每升mol/m3mol/L 摩尔浓度克分子浓度克离子浓度当量浓度式量浓度MMMMF 克分子每升克离子每升克当量每升克式量每升MMN 法定的量和单位应废除的量和单位量的名称量的符号单位名称单位符号量的名称量的符号单位名称单位符号物质B 的质量摩尔浓度bBmB 摩每升克mol/kg 重量摩尔浓度;重量克分子浓度压力,压强P 帕[斯卡]千帕PakPa 标准大气压毫米汞柱托巴atmmmHgTorrb 热力学温度摄氏温度Tt 开[尔文]摄氏度K℃绝对温度华氏温度开氏绝对华氏ºKºF 注:①法定单位名称和符号中顶格写的SI 单位,退后一格写的是常用的十进倍数或分数单位;②“单位名称”项中,方括号中的字,在不致混淆的情况下可以省略,省略后为其简称。
分子数和分子量

分子数和分子量分子数和分子量是化学中用来描述化学物质的重要概念。
分子数表示分子中所含原子的数量,而分子量则表示分子的相对质量。
在本文中,将介绍分子数和分子量的概念及其计算方法,以及它们在化学领域的应用。
1. 分子数的概念和计算方法分子数是指分子中的原子数量。
对于简单的分子,可以通过化学式中的原子个数来确定分子数。
例如,对于水分子H2O,其分子数为3,包括2个氢原子和1个氧原子。
对于复杂的分子,可以利用摩尔的概念来计算分子数。
摩尔是指物质的量,用单位mol表示。
1摩尔的表示方法为6.02×10^23,称为阿伏伽德罗常数,通常用符号NA表示。
根据化学式及元素的相对原子质量,可以计算出所含的摩尔数,进而得到分子数。
例如,对于二氧化碳分子CO2,根据化学式可以知道它包含1个碳原子和2个氧原子。
根据元素周期表中对应的相对原子质量,我们得知碳的相对原子质量为12.01,氧的相对原子质量为16.00。
因此,CO2的分子量为12.01 + 2×16.00 = 44.01 g/mol。
根据摩尔与分子数的关系,1摩尔CO2分子的分子数为6.02×10^23,也就是说,1 mol CO2中有6.02×10^23个CO2分子。
总结起来,计算分子数的方法可以通过化学式中的原子个数得到,或者通过分子量和阿伏伽德罗常数计算得到。
2. 分子量的概念和计算方法分子量是指分子相对于碳-12同位素的相对质量。
相对原子质量是以碳-12同位素为标准的,其质量被定义为12。
相对原子质量是使用元素的质量数加权平均计算得出的,其中考虑了元素的同位素的存在。
分子量的计算方法是将化学式中的各个原子的相对原子质量进行相加。
例如,对于水分子H2O,其中包含2个氢原子和1个氧原子,根据元素周期表可以得到氢的相对原子质量为1.01,氧的相对原子质量为16.00。
因此,水的分子量为2×1.01 + 16.00 = 18.02 g/mol。
化学物质的分子量

化学物质的分子量化学物质的分子量是指一个分子中元素的相对质量之和。
它是化学计算中十分重要的概念,可以用来确定物质的化学计量关系,揭示化学反应的本质。
下面将介绍分子量的计算方法以及其在化学实验和工业中的应用。
一、分子量的计算方法1. 元素的相对原子质量在开始计算分子量之前,我们需要了解元素的相对原子质量。
相对原子质量是指元素相对于碳-12同位素的质量比,它的单位是原子质量单位(u)。
表中列出了一些常见元素的相对原子质量。
(在这里按表格的方式列出元素和对应的相对原子质量)2. 分子式的解析一个化学物质的分子式表示了它组成的元素及其相对比例。
通过分子式,我们可以得知该物质中各元素的原子个数。
以水(H2O)为例,分子式中表明了氢原子的个数为2,氧原子的个数为1。
3. 分子量的计算分子量的计算公式如下:分子量 = 每个原子的相对原子质量之和以水(H2O)为例,氢原子的相对原子质量为1.008 u,氧原子的相对原子质量为16.00 u。
根据公式,可以得出水的分子量为 2 * 1.008 u +16.00 u = 18.016 u。
二、分子量的应用1. 化学实验中的物质计量在化学实验中,我们常常需要按照一定的摩尔比例来使用化学物质。
通过计算物质的分子量,我们可以准确地确定其摩尔质量,从而根据所需的摩尔比例来称量和混合物质。
例如,在制备氯化钠溶液时,我们需要知道氯化钠(NaCl)的摩尔质量。
由于氯原子的相对原子质量为35.45 u,钠原子的相对原子质量为22.99 u,根据分子量的计算公式,氯化钠的摩尔质量为35.45 u + 22.99 u = 58.44 u。
根据此摩尔质量,我们可以准确地称量出所需氯化钠的质量。
2. 工业生产中的化学反应在工业生产中,分子量的计算也发挥着重要的作用。
通过计算反应物和生成物的分子量,可以准确地预测反应中的化学计量关系,提高产品的纯度和产量。
例如,在制备硫酸铜(CuSO4)时,我们需要知道硫酸(H2SO4)和铜氧(CuO)的分子量。
分子量的表示

分子量的表示
分子量是化学中一个十分重要的概念,它通常用来描述分子或者化合物的质量,有助于化学家们进行实验设计和理论研究。
下面将为大家介绍分子量的表示方式及其相关概念。
一、相对分子质量
相对分子质量通常用符号“Mr”表示,它表示一个分子的质量与碳-12同位素一个原子的质量相对比的比值,无单位。
例如,氧气(O2)的相对分子质量为32,这意味着氧气的质量是碳-12的2倍。
二、分子式
分子式是描述一个分子中各元素的种类和数量的化学式,通常用字母和数字表示。
例如,甲烷(CH4)的分子式中包含一个碳原子和四个氢原子。
三、摩尔质量
摩尔质量是一个物质分子的质量,通常用符号“M”表示,单位是克/摩尔。
它等于这个分子中各元素的相对原子质量之和,例如,甲烷的摩尔质量为16克/摩尔。
四、计算分子量
计算分子量是化学实验和理论研究中常用的一种操作。
计算分子量可以帮助我们确定物质的组成和性质。
计算分子量的方法是将每种原子的相对原子质量相加,再乘以这种原子在分子中的数量。
例如,乙醇(C2H5OH)的分子量为46克/摩尔。
如果一个物质的分子量过大或过小,往往需要使用其他方法来描述它的质量。
例如,一些大分子化合物的分子量可以用相对分子质量来估算,而一些小分子则可能需要使用原子质量或电荷数来描述。
总之,分子量是化学中一个极其重要的概念,它能够帮助化学家们更好地理解分子的组成和性质。
同时,正确的分子量计算也是进行实验和理论研究的基础。
分子量mv

分子量mv分子量(Molecular Weight,简称MW)是化学中常用的一个概念。
它是指一个分子中所有原子的质量之和,通常用克/摩尔(g/mol)作为单位来表示。
分子量是分析化学、有机化学、生物化学等领域中的一个重要参数,而且它的求解方法也非常多样化。
分子量在化学中有着广泛的应用,比如可以用于确定物质的含量,评价分子量对材料的影响以及用于质谱分析等。
另外,分子量还可以用于计算反应的摩尔比,预测反应产物和控制化学反应。
因此说,分子量是化学中一个非常基础的概念,对于化学学生来说也是需要掌握的基本知识之一。
对于确定一个分子的分子量,我们可以使用化学元素周期表中元素的相对原子质量来计算。
例如,在乙醇分子中,由两个碳原子、六个氢原子和一个氧原子组成。
而相对原子质量分别为12.01、1.01和16.00。
因此,乙醇的分子量Mw可以用以下公式求解:Mw = 2 ×12.01 + 6 × 1.01 + 1 × 16.00= 46.06 g/mol如果一个化合物不是单一分子,而是由多个分子组成的,我们就需要使用相对分子质量(Relative Molecular Mass,简称RMM)来表示。
相对分子质量是一个“平均值”,它是指一定数量的分子的平均质量,而不同于每一个分子的质量。
相对分子质量可以通过分子量除以阿伏伽德罗数NA来求解。
例如,白糖的分子量是342.3 g/mol,那么它的相对分子质量为RMM = Mw / NA= 342.3 / 6.022 × 10²³= 5.68 × 10⁻²³ g除了上述方法外,我们在计算分子量时还可以使用其他的方法。
比如,我们可以使用光学旋光仪、冷泳电度或凝胶渗透色谱法进行测量。
这些方法可以得出高精度的数据,但是需要使用专业的仪器和技术。
此外,现代技术的发展还产生了一些新的方法,如质谱分析、核磁共振和激光光散射等,可以更加精确地确定分子量。
分子长度单位

分子长度单位分子长度单位是描述分子尺寸或长度的单位。
在化学和生物学领域,分子长度单位通常用来表示分子的大小、形状和结构。
本文将介绍几种常用的分子长度单位及其应用。
一、埃(Angstrom)埃是一个常用的分子长度单位,符号为Å。
1埃等于10的-10次方米,即0.1纳米。
埃通常用来表示原子之间的距离或分子的直径。
例如,水分子的直径约为2.75埃。
二、纳米(Nanometer)纳米是另一种常用的分子长度单位,符号为nm。
1纳米等于10的-9次方米,即1埃等于0.1纳米。
纳米尺度是研究纳米材料和纳米器件的重要领域。
纳米颗粒的大小通常在1到100纳米之间。
三、皮秒(Picosecond)皮秒是用来表示分子运动的时间尺度的单位,符号为ps。
1皮秒等于10的-12次方秒。
皮秒通常用来描述分子的振动、旋转和化学反应过程。
在这个时间尺度上,分子的结构和性质可能发生显著的变化。
四、纳秒(Nanosecond)纳秒是另一种常用的分子时间单位,符号为ns。
1纳秒等于10的-9次方秒,即1纳秒等于1000皮秒。
纳秒尺度是研究分子动力学的重要领域。
在这个时间尺度上,分子的构型和相互作用可能发生重要的变化。
五、分子量(Molecular weight)分子量是指分子中所有原子相对原子质量的总和。
分子量通常用原子质量单位(Dalton)表示,符号为Da。
分子量是描述分子大小的重要参数,与分子的化学性质和生物活性密切相关。
六、分子长度与性质关系分子的长度与其性质之间存在一定的关系。
例如,有机分子的长度可以影响其溶解性、熔点和沸点。
长链聚合物的分子长度可以影响其力学性质和流变行为。
同时,分子长度也与分子的电子结构和光学性质有关。
七、应用领域分子长度单位在化学、生物学、材料科学和纳米科技等领域得到广泛应用。
例如,在药物研发中,分子长度单位可以用来描述药物分子的大小和形状,从而预测其生物活性和药效。
在纳米材料和纳米器件研究中,分子长度单位可以用来表征纳米颗粒的大小和形状,从而研究其光学、电学和磁学性质。
化学物质分子量

化学物质分子量化学物质分子量是指物质中所有原子的相对原子质量总和。
通过计算分子量,可以更好地理解和描述化学反应和物质性质。
本文将介绍如何计算分子量以及其在化学领域的重要性。
一、分子量的计算方法化学物质的分子量可以通过计算各个原子质量的总和来得到。
具体步骤如下:1. 找到化学式化学式是用化学符号表示化学物质的公式。
例如,氧气的化学式为O₂,水的化学式为H₂O。
了解化学式可以帮助确定物质中各个原子的数量。
2. 查找各个原子的原子质量每种元素都有一个特定的原子质量,可以通过化学元素周期表查阅得到。
例如,氧的原子质量为16,氢的原子质量为1。
3. 计算各个原子的贡献根据化学式中每个原子的数量,乘以其对应的原子质量,得到每个原子的贡献。
例如,氧气中有2个氧原子,氢氧中有2个氢原子,分别计算得到氧的贡献为16 x 2 = 32,氢的贡献为1 x 2 = 2。
4. 求和得到分子量将各个原子的贡献相加,得到化学物质的分子量。
例如,氧气的分子量为32,水的分子量为18。
二、分子量的意义1. 描述化学反应在化学反应中,了解物质的分子量可以帮助预测反应的产物。
通过比较反应物和产物的分子量,可以确定反应中发生了哪些化学变化。
分子量还可用于计算化学反应的理论产量和实际产量之间的比值。
2. 确定物质的性质分子量对理解物质的性质也有重要意义。
分子量较大的物质通常具有较高的沸点和熔点,较低的蒸汽压和较高的相对密度。
通过比较不同物质的分子量,可以推断其物理性质和化学性质的差异。
3. 实验设计在实验设计过程中,分子量的计算也起到关键作用。
通过知道反应物的分子量,可以确定所需的反应物的量。
在合成化学中,知道所需化学物质的分子量可以帮助计算所需的反应物的质量或体积,以及合成产物的理论产量。
4. 药学和生化研究在药学和生化研究中,分子量是一种基本的生物指标。
通过计算或测定药物、蛋白质、核酸等生物分子的分子量,可以衡量其活性、稳定性和相互作用能力。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学常用单位、元素分子量和常用物质分子量
附录2 常用酸碱试剂的密度和浓度
附录4 相对原子质量表(1993年)
附录5常用缓冲溶液的配制
参考文献
1.刘珍主编.1998.化验员读本(第3版).北京.化学工业出版社。
2.张济新等编. 1997.分析化学实验(第1版).上海.华东理工大学出版社。
3.张英主编. 200
4.食品理化与微生物检测实验.北京.中国轻工业出版社。
4.张英主编. 2004.生物与化学基本技能实训指导.广州.广东科技出版社。
5.胡伟光,张文英主编. 2004.定量化学分析实验.北京.化学工业出版社。
6.无锡轻工业学院等编. 1995.微生物学(适用于工业发酵专业).北京.中国轻工出版社。
7.方富禄主编. 2001.有机化学实验.北京.高等教育出版社。
8.孙守田主编. 1980.化验员基本知识(第1版).北京.化学工业出版社。
9.吕春绪诸松渊主编. 1994.化验室工作手册.南京.江苏科学技术出版社。
10.宋清,张德聪编. 1996.实验设计与数据评价.广州.华南理工大学出版社。
11.周惠琳等.1993年.无机化学实验.广州.暨南大学出版社。
12.武汉大学化学系无机化学教研室编. 1997.无机化学实验.武昌.武汉大学出版社。
13.高职高专化学教材编写组编. 2002.无机化学实验.北京.高等教育出版社。
14.奚关根,赵长宏,高建宝编.1999.有机化学实验.上海.华东理工大学出版社。
15.诸葛健,王正祥. 1994.工业微生物实验技术手册.北京.中国轻工出版社。
