离子选择电极
《离子选择电极》课件

晶体膜电极的制备
要点一
总结词
晶体膜电极通常采用沉淀法或气相沉积法制备,其制备过 程相对复杂,需要精确控制反应条件和结晶过程。
要点二
详细描述
晶体膜电极的制备通常包括以下步骤:首先选择适当的反 应物和溶剂,并控制反应条件,如温度、压力、浓度等; 然后通过沉淀法或气相沉积法使反应物在基底上形成结晶 ;接着对这些结晶进行热处理和退火处理,以优化结晶结 构和性能;最后对结晶进行研磨和抛光,制成敏感膜。
环境监测
离子选择电极可用于检测水体、土壤等环境样品中的离子 浓度,如pH值、氯离子、氟离子等,有助于环境质量的 评估和污染治理。
医学诊断
离子选择电极在医学诊断中用于监测体液中离子的浓度变 化,如血液中的钾离子、钠离子等,对于诊断和治疗疾病 具有重要意义。
食品分析
在食品分析中,离子选择电极可用于检测食品中的矿物质 、添加剂和有害物质,如硝酸盐、亚硝酸盐等,以确保食 品的安全和品质。
液体膜电极的制备
总结词
液体膜电极通常采用涂布法或浸渍法制备,其制备过程 相对简单,需要选择合适的液态敏感膜材料和基底。
详细描述
液体膜电极的制备通常包括以下步骤:首先选择适当的 液态敏感膜材料和基底;然后将液态敏感膜材料涂布或 浸渍在基底上;接着对这些涂布或浸渍后的基底进行干 燥和固化处理;最后对固化后的膜进行研磨和抛光,制 成敏感膜。
离子选择电极的原理
离子选择电极的敏感膜对目标离子具有选择性响应,能够结合目标离子,从而改变膜电位。膜电位的 变化与目标离子的浓度成一定关系,通过测量膜电位的变化可以推算出目标离子的浓度。
内参比电极的作用是提供稳定的电位参考点,而内参比溶液则维持一定的离子强度,以便进行准确的 浓度测量。
第三节离子选择性电极要点

三、离子选择性电极性能参数
(一)线性范围及检测下限 E
D
离子选择性电极定量测定的依据 是能斯特方程:
EK
2.303RT ZiF
lg
ai
直线部分所对应的离子活度范围 称为离子选择电极响应的线性范 围。CD和AB延长线的交点N所对 应的活度称为检测下限。影响检 测下限的主要因素是电极敏感膜 的溶解度,也与实验条件有关。
• 液体离子交换剂:其极易扩散进 入微孔膜,但不溶于水,故不能 进入试液溶液。
(二)非晶体膜电极
二癸基磷酸根可以在液膜-试液两相界面间传
递钙离子,直至达到平衡。由于Ca2+在水相(试液
和内参比溶液)中的活度与有机相中的活度差异,
在两相之间产生相界电位。液膜两面发生的离子交
换反应:
[(RO)2PO2]2Ca2+(有机相)=2(RO)2PO2-(有机相)+Ca2+(水相)
第三节 离子选择性电极
selective ionic electrode(SIE)
❖ 一、离子选择性电极的共同特点 ❖ 二、离子选择性电极的类型 ❖ 三、离子选择性电极性能参数
一、离子选择性电极的共同特点
对某种离子有选择性响 应的电极称为离子选择性电 极又称膜电极,是一种电化 学传感器。电极表面上不发 生电极反应,仅对溶液中特 定离子有选择性响应(选择 性地让某种离子渗透)。
Kij 的意义为在相同实验条件下,产生相同电 位的待测离子活度 ai 与干扰离子活度 aj 的比值:
因此, Kij 越小表示电极的选择性越高。
例如: KH ,Na 1011
LaF3 + 空穴 → LaF2+(新空穴) + F-
✓ 线性范围和检测下限::
离子选择电极名词解释

离子选择电极名词解释
离子选择电极(ISEs,Ion-Selective Electrodes)是用来测定电离溶液中某
一离子浓度的传感器,也是一种化学传感技术。
它通过检测溶液中该离子所起作用的电位变化而测定离子浓度。
原理上,离子选择电极包含了一个过滤层,它能够选择地阻挡离子通过;而在探极与溶液界面上,这个离子可以从探极向溶液传输电荷。
对于二者间形成的静电场,在该离子的电势存在的情况下,会有电位偏移发生。
这就是它的原理。
离子选择电极的结构主要由固定极和浮动极组成,前者通过一个过滤层与离子接触,而后者则能够用多种途径来探测电位变化。
使用的应用领域很多,如分析化学,环境学,生物学检测,生态监测,食品安全,农业分析,水处理厂检测等。
离子选择电极是一种利用电化学原理来激发特定环境中的溶液中的离子活动,
从而检测出其电位变化所产生的特征信号而达到测量离子浓度的仪器。
它的优点是灵敏度高,选择性强,且容易操作。
它不仅可以测量阴离子和阳离子浓度,还能够用来学习各种环境及生物系统中离子变化的定量关系,从而对相应的场合及有关因素更好地掌控性。
离子选择电极在现代实验室及理化分析中也起着不可或缺的作用。
离子选择电极的原理

离子选择电极的原理
离子选择电极是一种能够选择性地检测特定离子的电极。
它基于离子的电势差,利用溶液中特定离子与电极之间的相互作用,实现对离子的测定。
离子选择电极通常由两个部分组成:离子选择膜和参比电极。
离子选择膜是一种选择性通透特定离子的薄膜,它可以通过渗透作用使特定离子与电极表面发生反应。
参比电极则是一个用于测量电位变化的电极。
在离子选择电极工作时,当特定离子与电极表面发生化学反应时,电子转移会导致电势差的变化。
该电势差可以通过与参比电极相比较来测量。
当特定离子的浓度增加时,其与电极表面的反应也增加,导致电势差的变化更明显,从而可以间接测量出离子的浓度。
离子选择电极的原理是基于离子与电极的相互作用。
这种相互作用可以是化学吸附、电分析或其他形式的反应。
离子选择膜的选择性通透性使得只有特定离子能够与电极表面发生反应,而其他离子则被屏蔽在选择膜的外部。
因此,离子选择电极可以实现对特定离子的选择性检测。
总体而言,离子选择电极的原理是通过选择性通透膜和参比电极来实现对特定离子的测定。
通过测量电势差的变化,可以间接检测出离子的浓度。
离子选择电极在环境监测、生物医学、食品安全等领域具有广泛的应用前景。
离子选择性电极的研究与应用

离子选择性电极的研究与应用离子选择性电极是一种主要用于分析水和生物液体中离子含量的传感器,由于其分析快速、准确、便携等特点,广泛应用于环境、医学、生命科学和食品工业等领域。
本文将探讨离子选择性电极的研究和应用。
一、离子选择性电极的原理离子选择性电极是一种化学传感器,主要由三个部分构成:电极本体、参比电极和通路。
电极本体中含有选择性固定在载体上的离子载体,它与被分析的离子发生配合或离解反应。
参比电极用于保持电位稳定并提供参考,通路用于连接电极本体和参比电极,形成电路。
当被分析的离子接近电极表面,它会与选择性载体产生反应,导致电荷分布的改变,从而产生电势变化。
通过电势测量,可以得出被分析离子的浓度。
二、离子选择性电极的种类离子选择性电极根据选择性载体的选择可以分为不同种类。
常见的选择性载体有有机物、离子交换树脂、表面活性剂和生物分子等。
1. 有机物选择性电极有机物选择性电极在环境分析和食品工业中广泛应用。
例如,氯离子选择性电极常用于测量饮用水和游泳池中的氯含量,其选择性载体是对甲酚磺酸乙酯。
硝酸盐选择性电极用于测量土壤和肥料中的硝酸盐,其选择性载体是二甲酸酯。
2. 离子交换树脂选择性电极离子交换树脂选择性电极使用的是离子交换树脂作为选择性载体。
它们主要用于生化分析中,例如氢离子选择性电极被广泛用于测定生命体系中的酸碱度。
此外,钾、钠离子选择性电极也是离子交换树脂选择性电极的常见类型。
3. 表面活性剂选择性电极表面活性剂选择性电极主要被用于医学和生物化学领域的研究中。
例如,阻抗相应型EDA(二乙氨基乙二胺)选择性电极用于测量体液中的钾离子、氨离子和钙离子等。
4. 生物分子选择性电极生物分子选择性电极用生物分子作为选择性载体,主要用于生命科学研究。
例如,谷氨酸选择性电极用于测量生物体中的谷氨酸浓度,其选择性载体是谷氨酰胺。
三、离子选择性电极的应用离子选择性电极的应用范围广泛,在环境、医学和生命科学领域中具有诸多优点。
离子选择性电极安全操作及保养规程

离子选择性电极安全操作及保养规程离子选择性电极(ISE)是一种常用的电化学分析仪器,广泛应用于化学、环境、食品工业等领域。
本文将介绍ISE的安全操作和保养规程,以确保正常工作和长期使用。
1. ISE的安全操作1.1 仪器的安装先使离子选择性电极插入电解质中,如测量氯离子,则插入市售的浓度为0.1mol/L的Cl^-溶液中,抽掉电解质缓慢旋转,橡胶冲头不能碰到容器底部,螺纹柄不能触碰电解质。
将ISE插到主仪器上,并保证电极头与样品接触,一般应待5分钟左右才能得到准确数据。
1.2 仪器的使用1.2.1 操作规程使用ISE前应了解其使用范围及测量限度,如果超出范围和限度,结果会相当不准确,所以使用离子选择性电极时,应遵守以下规程:•准确记录计算后的校正因子、校正时间和样品状态,保证数据的准确性。
•在测量的同时,应先冲洗和暴露电极,然后再进行测量。
•样品不应大于电极中的填充液,在电解质中一般为5mm左右,过多的样品会影响结果。
•处理样品时应小心,不要让其污染离子选择性电极。
•操作完毕后及时清洁ISE。
1.2.2 操作技巧•样品的搅拌:由于电极头受到液体分子的影响,电极中会形成一个静电区,影响离子的扩散和电感的变化。
所以,在测量时需要对样品进行搅拌,使样品均匀布置。
•测量时温度要控制在20℃左右,如果过冷或过热都会影响测量。
•操作完毕后要及时将电极头暴露,避免发生氧化等化学反应,在储存的时候可以放置在电极架上,如果想长期储存,可以将电极头泡在PH4和PH6.9的缓冲溶液中。
1.3 仪器的保养1.3.1 使用期间使用期间需要注意以下几点:•操作完毕后要及时清洁电极表面,用盐水或蒸馏水冲洗电极头和开口处,防止污染离子选择性电极,影响使用效果和寿命。
•按照使用说明书要求进行校正。
•如离子选择性电极出现分离或脱开现象,应该立即停止使用。
1.3.2 停止使用后离子选择性电极停止使用后应该进行特殊保养:•使用蒸馏水将浸泡在电极头中的盐分固体清洗干净,弄干,然后涂上填充液。
离子选择电极

电极介绍
离子选择性电极:(电极结构、晶体电极(均相晶膜电极(F-、Ag2S)、多相晶膜电极)、流动载体电极(K+、 Ca2+)、敏化离子(灵敏度、响应范围、选择性系数、响应时间、稳定性、内阻、准确性)
电极构造
离子选择电极的构造主要包括: 电极腔体――玻璃或高分子聚合物材料做成 内参比电极――通常为Ag/AgCl电极 内参比溶液――由氯化物及响应离子的强电解质溶液组成 敏感膜――对离子具有高选择性的响应膜
离子选择电极
利用膜电位测定溶液中离子活度或浓度的电化学传感器
01 电极介绍
03 电极构造 05 响应范围
目录
02 基本特性 04 发展历史 06 其它应用
离子选择电极又称离子电极。一类利用膜电位测定溶液中离子活度或浓度的电化学传感器。1906年由R.克里 默最早研究,随后由德国哈伯(F.Harber)等人制成的测量溶液PH的玻璃电极是第一种离子选择电极,到60年代 末,离子选择电极的商品已有20多种。离子选择电极具有将溶液中某种特定离子的活度转化成一定电位的能力, 其电位与溶液中给定离子活度的对数成线性关系。离子选择电极是膜电极,其核心部件是电极尖端的感应膜。按 构造可分为固体膜电极、液膜电极和隔膜电极。离子选择电极法是电位分析的分支,一般用于直接电位法,也可 用于电位滴定。该法的特点是:①测定的是溶液中特定离子的活度而不是总浓度;②使用简便迅速,应用范围广, 尤其适用于对碱金属、硝酸根离子等的测定;③不受试液颜色、浊度等的影响,特别适于水质连续自动监测和现 场分析。PH和氟离子的测定所采用的离子选择电极法已定为标准方法,水质自动连续监测系统中,有10多个项目 采用离子选择电极法。
发展历史
离子选择性电极的分类 1906年发现玻璃膜电位现象,1929年制成实用的玻璃pH电极;上世纪50年代末制成 了碱金属玻璃电极;1965年制成了卤离子电极;随后,有选择性响应的各种电极得到迅速发展。1976年,IUPAC 建议将这类电极称为离子选择性电极(SIE),并作详细分类。
离子选择电极法

离子选择电极法
离子选择电极法是一种分析离子浓度的分析方法,原理是利用离子选择性与离子浓度
之间的反比关系来测定离子浓度。
它是一种密闭系统,离子无法流失,这将影响离子的浓度,但电极传感器不受影响,这样就可以以测量离子选择性与离子浓度变化的比值作为离
子浓度的标准。
仪器包括电极电源,电极反应池,电极,变送器,零件等。
电极反应池是一种容纳离
子扩散的容器,它有两个电极,一个总是处于阳极模式的离子选择性电极,另一个是处于
阴极模式的离子选择性电极。
在反应池中,阳极电极会吸收离子,而阴极电极则传递电流
反应产生的离子,变送器将电流转换成离子浓度,从而反映离子浓度的变化。
如果要检测准确的离子浓度,必须首先准备若干溶液,分别加入相同量的离子溶液,
然后将它们设置在探针中,并将探针放入电极反应池中,建立电荷平衡。
之后,利用变送
器检测每种离子的浓度,并由此得出离子的浓度比值。
由于每种离子的离子选择电极有不
同的电位,所以离子浓度比值是与离子浓度正比的,因此可以通过测量离子选择性与离子
浓度比值来实现离子浓度的准确测定。
离子选择电极法在医学领域有着广泛的应用,例如在血液检测和尿检时常用这种方法
来测量血钠、血磷、血糖等离子。
此外,离子选择电极法还常用于水质检测,在水源中监
测有害离子,如氰化物和硫化物的浓度,确保水质的活性和安全用途。
在食品行业,离子
选择电极法也被广泛应用,常用于测量水果汁中的离子浓度,监测食物的品质及安全控制。
离子选择性电极工作原理

离子选择性电极工作原理
离子选择性电极是一种特殊的电极,它能根据离子种类的不同选择性地响应特定离子的浓度变化。
离子选择性电极常用于离子测量、分析和监测等领域。
离子选择性电极由两部分组成:可溶性离子选择电介质和导电电极。
可溶性离子选择电介质通常是一种可溶于水的化合物,它与特定的离子具有较强的亲和力。
当离子选择电介质接触到溶液中的离子时,一些离子会与电介质发生离子交换,形成离子选择性电荷层。
导电电极是由导电材料制成,通常是银、铜或银/铜合金等。
导电电极与电介质接触,形成导电电介质界面。
由于离子选择性电介质上的离子选择性电荷层,该界面形成了一个电势差。
当电极浸入待测试溶液中时,离子选择性电介质会与该溶液中的离子发生离子交换。
根据不同离子选择性电介质的特性,只有特定离子能够与电介质发生交换。
这导致电介质界面上的电势差发生变化,这种变化与待测离子的浓度成正比。
为了测量电势差的变化,离子选择性电极常常与参比电极一起使用,构成电池。
参比电极的电势相对稳定,它提供一个基准电势,使得测量的电势差能够与待测离子的浓度成比例变化。
通过测量电势差的变化,我们可以根据已知浓度下的标准曲线来计算待测离子的浓度。
这种方法可以用于水质监测、药物分析、环境监测等各种应用中。
总之,离子选择性电极通过离子选择电介质和导电电极的相互作用,根据特定离子的选择性响应其浓度变化。
这种工作原理使得离子选择性电极在离子测量等领域具有重要的应用价值。
第八节离子选择性电极法

参 恒定
5
♣ 电池电动势:
E= Φ –Φ参 ={ Φ0 — 2.303RT/Flga(F-)} –Φ参 = k – 0.0592 lg aF- (25℃) =K + 0.0592 pF
活度系数一定时,E与F离子浓度的对数呈线性关系
♣ 适用pH范围: 5 ~ 6(最佳5.8)
碱性体系: LaF3 + 3OH- = La(OH)3 + 3F膜表面aF-↑,结果偏高, 损坏电极
*
7
标准曲线法的特点
➢ 1操作简单,适合简单体系的样品,但要求标准 溶液和待测溶液的组成相近,溶液的离子活度 相同,温度相同。一般需要加入适当的“离子 强度缓冲剂”,以确保标准溶液和试样的离子 活度一致,同时控制溶液的PH和掩蔽干扰离子。
➢ 2可测范围广,适合批量样品分析
➢ 3即使电极响应不完全服从Nernst方程,也可得 到满意结果
离子选择电极的特点
1)选择性好。对被测离子具有较高选择性响应的离子选择电 极,共存离子干扰小,样品不需复杂的预处理,不受试样 颜色、浑浊、悬浮物、或粘度的影响。
2)操作简单,分析速度快。单次分析只需几分钟。
3)灵敏度高,测定范围宽, 氟离子选择电极法的检测范围
10-1~10-6mol/L
4)易实现连续分析和自动分析。
酸性体系: 2F-+H+=HF-2 aF-降低,结果偏低
*
6
三分析方法
1标准曲线法
配制一系列浓度不同的F标准溶液, 并分别与氟离子选择性电极和饱和甘汞 电极组成化学电池,测定其电动势,绘 制E~ loga曲线;在相同条件下,测定由 试样溶液和电极组成电池的电动势Ex, 并从标准曲线上查出对应的logax, 求出 待测离子浓度。
第1节离子选择电极的分类及响应机理

6/15/2024
16
酶催化反应:
尿酶
CO(NH2 )2 + H2O ──→ 2NH3 + CO2
葡萄糖氧化酶
氨电极检测
葡萄糖 + O2 + H2O ────→ 葡萄糖酸 + H2 O2
氧电极检测
氨基酸氧化酶
R-CHNH2 COO- +O2 +H2 O ────→
R-COCOO- +NH4+ +H2 O2
一、电位分析原理
将离子选择性电极(指示电极)和参比电极插入试液可以 组成测定各种离子活度的电池:
参比电极 试液 指示电极 电池电动势为:
E
K
2.303RT nF
lg
ai
离子选择性电极作正极时,
对阳离子响应的电极,取正号;
对 阴离子响应的电极,取负号。
6/15/2024
1
(一)电位分析的理论基础
制作关键:生物组织膜的固定,通常采用的方法有物理 吸附、共价附着、交联、包埋等。
6/15/2024
18
组织电极的酶源与测定对象一览表
6/15/2024
19
氨基酸通过以上反应后检测,或进一步氧化放出CO2 , 用气敏电极检测。
6/15/2024
17
(3)组织电极
特性:以动植物组织为敏感膜;
优点:
a. 来源丰富,许多组织中含有大量的酶; b. 性质稳定,组织细胞中的酶处于天然状态,可发挥较 佳功效;
c. 专属性强; d. 寿命较长; e. 制作简便、经济,生物组织具有一定的机械性能。
[(RO)2PO]2 - Ca2+ (有机相) = 2 [(RO)2PO]2 -(有机相) + Ca2+ (水相)
离子选择性电极的概念、构成、原理和分类

离子选择性电极的概念、构成、原理和分类
一.概念
离子选择性电极又称膜电极(ISE,ion selective electrode),是具有敏感膜并能产生膜电位、基于离子交换或扩散的电极。
二、构成
主要由离子选择性膜、内参比电极(通常为Ag/AgCl电极)、内参比溶液组成(由氯化物及相应离子的强电解质溶液组成)。
三、工作原理
离子选择性电极是通过某些离子在膜两侧的扩散、迁移和离子交换等作用,选择性地对某个离子产生膜电势、而膜电势与该离子活度的关系符合Nernst方程。
E0---电极的标准电压;
R---气体常数(8.31439焦耳/摩尔和℃);
T---开氏绝对温度(例:20℃相当于(273.15+20)293.15开尔文);
F----法拉弟常数(96485.3383±0.0083C/mol);
N---被测离子的化合价(银=1,氢=1);
ln(αMe)---离子活度αMe的对数;
公式推导:ΔE=lgαMe,即电位与离子活度的对数成线性关系。
四、分类
1) 根据电极外壳材质分为:塑料外壳和玻璃外壳,其中塑料外壳不可添加电解液
2) 根据电极结构分类:复合电极和非复合电极,一般在线应用上多采用非复合电极形式,即测量电极与参比电极分离式。
3) 根据膜性质不同:有非晶体膜电极、晶体膜电极、敏化电极等
4) 根据电缆连接线分类:有一体式电极和分体式电极。
其中分体式电极多用于在线安装,常用VP接头,电缆线根据要求定制。
三、离子选择性电极
4.电位选择系数 若测定离子为i,干扰离子为j:
膜 = K +0.059 lg[ai + Ki,j (aj) ] n
Ki,j:在相同的测定条 Ki,j= 件下,待测离子和干 扰离子产生相同电位 时待测离子的活度αi 与干扰离子活度αj的比值.
ni nj
ai (aj)
ni nj
Ki,j表明i离子选择性电极抗j离子
则: 膜 = 外 内
= 常数 + 0.059 lg a外
= 常数 0.059 pH
玻 = AgCl/Ag+ 膜
= K 0.059 pH
讨论: (1) 玻 = K 0.059 pH
(2) 不对称电位 理论上: a外= a内 , 膜=0
实际上: 膜≠0
长时间在水中浸泡后(24 h)恒定L的NaCl,使溶液保持较大稳 定的离子强度; 0.25mol/LHAc和0.75mol/LNaAc, 使溶液pH在5左右; 0.001mol/L的柠檬酸钠, 掩蔽Fe3+ 、Al3+等干扰离子。
(2)标准加入法适于复杂样品的测定
2.303 RT (x1 c E1 K lg( xi1icxx)) nF
(3) 高选择性
测定pH怎样
(4) 酸差和碱差或钠差
酸差:?;钠差:? 电极的适用pH范围 (5) 不受溶液中氧化剂、还原剂、 颜色及沉淀的影响,不易中毒
(6) 玻璃电极不用时应放水中保存
(2)流动载体膜电极(液膜电极)
Ca离子交换剂:二癸基磷酸钙 有机溶剂:苯基磷酸二辛酯
带负电荷载体电极 流动载体电极:
酸碱滴定法
pH
NaOH加入量
2.滴定终点确定方法 (1)E-V曲线法 (2)一级微商法 ΔE/ΔV -V曲线法
2.离子选择性电极分类及原理解析

1.晶体膜电极(氟电极)
结构:右图
敏感膜:(氟化镧单晶)
掺有EuF2 的LaF3单晶切片;
内参比电极:Ag-AgCl电极(管 内 )。 内参比溶液:0.1mol/L的NaCl和0.1mol/L的NaF混合溶液(F-用 来控制膜内表面的电位,Cl-用以固定内参比电极的电位)。
原理:
LaF3的晶格中有空穴,在晶格上的F-可以移 入晶格邻近的空穴而导电。离子的大小、形状 和电荷决定其是否能够进入晶体膜内。
当氟电极插入到F-溶液中时,F-在晶体膜 表面进行交换。25℃时:
RT lna F =K - 0.059 lgaF- = K + 0.059 pF E膜 = K nF
具有较高的选择性,需要在pH5~6之间使 用。 pH高时,溶液中的OH-与氟化镧晶体膜中 的F-交换。 pH较低时,溶液中的F -生成HF。
lg ci E
E E
nF
lnai
2、标准加入法
设某一试液体积为V0,其待测离子的浓度为cx, 往试
液中准确加入一小体积Vs(大约为V0的1/100)的用待测
离子的纯物质配制的标准溶液, 浓度为Cs(约为Cx的100 倍)。由于V0>>Vs,可认为溶液体积基本不变。则: 浓度增量为:⊿c = Cs Vs / V0
2.303 RT E1 K lg( xi i c x ) nF
2.303 RT E2 K lg( x2 2 c x x2 2 c) nF
可以认为γ 2≈γ 1,χ 2≈χ 1。则:
2.303 RT c E E2 E1 lg(1 ) nF cx
2.303 RT 令:S ; nF c 则: E S lg(1 ) cx c x c(10 E / s 1) 1
离子选择性电极

分类方法
按敏感膜类型分类
可分为晶体膜电极、液膜电极、气膜电极 和生物膜电极等。
按响应离子类型分类
可分为阳离子选择性电极、阴离子选择性 电极和两性离子选择性电极等。
按应用领域分类
可分为环境监测电极、生物医学电极、食 品分析电极和工业过程控制电极等。
常见类型及其特点
晶体膜电极
以晶体材料为敏感膜,具有高选择性和稳定性,但响应时 间较长。如氟离子选择性电极,用于测定水样中的氟离子 含量。
检测土壤中的重金属离子(如镉、铅等)含量,评估 土壤污染程度。
大气污染监测
用于大气颗粒物中有害离子的检测,揭示大气污染来 源和程度。
水体富营养化监测
监测水体中的磷酸根离子、硝酸根离子等营养盐含量 ,评估水体富营养化状况。
其他领域的应用拓展
食品工业
检测食品中的添加剂和有害离子含量,确保食品 安全。
农业领域
生物医学领域的应用
血液分析
用于血液中钾离子、钠离子、钙 离子等关键离子的检测,辅助诊
断疾病。
药物分析
检测生物样品(如尿液、血清等) 中药物离子的浓度,评估药物治疗 效果。
生物传感器
将离子选择性电极与生物识别元件 相结合,构建高灵敏度的生物传感 器,用于生物分子识别和检测。
环境科学中的应用
土壤污染监测
用于土壤和肥料中关键离子的检测,指导农业生 产。
能源领域
在电池、燃料电池等能源转换和存储技术中,离 子选择性电极可用于监测和优化离子传输过程。
谢谢您的聆听
THANKS
离子扩散
待测离子在溶液中扩散至电极膜 表面。
离子交换与迁移
待测离子与膜内离子载体进行交 换,并在膜内迁移。
第2节 离子选择性电极的分类及响应机理

因此其应用开始普及; 1960年代,对 pH 敏感膜进行了大量而系统的研究,发展了许多对 K+、Na+、
Ca2+、F-、NO3-响应的膜电极并市场化。
玻璃电极包括对H+ 响应的pH玻璃电极及对K+ 、 Na+ 等离子响应的pK、pNa玻璃电极。
3. pH玻璃电极的前处理
硅酸盐玻璃的结构如下图:玻璃中有 金属离子、氧、硅三种元素,O-Si-O 键在空间构成固定的带负电荷的三维网 络骨架,金属离子与氧原子以离子键的 形式结合,存在并活动于网络之中承担 着电荷的传导。
Na+ Na+
O
O
O Si O Si O Na
O
O
Ca2+
Na+
Na+ Ca2+ 图7-4 硅酸盐玻璃的结构
(1) 干玻璃不具有响应H+的功能
因为玻璃中没有可供H+交换的 点位,所以对H+没有响应。
因此对pH玻璃电极必须进行前处理。
水化
?
蒸馏水浸泡
(2) pH玻璃电极的前处理
当内外玻璃膜与水溶液接触时,Na2SiO3晶体 骨架中的Na+与水中的H+发生交换:
H+ + Na+ Gl-
Na+ + H+ Gl-
pH玻璃电极的响应机理图示
E外 Ed外
Ed内 E内
++++++++++ ++++++++++
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
三、离子选择电极(Membrane potential and ISE)和膜电位1. 膜电位及其产生膜电极(Membrane potential and ISE),具有敏感膜且能产生膜电位的电极。
膜电位产生于被分隔两边不同成分的溶液,测量体系为:参比电极1|溶液1|膜|溶液2|参比电极2膜电极特点:仅对溶液中特定离子有选择性响应(离子选择性电极)。
膜电极的关键:选择膜的敏感元件。
敏感元件构成:特殊组分的玻璃、单晶、混晶、液膜、高分子功能膜及生物膜等。
膜电极组成的半电池,没有电极反应;相界间没有发生电子交换过程。
表现为离子在相界上的扩散,造成双电层存在,产生界面电位差。
该类主指离子选择性电极。
•膜电位: = 膜内扩散电位和膜与电解质溶液形成的内外界面的Donnan电位的代数和。
膜电位=扩散电位(膜内) + Donnan电位(膜与溶液之间)(1)扩散电位:液液界面或固体膜内,因不同离子之间或离子相同而浓度不同而发生扩散即扩散电位。
其中,液液界面之间产生的扩散电位也叫液接电位。
特点:这类扩散是自由扩散,正负离子可自由通过界面,没有强制性和选择性。
(2)Donnan电位:选择性渗透膜或离子交换膜,它至少阻止一种离子从一个液相扩散至另一液相或与溶液中的离子发生交换。
这样将使两相界面之间电荷分布不均匀——形成双电层——产生电位差——Donnan 电位。
这类扩散具强制性和选择性。
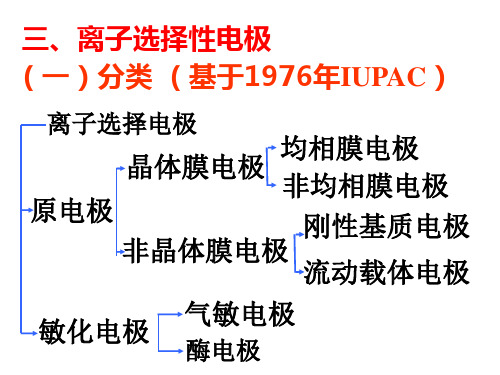
2. 离子选择性电极ISE 原电极晶体膜均相膜如F-,Cl-,Cu2+非均相膜如硅橡胶膜非晶体膜刚性基质如PH,PNa流动载体带正电荷如NO3-,ClO4-,BF4-带负电荷如Ca2+, Mg2+中性如K+敏化电极气敏电极如CO2, NH4+电极生物电极如酶电极,生物组织电极玻璃电极构成:是一种特定配方的玻璃吹制成球状的膜电极,这种玻璃的结构为三维固体结构,网格由带有负电性的硅酸根骨架构成,Na+可以在网格中移动或者被其他离子所交换,而带有负电性的硅酸根骨架对H+有较强的选择性。
当玻璃膜浸泡在水中时,由于硅氧结构与氢离子的键合强度远大于其与钠离子的强度(约为1014倍),因此发生如下的离子交换反应:G-Na+ + H+↔G+H+ + Na+电极构造球状玻璃膜(Na2SiO3,0.1mm厚)+[内参比电极(Ag/AgCl)+缓冲液]膜电位产生机理当内外玻璃膜与水溶液接触时,Na2SiO3晶体骨架中的Na+与水中的H+发生交换:G-Na+ + H+====G-H+ + Na+因为平衡常数很大,因此,玻璃膜内外表层中的Na+的位置几乎全部被H+所占据,从而形成所谓的“水化层”。
选择膜的一面与被测溶液接触,另一面与电极的内充液相接触,内充液中含有固定浓度的被测离子。
膜内外被测离子活度的不同而产生电势差,将膜电极和参比电极一起插到被测溶液中,则电池结构为:玻璃膜=水化层+干玻璃层+水化层电极的相=内参比液相+内水化层+干玻璃相+外水化层+试液相膜电位ϕm= ϕ外(外部试液与外水化层之间)+ϕ玻(外水化层与干玻璃之间)- ϕ玻’(干玻璃与内水化层之间)- ϕ内(内水化层与内部试液之间)pH测定的电池组成为:Ag,AgCl ⎢pH溶液(已知浓度) ⎢玻璃膜⎢pH试液⎢⎢KCl(饱和) ⎢Hg2Cl2,Hg内外参比电极的电势值固定,且内充溶液中离子的活度也一定,则电池电动势为:ϕ内= k1 + 0.059lg(a2/a2’ )ϕ外= k2 + 0.059lg(a1/a1’)由于玻璃膜内、外表面的性质基本相同,则k1=k2,a1’ = a2’ϕm = ϕ外- ϕ内= 0.059lg(a1 /a2)由于内参比溶液中的H+活度(a2)是固定的,则:ϕm = K´+0.059lg a1 = K´- 0.059pH试液a1、a2分别表示外部试液和电极内参比溶液的H+活度;a1’、a2’分别表示玻璃膜外、内水合硅胶层表面的H+活度;k1、k2则是由玻璃膜外、内表面性质决定的常数。
玻璃电极特点•不对称电位:当玻璃膜内外溶液H+浓度或pH值相等时,ϕm=0,但实际上ϕm不为0,这说明玻膜内外表面性质是有差异的,如表面的几何形状不同、结构上的微小差异、水化作用的不同等。
消除方法:充分浸泡电极和用标准pH缓冲溶液校正。
•酸差:当用pH玻璃电极测定pH<1的强酸性溶液或高盐度溶液时,电极电位与pH之间不呈线性关系,所测定的值比实际的偏高:因为H+浓度或盐份高,即溶液离子强度增加,导致H2O分子活度下降,即H3O+活度下降,从而使pH测定值增加。
•碱差或钠差:当测定较强碱性溶液pH值时,玻璃膜除对H+响应,也同时对其它离子如Na+响应。
因此pH测定结果偏低。
pH电极的最佳适用范围:pH1~9•当用Li玻璃代替Na玻璃吹制玻璃膜时,pH测定范围可在1~14之间。
•通过改变玻璃膜的结构可制成对K+、Na+、Ag+、Li+等响应的电极。
有H+,Na+,K+,Ag+,Li+的玻璃电极。
•对H+有高度选择性的指示电极,使用范围广,不受氧化剂、还原剂、有色、浑浊或胶态溶液的pH测定;响应快(达到平衡快)、不沾污试液。
缺点:膜太薄,易破损,且不能用于含F-的溶液;电极阻抗高,须配用高阻抗的测量仪表。
2).晶体膜电极(典型:氟电极)结构:()敏感膜:(氟化镧单晶):掺有EuF2的LaF3单晶切片;内参比电极:管内的Ag-AgCl电极。
内参比溶液:0.1 mol/L NaCl + 0.10 mol/L NaF原理: LaF3的晶格中有空穴,在晶格上的F-可以移入晶格邻近的空穴而导电,对于一定的晶体膜,离子的大小、形状和电荷决定其是否能够进入晶体膜内,故膜电极一般都具有较高的离子选择性。
当氟电极插入到含有F-的溶液中时,F-在晶体膜表面进行交换,如果溶液中的F-活度较高,则溶液中的F-进入晶体。
反之,晶体表面的F-进入溶液。
由此产生的膜电势与溶液中的F-活度的关系,在一定范围内可以用奈斯特方程来表示。
25℃时:ϕ膜= K-0.059lg a F- = K+0.059pF酸度影响:OH-与LaF3反应释放F-,使测定结果偏高;H+与F-反应生成HF或HF2-降低F-活度,使测定偏低。
减小干扰:控制pH5-7。
阳离子干扰:Be2+,Al3+,Fe3+, Th4+,Zr4+等可与F-络合——使测定结果偏低,可通过加络合掩蔽剂(如柠檬酸钠、EDTA、钛铁试剂、磺基水杨酸等)消除其干扰。
基体干扰(以活度代替浓度)消除:标准和待测样品中同时加入惰性电解质----总离子强度调节剂(Total ion strength adjustment buffer, TISAB),控制pH、消除阳离子干扰、控制离子强度。
TISAB组成:KNO3+NaAc+HAc+柠檬酸钾。
3).流动载体膜电极(液膜电极)流动载体可在膜中流动,但不能离开膜,而离子可以自由穿过膜。
界面双电层Dinann扩散机理。
构成:固定膜[活性物质(载体)+溶剂(增塑剂)+基体(微孔支持体)]+液体离子交换剂+内参比流动载体膜:固化PVC膜电极离子交换剂+有机溶剂+ PVC+四氢呋喃→膜特点:稳定,寿命长机理:膜内活性物质(液体离子交换剂)与待测离子发生离子交换,但其本身不离开膜。
这种离子之间的交换将引起相界面电荷分布不均匀,从而形成膜电位。
几种流动载体电极NO3-:(季铵类硝酸盐+邻硝基苯十二烷醚+5%PVC)Ca2+:(二癸基磷酸钙+苯基磷酸二辛酯+微孔膜)K+:(冠醚+邻苯二甲二戊酯+PVC-环已酮)钙电极:构成:内参比电极:Ag-AgCl电极内参比溶液:0.1mol/L CaCl2水溶液内外管之间:0.1mol/L二癸基磷酸钙的苯基磷酸二辛酯溶液多孔膜:载有离子交换剂(二癸基磷酸钙)原理:二癸基磷酸钙极易扩散进入微孔膜,但不溶于水,故不能进入试液溶液,但二癸基磷酸根可以在液膜-试液两相界面间来回迁移,传递钙离子,直至达到平衡。
由于Ca2+在水相(试液和内参比溶液)中的活度与有机相中的活度差异,在两相之间产生相界电势。
钙电极适宜的pH范围是5~11,可测出10-5 mol/L的Ca2+ 。
4).敏化电极敏化电极是指气敏电极、酶电极、细菌电极及生物电极等。
这类电极的结构特点是在原电极上覆盖一层膜或物质,使得电极的选择性提高。
气敏电极端部装有透气膜,气体可通过它进人管内。
管内插入pH 玻璃复合电极,复合电极是将外参比电极(Ag /AgCI )绕在电极周围。
管中充有电解液(中介液)。
试样中的气体通过透气膜进入中介液,引起电解液中离子活度的变化,这种变化由复合电极进行检测。
如 CO2气敏电极,pH 玻璃电极作为指示电极, 中介液为0.01mol/L 的碳酸氢钠。
二氧化碳与水作用生成碳酸,从而影响碳酸氢钠的电离平衡来指示CO2 。
5). 生物膜电极生物膜电极是将生物化学和电分析化学相结合而研制成的电极。
特点:将电位法电极作为基础电极,生物酶膜或生物大分子膜作为敏感膜而实现对底物或生物大分子的分析。
1、酶电极:覆盖于电极表面酶活性物质(起催化作用)与待测物反应生成可被电极反应的物质, 原理:基于用电位法直接测量酶促反应中反应物的消耗或反应物的产生而实现对底物分析的一种分析方法。
它将酶活性物质覆盖在电极表面,这层酶活性物质与被测的有机物或无机物(底物)反应,形成一种能被电极响应的物质。
例,尿素在尿素酶催化下发生下面反应:反应生成的NH 4+可用铵离子电极来测定。
若将尿素酶涂在铵离子电极上则成为尿素电极,此电极插入含有尿液的试液中,可由于尿素分解出来的NH4+的响应而间接测出尿素的含量。
氨基酸测定:上述反应产生的NH 4+可由铵离子电极测定。
四、离子选择性电极的性能参数 1.Nernst 响应、线性范围、检测下限校正曲线:以离子选择电极的电位对响应离子活度的负对数作图。
若这种响应变化服从于Nernst 方程,则称它为 Nernst 响应。
线性范围:CD 段对应的检测离子的活度(或浓度)范围。
级差:CD 段的斜率:即活度相差一数量级时,电势改变的数值,用S 表示。
检测下限:当活度较低时,曲线就逐渐弯曲,GF 与CD 延长线的交点A 所对应的测定离子的活度(或浓度)。
2. 选择性系数(selectivity coefficient)离子选择电极除对某特定离子有响应外,溶液中共存离子对电极电位也有贡献。
电极电位i 为待测离子,j 为共存离子。
Kij 为离子选择性系数,其值越大,表示ISE 测定i 离子抗j 离子的干)lg(303.2/j i zz j jpot ij i i K F z RT k ααϕ∑++'=扰能力越强。
第二项正离子取+,负离子取-。
K ij pot(K ij)称为选择性系数,该值越小,表示i离子抗j离子的干扰能力越大。
