第十讲有机化学反应类型及条件
高中有机化学反应类型与反应机理

细说高中有机反应类型和反应机理纵观近几年高考,有机化学的比重相对稳定,都在二十几分,所涉及到的知识点主要为有机物官能团的性质(选择题)、有机反应类型的判断、有机结构、有机推断及有关计算。
而有关有机反应类型的判断,官能团性质的考查是学生错误率较高的知识点。
那么,如何有效地进行复习呢?我们知道,有机反应不同于无机反应,概念间有交叉,也有包含与被包含关系,有的反应类型较难判定。
若掌握了有机反应机理,则反应类型的判断以及官能团的性质就迎刃而解了。
一.反应类型:取代;加成;消去;氧化;还原;加聚;缩聚;酯化;水解;显色反应二.反应机理:1.取代反应-----等价替换(有进有出)a.定义:有机物分子中的某些原子或原子团,被其它的原子或原子团所代替的反应。
b.类型:烃的卤代、烃的硝化(磺化)、醇分子间脱水、醇与HX反应、酚的卤代、酯化(皂化)、水解(卤代烃、酯、二糖、多糖、蛋白质)、有机酸酐c.条件:①X2单质------ 烃的卤代、苯的同系物侧链卤代:光照苯的同系物苯环卤代:常温、铁屑;②浓溴水 ------ 酚的苯环卤代(邻、对位);③浓硫酸、加热------酯化、分子间脱水、醇与HX反应;④水解----- 氢氧化钠水溶液共热或稀硫酸共热或酶;⑤碱石灰、加热-------羧酸盐(去羧反应):2. 加成反应---开键加合(只进不出)a.定义:有机分子里不饱和的碳原子跟其它原子或原子团直接结合生成别的物质。
b.类型:烯、炔、二烯烃等不饱和烃的加成,苯和苯的同系物的加成,醛、酮的加成,油酸的氢化,油脂的硬化。
c.对象:加H2O、加X2、H2、HX、HCN等d.注意:①卤素可用水溶液,也可用溴的CCl4或者单质气体;②与H2加成一般用Ni作催化剂,对碳氧双键的加成中学阶段只限醛、酮,而不考虑羧基、酯基;③氢化反应的产物中碳的“架”或“环”不变,因此可根据氢化产物回推原来有机物的碳架或碳环;⑤与卤素、卤化氢的加成为分子式中羟基的引入提供先决条件。
高中化学—有机化学10种反应类型

一、取代反应定义:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应称为取代反应。
在中学化学中,取代反应包括卤代、酯化、水解、硝化和磺化等很多具体的类型。
分例如下:1、与卤素单质的取代------发生该类反应的有机物包括:烷烃、烯烃、芳香烃、醇、酚等。
例如:2、与混酸的硝化反应(苯及其同系物、苯酚、烷烃等均能发生硝化反应)。
如:(3)注:环己烷对酸、碱比较稳定,与中等浓度的硝酸或混酸在低温下不发生反应,与稀硝酸在100℃以上的封管中发生硝化反应,生成硝基环己烷。
在铂或钯催化下,350℃以上发生脱氢反应生成苯。
环己烷与氧化铝、硫化钼、古、镍-铝一起于高温下发生异构化,生成甲基戌烷。
与三氯化铝在温和条件下则异构化为甲基环戊烷。
低碳硝基烷的工业应用日益广泛。
在使用原料上,以丙烷硝化来制取是合理的途径。
在工艺方面,国外较多的是以硝酸为硝化剂的气相硝化工艺,已积累了较丰富的工业经验。
有代表性的反应器则是多室斯登该尔反应器。
国内迄今有关硝基烷的生产和应用研究均进行得不多,这是应该引起我们充分注意的。
3、与硫酸的磺化反应(苯、苯的衍生物, 几乎均可磺化)。
如:4、羧酸和醇的酯化反应5、水解反应(卤代烃、酯、多糖、二糖、蛋白质都能在一定条件下发生水解反应)。
如:6、与活泼金属的反应:(醇、酚、羧酸等均能与活泼金属如钠反应生成氢气)。
如:7、醇与卤化氢(HX)的反应。
如:8、羧酸或醇的分子间脱水。
如:二、加成反应定义:有机物分子里不饱和碳原子跟其它原子或原子团直接结合生成化合物的反应叫加成反应。
在中学化学中,分子结构中含有“双键”或“叁键”的化合物均能发生加成反应。
如烯烃、二烯烃、炔烃、苯及其同系物、醛、酮、不饱和高级脂肪酸及其甘油脂、单糖等。
通常参与加成反应的无机试剂包括H2、X2(X为Cl、Br、I)、HX、H2O、HCN等小分子(对称或不对称试剂)起加成反应。
说明:i.羧基和酯基中的碳氧双键不能发生加成反应。
有机化学反应类型归纳及复习

有机化学反应类型归纳及复习2009.10.2一、取代反应 1.概念:有机物分子里某些原子或原子团被其它原子或原子团所代替的反应。
2.能发生取代反应的官能团有:醇羟基(-OH )、卤原子(-X )、羧基(-COOH )、酯基(-COO -)、肽键(-CONH -)等。
(1)烷烃卤代条件:光照,卤素为纯卤素,如氯气,溴蒸气(不能是溴水) 产物:卤代烃(R-X )+ 卤化氢(HX )(2)苯及苯的同系物卤代条件:催化剂(Fe ),纯卤素:苯环上的氢被取代 光照;纯卤素:苯环侧链上的氢被取代(3)卤代烃水解条件:NaOH 水溶液。
其中水是反应物,NaOH 能促进水解平衡向右移动C 2H 5-Br + H -OH −−−→−∆/NaOH C 2H 5OH + HBr ; 生成的HBr 能与NaOH 继续反应:NaOH+HBr →NaBr+H 2O两个方程式综合起来,也可以写成:C 2H 5-Br + NaOH −→−∆C 2H 5OH + NaBr (4)醇:成醚:CH 3CH 2-OH+H-O-CH 2CH 3−−−−→−C140/浓硫酸CH 3CH 2-O-CH 2CH 3+H 2O 卤化:CH 3CH 2—OH +H —Br −→−∆CH 3CH 2Br + H 2O (5)酚:卤化、硝化(6)羧酸酯化:条件:浓硫酸;加热R-COO-H + H-O-R ′−−−→−∆/浓硫酸R-COO-R ′+ H 2O (7)酯水解条件:酸性水解或碱性水解;碱性水解生成了盐,要通过酸化变成酸溶液,然后经过蒸馏得到有机酸。
CH 3COOC 2H 5+H 2O −−−→−∆/浓硫酸CH 3COOH +C 2H 5OH ;RCOOR ′+NaOH −→−∆RCOONa +R ′OH 3.能发生取代反应的有机物种类如下图所示:二、加成反应 1.能发生加成反应的官能团:双键、三键、苯环、羰基(醛、酮)等。
(1)C=C 与H2、X2、HX 、H2O : (2)C ≡C 与H2、X2、HX 、H2O : (3)苯与H2(4)醛、酮与氢气加成: (5)油脂氢化:2.加成反应有两个特点:①反应发生在不饱和的键上,不饱和键中不稳定的共价键断裂,然后不饱和原子与其它原子或原子团以共价键结合。
有机反应简介

第一章 印象管理
成熟的
幼稚的
有能力的
没能力的
有品位的
没品位的
有教养
没教养
有气质
没气质
---
---
• 第一印象就是别人给你的打分
你留给别人的第一印象如何?
• 从心理学的角度来看,由于第一印象是在对 某人一无所知的情况下获得的,故嵌入大脑 的程度较深,并且它对今后输入的关于此人 的信息将产生不可忽略的作用。
• 12~22分:第一印象差 • 也许你会感到吃惊,因为很可能你只是依着自己的习惯行事而
已。也许你本来是很愿意给别人留下一个美好的印象,可是你的 不经心或缺乏体贴、或言语无趣,无形中却让来人做出关于你的 错误的勾勒。你必须记住交往是种艺术,而艺术是不能不修边幅 的。 • 23~46分:第一印象一般 • 你的表现中存在着某些令人愉快的成分,但同时又偶有不够精 彩之处,这使得别人不会对你印象恶劣,却也不会产生很强的吸 引力。如果你希望提高自己的魅力,首先必须从心理上重视,努 力在“交锋”的第一回合中显示出自己的最佳形象。 • 47~60分:第一印象好 • 你的适度、温和、合作给第一次见到你的人留下了深刻的印象。 无论对方是你工作范围抑或私人生活中的接触者,他们无疑都有 与你进一步接触的愿望。你的问题只在于注意那些单向的对你 “一见钟情”者。
烷烃卤代反应时,并不是直接生成中间体自由基,而是先经过一 个过渡态才能完成。
过渡态(transition state):在 过渡态的特点:
反应物互相接近的反应进程中, (1)能量高。
与势能最高点相对应的结构称 (2)极不稳定,不能分离得到。
为过渡态。
(3)旧键未完全断开,新键未完
全形成。
甲烷氯代反应势能图
化学有机化学的反应类型与机制

化学有机化学的反应类型与机制化学有机化学是研究有机分子的合成、性质和反应的学科。
在有机化学中,反应类型和反应机制是理解和预测有机化学反应的基础。
本文将介绍常见的有机化学反应类型以及相关的反应机制。
一、取代反应取代反应是有机化学中最常见和基础的反应类型之一。
取代反应发生在有机化合物中的一个官能团被另一个官能团取代的过程中。
常见的取代反应有烃类的卤代烷的取代反应、醇的酸催化取代反应等。
这类反应通常遵循亲核取代机制或电子亲和性反应机制。
亲核取代机制是指亲核试剂攻击电子亏陷的化学键,从而导致新的官能团的生成。
例如,碱性条件下的醇的取代反应中,醇中的氧负离子攻击具有亲电性的卤代烷,形成醚。
电子亲和性反应机制是指亲电试剂(通常为正离子)与反应底物中的云电子形成化学键。
例如,在卤代烷和氢氧根离子反应中,卤代烷中的卤原子受到亲电性氧离子的攻击,形成醇。
二、加成反应加成反应是指两个或多个分子在反应中形成新的化学键。
这类反应通常遵循亲电加成机制或自由基加成机制。
亲电加成机制是指亲电试剂以亲电性攻击另一个化合物的云电子,形成新的化学键。
例如,烯烃与卤代烷的加成反应中,卤代烷以亲电性攻击烯烃的云电子,形成新的碳碳键。
自由基加成机制是指自由基与另一个分子的自由基反应形成新的化学键。
例如,烯烃与溴原子的加成反应中,溴原子将自由基形成的氢原子取代并形成新的碳溴键。
三、消除反应消除反应是指有机化合物中的官能团通过断键形成双键或三键。
常见的消除反应有脱水、脱卤和β消除等。
脱水反应是指有机化合物中的一个水分子被去除,形成新的化学键。
例如,醇通过脱水反应生成烯烃。
脱卤反应是指有机化合物中的卤素原子被去除,形成新的化学键。
例如,卤代烷受热时发生脱卤反应,生成烯烃。
β消除反应是指有机化合物中两个相邻的官能团分子中的一个分子被去除,形成新的化学键。
例如,酮分子中的β-羰基取代被去除,生成烯醇。
四、重排反应重排反应是有机化学中一类重排原子或官能团的反应。
有机反应种类介绍

有机反应种类介绍有机反应是有机化学中的重要概念,它指的是有机化合物之间或有机化合物与其它物质之间发生的化学反应。
有机反应种类繁多,根据反应机理和反应类型的不同,可以将有机反应分为多种不同的类型。
下面将介绍一些常见的有机反应种类。
1. 加成反应:加成反应是指分子中两个原子间发生化学键的形成,同时形成一个新的分子。
典型的加成反应包括烯烃的加成反应、醛酮的加成反应等。
2. 消除反应:消除反应是指有机分子中某个原子或基团与分子中的其它原子或基团之间发生脱离反应,形成一个或多个新的分子。
典型的消除反应包括醇的脱水反应、卤代烷的脱卤反应等。
3. 取代反应:取代反应是指有机分子中的一个原子或基团被另一个原子或基团取代的反应。
典型的取代反应包括卤代烷的亲核取代反应、酰基取代反应等。
4. 加成-消除反应:加成-消除反应是指反应中既发生加成反应,又发生消除反应的反应类型。
典型的加成-消除反应包括醇的酸催化脱水反应等。
5. 氧化反应:氧化反应是指有机分子中的一个原子或基团被氧化剂氧化的反应。
典型的氧化反应包括醇的氧化反应、醛的氧化反应等。
6. 还原反应:还原反应是指有机分子中的一个原子或基团被还原剂还原的反应。
典型的还原反应包括醛的还原反应、酮的还原反应等。
除了上述的反应种类外,还有许多其他类型的有机反应,如重排反应、环化反应、氢移反应等。
有机反应的种类繁多,反应机理也各不相同,有机反应的研究对于理解有机化学反应的机理和应用有重要的意义。
在有机反应的应用中,我们可以根据反应的类型和机理来设计反应条件、催化剂的选择、反应的步骤等,以实现有机反应的高效进行。
有机反应的应用广泛,包括有机合成、药物合成、材料合成等领域,有机反应的研究和应用对于推动有机化学的发展和应用有着重要的作用。
通过对有机反应的种类和机理的深入理解,我们可以更好地应用有机反应的原理和方法,为有机化学的研究和应用做出更大的贡献。
初中化学反应类型

初中化学——反应类型
在初中阶段学习化学时,我们经常会涉及到各种各样的化学反应。
化学反应是物质之间发生的转化过程,它们可以根据反应过程的特点被分为不同的类型。
本文将介绍初中化学中常见的反应类型,帮助我们更好地理解化学反应的基本原理。
1. 物理性质变化
物理性质变化是物质在外部形态或性质上发生改变,但分子结构未发生变化的过程。
比如:水从液态变为固态,水银的温度增加导致膨胀等。
2. 化学性质变化
化学性质变化是物质由一种物质转变为另一种物质的过程,伴随着化学键的破裂和新键的形成。
常见的化学反应类型有以下几种:
2.1. 合成反应
合成反应是指两种或两种以上的物质反应生成一种新的物质的过程。
例如:
2H₂ + O₂ → 2H₂O。
2.2. 分解反应
分解反应是指一种化合物在适当条件下分解为两种或两种以上的物质。
例如:2H₂O → 2H₂ + O₂。
2.3. 双替换反应
双替换反应是指两种化合物中的阳离子与阴离子互相交换位置形成两种新的化合物。
例如:AgNO₃ + NaCl → AgCl↓ + NaNO₃。
2.4. 氧化还原反应
氧化还原反应是指在反应过程中发生氧化和还原的过程。
氧化是指物质失去电子,还原是指物质获得电子。
例如:2Fe + 3Cl₂ → 2FeCl₃。
结语
通过学习不同类型的化学反应,我们可以更好地理解物质之间的相互作用,从而更深入地了解化学原理。
希望本文能够帮助读者对初中化学中的反应类型有更清晰的认识。
有机化学反应类型分类总结
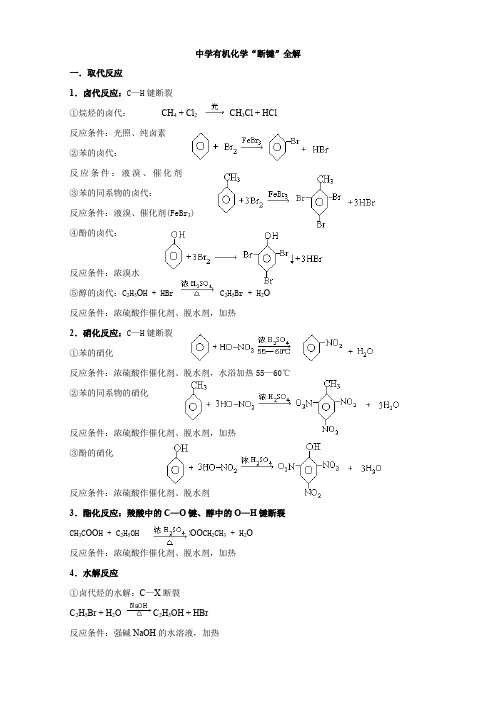
中学有机化学“断键”全解一.取代反应1.卤代反应:C—H键断裂①烷烃的卤代:CH4 + Cl2CH3Cl + HCl反应条件:光照、纯卤素②苯的卤代:反应条件:液溴、催化剂(FeBr3) ③苯的同系物的卤代:反应条件:液溴、催化剂(FeBr3)④酚的卤代:反应条件:浓溴水⑤醇的卤代:C2H5O H + HBr C2H5Br + H2O反应条件:浓硫酸作催化剂、脱水剂,加热2.硝化反应:C—H键断裂①苯的硝化反应条件:浓硫酸作催化剂、脱水剂,水浴加热55—60℃②苯的同系物的硝化反应条件:浓硫酸作催化剂、脱水剂,加热③酚的硝化反应条件:浓硫酸作催化剂、脱水剂3.酯化反应:羧酸中的C—O键、醇中的O—H键断裂CH3C OO H + C2H5OH CH3C OO CH2CH3 + H2O反应条件:浓硫酸作催化剂、脱水剂,加热4.水解反应①卤代烃的水解:C—X断裂C2H5Br + H2O C2H5OH + HBr反应条件:强碱NaOH的水溶液,加热②酯的水解:C—O键断裂反应条件:稀硫酸作催化剂,水浴加热70—80℃③蛋白质的水解:酰氨键中C—N键断裂5.醇与醇分子间脱水:醇分子中的的C—O键与另一醇分子中与羟基相连碳原子上的C—H键发生断裂2 CH3CH2OH CH3CH2OCH2CH3 + H2O反应条件:浓硫酸作催化剂、脱水剂,加热140℃6.置换反应:①醇的置换反应:O—H键断裂2 CH3CH2OH + 2 Na →2CH3CH2ONa + H2↑反应条件:活泼金属(K、Ca、Na、Mg、Al、Li等)②酚的置换反应:O—H键断裂反应条件:活泼金属(K、Ca、Na、Mg、Al、Li等),熔化的苯酚③羧酸的置换反应:O—H键断裂2CH3COOH + Zn →(CH3COO)2Zn + H2↑反应条件:氢以前的活泼金属7.羧酸盐的脱羧反应:C—C键断裂CH3C OO Na + Na O H CH4↑+ Na2CO3反应条件:羧酸盐无水,加热8.复分解反应:C—H键断裂①中和反应:R COOH + NaOH → R COONa + H2O②羧基的检验:R COOH + NaHCO3→ R COONa + H2O + CO2↑二.加成反应1.烯烃的加成反应:断裂中的一个键①与水的加成:CH2=CH2 + H2O CH3CH2OH②与卤素的加成:CH2=CH2 + Br2 →CH2BrCH2Br③与卤代烃的加成:CH2=CH2 + HCl CH3CH2Cl④与氢气的加成:CH2=CH2 + H2CH3CH32.炔烃:断裂中的一个键或二个键①与水的加成:②与卤素的加成:③与卤代烃的加成:④与氢气的加成:3.苯及苯的同系物的加成:断裂苯环上的特殊化学键4.醛的加成:断裂碳氧双键中的一个键三.消去反应:1.醇的消去反应:羟基与碳相连的C—O键及与羟基所在碳原子相邻的碳上的C—H键断裂CH3CH2OH CH2==CH2↑+ H2O反应条件:浓硫酸作催化剂、脱水剂,加热170℃2.卤代烃的消去反应:卤代烃C—X键及与卤素原子所在碳原子相邻的碳上的C—H键断裂CH3CH2Cl + NaOH CH2==CH2↑+ NaCl + H2O反应条件:强碱NaOH的醇溶液,加热四.氧化反应:1.剧烈氧化(有机物的燃烧):断裂分子中所有化学键CH3CH2OH + 3O22CO2 +3 H2O2.控制氧化①醇的催化氧化:醇羟基上的C—H键及与羟基所在碳原子相邻的碳上的C—H键断裂2 CH3CH2OH + O22CH3CHO + H2O②醛的催化氧化:断裂醛基上的C—H键2R—CHO + O2RCOO H③醛的银镜反应:断裂醛基上的C—H键R—CHO + 2Ag(NH3)2OH RCOONH4 + 3NH3 +2Ag↓+H2O反应条件:现配的银氨溶液,水浴加热④醛与新制的Cu(OH)2反应:断裂醛基上的C—H键R—CHO +2Cu(O H)2 RCOOH + Cu2O↓+ 2H2O反应条件:新配的Cu(O H)2悬浊液,加热⑤苯的同系物与酸性KMnO4反应:断裂苯环侧链上的C—H、C—C键⑥烯烃的催化氧化:断裂中的一个键断裂CH2=CH2 +O2CH3CHO⑦丁烷的催化氧化:C—C断裂CH3CH2 CH2CH3 + 5O2 4 CH3COOH + 2 H2O五、聚合反应:1.加聚反应:断裂中的一个键断裂①烯烃的加聚:②卤烯烃的加聚:③不饱和羧酸的加聚:2.缩聚反应:①酚醛缩聚:酚羟基上的C—H与醛基上的C==O键断裂②氨基酸缩聚:羧基中C—O键与氨基中N—H键断裂③脂化缩聚:醇羟基上的O—H与羧基上的C—O键断裂六、分解与裂化、裂解1.分解反应①甲烷的分解:断裂C—H键反应条件:隔绝空气,加热到1000—1500℃②烯烃的臭氧分解:中的二个键全断裂③炔烃的臭氧分解:中的三个键全断裂2.裂化与裂解:C—C键断裂CH3CH2 CH2CH3 C2H4 + C2H6七、颜色反应酚遇Fe3+显蓝色:酚羟基上的O—H键断裂。
有机化学基本反应类型

有机化学基本反应类型(一)、取代反应(不同于置换反应)1、卤代(饱和烃的特征反应)饱和烃:光++HClCH3ClCl2CH4苯:苯的同系物:2、硝化+HNO3浓NO2H2O H2SO4+3、磺化+H2SO4()浓7080℃SO3H H2O+4、卤代烃水解(条件:NaOH水溶液,加热)-两种水解形势CH3CH2Cl3CH2OH+NaCl5、醇与HX反应() C2H5OH2H5BrNaHSO4+NaBr+H2O+C2H5OH H2SO C2H5Br+H2O+6、苯酚和浓溴水7、酯化(浓硫酸,加热)-浓硫酸:催化剂和吸水剂脱水方式:酸脱-OH、醇脱-HCH3COOH CH3CH2CH3COOC2H5+H2O+8、酯的水解(稀硫酸,水浴加热/ NaOH水溶液)+++H2CH3COOC2H5CH3COOH C2H5OH-9、成醚(分子间脱水)浓H2O+CH3CH2OH3CH2OCH2CH32H2SO4140℃(二)、加成反应(不同于化合反应)1、加氢22233CH CH H CH CH 催化剂∆=+−−−−→ 2、加卤素 CH Br Br CH CH 2CH 2+CH 2CH CH 2CH BrBr CH 2CH CH CH 2 3、加水 2223223、CH CH H O CH CH OH CH CH H O CH CHO催化剂加热加压催化剂=+−−−−−→≡+−−−−→ 4、加HX Cl CH 3CH 3HCl+CH CH CH 3(一般氢多加氢)5、加HCN 2CH CH HCN CH CH CN 催化剂≡+−−−−→=-(三)、消去反应1、2432222H SO CH CH OH CH CH H O 浓170C ︒−−−−−→=↑+醇消去反应条件:浓硫酸,加热/乙醇加热到170度-OH 所连碳的邻碳上必须有氢2、+H 2O +NaBr CH 3CH CH CH 3BrCH 3CH CH 2CH 3 卤代烃消去反应条件:NaOH 醇溶液,加热-X 所连碳的邻碳上必须有氢(四)、脱水反应2432222243225252242H SO 170H SO 140H SOCH CH OH CH CH H O 2CH CH OH C H O C H HO HCOOH CO H O 浓浓浓CC︒︒∆−−−−−→=+−−−−−→--+−−−−−→↑+ H 2O ++CO CO 2COOH COOH↑↑(五)、酯化反应OH OH +3nHO n NO OH (C 6H 7O 2)H 2ONO 2O NO 2O NO 2O 6H 7O 2)+3n n(六)水解反应1、 卤代烃水解2、 酯的水解3、 油脂的水解4、 糖的水解5、 蛋白质的水解(七)加聚反应n CH 2CH 2催化剂CH 2CH 2n(八)缩聚反应H 2O +n n CH 2OH OHn +n(九)氧化以应(在一定条件下,有机物加氧或去氢的反应)1、 烃及含氧衍生物的燃烧2、 烯烃的氧化(氧气)3、 烯、炔被酸性高锰酸钾氧化4、 苯的同系物被酸性高锰酸钾氧化5、醇的催化氧化(条件:-OH 所连C 上必须有氢原子)-OH 所连C 上有2或3个氢――被氧化成醛 -OH 所连C 上有1个氢――――被氧化成酮 -OH 所连C 上无氢时―――――不能被氧化醇被酸性高锰酸钾氧化6、酚被酸性高锰酸钾/溴水氧化7、醛的氧化8、乙二酸、葡萄糖、麦芽糖(十)还原反应(在一定条件下有机物加氢或去氧的反应)1、 烯烃、炔烃、苯及其同系物、酚类的还原2、 醛、酮的还原3、硝基苯的还原H 2O+3FeCl 2+32NO 2(十一)裂化、裂解反应裂化:81841048C H C H C H ∆−−→+裂解(为深度裂化):42222CH C H 3H 高温−−−→+(十二)成盐反应2525232322C H OH 2Na 2C H ONa H Na NaOH CH COOH Na CO Cu(OH)盐盐盐盐+→+↑→⎧⎪→⎪+⎨→⎪⎪→⎩ ++3Cl NH 2ONa NaOH+OHH 2O(十四)颜色反应1、 多羟基化合物与新制Cu(OH)2悬浊液反应得绛蓝色溶液2、苯酚与FeCl 3溶液反应得紫色溶液3、苯酚被氧化生成粉红色晶体6、碘遇淀粉变蓝(十五)其它反应1、脱羧反应(制取甲烷)334CH COONa NaOH NaCO CH 碱石灰∆+−−−−→+↑ 2、 缩合反应3、增链反应。
有机化学的官能团性质反应类型

高中化学所有有机化学的官能团性质,反应类型,引入官能团,反应条件一、卤基(卤原子):水解也称取代(氢氧化钠溶液),消去(氢氧化钠醇溶液)酚羟基:显色(Fecl3)羧基:和醇发生酯化(浓硫酸加热)还原(+H2)中和醇羟基:酯化,取代,消去CC双键和叁建:加成,聚合反应(加聚)羰基:银镜酯基:水解(生成醇和羧酸)苯基:加成,取代,磺化,硝化都能发生氧化反应(+O2点燃)同时带羟基和羧基的化合物还能发生缩聚取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
加成反应:有机物分子里不饱和的碳原子跟其他原子或原子团直接结合的反应。
聚合反应:一种单体通过不饱和键相互加成而形成高分子化合物的反应。
加聚反应:一种或多种单体通过不饱和键相互加成而形成高分子化合物的反应。
消去反应:从一个分子脱去一个小分子(如水.卤化氢),因而生成不饱和化合物的反应。
氧化反应:有机物得氧或去氢的反应。
还原反应:有机物加氢或去氧的反应。
酯化反应:醇和酸起作用生成酯和水的反应。
水解反应:化合物和水反应生成两种或多种物质的反应(有卤代烃、酯、糖等)1.氧化反应:有机物得氧或去氢的反应。
甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH4→C+2H2(条件为高温高压,催化剂)乙烯燃烧 CH2=CH2+3O2→2CO2+2H2O(条件为点燃)乙炔燃烧C2H2+3O2→2CO2+H2O (条件为点燃)苯燃烧 2C6H6+15O2→12CO2+6H2O (条件为点燃)乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O (条件为点燃)乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)(这是总方程式)2. 取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HCl CH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HCl CHCl3+Cl2→CCl4+HCl (条件都为光照。
有机化学基本反应类型较全

有机反应类型——知识归纳
书写有机化学反应的注意事项
写有机物的结构简式及反应条件
不漏写除了有机物外的其它无机小分子
如酯化反应、硝化反应、醇催化氧化、缩聚反 应生成的H2O;卤代反应生成的HX等 配平:如醇、醛的催化氧化、银镜反应
专用名词不能出错
如,苯写“笨”、“酯”和“脂”混用、“硝化” 写“消化”, “水浴”写成“水狱”,“褪色” 写成“腿色”
有机反应类型——加聚反应
类型(联系书上提到的高分子材料):
乙烯型加聚 聚丙烯、聚苯乙烯、聚氯乙烯、 聚丙烯腈、聚甲基丙烯酸甲酯(有机玻璃) 1,3-丁二烯型加聚(破两头,移中间) 天然橡胶(聚异戊二烯) 氯丁橡胶(聚一氯丁二烯) 含有双键的不同单体间的共聚
乙丙树脂(乙烯和丙烯共聚), 丁苯橡胶(丁二烯和苯乙烯共聚)
5、水解反应
(1)H2NCH2CONHCH2COOH+H2O→ (2)C12H22O11(蔗糖)+H2O→ (3) C12H22O11(麦芽糖)+H2O → (4)(C6H10O5)n(淀粉)+H2O → (5)(C6H10O5)n(纤维素)+H2O →
(条件、现象、应用)
6、皂化反应
C 17 H35 C O O C H2 C 17 H35 C O O C H + C 17 H35 C O O C H2
条件下
不对称烯烃或炔烃和H2O、HX加成时可能产生两 种产物
醛基的C=O只能和H2加成,不能和X2加成,而羧 基和酯的C=O不能发生加成反应
若一种物质中同时存在C=C、醛基等多个官能团 时,和氢气的加成反应可同时进行,也可以有选 择地进行,看信息而定
有机反应类型——消去反应
原理:“无进有出”
大学有机化学教学中的反应条件与反应类型的讲解

大学有机化学教学中的反应条件与反应类型的讲解有机化学是大学化学课程中的一门重要学科,它研究的是有机物的结构、性质和反应。
在有机化学教学中,反应条件和反应类型是学生们需要掌握的重要内容。
本文将从反应条件和反应类型两个方面进行讲解。
一、反应条件1. 温度:温度是影响有机反应速率的重要因素之一。
一般来说,反应速率随温度的升高而增加。
但是,过高的温度可能导致副反应的发生,因此在实验中需要控制好反应的温度。
2. 溶剂:溶剂在有机反应中起到溶解反应物和催化剂的作用。
常用的有机溶剂有乙醇、丙酮、二甲基甲酰胺等。
选择合适的溶剂可以提高反应的效率和选择性。
3. 催化剂:催化剂是加速有机反应速率的物质。
常见的有机催化剂有酶、酶模型、金属离子等。
催化剂可以降低反应的活化能,使反应更容易进行。
4. 反应时间:反应时间是指反应达到平衡所需的时间。
有机反应的时间长短取决于反应物的浓度、温度和催化剂的活性等因素。
在实验中,需要根据反应的具体情况来确定合适的反应时间。
二、反应类型1. 取代反应:取代反应是有机化学中最常见的反应类型之一。
它是指一个原子或基团被另一个原子或基团所取代的反应。
常见的取代反应有氯代烃的取代反应、醇的取代反应等。
2. 加成反应:加成反应是指两个或多个分子结合形成一个新的分子的反应。
加成反应可以是电子亲和性试剂与亲电性试剂之间的反应,也可以是亲电性试剂与亲电性试剂之间的反应。
常见的加成反应有烯烃的加成反应、醛酮的加成反应等。
3. 消除反应:消除反应是指一个分子中的两个或多个原子或基团被去除形成一个新的分子的反应。
常见的消除反应有醇的脱水反应、醚的脱水反应等。
4. 缩合反应:缩合反应是指两个或多个分子结合形成一个较大的分子的反应。
常见的缩合反应有醛酮的缩合反应、酯的缩合反应等。
总结起来,有机化学教学中的反应条件和反应类型是学生们需要掌握的重要内容。
通过掌握反应条件,可以更好地理解有机反应的机理和规律。
而了解不同的反应类型,可以帮助学生们更好地理解有机反应的特点和应用。
有机化学十种反应类型详细总结

一、取代反应定义:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应称为取代反应。
在中学化学中,取代反应包括卤代、酯化、水解、硝化和磺化等很多具体的类型。
分例如下:1、与卤素单质的取代------发生该类反应的有机物包括:烷烃、烯烃、芳香烃、醇、酚等。
例如: (1).(在适当的条件下,烷烃的取代反应是可以逐步进行的,得到一系列的混合物)。
(2).(3).CH 2=CH -CH 3 + Cl 2CH 2=CH -CH 2-Cl + HCl(4). (5).+ 2HCl2、与混酸的硝化反应(苯及其同系物、苯酚、烷烃等均能发生硝化反应)。
如: (1).+ HNO 2-NO 2 + H 2O(2).(3).环己烷对酸、碱比较稳定,与中等浓度的硝酸或混酸在低温下不发生反应,与稀硝酸在100℃以上的封管中发生硝化反应,生成硝基环己烷。
在铂或钯催化下,350℃以上发生脱氢反应生成苯。
环己烷与氧化铝、硫化钼、古、镍-铝一起于高温下发生异构化,生成甲基戌烷。
与三氯化铝在温和条件下则异构化为甲基环戊烷。
低碳硝基烷的工业应用日益广泛。
在使用原料上,以丙烷硝化来制取是合理的途径。
在工艺方面,国外较多的是以硝酸为硝化剂的气相硝化工艺,已积累了较丰富的工业经验。
有代表性的反应器则是多室斯登该尔反应器。
国内迄今有关硝基烷的生产和应用研究均进行得不多,这是应该引起我们充分注意的。
(4).CH 3-CH 2-CH 3(气) + HNO 3(气)CH 3-CH 2-CH 2-NO 2 + H 2O3、与硫酸的磺化反应(苯、苯的衍生物, 几乎均可磺化)。
如: (1).(2).(邻、对位产物为主)4、羧酸和醇的酯化反应光照浓硫酸 △100℃++(1).羧酸和醇:CH 3COOH + CH 3CH 2OH CH 3COOCH 2CH 3 + H 2O(2).无机含氧酸和醇的反应:5、水解反应(卤代烃、酯、多糖、二糖、蛋白质都能在一定条件下发生水解反应)。
大学有机化学教学中的反应条件与反应类型的讲解

大学有机化学教学中的反应条件与反应类型的讲解有机化学是研究碳元素化合物及其反应的科学领域。
在大学有机化学教学中,反应条件和反应类型是学习和理解有机化学基础的重要内容。
本文将从反应条件和反应类型两个方面进行讲解。
一、反应条件1. 温度:在有机化学反应中,温度是一个重要的反应条件。
不同的反应需要不同的温度条件才能进行。
例如,酯化反应通常在酸性条件下进行,需要较高的温度才能使反应进行。
而酯的水解反应则需要较低的温度,通常在酸性或碱性条件下进行。
2. 压力:压力是影响有机化学反应速率和平衡的因素之一。
在某些反应中,增加压力可以促进反应进行,使反应速率提高。
例如,氢化反应中,增加氢气的压力可以提高反应速率。
但并不是所有的有机化学反应都受到压力的影响,有些反应对压力变化不敏感。
3. 光照:光照是一些有机化学反应中必要的条件。
光照可以提供能量,促使反应进行。
例如,光照下的光气反应可以使烯烃发生加成反应,生成二元醇。
此外,光照还可以引发某些光敏反应,如光氧化反应。
4. 催化剂:催化剂是加速有机化学反应速率的物质。
催化剂可以提供反应的新反应路径,降低反应的活化能,从而加快反应速率。
常见的有机化学催化剂包括酶、酸、碱、金属等。
例如,酶催化的酯水解反应速率远远高于无催化剂的反应。
二、反应类型1. 加成反应:加成反应是有机化学中常见的一种反应类型。
在加成反应中,两个或多个反应物结合形成一个新的化合物。
例如,烯烃与氢气的加成反应可以生成饱和烃。
此外,烯烃还可以与卤素发生加成反应,生成卤代烷。
2. 消除反应:消除反应是有机化学中另一种重要的反应类型。
在消除反应中,一个分子中的两个官能团结合失去一个小分子。
例如,醇可以发生脱水反应,失去水分子生成烯烃。
此外,醇还可以与酸发生酯化反应,失去水分子生成酯。
3. 取代反应:取代反应是有机化学中常见的一种反应类型。
在取代反应中,一个官能团被另一个官能团所取代。
例如,卤代烷可以与氢氧化钠发生取代反应,生成相应的醇。
有机反应机理和反应类型

有机反应机理和反应类型有机反应机理是研究有机化合物在反应过程中发生的变化的一种方法。
它揭示了反应底物与产物之间的化学变化,以及反应中可能涉及的中间体和过渡态。
有机反应类型则是根据反应中的特定特征和机制将反应分类的方法。
一、酯化反应酯化反应是一种有机反应,通过酸催化或酶催化,醇与酸酐之间的酯结合,生成酯化合物。
该反应的机理包括酸催化步骤、裂解步骤和酯化步骤。
酸催化步骤中,酸负责质子化醇,并使酸酐发生裂解,生成酸和酰氧离子。
裂解步骤中,酸酐的酰氧离子与醇的质子化醇发生求核取代反应,形成酯和酸。
酯化步骤中,酸催化下,酸与醇发生质子化和水解反应,生成酯。
二、亲电取代反应亲电取代反应是一种有机反应,通过亲电试剂与有机物中的亲核试剂之间的相互作用,进行化学变化。
该反应包括亲电试剂的进攻和亲核试剂的离开,生成产物。
亲电取代反应的机理可以分为两步:亲电试剂进攻和亲核试剂离开。
在第一步中,亲电试剂通过与反应物的亲电中心之间的相互作用,形成中间体。
在第二步中,亲核试剂攻击中间体,将原来的反应物的基团替换为新的基团。
三、自由基反应自由基反应是一种有机反应,通过自由基与有机物中的亲核试剂之间的相互作用,进行化学变化。
该反应的机理包括自由基的产生、自由基的进攻和自由基的消除。
在产生自由基的步骤中,常使用氧化剂或光照射来打断反应物的化学键,产生自由基。
在自由基进攻的步骤中,自由基通过与反应物中的亲电中心之间的相互作用,形成中间体。
在自由基消除的步骤中,反应产物中的两个自由基相互结合,生成较稳定的产物。
四、环加成反应环加成反应是一种有机反应,通过酸催化或碱催化,烯丙基复合物与具有亲核性的试剂之间的反应,生成环化合物。
该反应的机理包括烯丙基离子的形成、环中间体的形成和中间体的断裂。
在烯丙基离子的形成步骤中,烯丙基复合物通过酸催化或碱催化,生成带正电荷的烯丙基离子。
在环中间体的形成步骤中,烯丙基离子与具有亲核性的试剂发生求核取代反应,生成环中间体。
【2020高考化学】有机化学10种反应类型
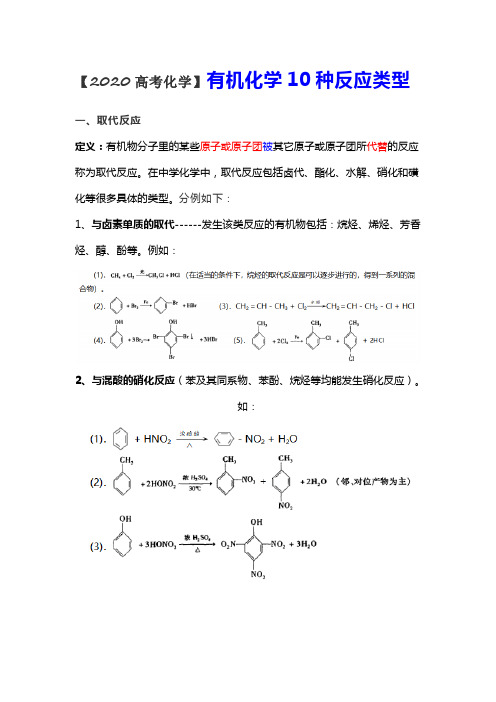
【2020高考化学】有机化学10种反应类型一、取代反应定义:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应称为取代反应。
在中学化学中,取代反应包括卤代、酯化、水解、硝化和磺化等很多具体的类型。
分例如下:1、与卤素单质的取代------发生该类反应的有机物包括:烷烃、烯烃、芳香烃、醇、酚等。
例如:2、与混酸的硝化反应(苯及其同系物、苯酚、烷烃等均能发生硝化反应)。
如:(3)注:环己烷对酸、碱比较稳定,与中等浓度的硝酸或混酸在低温下不发生反应,与稀硝酸在100℃以上的封管中发生硝化反应,生成硝基环己烷。
在铂或钯催化下,350℃以上发生脱氢反应生成苯。
环己烷与氧化铝、硫化钼、古、镍-铝一起于高温下发生异构化,生成甲基戌烷。
与三氯化铝在温和条件下则异构化为甲基环戊烷。
低碳硝基烷的工业应用日益广泛。
在使用原料上,以丙烷硝化来制取是合理的途径。
在工艺方面,国外较多的是以硝酸为硝化剂的气相硝化工艺,已积累了较丰富的工业经验。
有代表性的反应器则是多室斯登该尔反应器。
国内迄今有关硝基烷的生产和应用研究均进行得不多,这是应该引起我们充分注意的。
3、与硫酸的磺化反应(苯、苯的衍生物, 几乎均可磺化)。
如:4、羧酸和醇的酯化反应5、水解反应(卤代烃、酯、多糖、二糖、蛋白质都能在一定条件下发生水解反应)。
如:6、与活泼金属的反应:(醇、酚、羧酸等均能与活泼金属如钠反应生成氢气)。
如:7、醇与卤化氢(HX)的反应。
如:8、羧酸或醇的分子间脱水。
如:二、加成反应定义:有机物分子里不饱和碳原子跟其它原子或原子团直接结合生成化合物的反应叫加成反应。
在中学化学中,分子结构中含有“双键”或“叁键”的化合物均能发生加成反应。
如烯烃、二烯烃、炔烃、苯及其同系物、醛、酮、不饱和高级脂肪酸及其甘油脂、单糖等。
通常参与加成反应的无机试剂包括H2、X2(X为Cl、Br、I)、HX、H2O、HCN等小分子(对称或不对称试剂)起加成反应。
有机化学基础知识点整理酮醇互变异构的条件和反应类型

有机化学基础知识点整理酮醇互变异构的条件和反应类型有机化学基础知识点整理:酮醇互变异构的条件和反应类型酮醇互变异构是有机化学中一种常见的反应类型,它指的是酮和醇之间通过化学反应相互转化的过程。
在这篇文章中,我们将整理酮醇互变异构的条件和反应类型,以帮助读者更好地理解这一概念。
一、酮醇互变异构的条件1. 非水溶剂条件:酮醇互变异构往往需要在非水溶剂的环境中进行。
例如,乙醚、甲苯等有机溶剂常被用于这类反应中,因为它们可以提供合适的反应环境。
2. 弱碱条件:酮醇互变异构通常需要在一定的碱性条件下进行。
一般来说,弱碱如碳酸钠、氢氧化钠等可以提供适当的催化条件,促使反应发生。
3. 适当的温度:酮醇互变异构的反应温度通常在室温或适度加热下进行,以保证反应的进行和速率的控制。
二、酮醇互变异构的反应类型1. 酮与醇的酸碱反应:酮与醇之间可以发生酸碱反应,形成相应的酮醇异构体。
这类反应常在碱性条件下进行,如氢氧化钠催化下的酮醇异构化反应。
示例反应方程式:酮 + 弱碱→ 醇2. 酮与醇的氧化还原反应:酮醇互变异构还可以通过氧化还原反应实现。
在一定的氧化剂或还原剂的作用下,酮醇之间发生电子转移,形成相应的互变异构体。
示例反应方程式:酮 + 氧化剂→ 醇或醇 + 还原剂→ 酮3. 酮与醇的还原反应:酮醇互变异构还可以通过还原反应实现。
还原反应常常需要合适的还原剂存在,促使酮的还原形成相应的醇异构体。
示例反应方程式:酮 + 还原剂→ 醇4. 酮与醇的酸催化异构化反应:酮醇互变异构还可以在适当的酸催化条件下进行。
酸催化反应可以加速反应速率,实现酮与醇之间的互变异构。
示例反应方程式:酮 + 酸催化剂→ 醇总结:酮醇互变异构是有机化学中的重要反应类型之一。
酮与醇之间的互变异构在许多有机合成和转化反应中具有重要的应用价值。
通过合适的条件和反应类型,我们可以实现酮与醇之间的相互转化,为有机化学研究和应用提供更多的选择。
以上是对酮醇互变异构的条件和反应类型的整理和介绍。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、相关知识链接
常见的Lewis酸如H+、R+、Cl+、Br+、 BF3、AlCl3等。
它们是缺少电子不满足八隅体(氢是 二隅体)电子构型的正离子,或者含 具有空轨道可接受电子对的原子。
在反应中总是进攻反应中电子云密度 较大的部位,所以是一种亲电试剂。
+ transition stat
协同反应
三、小结:有机反应类型分类
各类反应的特点: 自由基反应常在气态下反应,常需光照、
高温或引发剂,一般无需酸或碱催化。 离子型反应很少在气态下发生,常需酸
或碱催化,溶剂化作用对反应速率的影 响较大。 协同反应的速率无论液相或气相都很少 受其它因素的影响而发生变化。
一、有机化学反应类型及条件
碳与其它原子间的σ键断裂时,可得到 碳正离子(carbonium ion或carbocation) 或碳负离子(carbanion)
异 裂
CY
C+Y
正 碳 离 子
异 裂
C Y
C + Y
负 碳 离 子
二、相关知识链接
有机酸碱概念
A 布朗斯特酸碱理论(酸碱质子理论)
凡能给出质子的物质都是酸以,能接受
一、有机化学反应类型及条件
2. 离子型反应(共价键的异裂) 共价键断裂后,其共用电子对只归属
于原共价键的某一原子,产生了正、负 离子。这种键的断裂方式叫做异裂 (heterolysis)。相应的反应称为离子型 反应(ionic reaction)
它往往被酸、碱或极性溶剂所催化, 一般在极性溶剂中进行。
E+
慢
π 络 合物
E
+H
δ 络 合物
+E
Hale Waihona Puke EEHH
+
H
+
共振 体 结 构
第三步是δ络合物碳正离子失去而形成卤苯。
下一知识点:第三步
五、亲电反应历程(5-1)
E
快
+H
E
+
H
δ 络 合物
该反应过程是由亲电试剂进攻苯环而引起的反 应,称为亲电取代反应历程。在苯环上发生的 卤化、硝化、磺化、烷基化和酰基化反应都属 亲电取代反应历程。
碳正离子属于路易斯酸也是亲电试剂。
二、相关知识链接
常见的Lewis碱有: I-、OH-、CN-、 R-、H2O、NH3、ROH、烯烃和芳烃 等。
它们是负离子,或者是具有未共用电 子对的原子,或者是富电子的π键。
在反应中往往寻求质子或进攻一个带 正电的中心,是亲核试剂。
碳负离子属于路易斯碱也是亲核试剂。
一、有机化学反应类型及条件
由亲电试剂进攻而发生的反应叫亲 电反应;由亲核试剂的进攻而发生的反 应叫亲核反应。根据反应物和产物之间 的关系,又可分为亲电取代和亲电加成; 亲核取代和亲核加成。
离子型 反应
亲电反应:由亲电试剂进攻反应物而引起的反应叫做 亲电反应。
亲核反应:由亲核试剂进攻反应物而引起的反应称为 亲核反应。
一、有机化学反应类型及条件
3.协同反应
协同反应(concerted reaction) 指反应时, 分子中旧键的断裂和新键的形成同时 发生,没有自由基或离子等中间体产 生。可在光或热的作用下发生。协同 反应往往有一个环状过渡态(transition state)。
一、有机化学反应类型及条件
如Diels-Alder反应:
加成反应历程包括两个步骤。
第一步是烯烃分子受HX的影响,π电子云偏移而极化,使一 个双键碳原子上带有部分负电荷,更易于受极化分子HX的带正 电部分(H->X)或质子H+的攻击,结果生成带正电的中间体碳 正离子和HX的共轭碱X-。
CC
反应物
δ+ δ- 慢
+H X
亲 电试 剂
C C +X
+
H
下一知识点:第二步
三、小结:有机反应类型分类
反应类型分类如下表所示:
自由基取代:烷烃卤代、芳烃侧链卤代、烯烃α—H卤代
自由基反应
自由基加成:烯烃的过氧化效应,部分聚合反应
反应类型
亲电加成:烯、炔、二烯烃的加成 亲电取代:芳环上的取代反应 离子型反应 亲核加成:醛、酮的亲核加成、羟醛缩合反应 亲核取代:卤代烃、醇的SN1反应 消除反应:卤代烃和醇的E1反应 亲核加成—消除反应:羧酸衍生物的代表反应
一、有机化学反应类型及条件
共价键的断裂方式:均裂和异裂
1. 自由基反应(共价键的均裂) 共价键断裂后,两个成键原子共用的 一对电子由两个原子各保留一个,这 种断裂方式称为均裂(homolysis)。
均 裂
CY
C+Y
自 由 基
一、有机化学反应类型及条件
均裂往往在较高的温度或光的照射下 发生。
由均裂生成的带有未成对电子的原子 或原子团叫自由基或游离基(free radical)。通过共价键的均裂而发生的 反应叫做自由基反应(free radical reaction)。
协同反应(反应连续进行,一步完成):双烯合成、SN2、 E2反应
在本节课中,主要对亲电反应和亲核反应相关知识进行介绍。要弄清楚亲核反 应和亲电反应,首先要明确什么是反应物,什么是试剂。
下一知识点:反应物和试剂
五、亲电反应历程(5-1)
1、亲电加成反应历程
以烯烃和卤化氢的加成反应为例,说明亲电加成的历程。
五、亲电反应历程(5-1)
第二步是碳正离子迅速与X-结合生成卤烷。
CC + X 快
+
H
CC HX
第一步的反应速度慢,反应速度由第一步决
定,而第一步是由亲电试剂的进攻而发生的,称
亲电加成反应。烯、炔和亲电试剂的反应,二烯
烃的加成反应,脂环烃小环的开环反应加成都是 亲电加成反应历程。 (亲电试剂:卤素、卤化氢、 水、硫酸、次卤酸等)
质子的物质都碱。
HCl + H2O
酸
碱
Cl + H 3O +
共轭碱 共轭酸
H2SO4 + CH3OH
酸
碱
HSO4- + CH3OH2+
共轭碱
共轭酸
二、相关知识链接
B 路易斯酸碱理论 酸是能接受一对电子形成共价键
的物质,碱是可以提供一对电子形成 共价键的物质。即酸电子对的接受体, 碱是电子对的给予体。
下一知识点:亲电取代
五、亲电反应历程(5-1)
2、亲电取代历程 以苯和亲电试剂反应为例,说明亲电取代历程。
第一步是亲电试剂E+进攻苯环,很快地和苯环的π 电子形成π络合物,π络合物仍然还保持苯环的结构。
+ E+
快
E+
反应物
亲 电试 剂
π 络 合物
下一知识点:第二步
五、亲电反应历程(5-1)
第二步是π络合物进一步与苯环的一个碳原子直接连 接,形成δ络合物。
