2017年浙江新高考29题化学计算题试题练习
2016年浙江省高考理综化学部分第28、29题练习

2016年浙江省高考理综化学部分第28、29题练习1.(15分)汽车尾气排放的一氧化碳、氮氧化物等气体已成为大气污染的主要来源。
德国大众汽车尾气检测造假事件引起全世界震惊。
根据下列示意图回答有关问题:(1)汽车发动机工作时会引发N2(g)+O2(g)=2NO(g) ∆H = +180 kJ·mol-1,其能量变化示意图如下:则NO中氮氧键的键能为▲ kJ·mol-1。
(2)空燃比过小易产生CO。
有人提出可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染。
判断该设想是否可行,并说出理由▲ 。
(3)利用活性炭涂层排气管处理NO x的反应为:xC(s)+2NO x(g)N2(g)+xCO2(g) ∆H= -b kJ·mol-1。
若使NO x更加有效的转化为无毒尾气排放,以下措施理论上可行的是▲ 。
A.增加排气管长度B.增大尾气排放口C.升高排气管温度D.添加合适的催化剂(4)催化装置中涉及的反应之一为:2NO(g) + 2CO(g)N2(g) + 2CO2(g) 。
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到图28-1所示的曲线。
催化装置比较适合的温度和压强是▲ 。
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO 和NO百分含量随时间变化曲线如图28-2所示。
则前10 s 内,CO和NO百分含量没明显变化的原因是▲ 。
③研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。
为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了以下三组实验:实验编号T(K)NO初始浓度(mol·L-1) CO初始浓度(mol·L-1)催化剂的比表面积(m2/g)Ⅰ400 1.00×10-3 3.60×10-382Ⅱ400 1.00×10-3 3.60×10-3124Ⅲ450 1.00×10-3 3.60×10-3124 根据坐标图28-3,计算400K时该反应的平衡常数为▲ ;并在图中画出上表中的实验II、III条件下混合气体中NO浓度随时间变化的趋势曲线图(标明各条曲线的实验编号)。
2020版(2020年4月)浙江选考高考化学:特训4第29题化学计算题专练 Word版含答案
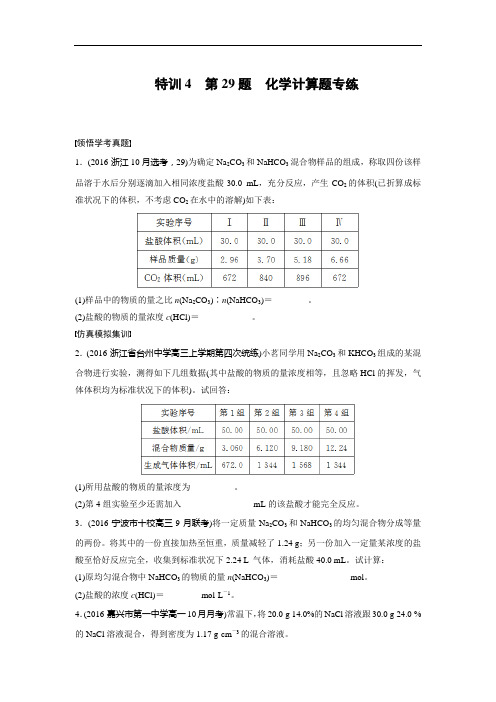
特训4第29题化学计算题专练领悟学考真题1.(2016·浙江10月选考,29)为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸30.0 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:(1)样品中的物质的量之比n(Na2CO3)∶n(NaHCO3)=________。
(2)盐酸的物质的量浓度c(HCl)=____________。
仿真模拟集训2.(2016·浙江省台州中学高三上学期第四次统练)小茗同学用Na2CO3和KHCO3组成的某混合物进行实验,测得如下几组数据(其中盐酸的物质的量浓度相等,且忽略HCl的挥发,气体体积均为标准状况下的体积)。
试回答:(1)所用盐酸的物质的量浓度为__________。
(2)第4组实验至少还需加入________________ mL的该盐酸才能完全反应。
3.(2016·宁波市十校高三9月联考)将一定质量Na2CO3和NaHCO3的均匀混合物分成等量的两份。
将其中的一份直接加热至恒重,质量减轻了1.24 g;另一份加入一定量某浓度的盐酸至恰好反应完全,收集到标准状况下2.24 L 气体,消耗盐酸40.0 mL。
试计算:(1)原均匀混合物中NaHCO3的物质的量n(NaHCO3)=________________ mol。
(2)盐酸的浓度c(HCl)=________ mol·L-1。
4.(2016·嘉兴市第一中学高一10月月考)常温下,将20.0 g 14.0%的NaCl溶液跟30.0 g 24.0 %的NaCl溶液混合,得到密度为1.17 g·cm-3的混合溶液。
(1)该混合溶液的质量分数为__________。
(2)该混合溶液的物质的量浓度是_______mol·L -1。
(3)在1 000 g 水中溶解__________ mol NaCl 才能使其浓度与上述混合溶液的浓度相等。
有机化学典型计算题

有机化学典型计算题1.取标准情况下CH4和过量的O2混合气体840mL点燃,将燃烧后的气体用碱石灰吸收,碱石灰增重0.600g,计算:(1)碱石灰吸收后所剩气体的体积(标准状况下)?(2)原混合气体中CH4跟O2的体积比.2.室温时,20ml某气态烃与过量氧气混合,将完全燃烧后的产物通过浓硫酸,再恢复至室温,气体体积减少了50mL,将剩余气体再通过氢氧化钠溶液,体积又减少了40mL.求该气态烃的分子式。
求该气态烃的分子式C2H63.A是由C H或C H O元素组成的有机物,取0.01molA在1.456L(标准状况)氧气中燃烧,燃烧的产物通过足量浓硫酸,浓硫酸增重0.54g,再在通过浓硫酸后的气体中点燃Mg条(足量),生成总质量为5.16g的黑白两种物质,且黑色生成物与白色生成物的物质的量比为1:4,求A的分子式。
A的分子式为C3H6 O24.有机物A是烃的含氧有机物,在同温同压下,A蒸气的质量是同体积乙醇蒸气的2倍。
1.38gA 完全燃烧后,将燃烧产物通过碱石灰,碱石灰的质量增加3.06 g。
若将燃烧后的产物通过浓硫酸,浓硫酸的质量增加1.08g。
取4.6gA与足量的金属Na反应,在标准状况下生成1.68L氢气,A与Na2CO3溶液混合不反应,求A的结构简式。
A是丙三醇。
结构简式为CH2(OH)-CH(OH)-CH2OH5.由一种气态烷烃与一种气态烯烃组成的混合气体,它对氦气的相对密度为6,将1体积混合气与4体积氧气再混合,然后装入密闭容器中,用电火花点燃,使之充分燃烧,若反应前后温度均保持在120℃,测得容器压强比反应前增加,则该混合气体可能由__________组成,若增加4%,则由__________气体组成。
要使压强增大4%,则体积要增大4%,则C3H6占4%,CH4占16%,此时M均恰好等于24,符合题意6.某有机化合物A对氢气的相对密度为29,燃烧该有机物2.9g,生成3.36L二氧化碳气体。
2019高考化学大一轮复习专题1专题讲座一学考第29题__化学计算题解题方法课件5

混合物中 NH+ 4 与Ba(OH)2溶液(浓度同上)恰好完全反应时,消耗氢氧化钡
是0.02 mol,因此溶液体积是200 mL,则溶液中c(Cl-)=0.02 mol÷0.2 L
=0.100 mol· L-1。
1 2
体会命题特点
解析
答案
细研解题方法
一、守恒法 方法指导 当物质之间发生化学反应时,其实质就是原子之间的化分和化合。即可推 知某种元素的原子无论是在哪种物质中,反应前后其质量及物质的量都不 会改变,即质量守恒;在化合物中,阴、阳离子所带电荷总数相等,即电 即电子守恒;在组成的各类化合物中,元素的正、负化合价总数的绝对值 相等 ,即化合价守恒。运用守恒法解题的基本类型主要有以下三种:
专题1 化学家眼中的物质世界
专题讲座一
学考第29题——化学计算题解题方法
探究学考真题
1.(2017· 浙江11月选考,29)取7.90 g KMnO4,加热分解后剩余固体7.42 g。 该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体A, 产物中锰元素以Mn2+存在。 请计算: 60%(或0.60) 。 (1)KMnO4的分解率_____________
1 2
解析
答案
(2)另一份固体混合物中 NH+ 4 与Ba(OH)2溶
液 ( 浓度同上 ) 恰好完全反应时,溶液中 0.100 mol· L-1 溶液体积变化忽 c(Cl - ) = _____________( 略不计)。 解析 每一份中硫酸铵和氯化铵分别是0.01 mol、0.02 mol,另一份固体
为铁,故本题实际上是求混合物中铁元素的质量,据混合物溶于盐酸后加
入KSCN不变色,说明溶液中无Fe3+,全部是FeCl2。由Cl-个数守恒可知: 1 1 n(FeCl2)= n(HCl)= ×0.1 L×1 mol· L-1=0.05 mol。又据铁元素守恒知 2 2 6.88 g混合物中含铁质量为2×0.05 mol×56 g· mol-1=5.6 g。
高考化学计算专题试题集(含答案)

Ⅰ.有关物质的量的计算一、选择题1.质量相等的两份气体样品,一份是CO ,另一份是CO 2,这两份气体样品中,CO 与CO 2所含氧原子的原子个数之比是 ( )A .1:2B .1:4C .11:14D .1l :282.下列各组中两种气体的分子数一定相等的是 ( )A .温度相同、体积相同的O 2和N 2B .质量相等、密度不等的N 2和C 2H 4C .体积相同、密度相等的CO 和C 2H 4D .压强相同、体积相同的O 2和H 23.由钾和氧组成的某种离子晶体含钾的质量分数是78/126,其阴离子只有过氧离子(O 22-)和超氧离子(O 2-)两种。
在此晶体中,过氧离子和超氧离子的物质的量之比为 ( )A .2:lB .1:lC .1:2D .1:34.由CO 2、H 2和CO 组成的混合气在同温同压下与氮气的密度相同。
则该混合气体中CO 2、H 2和CO 的体积比为 ( )A .29:8:13B .22:l :14C .13:8:29D .26:16:575.由X 、Y 两元素组成的气态化合物XY 4,在一定条件下完全分解为A 、B 两种气体物质,己知标准状况下20mLXY 4分解可产生标准状况下30mL A 气体(化学式为Y 2)和10mL B气体,则B 的化学式为 ( )A .X 2B .Y 2X 2C .XY 2D .X 2Y 46.将N02、NH 3、O 2混合气22.4L 通过稀硫酸后,溶液质量增加了26.7g ,气体体积缩小为4.48L .(气体体积均在标况下测定)剩余气体能使带火星的木条着火,则混合气体的平均分子量为 ( )A .28.1B .30.2C .33.1D .34.07.为方便某些化学计算,有人将98%浓硫酸表示成下列形式,其中合理的是 ( )A .H 2SO 4·19B .H 2SO 4 ·H 2OC .H 2SO 4·SO 3D .SO 3· 109H 2O 8.两种气态烃组成的混合气体0.1mol ,完全燃烧得O.16molCO 2 T3.6g 水。
高一化学计算题练习试题集

高一化学计算题练习试题答案及解析1.用足量的NaOH吸收448mLCl2(标准状况)氯气,计算生成NaCl的物质的量。
【解析】在标况下,448 mLCl2即氯气物质的量为0.448除以22.4等于0.02mol。
再由2NaOH+Cl2=NaCl+NaClO+H2O 因此可以生成氯化钠物质的量为0.02mol.故氯化钠的质量为1.17克。
【考点】2.将50.0g含有NH4NO3、(NH4)2SO4及其它难溶物的混合物样品,溶于水,过滤后加入足量浓NaOH溶液共热,在标准状况下收集到13.44 L氨气,再向溶液中加入足量BaCl2溶液,产生沉淀46.6g,试计算混合物中NH4NO3的物质的量及(NH4)2SO4的质量分数。
【答案】n(NH4NO3)=0.2mol,w((NH4)2SO4)=52.8%【解析】加入氯化钡产生沉淀,则说明这个沉淀是硫酸钡,即硫酸钡的质量为46.6克。
则它的物质的量为46.6除以233等于0.2mol.再由原子个数守恒可知(NH4)2SO4的物质的量等于BaSo4 物质的量所以(NH4)2SO4为0.2mol 。
再由质量等于物质的量乘以摩尔质量可求出硫酸铵的质量为0.2乘以132等于26.4克,.所以硫酸铵的质量分数为26.4除以50.5等于52.8%由氮元素个数守恒可知;(NH4)2SO4---2NH3由 (NH4)2SO4生成氨气的物质的量为0.4mol而总得氨气的物质的量为13.44除以22.4等于0.6mol 所以由硝酸铵制备得的氨气的物质的量为0.6减去0.4等于0.2mol,据氮原子个数守恒可知硝酸铵的物质的量为0.2mol【考点】考查物质的量在化学反应中计算的相关知识点3.在恒温时,向某密闭容器中通入2mol X和1mol Y气体,发生如下反应:2X(气)+Y(气)2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
(1)与上述平衡保持同温、同压,若向密闭容器中通入4mol X(气)、2mol Y(气),达到平衡,则Z的体积分数为;平衡时,气体的总物质的量是。
高中化学计算题总结+高考真题练习

.高中化学计算题的解法概括【知识网络】计算方法差质量差量法体积差质量守恒电荷守恒守恒法电子守恒原子守恒粒子关守恒系式方程式法叠加均匀平式量均均匀摩电值子质量法均匀构成极值法估量法原理利用物质在反响前后的质量差求解利用气体物质在反响前后的体积差量求解从宏观上看,化学反响前后的质量相等①在电解质溶液中,因为整个溶液呈中性,因此阴、阳离子所带的电荷总量一定相等。
②在离子方程式中,反响物所带正(负)电荷总量与生成物所带正(负)电荷总量相等。
在氧化复原过程中,老是存在着得电子总数等于失电子总数,在原电池和电解池中经过两极的电子数必定相等。
反响前原子总数等于反响后产物以各样形式存在的总数从微观上看,化学反响前后同种元素的原子个数必定相等。
对循环反响(前一反响的某一产物,在参加后续反响后,又重生成,使反响循环下去)将方程式相加,消去循环项。
即用均匀相对原子质量或相对分子质量判断物质成分或含量反响中均匀转移 1mol 电子所需混淆物的质量,其值介于两组分之间在混淆物的计算中,能够把均匀构成作为中介,以此议论可能的构成是把所研究的对象或过程变化经过假定,推到理想的极限值,使因果关系变得十分显然,进而得出正确的判断,或许将化学识题抽象成数学的极限问题求解。
是从化学原理出发,充足利用界限条件,并运用近似值、均匀值、极限值、等于、大于或小于等数学方法,对化学识题的定量问题进行估计、评论、推测,进而得出正确结论的一种思想方法。
说明实例依据物质变化前后某种量发生变化的方程式或关系式,找出所谓“理论差量”。
利用该法重点有两点:①弄清差量的原由;②弄清差量与什例 1么量成比率。
例 2是奇妙选择化学式或溶液中某两种数(如正负例 3化合价总数、阴阳离子所带的正负电荷总数)相等,或几个连续(或平行)的方程式前后某微粒(如离子、原子、电子)的物质的量保持不变作为解题依照。
例 4例 5例 6例 7是计算顶用来表示已知量与未知量成正比率关系的式子。
高中化学计算题总结高考真题练习
高中化学计算题的解法归纳【知识网络】【易错指津】1.根据氧化还原反应中电子守恒计算时,一是准确判断新给物质的化合价,二是如原子团中某原子个数不为1时,要乘以原子个数。
2.根据化学反应,利用气体物质的量推算容器压强时,不要将固体物质的量也计算在内。
3.对一些特殊反应,如浓H 2SO 4、浓HNO 3、浓HCl 随反应进行浓度在减少,导致反应情况改变,不能只从理论上计算。
例1 某体积可变的密闭容器,盛有适量的A 和B 的混合气体,在一定条件下发生反应: 2C 。
若维持温度和压强不变,当达到平衡时,容器体积为VL ,其中C 气体的体积占10%,下列推断正确的是(全国高考题)①原混合气体的体积为1.2VL ②原混合气体的体积为1.1VL ③反应达平衡时气体A 消耗掉0.05VL ④反应达平衡时气体B 消耗掉0.05VL A.②③ B.②④ C.①③ D.①④ 例2 C 8H 16经多步裂化,最后完全转化为C 4H 8、C 3H 6、C 3H 6、C 2H 4、C 2H 6、CH 4五种气体的混合物。
该混合物的平均相对分子质量可能是(上海高考题)A.28B.30C.38D.40例3 将硫酸钾、硫酸铝、硫酸铝钾三种盐混合溶于硫酸酸化的水中,测得c(SO 42-)=0.105mol/L 、c(Al 3+)=0.055mol/L ,溶液的pH=2.0(假设溶液中H 2SO 4完全电离为H +和SO 42-),则c(K +)为(上海高考题)例4 某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物,当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是(全国高考题) A.NO 2 B.NO C.N 2O D.N 2例5 将1.92g 铜粉与一定量浓硝酸反应,当铜粉完全作用时收集到1.12L (标准状况)。
则所消耗硝酸的物质的量是(上海高考题)例6 由NaH 2PO 4脱水形成聚磷酸盐Na 200H 2P 200O 601,共脱去水分子的数目为(上海高考题) A.198个 B.199个 C.200个 D.201个 例7 工业上常用漂白粉跟酸反应放出的氯气质量对漂白粉质量的质量分数来表示漂白粉的优劣,漂白粉与酸的反应为:Ca(ClO)2+CaCl 2+2H 2SO 4=2CaSO 4+2Cl 2↑+2H 2O ,现为了测定一瓶漂白粉的x%,进行如下实验,称取漂白粉样品2.00g ,加水研磨后,转入250mL 容量瓶内,用水稀释至刻度,摇匀后,取出25.0mL ,加入过量的KI 溶液和过量稀硫酸,静置,待漂白粉放出的氯气与KI 完全反应后,用0.1mol/LNa 2S 2O 3标准溶液滴定反应中生成的碘,反应如下2Na 2S 2O 3+I 2= Na 4S 4O 6+2NaI ,滴定时用去溶液20.0 mL 。
高一化学计算题练习试题集

高一化学计算题练习试题答案及解析1.某校化学兴趣小组为测定空气中二氧化硫的含量,用NaOH溶液吸收SO2,反应方程式如下:2NaOH+SO2 ==Na2SO3+ H2O用NaOH溶液吸收1000L已除去CO2的空气样品,溶液质量增重了0.64g,已知此时空气的密度约为1.3g/L,求:(1)被吸收的SO2质量. (2)发生反应的NaOH的质量.(3)空气中SO2的质量分数(计算结果精确到0.01%) .【答案】(1)0.64 g;(2)0.8g;(3)0.05%【解析】(1)溶液质量增重了0.64g,即被吸收的SO2质量是0.64g。
(2)设发生反应的NaOH的质量为x,则:2NaOH+ SO2 ="===Na"2SO3+ H2O80 64X 0.64 g解得x="0.8" g(3)空气中SO2的质量分数= ×100%="0.05%"【考点】考查发生化学反应的物质的质量及混合物中物质的含量的计算的知识。
2.将3.25g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应。
求:(1)反应中生成的H2在标准状况下的体积;(2)所用盐酸中HCl的物质的量浓度。
【答案】1.12L;0.5mol/L【解析】n(Zn)=3.25g÷65g/mol=0.05mol,则根据反应式可知Zn + 2HCl ="=" ZnCl2 + H2↑1 mol2 mol 1 mol0.05mol 0.1mol 0.05mol所以V(H2)=0.05mol ×22.4L/mol ="=" 1.12Lc(HCl)= 0.1mol÷0.2L=0.5mol /L【考点】考查物质的量的有关计算3.向铜片中加入115mL某浓度的硫酸,在加热条件下反应,待铜片全部溶解后,将其溶液稀释到500mL,再加入足量锌粉,使之充分反应,收集到2.24L(标准状况)气体。
高一化学计算题练习试题集

高一化学计算题练习试题答案及解析1.向100ml 1mol/L 的Al2(SO4)3溶液中加入100ml NaOH溶液,得到7.8克白色沉淀,请问NaOH溶液物质的量浓度可能是多少?【答案】3mol/L 7mol/L【解析】本题考查根据化学方程式计算,注意氢氧化铝为两性氢氧化物,可溶于强碱氢氧化钠溶液。
分两种情况讨论:1、当氢氧化钠不足量时;设 NaOH溶液的物质的量浓度是x,3OH-+Al3+=Al(OH)3↓3mol 78g0.1xmol 7.8g解得 x=3mol/L;2、氢氧化钠过量,先生成沉淀,后沉淀部分溶解。
硫酸铝中Al3+的物质的量为2×1mol/L×0.1L=0.2mol,7.8g沉淀需要Al3+的物质的量为0.1mol,转变成AlO2-的Al3+的物质的量为0.1mol.设 NaOH溶液的物质的量浓度是xmol/L,3OH-+Al3+=Al(OH)3↓3 mol 78g0.3mol 7.8g4OH-+Al3+=AlO2-+2H2O4mol 1mol0.4mol 0.1mol根据公式c=n/V计算,KOH溶液的物质的量浓度是7mol/L。
【考点】考查根据化学方程式计算及氢氧化铝的性质。
2.从100 mL某种待测浓度的 H2SO4溶液中取出25 mL,加入10 mL 0.5 mol·L-1 BaCl2溶液,恰好完全反应。
求:①得到 BaSO4沉淀多少克 ?②待测 H2SO4溶液中溶质的物质的量浓度是多少?【答案】m(BaSO4)=1.165g c(H2SO4)=0.2mol·L-1【解析】①氯化钡的物质的量=0.01L×0.5mol/L=0.005mol,则H2SO4+BaCl2=2HCl+BaSO4↓1mol 1mol 1moln(H2SO4) 0.005mol n(BaSO4)则1mol:1mol=n(H2SO4):0.005mol解得n(H2SO4)=0.005mol1mol:1mol=0.005mol:n(BaSO4)解得n(BaSO4)=0.005mol则硫酸钡的质量=0.005mol×233g/mol=1.165g②待测 H2SO4溶液中溶质的物质的量浓度=0.005mol÷0.025L=0.2mol/L【考点】考查物质的量、物质的量浓度的有关计算3.标准状况下448mL某气态烃完全燃烧后,生成2.64g二氧化碳,等量的这种烃也能使含2% Br2的四氯化碳溶液160g全部褪色,求该烃的化学式和结构简式(不必写计算过程)。
高考化学计算大题知识点归纳及专项练习题(含答案)

高考化学计算大题知识点归纳及专项练习题(含答案)一、知识点归纳规律方法1.化学计算中常考查的守恒思想有“转移电子数守恒、电荷守恒和质量守恒”等,它们是解决化学计算的“金钥匙”,首先要准确判断应该运用哪一种守恒解题。
(1)运用转移电子守恒解题①找出氧化剂、还原剂及相应的还原产物和氧化产物(谁变价)。
②确定一个原子或离子得失电子数(变几价)。
③根据题中物质的物质的量和得失电子守恒列出等式(几个变)。
④对于多步连续进行的氧化还原反应,只要中间各步反应过程没有损耗,可直接找出起始物和最终产物,删去中间产物,建立二者之间的电子守恒关系,快速求解。
(2)运用电荷守恒解题电荷守恒的解题依据是:电解质溶液中不论存在多少种离子,溶液都是呈电中性的,即阴离子所带电荷总数和阳离子所带电荷总数相等。
解题的关键是:找全离子;离子带几个电荷乘几。
(3)运用质量守恒解题运用质量守恒的关键是准确判断在整个反应过程中哪一种元素的原子的个数或物质的量不发生改变,淡化中间过程,快速解题。
2.关系式法解题的答题思路和模式(1)分析题中反应——写出各步反应方程式——根据反应中各物质的计量数关系——确定已知物质与待求物质的物质的量关系——列比例求算(2)分析题中反应——根据某元素原子守恒——确定关系式——列比例求解3.(1)熟记反应热ΔH的基本计算公式ΔH=生成物的总能量-反应物的总能量;ΔH=反应物的总键能-生成物的总键能(2)掌握常见物质中的化学键类型和数目如:CO2;CH4;P4;P2O5等4.活用“三点”可快速准确解电解计算题(1)串联电路中每个电极转移的电子数相等。
(2)准确判断各电极的电极产物。
(3)掌握转移4 mol e-不同电极产物之间满足的关系。
4 mol e-~1 mol O2~2 mol H2~2 mol Cl2~2 mol Cu~4 mol Ag~4 mol H+~4 mol OH-反思归纳1.化学平衡和电解质溶液计算时常注意的问题(1)要利用“三段式”突破平衡和电解质溶液的计算题。
专题03 化学计量与化学计算—三年高考(2015-2017)化学真题分项版解析(解析版)

1.【2017新课标2卷】阿伏加德罗常数的值为A N 。
下列说法正确的是A .1 L 0.1mol·1L -NH 4Cl 溶液中,4NH +的数量为0.1A N B .2.4g Mg 与H 2SO 4完全反应,转移的电子数为0.1A NC .标准状况下,2.24 L N 2和O 2的混合气体中分子数为0.2A ND .0.1 mol H 2和0.1mol I 2于密闭容器中充分反应后,其分子总数为0.2A N【答案】D【名师点睛】本题考查阿伏加德罗常数的应用,是高考的一个热点,主要从物质结构、水解、转移电子、可逆反应等角度考查,本题相对比较容易,只要认真、细心就能做对,平时多注意这方面的积累。
2.【2017新课标3卷】N A 为阿伏加德罗常数的值。
下列说法正确的是A .0.1 mol 的11B 中,含有0.6N A 个中子B .pH=1的H 3PO 4溶液中,含有0.1N A 个H +C .2.24L (标准状况)苯在O 2中完全燃烧,得到0.6N A 个CO 2分子D .密闭容器中1 mol PCl 3与1 mol Cl 2反应制备 PCl 5(g ),增加2N A 个P-Cl 键【答案】A【解析】A .B 的原子序数为5,即质子数为5,在质量数为11的B 原子中含有6个中子,0.1mol 11B 含有0.6N A 个中子,A 正确;B .溶液体积未定,不能计算氢离子个数,B 错误;C .标准状况下苯是液体,不能利用气体摩尔体积计算2. 24L 苯的物质的量,则无法判断其完全燃烧产生的CO 2分子数目,C 错误;D .PCl 3与Cl 2反应生成PCl 5的反应是可逆反应,反应物不可能完全转化为生成物,则1molPCl 3与1molCl 2反应生成的PCl 5小于1mol ,增加的P -Cl 键的数目小于2N A 个,D 错误。
答案选A 。
【名师点睛】考查与阿伏加德罗常数有关计算时,要正确运用物质的量的有关计算,同时要注意气体摩尔体积的使用条件;另外还要谨防题中陷阱,如讨论溶液里的离子微粒的数目时,要考虑:①溶液的体积,②离子是否水解,③对应的电解质是否完全电离;涉及化学反应时要考虑是否是可逆反应,如选项D涉及可逆反应,反应的限度达不到100%;其它如微粒的结构、反应原理等,总之要认真审题,切忌凭感觉答题。
浙江省普通高校招生选考科目考试化学模拟题分类汇总

B.KOH
14.(18 年 2 月金华十校)下列属于碱的是
C.Cu2(OH)2CO3
A.CH3COOH
B.CuCl2
15.(18 年 2 月温州六校)下列属于盐的是
C.Ba(OH)2
A.生石灰
B.盐酸
C.纯碱
16.(18 年 2 月绍兴上虞调测)下列不.属于氧化物的是
A.Na2O
B.H2O
C.CO
17.(18 年 2 月绍兴上虞调测)下列物质属于纯净物的是
Ⅰ 物质的分类 ···········································································1 Ⅱ 电解质 ·················································································2 Ⅲ 化学反应类型 ········································································2 Ⅳ 物质的分散系 ········································································4
7.(17 年 12 月金丽衢十二校)下列物质属于纯净物的是
A.碱石灰
B.煤
C.冰醋酸
8.(17 年 12 月七彩阳光)下列属于碱性氧化物的是
A.CO2
B.KOH
C.MgO
9.(17 年 12 月 9+1 联盟)下列属于酸性氧化物的是
A.SO3
B.Ba(OH)2
10.(17 年 12 月重点热身)下列属于碱的是
2017年浙江新高考29题化学计算题试题练习

2017年浙江新高考29题——化学计算1. 将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2体积(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解)。
试计算:(无需书写计算步骤)(1)盐酸的物质的量浓度为mol/L。
(2)该样品中NaOH与Na2CO3物质的量之比为。
2. 取1.19gK2CO3和KHCO3的混合物溶于水配成25mL溶液,往溶液中加入25mLBa(OH)2溶液恰好使生成的白色沉淀的量最多。
反应后溶液的c(OH-)=0.3mol/L(混合溶液体积为50mL)。
试计算:(1)反应后溶液中n(OH-)= mol。
(2)原混合物中n(K2CO3):n(KHCO3)= 。
3. 取2.74gNa2CO3和NaHCO3的混合物溶于水配成25mL溶液,往溶液中加入25mLHCl溶液恰好完全反应生成标准状况下672mL气体。
反应后溶液的c(Cl-)=0.8mol/L(混合溶液体积为50mL)。
试计算:(1)反应后溶液中n(Cl-)= mol。
(2)原混合物中n(Na2CO3):n(NaHCO3)= 。
5. 取14.3g Na2CO3·xH2O溶于水配成100mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸20.0mL,并收集到1.12LCO2(标准状况)。
试计算:(1) 稀盐酸物质的量的浓度为mol/L。
(2) x值是。
6. 取NaHCO3和Na2CO3的混合物8.22g,加热到质量不再发生变化,冷却后测得其质量为6.36g。
(1)取等质量的原混合物溶于水,配成80mL溶液,则c(Na+)= mol/L(2)向(1)所配的溶液中逐滴加入1mol/L的稀盐酸至过量,生成CO2的体积(标准状况)与加入盐酸的体积有如右图所示的关系(不考虑CO2的溶解),则a点消耗盐酸的体积为 mL。
7. 标准状况下,将7.84L HCl气体溶于水配得350mL 盐酸,然后与含17.9g Na2CO3和NaHCO3的溶液混合,充分反应后生成0.200mol CO2气体。
高考化学计算题守恒法详解(含例题及练习题)

高考化学计算题守恒法详解(含例题及练习题)利用电荷守恒和原子守恒为基础,就是巧妙地选择化学式中某两数(如化合价数、正负电荷总数)始终保持相等,或几个连续的化学方程式前后某微粒(如原子、电子、离子)的物质的量保持不变,作为解题的依据,这样不用计算中间产物的数量,从而提高解题速度和准确性。
1、原子个数守恒【例题1】某无水混合物由硫酸亚铁和硫酸铁组成,测知该混合物中的硫的质量分数为a,求混合物中铁的质量分数。
【分析】根据化学式FeSO4、Fe2(SO4)3可看出,在这两种物质中S、O原子个数比为1:4,即无论这两种物质以何种比例混合,S、O的原子个数比始终为1:4。
设含O的质量分数x,则32/64=a/x,x=2a。
所以ω(Fe)=1-3a【例题2】用1L1mol/L的NaOH溶液吸收0.8molCO2,求所得的溶液中CO23-和HCO3=的物质的量之比为【分析】依题意,反应产物为Na2CO3和NaHCO3的混合物,根据Na原子和C原子数守恒来解答。
设溶液中Na2CO3为xmol,为NaHCO3ymol,则有方程式①2x+y=1mol/L×1L①x+y=0.8mol,解得x=0.2,y=0.6,所以[CO32-]:[HCO3-]=1:32、电荷守恒即对任一电中性的体系,如化合物、混和物、溶液等,电荷的代数和为零,即正电荷总数和负电荷总数相等。
【例题3】在Na2SO4和K2SO4的混和溶液中,如果[Na+]=0.2摩/升,[SO42-]=x摩/升,[K+]=y摩/升,则x和y的关系是(A)x=0.5y (B)x=0.1+0.5y (C)y=2(x-0.1) (D)y=2x-0.1【分析】可假设溶液体积为1升,那么Na+物质的量为0.2摩,SO42-物质的量为x摩,K+物质的量为y摩,根据电荷守恒可得[Na+]+[K+]=2[SO42-],所以答案为BC 【例题4】用1L1mol/L的NaOH溶液吸收0.8molCO2,求所得的溶液中CO23-和HCO3=的物质的量之比为【分析】根据电荷守恒:溶液中[Na+]+[H+]=[HCO3-]+2[CO32-]+[OH-],因为[H+]和[OH-]均相对较少,可忽略不计。
2017年高考真题化学平衡汇编
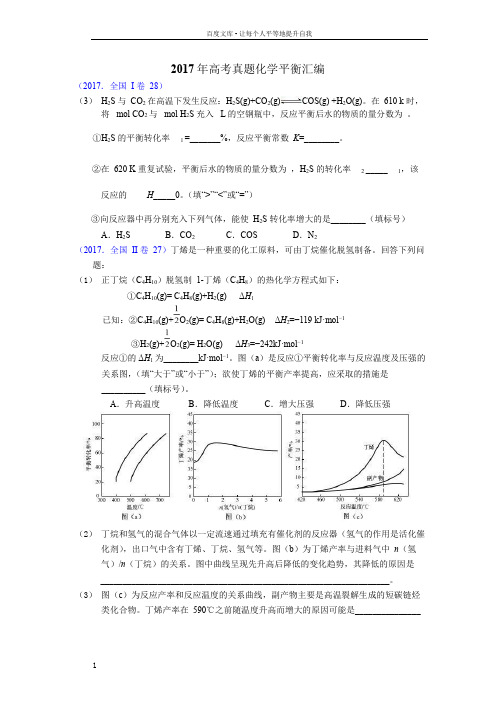
2017年高考真题化学平衡汇编(2017.全国I 卷28)(3)H2S 与CO2 在高温下发生反应:H2S(g)+CO2(g)COS(g) +H2O(g)。
在610 k 时,将 mol CO2 与 mol H2S 充入 L 的空钢瓶中,反应平衡后水的物质的量分数为。
①H2S 的平衡转化率 1 =_______%,反应平衡常数K=________。
②在620 K 重复试验,平衡后水的物质的量分数为,H2S 的转化率 2 _____1,该反应的H_____0。
(填“>”“<”或“=”)③向反应器中再分别充入下列气体,能使H2S 转化率增大的是________(填标号)A.H2S B.CO2C.COS D.N2(2017.全国II 卷27)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。
回答下列问题:(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:①C4H10(g)= C4H8(g)+H2(g)ΔH1已知:②C4H10(g)+O2(g)= C4H8(g)+H2O(g)ΔH2=−119 kJ·mol−1③H2(g)+O2(g)= H2O(g)ΔH3=−242kJ·mol−1反应①的ΔH1 为________kJ·mol−1。
图(a)是反应①平衡转化率与反应温度及压强的关系图,(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度B.降低温度C.增大压强D.降低压强(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。
图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。
图中曲线呈现先升高后降低的变化趋势,其降低的原因是__________________________________________________________________。
高一化学计算题练习试题集

高一化学计算题练习试题答案及解析1.标准状况下1.68 L无色可燃气体在足量氧气中完全燃烧。
若将产物通入足量澄清石灰水中,得到的白色沉淀质量为15.0 g;若用足量碱石灰吸收燃烧产物,质量增加9.3 g。
(1)燃烧产物中生成水的质量是______________________________。
(2)若原气体是单一气体,则它的分子式是___________________________。
(3)若原气体是两种等物质的量的气体的混合物,其中只有一种是烃,请写出它们的分子式(只要求写出一组)___________________________。
【答案】(1)2.7 g(2)C2H4(3)C3H8与CO(或C4H6与H2、C3H6与CH2O等)【解析】(1)白色沉淀为CaCO3,对应的CO2为0.15 mol,即6.6 g,碱石灰吸收的是H2O和CO2,因此H2O的质量为2.7 g。
(2)1.68 L无色气体的物质的量为0.075 mol,得出气体分子中碳、氢原子数分别为2、4,如果是单一气体,分子式为C2H4。
(3)由于混合物中两气体物质的量相等,所以只要两气体的碳、氢原子数的平均值分别为2、4就能满足条件。
2.一定量的氧化铜被足量的一氧化碳在加热的情况下还原,得到的气体通入含有X摩氢氧化钙的澄清石灰水,得沉淀Y克,则原氧化铜的质量是多少?[已知反应CaC03 + CO2+ H20→Ca(HCO3)2]【答案】(80Y/100)g(200X-Y/100)×80g 【解析】反应分两种情况情况:Ca(OH)2过量发生反应如下:Ca(OH)2+ CO2="=" CaC03↓+H20 CuO + CO Cu +CO244g 100g 80 44gm(CO2) Yg m(CuO)(44Y/100)g求得 m(CO2)=(44Y/100)g m(CuO)=(80Y/100)gCO2过量发生反应如下:CaC03+ CO2+ H20==Ca(HCO3)2Ca(OH)2+ CO2="=" CaC03↓+H2O100g 44g 1mol 1mol100Xg-Yg m1(CO2) Xmol m2(CO2) XmolCuO + CO Cu + CO2求得m1(CO2)=44g×(100Xg-Yg)÷100g m2(CO2)=44Xg 则CuO的质量为(200X-Y/100)×80g【考点】化学计算3. I.(1)在一密闭的2L的容器里充入8mol SO2和4mol 18O2,在一定条件下开始反应:2SO2(g)+O2(g)2SO3(g),2min末测得容器中有7.2mol SO2。
高考化学计算题解题技巧(含例题解析)

高考化学计算题解题技巧(含例题解析)1、守恒法多数计算题是以化学反应为依据,化学方程式可表示反应物和生成物之间的质量、微观粒子、物质的量、气体体积等变化关系,又反映出化学反应前后的电荷数、电子得失数、微粒个数都是守恒的。
在有关的多步反应、并行反应、混合物的综合计算等问题中,如能巧用这些守恒规律,可使难度较大和计算过程繁杂的题目达到解题思路简明、方法简单、步骤简化的目的,收到事半功倍的效果。
(1)质量守恒法例1把过量的铁粉加入到FeCl3和CuCl2组成的混合液中,充分搅拌,反应后过滤、干燥、称得不溶物的质量与加入铁粉的质量相等。
求混合物中FeCl3和CuCl2的物质的量之比是多少?解析:设混合物中CuCl2的物质的量为x,FeCl3物质的量为yFe+CuCl2=Cu+FeCl2Fe+2FeCl3=3FeCl2xmol xmol xmol y/2mol ymol反应后所得不溶物为铜粉和过量的铁粉。
按题意,反应中与FeCl3和CuCl2反应而消耗的铁粉的质量与置换出铜粉的质量相等。
按此等量关系用代数法求解。
56(x+y/2)=64x∴x:y=2:7(2)摩尔守恒法这是利用某种原子(或原子团)反应前物质的量等于转化为各种产物中所含该原子(或原子团)的物质的量进行计算的一种方法。
例2(1994年高考24题)38.4mg铜与适量的浓硝酸反应,铜全部作用后,共收集到气体22.4ml(标准状况),反应消耗的HNO3的物质的量可能是()A、1.0×10—3molB、1.6×10—3molC、2.2×10—3molD、2.4×10—3mol解析:此题的隐含条件是“随着铜与硝酸反应,硝酸越来越稀,因而产生的气体有NO2和NO”。
根据N原子守恒(不考虑NO2聚合成N2O4)有:nHNO3=nCu(NO3)2+nNO2+nNO=nCu×2+n总气体=[(38.4×10—3)/64]×2+(22.4×10—3)/22.4=2.2×10—3(mol)应选C。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2017年浙江新高考29题——化学计算
1. 将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2体积(标准状况)与加入的盐酸体积有如图关系(不考虑CO 2在水中的溶解)。
试计算:(无需书写计算步骤)
(1)盐酸的物质的量浓度为mol/L。
(2)该样品中NaOH与Na2CO3物质的量之比为。
2. 取1.19gK2CO3和KHCO3的混合物溶于水配成25mL溶液,往溶液中加入25mLBa(OH)2溶液恰好使生成的
白色沉淀的量最多。
反应后溶液的c(OH-)=0.3mol/L(混合溶液体积为50mL)。
试计算:
(1)反应后溶液中n(OH-)= mol。
(2)原混合物中n(K2CO3):n(KHCO3)= 。
3. 取2.74gNa2CO3和NaHCO3的混合物溶于水配成25mL溶液,往溶液中加入25mLHCl溶液恰好完全反应生成标准状况下672mL气体。
反应后溶液的c(Cl-)=0.8mol/L(混合溶液体积为50mL)。
试计算:
(1)反应后溶液中n(Cl-)= mol。
(2)原混合物中n(Na2CO3):n(NaHCO3)= 。
5. 取14.3g Na2CO3·xH2O溶于水配成100mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸20.0mL,并收集到1.12LCO2(标准状况)。
试计算:
(1) 稀盐酸物质的量的浓度为mol/L。
(2) x值是。
6. 取NaHCO3和Na2CO3的混合物8.22g,加热到质量不再发生变化,冷却后测得其质量为6.36g。
(1)取等质量的原混合物溶于水,配成80mL溶液,则c(Na+)= mol/L
(2)向(1)所配的溶液中逐滴加入1mol/L的稀盐酸至过量,
生成CO2的体积(标准状况)与加入盐酸的体积有如右图所示
的关系(不考虑CO2的溶解),则a点消耗盐酸的体积为 mL。
7. 标准状况下,将7.84L HCl气体溶于水配得350mL 盐酸,然后与含17.9g Na2CO3和NaHCO3的溶液混合,充分反应后生成0.200mol CO2气体。
(1)盐酸的物质的量浓度 mol/L
(2)原溶液中m(NaHCO3)= g
8.为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸30.0 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:
实验序号I II III IV
盐酸体积(mL) 30.0 30.0 30.0 30.0
样品质量(g) 2.96 3.70 5.18 6.66
CO2体积(mL) 672 840 896 672
(1) 样品中物质的量之比n(Na2CO3):n(NaHCO3)=_________。
(2) 盐酸的物质的量浓度c(HCl)=______________。
9.将铁粉和氧化亚铁粉末混合物9.2g加入150mL的稀硫酸中,恰好完全反应,在标准状况下生成2.24L 气体,试计算:
(1)混合物中铁粉的质量为 g。
(2)稀硫酸的物质的量的浓度为 mol/L。
10.将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合液中,若铜片完全溶解时(不考虑盐的水解及溶液体积的变化),溶液中的Fe3+、Cu2+、H+三种离子的物质的量的浓度相等,且测得溶液的c(H+)=0.1nol/L。
(1)原混合液中硫酸铁的物质的量 mol
(2)反应后溶液中SO42-离子的物质的量的浓度 mol/L。
11.部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)5.76g,经如图所示的处理:
试计算:
(1)合金样品中铁元素的质量分数为。
(2)标准状况下气体V= mL。
12.将20g某铁矿石(设只含铁的氧化物和杂质SiO2)溶于过量的稀盐酸,过滤后得滤液和5.6g不容物;然后在滤液中加入足量的NaOH溶液,过滤、洗涤、灼烧得16g红棕色固体。
(1)该矿石中铁的氧化物的化学式是。
(2)若加入的稀盐酸为2.1mol/L 200mL,则滤液的PH = (忽略反应前后体积变化)。
13. 有一包铁粉与铜粉混合均匀的粉末样品,为确定其组成,某同学将不同质量的该样品分别与40ml
1mol/L的FeCl3溶液反应,实验结果如下表所示(忽略反应前后溶液的体积的变化)。
试计算:
(1)实验④的滤液中c(Fe2+)= 。
(2)原粉末样品中m(Fe): m(Cu) = 。
14.某同学将一定量铜粉与10mL的浓硫酸充分反应,生成的气体为1.12L(已换算为标准状况,且不考虑其它副反应)。
(1)反应中理论上消耗铜的质量为 g
(2)若向反应后溶液中逐滴加入5mol/LNaOH溶液至铜离子恰好全部转变为C u(O H)2沉淀,消耗NaOH溶液52mL,则原浓硫酸的浓度为 mol/L。
15.实验室中,用一小片铜与5mL浓硫酸在试管中充分反应,将反应后的溶液稀释到200mL,测得PH=1。
将生成的SO2气体用50mL 1.2mol/L的NaOH溶液吸收,得到NaHSO3和Na2SO3的混合液中,两种溶质的物质的物质的量恰好相等。
(1)参加反应的铜的质量为 g。
(2)浓硫酸物质的量的浓度为 mol/L。
16.已知一定量的氢气在氯气中燃烧,所得混合物用500 mL 3.00 m ol·L-1的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.300 mol。
忽略氯气与水反应、盐类水解及溶液体积变化。
回答下列问题
(1)所得溶液中Cl-的物质的量为_________mol。
(2)所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)= ________。
17.将一定质量未除去氧化膜的镁条投入100 mL某浓度的盐酸中,镁条恰好完全溶解,生成气体100.8 mL(标准状况),向反应后的溶液中逐滴加入0.2 mol·L-1的NaOH溶液,当Mg2+恰好完全沉淀时,消耗NaOH 溶液体积为50 mL。
(1)盐酸物质的量浓度为________mol·L-1。
(2)该镁条中未被氧化的镁与被氧化的镁的物质的量之比为________。
18.量取16.0 mL 10.0 mol·L-1HCl溶液,加蒸馏水稀释至100 mL,取两份稀释后的HCl溶液各25 mL,分别加入等质量的Mg和Al,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)。
请计算:
(1)稀释后HCl溶液的物质的量浓度为__________mol·L-1。
(2)加入Mg的质量至少有__________。
19.取100 mL等物质的量浓度的盐酸和硫酸混合溶液,当加入100 mL 3.0 mol·L-1的Ba(OH)2溶液时,溶液显中性。
请计算:
(1)原混合液中H+的物质的量浓度为__________mol·L-1。
(2)当加入的Ba(OH)2体积为75 mL时,产生的沉淀质量为____________g。
20.Cl2与NaOH溶液反应可生成NaCl、NaClO和NaClO3(Cl-和ClO-)的比值与反应的温度有关,用24 g NaOH 配成的250 mL溶液,与Cl2恰好完全反应(忽略Cl2与水的反应、盐类的水解及溶液体积变化):
(1)NaOH溶液的物质的量浓度________mol·L-1。
(2)某温度下,反应后溶液中c(Cl-)=6c(ClO-),则溶液中c(ClO-) =________mol·L-1。
21.实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。
为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
①取25 mL甲溶液,向其中缓慢滴入乙溶液15 mL,共收集到112 mL(标准状况)气体。
②取15 mL乙溶液,向其中缓慢滴入甲溶液25 mL,共收集到56 mL(标准状况)气体。
(1)甲是____________(填化学式,下同)溶液,乙是_____________溶液。
(2)甲溶液的物质的量浓度为_______mol·L-1,乙溶液的物质的量浓度为________mol·L-1。
