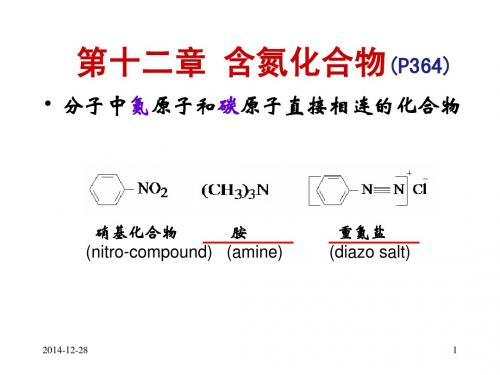
第十二章 硝基化合物 PPT课件
合集下载
苯的氨基与硝基化合物幻灯片

• 对氯苯胺事故应急处理: 隔离泄漏污染区,周围设警示标志,建议应 急处理人员戴好防毒面具,穿化学防护服。不要直接接触泄漏物,用 洁净的铲子收集于干燥洁净有盖的容器中,运至废物处理场所。如大 量泄漏,收集回收或无害处理后废弃。 • 急救措施: 皮肤接触对氯苯胺应立即脱去污染的衣服,用肥皂水及清 水彻底冲洗。注意手、足和指甲等部位。眼睛接触立即提起眼险,用 大量清洁流水或生理盐水冲洗。吸入后,迅速脱离现场至空气新鲜处。 呼吸困难时给氧。呼吸停止时,立即进行人工呼吸,并立即就医。误 服者给漱口,饮水,洗胃后口服活性炭,再给以导泻,并立即就医。
主要毒作用的共同点
(四)神经系损害
• 该类化合物难溶于水,易溶于脂肪,进入人体后 易与含大量类脂质的神经细胞发生作用,引起神 经系统的损害。重度中毒患者可有神经细胞脂肪 变性,视神经区可受损害,发生视神经炎、视神 经周围炎等。
主要毒作用的共同点
(五)皮肤损害和致敏作用
• 有些苯的氨基和硝基化合物对皮肤有强烈的刺激 作用和致敏作用,一般在接触后数日至数周后发 生接触性或过敏性皮炎,脱离接触并进行适当治 疗后可痊愈。此外,个别过敏体质者,接触对苯 二胺和二硝基氯苯后,还可发生支气管哮喘,临 床表现与一般哮喘相似。
毒理
• 三.毒性作用 苯胺代谢中间产物苯基羟胺,有很 强的形成高铁血红蛋白的能力,使血红蛋白失去 携氧功能,造成机体组织缺氧,引起中枢神经系 统、心血管系统及其他脏器的一系列损害。
毒理
苯胺的急性毒性: 大鼠吸入4h LC50774.2mg/m3 小鼠吸入 LC501120mg/m3 人经口MLD估计4 g
毒作用表现
• 严重中毒者,中毒3~4天后可出现不同程 度的溶血性贫血。可有黄疸、中毒性肝病和 膀胱刺激症状等。肾脏受损时,出现少尿、 蛋白尿、血尿等,严重者可发生急性肾功能 衰竭,少数见心肌损害。
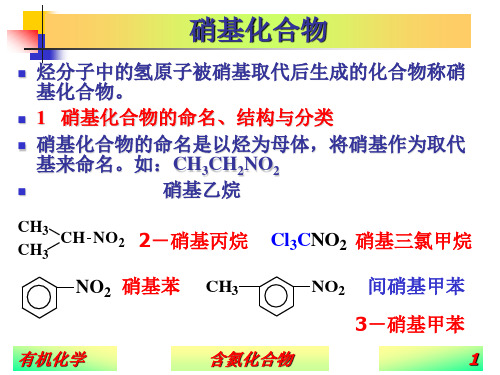
硝基化合物

O R
成环和重排
O R C CH2 R' 成环 O R + C CH2 R' 重排 R R' O R C CH2R' + N N O
+ + H2C N N C R
醛和环酮以重排产物为主,普通的酮主要生成环氧化物。酮分子中 与羰基相连的两个烃基不相同时,得到两种重排产物的混合物。
O R O R C CH2 H + + H2C N N C H + N N O R C CH3
H 重排
O + CH2N2
O CH2 + N N
O + N2
O C CH2 CH2N2 CH2
O C CH2 + N N
O C
环丙酮
3. 与酰氯反应
O R
脱去氯化氢
O R O H C CH2 Cl + -H+ N N O R C CH + N N + N N
+ + H2C N N C Cl
-Cl
R
第一节 硝基化合物
硝基化合物可分为脂肪族硝基化合物和芳香族硝基化合物。 硝基化合物的结构
CH3 + N O
Sp2杂化
O
O O
C-N 147pm , <ONO = 127
N-O
+ N
122pm
+ N O O
+ N
O O
P, π 共轭
CH3
NO2
μ= 3.5 D
硝基为强的吸电子基
厚 第十八章 止 其它含氮化合物
H2 O R'OH NH3 O O RCH2COR'
成环和重排
O R C CH2 R' 成环 O R + C CH2 R' 重排 R R' O R C CH2R' + N N O
+ + H2C N N C R
醛和环酮以重排产物为主,普通的酮主要生成环氧化物。酮分子中 与羰基相连的两个烃基不相同时,得到两种重排产物的混合物。
O R O R C CH2 H + + H2C N N C H + N N O R C CH3
H 重排
O + CH2N2
O CH2 + N N
O + N2
O C CH2 CH2N2 CH2
O C CH2 + N N
O C
环丙酮
3. 与酰氯反应
O R
脱去氯化氢
O R O H C CH2 Cl + -H+ N N O R C CH + N N + N N
+ + H2C N N C Cl
-Cl
R
第一节 硝基化合物
硝基化合物可分为脂肪族硝基化合物和芳香族硝基化合物。 硝基化合物的结构
CH3 + N O
Sp2杂化
O
O O
C-N 147pm , <ONO = 127
N-O
+ N
122pm
+ N O O
+ N
O O
P, π 共轭
CH3
NO2
μ= 3.5 D
硝基为强的吸电子基
厚 第十八章 止 其它含氮化合物
H2 O R'OH NH3 O O RCH2COR'
讲稿苯的氨基与硝基类化合物

第36页,共56页。
职业接触限值
苯胺(皮)
PC- TWA:3 mg/m3 PC-STEL:7.5mg/m3
第37页,共56页。
中毒案例
王××,男,26岁,某染料厂苯胺车间还原岗位操作工。因严重恶心,头 痛半日,1980年8月22日急诊入院。患者于入院当日在车间检修苯胺还原锅, 进入锅内更换搅拌器,其锅内苯胺没有彻底清洗,温度亦很高,工作中只着普 通工作服,佩戴长管式防毒面具,在锅内工作30分钟,出来后自觉头晕、恶心, 洗澡后回家休息,上述症状逐渐加重,且无力,倦怠,而来院就医,收入院治 疗。
第44页,共56页。
慢性TNT中毒表现
▪ 中毒性白内障 ▪ 肝脏损害 ▪ 血液系统损害 ▪ 其他
第45页,共56页。
中毒性白内障
➢ 是常见而且具有特征性的体征,白内障检出率在 9.6%~72.8%。
本专业工龄6年。1979年急性苯胺中毒入院治疗12天,痊愈出院。
体格检查 体温36.8℃,脉搏90/分,呼吸25/分.意识清;面色发绀,耳壳、 鼻尖、口唇、指(趾)端青紫,肝脾未触及。其余无殊。
实验室检查 血红蛋白17.58%,高铁血红蛋白40%,网织红细胞1.2 %,白细胞9500/mm3,嗜中性62%,淋巴36%,嗜酸2%。检出变性珠 蛋白小体。尿常规正常。肝功能正常。
第41页,共56页。
接触机会
三硝基甲苯作为炸药,广泛应用于国 防、采矿、开凿隧道,在粉碎、过筛、配 料、包装生产过程可产生粉尘及蒸气。
第42页,共56页。
代谢
进人体内的三硝基甲苯在肝微粒体和线粒体的参与下通过氧化、 还原、结合等 途径进行代谢。
(1)氧化反应:包括①TNT的甲基氧化为羟基,并进一步氧 化为羧基。②TNT的苯环氧化形成酚类化合物。
职业接触限值
苯胺(皮)
PC- TWA:3 mg/m3 PC-STEL:7.5mg/m3
第37页,共56页。
中毒案例
王××,男,26岁,某染料厂苯胺车间还原岗位操作工。因严重恶心,头 痛半日,1980年8月22日急诊入院。患者于入院当日在车间检修苯胺还原锅, 进入锅内更换搅拌器,其锅内苯胺没有彻底清洗,温度亦很高,工作中只着普 通工作服,佩戴长管式防毒面具,在锅内工作30分钟,出来后自觉头晕、恶心, 洗澡后回家休息,上述症状逐渐加重,且无力,倦怠,而来院就医,收入院治 疗。
第44页,共56页。
慢性TNT中毒表现
▪ 中毒性白内障 ▪ 肝脏损害 ▪ 血液系统损害 ▪ 其他
第45页,共56页。
中毒性白内障
➢ 是常见而且具有特征性的体征,白内障检出率在 9.6%~72.8%。
本专业工龄6年。1979年急性苯胺中毒入院治疗12天,痊愈出院。
体格检查 体温36.8℃,脉搏90/分,呼吸25/分.意识清;面色发绀,耳壳、 鼻尖、口唇、指(趾)端青紫,肝脾未触及。其余无殊。
实验室检查 血红蛋白17.58%,高铁血红蛋白40%,网织红细胞1.2 %,白细胞9500/mm3,嗜中性62%,淋巴36%,嗜酸2%。检出变性珠 蛋白小体。尿常规正常。肝功能正常。
第41页,共56页。
接触机会
三硝基甲苯作为炸药,广泛应用于国 防、采矿、开凿隧道,在粉碎、过筛、配 料、包装生产过程可产生粉尘及蒸气。
第42页,共56页。
代谢
进人体内的三硝基甲苯在肝微粒体和线粒体的参与下通过氧化、 还原、结合等 途径进行代谢。
(1)氧化反应:包括①TNT的甲基氧化为羟基,并进一步氧 化为羧基。②TNT的苯环氧化形成酚类化合物。
硝基化合物PPT课件

C l C H 2 C O O N a + N a N O 2H 2 O O 2 N C H 2 C O O N a 蒸 - C 馏 O 2C H 3 N O 2 C l C H 2 C H 2 C O O N a + N a N O 2H 2 O O 2 N C H 2 C H 2 C O O子结构式:
或
• 两个氮氧键长均为0.121nm
.
3
(2) 硝基的结构
• 硝基的共振结构式
.
4
二. 硝基化合物的制备 (1) 脂肪族硝基化合物的制备:烷烃和硝酸——硝化反应(得混合物作溶剂)
• 主要产物为一硝基化合物;
同时发生碳键的断裂而生成 低级硝基化合物。
实验室制备:
第十二章 含氮化合物
.
ex1it
第一节 硝基化合物 (Nitro Compounds)
一. 硝基化合物的分类、结构和命名
•硝基化合物可看成烃分子中的氢原子被硝基取代后的 衍生物。
(1)一硝基化合物和多硝基化合物 (2)伯、仲、叔硝基化合物(1°,2°,3°硝基化合物)
• 命名——硝基作为取代基:
对应的是几级碳
物是液体,它们具有苦杏仁味;有毒性. • 多硝基化合物在受热时一般易分解而发生爆炸.
硝基化合物的红外光谱
• 脂肪族伯和仲硝基化合物的N-O伸缩振动在1565~1545 cm-1 和 1385~1360 cm-1,叔硝基化合物的N-O伸缩振动在1545~1530 cm-1 和1360~1340 cm-1.
[2H] Ar NH NH Ar
.
氢化偶氮苯衍生物 14
2. 氢化偶氮苯类化合物的重排反应
N H N H
H + N H 2
或
• 两个氮氧键长均为0.121nm
.
3
(2) 硝基的结构
• 硝基的共振结构式
.
4
二. 硝基化合物的制备 (1) 脂肪族硝基化合物的制备:烷烃和硝酸——硝化反应(得混合物作溶剂)
• 主要产物为一硝基化合物;
同时发生碳键的断裂而生成 低级硝基化合物。
实验室制备:
第十二章 含氮化合物
.
ex1it
第一节 硝基化合物 (Nitro Compounds)
一. 硝基化合物的分类、结构和命名
•硝基化合物可看成烃分子中的氢原子被硝基取代后的 衍生物。
(1)一硝基化合物和多硝基化合物 (2)伯、仲、叔硝基化合物(1°,2°,3°硝基化合物)
• 命名——硝基作为取代基:
对应的是几级碳
物是液体,它们具有苦杏仁味;有毒性. • 多硝基化合物在受热时一般易分解而发生爆炸.
硝基化合物的红外光谱
• 脂肪族伯和仲硝基化合物的N-O伸缩振动在1565~1545 cm-1 和 1385~1360 cm-1,叔硝基化合物的N-O伸缩振动在1545~1530 cm-1 和1360~1340 cm-1.
[2H] Ar NH NH Ar
.
氢化偶氮苯衍生物 14
2. 氢化偶氮苯类化合物的重排反应
N H N H
H + N H 2
【有机化学】杂环化合物【课件PPT】

NN
O + Br2 0 OC
O Br 80%
S
95% H2SO4
25oC
S
SO3H (69~76%)
21
+ Ac2O
N
乙酸酐
H
N H
CH3 O
吡咯和呋喃遇强酸时, 杂原子能质子化, 使芳香大 键破坏, 所以不能用强酸进行硝化和磺化反应, 需选用较温和的非质子性试剂。例如吡咯硝化需 用硝酸乙酰基酯。
1N 6 5
7
N
2
N
3
4
NH9
8
嘌呤
嘌呤是由咪唑和 嘧啶两个杂环稠 合而成。
23
6
1N 5
7
N
2
8
N
3
4
NH9
9H-嘌呤
N Quinoline
6
1N 5
7
NH
2 N4 N 8
39
7H-嘌呤
N Isoquinoline
CH3O
CH3O
N
罂粟碱
OCH3
OCH3
24
水溶度: ∞ 1:1
1:1
微溶
答: 吡啶能与水形成氢键。羟基或氨基取代的 吡啶因分子间氢键的形成而降低了水溶度。
14
2. 碱性:吡啶环 N 原子的孤电子对处于sp2杂化 轨道上,而一般脂肪胺N上的孤电子对处于sp3杂化 轨道。前者碱性较弱 (pKb=8.8) 。
+ HCl N
+ Cl N H
碱性比较:脂肪胺 >>
N N Pyridazine
哒嗪
N
N Pyrimidine
嘧啶
N
N Pyrazine
第一节 硝基化合物

第一节 硝基化合物
一.硝基化合物的分类、命名和结构
1. 分类 2. 命名 3. 结构
二.硝基化合物的性质
1. 物理性质 2. 化学性质
脂肪族硝基化合物 芳香族硝基化合物
一、硝基化合物的分类、命名和结构
1. 分类 硝基化合物通式:R━NO2
官能团:硝基
伯 RCH2NO2
脂肪族硝基化合物 仲 R2CHNO2
OH
NO2 NaHCO3溶液
NO2
H+
NO2
130 ℃
Cl
ONa
NO2 NaHCO3溶液 100 ℃
NO2 H+
OH NO2
NO2
NO2
NO2
二、硝基化合物的性质
O2N
Cl
NO2 NaHCO3溶液 O2N 35 ℃
ONa NO2 H+
O2N
OH NO2
NO2
NO2
NO2
硝基是强吸电子基团,随着硝基数目的增加,苯环上电子云密度
按照烃基的结构
叔 R3CNO2
芳香族硝基化合物
一硝基化合物 按照官能团的数目
多硝基化合物
一、硝基化合物的分类、命名和结构
2. 命名
硝基化合物的命名和卤代烷类似,硝基只作取代基
NO2
CH3
COOH
(CH3)2CHNO2
2-硝基丙烷 2-nitropropane
NO2
间二硝基苯 m-dinitrobenzene
R2CHNO2 + HONO
NO2
R
NO
NaOH 溶液
C
溶解,得到蓝色溶液
R
NO2
R3CNO2 + HONO
一.硝基化合物的分类、命名和结构
1. 分类 2. 命名 3. 结构
二.硝基化合物的性质
1. 物理性质 2. 化学性质
脂肪族硝基化合物 芳香族硝基化合物
一、硝基化合物的分类、命名和结构
1. 分类 硝基化合物通式:R━NO2
官能团:硝基
伯 RCH2NO2
脂肪族硝基化合物 仲 R2CHNO2
OH
NO2 NaHCO3溶液
NO2
H+
NO2
130 ℃
Cl
ONa
NO2 NaHCO3溶液 100 ℃
NO2 H+
OH NO2
NO2
NO2
NO2
二、硝基化合物的性质
O2N
Cl
NO2 NaHCO3溶液 O2N 35 ℃
ONa NO2 H+
O2N
OH NO2
NO2
NO2
NO2
硝基是强吸电子基团,随着硝基数目的增加,苯环上电子云密度
按照烃基的结构
叔 R3CNO2
芳香族硝基化合物
一硝基化合物 按照官能团的数目
多硝基化合物
一、硝基化合物的分类、命名和结构
2. 命名
硝基化合物的命名和卤代烷类似,硝基只作取代基
NO2
CH3
COOH
(CH3)2CHNO2
2-硝基丙烷 2-nitropropane
NO2
间二硝基苯 m-dinitrobenzene
R2CHNO2 + HONO
NO2
R
NO
NaOH 溶液
C
溶解,得到蓝色溶液
R
NO2
R3CNO2 + HONO
《硝基化合物》课件

和运输
探讨硝基化合物的储存 和运输要求,以确保安 全。
3 硝基化合物的处理
和回收
讨论如何正确处理和回 收硝基化合物以减少对 环境的影响。
总结
硝基化合物的主要内容
回顾硝基化合物的核心概念和重要知识点。
硝基化合物的重要性
强调硝基化合物在科学研究和实际应用中的重要性。
硝基化合物的发展趋势
展望硝基化合物领域的未来发展趋势和前景。
探讨硝化反应发生所需的适宜条件。
硝化反应的实验方法
介绍实验室中用于合成硝基化合物的常用实验方法。
硝基化合物的性质
物理性质
探索硝基化合物的物理性质, 如熔点、沸点和溶解度等。
化学性质
介绍硝基化合物的常见化学 反应和反应特点。
硝基化合物的危害
讨论硝基化合物在人体和环 境中的危害和影响。
硝基化合物的应用
硝基化合物
欢迎来到《硝基化合物》的PPT课件!今天我们将深入探讨硝基化合物的定 义、合成、性质、应用和安全性等方面的知识。
什么是硝基化合物
• 硝基化合物的定义 • 硝基的结构和化学性质 • 硝基化合物的种类和分类
硝基化合物的合成
硝化反应的原理
详细介绍硝化反应如何实现硝基化合物的合成。
硝化反应的条件
1
医药应用
2
探索硝基化合物在医药领域的重要作
用和应用。
3
工业应用
了解硝基化合物在工业生产中的广泛 应用领域。
硝基化合物的环境影响
讨论硝基化合物对环境的影响和可持 续发展的相关措施。
硝基化合物的安全性
1 作硝基化合物所 需的安全措施。
2 硝基化合物的存储
硝基咪唑类化合物PPT参考幻灯片

13
硝基咪唑类化合物
序号 21 22 25 26 27 29 30 31 32
分子结构
CAS 登录号 69198-10-3 22994-85-0
443-48-1 3366-95-8 1077-93-6 13182-89-3 19387-91-8 55981-09-4 7681-76-7
产品名称
分子式
结构式
分子式 分子量 CAS。NO.
C7H11N3O4 201.18
C7H11N3O4 201.18
62580-80-7
C7H10ClN3O3 219.626
14419-11-5
2020/3/2
4
硝基咪唑类化合物
-吗啉硝唑
产品名称 英文名
别名 化学名
吗啉硝唑 Morinidazole 迈灵达 1-[3-(4-吗啉基)-2-羟丙基]-2-甲基-5-硝基-1H-咪唑
C6H9N3O3
福米硝唑; forminitrazole C4H3N3O3S
米索硝唑; misonidazole
C7H11N3O4
异丙硝唑; ipronidazole
C7H11N3O2 12
硝基咪唑类化合物
序号 10 11 12 13 14 15 16 17 18 19
20
2020/3/2
分子结构
6258080714419115吗啉硝唑产品名称吗啉硝唑英文名morinidazole别名化学名134吗啉基2羟丙基2甲基5硝基1h咪唑分子结构分子式分子量27029casn092478278奥硝唑相关化合物奥硝唑相关化合物左奥磷酸酯氨基酸盐序号分子结构cas登录号产品名称分子式13752335帕硝唑
C4H5N3O2 127.10
硝基咪唑类化合物
序号 21 22 25 26 27 29 30 31 32
分子结构
CAS 登录号 69198-10-3 22994-85-0
443-48-1 3366-95-8 1077-93-6 13182-89-3 19387-91-8 55981-09-4 7681-76-7
产品名称
分子式
结构式
分子式 分子量 CAS。NO.
C7H11N3O4 201.18
C7H11N3O4 201.18
62580-80-7
C7H10ClN3O3 219.626
14419-11-5
2020/3/2
4
硝基咪唑类化合物
-吗啉硝唑
产品名称 英文名
别名 化学名
吗啉硝唑 Morinidazole 迈灵达 1-[3-(4-吗啉基)-2-羟丙基]-2-甲基-5-硝基-1H-咪唑
C6H9N3O3
福米硝唑; forminitrazole C4H3N3O3S
米索硝唑; misonidazole
C7H11N3O4
异丙硝唑; ipronidazole
C7H11N3O2 12
硝基咪唑类化合物
序号 10 11 12 13 14 15 16 17 18 19
20
2020/3/2
分子结构
6258080714419115吗啉硝唑产品名称吗啉硝唑英文名morinidazole别名化学名134吗啉基2羟丙基2甲基5硝基1h咪唑分子结构分子式分子量27029casn092478278奥硝唑相关化合物奥硝唑相关化合物左奥磷酸酯氨基酸盐序号分子结构cas登录号产品名称分子式13752335帕硝唑
C4H5N3O2 127.10
有机化学 第十二章 含氮化合物
胺的化学性质(P374)
结 构 分 析
2014-12-28
18
1、 胺的碱性和成盐反应
1) 胺的碱性
胺的水溶液和氨一样发生解离反应而呈碱性:
Kb值愈大或pKb值愈小则碱性愈强;反之愈弱。
2014-12-28 19
一些胺的pKb值
2014-12-28
20
①
脂肪胺的碱性大于芳香胺
脂肪胺 氨
芳香胺
2014-12-28
6
12. 2. 1 胺的分类、命名和结构(P370)
1 、 胺的分类:
① RNH2:伯胺; R2NH:仲胺; R3N:叔胺 ② RNH2--脂肪胺; ArNH2 --芳香胺 ③ RNH2:一元胺; H2NRNH2:二元胺;多元胺
*注意: 伯、仲、叔胺与伯、仲、叔醇的不同涵义 叔碳
Hofmann 消除的取向
2014-12-28
33
比较:卤代烷的消除取向—Saytzeff 取向 (决定于产物的稳定性)
H H3C CH2 CH ' CH X
H CH2 NaOC2H5 H3C CH2 CH CH
H CH2
主要
主要产物为双键上取代基最多的烯烃。
2014-12-28 34
Hofmann消除取向的解释 (决定于反应物的结构) 从β-氢的位阻和酸性的差别分析
1 含氮化合物的还原 2 酰胺的降解制备 3 氨或胺的烃基化
2014-12-28
50
1、 含氮化合物的还原
(1)硝基化合物的还原
还原剂:H2-Ni(orPt)、Fe(orSn)+HCl、(NH4)2S……
NO2 + 3H 2 NO2
Fe+HCl Ni 常温常压
有机化学-硝基化合物和胺

R1 手性中心
N
R4
R2
R3
无法翻转,有旋光性
2. 胺的物理性质 低级胺为气体或易挥发性液体; 高级胺为固体; 芳香胺为高沸点的液体或低熔点的固体; 胺具有特殊的气味; 胺能与水形成氢键; 一级胺和二级胺本身分子间也能形成氢键。
三. 胺的化学反应
1. 结构
N
N
H
H
H
(1) 氨和胺中的N是不等性的 sp3杂化,未共用电子 对占据一个sp3杂化轨道。
胺有碱性,遇酸能形成盐:
RNH2 + CH3COOH
CH3COO- +NH3R
H NH2 + R X
SN2 RNH2 + HX
3. 烃基化
R+NH3X- OH- RNH2 + H2O + X-
NH3 RNH2 ++NH4X-
RX + NH3 RX OH- RNH2 RX OH- R2NH RX OHR3N RX R+4NX-
SO2NR Na+ SO2NR2
+ NaCl
R3N + CH3
-OH
SO2OH
CH3
RI SO2N+R3I-
R3N + CH3
SO2Cl NaOH-H2O
R3N +CH3
-OH H+ +
R3NH
SO2O- Na+
磺酰氯与胺的反应与酰氯相似:
由低级伯胺生成的N-烃基对甲苯磺酰胺能溶于氢氧化钠
水溶液中:
(2) 随着N上连接基团的不同,键角大小会有改变。
(3)当氮与三个不同基团相连时,有一对对映体。
硝基化合物
连有羰基和硝基时,只还原硝基。
NO2
SnCl2 + HCl
NH2 C HO C HO
还原结果无规 律,由实验事 实确定。
多硝基化合物在钠或铵的硫化物、硫氢化物等还原剂
作用下,可进行选择性(或部分)还原。如:
NO2 NO2
NaHS,CH3OH △
NH2 NO2
OH O2N NO2
C H3 NO2 NO2 还原对位
O
N =
δ
O Cl
O N
δ
=
O
Cl
显然,Cl原子的邻、对位上的-NO2数目↑,其亲核取代
反应活性↑。
Cl NO2
Na2CO3 130℃
OH NO2
Cl NO2 NO2
10% Na2CO3 △ , 煮沸
OH NO2 NO2
Cl O 2N NO2 NO2
H2O 沸腾
OH O2N NO2 NO2
3. 对甲基的影响 我们知道含活泼氢的化合物可以与苯甲醛缩合。显然,
NH4SH △
OH NO2 Na2S,CH3OH
△
O2N NO2
C H3 NO2 NH2
NH2
NH2 NO2 NO2 还原邻位
NH4SH △
NH2 NH2 NO2
三、 硝基对苯环的影响 硝基是强吸电子基,当其与苯环直接相连时,不仅使 芳环上的亲电取代反应活性↓,以致不能进行(如:F-C反
应),而且通过-I、-C效应,对其邻、对位的取代基产生
=
O O
R C H=N 假酸式
OH O
NaOH
R C H=N
+ O Na
O
+
H2O
有机化学
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一般难得到
➢ 硝基的碱性还原过程
Ar N O H2N Ar
-H2O Ar N OH
HN Ar [2H]
Ar N N Ar 偶氮苯衍生物
Ar NH NH Ar 氢化偶氮苯衍生物
2. 氢化偶氮苯类化合物的重排反应
H+
NH NH
NH2
NH2
联苯胺
环上有取代基时的重排
R H+
NH NH
R
H2N R
R NH2
NH3 100oC
NH2 NO2
其它底物的类似取代反应
X + Nu
Nu +X
W
W
W: 吸电子基
各类吸电子基对反应速率的促进作用比较:
W: N2 > NR3 > NO > NO2 > CF3
O
> CR > CN > COOH
例:
NC
Cl
F Cl
Cl
N H
DMSO,
NaOR
Cl
NC
N
F
H
Cl
Cl
第十二章 含氮化合物
exit
第一节 硝基化合物 (Nitro Compounds)
一. 硝基化合物的分类、结构和命名
•硝基化合物可看成烃分子中的氢原子被硝基取代后的 衍生物。
(1)一硝基化合物和多硝基化合物 (2)伯、仲、叔硝基化合物(1°,2°,3°硝基化合物)
• 命名——硝基作为取代基:
对应的是几级碳
• 在中性(Zn/NH4Cl)条件下还原,很容易停留在 N-羟基苯胺 Na3AsO3
Fe + NaOH
Fe
H2O2
Zn + NaOH
Zn + NaOH
NaOBr
➢ 硝基的酸性还原过程(经过多个中间产物)
[2H] Ar NO2
[2H] Ar NO
亚硝化合物
[2H] Ar NHOH
羟基芳胺
Ar NH2 芳胺
R
➢ 有多取代产物,分离有难度 ➢ 2o 或 3o R-X 可能有消除产物
腈、酰胺、肟、腙的还原
H2, Raney Ni
R CN
NH3 LiAlH4
R CH2NH2 (第11章)
O R C NH2
LiAlH4
H2O
RCH2NH2 (第11章)
R C N OH
R' 肟
R C N NH2
R' 腙
Hห้องสมุดไป่ตู้ / Ni 或 LiAH4
➢ 合成路线
O C6H13
N
H
O CH3
SN2
NH2NH2
O NK O
H2N
C6H13 H
CH3
C6H13 H OH
CH3
TsCl
吡啶
C6H13 H OTs
CH3
CH3COONa
DMF 或 DMSO SN2 O
CH3COO
C6H13 H
CH3
OH
酯水解
C6H13
HO
H
CH3
TsCl
吡啶
(1)
NK
O SN2
RX
R' NH2 碱
R NH R'
此方法在合成上的 主要问题是什么?
+ HX (碱吸收)
醛酮的还原胺化(亚胺的还原)
R C
R'
NH2 R" O
H+
R
H2 / Ni
C N R"
R CH NH R"
R'
R'
N-取代酰胺的还原
O R C NHR'
(1) LiAlH4 (2) H2O
RCH2NHR'
3. 脂肪族叔胺的制备
硝基化合物的结构: (1)电子结构式:
或
• 两个氮氧键长均为0.121nm
(2) 硝基的结构 • 硝基的共振结构式
二. 硝基化合物的制备 (1) 脂肪族硝基化合物的制备:烷烃和硝酸——硝化反应(得混合物作溶剂)
• 主要产物为一硝基化合物;
同时发生碳键的断裂而生成 低级硝基化合物。
实验室制备:
CH3(CH2)5CHCH3 + NaNO2
(2) 脂肪族硝基化合物的还原 R-NO2 H2/ Pt or Ni R-NH2
3. 苯环上的亲电取代反应 • 硝基是间位定位基,它使苯环钝化:
• 由于硝基的钝化影响,硝基苯不能发生傅-克反应。
4. 芳环上的亲核取代反应I 加成-消除机理
➢一般条件下芳环上的亲核取代较难发生
例:
Cl NaOH
OH H+
注意取代基在重排前后的位置
➢ 氢化偶氮苯类化合物的重排机理(分子内重排)
2H+ NH NH
NH2 NH2
NH2
NH
NH2
NH
H
H2N H
NH2
2H+ H2N
NH2
•芳香族多硝基化合物 用碱金属的硫化物或多硫化物,硫氢化铵、硫化铵或多硫化铵 为还原剂,可以选择性还原其中的一个硝基成为氨基:
选择性还原其中 的一个硝基成为 氨基.
O
C
Ar
NH2
X2 / NaOH
Ar NH2 + CO2
制备芳香伯胺
例:
O NH3
O O
Cl2 / NaOH
O NaOH
NH
O O
ONa H+
NH2
O ONa NH2
O O
OH
NH2
Curtius反应和Schmidt反应——Hofmann降解的扩展
O NaN3
R C Cl
Curtius 反应
O HN3
(2) NH2NH2
C6H13
H
NH2
CH3
酰胺的 Hofmann 降解( Hofmann重排)(新内容)
O Br2 / NaOH
R C NH2
R NH2 + CO2
Hofmann 降解
➢Hofmann 降解机理
比原料少一个碳
O R C NH
H OH
O R C NH
Br Br
O R C N Br
仲胺的烷基化
RX
"R NH R' 碱
R' RN
R"
+ HX (碱吸收)
"R NH R'
n-BuLi
"R
N Li R'
RX 醚
R' RN
R"
胺的取代基 位阻较小, 产率较高。
通过烯胺的还原
RCH2
HNR"2 RCH
H2
RCH2
CO (H)R'
N OO
消除 -X 快
N OO
Meisenheimer络合物
OH NaOH
ONa
NO2
NO2
硝基芳香卤代烃的亲核取代举例
OCH3 NO2
NO2
NaOCH3
Cl NO2
NaSH
NHNH2 NO2
NO2
NO2 NH2NH2
NH2CH3
SH NO2
NO2
NHCH3 NO2
NO2
Cl + CH3ONa
多,取代更
H+ O2N
NO2 加容易
NO2
NO2
取代反应的机理 —— 加成-消除机理
X
X OH
OH 加成
X OH
X OH
NO2
慢
N
OO
实验证据:
i. 动力学证据:双分子反应 ii. NO2在间位时反应难发生 iii. X 为 Cl, Br, I 时反应的速率接近 iv. X = F 时反应速率较快 v. 邻对位硝基增加,反应更加容易
高温,高压
为什么?
SN2过程
Cl
OH
无法翻转
SN1过程
Cl
+ Cl
C(sp2)-Cl不易断裂
含硝基芳香卤代物的亲核取代
X NaOH 135~160oC
NO2
X NO2 Na2CO3
NO2
100oC
X
O2N
NO2
H2O
OH H+
NO2
➢邻或对位
OH
硝基可促进
H+
NO2 取代进行
NO2
➢硝基数目
OH
• 叔硝基化合物没有这种氢原子,因此不能异构成酸式,也就
不能与碱作用.
2. 硝基的还原
Fe / HCl or
Zn / HCl or
NH2
Sn (SnCl2) /HCl
NO2
酸性还原
R
(单分子还原)
R
Zn / NaOH
R
碱性还原
NH NH
氢化偶氮苯
R
(双分子还原)
➢ 合成上的应用 —— 制备芳香族胺类化合物 (向芳环上引入氨基)
OH
PKa: 9.89
OH
NO2
7.15
OH
O2N
NO2
NO2
0.38
H2CO3 6.37
第二节 胺(Amine)
一. 胺类化合物的类型、命名、结构
类型
R NH2
R NH R'
R" R N R'
伯胺 (一级胺)
仲胺 (二级胺)
叔胺 (三级胺)
R3
R1 N R4 X R2
季铵盐 (四级铵盐)
R = 烷基: 脂肪胺 芳基: 芳香胺
