核磁共振氢谱总结
核磁共振氢谱(1H-NMR)

>C=O, >C=C<的屏蔽作用与苯环类似。在其平面的上、下方各有一个锥形屏蔽区(“+”),其它区域为去屏蔽区。
(3)三键
互相垂直的两个π键轨道电子绕σ键产生环电流,在外加磁场作用下产生与三键平行但方向与外加磁场相反的感应磁场。三键的两端位于屏蔽区(“+”),上、下方为去锥形屏蔽区(“-”)δ值比烯氢小。
δ3=5.25-0.35=4.90
δ4=5.25+2.11=7.36
e芳环氢
δHi=7.26+ΣZi
1溶剂影响:
低极性溶剂,CDCL3,CCL4,δoHi =7.26
高极性溶剂, DMSOδoHi =7.41
2.取代基在邻间对位作用不同
f.芳杂环
环上的氢的化学位移与其相对于杂原子的位置有关
g.醛基氢:9-12ppm
(1).自旋-自旋耦合引起谱峰分裂,裂距大小反映了耦合作用的强弱,即核磁矩之间相互作用能的大小,称为耦合常数(coupling constant) J(单位Hz)
有耦合作用的两核,取向相同时能量较高, J<0
取向相反时能量较低, J>0
(2)偶合常数J与分子特定的结构有关,即与两个核在分子中相隔化学键的数目、键的性质、偶合核的二面角有关。
由于吸收峰都集中在狭窄的范围内,故对一些较为复杂的化合物要准确地分析其吸收峰是有困难的。
烯烃
δ= 5.28+σgem+σcis+σtrans
Jgem=0-3Hz
Jcis=8-12Hz
Jtrans=12-18Hz
苯
δHi=7.26+ΣZi
J邻位7-8.5Hz
J间位2-3Hz
J对位0-1Hz
核磁共振氢谱小结

目录核磁共振氢谱 (2)1氢的化学位移 (2)1.1化学位移 (2)1.2屏蔽效应 (2)1.3影响化学位移的因素 (3)1.3.1诱导效应 (3)1.3.2共轭效应 (4)1.3.3各向异性效应 (5)1.3.4Van der Waals效应 (5)1.3.5氢键与溶剂效应 (5)2自旋偶合和自旋裂分 (6)2.1 n + 1规律 (6)2.2 偶合常数 (7)2.2.3远程偶合 (7)2.2.4质子与其他核的偶合 (8)3自旋系统 (8)3.1化学等价 (8)3.2磁等价 (9)3.4自旋系统的命名 (10)3.5自旋系统的分类 (10)3.5.1二旋系统 (11)3.5.2三旋系统 (11)3.5.3四旋系统 (14)4简化1H-NMR谱的实验方法 (16)5图谱的分类 (17)6常用化学位移标准物 (18)7应用 (19)核磁共振氢谱1氢的化学位移原子核由于所处的化学环境不同,而在不同的共振磁场下显示吸收峰的现象。
1.1化学位移的表示:单位ppm低场(高频)←→高场(低频)1.2屏蔽效应(化学位移的根源)磁场中所有自旋核产生感应磁场,方向与外加磁场相反或相同,使原子核的实受磁场降低或升高,即屏蔽效应。
标准:四甲基硅(TMS ),δ=0,(如以τ表示,τ=10,τ=10+δ)屏蔽常数和化学位移1.3影响化学位移的因素诱导效应共轭效应各向异性效应V an der Waals效应氢键效应和溶剂效应1.3.1诱导效应氢原子核外成键电子的电子云密度产生的屏蔽效应。
拉电子基团:去屏蔽效应,化学位移左移,即增大推电子基团:屏蔽效应,化学位移右移,即减小由于邻对位氧原子的存在,右图中双氢黄酮的芳环氢ab的化学位移为6.15ppm通常芳环氢化学位移大于7ppm。
1.3.2共轭效应1.3.3各向异性效应芳环叁键羰基双键单键在分子中处于某一化学键的不同空间位臵上的核受到不同的屏蔽作用,这种现象称为各向异性效应,这是因为由电子构成的化学键在外磁场的作用下,产生一个各向异性的附加磁场,使得某些位和 键碳原子相连的H,其所受屏蔽作用小于烷基碳原子相连的H原子。
核磁共振波谱法之氢谱解析

1.6 a峰的氢数 3H 1.6 1.0 0.5 0.6 1.0 b峰的氢数 2H 1.6 1.0 0.5 0.6
同理计算c峰和d峰各相当于1H。
依已知含氢数目的峰的积分值为准,求出一个氢相当的 积分值,而后求出氢分布。 本题中δd10.70很容易认定为羧基氢的共振峰,因而 0.60cm相当于1个氢,因此:
a b O c CH2CH2 O C CH3
3 2
化合物 C10H12O2
2 5
8
7
6
5
4
3
2
1
0
例1 计算下图中a、b、c、d各峰的氢核数目。
C4H7BrO2的核磁共振氢谱
测量各峰的积分高度,a为1.6cm,b为1.0cm,c为0.5cm,d 为0.6cm。氢分布可采用下面两种方法求出。 (1)由每个(或每组)峰面积的积分值在总积分之中所占 的比例求出:
②氢分布:
③ a 2.42 单峰 3H CH 3 CO 而不是与氧相连(CH3-O-的δ 为3.5~3.8)
d 7.35 单峰 5H 单取代苯,与烃基直接 相连
④由分子式中扣除CH3-CO-及C6H5-,余C2H2Br2而c、d皆 为二重峰,而化学位移δb4.91、 δc5.33,说明存在着-CHBrCHBr-基团。 ⑤结构式: 综上所述,未知物结构式为:
第五节
核磁共振氢谱的解析
要求:
1、掌握核磁共振氢谱中峰面积与氢核数目的 关系; 2、掌握核磁共振氢谱的解析步骤; 3、熟悉并会解析一些简单的核磁共振氢谱。
一、谱图中化合物的结构信息 1、核磁共振氢谱提供的信息:由化学位移、偶合常数 及峰面积积分曲线分别提供含氢官能团、核间关系及氢 分布等三方面的信息。具体如下: (1)峰的数目:标志分子中磁不等价质子的种类,多少种;
常见的核磁共振氢谱(化学位移)

常见的核磁共振氢谱(化学位移)1. 烷烃 (Alkanes)烷烃中的氢原子通常出现在0.81.3 ppm 的区域。
具体位置取决于烷烃的分支程度和相邻基团的影响。
例如,甲基(CH3)通常在0.9 ppm 左右,而乙基(CH2)则在1.21.4 ppm。
2. 烯烃 (Alkenes)烯烃中的氢原子由于双键的存在,其化学位移通常在 5.06.5 ppm。
双键的位置和相邻基团也会影响具体的化学位移值。
例如,乙烯基(CH=CH2)的氢原子通常在5.05.5 ppm。
3. 芳香烃 (Arenes)芳香烃中的氢原子由于芳香环的存在,其化学位移通常在7.08.5 ppm。
苯环上的氢原子根据其取代基的位置和类型,化学位移会有所不同。
例如,苯环上的甲基(CH3)通常在2.2 ppm 左右,而苯环上的氢原子则在7.27.6 ppm。
4. 醇 (Alcohols)醇中的氢原子由于羟基(OH)的存在,其化学位移通常在1.05.0 ppm。
具体位置取决于羟基与相邻基团的影响。
例如,伯醇(CH2OH)的氢原子通常在3.54.5 ppm,而仲醇(CHOH)则在4.04.5 ppm。
5. 醚 (Ethers)醚中的氢原子由于氧原子的影响,其化学位移通常在 3.04.5 ppm。
具体位置取决于醚键与相邻基团的影响。
例如,甲基醚(OCH3)的氢原子通常在3.23.5 ppm,而乙基醚(OCH2CH3)则在3.54.0 ppm。
6. 酮 (Ketones)ppm。
具体位置取决于羰基与相邻基团的影响。
例如,甲基酮(COCH3)的氢原子通常在2.02.2 ppm,而乙基酮(COCH2CH3)则在2.22.5 ppm。
7. 醛 (Aldehydes)醛中的氢原子由于羰基(C=O)的存在,其化学位移通常在9.010.0 ppm。
具体位置取决于羰基与相邻基团的影响。
例如,甲醛(CHO)的氢原子通常在9.510.0 ppm,而乙醛(CH2CHO)则在9.510.0 ppm。
第五章核磁共振氢谱

C O
CH2
O
C OH
两个羧基缔合状态不同
1)分子中原子核相对静止时: 用对称操作判断化学等价性
X
i)
Ha
C
例: CH2Cl2
X
Hb
两取代基完全相同, Ha 和Hb有C2对称轴和对称平面,这两个氢 称为等位氢(homotopic), (“同偏”氢), 具有相同化学位移, 又 称等频氢(isochronous), 无论在任何环境都是化学等价的.
J : 相邻两峰之间的距离.
3) 一级谱图的规律:
a. 磁等价的质子之间,有偶合,但不发生裂分,如果没 有其他质子的偶合应出单峰。
b. 磁不等价的质子之间的偶合,发生裂分,峰数目符合 n+1规律。
c. 各组质子多重峰中心为质子的化学位移,峰形左右对 称,还有“倾斜效应”。
d. 偶合常数可以从图上直接读出。 e. 各组质子多重峰的强度比为二项式展开式的系数比。 f. 不同类型质子积分面积之比等于质子的个数比。 g. 如果不同邻近基团的核与所研究的核之间有相同的偶
1.化学等价(Chemical equivalence): 若分子中两相同原子(或两相同基团)处于相同化
学环境时,它们是化学等价的.
化学不等价: (1) 在化学反应中反应速度不同; (2) 波谱特征不同.
例如: 柠檬酸
OH HO2C CH2 C CH2 CO2H
CO2H
HO C
O
H2
C
O
C
H O
H
2) 分子内存在着快速运动: 常见分子内运动: 链旋转, 环的翻转(reversal)等. i) 链旋转: RCH2-CXYZ
ii) 环的翻转: 环己烷翻转时, 直立氢和平伏氢交互变化, 二者等频,一个信号.
核磁共振氢谱总结

第3章核磁共振氢谱核磁共振(nuclear magnetic resonance, NMR)是近十几年来发展起来的新技术,它与元素分析、组外光谱、红外光谱、质谱等方法配合,已成为化合物结构测定的有力工具。
目前核磁共振已经深入到化学学科的各个领域,广泛应用越有机化学、生物化学、药物化学、罗和化学、无机化学、高分子化学、环境化学食品化学及与化学相关的各个学科,并对这些学科的发展起着极大的推动作用。
核磁共振测定过程中不破坏样品,仪分样品可测多种数据;不但可以测定纯物质,也可以测定彼此型号不重叠的混合物样品;不但可以测定有机物,现在许多无机物的分子结构也能用核磁共振技术进行测定。
3.1 核磁共振的基本原理3.1.1 原子核的磁矩原子核是带正电的粒子,若其进行自旋运动将能产生磁极矩,但并不是所有的原子核都能产生自旋,只有那些中子数和质子数均为奇数,或中子数和质子数之一为奇数的原子核才能产生自旋。
如1H、13C、15N、19F、31P……、119Sn等。
这些能够自旋的原子核进行自旋运动时能产生磁极矩,原子核的自旋运动与自旋量子数I相关,I=0的原子核没有自旋运动。
只有I≠0的原子核有自旋运动。
原子核由中子和质子所组成,因此有相应的质量数和电荷数。
很多种同位素的原子核都具有磁矩,这样的原子核可称为磁性核,是核磁共振的研究对象。
原子核的磁矩取决于原子核的自旋角动量P,其大小为:式中:I为原子核的自旋量子数。
h为普朗克常数。
原子核可按I的数值分为以下三类:(1)中子数、质子数均为偶数,则I=0,如12C、16O、32S等。
此类原子核不能用核磁共振法进行测定。
(2)中子数与质子数其一为偶数,另一为奇数,则I为半整数,如I=1/2:1H、13C、15N、19F、31P、37Se等;I=3/2:7Li、9Be、11B、33S、35Cl、37Cl等;I=5/2:17O、25Mg、27Al、55Mn等;以及I=7/2、9/2等。
核磁共振氢谱 (PMR或1HNMR)

核磁共振氢谱(PMR或1HNMR)核磁共振技术是20世纪50年代中期开始应用于有机化学领域,并不断发展成为有机物结构分析的最有用的工具之一。
它可以解决有机领域中的以下问题:(1)结构测定或确定,一定条件下可测定构型和构象;(2)化合物的纯度检查;(3)混合物分析,主要信号不重叠时,可测定混合物中各组分的比例;(4)质子交换、单键旋转、环的转化等化学变化速度的测定及动力学研究。
NMR的优点是:能分析物质分子的空间构型;测定时不破坏样品;信息精密准确。
NMR通常与IR并用,与MS、UV及化学分析方法等配合解决有机物的结构问题,还广泛应用于生化、医学、石油、物理化学等方面的分析鉴定及对微观结构的研究。
一、基本概念核磁共振(简称为NMR)是指处于外磁场中的物质原子核系统受到相应频率(兆赫数量级的射频)的电磁波作用时,在其磁能级之间发生的共振跃迁现象。
检测电磁波被吸收的情况就可以得到核磁共振波谱。
因此,就本质而言,核磁共振波谱是物质与电磁波相互作用而产生的,属于吸收光谱(波谱)范畴。
根据核磁共振波谱图上共振峰的位置、强度和精细结构可以研究分子结构。
发展历史1.1946 年美国斯坦福大学的F. Bloch 和哈佛大学E.M .Purcell领导的两个研究组首次独立观察到核磁共振信号,由于该重要的科学发现,他们两人共同荣获1952 年诺贝尔物理奖。
NMR发展最初阶段的应用局限于物理学领域,主要用于测定原子核的磁矩等物理常数。
2.1950 年前后W .G. Proctor等发现处在不同化学环境的同种原子核有不同的共振频率,即化学位移。
接着又发现因相邻自旋核而引起的多重谱线,即自旋—自旋耦合,这一切开拓了NMR 在化学领域中的应用和发展。
3.20 世纪60 年代,计算机技术的发展使脉冲傅里叶变换核磁共振方法和谱仪得以实现和推广,引起了该领域的革命性进步。
随着NMR 和计算机的理论与技术不断发展并日趋成熟,NMR 无论在广度和深度方面均出现了新的飞跃性进展,具体表现在以下几方面:1)仪器向更高的磁场发展,以获得更高的灵敏度和分辨率,现己有300、400、500、600MHz,甚至1000MHz 的超导NMR 谱仪;2)利用各种新的脉冲系列,发展了NMR 的理论和技术,在应用方面作了重要的开拓;3)提出并实现了二维核磁共振谱以及三维和多维核磁谱、多量子跃迁等NMR 测定新技术,在归属复杂分子的谱线方面非常有用。
氢谱解析知识点总结

氢谱解析知识点总结一、氢谱解析的原理氢谱解析是利用核磁共振(NMR)技术对物质中氢原子进行分析的一种方法。
其原理基于氢原子核在外加磁场下发生的磁共振现象,通过测量氢原子核的共振频率和强度,可以得到有关样品组成和结构的信息。
在氢谱解析中,采用的主要是质子核磁共振(1H-NMR)技术,即利用氢原子核的磁共振进行分析。
1.1 原子核的磁矩氢原子核由一个质子组成,其核自旋为1/2,因此具有磁矩。
在外加磁场下,氢原子核会产生磁偶极矩,这导致核在磁场中存在能级分裂现象,从而引起共振现象。
1.2 核磁共振现象当氢原子核处于外部磁场中时,其核磁矩会与外部磁场发生相互作用,导致核的能量发生分裂,分裂的能级差与外部磁场的强度成正比。
当外部磁场的强度等于核的共振频率时,会发生共振吸收,此时氢原子核会发生能级跃迁,产生共振信号。
通过测量共振频率,可以得到氢原子核的化学环境和结构信息。
1.3 化学位移在氢谱解析中,样品中的不同氢原子会由于其化学环境不同而呈现出不同的共振频率。
这是因为,氢原子的共振频率与其周围的化学环境有关,如化学键的种类和数目、邻近的官能团等。
这种现象称为化学位移,通过化学位移可以对不同氢原子进行识别和定量分析。
1.4 耦合效应在一些情况下,样品中的氢原子之间会发生相互耦合,使得它们的共振频率发生变化。
这种现象称为耦合效应,通过耦合效应可以得到关于氢原子之间的相互作用和化学键的信息,进一步帮助解析样品的结构和成分。
以上是氢谱解析的基本原理,了解这些知识点有助于加深对氢谱解析技术的理解,为后续的仪器分析和谱图解析打下基础。
二、氢谱解析的仪器分析氢谱解析的仪器主要是核磁共振谱仪,利用核磁共振谱仪可以对样品进行快速准确的分析。
核磁共振谱仪通常由磁体、射频系统、梯度磁场和检测器等部分组成,其工作原理是利用外部静态磁场和射频辐射来引起样品中核的共振现象。
2.1 磁体核磁共振谱仪中的磁体是用来产生外部静态磁场的装置,常见的磁体有永磁体和超导磁体。
核磁共振氢谱的解析
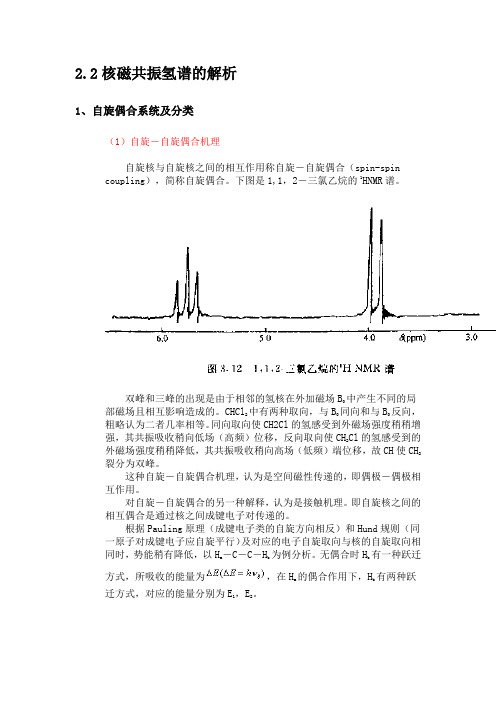
2.2核磁共振氢谱的解析1、自旋偶合系统及分类(1)自旋-自旋偶合机理自旋核与自旋核之间的相互作用称自旋-自旋偶合(spin-spin coupling),简称自旋偶合。
下图是1,1,2-三氯乙烷的1HNMR谱。
双峰和三峰的出现是由于相邻的氢核在外加磁场B中产生不同的局部磁场且相互影响造成的。
CHCl2中有两种取向,与B同向和与B反向,粗略认为二者几率相等。
同向取向使CH2Cl的氢感受到外磁场强度稍稍增强,其共振吸收稍向低场(高频)位移,反向取向使CH2Cl的氢感受到的外磁场强度稍稍降低,其共振吸收稍向高场(低频)端位移,故CH使CH2裂分为双峰。
这种自旋-自旋偶合机理,认为是空间磁性传递的,即偶极-偶极相互作用。
对自旋-自旋偶合的另一种解释,认为是接触机理。
即自旋核之间的相互偶合是通过核之间成键电子对传递的。
根据Pauling原理(成键电子类的自旋方向相反)和Hund规则(同一原子对成键电子应自旋平行)及对应的电子自旋取向与核的自旋取向相同时,势能稍有降低,以Ha -C-C-Hb为例分析。
无偶合时Hb有一种跃迁方式,所吸收的能量为,在Ha 的偶合作用下,Hb有两种跃迁方式,对应的能量分别为E1,E2。
在Hb 的偶合作用下,Ha也被裂分为双峰,分别出现在处,峰间距等于Jab,J为偶合常数。
所以自旋-自旋偶合是相互的,偶合的结果产生谱线增多,即自旋裂分。
偶合常数(J)是推导结构的又一重要参数。
在1HNMR谱中,化学位移(δ)提供不同化学环境的氢。
积分高度(h)代表峰面积,其简化为各组数目之比。
裂分峰的数目和J值可判断相互偶合的氢核数目及基团的连接方式。
(2)n+1规律某组环境完全相等的n个核(I=1/2),在B中共有(n+1)种取向,使与其发生偶合的核裂分为(n+1)条峰。
这就是(n+1)规律,概括如下:某组环境相同的氢若与n个环境相同的氢发生偶合,则被裂分为(n +1)条峰。
某组环境相同的氢,若分别与n个和m个环境不同的氢发生偶合,且J值不等,则被裂分为(n+1)(m+1)条峰。
核磁共振氢谱的解析要点

2.2核磁共振氢谱的解析1、自旋偶合系统及分类(1)自旋-自旋偶合机理自旋核与自旋核之间的相互作用称自旋-自旋偶合(spin-spin coupling),简称自旋偶合。
下图是1,1,2-三氯乙烷的1HNMR谱。
双峰和三峰的出现是由于相邻的氢核在外加磁场B中产生不同的局部磁场且相互影响造成的。
CHCl2中有两种取向,与B同向和与B反向,粗略认为二者几率相等。
同向取向使CH2Cl的氢感受到外磁场强度稍稍增强,其共振吸收稍向低场(高频)位移,反向取向使CH2Cl的氢感受到的外磁场强度稍稍降低,其共振吸收稍向高场(低频)端位移,故CH使CH2裂分为双峰。
这种自旋-自旋偶合机理,认为是空间磁性传递的,即偶极-偶极相互作用。
对自旋-自旋偶合的另一种解释,认为是接触机理。
即自旋核之间的相互偶合是通过核之间成键电子对传递的。
根据Pauling原理(成键电子类的自旋方向相反)和Hund规则(同一原子对成键电子应自旋平行)及对应的电子自旋取向与核的自旋取向相同时,势能稍有降低,以Ha -C-C-Hb为例分析。
无偶合时Hb有一种跃迁方式,所吸收的能量为,在Ha 的偶合作用下,Hb有两种跃迁方式,对应的能量分别为E1,E2。
在Hb 的偶合作用下,Ha也被裂分为双峰,分别出现在处,峰间距等于Jab,J为偶合常数。
所以自旋-自旋偶合是相互的,偶合的结果产生谱线增多,即自旋裂分。
偶合常数(J)是推导结构的又一重要参数。
在1HNMR谱中,化学位移(δ)提供不同化学环境的氢。
积分高度(h)代表峰面积,其简化为各组数目之比。
裂分峰的数目和J值可判断相互偶合的氢核数目及基团的连接方式。
(2)n+1规律某组环境完全相等的n个核(I=1/2),在B中共有(n+1)种取向,使与其发生偶合的核裂分为(n+1)条峰。
这就是(n+1)规律,概括如下:某组环境相同的氢若与n个环境相同的氢发生偶合,则被裂分为(n +1)条峰。
某组环境相同的氢,若分别与n个和m个环境不同的氢发生偶合,且J值不等,则被裂分为(n+1)(m+1)条峰。
核磁共振氢谱总结

核磁共振氢谱总结核磁共振氢谱(Nuclear Magnetic Resonance Hydrogen Spectrum),简称NMR谱,是一种重要的分析手段,被广泛应用于化学、生物医学等领域。
本文将对核磁共振氢谱进行总结,包括核磁共振的原理、仪器设备、谱图解析以及应用。
1. 核磁共振原理核磁共振(Nuclear Magnetic Resonance,NMR)是基于原子核自旋的一种物理现象。
它利用样品中核自旋与外加磁场共振吸收和发射特定频率的电磁辐射。
其原理可概括为以下三个方面:•自旋量子数:核自旋量子数是核磁共振的重要参数之一,不同元素的核自旋量子数不同,常见的氢核自旋量子数为1/2。
这是核磁共振谱中信号出现为两个峰的原因之一。
•外加磁场:在样品中加入外加磁场,使样品中的核自旋分裂成能级,这些能级间的能量差正比于外加磁场的强度。
不同核的共振频率与外加磁场强度成正比。
•辐射频率:辐射频率与核自旋、外加磁场强度以及样品中的化学环境有关。
在核磁共振谱中,吸收峰对应于各个核的共振频率。
2. 核磁共振仪器设备核磁共振实验需要特定的仪器设备来实现信号的获取和处理,主要包括以下几个方面:2.1 磁体磁体是核磁共振仪器的核心部件之一,它用于提供强大且稳定的磁场。
常见的核磁共振磁体为超导磁体,通过电流通路在低温下形成超导状态,产生极强的磁场。
2.2 辅助设备核磁共振仪器还需要一些辅助设备来实现信号的接收和处理,例如:放大器、探头、数字化转换器、计算机等。
这些设备可以将样品中的核磁共振信号转化为可视化的谱图,方便进行进一步的分析和解读。
3. 谱图解析核磁共振谱图是一种常见的实验数据表达形式,通过解读谱图可以获得样品的结构和化学环境信息。
一般而言,核磁共振谱图包含以下几个重要的参数:3.1 化学位移化学位移是核磁共振谱图中的一个关键参数,用于描述不同核在外加磁场中共振的位置。
化学位移用化学位移比值(δ)表示,一般以标准化合物(如二甲基硅烷)为参照物。
核磁共振氢谱总结

第3章核磁共振氢谱核磁共振(nuclear magnetic resonance, NMR)是近十几年来发展起来的新技术,它与元素分析、组外光谱、红外光谱、质谱等方法配合,已成为化合物结构测定的有力工具。
目前核磁共振已经深入到化学学科的各个领域,广泛应用越有机化学、生物化学、药物化学、罗和化学、无机化学、高分子化学、环境化学食品化学及与化学相关的各个学科,并对这些学科的发展起着极大的推动作用。
核磁共振测定过程中不破坏样品,仪分样品可测多种数据;不但可以测定纯物质,也可以测定彼此型号不重叠的混合物样品;不但可以测定有机物,现在许多无机物的分子结构也能用核磁共振技术进行测定。
核磁共振的基本原理原子核的磁矩原子核是带正电的粒子,若其进行自旋运动将能产生磁极矩,但并不是所有的原子核都能产生自旋,只有那些中子数和质子数均为奇数,或中子数和质子数之一为奇数的原子核才能产生自旋。
如1H、13C、15N、19F、31P……、119Sn等。
这些能够自旋的原子核进行自旋运动时能产生磁极矩,原子核的自旋运动与自旋量子数I相关,I=0的原子核没有自旋运动。
只有I≠0的原子核有自旋运动。
原子核由中子和质子所组成,因此有相应的质量数和电荷数。
很多种同位素的原子核都具有磁矩,这样的原子核可称为磁性核,是核磁共振的研究对象。
原子核的磁矩取决于原子核的自旋角动量P,其大小为:式中:I为原子核的自旋量子数。
h为普朗克常数。
原子核可按I的数值分为以下三类:(1)中子数、质子数均为偶数,则I=0,如12C、16O、32S等。
此类原子核不能用核磁共振法进行测定。
(2)中子数与质子数其一为偶数,另一为奇数,则I为半整数,如I=1/2:1H、13C、15N、19F、31P、37Se等;I=3/2:7Li、9Be、11B、33S、35Cl、37Cl等;I=5/2:17O、25Mg、27Al、55Mn等;以及I=7/2、9/2等。
(3)中子数、质子数均为奇数,则I为整数,如2H(D)、6Li、14N等I=1;58Co,I=2;10B,I=3。
核磁共振氢谱总结

第3章核磁共振氢谱核磁共振(nuclear magnetic resonance, NMR )是近十几年来发展起来的新技术,它与元 素分析、组外光谱、红外光谱、质谱等方法配合,已成为化合物结构测定的有力工具。
目前 核磁共振已经深入到化学学科的各个领域,广泛应用越有机化学、生物化学、药物化学、罗和化学、无机化学、 高分子化学、环境化学食品化学及与化学相关的各个学科,并对这些学 科的发展起着极大的推动作用。
核磁共振测定过程中不破坏样品, 仪分样品可测多种数据; 不但可以测定纯物质, 也可以测定彼此型号不重叠的混合物样品; 不但可以测定有机物,现在许多无机物的分子结构也能用核磁共振技术进行测定。
3.1核磁共振的基本原理3.1.1原子核的磁矩原子核是带正电的粒子,若其进行自旋运动将能产生磁极矩,但并不是所有的原子核都能产生自旋,只有那些中子数和质子数均为奇数,或中子数和质子数之一为奇数的原子核才能产生自旋。
如1H 、13C 、15N 、19F 、31P ……、119Sn 等。
这些能够自旋的原子核进行自旋运 动时能产生磁极矩,原子核的自旋运动与自旋量子数 I 相关,I=0的原子核没有自旋运动。
只有I 和的原子核有自旋运动。
原子核由中子和质子所组成, 具有磁矩,这样的原子核可称为磁性核,核的自旋角动量P ,其大小为:以及 1=7/2、9/2 等。
(3)中子数、质子数均为奇数,则I 为整数,如10B , I=3。
(2)、( 3)类原子核是核磁共振研究的对象。
其中,于原子核表面,这样的原子核不具有四极矩,其核磁共振的谱线窄,最宜于核磁共振检测。
凡I 值非零的原子核即具有自旋角动量P ,也就具有磁矩 卩,□与P 之间的关系为:M = YP丫称为磁旋比,是原子核的重要属性。
因此有相应的质量数和电荷数。
很多种同位素的原子核都 是核磁共振的研究对象。
原子核的磁矩取决于原子_____ hP =弋心 + 1)^— h为普朗克常数。
核磁共振氢谱总结

核磁共振氢谱总结核磁共振(NMR)是一种基于核自旋的物理原理,用于研究物质的结构和性质。
在NMR中,氢谱是应用最广泛且最常见的谱之一,因为氢原子存在于大多数有机化合物和生物分子中。
本文将对氢谱的原理、应用和解读进行详细总结。
一、原理核磁共振氢谱是通过对样品中氢原子进行探测来获取的。
核磁共振现象是由于氢核在磁场中的旋转偏离状态所产生的。
当样品放置在一个恒定的磁场中,大部分氢原子的旋转轴趋于沿着磁场方向,在这种情况下,它们处于低能态。
然而,一小部分氢原子具有不平衡的旋转状态,即它们的旋转轴与磁场方向存在一定的角度差异,这些氢原子处于高能态。
当应用一段特定的射频脉冲后,能量从高能态向低能态转移,这会导致吸收特定频率的能量,产生共振信号。
通过测量吸收特定频率的能量,可以得到有关样品中氢原子的信息。
二、应用1.结构鉴定:核磁共振氢谱可用于确定化合物的结构和组成。
通过分析吸收峰的位置、强度和形状,可以确定分子中氢原子的化学环境。
氢谱也可以提供有关分子的分子量、官能团和键合关系的信息。
2.动力学研究:核磁共振氢谱还可用于研究化学反应的动力学过程。
通过监测吸收峰的变化,可以了解分子在化学反应中的转变和交换。
3.生物医学研究:核磁共振氢谱在分析生物体内代谢产物、药物代谢和疾病诊断方面发挥重要作用。
不同代谢产物和疾病状态下的氢谱特征会有所不同,通过与数据库匹配,可以确定样品中代谢产物的类型和含量。
三、谱图解读1. 化学位移:氢原子的化学环境不同,会导致谱图上出现不同的吸收峰。
化学位移是指吸收峰相对于参照物(通常为三氯甲烷)的偏移量,单位为ppm。
常见的化学位移区域有相应的化学环境,如甲基(0.9-1.3 ppm)、亚甲基(1.3-2.5 ppm)、亚氨基(2.5-4.5 ppm)等。
2.积分峰面积:吸收峰的面积与相应氢原子的数量成正比。
通过积分峰面积可以确定不同化学环境中氢原子的数量比例。
3.耦合常数:当分子中的氢原子处于共价键形成的多重态时,它们之间会通过磁偶极作用产生相互影响,导致谱图上出现多重峰。
核磁共振氢谱解析

原子核的进动
在磁场中,原子核的自旋取向有2I+1个。各个取向由一个自旋量子 数m表示。
磁旋比:1H=26753, 2H=410 7,13C= 6726弧度/秒 高斯
N
2 H0 H0
自旋角速度ω,外磁场H0,进动频率ν
共振条件
原子核在磁场中发生能级分裂,在磁场的垂直方向上加小交变电场, 如频率为v射,当v射等于进动频率ν ,发生共振。低能态原子核吸收 交变电场的能量,跃迁到高能态,称核磁共振。
1H
13C
19F 31P
60.000 MHZ 15.086 MHZ 56.444 MHZ 24.288 MHZ
对于1H 核,不同的频率对应的磁场强度:
射频 40 MHZ 60 100 200 300 500 磁场强度 0.9400 特斯拉 1.4092 2.3500 4.7000 7.1000 11.7500
化学等价
处于相同化学环境的原子 — 化学等价原子
化学等价的质子其化学位移相同,仅出现一组 NMR 信号。
化学不等价的质子在 NMR 谱中出现不同的信号 组。
例1:CH3-O-CH3 例2:CH3-CH2-Br 例3:(CH3)2CHCH(CH3)2 例4:CH3-CH2COO-CH3 一组NMR 信号 二组NMR信号 二组NMR 信号 三组NMR 信号
试比较下面化合物分子中 Ha Hb Hc 值的大小。
CH3 CH3-O-CH2-C-CH3
a b
Cl
c
b>a>c
电负性较大的原子,可减小H原子受到的屏蔽作用,引起 H原子向低场移动。向低场移动的程度正比于原子的电负
性和该原子与H之间的距离。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第3章核磁共振氢谱核磁共振(nuclear magnetic resonance, NMR)是近十几年来发展起来的新技术,它与元素分析、组外光谱、红外光谱、质谱等方法配合,已成为化合物结构测定的有力工具。
目前核磁共振已经深入到化学学科的各个领域,广泛应用越有机化学、生物化学、药物化学、罗和化学、无机化学、高分子化学、环境化学食品化学及与化学相关的各个学科,并对这些学科的发展起着极大的推动作用。
核磁共振测定过程中不破坏样品,仪分样品可测多种数据;不但可以测定纯物质,也可以测定彼此型号不重叠的混合物样品;不但可以测定有机物,现在许多无机物的分子结构也能用核磁共振技术进行测定。
3.1 核磁共振的基本原理3.1.1 原子核的磁矩原子核是带正电的粒子,若其进行自旋运动将能产生磁极矩,但并不是所有的原子核都能产生自旋,只有那些中子数和质子数均为奇数,或中子数和质子数之一为奇数的原子核才能产生自旋。
如1H、13C、15N、19F、31P……、119Sn等。
这些能够自旋的原子核进行自旋运动时能产生磁极矩,原子核的自旋运动与自旋量子数I相关,I=0的原子核没有自旋运动。
只有I≠0的原子核有自旋运动。
原子核由中子和质子所组成,因此有相应的质量数和电荷数。
很多种同位素的原子核都具有磁矩,这样的原子核可称为磁性核,是核磁共振的研究对象。
原子核的磁矩取决于原子核的自旋角动量P,其大小为:式中:I为原子核的自旋量子数。
h为普朗克常数。
原子核可按I的数值分为以下三类:(1)中子数、质子数均为偶数,则I=0,如12C、16O、32S等。
此类原子核不能用核磁共振法进行测定。
(2)中子数与质子数其一为偶数,另一为奇数,则I为半整数,如I=1/2:1H、13C、15N、19F、31P、37Se等;I=3/2:7Li、9Be、11B、33S、35Cl、37Cl等;I=5/2:17O、25Mg、27Al、55Mn等;以及I=7/2、9/2等。
(3)中子数、质子数均为奇数,则I为整数,如2H(D)、6Li、14N等I=1;58Co,I=2;10B,I=3。
(2)、(3)类原子核是核磁共振研究的对象。
其中,I=1/2的原子核,其电荷均匀分布于原子核表面,这样的原子核不具有四极矩,其核磁共振的谱线窄,最宜于核磁共振检测。
凡I值非零的原子核即具有自旋角动量P,也就具有磁矩μ,μ与P之间的关系为:γ称为磁旋比,是原子核的重要属性。
3.1.2 自旋核在次场中的取向和能级质子核磁距在外加磁场中空间量子化,有2I + 1种可能的空间取向,这些磁量子数m 的值只能取I, I-1......-I, -I+1,共有2I + 1种可能的值,如下图所示:根据电磁理论,磁矩μ在外磁场中与磁场的作用能E为:式中:B O为磁场强度。
作用能E属于位能性质,故核磁矩总是力求与外磁场方向平行。
外磁场越强,恩呢高级分裂越大,高低能态的能级差也越大。
3.1.3 核的回旋和核磁共振当发生核磁共振现象时,原子核在能级跃迁的过程中吸收了电磁波的能量,由此可检测到相应的信号。
在磁场中,通电线圈产生磁距,与外磁场之间的相互作用使线圈受到力矩的作用而发生偏转。
同样在磁场中,自旋核的赤道平面也受到力矩作用而发生偏转,其结果是核磁距围绕磁场方向转动,这就是拉莫尔进动。
在静磁场中,具有磁矩的原子核存在着不同能级。
此时,如运用某一特定频率的电磁波来照射样品,并使该电磁波满足下式,原子核即可进行能级之间的跃迁,这就是核磁共振。
当然,跃迁时必须满足光谱选律,即。
所以产生核磁共振的条件为:射回射回可见,射频频率和磁场强度B O是呈正比的,在进行核磁共振实验时,所用的测长强度越高,发生核磁共振所需的射频频率也越高。
3.1.4 核的自旋弛豫对磁旋比为γ的原子核外加一静磁场B0时,原子核的能级会发生分裂。
处于低能级的粒子数n1将多于高能级的离子数n2,这个比值可用玻尔兹曼定律计算。
由于能级差很小,n1和n2很接近。
为能连续存在核磁共振信号,必须有从高能级返回低能级的过程,这个过程即称为弛豫过程。
弛豫过程有两类:自旋-晶格弛豫,亦称为纵向弛豫。
其结果是一些核由高能级回到低能级。
该能量被转移至周围的分子(固体的晶格,液体则为周围的同类分子或溶剂分子)而转变成热运动,即纵向弛豫反映了体系和环境的能量交换;自旋-自旋弛豫,亦称为横向弛豫。
这种弛豫并不改变n1,n2的数值,但影响具体的(任一选定的)核在高能级停留的时间。
这个过程是样品分子的核之间的作用,是一个熵的效应。
3.2 核磁共振仪与实验方法3.2.1 连续波核磁共振谱仪扫场:固定射频波频率,由扫描发生器线圈连续改变磁场强度,由低场至高场扫描。
扫频:固定磁场强度,通过改变射频频率的方式进行扫描。
3.2.2 脉冲傅里叶变换核磁共振谱仪PFT-NMR有很强的累加信号能力,所以有很高的灵敏度,大大减少样品的用量。
3.2.3 样品的处理非粘稠性的液体样品,可以直接测定。
对难以溶解的物质,如高分子化合物、矿物等,可用固体核磁共振仪测定。
但在大多数情况下,固体样品和粘稠性液体样品都是配成溶液进行测定。
溶剂应该不含质子,对样品溶解性好,不发生缔合作用,如四氯化碳、二硫化碳和氘代试剂等。
标准物质一般选用四甲基硅烷。
3.2.4 核磁共振图谱谱图的右边是高磁场、低频率,左边是低磁场、高频率。
吸收峰上的阶梯曲线是积分线,记录出各组峰的积分高度,由此可得到各组峰代表的质子的数量比。
3.3 1H的化学位移3.3.1 电子的屏蔽效应和化学位移大多能自旋的原子核都会受到核周围电子旋转动能的影响,原子核外层电子的旋转也会产生另外一个磁场,而电子旋转产生的磁场方向与原子核自旋产生的磁场方向相反。
这样,实际上有机物分子中自旋原子核所感受外加磁场电磁波的大小与原子核外层电子旋转产生的磁场有关,外层电子旋转产生的磁场,对原子核接受外加磁场的电磁波会产生屏蔽作用(shielding effect)。
由于原子核在有机物分子中所处的位置有差异,这样处于不同位置的原子核周围的电子状态就不同,也即原子核受电子屏蔽作用的程度也不同(用σ表示屏蔽常数),因而有机物分子中处于不同位置的原子核可以在不同的外加磁场的电磁波频率处发生共振。
这样就可以根据原子核发生共振的频率,推断出原子核在有机物分子中的位置,进而推断出有机物的分子结构。
在外层电子屏蔽条件下,自旋原子核在外加磁场作用时发生共振时的电磁波频率称作化学位移(chemical shift),常用δ表示。
现在的核磁共振谱主要是根据化学位移的数值来推断原子核在有机物分子中的位置而进行结构鉴定的。
核的共振频率ν与B O有如下关系:ν=γ B O(1-σ)∕2π由于荷所处化学环境不同其屏蔽常数σ的值不同,因此共振频率ν也不同。
3.3.2 化学位移的表示方法现在的核磁共振谱图中的化学位移δ值均为和基准物质四甲基硅烷化学位移δ值的相对比值,并被放大100万倍。
样品或样品其中ν为电磁波频率,TMS为基准物质四甲基硅烷,B为外加磁场强度。
必须指出:化学位移δ值是一个相对比值,它是一个无单位的数值,所谓ppm表示数值被放大百万倍,而不是δ值的单位。
另外,核磁共振δ值的ppm更与浓度单位ppm无任何关系。
3.3.3 影响化学位移的因素1. 诱导效应(inductive effect)某基团如果与电负性较强的原子(基团)连接,由于电负性较强的原子的拉电子作用,使该基团周围的电子密度降低,核的屏蔽减少,谱线向低场移动,这种效应称之诱导效应。
例如在CH3X中δ值与电负性EX有明显的依赖关系。
随着卤素的电负性增加,拉电子能力增强。
因而碳原子周围电子密度下降,由于氢原子与之相连,其电子密度也下降导致磁屏蔽减少δ值增加。
2. 共轭效应(conjugate effect)在具有多重健或共轭多重健的分子体系中,由于π电子的转移导致某基团电子密度和磁屏蔽的改变,此种效应称之共轭效应。
共轭效应有两种类型:π-π和p-π共轭,值得注意的是这两种效应电子转移方向是相反的。
在左的情形,氧原子具有孤对电子,与乙烯双键构成p-π共轭,电子转移的结果,使β位的C,H的电子云密度增加磁屏蔽也增加,因而δ减少(乙烯的δ为5.25ppm)。
右边的情形属于π-π,电子转移的方向恰恰相反,使β位的C,H的电子云密度降低,磁屏蔽也减少,因而δ增加。
3. 磁各向异性(magnetic anisotropic effect)如果分子具有多重键或共轭多重键,在外磁场作用下,π电子会沿着分子的某一方向流动,形成次级磁场,从而影响分子的磁屏蔽,由于次级磁场具有方向性,对分子各部位的磁屏蔽亦不同,称之为磁各向异性效应。
(1) 苯环的环电流效应由于苯环π电子的离域性,或流动性,在外加磁场H0的作用下,当H0的方向垂直于苯环平面时,π电子便沿着苯环碳链流动,形成环电流(ring current),电子流动的结果产生磁场,根据楞次定律,感应磁场的方向与外加磁场H0相反,因此苯环平面的上下正屏蔽区,侧面形成去屏蔽区,苯环的质子处于去屏蔽区。
对于某些具有共轭体系的大环化合物,环电流效应更为显着,环内质子与环外质子的δ相差很大。
例如(2) 双键与羰基的屏蔽与苯环的情形相似,双键与羰基的磁屏蔽如图所示:(3) 炔烃的屏蔽碳碳叁键刚好相反,去屏蔽区在叁键的上下方,而屏蔽区与叁键共平面。
这样乙炔的氢原子则处于屏蔽区,导致化学位移δ值为2.88ppm,远远小于乙烯。
(4) 单键单键有较弱的各向异性效应,C—C单键的去屏蔽区是以C—C单键为轴的圆锥体。
4. 范德华效应(Van der Waaslss effect)当两个原子相互靠近时,由于受到范德华力的作用,电子云相互排斥,导致原子周围的电子云密度降低,屏蔽减少,谱线向低场移动,这种效应称之为范德华效应。
5. 氢键效应(effect of hydrogen bond)和溶剂效应(solvent effect)有物机分子中氢核化学位移δ值产生影响的是氢键作用。
对于含有羟基和氨基的有机物,往往形成氢键,这样氢键的作用会导致氧和氮原子上氢的化学位移δ值的变化。
一般而言,有机物分子形成氢键会使氢核周围的电子云密度降低,即可发生类似去屏蔽的作用。
这样能形成氢键的有机物分子,其氧和氮原子上氢的化学位移δ值会显着增大。
形成氢键的质子由于受到两个氧原子的拉电子作用(诱导效应),其氢谱出现在低场位置上。
另外,羟基和氨基的核磁共振峰强度一般较弱和宽大,而其它有机基团的峰则强而尖锐,比较容易区分。
溶剂效应的产生往往是由溶剂的磁各向异性效应或溶剂与被测试样分子间的氢键效应引起的。
3.4 各类质子的化学位移氢核类型示例化学位移δppm环丙烷0.2伯烷RCH30.9仲烷R2CH2 1.3叔烷R3CH 1.5烯丙基取代C=C-CH3 1.7碘取代I-CH3 2.0-4.0酯基取代H3C-COOR 2.0-2.2羧基取代H3C-COOH 2.0-2.6酰基取代H3C-COR 2.0-2.7炔C≡C-H 2.0-3.0苯基取代 2.2-3.0醚基取代R-O-CH3 3.3-4.0溴取代CH3Br 2.5-4.0氯取代CH3Cl 3.0-4.0羟基取代CH3OH 4.0-4.3氟取代CH3F 4.0-4.5酰氧基取代RCOO-CH3 3.7-4.1胺RNH2 1.0-5.0醇ROH 1.0-5.5烯C=C-H 4.6-5.9苯 6.0-8.5醛RCHO 9.0-10.0羧酸RCOOH 10.5-12.0酚 4.0-12.0烯醇C=C-OH 15.0-17.0对于大部分有机化合物来说氢谱的化学位移值在0-10 ppm. 大致可分以下几个区:0-0.8 ppm:很少见,典型化合物; 环丙烷,硅烷,以及金属有机化合物。
