2013-Q1卡培他滨片CTD标准模板
(优质医学)卡培他滨放疗PPT演示课件

.
口服氟尿嘧啶的发展历程
肿瘤内激活/口服
Capecitabine
1992年合成 1998 FDA年批准
肿瘤选择性口服
Furtulon
1976合成,通过嘧啶核苷磷酸 化酶转换成5-FU
S-1(三剂组方)
93年合成 99年日本批准
非肿瘤选择性口服
Tegafur 1967合成
5-FU IV Roche, 1962 静脉
UFT(二剂组方) 1984合成,加入尿嘧啶,减少
5-Fu灭活
5-FU Heidelberger 1957
1950
1960
1970
1980
.
1990
2000
卡培他滨作用机制显示其具有靶向选择作用
小肠 肝脏 卡培他滨
CE 5'-DFCR CyD 5'-DFCR CyD
不良反应低,患者生活质量高。
5FU/LV:
5-FU/LV需要每两周1次超过48小时的输注,与奥沙利铂联用输注时间更长; 配药时间长,治疗时间长,药品污染几率大; 需要外科置入中心静脉插管 ,价格昂贵,患者痛苦; 病人长时间处于中心静脉径路,40%以上的患者可能发生血栓、感染、出血及气胸 并发症 ,患者综合治疗费用高。 需住院治疗,需要花费病床费用,病人的生活质量较差。 等
治疗组生存率明显高于观察组
采用联合放化疗可显著增加患者生存率 对照组和研究组分别 有23例和14例患者死亡
.
Bang YJ, etc Lancet. 2012 Jan 28;379(9813):315-21.
不良反应评价
所有患者均顺利完成 治疗,大部分患者在治疗期间出 现以白细胞减 少、肢端麻木、食欲下降、恶心、呕吐、 腹痛及 血液、外周神经毒性和胃肠道反应等,且多为 I、 Ⅱ级的轻度反应; 研究组和对照组各有7例和5例患者出 现短暂的Ⅲ级骨 髓抑制,经升白等对症处理后恢复; 卡培他滨化疗联合3D适形放疗能明显降低胃癌根治术后 患者的局部复发率并提高远期生存率,副反可耐受。
卡培他滨片剂审评概述

当前位置: 信息公开>>审评报告>>审评概述>>详细发布日期:20121229栏目:主题:卡培他滨片剂内容:卡培他滨片剂审评概述卡培他滨为氟嘧啶脱氧核苷氨基甲酸酯口服抗肿瘤药,能够在胸腺嘧啶脱氧核苷磷酸化酶(dThdPase)的作用下转化为5-氟脲嘧啶(5-FU),进而发挥抗肿瘤作用。
由于dThdPase在肿瘤组织中(例如胃癌,乳腺癌,结直肠癌,宫颈癌和卵巢癌)的浓度高于正常组织,使得药物可以浓集于肿瘤部位,增强并特异性杀伤肿瘤细胞,从而最大程度地降低5-氟尿嘧啶对正常人体细胞的损害,提高安全性。
卡培他滨由罗氏公司开发,1998年首次在瑞士上市,目前已在世界50余个国家上市,剂型为片剂,规格:0.15g、0.5g。
批准的适应症包括乳腺癌、结直肠癌(单药治疗和辅助治疗)以及胃癌等。
本品具有高度靶向性,能选择性地作用于肿瘤细胞,使药物在肿瘤部位有更高活性,增强疗效的同时也减轻了不良反应,易于耐受,能显著提高患者的生存质量,缩短平均住院时间,节约住院费用。
鉴于本品具有较高的临床价值,且临床可及性尚未得到满足,对该品种采用了“资料链接现场”的审评模式。
该审评模式的核心原则是:基于临床急需的特性,要求申报企业在申报时即能够在实际生产线上生产该仿制药,且与上市原研产品的质量相比要一致或更优,仿制品的生产厂要具有国际标准的质控体系。
目前已有5家国内企业(原料和制剂)完成了生产现场检查、第三方验证和技术审评工作,3家企业申报的制剂建议批准进行生物等效性研究。
已批准进行生物等效性研究的三家国内企业的申报资料均按照CTD格式申报,体现了过程控制和终点控制相结合的、全面系统的药品质量控制理念,研发逻辑比较符合药物研发的规律。
三家企业的工艺研究和验证比较全面,达到或接近生产规模;质量控制研究比较全面,方法的筛选与验证比较充分,申报的注册标准与最新版的国外药典收载的同品种标准及相关指导原则一致,质量与进口原研发厂的产品基本一致,有一家企业的产品纯度甚至优于进口原研发厂产品。
2013-Q1恩替卡韦

2.3.S.2.2 生产工艺和过程控制
1. 合成路线:如下图,参见申报资料 3.2.S.2.2(第 7 页)
恩替卡韦 主要研究信息汇总表(CTD)
第 4 页 共 22 页
浙江华海药业股份有限公司
恩替卡韦
模块: 2
质量部分
模块: 2.3.S
原料药
保密文件 版本号: CN-01 日期: 2012-11-15
恩替卡韦 主要研究信息汇总表(CTD)
第 8 页 共 22 页
浙江华海药业股份有限公司
恩替卡韦
模块: 2
质量部分
模块: 2.3.S
原料药
保密文件 版本号: CN-01 日期: 2012-11-15
2.3.S.3 2.3.S.3.1
特性鉴定 结构和理化性质
1. 结构确证
结合合成路线以及各种结构确证手段(IR,UV,MS,H-NMR,C-NMR),本公司生产的恩替卡 韦结构确定如下。详细请参见附件结构确证报告。
缩写备注:
MMTCl: 4-甲氧基三苯基氯甲烷 DMAP: 4-二甲氨基吡啶 DMP: 戴斯-马丁试剂 (Dess-Martin Periodinane) TEA: 三乙胺 DCM: 二氯甲烷 THF: 四氢呋喃
恩替卡韦 主要研究信息汇总表(CTD)
第 5 页 共 22 页
浙江华海药业股份有限公司
99.89% (纯度)
6.2%
99.93% (纯度)
6.2%
成品烘干温度 50℃(同 3.2.S.2.2)
99.80% (纯度)
—
—
成品烘干温度升 至 60℃以上
99.73% (纯度)
—
—
成品烘干温度升 至 70℃以上
卡培他滨片说明书.doc

卡培他滨片说明书【药品名称】通用名:卡培他滨片英文名: Capecitabinen Tablets汉语拼音: Kapeitabin Pian【适应证】卡培他滨片适用于紫杉醇和包括有蒽环类抗生素化疗方案治疗无效的晚期原发性或转移性乳腺癌的进一步治疗。
适用于结、直肠癌的治疗。
【剂量与用法】推荐剂量:每日 2,500mg/ m2,连用两周,休息一周。
每日总剂量分早晚两次于饭后半小时用水吞服。
如病情继续恶化或产生不能耐受的毒性时应停止治疗。
【治疗中剂量调整】卡培他滨片所引起的毒性有时需要做对症处理或对剂量进行调整(停药或减量)。
一旦减量,以后不能再增加剂量。
以下是对毒性进行剂量调整时的推荐剂量(根据加拿大国家癌症研究所制定的常见毒性标准)。
1 级。
2 级。
第一次出现:停止治疗,直到恢复至0-1 级水平时,按维持剂量的100%进行下一疗程治疗。
第二次出现:停止治疗,直到恢复至0-1 级水平时,按维持剂量的75%进行下一疗程治疗。
第三次出现:停止治疗,直到恢复至0-1 级水平时,按维持剂量的50%进行下一疗程治疗。
第四次出现:永久停止治疗。
3 级:第一次出现:停止治疗,直到恢复至0-1 级水平时,按维持剂量的75%进行下一疗程治疗。
第二次出现:停止治疗,直到恢复至0-1 级水平时,按维持剂量的50%进行下一疗程治疗。
第三次出现:永久停止治疗。
4级:永久停止治疗。
如停药后需继续治疗,则应考虑到病人的最大益处,且在毒性症状恢复至 0-1 级水平时以推荐剂量的50%进行使用。
【特殊人群的剂量调整】肝功能不全:对肝转移引起的轻度至中度肝功能不全的病人所进行的卡培他滨片药代动力学研究表明,无需对这类病人做剂量调整。
肾功能不全:尚未对肾功能不全者(指血清肌酐)进行卡培他滨片药代动力学研究。
儿童:尚未在儿童中进行卡培他滨片的疗效与安全性研究。
老年人:无须作剂量调整。
但在老年人( 65 岁以上)比年轻人更易对卡培他滨产生毒性,故应对其进行密切监测。
卡培他滨说明书,你真的会看吗?建议收藏的详细解析版

卡培他滨说明书,你真的会看吗?建议收藏的详细解析版首先,卡培他滨属于哪种化疗药物:细胞毒性药物,就是我们常说的化疗药物。
不同于靶向药物针对性杀死表达某种基因突变的肿瘤细胞,化疗药物主要攻击处于快速分裂期的细胞,因此除了蛮横的肿瘤细胞以外,极其容易受到攻击的就是血液细胞。
卡培他滨的主流用药方案卡培他滨有大致两种用药:01单用卡培他滨通常是口服,针对一些分期较早(复发概率较低),或是年龄较长的老年患者,考虑联合用药打击过猛,反而损害免疫系统,无法从化疗中收益。
单药应用推荐剂量为1250mg/m2,每日两次,口服(每日总剂量为2500mg/m2);吃2周,停1周,3周为一疗程,餐后30分钟内用水吞服。
那么具体怎么计算用量呢,首先要先算体表面积,体表面积计算公式:体表面积(m) =0.0061x身高(cm)+0.0128×体重(kg)-0.1529。
举个例子,患者A,75岁老年男性,身高:175cm,体重:65kg,体表面积:1.7466 m2约等于2.00m2;那么根据说明书:推荐剂量1250mg/m2,按照卡培他滨每片0.5g(=500mg)计算,患者A的卡培他滨具体用药量为:1250x2.00=2500mg 每顿;注:5片/次 2次/日餐后30分钟内用水吞服,连服14天,休息1周,3周(21天)为一个疗程。
02与奥沙利铂联用奥沙利铂130mg/m2,静脉输注,当天开始口服卡培他滨,剂量为1000mg/m2,每日两次,用药2周,停1周;再举个例子:患者B,55岁老年男性,身高:175cm,体重:65kg,体表面积:1.7466 m2约等于2.00m2;那么根据说明书:奥沙利铂推荐剂量:130mg/m2;卡培他滨推荐剂量1000mg/m2,按照卡培他滨每片0.5g(=500mg)计算:患者B的化疗药物具体用药量为:奥沙利铂:130x2.00=260mg+卡培他滨:1000x2.00=2000mg ;注:第一天静脉滴注奥沙利铂260mg;同日起,口服卡培他滨:4片/次2次/日餐后30分钟内用水吞服,连服14天,休息1周,3周(21天)为一个疗程。
卡培他滨片质量标准

卡培他滨片质量标准
卡培他滨片是一种常用的抗癌药物,其质量标准对于药品的生产和使用至关重要。
下面将对卡培他滨片的质量标准进行详细介绍。
一、外观和性状。
卡培他滨片应为白色或类白色片剂,无明显的异物和色斑。
其性状应为结晶或结晶性粉末,无明显气味。
二、含量测定。
卡培他滨片的含量应符合国家药典规定,一般来说,其含量应在90%~110%之间。
三、溶出度。
卡培他滨片在不同介质中的溶出度应符合国家药典规定,一般来说,其溶出度应在75%~125%之间。
四、不溶物。
卡培他滨片中不溶于水的物质含量应符合国家药典规定,一般来说,其不溶物含量不应超过0.2%。
五、有关杂质。
卡培他滨片中有关杂质的含量应符合国家药典规定,各种杂质的含量都应在一定范围内。
六、微生物限度。
卡培他滨片中的微生物限度应符合国家药典规定,微生物总数、大肠菌群和霉菌、酵母菌的数量都应在规定范围内。
七、贮存。
卡培他滨片在贮存过程中,应避免阳光直射,防潮防尘,温度不超过25摄氏度,相对湿度不超过60%。
八、包装。
卡培他滨片的包装应符合国家药典规定,包装应完整,无破损,标签应清晰完整。
以上就是对卡培他滨片质量标准的详细介绍,希望能对生产和使用该药品的相关人员有所帮助。
在生产过程中,必须严格按照国家药典的要求进行操作,确保药品质量符合标准,以保障患者的用药安全。
药物说明书drins卡培他滨罗氏

卡培他滨片说明书来源: 上海罗氏制药有限公司【药品名称】通用名称:卡培他滨片英文名称:Xeloda(CapecitabineTablets) 商品名称:希罗达【成份】卡培他滨【性状】0.15g:双凸、长方形、浅桃色包衣片,除去包衣后显白色。
一面有XELODA字样,另一面有150字样;0.5g:双凸、长方形、桃色包衣片,除去包衣后显白色。
一面有XELODA字样,另一面有500字样。
【适应症】结肠癌辅助化疗:卡培他滨适用于Dukes‘C期、原发肿瘤根治术后、适于接受氟嘧啶类药物单独治疗的结肠癌患者的单药辅助治疗。
其治疗的无病生存期(DFS)不亚于5-氟尿嘧啶和甲酰四氢叶酸联合方案(5-FU/LV)。
卡培他滨单药或与其他药物联合化疗均不能延长总生存期(OS),但已有试验数据表明在联合化疗方案中卡培他滨可较5-FU/LV改善无病生存期。
医师在开具处方使用卡培他滨单药对Dukes’C期结肠癌进行辅助治疗时,可参考以上研究结果。
用于支持该适应症的数据来自国外临床研究(见【临床试验】部分内容)。
结直肠癌:卡陪他滨单药或与奥沙利铂联合(XELOX)适用于转移性结直肠癌的一线治疗。
乳腺癌联合化疗:卡培他滨可与多西紫杉醇联合用于治疗含蒽环类药物方案化疗失败的转移性乳腺癌。
乳腺癌单药化疗:卡培他滨亦可单独用于治疗对紫杉醇及含蒽环类药物化疗方案均耐药或对紫杉醇耐药和不能再使用蒽环类药物治疗(例如已经接受了累积剂量400mg/m2阿霉素或阿霉素同类物)的转移性乳腺癌患者。
耐药的定义为治疗期间疾病继续进展(有或无初始缓解),或完成含有蒽环类药物的辅助化疗后6个月内复发。
胃癌:卡培他滨适用于不能手术的晚期或者转移性胃癌的一线治疗。
【规格】0.15g;0.5g【用法用量】【不良反应】研究者认为,在卡培他滨针对不同适应症进行单药治疗 (结肠癌辅助治疗,转移性结直肠癌和转移性乳腺癌治疗)和进行联合化疗方案时都有可能发生不良反应。
根据7项临床试验集中分析所得出的最高发生率,将各种不良反应归入以下表格中的相应分类中。
卡培他滨

本组发生2例严重不良事件(SAE),其中1例威胁生命,提 示少数个体对希罗达®的反应可以特别敏感,这与患者体内 双氢嘧啶脱氢酶(Dihydropyrimidinedehydrogenase, DPD) 的活性差异有关。 因此,本品应在对肿瘤化疗有经验的专科医师密切观察下 使用。用药过程中应密切观察患者情况,一旦出现腹泻、 口腔溃疡等不良反应,需适时调整剂量或停药处理。
疗效判断标准
按WHO的疗效评价标准
结果
入组人数
全组共入组乳腺癌患者71例。其中一例患者发现脑 转移,服药不足一疗程退出研究并失访,不能作疗效及 不良反应评价。 一例虽完成研究,但属于一线化疗病人,不符合入 选标准,不能评价疗效。2例用药1疗程后因不良反应退 出研究,未作病灶复查。故可作不良反应评价者70例, 可作疗效评价者 67例。
主要不良反应
名称 发生率(%) I--IV度 手足综合征 皮肤色素沉着 腹泻 贫血 胆红素升高 62.8% 44.3% 12.9% 30.0% 14.3% III--IV度 10% / 4.3% / /
表四:全组患者(70例 表四:全组患者(70例)不良反 应发生率
不良反应 汇总 例数 % 44 30 31 21 18 9 15 11 7 1 4 62.8 42.9 44.3 30 25.7 12.9 21.4 12.7 10 1.4 5.7 I 级 例数 % 26 23 28 20 16 5 14 8 5 1 4 37.2 32.9 40 28.6 22.9 7.2 20 11.4 7.2 1.4 5.7 II级 例数 % 11 7 2 1 2 1 1 1 2 15.7 10 2.9 1.4 2.9 1.4 1.4 1.4 2.9 III级 例数 % 7 1 10 1.4 IV级 例数 % III+IV 例数 % 7 1 10 1.4 手足综合症 皮肤色素沉着 恶心 厌食 呕吐 腹泻 疲劳 口炎 头晕 脱发 心慌、气短
卡培他滨-胃癌

59%
CAPEOX 组 XELOX 组
81% 单纯手术组
中国人群
59%
0% 25% 50% 75% 100%
*分层因素包括国家和疾病分期
Roche internal data
Bang, et al. Lancet 2012
胃癌辅助化疗的指南推荐
推荐方案 • 卡培他滨联合奥沙利铂用于D2术后患者
XP
•KPS ≥70%
•18–75 岁 •晚期胃癌
5-FU 800mg/m2 i.v. d15 q3w
FP
顺铂 2 80mg/m i.v. d1 q3w
主要研究目的: XP方案的无进展生存期(PFS)不劣于FP方案
Annals of Oncology 2009;20 666–673
XP方案疗效非劣于FP方案
化疗时机: • 一般在术后3-4周,患者身体状况基本恢复 适用患者: • 术后病理分期为Ib期伴淋巴结转移, II, III期患者 方案推荐: • 辅助化疗推荐氟尿嘧啶联合铂类的两药联合方案
• 不能耐受联合方案的患者或Ib期患者推荐口服氟尿嘧啶单药
卡培他滨用于治疗胃癌
早期胃癌---CLASSIC研究 晚期胃癌---ML17032 REAL-2 META分析 ToGA研究
5'-FU代谢药时曲线
5'-FU(艾滨®) 5'-FU(希罗达®)
200
100
0 0 0 2 4 6 8 10 2 4 6 8 10 给药后时间(小时)
艾滨®与希罗达®的AUC0-∞、AUC0-t和Cmax在给药顺序、制剂间和周期间均无显著性差异 Tmax在艾滨®与希罗达®之间无统计学差异。
内容提要
卡培他滨片的质量控制

卡培他滨片的质量控制1、实验材料1.1、材料甲醇、乙睛、冰醋酸购买于山东禹王实业有限公司化工分公司;高效液相用甲醇、乙睛为色谱纯,其它试剂为分析纯。
表1 材料信息一览表1.2仪器表2 仪器一览表2、方法与结果2.1、质量标准参考卡培他滨片美国药典标准(USP39)的内容,制定了本品的质量标准。
表3 质量标准、方法和限度2. 2分析方法【性状】本品为薄膜衣片,除去包衣后显白色。
【鉴别](1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应照品溶液主峰的保留时间一致。
(2)本品的红外光吸收图谱应与对照品的图谱一致。
【含量】稀释液:甲醇一乙睛一水(7:1:12)溶液A: O.I%冰醋酸水溶液溶液B:甲醇一乙睛一溶液A (7:1:12)溶液C:甲醇一乙腊一溶液A (16:1:3 )时间程序系统适用性溶液:用稀释液制成含0.6}g/ml的USP卡培他滨标准品,USP相关杂质A,USP 相关杂质B和USP相关杂质C溶液。
标准溶液:用稀释液制成含0.6mg/ml的USP卡培他滨标准品溶液。
样品溶液:取20片样品,碾细,称取适量粉末,用稀释液制成含卡培他滨0.6mg/ml的样品溶液,过滤,取续滤液作为样品溶液。
色谱系统:高效液相色谱色谱法检测波长:250nm2. 3分析方法的验证2. 3. 1、性状本品为薄膜衣片,除去包衣后应显白色。
取卡培他滨片三批样品,依法检查,结果见下表。
表4 卡培他滨片外观性状检查试验结果试验结果表明:3批样品检查结果均为薄膜包衣片,除去包衣后显白色,订入质量标准。
2. 3. 2鉴别2. 3. 2. 1红外吸收光谱法将一片卡培他滨片研细,加约1-2mg药粉到300mg的溴化钾中,依法检查,供试样品的吸收带应和对照品一致。
表5 卡培他滨片IR法鉴别检查结果结论:3批样品的红外色谱吸收带均与对照品一致,将本鉴别方法列入质量标准2. 3. 2. 2高效液相色谱法在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
xeloda不良反应及处理

最新课件
1
单药治疗
卡培他滨单药治疗 (1250 mg/m2/bid,1-14 天,每 3 周)时 ≥ 5%患者不良反应
身体系统 不良反应 代谢及营养 神经系统
眼
非常常见 (≥ 10%)
厌食 (G3/4:1%)
常见 (≥5% - < 10%)
脱水 (G3/4: 3%) 食欲低下(G3/4:<1%) 感觉异常, 味觉障碍(G3/4:<1%), 头痛(G3/4:<1%), 头昏(除眩晕外) (G3/4:<1%) 流泪增多 结膜炎 (G3/4:<1%)
最新课件
5. Bonnefoi H, et al. Eur J Cancer. 2003;39(9):121767-1283.
6. Goel S, et al. Am J Clin Oncol. 2002;25(5):528-534.
其他干预措施
• Lin 等采用塞来昔布(剂量为200mg/次,每天2次)联合卡培他滨治疗转移 性结直肠癌患者手足综合症。
全身及给 药部位
非常常见 ≥10%
便秘, 消化不良
脱发, 指甲疾病
关节痛, 肌痛, 四肢痛
发热, 虚弱, 无力, 不耐热
常见 ≥5% - <10% 感染+ 口腔念珠菌病
颌痛 背痛
发热+ 疼痛
表中列出了卡培他滨联合多种化疗方案治疗 各种适应症时发生的,且或发生频率较高的 不良反应,但其中排除了卡培他滨单药治疗 时观察到的药物不良反应
希罗达meta分析:
总生存期(月)
35
30
29.0
25
20 15.9
15
10 5
卡倍他滨生产工艺和过程控制
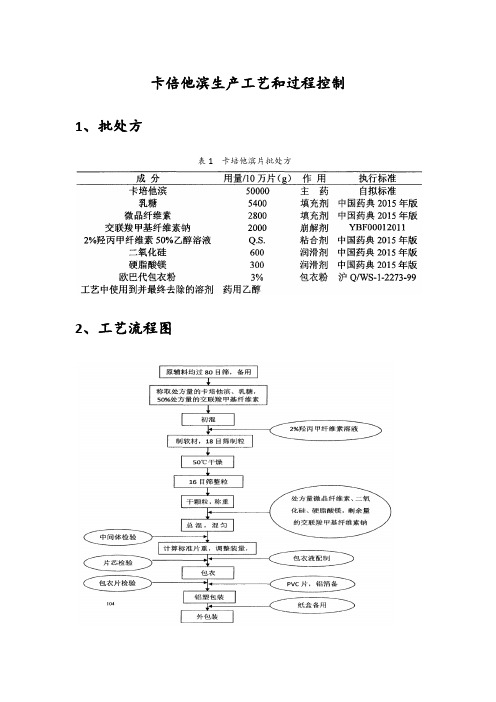
卡倍他滨生产工艺和过程控制1、批处方表1 卡培他滨片批处方2、工艺流程图3.生产工艺1.配料1.1操作流程1.2工艺条件、质量控制要点1.2.1配药、备料、称量在D级洁净区内进行,环境温度控制为18-26℃,相对湿度控制为45-65%,此操作室与洁净走廊保持相对负压。
1.2.2称量前应确保衡器校正合格。
1.2.3领料前以处方与原辅料检验报告单为基准核对原辅料的品名、批号、生产厂家、规格及数量。
原辅料无合格《检验报告》及内包装破损的不得使用。
1.2.4原辅料预处理:使用前打开袋子,目检,在目力范围内发现2个以上杂点或大异物,应退回仓库,拒绝使用。
1.2.5把原辅料钠拉至预处理间,将原辅料分别过80目筛;过筛前后均需检查筛网的完整性、牢固性。
1.2.6按处方计算原辅料的投料量,两人复核无误后方可称料。
1.2.7在称量室认真校正电子称后,对所用原辅料进行准确称量,他人独立复核无误,并填写原辅料检查使用记录(电子台秤每班使用前后分别校正一次)。
1.2.8对称量好的原辅料封口贮存并及时做好标示。
称量结束后剩余的原辅料也应及时封口贮存,并及时填写称量记录、货位卡,更换品种时,剩余原辅料作退库处理。
并标明品名、批号、使用日期、剩余数量及退库人签名。
1.2.9粘合剂为2%轻丙甲纤维素溶液50%药用乙醇溶液,制软材时粘合剂加入用量应在标准用量的X10%之内。
1.2.10配料人员投料前需重新复核原辅料重量,复核无误后将处方量的卡培他滨、乳糖、50%处方量的交联梭甲基纤维素钠(内),置高效混合制粒机中混合15-20分钟,浆叶转速63转/分。
然后加入处方量的粘合剂,加入过程注意速度要慢,防止过快引起粉尘飞溅。
粘合剂全部加入后桨叶转速是63转/分,飞刀转速调至1500转/分,直至2分钟,停止检查软材情况。
如果质量达不到要求,可以再搅拌1-2分钟(浆叶转速70转/分,飞刀转速1800转),出料。
1.2.11制湿颗粒:选择18目数的筛网,安装到摇摆式颗粒机上,筛网安装应平整无皱折,将软材加入到摇摆式颗粒机中开始制粒,将制备的颗粒加入到流化床多功能制粒包衣机中。
卡培他滨说明书

请仔细阅读说明书并在医师指导下使用警告!对于同时服用卡培他滨和香豆素类衍生物抗凝药如华法令和苯丙香豆素的患者,应该频繁监测抗凝反应指标,如INR或凝血酶原时间,以调整抗凝剂的用量。
在合并用药期间,曾有凝血参数改变和/或出血,包括死亡的报告。
发生时间:在开始卡培他滨治疗后几天到几个月时间内,也可能在停止使用卡培他滨后1个月内观察到。
易感因素:年龄>60,诊断为癌症。
【药品名称】通用名称:卡培他滨片英文名称:Capecitabine Tablets汉语拼音:Kapeitabin Pian【成份】本品主要成份为卡培他滨。
化学名称:5’-脱氧-5-氟-N-[(戊氧基)羰基]-胞(嘧啶核)苷。
分子式:C15H22FN3O6分子量:【性状】本品为薄膜衣片,除去包衣后显白色或类白色。
【适应症】结肠癌辅助化疗:卡培他滨适用于Dukes’ C期、原发肿瘤根治术后、适于接受氟嘧啶类药物单独治疗的结肠癌患者的单药辅助治疗。
其治疗的无病生存期(DFS)不亚于5-氟尿嘧啶和甲酰四氢叶酸联合方案(5-FU/LV) 。
卡培他滨单药或与其他药物联合化疗均不能延长总生存期(OS),但已有试验数据表明在联合化疗方案中卡培他滨可较5-FU/LV改善无病生存期。
医师在开具处方使用卡培他滨单药对Dukes’ C期结肠癌进行辅助治疗时,可参考以上研究结果。
结直肠癌:卡培他滨单药或与奥沙利铂联合(XELOX)适用于转移性结直肠癌的一线治疗。
乳腺癌联合化疗:卡培他滨可与多西紫杉醇联合用于治疗含蒽环类药物方案化疗失败的转移性乳腺癌。
乳腺癌单药化疗:卡培他滨亦可单独用于治疗对紫杉醇及含蒽环类药物化疗方案均耐药或对紫杉醇耐药和不能再使用蒽环类药物治疗(例如已经接受了累积剂量400 mg/m2阿霉素或阿霉素同类物)的转移性乳腺癌患者。
耐药的定义为治疗期间疾病继续进展(有或无初始缓解),或完成含有蒽环类药物的辅助化疗后6个月内复发。
胃癌:卡培他滨适用于不能手术的晚期或者转移性胃癌的一线治疗。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
卡培他滨片 CTD 格式申报主要研究信息汇总表
(2)辅料用量选择依据 通过对对照药品(原研产品)希罗达片重的测定,其片芯重约611~625mg,
设计自制片重控制同希罗达。选用与卡培他滨相容性良好的辅料,在常规用量范 围内,进行组方,以中间体物料性状、压片情况、片剂外观性状、溶出度等项目 为指标,进行处方筛选。
pH1.2盐酸溶液中溶出曲线
SH0189 SH0329 1003311
10
20
30
40
50
60
时间(min)
%
6
卡培他滨片 CTD 格式申报主要研究信息汇总表
卡培他滨片(***批)与希罗达 在 pH4.0 醋酸盐缓冲液中溶出曲线的比较
120
累 100
积
溶 80
出
度 (
60
) 40
pH4.0醋酸溶液中溶出曲线
7
卡培他滨片 CTD 格式申报主要研究信息汇总表
结论:自制样品与希罗达在 4 种不同的溶出介质中溶出曲线的 f2 相似因子
均大于 50,说明自制样品与希罗达溶出曲线具有相似性。
详见申报资料 3.2.P.2.2.2(页码:10~25)。
(2)有关物质比较
自制卡培他滨片:江苏正大天晴药业股份有限公司生产,
(2) 本品为片剂,无附带专用溶剂。 (3) 本品使用的包装材料为铝箔和聚氯乙烯/聚偏二氯乙烯固体药用复合硬 片(PVC/PVDC)。
2.3.P.2 产品开发 卡培他滨由瑞士罗氏(Roche) 制药公司开发,于 1998 年 4 月以商品名希
罗达(Xeloda) 在美国获准上市,2000 年获得 SFDA 批准进口,上市剂型为片剂, 规格 0.15g、0.5g。
2.3.P.2.1.2 辅料 (1)辅料种类选择依据
参考希罗达的辅料种类,并结合原料的性质进行卡培他滨片辅料相容性试验, 最终确认卡培他滨片的辅料有乳糖、微晶纤维素、羟丙基纤维素、交联羧甲基纤 维素钠、二氧化硅、硬脂酸镁。包衣粉选用的是常用的胃溶型薄膜包衣预混剂(欧 巴代® 85G68918)。
选择的卡培他滨片辅料种类基本同原研制剂希罗达。
经注册申请人授权,恩替卡韦与卡培他滨片 CTD资料仅限于2013年药物研发与评价研讨班使用, 不得挪作他用。
为便于会议使用,已对研究资料及相关数据进 行了修改,且研讨班的评述意见不代表对申请人申 报该品种的真实审评意见。
卡培他滨片 CTD 格式申报主要研究信息汇总表
卡培他滨片 CTD 格式申报药学研究主要信息汇总表
有关物质的对比。 对照药品:由上海罗氏制药有限公司为瑞士巴塞尔豪夫迈·罗氏有限公司生产; 商品名:希罗达®(Xeloda®);规格:0.5g;铝塑包装。
批号:SH0189,生产日期 20090807,有效期至 20110806; 批号:SH0329,生产日期 20100322,有效期至 20120321; (1)自制制剂与对照药品不同溶出介质中的溶出行为对比
4
卡培他滨片 CTD 格式申报主要研究信息汇总表
溶出 介质
水
pH1.2 盐酸 溶液
pH4.0 醋酸盐缓
冲液
pH6.8 磷酸盐缓
冲液
表* 卡培他滨片(**批)同希罗达在四种介质中溶出曲线 测定结果比较(n=6) 累积溶出量(%)
时间 min
***批
希罗达 SH0189
希罗达 SH0329
10
46
44
详见申报资料 3.2. P.2.1.2(页码:7~9 )。
2.3.P.2.2 制剂研究
2. 3.P.2.2.1 处方开发过程
处方的研究开发过程和确定依据参见申报资料 3.2.P.2.2.1(页码:9~10)。
最终确定的自制卡培他滨片与对照药品希罗达的处方组成比较见下表:
希罗达(原研产品)
自制卡培他滨片
%
0
0
10
20时间(min)30
40
50
60
从四种溶出介质中的累积溶出曲线看,我公司研制的卡培他滨片与希罗达®
的体外溶出行为基本一致。计算 f2 相似因子,溶出达到 85%以上的时间点只能
选取一个,且时间点不少于 3 个。因此选择 10、20、30min 的溶出数据,结果如
下:
溶出介质
****批与 希罗达 SH0189
主药
卡培他滨
卡培他滨
稀释剂 粘合剂
乳糖 微晶纤维素 羟丙甲纤维素
乳糖 微晶纤维素 羟丙甲纤维素
崩解剂 润滑剂 助流剂 包衣材料
交联羧甲基纤维素钠
交联羧甲基纤维素钠
硬脂酸镁
硬脂酸镁
/
二氧化硅
羟丙甲纤维素、滑石粉、钛白粉、 胃溶型薄膜包衣预混剂
合成氧化铁黄、氧化铁红
下表说明不同开发阶段(小试、中试、大生产)处方组成的变化、原因以 及支持变化的验证研究。
我公司仿制的卡培他滨片,剂型同原研厂家罗氏制药的希罗达,规格 0.5g。
1
卡培他滨片 CTD 格式申报主要研究信息汇总表
2.3.P.2.1 处方组成 2.3.P.2.1.1 原料药
(1) 原料药和辅料的相容性试验 参照FDA官方网站希罗达® (Xeloda®)使用说明书,希罗达为桃色或浅桃色薄 膜衣,其非活性成分包括:无水乳糖,交联羧甲基纤维素钠,羟丙甲纤维素,微 晶纤维素,硬脂酸镁,纯化水;桃色或浅桃色薄膜衣含羟丙甲纤维素、滑石粉、 钛白粉、合成氧化铁黄、氧化铁红。 日本上市的卡培他滨片,商品名:Xeloda®,规格0.3g,白色薄膜衣片。其 非活性成分包括:无水乳糖,交联羧甲基纤维素钠,羟丙甲纤维素,微晶纤维素, 硬脂酸镁,滑石粉、二氧化钛。 参照希罗达处方中的辅料组成,选用固体制剂常用辅料乳糖、微晶纤维素、 交联羧甲基纤维素钠、羟丙甲纤维素、硬脂酸镁、二氧化硅,分别与主药按一定 比例混合后,取适量,分别在(4500±500Lx)、高温(60℃)、高湿(相对湿度 92.5%,25℃)的条件下放置 10 天,检测有关物质,考察辅料与卡培他滨原料药 的相容性。 卡培他滨与上述辅料经高温 60℃、强光照射、高湿 92.5%放置 10 天,与初 始相比,其外观性状、有关物质、含量基本没有变化;表明上述各种辅料与卡培 他滨的相容性良好,可用作卡培他滨片的辅料。 包衣粉选用常用的水溶性胃溶型薄膜包衣预混剂(欧巴代® 85G68918)。 详见申报资料 3.2. P.2.1.1 原料药(页码:4~6)。 (2)卡培他滨为白色或类白色结晶性粉末;无臭。卡培他滨在甲醇中极易溶解, 在水中略溶。
希罗达每片含乳糖约54mg。片芯重约623mg,其中主药卡培他滨500mg、 乳糖54mg。在此基础上,确定了微晶纤维素用量45mg/片。粘合剂羟丙甲纤维 素溶液的浓度,根据中间体的物料休止角、可压性,最终选择3%浓度。崩解剂 交联羧甲基纤维素钠用量决定了片溶出速度,根据实验结果,调整用量使自制片 的溶出速度(溶出曲线)基本同希罗片。处方中润滑剂二氧化硅、硬脂酸镁的用 量,在一般常规用量范围内,根据中间体休止角、流动性,片子外观,确定用量。 包衣粉的用量,使片剂增重不超过3%。
43
15
----
----
63
20
87
85
79
30
98
96
95
45
99
96
97
60
99
96
98
累积溶出量(%)
时间 min
***批
希罗达 SH0189
希罗达 SH0329
10
32
36
36
15
----
----
57
20
67
75
75
30
93
92
89
45
89
88
84
60
84
84
79
累积溶出量(%)
时间 min
处方组成变化汇总
3
卡培他滨片 CTD 格式申报主要研究信息汇总表
小试处方 中试处方 大生产处方
批量 800 片
3.5 万片
主要变化及原因
本品从小试到放大, 处方组成没有变化
支持依据 /
本品中原辅料均不存在过料投料现象。
2.3.P.2.2.2 制剂相关特性 为进一步验证我们的处方工艺,将自制样品与希罗达进行体外溶出行为、
3.2. P.1 剂型及产品组成 (1) 我公司研制开发的卡培他滨片,剂型为片剂,规格:0.5g,处方中的辅
料为乳糖、微晶纤维素、交联羧甲基纤维素钠、羟丙甲纤维素、硬脂酸镁、二氧 化硅、胃溶型薄膜包衣预混剂。
卡培他滨片单位剂量的处方组成如下:
成分
用量
过量加入 作用
执行标准Biblioteka 片芯mg%
卡培他滨
500 80.26
无
主药
企业标准
乳糖
54
8.67
无
稀释剂 中国药典 2010 年版
微晶纤维素
45
7.22
无
稀释剂
JX*****
羟丙甲纤维素(5cps)
约 9 1.44
无
粘合剂
JX20020062 中国药典 2010 年版
交联羧甲基纤维素钠
6
0.96
无
崩解剂
JX20010349
二氧化硅
6
0.96
无
润滑剂 中国药典 2010 年版
120
累 100 积 溶 80 出 度 60 ( ) 40
20
水中溶出曲线
SH0329 SH0189 1003311
%
0
0
10
20
30
40
50
60
时间(min)
100
90 累 积 80 溶 70 出 度 60 ( 50 ) 40
30
