高中化学方程式填空训练
高中化学方程式填空练习

高一化学方程式填空复习(加粗字体的为重点之中的重点)金属一钠1.钠投入硫酸铜溶液中____________________________________________________2.除杂:Na2CO3固(NaHCO3固)____________________________________________Na2CO3液(NaHCO3液)____________________________________________ NaHCO3(Na2CO3)_____________________________________________3.Na2CO3溶液中滴入HCl(离子方程式)____________________________________________________________________4.电解熔融NaCl____________________________________________________ 5.电解饱和食盐水NaCl______________________________________________________二镁和铝1. 工业制镁(电解)_________________________________________________2. 氧化镁和盐酸反应的离子方程式____________________________________3.氯化镁和氢氧化钠反应的离子方程式_________________________________4.铝和盐酸反应的离子方程式_________________________________________5.铝和氢氧化钠反应的离子方程式______________________________________6.铝与三氧化二铁的铝热反应__________________________________________7.工业制铝(电解)___________________________________________________________8. 泡沫灭火器中Al3+与HCO3-的反应_________________________________________________9.Al2O3的两性(分别与盐酸和氢氧化钠的化学和离子方程式)_________________________________,_______________________________________ _________________________________,_______________________________________10.Al(OH)3的两性(与盐酸和氢氧化钠的化学和离子方程式)_________________________________,_______________________________________ _________________________________,_______________________________________ 11.实验室制氢氧化铝的离子方程式_______________________________________ 12.氢氧化铝受热____________________________________________________13.氯化铝溶液中滴氢氧化钠的现象及离子方程式__________________________________________________________________________________________________________________________________14.AlCl3溶液加热蒸干灼烧可以得到什么物质____________________________三铁1.铁与水蒸气的反应____________________________________________________2.铁与硫酸铜的反应____________________________________________________3. 白色沉淀迅速变成灰绿色,最后变成红褐色____________________________4.氢氧化铁胶体的制备_________________________________________________5.FeCl3腐蚀铜制印刷电路板的反应_______________________________________6.除杂:FeCl3(FeCl2) __________________________________________________FeCl2(FeCl3) __________________________________________________7.Fe3+检验__________________________________________________Fe3O4与盐酸反应__________________________________________________8、冶炼汞、银、铁的反应_______________________________________________________________________________ _______________________________________________________________________________ _______________________________________________________________________________ 非金属一硅1.装NaOH溶液的试剂瓶不能用玻璃塞的原因_____________________________2.盛装氢氟酸不能用玻璃瓶的原因_______________________________________3.实验室制硅酸_______________________________________________________4.证明硅酸酸性弱于碳酸____________________________________________________ 二氮与硝酸1.雷雨发庄稼____________________________________________________________________________________________________________________2.氨的喷泉实验酚酞变红的原因_________________________________________3.干燥氨气不能用浓硫酸的原因_________________________________________4.工业制硝酸的基础,氨的催化氧化______________________________________5.食盐与氯化铵的分离方法_____________________________________________6.实验室制氨气的化学方程式___________________________________________7.铵根离子检验的离子方程式___________________________________________8.实验室制NO的化学及离子方程式______________________________________________________________________________________________________的化学及离子方程式____________________________________9.实验室制NO2_________________________________________________________________10.工业上合成氨的反应__________________________________________________ 11.NO、O2与水反应的关系式:_______________________________________________ 12.NO2、O2与水反应的关系式:__________________________________________________ 三硫与硫酸1.SO2的水溶液滴石蕊显_____ 色,原因是(方程式)_______________________2.Cl2通入石蕊现象________________ ,原因是(方程式)__________________通入溴水中,溴水颜色____ 原因是(化学和离子方程式,此原理用3.将SO2于海水提溴实验)_________________________________,________________________________4.工业上制硫酸的三个反应________________________________________________________________________________________________5.酸雨长期放置PH减小的原因(化学及离子方程式)______________________6.蔗糖脱水反应 ________________________________________________________为什么同时会闻到刺激性气味__________________________________________7.铜与浓硫酸___________________________________________________________8.硫酸根离子的检验,试剂_____________离子方程式_______________________ 四氯气1.新制氯水在日光下照射,产生大量气泡__________________________________2.工业制盐酸____________________________________________________________3. Fe在Cl2中燃烧________________________________________________________4工业制漂白粉,漂粉精的反应___________________________________________5.漂粉精在空气中放置失效的原因________________________________________6.实验室制氯气(化学及离子方程式)_______________________________________________________________________________________________7.氯气尾气吸收(化学及离子方程式)____________________________________ ________________________________________________________________________8.将氯气分别通入NaBr和NaI的化学及离子方程式__________________________________,_________________________________________________________________________,_____________________________________ 9.海带提碘:向有碘离子的溶液中加少量稀硫酸酸化,再加入过氧化氢,离子方程式___________________________________________________________。
2020高考化学冲刺 题型训练 填空题—陌生方程式书写专练

三、陌生方程式书写专练1.利用石灰乳和硝酸工业的尾气(含NO 、NO 2)反应,既能净化尾气,又能获得应用广泛的Ca(NO 2)2。
生产中溶液需保持弱碱性,在酸性溶液中Ca(NO 2)2会发生分解,产物之一是NO,反应的离子方程式:________________________________________________________________________ ________________________________________________________________________。
答案 3NO -2+2H +===NO -3+2NO ↑+H 2O2.生产硫化钠大多采用无水芒硝(Na 2SO 4)-碳粉还原法,若煅烧所得气体为等物质的量的CO 和CO 2,写出煅烧时发生反应的化学方程式:________________________________________________________________________ ________________________________________________________________________。
答案 3Na 2SO 4+8C=====高温3Na 2S +4CO ↑+4CO 2↑3.向含碘废液中加入稍过量的Na 2SO 3溶液,将废液中的I 2还原为I -,其离子方程式:________________________________________________________________________ ________________________________________________________________________。
答案 SO 2-3+I 2+H 2O===2I -+SO 2-4+2H +4.向含Cr 2O 2-7的酸性废水中加入FeSO 4溶液,使Cr 2O 2-7全部转化为Cr 3+。
高中化学方程式(填空版)

高中化学方程式一、非金属单质(F2Cl2O2S N2P C Si H)1、氧化性:F2+H2===________________(阴暗处爆炸)F2+Xe(过量)==________________2F2(过量)+Xe==____________ (XeF4是强氧化剂,能将Mn2+氧化为MnO4–) nF2+2M===____________(M表示大部分金属)2F2+2H2O===____________ (水是还原剂)2F2+2NaOH===____________F2+2NaCl===____________F2+2NaBr===____________F2+2NaI===____________7F2(过量)+I2===___________F2+Cl2(等体积)=== ____________ (ClF属于类卤素:ClF+H2O==HF+HClO )3F2(过量)+Cl2===____________ (ClF3+3H2O==3HF+HClO3 )Cl2+H2____________ (将H2在Cl2点燃;混合点燃、加热、光照发生爆炸) 3Cl2+2P____________Cl2+PCl3____________Cl2+2Na____________3Cl2+2Fe____________Cl2+Cu____________Cl2+2FeCl2===____________ (在水溶液中:Cl2+2Fe2+===2Fe3++3Cl-)Cl2+2NaBr===____________Cl2+2Br-=____________Cl2+2KI===____________Cl2+2I-=____________3Cl2(过量)+2KI+3H2O===____________3Cl2+I–+3H2O=____________–5Cl2+I2+6H2O===____________5Cl2+I2+6H2O=____________Cl2+Na2S===____________Cl2+S2–=____________Cl2+H2S===____________ (水溶液中:Cl2+H2S=2H++2Cl–+S↓)Cl2+SO2+2H2O===____________Cl2+SO2+2H2O=____________Cl2+H2O2===____________Cl2+H2O2=____________2O 2+3Fe ____________O 2+K===____________S+H 2____________ 2S+C ____________ S+Zn ____________S+Fe ____________ (既能由单质制取,又能由离子制取) S+2Cu ____________ (只能由单质制取,不能由离子制取) 3S+2Al ____________ (只能由单质制取,不能由离子制取)N 2+3H 2____________N 2+3Mg ____________N 2+3Ca ____________ N 2+3Ba ____________ N 2+6Na ____________ N 2+6K ____________ N 2+6Rb ____________ N 2+2Al____________P 4+6H 2____________ P+3Na ____________2P+3Zn ____________ H 2+2Li ____________ 2、还原性 S+O 2____________S+H 2SO 4(浓) ____________ S+6HNO 3(浓) ________________________S+4H ++6==________________________ 3S+4HNO 3(稀)________________________3S+4H ++43NO ________________________N 2+O 2 ____________4P+5O 2____________ (常写成P 2O 5)2P+3X 2____________(X 表示F 2,Cl 2,Br 2)PX 3+X 2 ____________ P 4+20HNO 3(浓) ________________________ C+2F 2____________C+2Cl 2____________C+O 2(足量)____________催化剂 高温高压2C+O2(少量)____________C+CO2____________C+H2O____________ (生成水煤气)2C+SiO2____________ (制得粗硅)Si(粗)+2Cl2____________ (SiCl4+2H2===Si(纯)+4HCl)Si(粉)+O2____________Si+C____________ (金刚砂)Si+2NaOH+H2O==____________________________________Si+2OH +H2O=________________________3、歧化反应Cl2+H2O==____________(加碱或光照促进歧化)Cl2+2NaOH==________________________Cl2+2Ca(OH)2==________________________3Cl2+6KOH(浓)_______________________3S+6NaOH________________________4P+3KOH(浓)+3H2O==____________________________________11P+15CuSO4+24H2O==________________________3C+CaO____________3C+SiO2____________二.金属单质(Na Mg Al Fe Cu)的还原性2Na+H2____________4Na+O2==____________ 2Na2O+O2 ____________2Na+O2____________ 2Na+S==____________(爆炸)2Na+2H2O==____________2Na+2H2O=________________________2Na+2NH3==____________2Na+2N H3=________________________4Na+TiCl4____________Mg+Cl2____________Mg+Br2____________2Mg+O2____________Mg+S____________2Cu+S____________ (Cu2S只能由单质制备)Mg+2H2O____________2Mg+TiCl4____________ Mg+2RbCl____________2Mg+CO2____________2Mg+SiO2____________Mg+H2S==____________Mg+H2SO4==____________(Mg+2H+=Mg2++H2↑)2Al+3Cl2____________4Al+3O2===____________ (常温生成致密氧化膜而钝化,在氧气中燃烧)4Al(Hg)+3O2+2xH2O===____________(铝汞齐)4Al+3MnO2____________ 2Al+Cr2O3____________ (铝热反应)2Al+Fe2O3____________2Al+3FeO____________2Al+6HCl===____________2Al+6H+=____________2Al+3H2SO4===____________2Al+6H+=____________2Al+6H2SO4(浓)=== ______________________ (Al,Fe在冷,浓的H2SO4,HNO3中钝化)Al+4HNO3(稀)=== _______________________ Al+4H++NO3–=______________2Al+2NaOH+2H2O===____________________2Al+2OH–+2H2O=____________2Fe+3Br2===________3Fe+2O2 __________2Fe+O2___________ (炼钢过程)Fe+I2____________Fe+S____________ (FeS既能由单质制备,又能由离子制备)3Fe+4H2O(g)____________Fe+2HCl===____________ Fe+2H+=____________Fe+CuCl2===____________Fe+Cu2+=____________Fe+SnCl4===________________(铁在酸性环境下不能把四氯化锡完全还原为单质锡)Fe+SnCl2==____________Fe+Sn2+=______________________三.非金属氢化物(HF HCl H2O H2S NH3) 金属氢化物(NaH)1、还原性:4HCl(浓)+MnO2________________________4H++2Cl–+MnO2________________________4HCl(浓)+PbO2________________________4H++2Cl–+PbO2________________________4HCl(g)+O2____________16HCl+2KMnO4===________________________16 H++10Cl-+2MnO4–=________________________6HCl+KClO3==________________________6H++5Cl–+ClO3–=________________________14HCl+K2Cr2O7===________________________14H++6Cl–+Cr2O72–=________________________2H2O+2F2===________________________2HCl+F2=____________ (F2气与HCl、HBr、HI、H2S、NH3气体不能共存)2HBr+Cl2=____________ (Cl2气与HBr、HI、H2S、NH3气体不能共存)2H2S+3O2(足量)____________ 2H2S+O2(少量)____________2H2S+SO2===____________H2S+H2SO4(浓)=== ____________________3H2S+2HNO3(稀)=== ____________3H2S+2H++2NO3–===_______________________5H 2S+2KMnO 4+3H 2SO 4===______________________5H 2S+2MnO 4–+6H +===_______________________ 3H 2S+K 2Cr 2O 7+4H 2SO 4===________________________3H 2S+Cr 2O 72–+8H +===_______________________ H 2S+4Na 2O 2+2H 2O===_______________________H 2S+4Na 2O 2+2H 2O===_______________________ 2NH 3+3CuO_______________________2NH 3+3Cl 2===_______________________ 8NH 3+3Cl 2===_______________________ NH 3+NaNO 2+HCl==_______________________NH 3+NO 2–+H +=_______________________ 4NH 3+3O 2(纯氧)____________4NH 3+5O 2________________4NH 3+6NO===_______________________ (用氨清除NO) NaH+H 2O===_______________________ (生氢剂)NaH+H 2O=_______________________ 4NaH+TiCl 4_____________CaH 2+2H 2O=_______________________2、酸性:4HF+SiO 2===________________(可测定矿样或钢样中SiO 2的含量,玻璃雕刻) 4HF+Si===_______________________2HF+CaCl 2===_________ H 2S+Fe===_______________________ H 2S+CuCl 2===_______________________ (弱酸制强酸的典型反应)H 2S+Cu 2+=_______________________ H 2S+2AgNO 3===_______________________H 2S+2Ag +=_______________________H 2S+HgCl 2===_______________________H 2S+Hg 2+=_______________________H 2S+Pb(NO 3)2===_______________________ (铅试纸检验空气中H 2S)H 2S+Pb 2+=_______________________H 2S+2Ag===_______________________ (银器在空气中变黑的原因)2NH 3(液)+2Na==_______________________ (NaNH 2+H 2O===NaOH+NH 3↑) 3、NH 3的碱性:NH 3+HX===_______________________ (X :F 、Cl 、Br 、I 、S) NH 3+HNO 3===___________ NH 3+H +=_____________ 2NH 3+H 2SO 4===_______________________ NH 3+H +=___________NH 3+NaCl+H 2O+CO 2===_____________(侯德榜制碱:用于工业制备小苏打,苏打) NH 3+H 2S==_________ NH 3+H 2S=_______________________ 4、不稳定性: 2HF________________2HCl_____________ 2H 2O_______ 2H 2O 2===____________ H 2S____________2NH 3____________2HI____________催化剂△催化剂四.非金属氧化物(SO 3、SO 2、N 2O 、NO 、N 2O 3、NO 2、N 2O 4、N 2O 5、CO 、CO 2、SiO 2、P 2O 3、P 2O 5、Cl 2O 、Cl 2O 3、Cl 2O 5、Cl 2O 7、ClO 2)1、低价态的还原性:(SO2、CO 、NO)2SO 2+O 2+2H 2O===____________(这是SO 2在大气中缓慢发生的环境化学反应) 2SO 2+O 2____________ SO 2+NO 2=== ____________SO 2+Cl 2+2H 2O===___________ Cl 2+SO 2+2H 2O=____________ SO 2+Br 2+2H 2O===____________ Br 2+SO 2+2H 2O===_________________ SO 2+I 2+2H 2O===____________ I 2+SO 2+2H 2O=____________ 2NO+O 2===____________NO+NO 2+2NaOH===____________(用于制硝酸工业中吸收尾气中的NO 和NO 2)NO+NO 2+2OH –=____________ 2CO+O 2____________CO+CuO____________ 3CO+Fe 2O 3____________ CO+H 2O____________2、氧化性:SO 2+2H 2S===____________ SO 3+2KI____________NO 2+2KI+H 2O===____________(不能用淀粉KI 溶液鉴别溴蒸气和NO 2) 4NO 2+H 2S===____________ 2NO 2+Cu ____________N 2O+Zn____________CO 2+2Mg ____________ (CO 2不能用于扑灭由Mg,Ca,Ba,Na,K 等燃烧的火灾) SiO 2+2H 2____________ S iO 2+2Mg____________3、与水的作用:SO 2+H 2O===____________SO 3+H 2O===____________ SO 3+H 2O=____________ 3NO 2+H 2O===____________ (NO 2不是硝酸的酸酐) N 2O 5+H 2O===____________ N 2O 5+H 2O=____________ P 2O 5+H 2O(冷水)=== ____________P 2O 5+3H 2O(热水)=== ____________ (P 2O5极易吸水,可作气体干燥剂) P 2O 5+3H 2SO 4(浓)=== ____________ CO 2+H 2O===____________ Cl 2O+H 2O==____________Cl 2O 7+H 2O==____________ Cl 2O 7+H 2O=____________ 4、与碱性物质的作用:SO 2+2NH 3+H 2O===____________SO 2+(NH 4)2SO 3+H 2O===____________催化剂 加热催化剂 加热2NH4HSO3+H2SO4===_______________ (硫酸工业尾气处理先用氨水吸收,再用H2SO4) SO2+Ca(OH)2===____________ (不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别) SO3+MgO===____________SO3+Ca(OH)2===____________CO2+NH3+H2O===____________CO2+2NH3(过量)+H2O===____________(NH4)2CO3_______________CO2+2NH3____________ (工业制取尿素)CO2+2NaOH(过量)== ____________ 2OH-+CO2=____________CO2(过量)+NaOH==____________ OH-+CO2=____________CO2+Ca(OH)2(过量)== ____________Ca2++2OH+CO2=____________2CO2(过量)+Ca(OH)2==____________OH―+CO2=____________CO2+CaCO3+H2O==____________CO2+CaCO3+H2O=____________CO2(不足)+2NaAlO2+3H2O===____________CO2+3H2O+AlO2–=____________CO2(足)+NaAlO2+2H2O===____________CO2+2H2O+AlO2–=____________CO2+C6H5ONa+H2O===____________CO2+C6H5O―+H2O=____________SiO2+CaO__________________ (炼钢造渣)SiO2+2NaOH===__________________ (常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3_________________ (制取玻璃)SiO2+CaCO3__________________ (制取玻璃)2NO2+2NaOH===__________________2NO2+2OH―===__________________NO+NO2+2NaOH===__________________ (制取硝酸工业尾气吸收)NO+NO2+2OH―===__________________五.金属氧化物1、低价态的还原性:△6FeO+O 2__________________FeO+4HNO 3===________________________FeO+4H++NO3―=________________________2、氧化性:Na2O2+2Na____________(此反应用于制备Na2O)MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al.一般通过电解制Mg和Al.Fe2O3+3H2__________________ (制还原铁粉)Fe3O4+4H2__________________CuO+H2__________________2Fe3O4+16HI==__________________2Fe3O4+16H++4I―=__________________Fe2O3+Fe __________________ (炼钢过程中加入废钢作氧化剂)FeO+C__________________ (高温炼钢调节C含量)2FeO+Si__________________ (高温炼钢调节Si含量)3、与水的作用:Na2O+H2O==__________________Na2O+H2O=__________________2Na2O2+2H2O===__________________2Na2O2+2H2O=__________________(此反应分两步:Na2O2+2H2O===_______________;2H2O2===________________ H2O2的制备可利用类似的反应:BaO2+H2SO4(稀)=== ________________________)MgO+H2O===________________________ (缓慢反应)4、与酸性物质的作用:Na2O+SO3==____________Na2O+CO2==____________MgO+SO3===______________Na2O+2HCl==__________________Na2O+2H+=__________________2Na2O2+2CO2==__________________Na2O2+H2SO4(冷,稀)=== ________________________MgO+H2SO4===__________________MgO+2H+=__________________Al2O3+3H2SO4===__________________Al2O3+6H+=__________________Al2O3+2NaOH===__________________(Al2O3两性氧化物)Al2O3+2OH―=__________________FeO+2HCl===__________________FeO+2H+=__________________Fe2O3+6HCl===__________________Fe2O3+6H+=__________________Fe3O4+8HCl===________________________Fe3O4+8H+=________________________六.含氧酸1、氧化性:4HClO3+3H2S===________________________ClO3–+3H2S=____________HClO3+HI===__________________ClO3–+I–=__________________3HClO+HI===__________________3HClO+I-=________________________HClO+H2SO3===__________________HClO+H2SO3=________________________HClO+H2O2===__________________HClO+H2O2=__________________(氧化性:HClO>HClO2>HClO3>HClO4,但浓,热的HClO4氧化性很强)2H2SO4(浓)+C____________2H2SO4(浓)+S____________H2SO4+Fe(Al)室温下钝化6H2SO4(浓)+2Fe________________________ 2H2SO4(浓)+Cu__________________H2SO4(浓)+2HBr===___________________ (不能用浓硫酸与NaBr制取HBr) H2SO4(浓)+2HI===__________________ (不能用浓硫酸与NaI制取HI)H2SO4(稀)+Fe===__________________2H++Fe=________________________H2SO3+2H2S===__________________4HNO3(浓)+C↑________________________6HNO3(浓)+S________________________5HNO3(浓)+P________________________5HNO3(稀)+3P+2H2O________________________5H++5NO3-+3P+2H2O____________6HNO3(浓足)+Fe===________________________4HNO3(浓)+Fe(足)=== _______________(先得Fe3+,在Fe过量时再生成Fe2+的盐) 4HNO3(稀足)+Fe===________________________4H++NO3-+Fe=________________________30HNO3+8Fe===________________________30 H++6NO3–+8Fe=________________________36HNO3+10Fe===________________________36H++6NO3–+10Fe===________________________30HNO3+8Fe===________________________30 H++3NO3–+8Fe===________________________4Zn+10HNO3(稀)== ________________________4Zn+10H++2NO3–===________________________4Zn+10HNO3(稀)== ________________________4Zn+10H++NO3–=________________________2、还原性:H2SO3+X2+H2O===__________________ (X表示Cl2,Br2,I2)H2SO3+X2+H2O=________________________2H2SO3+O2==__________________2H2SO3+O2=__________________H2SO3+H2O2===________________________H2SO3+H2O2=________________________5H2SO3+2KMnO4===________________________5H2SO3+2MnO4–=________________________H2SO3+2FeCl3+H2O===________________________H2SO3+2Fe3++H2O=________________________3、酸性:H2SO4(浓)+CaF2 __________________ (不挥发性酸制取挥发性酸)H2SO4(浓)+NaCl__________________(不挥发性酸制取挥发性酸)H2SO4(浓)+2NaCl______________________(不挥发性酸制取挥发性酸)H2SO4(浓)+NaNO3__________________(不挥发性酸制取挥发性酸)3H2SO4(浓)+Ca3(PO4)2__________________ (强酸制弱酸酸)2H2SO4(浓)+Ca3(PO4)2__________________(工业制磷肥)3HNO3+Ag3PO4==__________________3H++Ag3PO4=________________________2HNO3+CaCO3==________________________2H++CaCO3=________________________(用HNO3和浓H2SO4不能制备H2S,HI,HBr,SO2等还原性气体)4H3PO4+Ca3(PO4)2 __________________(重钙)H3PO4(浓)+NaBr _______________ (不挥发性酸制取挥发性酸,磷酸是非氧化性酸) H3PO4(浓)+NaI__________________4、不稳定性:2HClO__________________ (保存在棕色瓶中)4HNO3__________________ (保存在棕色瓶中)H2SO3__________________ (在加热或酸性条件下分解)H2CO3__________________ (在加热或酸性条件下分解)H4SiO4__________________ H2SiO3 __________________H2S2O3(在加热或酸性条件下分解)七.碱1、低价态的还原性:4Fe(OH)2+O2+2H2O===________________________2、与酸性物质的作用:2NaOH+SO2(少量)== ________________________OH–+SO2=________________________NaOH+SO2(足)== ________________________OH-+SO2(足)= ________________________2NaOH+SiO2==________________________OH-+SiO2=________________________2NaOH+Al2O3==________________________2OH-+Al2O3=________________________2KOH+Cl2==________________________Cl2+2OH–=________________________NaOH+HCl==________________________H++OH =________________________NaOH+H2S(足)== ________________________OH–+H2S=________________________2NaOH+H2S(少量)== ________________________2OH–+H2S=________________________3NaOH+AlCl3==________________________3OH–+Al3+=________________________NaOH+Al(OH)3==________________________ (AlCl3和Al(OH)3哪个酸性强?)OH–+Al(OH)3=________________________Ca(OH)2+2NH4Cl________________________ (实验室制NH3)NaOH+NH4Cl________________________Mg(OH)2+2NH4Cl==________________________ (Al(OH)3+NH4Cl不溶解)Ba(OH)2+H2SO4==________________________2H++2OH–+Ba2++SO42–=______________________________3、不稳定性:Mg(OH)2____________2Al(OH)3____________2Fe(OH)3___________Cu(OH)2____________2AgOH==____________八.盐1、氧化性:(在水溶液中)2FeCl3+Fe==______________ 2Fe3++Fe=__________________2FeCl3+Cu===____________ (用于雕刻铜线路版) 2Fe3++Cu=__________________ 2FeCl3+Zn(少量)=== ____________2Fe3++Zn=__________________FeCl3+Ag===____________2Fe3++Cl-+2Ag=_______________Fe2(SO4)3+2Ag===__________________(较难反应) Fe(NO3)3+Ag不反应2FeCl3+H2S===__________________2Fe3++H2S=__________________2FeCl3+2KI===__________________ 2Fe3++2I-=__________________FeCl2+Mg===__________________Fe2++Mg=__________________NaNO2+NH4Cl==__________________ (实验室制氮气)NH4++NO2-=______________ 2、还原性:2FeCl2+3Cl2===____________ (在水溶液中不需加热)2Fe2++3Cl2=__________________3Na2S+8HNO3(稀)=== ________________________3S2-+8H++2NO3-=________________________3Na2SO3+2HNO3(稀)=== ________________________3SO32-+2H++2NO3-=________________________2Na2SO3+O2===__________________ (Na2SO3在空气中易变质)Na2SO3+S________________________Na2S+Cl2==______________________ (在水溶液中) S2-+Cl2=__________________ 3、与碱性物质的作用:Ca(OH)2+CuSO4==________________(波尔多液)MgCl2+2NH3·H2O==________________________Mg2++2NH3·H2O=________________________AlCl3+3NH3·H2O===________________________Al3++3NH3·H2O=________________________FeCl3+3NH3·H2O===________________________Fe3++3NH3·H2O=________________________CuSO4+2NH3·H2O(不足)== ________________________Cu2++2NH3·H2O=________________________Cu(OH)2+4NH3·H2O=________________________Cu(OH)2+4NH3·H2O=________________________ 铜氨溶液CuSO4+4NH3·H2O(足)== __________________总方程式Cu2++4NH3·H2O=________________________铜氨溶液AgNO3+NH3·H2O==__________________2AgOH=__________________ Ag2O+4NH3·H2O=________________________银氨溶液AgNO3+2NH3·H2O==________________________Ag++2NH3·H2O=________________________ 总方程式ZnSO4+2NH3·H2O(不足)== ________________________Zn2++2NH3·H2O=________________________Zn(OH)2+4NH3·H2O=________________________ZnSO4+4NH3·H2O(足)== ________________________Zn2++4NH3·H2O=________________________总方程式4、与酸性物质的作用:强酸制弱酸,或不挥发性酸制挥发性酸Na3PO4+2HCl===__________________PO43-+2H+=__________________Na2HPO4+HCl===__________________ HPO42-+H+=__________________NaH2PO4+HCl===__________________H2PO4-+H+=__________________Na2CO3+HCl===__________________CO32-+H+=__________________NaHCO3+HCl===__________________HCO3-+H+=__________________3Na2CO3+2AlCl3+3H2O==______________________(物质之间的双水解反应) 3CO32-+2Al3++3H2O=________________________3Na2CO3+2FeCl3+3H2O===__________________ (物质之间的双水解反应) 3CO32-+2Fe3++3H2O=________________________3NaHCO3+AlCl3===________________________(物质之间的双水解反应) 3HCO3-+Al3+=________________________3NaHCO3+FeCl3===________________________(物质之间的双水解反应) 3HCO3-+Fe3+=________________________3Na2S+Al2(SO4)3+6H2O===________________________(物质之间的双水解反应) 3S2-+2Al3++3H2O=________________________3NaAlO2+AlCl3+6H2O==________________________(物质之间的双水解反应) 3AlO2-+Al3++6H2O=________________________3NaAlO2+FeCl3+6H2O==________________________3AlO2-+Fe3++6H2O=________________________NaAlO2+NH4Cl+2H2O==________________________AlO2-+NH4++2H2O=________________________Na2CO3+H2O+CO2===________________________CO32-+H2O+CO2=________________________Na2CO3+H2O+2SO2==________________________(1:2)CO32-+H2O+2SO2=________________________2Na2CO3(足)+H2O+SO2==__________________ (CO2中的SO2不能用Na2CO3洗气) 2CO32-+H2O+SO2=__________________(2:1)Na2CO3+SO2==________________________(1:1)CO32-+SO2=________________________Na H CO3+SO2===__________________ (CO2中的SO2可能用NaHCO3洗气) 2HCO3-+SO2=________________________2Na H CO3+SO2==________________________2HCO3-+SO2=________________________Na2SiO3+2HCl===________________或Na2SiO3+2HCl+H2O===_________________ SiO32-+2H+=________________或SiO32-+2H++H2O=__________________Na2SiO3+CO2+2H2O===__________________SiO32-+CO2+2H2O=__________________5、盐与盐复分解反应Na2SO4+BaCl2==________________________ (沉淀不溶于盐酸、硝酸)SO32-+Ba2+=________________________Na2SO3+BaCl2==______________ (沉淀溶于盐酸,在硝酸中生成新的沉淀,沉淀不消失) SO32-+Ba2+=________________________Na2CO3+BaCl2==________________________ (沉淀溶于盐酸、沉淀消失)CO32-+Ba2+=________________________Na2CO3+CaCl2==________________________ (NaHCO3不反应)CO32-+Ca2+=________________________AgNO3+NaCl==________________ Ag++Cl-=____________AgNO3+NaBr==_________________ Ag++Br-=____________AgNO3+KI==__________________ Ag++I-=____________3AgNO3+Na3PO4==__________________3Ag++PO43-=____________CuSO4+Na2S==__________________Cu2++S2-=____________FeCl3+3KSCN==__________________Fe3++3SCN-=__________________ (血红色,用于Fe3+的特性检验)6、不稳定性:Na2S2O3+H2SO4===________________________S2O32-+2H+=________________________NH4Cl__________________NH4I__________________2HI____________NH4I__________________NH4HCO3__________________2KNO3__________________2Cu(NO3)3__________________2AgNO3__________________ (保存在棕色瓶中)5NH4NO3__________________10NH4NO3________________________ (硝酸铵爆炸反应)2KMnO4________________________2KClO3__________________2NaHCO3________________________Ca(HCO3)2__________________CaCO3__________________MgCO3__________________九、电离方程式1.酸的电离(H2SO4、HNO3、HCl、HBr、HI、H3PO4、HF、H2SO3、CH3COOH、H2CO3、H2S、HNO2、C6H5OH、HCN、HClO)H2SO4==__________________或:H2SO4+2H2O==__________________HNO3==_________________或:HNO3+H2O==__________________ (以下雷同) HCl==__________________HBr==__________________HI==__________________H3PO4____________H2PO-4__________ HPO-24____________HF____________H2SO3____________HSO-3____________CH3COOH____________H2CO3____________ -3HCO____________H2S____________-HS____________HNO2____________C6H5OH____________ (苯酚不是酸,显酸性)HCN____________HClO____________H2O____________2H2O____________2、碱的电离(NaOH、KOH、Ba(OH)2、Mg(OH)2、Al(OH)3、NH3·H2O)NaOH==____________KOH==____________Ba(OH)2==____________Mg(OH)2____________Al(OH)3____________酸式电离:Al(OH)3____________NH3·H2O____________Ca(OH)2==____________ (澄清石灰水)Ca(OH)2____________ (石灰悬浊液)3、盐的电离(NaCl、Na2SO4、NaHSO4、Na2SO3、NaHSO3、MgSO4、CaSO4、Al2(SO4)3、CuSO4、AlCl3、AgNO3、CH3COONa、NH4NO3、FeCl3、Na2CO3、NaHCO3、Na2S、NaHS、NaH2PO4、Na2HPO4、Na3PO4、KI、NaBr、NaClO、AgCl、CaCO3)NaCl==____________Na2SO4==____________NaHSO4==____________Na2SO3==____________NaHSO3==____________ (错误书写:NaHSO3==Na++H++SO42-)MgSO4==____________Al2(SO4)3==____________CuSO4==____________AlCl3==____________AgNO3==__________CH3COONa==____________NH4NO3==____________FeCl3==____________Na2CO3==____________NaHCO3==____________ (错误书写:NaHCO3==Na++H++-2CO)3Na2S==____________NaHS==____________ (错误书写:NaHS==Na++H+-2S)NaH2PO4==____________Na2HPO4==____________ (错误书写:Na2HPO4==2Na++H++PO-3)4Na3PO4==____________KI==____________NaBr==____________NaClO==____________AgCl____________ (难溶、微溶物质在水中发生微弱电离)CaCO3____________ (错误书写:CaCO3==Ca2++CO-2)3)CaSO4____________ (错误书写:CaSO4==Ca2++SO-243、熔融电离NaCl____________MgCl2____________Na2O____________Al2O3____________十、水解反应1、单水解---可逆水解NH4Cl+H2O____________NH4++H2O____________FeCl3+3H2O____________ Fe3++3H2O____________AlCl3+3H2O____________Al3++3H2O____________CuSO4+2H2O____________ (金属活动顺序表中Mg2+以后的阳离子均水解) NaHCO3+H2O____________ (NaHSO4不水解,NaHSO3电离大于水解)Na2CO3+H2O____________ CO32-+H2O____________NaHCO3+H2O____________ (第一步远远大于第二步,二步不能叠加)Na2SO3+H2O____________SO32-+H2O____________NaHSO3+H2O____________ (第一步远远大于第二步,二步不能叠加)HSO3-+H2O____________Na2S+H2O____________S2-+H2O____________NaHS+H2O____________ (第一步远远大于第二步,二步不能叠加)HS-+H2O____________Na3PO4+H2O________________PO43-+H2O________________Na2HPO4+H2O________________HPO42-+H2O________________ NaH2PO4+H2O________________ H2PO4-+H2O________________ CH3COONa+H2O________________ CH3COO-+H2O________________ C6H5ONa+H2O________________C6H5O-+H2O________________ 2、双水解CH3COONH4+H2O________________NH4F+H2O________________Al2S3+6H2O==________________ (隔绝空气,密封保存)Mg3N2+6H2O==________________ (隔绝空气,密封保存)Na3P+3H2O==________________ (隔绝空气,密封保存)Zn3P2+6H2O==________________ (Zn3P2一种老鼠药,PH3剧毒神经毒剂)CaC2+2H2O==________________ (隔绝空气,密封保存)C2H5ONa+H2O==________________十一、电解及电极方程式1、电解质溶液在惰性电极条件下,或阴极是较活泼金属电极,阳极是惰性电极条件下的电解2NaCl+2H2O____________(-)2H2O+2e-==____________ 或2H++2e-===____________(+)2Cl--2e-==____________2Cl-+2H2O____________CuCl2____________(-)Cu2++2e-==____________(+)2Cl- -2e-==____________Cu2++2Cl-____________2CuSO4+2H2O____________(-)2Cu2+ + 4e-==____________(+)2H2O - 4e-==____ ___或:4OH--4e-==______ 4H2O____________2Cu2++2H2O ____________2H2O____________(-) 4H++4e-==____________(+)4OH--4e-==____________中性电解4H2O____________-2H2O____________酸性水解:(-) 4H++4e-==____________(+)2H2O-4e-==____________4OH--4e-==____________2H2O____________碱性水解:(-) 4H2O+4e-==____________ 或:4H++4e-==____________(+)4OH--4e-==____________2H2O____________2、电镀:镀件作阴极,被镀金属作阳极,被镀金属的含氧酸盐作电解质溶液镀铜:CuSO4电镀液镀件(-) Cu2++2e-==________________纯铜(+) Cu–2e-==________________镀锌:ZnSO4电镀液镀件(-) Zn2++2e-==________________纯锌(+) Zn–2e-==________________镀银:AgNO3电镀液镀件(-) Ag++e-==________________纯银(+) Ag–e-==________________镀镍:NiSO4电镀液镀件(-) Ni2++2e-==________________纯镍(+) Ni–2e-==________________3、熔融状态下的电解:2NaCl(熔融)________________(-)2Na++2e-==________________(+)2Cl--4e-==________________2Na++2Cl-(熔融)________________2Al2O3(熔融)________________(-)4Al3++12e–==________________(+)6O2--12e-==________________4Al3+ +6O2-________________NaHF2(熔融)________________(-)2H++2e–==________________(+)2F--2e-==________________2HF________________十二、原电池反应X—Y(电解质溶液) 或X//电解质溶液//YZn极(-) Zn–2e-==________________ (氧化反应)Cu极(+) 2H++2e-==________________ (还原反应)离子方程式Zn+2H+==________________化学方程式Zn+H2SO4=________________Fe极(-) Fe–2e-==________________ (氧化反应)C极(+) 2H++2e-==________________ (还原反应)离子方程式Fe+2H+==________________ (析氢腐蚀)Fe极(-) 2Fe–4e-==________________ (氧化反应)C极(+) O2+2H2O+4e-==________________ (还原反应)化学方程式2Fe+O2+2H2O==________________ (吸氧腐蚀)4Fe(OH)2+O2+2H2O==________________铁锈的生成过程)Al极(-) 4Al–12e==________________(氧化反应)Ni极(+)3O2+6H2O+12e-==________________(还原反应)化学方程式4Al+3O(海洋灯标电池)Cl+H2O==________________________4Zn极(-) Zn–2e==____________________ (氧化反应)Cu极(+) 2MnO2+2H++2e-==________________(还原反应)化学方程式Zn+2NH4Cl+2MnO2=____________________Pb极(-) Pb+H2SO4–2e-==________________ (氧化反应)PbO2极(+)PbO2+H2SO4+2H++2e-==____________ (还原反应)化学方程式Pb+PbO2+2H2SO4==____________________Pb—PbO2(浓硫酸)充电Pb极(-) PbSO4+2H+–2e-== ________________ (还原反应)PbO2极(+)PbSO4+2H2O+2e-==________________ (氧化反应)化学方程式2PbSO4+2H2O==____________________(-) Li–e==_______________(氧化反应)(+) MnO2+Li++e-==________________(还原反应)化学方程式Li+MnO2==LiMnO2Zn极(-) Zn+2OH––2e-==________________ (氧化反应)Cu极(+) Ag2O+H2O+2e-==________________(还原反应)化学方程式Zn+Ag2O ==________________Pt极(-) 2H2+4-OH–4e-==______________ (氧化反应)Pt极(+) O2+2H2O+4e-==________________(还原反应)化学方程式2H2+O2==____________________Pt极(-) CH4+10-OH–8e-==________________ (氧化反应)Pt极(+) 2O2+4H2O+8e-==________________(还原反应)化学方程式CH4+2O2+2NaOH==____________________十三、其他方程式2、Al4C3+12H2O=___________________________ (碳化物氮化物的水解)3、3K2MnO4+2CO2=________________________4、AgNO3+NaCl=________________________2AgCl=________________________ (见光或受热)5、2Br2+3Na2CO3+H2O=________________________Br2+NaHCO3=________________________6、2FeCl3+SO2+2H2O=________________________BaCl2+H2SO4=________________________7、Ca(H2PO4)2+2Ca(OH)2=________________________8、4KO2+2CO2=________________________9、SOCl2+H2O=________________________10、HIO+HCl=________________________HIO+NaOH=________________________11、NH2Cl+H2O=________________________12、Cu2(OH)2CO3+4CH3COOH=________________________(CH3COO)2Cu+Fe=________________________14、3BrF3+5H2O=________________________15、As2O3+6Zn+12HCl=________________________16、3As2S3+28HNO3+4H2O=________________________17、Na2SO3+SO2+H2O=_______________△2NaHSO3________________________18、P2O5+2NaOH=________________________P2O5+6NaOH=________________________19、3Na2S+As2S5=__________________Na2S+SnS2=________________________20、(CN)2+2H2S→________________________21、(SCN)2+2NaOH=________________________22、HCl+KOH=____________________2HI+PbO=________________________29、2S2―+SO32―+6H+=________________________30、SiO32―+2NH4+=________________________31、3H2O2+2CrO2―+2OH―=________________________32、Al3++2SO42―+2Ba2++4OH―=________________________33、Fe2O3+6H++2I―=________________________34、Al3++3HCO3―=________________________35、2H++[Ag(NH3)2]+=________________________36、HS―+OH―=________________________37、AsO43―+2I―+2H+=________________________38、Cr2O72―+6Fe2++14H+=________________________。
第五单元 化学方程式填空练习
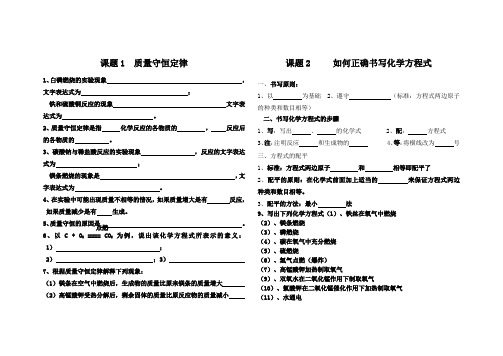
课题1 质量守恒定律1、白磷燃烧的实验现象,文字表达式为;铁和硫酸铜反应的现象文字表达式为。
2、质量守恒定律是指化学反应的各物质的,反应后的各物质的。
3、碳酸钠与稀盐酸反应的实验现象,反应的文字表达式为;镁条燃烧的现象是,文字表达式为。
4、在实验中可能出现质量不相等的情况,如果质量增大是有反应,如果质量减少是有生成。
5、质量守恒的原因是。
6、以 C + O2==== CO2为例,说出该化学方程式所表示的意义:1);2);3)7、根据质量守恒定律解释下列现象:(1)镁条在空气中燃烧后,生成物的质量比原来镁条的质量增大(2)高锰酸钾受热分解后,剩余固体的质量比原反应物的质量减小课题2 如何正确书写化学方程式一、书写原则:1、以为基础2、遵守(标准:方程式两边原子的种类和数目相等)二、书写化学方程式的步骤1、写:写出、的化学式2、配:方程式3、注:注明反应和生成物的4、等:将横线改为号三、方程式的配平1、标准:方程式两边原子和相等即配平了2、配平的原则:在化学式前面加上适当的来保证方程式两边种类和数目相等。
3、配平的方法:最小法9、写出下列化学方程式(1)、铁丝在氧气中燃烧(2)、镁条燃烧(3)、磷燃烧(4)、碳在氧气中充分燃烧(5)、硫燃烧(6)、氢气点燃(爆炸)(7)、高锰酸钾加热制取氧气(9)、双氧水在二氧化锰作用下制取氧气(10)、氯酸钾在二氧化锰催化作用下加热制取氧气(11)、水通电点燃课题3 利用化学方程式的简单计算一、依据:利用化学方程式能反映物质间的比,且比呈正比例关系。
二、步骤:①设;②根据题意写出;③根据化学方程式找出量与量的质量比;④列出,并求出;⑤答注意:①由于方程式只能反映物质间的质量比,因此代入方程式中的各个量必须是。
②由于方程式中各物质是纯净物,因此代入方程式中的量必须是的质量。
③单位必须统一。
例题:加热6克高锰酸钾可以得到氧气多少克?(1)设未知量(2)写方程式并配平(3)写出相关物质的相对分子质量和已知量、未知量(4)列比例式、求解(5)简明作答练习:1、2.4克镁完全燃烧能得到多少克氧化镁?2 10克水通电可制得氢气多少g?氧气多少g?3 把干燥纯净的KClO3和MnO2的混合物13.32克,加热至不再产生气体为止,称量剩余物质量为9.48克,求①生成氧气的质量;②剩余物质各是什么?质量分别是多少克?4、在标准状况下,6.2g磷在氧气中充分燃烧,需要氧气多少克?这些氧气的体积是多少升?能生成P2O5多少克?(已知标况下ρO2=1.43g/L)5、含锌65%的锌粒200g,与足量的稀H2SO4反应,可制得H2多少升?(标况下2Hρ=0.09g/L)6、一定质量的KClO3和MnO2的混合物中,MnO2的质量分数为20%,加热后,剩余的固体混合物中MnO2的质量分数升高至25%,则KClO3的分解率是多少?。
高中化学方程式配平100题

高中化学方程式配平100题在高中化学学习过程中,化学方程式的配平是一个基础且重要的环节。
正确配平方程式可以帮助我们理解化学反应的过程,掌握化学方程式的规律性。
下面就为大家提供100道高中化学方程式配平的练习题,希望对大家的学习有所帮助。
1. H₂ + O₂ → H₂O2. Na + Cl₂ → NaCl3. Fe + O₂ → Fe₂O₃4. Al + O₂ → Al₂O₃5. Ca + H₂O → Ca(OH)₂ + H₂6. Mg + HCl → MgCl₂ + H₂7. H₂SO₄+ NaOH → Na₂SO₄ + H₂O8. HCl + NaOH → NaCl + H₂O9. S + O₂ → SO₂10. N₂ + H₂ → NH₃11. CO + O₂ → CO₂12. C₃H₈ + O₂ → CO₂ + H₂O13. CH₄ + O₂ → CO₂ + H₂O14. NH₄NO₃ → N₂O + O₂ + H₂O15. FeCl₃ + NaOH → Fe(OH)₃ + NaCl16. Pb(NO₃)₂ + KI → PbI₂ + KNO₃17. AgNO₃+ NaCl → AgCl + NaNO₃18. CuCl₂ + NaOH → Cu(OH)₂ + NaCl19. H₂O₂ → H₂O + O₂20. Fe(NO₃)₃ + NaOH → Fe(OH)₃ + NaNO₃21. Na₂CO₃ + HCl → NaCl + H₂O + CO₂22. H₂SO₄ + Na₂CO₃ → Na₂SO₄ + H₂O + CO₂23. Pb(NO₃)₂ + Na₂SO₄ → PbSO₄ + NaNO₃24. FeCl₃ + NaOH → Fe(OH)₃ + NaCl25. Zn + H₂SO₄ → ZnSO₄ + H₂26. Al + Fe₂O₃ → Al₂O₃ + Fe27. H₂ + N₂ → NH₃28. K + H₂O → KOH + H₂29. BaCl₂ + Na₂SO₄ → BaSO₄ + NaCl30. Mg + Br₂ → MgBr₂31. Fe + CuSO₄ → FeSO₄ + Cu32. Ca(OH)₂ + H₃PO₄ → Ca₃(PO₄)₂ + H₂O33. H₂ + F₂ → HF34. KOH + H₂SO₄→ K₂SO₄ + H₂O35. Al + HCl → AlCl₃ + H₂36. HNO₃ + NaOH → NaNO₃ + H₂O37. Pb(NO₃)₂ + KCl → PbCl₂ + KNO₃38. Zn + HCl → ZnCl₂ + H₂39. H₂O + C → CO + H₂40. CH₄ + Cl₂ → CCl₄ + HCl41. H₃PO₄ + NaOH → Na₃PO₄ + H₂O42. H₂O₂ + HCl → H₂O + Cl₂43. Al + FeCl₃ → AlCl₃ + Fe44. Na + H₂O → NaOH + H₂45. H₂O₂ + KI → KOH + I₂ + H₂O46. Ca + O₂ → CaO47. Na₂CO₃ + HCl → NaCl + H₂O + CO₂48. Na + Br₂ → NaBr49. Ca + HCl → CaCl₂ + H₂50. H₂ + Cl₂ → HCl51. H₂O₂ + KMnO₄ → K₂MnO₄ + O₂ + H₂O52. Mg + Cl₂ → MgCl₂53. C₄H₁₀ + O₂ → CO₂ + H₂O54. NH₄Cl + KOH → NH₃ + KCl + H₂O55. FeSO₄ + NaOH → Fe(OH)₂ + Na₂SO₄56. NH₄NO₃ → N₂O + H₂O57. Al + H₂SO₄ → Al₂(SO₄)₃ + H₂58. Fe + HCl → FeCl₃ + H₂59. O₂ + C₆H₁₂O₆ → CO₂ + H₂O60. NaCl + F₂ → NaF + Cl₂61. Ba + H₂O → Ba(OH)₂ + H₂62. HCl + Ca(OH)₂ → CaCl₂ + H₂O63. Mg + H₂O → MgO + H₂64. Na + Cl₂ → NaCl65. FeCl₃ + NaOH → Fe(OH)₃ + NaCl66. Na₂CO₃ + H₃PO₄ → Na₃PO₄ + H₂CO₃67. H₂O + Na → NaOH + H₂68. Zn + HNO₃ → Zn(NO₃)₂ + N₂O + H₂O69. CuO + H₂ → Cu + H₂O70. Mg + HCl → MgCl₂ + H₂71. Cu + HNO₃ → Cu(NO₃)₂ + NO₂ + H₂O72. NaCl + H₂O₂ → NaClO + HCl + H₂O73. Fe + H₂SO₄ → FeSO₄ + H₂74. H₂ + O₂ → H₂O75. Na + Cl₂ → NaCl76. Fe + O₂ → Fe₂O₃77. Al + O₂ → Al₂O₃78. Ca + H₂O → Ca(OH)₂ + H₂79. Mg + HCl → MgCl₂ + H₂80. H₂SO₄ + NaOH → Na₂SO₄ + H₂O81. HCl + NaOH → NaCl + H₂O82. S + O₂ → SO₂83. N₂ + H₂ → NH₃84. CO + O₂ → CO₂85. C₃H₈ + O₂ → CO₂ + H₂O86. CH₄ + O₂ → CO₂ + H₂O87. NH₄NO₃ → N₂O + O₂ + H₂O88. FeCl₃ + NaOH → Fe(OH)₃ + NaCl89. Pb(NO₃)₂ + KI → PbI₂ + KNO₃90. AgNO₃ + NaCl → AgCl + NaNO₃91. CuCl₂ + NaOH → Cu(OH)₂ + NaCl92. H₂O₂ → H₂O + O₂93. Fe(NO₃)₃ + NaOH → Fe(OH)₃ + NaNO₃94. Na₂CO₃ + HCl → NaCl + H₂O + CO₂95. H₂SO₄ + Na₂CO₃ → Na₂SO₄ + H₂O + CO₂96. Pb(NO₃)₂ + Na₂SO₄ → PbSO₄ + NaNO₃97. FeCl₃ + NaOH → Fe(OH)₃ + NaCl98. Zn + H₂SO₄ → ZnSO₄ + H₂99. Al + Fe₂O₃ → Al₂O₃ + Fe100. H₂ + N₂ → NH₃希望通过这100道方程式配平练习题,大家可以熟练掌握化学方程式配平的方法和技巧,提升自己的化学学习水平。
高中化学方程式配平练习题(含答案)

配平方程式1.下列化学方程式配平正确的是A 2KMnO 4+11H 2S +5H 2SO 4=K 2SO 4+2MnSO 4+13S ↓+16H 2OB 2KMnO 4+8H 2S +4H 2SO 4=K 2SO 4+2MnSO 4+9S ↓+12H 2OC 2KMnO 4+5H 2S +3H 2SO 4=K 2SO 4+2MnSO 4+S ↓+4H 2OD 2KMnO 4+5H 2S +3H 2SO 4=K 2SO 4+2MnSO 4+5S ↓+8H 2O 2.配平下列以KMnO 4为氧化剂的氧化-还原反应(1)KMnO 4+SO 2+H 2O -MnSO 4+K 2SO 4+H 2SO 4(2)KMnO 4+K 2SO 3+H 2O -MnO 2+K 2SO 4+KOH (3)KMnO 4+KNO 2+-MnSO 4+K 2SO 4+KNO 3+H 2O (4)KMnO 4+H 2S +H 2SO 4-K 2SO 4+MnSO 4+S ↓+H 2O(5)KMnO 4+H 2O 2+H 2SO 4-K 2SO 4+MnSO 4+O 2↑+H 2O(6)KMnO 4+HCl -MnCl 2+Cl 2+KCl +H 2O (7)KMnO 4+NaOH +PH 3-K 2MnO 4+Na 2MnO 4+Na 3PO 4+H 2O (8)KMnO 4+FeCl 2+H 2SO 4-K 2SO 4+MnSO 4+Fe 2(SO 4)3+Cl 2+H 2O3.配平下列以Cr (Ⅵ)为氧化剂的氧化-还原反应(1)K 2Cr 2O 7+C +H 2SO 4-K 2SO 4+Cr 2(SO 4)3+CO 2+H 2O(2)KI +K 2CrO 4+HCl -CrCl 3+KCl +I 2+H 2O (3)K 2Cr 2O 7+Fe 3O 4+H 2SO 4-Cr 2(SO 4)3+Fe 2(SO 4)3+K 2SO 4+H 2O (4)K 2Cr 2O 7+KI +-CrPO 4+K 3PO 4+I 2+H 2O 4.配平下列以HNO 3为氧化剂的氧化-还原反应(1)Cu +HNO 3-Cu(NO 3)2+NO +H 2O (2)FeSO 4+HNO 3+H 2SO 4-Fe 2(SO 4)3+NO +H 2O (3)Zn +HNO 3-Zn(NO 3)2+NH 4NO 3+H 2O (4)As 2S 3+HNO 3-H 3AsO 4+S +NO 2+H 2O (5)P +HNO 3+H 2O -H 3PO 4+NO (6)P +HNO 3-H 3PO 4+NO 2+H 2O (7)AsH 3+HNO 3-H 3AsO 4+NO 2+H 2O (8)As 2O 3+HNO 3+H 2O -H 3AsO 4+NO (9)Cu 2S +HNO 3-S +NO +Cu(NO 3)2+H 2O (10)Cu 2S +HNO 3-H 2SO 4+NO +Cu(NO 3)2+H 2O (11)FeS 2+HNO 3=Fe(NO 3)3+SO 2+NO +H 2O(12)Fe 3P +HNO 3-Fe(NO 3)3+NO +H 3PO 4+H 2O (13)Fe 3C +HNO 3-CO 2+NO +Fe(NO 3)3+H 2O 5.配平下列氧化-还原反应(1)KNO 2-K 2O +NO +O 2(2)P +KOH +H 2O -PH 3+KH 2PO 2(3)FeS 2+CuSO 4+H 2O -FeSO 4+Cu 2S +H 2SO 4(4)P +CuSO 4+H 2O -Cu +H 3PO 4+H 2SO 4(5)P +CuSO 4+H 2O -Cu 3P +H 3PO 4+H 2SO 4(6)HClO 3+P 4+H 2O -HCl +H 3PO 4(7)Fe(OH)3+NaOH +Cl 2-Na 2FeO 4+NaCl +H 2O (8)KI +H 2SO 4-I 2+H 2S +KHSO 4+H 2O (9)PbO 2+H 2SO 4-PbSO 4+O 2+H 2O (10)AsH 3+AgNO 3+H 2O -As 2O 3+Ag +HNO 3(11)NH 4ClO 4-N 2↑+HCl ↑+O 2↑+H 2O (12)NH 4NO 3-N 2+NO 2+H 2O (13)NH 4NO 3-N 2+HNO 3+H 2O (14)S +KOH -K 2S +K 2SO 3+H 2O (15)NO 2+NaOH -NaNO 2+NaNO 3+H 2O (16)F 2+NH 3-NH 4F +N 2(17)FeS 2+O 2-Fe 2O 3+SO 2(18)Cu(IO 3)2+KI +H 2SO 4-CuI ↓+I 2+K 2SO 4+H 2O6.配平下列含x 的氧化-还原反应(1)S +Ca(OH)2-CaS 2O 3+CaS ·S x +H 2O (2)Na 2S x +NaClO +NaOH -Na 2SO 4+NaCl +H 2O (3)NO x +NH 3-N 2+H 2O 7.配平下列离子氧化-还原反应--(1)A n +B x -A y +B m ---(2)Cl m +OH -ClO n +Cl +H 2O -+++-(3)BiO 3+Mn 2+H -Bi 3+MnO 4+H 2O +++(4)VO 2+H 2C 2O 4·2H 2O +H -VO 2+CO 2↑+H 2O 8.配平下列氧化还原方程式(1)F 2+NH 3-NH 4F +N 2+++(2)VO 2+H 2C 2O 4·2H 2O +H -VO 2+CO 2↑+H 2O (3)P 4+CuSO 4+H 2O -Cu 3P +H 3PO 4+H 2SO 49.已知铁溶于一定浓度的硝酸溶液中反应的离子方程式为(系数a ~k 均为正整数):-+++aFe +bNO 3+cH dFe 2+fFe 3+gNO ↑+hN 2O ↑+kH 2O 。
高一化学填空题练习试题集

高一化学填空题练习试题答案及解析1.工业上制漂白粉的化学方程式为:______________________________________;漂白粉在水中因吸收空气中的CO2而实现漂白的原理:____________________________(用化学方程式表示)【答案】2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO【解析】氯气可以和强碱之间反应生成氯化物、次氯酸盐和水,漂白粉的成分是CaCl2和Ca(ClO)2的混合物。
Cl2通入石灰乳制取漂白粉2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,其漂白原理是次氯酸钙与空气中的二氧化碳和水反应生成了次氯酸,故它的漂白原理为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO【考点】考查漂白粉制取以及漂白原理的相关知识点。
2.工业上电解制碱的技术是用阳离子交换膜法,主要原料是饱和食盐水。
下图为阳离子交换膜法电解原理示意图:请回答下列问题:(1)A极为电解槽的________极,B极的材料工业上常采用的是生活中常见的金属,但有大量损耗,其主要原因是。
(填“吸氧腐蚀”或“析氢腐蚀”)(2)电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,这种阳离子交换膜,只允许溶液中的__________通过(填写下列微粒的编号)。
①H2,②Cl2,③H+,④Cl-,⑤Na+,⑥OH-。
(3)若上述电解过程中用阴离子交换膜代替阳离子交换膜(已知:3Cl2 +6OH-==5Cl-+ClO3-+3H2O),下列说法正确的组合是。
A.电解结束时,右侧溶液中含有ClO3—B.电解槽内发生反应的总化学方程式为:NaCl + 3H2O NaClO3+ 3H2↑C.用阴离子交换膜后,电解槽内两个电极发生的电极反应与原来一样D.用阴离子交换膜后,阳离子的定向移动方向与原来相反(4)已知某电解槽每小时加入10%的氢氧化钠溶液a kg,每小时能产生标准状况下的氯气b L,则电解后流出的氢氧化钠溶液(密度为d g·cm-3)的物质的量浓度为(理论计算,需化简) mol/L。
高中化学反应方程复习题练习题

高中化学反应方程复习题练习题一、选择题1. 反应方程:氯化铁+氢氧化钠→氯化钠+氢氧化铁。
该方程中,铁的氧化数变化为:A. +1B. +2C. +3D. +42. 反应方程:氯化氢+氢氧化钠→氯化钠+水。
该方程中,氢的氧化数变化为:A. +1B. +2C. -1D. -23. 反应方程:氧化铁+二氧化碳→氧化钙+一氧化碳。
该方程中,碳的氧化数变化为:A. +2B. +4C. -2D. -44. 反应方程:二氧化硫+氧气→三氧化硫。
该方程中,硫的氧化数变化为:A. +2B. +4C. +6D. +85. 反应方程:氯化钠+二氧化碳→氯化铁+一氧化碳。
该方程中,钠的氧化数变化为:A. +1B. +2C. -1D. -2二、填空题1. 反应方程:氧化钠+二氧化硫→硫酸钠+一氧化钠。
该方程中,氧化钠的化学式为_____。
2. 反应方程:氯化钾+硝酸银→氯化银+硝酸钾。
该方程中,氯化银的化学式为_____。
3. 反应方程:二氧化硫+氧气→三氧化硫。
该方程中,二氧化硫的化学式为_____。
4. 反应方程:亚硫酸银+氢氧化铵→硫化银+氨气+水。
该方程中,氢氧化铵的化学式为_____。
5. 反应方程:硝酸铵→氧化氮+二氧化氮+水。
该方程中,硝酸铵的化学式为_____。
三、解答题1. 根据反应方程:氯化钠+硫酸银→氯化银+硫酸钠。
请根据该方程回答以下问题:1) 氯化钠受到____氧化,硫酸银受到____氧化。
2) 氯化银受到____还原,硫酸钠受到____还原。
2. 根据反应方程:二氧化硫+氢氧化钠→亚硫酸钠+水。
请根据该方程回答以下问题:1) 二氧化硫受到____氧化,氢氧化钠受到____还原。
2) 亚硫酸钠中_____的氧化数为-2。
3. 根据反应方程:氯化铁+氢氧化钠→氯化钠+氢氧化铁。
请根据该方程回答以下问题:1) 氯化铁中____的氧化数为+3。
2) 氯化钠中____的氧化数为-1。
四、应用题1. 通过化学反应方程:氢氧化钠+酸→盐+水,判断以下反应的类型:反应一:氢氧化钠+硝酸铜→盐+水反应二:氢氧化钠+硫酸铁→盐+水反应三:氢氧化钠+盐酸→盐+水2. 已知完全反应方程:亚硫酸钠+氢氧化铵→硫化铵+水。
高中化学填空试题及答案

高中化学填空试题及答案1. 根据题目所给的化学方程式,写出下列反应的化学方程式。
(1)铁与稀硫酸反应生成硫酸亚铁和氢气。
(2)氢气在氧气中燃烧生成水。
(3)碳酸钙在高温下分解生成氧化钙和二氧化碳。
2. 写出下列物质的化学式。
(1)水(2)二氧化碳(3)氧化铁3. 根据题目所给的化学方程式,计算下列反应中生成物的质量。
(1)锌与稀硫酸反应生成硫酸锌和氢气,若锌的质量为65g,求生成硫酸锌的质量。
(2)氢气在氧气中燃烧生成水,若氢气的质量为4g,求生成水的质量。
4. 根据题目所给的化学方程式,判断下列反应中哪种物质是氧化剂,哪种物质是还原剂。
(1)铜与硝酸银反应生成硝酸铜和银。
(2)氢气与氧化铜反应生成铜和水。
5. 根据题目所给的化学方程式,写出下列反应的离子方程式。
(1)硫酸铜与氢氧化钠反应生成氢氧化铜沉淀和硫酸钠。
(2)碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳。
6. 根据题目所给的化学方程式,写出下列反应的平衡常数表达式。
(1)氮气与氢气反应生成氨气。
(2)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳。
答案:1.(1)Fe + H2SO4 → FeSO4 + H2↑(2)2H2 + O2 → 2H2O(3)CaCO3 → CaO + CO2↑2.(1)H2O(2)CO2(3)Fe2O33.(1)生成硫酸锌的质量为161g。
(2)生成水的质量为36g。
4.(1)氧化剂是硝酸银,还原剂是铜。
(2)氧化剂是氧化铜,还原剂是氢气。
5.(1)CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4(2)NaHCO3 + HCl → NaCl + H2O + CO2↑6.(1)K = [NH3]/[N2][H2]^3(2)K = [CaCl2][CO2]/[CaCO3][HCl]。
高中常见化学方程式填空练习试题

钾和硫酸的反应
47
钾和硫酸铜的反应
48
锂在氮气中燃烧
镁、铝及其化合物有关的化学方程式
序号
反应条件
化学反应方程式或离子方程式
1
镁在氧气中燃烧
2
镁在氮气中燃烧
3
镁在二氧化碳中燃烧
4
镁在氯气中燃烧
5
镁与硫粉共热
6
镁与硫酸反应
7
镁与氯化亚铁反应
8
工业制备镁
9
铝在氧气中燃烧
10
铝在氯气中燃烧
11
铝与硫粉共热
12
铝与稀硫酸反应
13
铝与氢氧化钠反应
14
铝与硫酸铜溶液反应
15
铝与氧化铁反应(铝热反应)
铝与二氧化锰反应
铝与五氧化二钒反应
铝与三氧化二铬反应
16
工业制备铝
17
氧化铝与盐酸反应
18
氧化铝与氢氧化钠反应
19
氢氧化铝受热分解
20
氢氧化铝酸式电离
21
氢氧化铝碱式电离
22
氢氧化铝与硫酸反应
23
氢氧化铝与氢氧化钠反应
10
氯气通入氢氧化钠溶液
11
氯气通入热的氢氧化钠溶液
12
向次氯酸钙溶液通入少量二氧化碳
52
铜生锈原理
53
铜与浓硫酸共热
54
铜与浓硝酸反应
55
铜与稀硝酸反应
56
铜与硝酸银溶液反应
57
氧化铁与稀硫酸反应
58
氧化铜与氢气加热
59
氧化亚铜与稀硫酸(歧化反应)
60
氧化亚铜与氢气共热
61
氧化亚铜与稀硝酸反应
高中化学方程式填空练习

高中化学方程式填空练习1钠与氧气反应:2Na + O2 == Na2O24Na + O2 == 2Na2O2.为什么不能用手拿钠:2Na + 2H2O = 2NaOH + H2↑2Na + 2H2O = 2Na+ + 2OH- + H2↑3.钠投入硫酸铜溶液中:2 Na + 2 H2O + CuSO4=Cu(OH)2 +Na2SO4+H2↑4.呼吸面具中的氧气来源:2Na2O2+ 2CO2= 2Na2CO3+ O22Na2O2+2H2O =4Na++4OH-+O25.除杂:Na2CO3固(NaHCO3固):2NaHCO3 = Na2CO3+H2O+CO2↑Na2CO3溶液(NaHCO3):NaHCO3+NaOH=Na2CO3+H2ONaHCO3溶液(Na2CO3):Na2CO3+CO2+H2O=2NaHCO36.Na2CO3溶液中逐滴滴入HCl:CO32- + H+ = HCO3 -;HCO3- + H+ = H2O + CO2↑;CO32- + 2H+= H2O + CO2↑7.Fe和O2点燃:3Fe+2O2== Fe3O4 铁在氯气中燃烧:2Fe+3Cl2 = 2FeCl3 8.电解熔融NaCl:___________________________________________________________ 9.NaHCO3溶液与少量氢氧化钙反应的离子方程式:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O10.NaHCO3溶液与过量氢氧化钙反应的离子方程式:HCO3-+Ca2++OH-=CaCO3↓+H2O 11、镁与二氧化碳的反应:2Mg+CO2=2MgO+C 镁与氮气的反应:3Mg+N2=Mg3N2 12.硫酸与氢氧化钡溶液反应的离子方程式:2H++SO42-+Ba2++2OH- = BaSO4↓+2H2O13、镁与盐酸反应的离子方程式:Mg+2H+=Mg2++H2↑14、铝和盐酸反应的离子方程式:2Al+6H+ =2Al3++3H2↑15、铝和氢氧化钠反应的离子方程式:2Al+2OH-+2H2O ==2AlO2-+3H2↑16、铝与三氧化二铁的铝热反应:2Al+Fe2O3==2Fe+Al2O317、工业制铝:2Al2O3===4Al+3O2↑18、NaAlO2溶液-和过量CO2反应:NaAlO2+CO2+2H2O =NaHCO3+Al(OH)3↓AlO2-+CO2+2H2O =HCO3-+Al(OH)3↓19、Al与硫酸铜溶液的反应:2Al + 3Cu2+=2 Al3++ 3Cu20.Al2O3的两性:Al2O3 + 6H+ = 2Al3+ + 3H2O;Al2O3 + 2OH- = 2AlO2- + H2O21、Al(OH)3的两性:Al(OH)3+3H+=Al3++3H2O;Al(OH)3+OH-=AlO2-+2H2O22、实验室制氢氧化铝的离子方程式Al3+ + 3NH 3·H2O = Al(OH)3↓+ 3NH4+23、氢氧化铝受热:2Al(OH)3=Al2O3+3H2O24、氯化铝溶液中滴氢氧化钠的现象及离子方程式:先产生白色沉淀Al3++3OH-=Al(OH)3↓后沉淀溶解Al(OH)3+ OH-=AlO2-+2H2O 总方程式Al3++4OH-=AlO2-+2H2O25明矾的电离方程式:KAl(SO4)2=K++Al3++2SO42-26①向明矾溶液中逐滴滴入氢氧化钡溶液至硫酸根离子刚好沉淀完全时,溶液的pH>7 离子反应总方程式为Al3++2SO42-+2Ba2++4OH- = 2AlO2-+2BaSO4↓+2H2O②向明矾溶液中逐滴加氢氧化钡溶液至铝离子刚好沉淀完全时,溶液的pH=7,离子反应总方程式为2Al3++3SO42-+3Ba2++6OH- = 2Al(OH)3↓+3BaSO4↓。
完整)高中化学方程式配平练习题

完整)高中化学方程式配平练习题1.此题无格式错误和明显有问题的段落。
2.下面是每个反应的配平结果:1) 2KMnO4 + 3SO2 + 2H2O → 2MnSO4 + 2KHSO4 +3H2SO42) 2KMnO4 + K2SO3 + 2H2O → 2MnO2 + K2SO4 + 2KOH3) 2KMnO4 + 2KNO2 + H2O → 2MnSO4 + K2SO4 +2KNO34) 2KMnO4 + 3H2S + 4H2SO4 → K2SO4 + 2MnSO4 + 3S↓ + 8H2O5) 2KMnO4 + 3H2O2 + 3H2SO4 → K2SO4 + 2MnSO4 +O2↑ + 5H2O6) 2KMnO4 + 16HCl → 2MnCl2 + 5Cl2 + 2KCl + 8H2O7) 2KMnO4 + 3NaOH + H3PO3 → K2MnO4 + Na2MnO4 + Na3PO4 + H2O8) 2KMnO4 + 3FeCl2 + 2H2SO4 → K2SO4 + 2MnSO4 + Fe2(SO4)3 + 3Cl2 + 2H2O3.下面是每个反应的改写:1) 在酸性条件下,二氧化锰氧化亚硫二氧化硫,生成硫酸和锰(II)离子。
2) 在碱性条件下,二氧化锰氧化亚硫酸钾,生成氧化锰(IV)、硫酸钾和氢氧化钾。
3) 在酸性条件下,二氧化锰氧化氧化铁(III),生成硫酸铬(III)、硫酸亚铁、硫酸钾和水。
4) 在酸性条件下,二氧化锰氧化硫化氢和硫酸,生成硫酸钾、硫酸锰(II)、硫和水。
5) 在酸性条件下,二氧化锰氧化过氧化氢和硫酸,生成硫酸钾、硫酸锰(II)、氧气和水。
6) 在酸性条件下,二氧化锰和盐酸反应,生成氯气、氯化锰(II)、氯化钾和水。
7) 在碱性条件下,二氧化锰氧化亚磷酸钠,生成高锰酸钾、高锰酸钠、磷酸三钠和水。
8) 在酸性条件下,二氧化锰氧化氯化亚铁和硫酸,生成硫酸钾、硫酸锰(II)、氯气、硫酸亚铁和水。
化学方程式配平专项训练

化学方程式配平专项训练姓名:_______________班级:_______________一、填空题1、配平和完成下列化学方程式:(1) P+FeOP 2O 5+Fe(2) Fe(红热)+ H 2O(气)——Fe 3O 4+H 2(3) N 2+H 2——NH 3 (4)Al+Fe 3O 4——Fe+Al 2O 3 2、配平下列反应的化学方程式:(1) NH 3+ Cl 2—— N 2 + HCl (2) C 2H 2+ O 2 —— CO 2+ H 2O (3) Fe 2O 3+ CO —— Fe + CO 23、配平下列化学方程式⑴ NH 3 + CI 2 === N 2 + NH 4Cl ⑵ FeS 2 + O 2 === Fe 2O 3 + SO 2 ⑶ C 3H 8 + O 2 === CO 2 + H 2O ⑷ N 2O 3 + Fe === Fe 3O 4 + N 2 ⑸ FeS 2+ O 2 === Fe 2O 3+ SO 2⑹ Al(OH)3+ H 2SO 4=== Al 2(SO 4)3+ H 2O4、体育课上,剧烈运动后血液中产生了较多乳酸(C 3H 6O 3),使人肌肉酸痛,经过一段时间放松,由于乳酸与吸入的氧气反应,生成二氧化碳和水,酸痛感消失。
该反应的化学方程式为__________________________________________5、我国使用的燃料主要是煤炭和石油,产生的SO 2遇到雨水成为酸雨。
目前有一种较有效的方法,即用直升飞机喷洒碳酸钙粉末,脱硫效果可达85%,碳酸钙与SO 2及空气中的氧反应生成硫酸钙和二氧化碳,写出化学方程式________________________________________。
6、指出下列化学方程式中的错误,并写出正确的化学方程式:(1)镁在空气中燃烧:Mg + O 2↑MgO 2 (2)木炭在空气中燃烧: C+ O 2CO 2↑7、配平下列化学方程式Al+ O 2—— Al 2O 3 CH 4+ O 2CO 2+ H 2OCO 2+ CCO CO 2+ Ca (OH )2 ---- CaCO 3↓+ H 2O8、现有铁丝、红磷、高锰酸钾、镁带、过氧化氢、硫磺粉等物质,选择适当的物质实现 下列变化的化学方程式(1)由一种物质发生分解反应制取氧气(2)一种物质跟氧气反应,产生大量白烟 (3)一种物质在空气中燃烧发出耀眼的白光 (4)一种物质在氧气中燃烧,火星四射,生成黑色固体 (5)一种无色液体加入黑色粉末生成可以助燃的气体气体 9、一个化学方程式能得到很多信息,你从反应2H 2+O 22H 2O 能得到哪些信息(写出三点)?(1)________________(2)_________________(3)_____________________.10、配平下列化学方程式:⑴ Al(OH)3+ H 2SO 4=== Al 2(SO 4)3+ H 2O ⑵ Fe 2O 3+ CO Fe+ CO 211、配平下列化学方程式 1.FeS 2+ O 2——Fe 2O 3+ SO 22、Cu 2(OH)2CO 3—— CuO+ CO 2+ H 2O3、KMnO 4 —— K 2MnO 4 + MnO 2 + O 24、CO + Fe 3O 4 —— Fe + CO 25、Al + Fe 3O 4 —— Fe + Al 2O 36、Al + H 2SO 4 —— Al 2(SO 4)3 + H 27、Al(OH)3+ HCl —— AlCl 3 + H 2O8、C 22H 46 + O 2 —— CO 2 + H 2O9、Fe + H 3PO 4 —— Fe 3( PO 4)2 + H 210、H 2 + Fe 2O 3 —— Fe + H 2O____________________________________________________________________________________ 12、 下列四个反应中生成物都是C,如果C的化学式为A2B 3,则该反应的化学方程式为: A. AB 2 + B 2 = 2C B. AB 2 + 2B 2 = 2C C. 2AB 2 + B 2 =2C D. 4AB + B 2 =2C13、有H 2、O 2、N 2的混合气体20 g ,在密闭的容器内点火反应后,发现气体剩余2 g ,则下列各组数据正确的可能是A.H 2 1 g O 2 17 g N 2 2 gB.H 2 2 g O 2 16 g N 2 2 gC.H 2 3 g O 2 16 g N 2 1 gD.H 2 2 g O 2 14 g N 2 4 g参考答案一、填空题1、思路解析:根据化学方程式配平的步骤,结合质量守恒定律,反应前后原子总数不变,配平。
化学方程式配平练习题

化学方程式配平练习题1. 写出下列化学反应的化学方程式,并进行配平:- 氢气与氧气在点燃条件下生成水。
- 碳与氧气在点燃条件下生成二氧化碳。
- 硫与氧气在点燃条件下生成二氧化硫。
- 铁与稀硫酸反应生成硫酸亚铁和氢气。
- 碳酸钙在高温下分解生成氧化钙和二氧化碳。
2. 配平以下化学方程式,并指出每种元素的氧化态变化: - 镁与稀盐酸反应生成氯化镁和氢气。
- 铜与硝酸银溶液反应生成硝酸铜溶液和银。
- 锌与稀硫酸反应生成硫酸锌和氢气。
3. 根据题目要求,写出下列化学反应的配平方程式:- 氢氧化钠与盐酸反应生成氯化钠和水。
- 碳酸钠与盐酸反应生成氯化钠、水和二氧化碳。
- 氧化铜与氢气在加热条件下反应生成铜和水。
4. 配平下列化学方程式,并计算反应中各物质的摩尔比: - 碳与二氧化碳在高温下反应生成一氧化碳。
- 钠与水反应生成氢氧化钠和氢气。
- 硫与氢气在点燃条件下反应生成硫化氢。
5. 写出并配平以下氧化还原反应的化学方程式:- 氯气与水反应生成盐酸和次氯酸。
- 过氧化氢在二氧化锰催化下分解生成水和氧气。
- 铁与氯化铁反应生成氯化亚铁。
6. 对以下化学反应进行配平,并说明反应类型:- 氨气与氧气在催化剂作用下生成一氧化氮和水。
- 甲烷在氧气中燃烧生成二氧化碳和水。
- 氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠。
7. 配平下列化学方程式,并指出反应中哪些元素的化合价发生了变化: - 铜与稀硝酸反应生成硝酸铜、一氧化氮和水。
- 过氧化钠与水反应生成氢氧化钠和氧气。
- 锌与稀硫酸反应生成硫酸锌和氢气。
8. 写出并配平以下化学反应方程式,同时计算反应物和生成物的摩尔质量:- 碳酸氢钠受热分解生成碳酸钠、水和二氧化碳。
- 铁与硫酸铜反应生成硫酸亚铁和铜。
- 氢气与氯气在点燃条件下反应生成氯化氢。
9. 配平下列化学方程式,并说明反应中各物质的状态(如:s - 固态,l - 液态,g - 气态,aq - 溶液):- 铁与稀盐酸反应生成氯化亚铁和氢气。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学方程式填空训练一一、碱金属元素及相关物质1、钠和氧气的反应i.常温下: ii.加热时:2、钠和硫的反应:(现象:)3、钠和水的反应:4、过氧化钠和水的反应:(此反应分两步:i. ii. )5、过氧化钠和二氧化碳的反应:(此反应也分两步:i. ii. )6、氧化钠分别和水、二氧化碳、盐酸的反应:;;。
7、碳酸钠与盐酸的反应:i.稀盐酸逐滴加入到碳酸钠溶液中直至过量:;ii. 碳酸钠逐滴加入到稀盐酸中:8、碳酸氢钠与盐酸的反应:9、碳酸钠和碳酸氢钠的相互转化:碳酸钠与二氧化碳及水的反应:;碳酸氢钠与氢氧化钠的反应。
碳酸氢钠受热分解:。
10、锂和氧气的反应:。
11、少量二氧化碳与氢氧化钠溶液的反应:。
过量二氧化碳与氢氧化钠溶液的反应:。
12、少量二氧化硫与氢氧化钠溶液的反应:。
过量二氧化硫与氢氧化钠溶液的反应:。
13、少量硫化氢与氢氧化钠溶液的反应:。
过量硫化氢与氢氧化钠溶液的反应:。
14、氢氧化钠与氢氧化铝溶液的反应:。
15、碳酸钙高温分解:。
碳酸镁受热分解:。
氢氧化铁受热分解:。
氢氧化铜受热分解:。
氢氧化铝受热分解:。
氢氧化镁受热分解:。
16、碳酸钙与水和二氧化碳的反应:。
17、农药波尔多液的制取方法:。
18、氯化铁溶液和氢氧化钠的反应:。
氯化铁溶液和一水合氨的反应:。
高中化学方程式填空训练二常见的金属及其化合物(是离子反应的还要写出离子方程式).................1、铝和氧气的反应:2、铝和盐酸的反应:3、铝和氢氧化钠溶液的反应:4、氧化铝与盐酸的反应:5、氧化铝氢氧化钠溶液的反应:6、氢氧化铝和盐酸的反应:7、氢氧化铝和氢氧化钠溶液的反应:8、氯化铝溶液和一水合氨的反应:9、在氯化铝溶液中逐滴加入氢氧化钠溶液直至过量时的反应:;10、向偏铝酸钠溶液中通入少量二氧化碳气体:11、向偏铝酸钠溶液中通入过量二氧化碳气体:12、向偏铝酸钠溶液中滴入少量盐酸:13、向偏铝酸钠溶液中逐滴滴入盐酸直至过量:;14、向偏铝酸钠溶液中加入碳酸氢钠溶液:15、氯化铝溶液和碳酸氢钠溶液的反应:16、铝和氧化铁的反应:铝和三氧化二铬的反应:铝和二氧化锰的反应:17、铁在氧气中的燃烧:18、铁和水蒸气的反应:19、铁和硫的反应:20、铁和硫酸铜溶液的反应:21、铁和三氯化铁溶液的反应:22、三氯化铁溶液和铜的反应:23、三氯化铁溶液和硫化氢的反应:24、三氯化铁溶液和二氧化硫的反应:25、三氯化铁溶液和碘化钠溶液的反应:26、氯化亚铁溶液中通入氯气:27、氢氧化亚铁在溶液中被氧气氧化:28、氧化铁和焦炭的反应:29、氧化铁和硫酸的反应:30、镁和二氧化碳的反应:31、氢氧化铁胶体的制取:32、三氯化铁溶液和氢氧化钠溶液的反应:补充和总结:高中化学方程式填空训练三卤族元素(是离子反应的还要写出离子方程式...............)1、氯气和铜的反应:2、氯气和铁的反应:3、氯气和钠的反应:4、氯气和氢气的反应:5、氯气和磷的反应:6、氯气和水的反应:7、常温下氯气和氢氧化钠溶液的反应:加热时氯气和氢氧化钠溶液的反应:8、氯气和氢氧化钙的反应:9、氯气和氯化亚铁溶液的反应:10、次氯酸钙(漂白粉)溶液中通入少量的二氧化碳:11、次氯酸钙(漂白粉)溶液中通入过量的二氧化碳:12、次氯酸钙钠溶液中通入少量的二氧化碳:..................13、次氯酸钙钠溶液中通入过量的二氧化碳:..................14、次氯酸钙(漂白粉)溶液中通加入稀盐酸:15、次氯酸钙(漂白粉)溶液中通加入浓盐酸:16、次氯酸见光分解:17、氟气和水的反应:18、氯气和溴化钠溶液的反应:19、向淀粉碘化钾溶液中通入氯气直至过量的反应:20、氯气的实验室制法:21、溴化银见光分解:22、卤素离子的检验方法:23、氯气和二氧化硫气体混合后通入水中:24、向亚硫酸钠溶液中通入氯气:25、向硫化钠溶液中通入氯气直至过量:高中化学方程式填空训练四氧族元素(是离子反应的还要写出离子方程式...............)1、硫与氢气的化合:2、硫与铁的化合:3、硫与铜的化合:4、硫与氧气的化合:5、氧气与臭氧的相互转化:6、过氧化氢的分解反应:7、硫化氢的分解反应:8、硫化氢与二氧化硫的反应:9、硫化氢的不完全燃烧:10、硫化氢的完全燃烧:11、硫化氢气体通入硫酸铜溶液中:12、二氧化硫通入硫化钠溶液中直至过量:13、二氧化硫与水化合:14、少量二氧化硫通入氢氧化钠溶液中:15、二氧化硫通入亚硫酸钠溶液中:16、二氧化硫通入氢氧化钙溶液中:17、二氧化硫与氧气的化合:18、二氧化硫与溴水的反应:19、二氧化硫与碘水的反应:20、硫化氢与溴水的反应:21、硫化氢与碘水的反应:22、三氧化硫与水的化合:23、浓硫酸与铜的反应:24、浓硫酸与碳的反应:25、浓硫酸与硫化氢的反应:26、浓硫酸钝化铁、铝的反应:27、亚硫酸钠被氧气氧化的反应:28、二氧化硫的工业制取方法(硫铁矿的煅烧):29、二氧化硫的实验室制取方法:30、硫化亚铁分别和硫酸、盐酸的反应:31、硫酸工业上二氧化硫的尾气吸收方法(氨水吸收法):;32、氯气通入亚硫酸钠溶液中:补充和总结:高中化学方程式填空训练五氮族元素(注明条件,是离子反应的还要写出离子方程式...............)1、氨气溶于水时的反应:2、氨气催化氧化反应:3、氨气的实验室制法:4、氨气的工业制法:5、氮气和镁的化合:6、氮气和氧气的化合:7、一氧化氮和氧气的反应:8、二氧化氮与水的反应:9、一氧化氮与氧气和水的反应:10、二氧化氮与氧气和水的反应:11、硝酸的分解:12、铜和稀硝酸的反应:13、铜和浓硝酸的反应:14、碳和浓硝酸的反应:15、硫和浓硝酸的反应:16、氯化铵的合成与分解:;17、少量的铁稀硝酸的反应:18、过量的铁稀硝酸的反应:19、碳酸氢铵的分解:20、硝酸铵的分解:在不同的条件下分解的产物不同1.2.3.21、铵根离子的检验方法:22、五氧化二磷与水的化合:1.加热时:2.不加热时:23、硝酸盐的分解:按金属的活泼性不同,对应的硝酸盐的分解产物也不同、Ca、Na的硝酸盐:~Cu的硝酸盐:以后的硝酸盐:4.硝酸亚铁的分解反应:碳族元素1、碳的完全燃烧和不完全燃烧:2、水煤气的制取方法:3、铁的冶炼原理:4、碳和二氧化碳的化合:5、单质硅的制取:6、粗硅的提纯过程:7、硅和氢氧化钠溶液的反应:8、硅和氟气的化合:9、硅和氢氟酸的反应:10、二氧化硅和氢氧化钠溶液的反应:11、二氧化硅和氢氟酸的反应:12、二氧化硅和氧化钙的反应:13、二氧化硅和碳酸钠的反应:14、二氧化硅和碳酸钙的反应:15、二氧化碳通入硅酸钠溶液时的反应:16、硅酸钠溶液和盐酸的反应:高中化学方程式填空训练六定量的化学方程式及其离子方程式的书写1、向L的FeBr2溶液中通入标况下:向L的FeBr2溶液中通入标况下:向L的FeBr2溶液中通入标况下:2、向L的NaOH溶液中通入标况下:向L的NaOH溶液中通入标况下:向L的NaOH溶液中通入标况下:3、向明矾溶液中加入氢氧化钡溶液直至沉淀的质量最大时:向明矾溶液中加入氢氧化钡溶液直至沉淀的物质的量最大时:4、向L的HNO3溶液中加入粉末,充分反应:向L的HNO3溶液中加入粉末,充分反应:向L的HNO3溶液中加入14gFe粉末,充分反应:5、碳酸氢钠溶液与足量的氢氧化钡反应:氢氧化钡溶液与足量的碳酸氢钠反应:6、碳酸氢钙溶液与氢氧化钙的反应:7、碳酸氢钙溶液与少量氢氧化钠溶液的反应:碳酸氢钙溶液与足量氢氧化钠溶液的反应:8、漂白粉溶液中通入少量SO2气体:漂白粉溶液中通入过量SO2气体:9、向L的AlCl3溶液中加入L的NaOH溶液10、向L的NaAlO2溶液中加入L的HCl溶液11、标况下和混合:标况下和混合:标况下和混合:原电池反应的书写表示方法:X—Y(电解质溶液) 或 X‖电解质溶液‖Y(1)不可逆电池伏打电池(最早、最简单的原电池):Zn—Cu(H2SO4)Zn极(-) Zn–2e-==Zn2+ (氧化反应)Cu极(+) 2H++2e-==H2↑ (还原反应)离子方程式 Zn+2H+==H2↑+Zn2+化学方程式 Zn+H2SO4=ZnSO4+H2↑铁碳电池(钢铁的析氢腐蚀):Fe—C(H2CO3)Fe极(-) Fe–2e-==Fe2+ (氧化反应)C极 (+) 2H++2e-==H2↑ (还原反应)离子方程式 Fe+2H+==H2↑+Fe2+ (析氢腐蚀)铁碳电池(钢铁的吸氧腐蚀):Fe—C(H2O、O2)Fe极(-) 2Fe–4e-==2Fe2+ (氧化反应)C极 (+) O2+2H2O+4e-==4-OH (还原反应)化学方程式 2Fe+O2+2H2O==2Fe(OH)2 (吸氧腐蚀)4Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3==Fe2O3·nH2O+(3-n)H2O (铁锈的生成过程)铝镍电池:Al—Ni(NaCl溶液、O2)Al极(-) 4Al–12e-==4Al3+(氧化反应)Ni极(+)3O2+6H2O+12e-==12-OH(还原反应)化学方程式 4Al+3O2+6H2O==4Al(OH)3 (海洋灯标电池)干电池:Zn—MnO2(NH4Cl糊状物) NH4Cl+H2O==NH3·H2O+HClZn极(-) Zn–2e-==Zn2+(氧化反应)Cu极(+) 2MnO2+2H++2e-==Mn2O3+H2O (还原反应)化学方程式 Zn+2NH4Cl+2MnO2=ZnCl2+Mn2O3+2NH3↑(2)可逆电池铅蓄电池:Pb—PbO2(浓硫酸)放电Pb极 (-) Pb+H2SO4–2e-==PbSO4+2H+(氧化反应) PbO2极 (+)PbO2+H2SO4+2H++2e-==PbSO4+2H2O (还原反应)化学方程式 Pb+PbO2+2H2SO4==2PbSO4+2H2OPb—PbO2(浓硫酸)充电Pb极 (-) PbSO4+2H+–2e-== Pb+H2SO4(还原反应) PbO2极 (+)PbSO4+2H2O+2e-==PbO2+H2SO4+2H+(氧化反应)化学方程式 2PbSO4+2H2O==Pb+PbO2+2H2SO4锂电池:Li—LiMnO2(固体介质)(-) Li–e-==Li+(氧化反应)(+) MnO2+Li++e-==LiMnO2+H2O (还原反应)化学方程式Li+MnO2==LiMnO2银锌电池:Zn—Ag2O(NaOH)Zn极(-) Zn+2OH––2e-==ZnO+H2O (氧化反应)Cu极(+) Ag2O+H2O+2e-==2Ag+2-OH(还原反应)化学方程式 Zn+Ag2O ==ZnO+2Ag(3)高能燃料电池:H2—O2(NaOH)Pt极(-) 2H2+4-OH–4e-==4H2O (氧化反应)Pt极(+) O2+2H2O+4e-==4-OH(还原反应)化学方程式 2H2+O2==2H2OCH4—O2(NaOH)Pt极(-) CH4+10-OH–8e-==-2CO+7H2O (氧化反应)3Pt极(+) 2O2+4H2O+8e-==8-OH(还原反应)化学方程式 CH4+2O2+2NaOH==Na2CO3+3H2O电离方程式的书写1、酸的电离(H 2SO 4、HNO 3、HCl 、HBr 、HI 、H 3PO 4、HF 、H 2SO 3、CH 3COOH 、H 2CO 3、H 2S 、HNO2、C 6H 5OH 、HCN 、HClO)H 2SO 4==2H ++SO 42- 或:H 2SO 4+2H 2O==2H 3O ++SO 42- HNO 3==H ++NO 3- 或:HNO 3+H 2O==H 3O ++NO 3- (以下雷同) HCl==H ++Cl -HBr==H ++Br -HI==H ++I -H 3PO 4H ++H 2PO -4 H 2PO -4H ++HPO -24 HPO -24H ++PO -34 HF H ++F - H 2SO 3H ++HSO -3 HSO -3H ++SO -23CH 3COOH H ++CH 3COO -H 2CO 3H ++-3HCO -3HCO H ++-23CO H 2S H ++-HS -HS H ++-2S HNO 2H ++NO -2 HCNH ++CN -HClOH ++ClO - H 2OH ++OH -2H 2OH 3O ++OH -2、碱的电离(NaOH 、KOH 、Ba(OH)2、Mg(OH)2、Al(OH)3、NH 3·H 2O) NaOH==Na ++OH -KOH==K ++OH -Ba(OH)2==Ba 2++2OH -Mg(OH)2Mg 2++2OH -Ca(OH)2Ca 2++2OH -(石灰悬浊液)碱式电离:Al(OH)3Al 3++3OH -酸式电离:Al(OH)3H ++-2AlO +H 2O NH 3·H 2O+4NH +2OH -Ca(OH)2==Ca 2++2OH -(澄清石灰水) 3、盐的电离(NaCl 、Na 2SO 4、NaHSO 4、Na 2SO 3、NaHSO 3、MgSO 4、CaSO 4、Al 2(SO 4)3、CuSO 4、AlCl 3、AgNO 3、CH 3COONa 、NH 4NO 3、FeCl 3、Na 2CO 3、NaHCO 3、Na 2S 、NaHS 、NaH 2PO 4、Na 2HPO 4、Na 3PO 4、KI 、NaBr 、NaClO 、AgCl 、CaCO 3)NaCl==Na ++Cl -Na 2SO 4==2Na ++-24SO NaHSO 4==H ++Na ++-24SO Na 2SO 3==2Na ++-24SO NaHSO 3==Na ++HSO 3- (错误书写:NaHSO 3==Na ++H ++SO 32-)MgSO 4==Mg 2++-24SO Al 2(SO 4)3==2Al 3++3-24SO CuSO 4==Cu 2++-24SO AlCl 3==Al 3++3Cl -AgNO 3==Ag ++NO 3 CH 3COONa==CH 3COO -+Na +NH 4NO 3==NH 4++NO 3-FeCl 3==Fe 3++3Cl -Na 2CO 3==2Na ++-23CO NaHCO 3==Na ++-3HCO (错误书写:NaHCO 3==Na ++H ++-23CO )Na 2S==2Na ++-2S NaHS==Na ++HS -(错误书写:NaHS==Na ++H+-2S )NaH2PO4==Na++H2PO-4Na2HPO4==2Na++HPO-24 (错误书写:Na2HPO4==2Na++H++PO-34)Na3PO4==3Na++PO-34KI==K++I―NaBr==Na++Br―NaClO==Na++ClO―AgCl Ag++-Cl (难溶、微溶物质在水中发生微弱电离)CaCO3Ca2++-23CO (错误书写:CaCO3==Ca2++CO-23)CaSO4Ca2++SO-24(错误书写:CaSO4==Ca2++SO-24)3、熔融电离NaClNa++-Cl MgCl2Mg2++2-Cl Na2O2Na++O2―Al2O32Al3++3O2―。
